(浙江选考)2018年高考化学二轮专题复习第12讲化学反应限度与化学平衡课件
【浙江选考】2018年高考化学二轮专题复习课件:第10讲 化学反应中的能量变化 (共18张PPT)

第1讲
考点一
物质的分类和变化、化学用语
考点二
-13-
实验测得:101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ 的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。 下列热化学方程式的书写正确的是( ) ①CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH=+890.3 kJ· mol-1 ②CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH=-890.3 kJ· mol-1
放热用“-”标注。仅②④符合要求。
关闭
ቤተ መጻሕፍቲ ባይዱ
关闭
B
解析 答案
专题一
重点梳理 精选例题
第1讲
考点一
物质的分类和变化、化学用语
考点二
-14-
跟踪训练 1.(2017· 宁波模拟)Na2CO3(aq)与盐酸反应过程中的能量变化示 意图如下,其中a,b,c均大于0,下列选项正确的是( )
专题一
重点梳理 精选例题
专题一
重点梳理 精选例题
第1讲
考点一
物质的分类和变化、化学用语
考点二
-11-
考点二 热化学方程式 1.热化学方程式书写的“四步”
一写方程式
二标状态
三标 ΔH
四标数值和单位
专题一
重点梳理 精选例题
第1讲
考点一
物质的分类和变化、化学用语
考点二
-12-
2.热化学方程式正误判断的“五审”
专题一
重点梳理 精选例题
专题四
化学反应原理
第10讲
化学反应中的能量变化
专题一
最新-2018年高考化学 化学反应速率和化学平衡复习课件 精品

B.化学反应速率0.8 mol/(L·s)是指1 s时某物质的浓 度为0.8 mol/L
C.对于任何化学反应来说,反应速率越大,反应现 象就越明显
D.根据化学反应速率的大小可以知道化学反应进行 的快慢
解析:不能用纯液体或固体的物质的量浓度变化来表 示化学反应速率,A错误;化学反应速率是平均速率,而 非瞬时速率,B错误;有些化学反应速率很大,可能无明 显实验现象,C错误;化学反应速率是用来描述化学反应 进行快慢的物理量,D正确.
点拨:解答该题时要注意影响该化学反应速率的因素 有温度、大理石的规格、HNO3的浓度.三个因素中两个 因素不变化,只改变一个因素来分析它对化学反应速率的 影响,要运用好对照实验.
解析:(1)据实验目的(Ⅰ)知①与②两实验的差别为浓 度,故实验②中T=298 K,规格为粗颗粒,而c(HNO3)= 1.00 mol/L;
HI
为例
3.温度 (1)规律:其他条件不变时,升高温度,v增大;反之, 降低温度,v减小 .一般,温度每升高10℃,反应速率就增 大到原来的2~4倍. (2)解释:升高温度―→单位体积内活化分子总数增加
活化分子数增加―→单位时间内有 效碰撞次数增加―→v增大.
(3)图象:(以N2+3H2 2NH3 ΔH<0为例)
4.催化剂
(1)规律:加入催化剂,v增大.
(2)解释:加入催化剂―→降低了反应的活化能―→活
化分子百分数增加
活化分子数增
加―→单位时间内有效碰撞次数增加―→v增大.
(3)图象
[例题2] 某探究小组用HNO3与大理石反应过程中质 量减小的方法,研究影响反应速率的因素.所用HNO3浓 度为1.00 mol/L、2.00 mol/L,大理石有细颗粒与粗颗粒两 种规格,实验温度为298 K、308 K,每次实验HNO3的用 量为25.0 mL,大理石用量为10.00 g.
优秀课件2018届高考化学第二轮复习化学平衡专项复习课件(56张ppt)

B
A 中隐含 SO3 的量为零, 但可逆反应中所有物质的物
质的量都不能为零,A 错;D 中隐含 SO2、O2 的量为零,D 错;C 中 SO2、SO3 均为 0.15 mol· L-1,隐含 SO2、SO3 均减 少,C 错。 [点评] 无论从正反应方向, 还是从逆反应方向建立平衡, 可逆反应都不能进行到底,任何物质的浓度都不可能为 0,平 衡时为各反应物与生成物共存的状态,下面的变式题同样是 对可逆反应定义的考查。
(1)反应混合体系中气体密度不变能否作为平衡依据
m 根据气体密度公式 ρ= V ,选定变量和恒量来确定。如对于 反应体系全部为气体的定容反应体系来说, 质量 m 和体积 V 都 是恒量,故密度 ρ 为恒量,即不论反应是否达到平衡,密度不 变,故密度不变不能作为判断反应是否平衡的标志。而对于反 应体系中不全部为气体的定容反应体系来说,V 是恒量,m 是 变量,故当反应达到平衡时,m 不再变化,此时密度随之而不 再变化,即密度不变可以作为判断是否平衡的标志。 (2) 反应混合体系中气体平均相对分子质量不变能否作为 平衡依据 m 可依据气体平均相对分子质量公式: M = n ,结合具体的 化学方程确定气体质量和气体物质的量哪个为变量和不变量来 进行分析。
反应 2SO2+O2 2SO3 达到平衡后, 再向反 应器中充入由 18O 组成的氧气,经过一段时间后,18O 可 能存在于( D ) A.生成的 SO3 中 B.O2 和 SO2 中 C.剩余的 SO2 中 D.O2、SO2 和 SO3 中
D SO2 与氧气的反应属于可逆反应,可逆反应是指 在相同条件下,既能向正反应方向进行同时又能向逆反应 方向进行的反应,所以最后 18O 可能存在于 O2、SO2 和 SO3 中。
再变化时,反应已达平衡。常见的变量有:气体的颜色;对于
高考化学二轮复习课件:专题8化学反应速率和化学平衡

栏 目 链 接
栏 目 链 接
H核心 自 查
1.某温度时,在2 L容器中X、Y、Z三种物质随
时间的变化关系曲线如图所示。
栏 目 链 接
H核心 自 查
(1)由图中的数据分析,该反应的化学方程式为
3X+Y 2Z __________________________________________ 。
栏 目 链 接
K考点 自 纠 1.在其他条件不变时,使用催化剂,正反应速率和 逆反应速率同等倍数加快,平衡不移动。( √ )
栏 目 链 接
2.当某反应达到限度时,反应物和生成物的浓度一
定相等。( × ) 3 .在一定条件下,向密闭容器中充入 1 mol N2 和 3 mol H2 充分反应,达到平衡时 N2 、 H2 、 NH3 三者共存。 (√ )
4.当一个可逆反应达到平衡状态时,正向反应速率
和逆向反应速率相等且都等于0。( × )
K考点 自 纠
5.在相同温度下,在相同容积的密闭容器中分别充 入1 mol N2、3 mol H2和2 mol NH3,当反应达到平衡时, 两平衡状态中NH3的体积分数相同。( √ ) 6.化学平衡移动,化学平衡常数不一定改变。( √ 7 .加入少量 CH3COONa 晶体可以减小 Zn 与稀硫酸 反应的速率,但不影响产生H2的总量。( √ 反应速率减小。( × ) ) 8.化学平衡向右移动,一定是正反应速率增大或逆 )
栏 目 链 接
9.任何可逆反应达到平衡后,改变温度,平衡一定 发生移动。( √ )
K考点 自 纠
10.化学反应速率发生变化,化学平衡一定发生移 动。( × )
栏 目 链 接
栏 目 链 接
G 高频考 点 突 破
高三化学二轮复习:化学反应速率与化学平衡课件

考纲要求 1.知道化学反应速率的定量表示方法,能通过实验测定某些化学 反应的速率。2.知道活化能的涵义及其对化学反应速率的影响。3. 通过实验探究温度、浓度、压强和催化剂对化学反应速率的影 响,认识其一般规律。4.通过催化剂实际应用的事例,认识其在 生产、生活和科学研究领域中的重大作用。5.能用焓变和熵变说 明化学反应的方向。6.通过化学平衡建立的过程,知道化学平衡 常数的涵义,能利用化学平衡常数计算反应物的转化率。7.通过 实验探究温度、浓度和压强对化学平衡的影响,并能用相关理论 加以解释。8.认识化学反应速率和化学平衡的调控在生活、生产 和科学研究领域中的重要作用。
t/min
0
10
20
30
40
50
c(H2O2)/mol·L-1 0.70 0.49 0.35 0.25 0.17 0.12
0~30 min H2O2反应的平均速率v=__0_._0_15___ mol·L-1·min-1。
1.(2021·辽宁高考)某温度下,降冰片 烯在钛杂环丁烷催化下聚合,反应物浓度 与催化剂浓度及时间关系如图。已知反应 物消耗一半所需的时间称为半衰期,下列 说法错误的是( )
(2)正、逆反应的速率常数与平衡常数的关系
对于基元反应aA(g)+bB(g) cC(g)+dD(g),v正=k正·ca(A)·cb(B),v逆
=k逆·cc(C)·cd(D),平衡常数K=cccaCA··ccdbDB=kk逆正··vv正逆,反应达到平衡时v正=v
逆,故K=
k正 k逆
。如:对于基元反应:2NO(g)+O2(g)
考查视角 以化工生产中的实际反应为背景材料考查速率的简单计算、影响速率的因素是高考的热点。 (2)(2021·全国乙卷)一氯化碘(ICl)是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机合成中的碘化剂。 1 MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。 b、c点表示的状态均未达到平衡, 4.(2019·全国卷Ⅲ节选)近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。 据图分析,生成CS2的反应为________(填“放热”或“吸热”)反应。 C.条件①,反应速率为0. c(H2O2)/mol·L-1 (1)CO2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C2H4)∶n(H2O)=________。
高考复习方案2018届高考化学大二轮专题复习浙江专用,新课标:第2单元-基本理论共228张PPT

高考真题再现
(3)由以上某些元素组成的化合物A、B、C、D有如下 转化关系:
其中,C是溶于水显酸性的气体;D是淡黄色固体。 写出C的结构式:_____;D的电子式:__________。 ①如果A、B均由三种元素组成,B为两性不溶物,则 A的化学式为________;由A转化为B的离子方程式为 ________________________________________________。 ②如果A由三种元素组成,B由四种元素组成,A、B 溶液均显碱性。用离子方程式表示A溶液显碱性的原因: ________________________________________________。 A、B浓度均为0.1 mol·L-1的混合溶液中,离子浓度由 大到小的顺序是________________;常温下,在该溶液中 滴加稀盐酸至中性时,溶质的主要成分有________。
返回目录
高考真题再现
[解析] A 由X元素的信息可知,其原子核外电子 排布为K层2个,L层4个,即为C元素,再根据各元素 在周期表中的相对位置可得,Y为O元素、Z为Si元 素、W为S元素、Q为Cl元素。钠与硫可形成Na2S2等多 硫化物,A项正确; Si与O形成的为原子晶体,为非电 解质,熔融时不能导电,B项错误; S的非金属性比Cl 弱,C项错误;O存在O2、O3等同素异形体,D项错 误。
浙江省专用
第二单元 基本理论
专题五 物质结构与元素周期律 专题六 化学反应速率和化学平衡 专题七 电解质溶液 专题八 电化学原理
高 频 考 点 探 究
易 错
专题五 物质结构与
归 纳
元素周期律
整
合
返回目录
主干知识整合
返回目录
高考真题再现
高考化学二轮复习课件:专题12有机化学基础

专题十二 有机化学基础
栏 目 链 接
K 课标考 纲展示
考纲展示 1.了解测定有机化合物组成和结构的一般方法。 2.知道有机化合物中碳的成键特征,并能认识 手性碳原子。 3.了解常见有机化合物中的官能团,能正确表 示简单有机化合物的结构。能根据有机化合物 的命名规则命名简单的有机化合物。 4.了解有机化合物存在同分异构现象(不包括 立体异构),能判断并正确书写简单有机化合物 的同分异构体的结构简式。 5.了解加成、取代、消去、加聚和缩聚等有机 反应的特点,能判断典型有机反应的类型。 6.掌握烃(烷烃、烯烃、炔烃和芳香烃)及其衍 生物(卤代烃、醇、酚、醛、羧酸、酯)的组成、 结构特点和主要性质。能利用不同类型有机化 合物之间的转化关系设计合理路线合成简单有 机化合物。
K 课标考 纲展示
2.同分异构体的常见题型。 (1)限定范围书写和补写,解题时要看清所限范围, 分析已知几个同分异构体的特点,对比联想找出规律补写, 同时注意碳的四价原则和官能团存在位置的要求。 (2)对“结构不同”要从两个方面考虑:一是原子或
栏 目 链 接
原子团的连接顺序;二是原子的空间位置。
(3)判断取代产物同分异构体种类的数目。其分析方 法是分析有机物的结构特点,确定不同位置的氢原子种类, 再确定取代产物同分异构体的数目。
K考点 自 纠
1.含有碳碳双键和碳碳叁键的化合物可以使溴水褪色。( √ 2.含有 C===C 键的化合物都具有顺反两种结构。( × ) 3.环烷烃与相同碳原子的单烯烃的分子式相同。( √ ) )
栏 目 链 接
)
√ 4.苯环中,六个碳原子和六个氢原子都是在一个平面上。(
5.苯酚的酸性比乙醇的酸性强,但比碳酸的酸性弱。( √ ) 6.用 NaHCO3 可以鉴别苯酚和苯甲酸。( √ ) 都是属于芳香族羧酸。( × )
(浙江专用)高考化学二轮复习 专题十 第2课时 化学平衡讲义(含解析)-人教版高三全册化学教案

第2课时化学平衡命题调研(2016~2019四年大数据)2016~2019四年考向分布核心素养与考情预测核心素养:变化守恒思想、模型建构、推理论据考情解码:本部分内容主要包括化学平衡状态的判定,影响化学平衡的因素以及化学平衡常数三个知识点,由选择和填空两个题型组成。
难点是化学平衡状态实质的理解,勒夏特列原理的应用,图像的解读和画图像。
其中画图像是选考中常考考点,也是难度最大的考点,解题关键是找到图像的起点,趋势和终点。
预测2020年选考中仍需着重关注以上考点。
真题重现1.(2019·浙江4月选考,17)下列说法正确的是( )A.H2(g)+I2(g)2HI(g),其他条件不变,缩小反应容器体积,正逆反应速率不变B.C(s)+H2O(g)H2(g)+CO(g),碳的质量不再改变说明反应已达平衡C.若压强不再随时间变化能说明反应2A(?)+B(g)2C(?)已达平衡,则A、C不能同时是气体D.1 mol N2和3 mol H2反应达到平衡时H2转化率为10%,放出热量Q1;在相同温度和压强下,当2 mol NH3分解为N2和H2的转化率为10%时,吸收热量Q2,Q2不等于Q1解析对于反应H2(g)+I2(g)2HI(g),反应前后气体分子数相等,缩小反应容器体积,平衡不移动,正逆反应速率增大相同的倍数,A项错误;碳的质量不变,说明正、逆反应速率相等,反应已达平衡状态,B项正确;恒温恒容条件下,若A、C同时为气体,当压强不变时,也能说明反应达到平衡状态,C项错误;设N2(g)+3H2(g)2NH3(g) ΔH=-a(a >0) kJ·mol-1,1 mol N2和3 mol H2反应达到平衡时H2转化率为10%,放出热量Q1=0.1a kJ,当2 mol NH3分解为N2和H2的转化率为10%时,吸收热量Q2=0.1a kJ,故Q1=Q2,D项错误,故选B。
答案 B2.(2019·浙江1月学考)一定温度下,在体积恒定的密闭容器中发生反应:N2(g)+3H2(g)2NH3(g)。
(B版,浙江选考专用)高考化学总复习第二部分专题八化学反应速率和化学平衡课件

——
第六页,共64页。
[温馨提示] (1)改变固体或纯液体的量对化学反应速率无影响(因为固 体、纯液体的浓度均可视为常数),但改变固体表面积会影响化学反应 速率。 (2)不要把外界因素对反应速率的影响和对化学平衡的影响混淆。如升 温,正、逆反应速率都增大,但是(dànshì)增大的幅度不同,导致化学平衡发生移 动。 (3)催化剂有正催化剂和负催化剂之分,正催化剂即通常所说的催化剂, 负催化剂又称为抑制剂。 4.“惰性气体”对反应速率的影响 我们把化学反应体系中与各反应成分不起反应的气体统称为“惰性气 体”。
Qc
ca ( A) cb (B)
3)利用K化 学反平应衡向常正数随反温应度方的向变进化行判断反应的热效应。 若升高K温 度反,K应值处增于大化,则学正平反衡应状为吸态热反应; 若升高K温 度反,K应值向减逆小反,则应正方反向应进为放行热反应。
2.平衡的转化率
对于可逆反应:aA+bB cC+dD,达到平衡时
3
<0
<0
反应的自发性随温度的变化而改
变。ΔH<0、ΔS<0的反应通常在
低温下自发进行(此时ΔH-TΔS<
0),ΔH>0、ΔS>0的反应通常在高
温下自发进行(此时ΔH-TΔS<0)
4
>0
>0
第十一页,共64页。
[特别提醒] 用ΔH-TΔS<0来判断反应的自发性,只能用于判断反应的 方向,不能确定反应是否一定会发生,也不能确定反应速率。 二、化学平衡 1.可逆反应 (1)定义:在② 相同条件 下,既可以向正反应方向进行,同时又可以向 逆反应方向进行的化学反应。 (2)特点 1)二同:a.相同条件下;b.正逆反应同时进行。 2)一小:反应物与生成物同时存在,任一组分的转化率都小于100%。 (3)表示(biǎoshì):在化学方程式中用“ ”表示(biǎoshì)。
(浙江选考)2018高考化学大一轮复习 专题7 化学反应速率与化学平衡 第2单元 化学反应的方向和限度教师用书
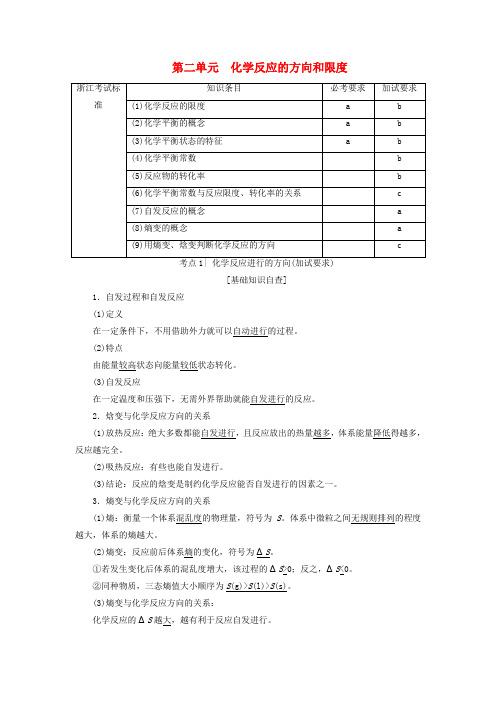
第二单元化学反应的方向和限度[基础知识自查]1.自发过程和自发反应(1)定义在一定条件下,不用借助外力就可以自动进行的过程。
(2)特点由能量较高状态向能量较低状态转化。
(3)自发反应在一定温度和压强下,无需外界帮助就能自发进行的反应。
2.焓变与化学反应方向的关系(1)放热反应:绝大多数都能自发进行,且反应放出的热量越多,体系能量降低得越多,反应越完全。
(2)吸热反应:有些也能自发进行。
(3)结论:反应的焓变是制约化学反应能否自发进行的因素之一。
3.熵变与化学反应方向的关系(1)熵:衡量一个体系混乱度的物理量,符号为S。
体系中微粒之间无规则排列的程度越大,体系的熵越大。
(2)熵变:反应前后体系熵的变化,符号为ΔS。
①若发生变化后体系的混乱度增大,该过程的ΔS>0;反之,ΔS<0。
②同种物质,三态熵值大小顺序为S(g)>S(l)>S(s)。
(3)熵变与化学反应方向的关系:化学反应的ΔS越大,越有利于反应自发进行。
4.焓变与熵变对化学反应方向的共同影响 体系能量降低和混乱度增大都有促使反应自发进行的倾向。
判断反应的自发性必须综合考虑反应的焓变和熵变。
在恒温、恒压时,(1)ΔH <0,ΔS >0,则反应一定能自发进行;(2)ΔH >0,ΔS <0,则反应一定不能自发进行;(3)ΔH <0,ΔS <0或ΔH >0,ΔS >0,反应可能自发进行,也可能不自发进行,与反应的温度有关。
[核心要点提升]化学反应方向的综合判据(加试内容)影响反应自发性的因素是焓变(ΔH )、熵变(ΔS )和温度(T )。
要正确判断一个化学反应能否自发进行,必须综合考虑ΔH 、ΔS 和T 这三个因素。
在恒温恒压时,有如下判据:⎩⎪⎨⎪⎧ ΔH -T ΔS <0,反应能自发进行ΔH -T ΔS =0,反应达到平衡状态ΔH -T ΔS >0,反应不能自发进行具体可表示为:的方向进行,直到达到平衡状态。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
minC,Δ.反n(应A)进=0行.15到m1oml,iΔnn时(C,反)=应0.1体5 系mo达l,可到知化x学=2平,错衡误状;B态项,化学反应速 率之D.比A的等正于反化应学速计率量等数于之C比的,0逆~2反m应in,速Δn率(C时)=,反0.2应m体ol系,v(达B)到=12化v(C学)=平12 × Δ���衡������·���(ΔC状������) =态12 × 20L.×2m2molin=0.025 mol·L-1·min-1,错误;C 项,化学平衡状态指 的是在一定条件下,当一个可逆反应的正反应速率与逆反应速率相
-3-
重点梳理 精选例题
②对于有气体存在且反应前后气体的物质的量发生改变的反应,
如N2(g)+3H2(g)
2NH3(g),若反应体系的压强不再发生
变化或平均相对分子质量不再发生变化,则说明反应已达平衡状态。
注意:对于有气体存在且反应前后气体的物质的量不发生改变的
反应,如:2HI(g)
H2(g)+I2(g),反应过程中的任何时刻体系的压
-5-
重点梳理 精选例题
(2017·学军中学)一定条件下的可逆反应2NO2 (红棕色) 2NO (无色)+O2 (无色),在恒压密闭容器充入NO2,达到化学平衡状 态的标志是( )
A.反应停止了
B.NO的正反应速率与O2的逆反应速率相等
C.c(NO)∶c(O2)=2∶1
关闭
反应D.达气到体平的衡颜时色,正不、再逆变反化应速率相等,但反应并没有停止,故A错误;NO的
量不再随时间而变化,如2HI(g)
H2(g)+I2(g)。
(4)全是气体参加的反应,恒容条件下体系的密度保持不变。
-9-
重点梳理 精选例题
考点二 化学平衡的移动 1.化学平衡移动的过程
重点梳理 精选例题
-10-
2.判断外界条件改变对化学平衡移动的影响
-11-
重点梳理 精选例题
(2017·11·浙江选考)已知N2(g)+3H2(g)
NH3是产物,故A错误;N2和H2的起始物质的量之比为1∶3,反应消耗的物 质的量之比也是1∶3,故反应达到平衡时N2和H2的转化率相同,故B正确; 当1 mol N2参与时反应放出的热量为92.4 kJ,而题目中没有确定参与反应 的反应物的量,故C错误;由表格可知600 ℃、30 MPa下反应达到平衡
强、气体的物质的量、平均相对分子质量都不变,故体系压强、气
体的物质的量、平均相对分子质量不变均不能说明反应已达平衡
状态。
-4-
重点梳理 精选例题
2.等效平衡判断“四步曲” 第一步,看:观察可逆反应特点(物质状态、气体分子数),判断反应 是反应前后气体体积不变的可逆反应还是反应前后气体体积改变 的可逆反应; 第二步,挖:挖掘反应条件,是恒温恒容还是恒温恒压,注意密闭容 器不等于恒容容器; 第三步,倒:采用一边倒法,将起始物质按可逆反应化学计量数之 比转化成同一边的物质; 第四步,联:联系等效平衡判断依据,结合题目条件判断是否达到 等效平衡。
-12-
重点梳理 精选例题
下列说法正确的是( )
A.体系中NH3的物质的量分数越大,则正反应速率越大
B.反应达到平衡时,N2和H2的转化率之比均为1
C.反应达到平衡0 率℃与、反30应M物P的a下浓反度应有达关,到且平反应衡物时浓,生度成越N大H正3的反物应质速的率越量大最,多而
2NH3(g) ΔH=-92.4
kJ·mol-1。起始反应物为N2和H2,物质的量之比为1∶3,且总物质的
量不变,在不同压强和温度下,反应达到平衡时,体系中NH3的物质
的量分数如下表:
温度 物质的量分数
400 ℃ 450 ℃ 500 ℃ 600 ℃
压强 20 MPa 30 MPa
0.387 0.274 0.189 0.088 0.478 0.359 0.260 0.129
第12讲 化学反应限度与化学平衡
-2-
重点梳理 精选例题
考点一 化学平衡状态判断 1.化学平衡状态的判断方法 指导思想:选定反应中的“变量”,即随反应进行而变化的量,当“变量” 不再变化时,反应已达平衡。
①������正 = ������逆 (1)直接判断依据 ②各组分的物质的量或质量不变
③各组分的含量(������、������)不变 (2)间接判断依据 ①对于有色气体存在的反应体系,如2NO2(g) N2O4(g)等,若体系的 颜色不再发生改变,则反应已达平衡状态。
正反应速率与O2的逆反应速率之比为2∶1时才能说明反应达到平衡状态,
故B错误;体系中c(NO)∶c(O2)始终是2∶1,不能作为判断反应是否达到平
衡的依据,故C错误;混合气体的颜色不再改变,说明NO2气体的浓度不变,
达到平衡状态,故D正确;故选D。
关闭
D
解析 答案
-6-
重点梳理 精选例题
跟踪训练
(2017·宁波模拟)一定温度下,在2 L的密闭容器中发生反
达D 到化学平衡状态,正确。
解析 答案
-8-
重点梳理 精选例题
规律小结
不能作为平衡“标志”的四种情况
(1)反应组分的物质的量之比等于化学方程式中相应物质的化学
计量数之比。
(2)恒温恒容下反应前后气体体积不变的反应,体系的压强或总物
质的量不再随时间而变化,如2HI(g)
H2(g)+I2(g)。
(3)反应前后气体体积不变的全气体反应,体系的平均相对分子质
等时,反应物的浓度与生成物的浓度不再改变,由表格可知反应进行
到 2 min 时,反应体系达到化学平衡状态,错误;D 项,化学反应达到平
衡状态时,同一种物质的正反应速率与逆反应速率相等,不同物质的
正反应速率与逆反应速率之比等于化学计量数之比,因 A、C 的化学
计量数均为 2,故 A 的正反应速率等于 C 的逆反应速率时,反应体系关闭
应:xA(g)+B(g)
2C(g) ΔH<0,A、C的物质的量随时间变化
的关系如下表所示。下列有关说法正确的是 ( )
时间/min
n(A)/mol
n(C)/mol
0
0.3
0
1
0.15
0.15
2
0.1
0.2
3
0.1
0.2
-7-
重点梳理 精选例题
A.x=1
关闭
A 项B.,反根应据开物始质2的m量in的内变,用化B量表之示比的等反于应化速学率计为量0.0数5之mo比l ,·0L~-11·min -1
