图示法分析溶液混合精品PPT课件
合集下载
《溶液的配制及分析》课件三十(13张PPT)(苏教版选修4)

引起误差的操作 称取时间过长或用滤纸称放 向容量瓶注液时少量流出 未洗净烧杯或玻璃棒 未冷却至室温而注入定容
m
减小 减小 减小 不变
V
不变 不变 不变 减小
C
减小 减小 减小 增大
引起误差的操作 定容时加水过量用吸管吸出 定容时仰视刻度线 定容时俯视刻度线 定容摇匀后液面下降又加水 定容摇匀后,液面下降
解:
2KMnO4+3H2SO4+ 5H2O2=K2SO4+2MnSO4+5O2+8H2O
2mol
5mol
0.1mol/L × 0.0202L CH2O20.001L
C=
0.1mol/L×0.0202L × 5mol 2mol×0.001L
=5.05mol/L
答:H2O2的物质的量浓度为5.05mol/L
一些 B 。
3、定容时,俯视液面 A 。
课前小测 课程要求 仪器使用
作业布置:
1、作业本对应习题
实验步骤
2、书本P25 练习与实践
误差分析 反馈练习
作业布置
问题解决
2.生产过氧化氢的化工厂检验科分析人员需要测 定生产车间出来的产品过氧化氢溶液的浓度:已 知化学反应:
2KMnO4+3H2SO4+5H2O2==
K2SO4+2MnSO4+5O2+8H2O 当在过氧化氢溶液中滴加高锰酸钾至红色不再褪 去时两者恰好完全反应。取过氧化氢样品1mL于 锥形瓶中,加25mL水稀释,在用硫酸酸化,逐 滴滴加0.1000mol/L的高锰酸钾溶液,当反应完全 时,消耗高锰酸钾溶液20.00mL。计算过氧化氢 样品的物质的量浓度。
课前小测 课程要求 仪器使用 实验步骤 误差分析 反馈练习 作业布置
初中九年级化学下册《溶解与乳化》溶液PPT优秀课件

第七章 溶 液
[归纳提升]温度、固体溶质的颗粒大小、是否搅拌等因 素都会影响溶质的溶解速率。为了证明某一因素对溶解速率 的影响,应采用控制变量法,使实验结果具有说服力。通过 升高温度、减小固体物质的颗粒大小、搅拌等方法能加快溶 质在溶剂里的溶解速率。
2020/11/20
18
第七章 溶 液
[课堂速记]
(3)根据溶液的名称可区别溶质和溶剂,一般将__溶__质__ 放在前面,溶_剂_____放在后面。如碘酒中碘____是溶质,酒精 ______是溶剂。
2020/11/20
6
第七章 溶 液
[点拨] ①溶液中__溶__质___可以有__多__种__,但_溶__剂____只 能有一种。②通常没有指明溶剂的溶液,一般是指_水__溶__液___
性质完全相同);_稳__定__性_____(即在外界条件不变的情况下, 长期放置不会出现分层)。
2020/11/20
3
第七章 溶 液
[注意] (1)溶液一定是透明的,但不一定是无色的,如 硫酸铜溶液是蓝色的、氯化亚铁溶液是浅绿色的等;(2)无 色透明的液体不一定是溶液,溶液必须是混合物,如蒸馏水、 酒精等虽然是无色透明的,但它们是纯净物,不是溶液。
2020/11/20
1
第七章 溶 液
问题导学
2020/11/20
2
第七章 溶 液
新知预习
一 溶液 1.概念:由一种或一种以上的物质___分__散___到另一种物
质中所形成的__均__一__而__稳__定__的__混__合__物_________。 2.特征:_均__一__性___(即溶液各部分浓度、密度、组成、
子之间有间隔。 3.溶质、溶剂的判断 (1)当固体、气体溶于液体时,__固_体__、__气__体___是溶质,
溶液PPT课件11 人教版优质课件

学试剂放入到一定量的水中,就可以形成低温小环境。这种试剂可以是 D
下列物质中的( )
A.食盐
B.熟石灰
C.蔗糖
D.硝酸铵
4. 下列有关溶液的说法,正确的是 ( B ) A.溶液通常是液体,溶质一定是固体 B.凡是溶液一定是混合物 C.一种物质分散到另一种物质中,形成的液体是溶液 D.无色透明的液体是溶液
5、溶解度曲线
溶解度 (克)
60
30
.M .N
t1
t2
(1)某一溶质在某一温度下的溶解度 (2)同一溶质溶解度随温度的变化情况
(3)溶解度曲线上方的点:饱和溶液
A
溶解度曲线下方的点:不饱和溶液
(4)若两种不同的溶质溶解度曲线有点,
则交点对应温度下,两种物质溶解度相等 B (5)比较溶解度大小
(6)溶质质量分数计算
Mg+H2SO4 24 98
MgSO4+H2
12 x
24 = 98
12
x
X=49 溶液中溶质质量分数为= 49 × 100%=49%
100
答:硫酸溶液中溶质质量分数为49%
5 、当你感到悲哀痛苦时,最好是去学些什么东西。学习会使你永远立于不败之地。 13 、在现在这个知识大爆炸的年代里,谁不继续学习,谁必将被社会淘汰,只有不断地为自己充电,才能在竞争中立于不败之地。 12 、失败并不可怕,只要我们怀着一颗不服输的心,勇往直前,那么胜利将不会离我们太远。 12 、每个人都是赤手空拳来到这个世界的,有的人成功,有的人失败,都有着各自原因。条件不会摆放在每个人面前,学会没有条件的时候自己去创造条件,才可能走近成功。 10 、要想壮志凌云,就须脚踏实地。 2 、成功如同谷仓内的金表,早已存在于我们周围,散布于人生的每个角落,只要执著地去寻找,就一定能找到。 16 、后悔是一种耗费精神的情绪。后悔是比损失更大的损失,比错误更大的错误。所以不要后悔。 9 、只要你有能力去做的事就一定要去做,不要给自己留下任何遗憾,人生最重要的不是所站的位置,而是所朝的方向。路就在你脚下,只要走,就能到达远方。 17 、不要老是想做救世主,就算是救世主,也没必要去拯救世人。可怜之人,必有可恨之处,而且都是犹大 20 、为目标,晚卧夜半,梦别星辰,脚踏实地,凌云舍我其谁! 5 、乐观,是达到成功之路的信心;不怀希望,不论什么事情都做不出来。 9 、善于把握事物的规律,掌握事物的正确动向,你就会事半功倍,而后取得最后的成功。 9 、如果我们消极地生活,那么迟早会深困在自己建造的“房子”里。 19 、一个人的成功除了靠自己的勤奋努力外,谦虚谨慎是不可缺少的品格。自以为是的人永远也找不到成功的门路。 6 、把握现在、就是创造未来。 2 、拼一载春秋,搏一生无悔。
初中化学九下 6.2 溶液组成的表示 课件 _3
不求做的最好,但求做的更好。 人家怕你,并不是一种福,人家欺你,并不是一种辱。 你想过普通的生活,就会遇到普通的挫折。你想过最好的生活,就一定会遇上最强的伤害。这个世界很公平,想要最好,就一定会给你最痛 。 君子不重则不威,学则不固。主忠信。无友不如己者,过则勿惮改。——《论语·学而》 勤学和知识是一对最美的情人。 如果知识不是每天在增加,就会不断地减少。 读书以过目成诵为能,最是不济事。 你可以用自己不的方式赚到财富;也可以用不的药医好病;但你无法从自己不爱的人身上获得幸福。 我们不希望自己是什么天才。没有从天而降的成功,每从跌倒里站起来一次,成功就近了一寸。也没有平白无故的威信。每正确一次,威信 就增加一分。 静以修身,俭以养德。——诸葛亮 如果要飞得高,就该把地平线忘掉。
溶液的质量=溶质质量+ 溶剂质量
溶液的体积≠溶质体积 + 溶剂体积
3.溶质、溶剂的判断
(1).溶质的状态可以是固、液或者气态;;
(2).水、酒精、汽油是常用的溶剂;
(3).除特别说明,一般人们所说的溶液都是指水溶液。
根据溶液名称。“溶质的溶剂溶液”,溶质在前,溶剂在后,如:碘酒,碘是
溶质,酒精是溶剂。如未说明溶剂,则溶剂为水。
氨气的水溶液(俗称氨水) 氨气(气体) 水
稀盐酸(氯化氢气体的水溶液)
氯化氢(气体) 水
锌粒溶于稀硫酸中完全反应后
所得溶液
硫酸锌(固体) 水
LOGO
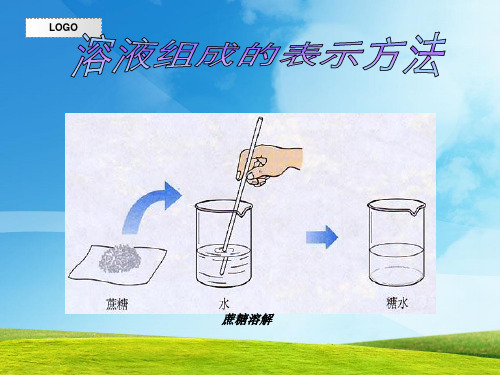
你知道下面瓶中标签是什么意思吗?
化学纯
500mL
浓盐酸(HCl)
含HCl 37 % 密度为1.18 g/cm3
下面我们就来学习溶液浓度的表 示方法。
LOGO
LOGO
课本12页,完成表格
溶质质量 溶剂质量 溶液质量 溶质质量 溶液质量
溶液的质量=溶质质量+ 溶剂质量
溶液的体积≠溶质体积 + 溶剂体积
3.溶质、溶剂的判断
(1).溶质的状态可以是固、液或者气态;;
(2).水、酒精、汽油是常用的溶剂;
(3).除特别说明,一般人们所说的溶液都是指水溶液。
根据溶液名称。“溶质的溶剂溶液”,溶质在前,溶剂在后,如:碘酒,碘是
溶质,酒精是溶剂。如未说明溶剂,则溶剂为水。
氨气的水溶液(俗称氨水) 氨气(气体) 水
稀盐酸(氯化氢气体的水溶液)
氯化氢(气体) 水
锌粒溶于稀硫酸中完全反应后
所得溶液
硫酸锌(固体) 水
LOGO
你知道下面瓶中标签是什么意思吗?
化学纯
500mL
浓盐酸(HCl)
含HCl 37 % 密度为1.18 g/cm3
下面我们就来学习溶液浓度的表 示方法。
LOGO
LOGO
课本12页,完成表格
溶质质量 溶剂质量 溶液质量 溶质质量 溶液质量
沪教初中化学九下《6第2节 溶液组成的表示》PPT课件 (4)

[解] 设:这种稀盐酸中溶质的质量为x。
CaCO3 ﹢ 2HCl=====CaCl2 + H2O + CO2
100
73
25g
x
100/25g=73/x
x=(25×73g)/100=18.25g
所 以 : 溶 质 的 质 量 分 数 ==(18.25g/100g) ×100%==18.25%
答:这种稀盐酸溶液中溶质的质量分数为
第九单元 溶液 课题3 溶质的质量分数
例题2:把50g质量分数为98%的 浓硫酸稀释成质量分数为20%的 硫酸溶液,需要多少克水?
[解析]溶液稀释(或浓缩) 前后溶质的质量不变。
例题2:溶液稀释和配制问题的计算
[解] 设:稀释后溶液的质量为x.。
50g ×98%=x×20%
x=(50g×98%)/20%=245g
D.将溶液中的水蒸发一半
3.若将12g含有少量铜屑(不与盐酸反应)的铁粉样 品放到盛有100g盐酸的烧杯中,恰好完全反应后, 烧杯中物质的总质量为111.6g。试求铁粉样品中铁 的质量分数。
通过本节课的学习,你知道 了什么?
所以:水的质量为245g-50g=195g
答:把50g质量分数为98%的浓硫酸稀 释成质量分数为20%的硫酸溶液,需要 水195g。
如果把50g换成50mL,那么 还需要什么条件才能解题?
例题3:100g某稀盐酸溶液与 25g碳酸钙完全反应。试计算这 种稀盐酸溶液中溶质的质量分 数。
[解析]本题是将溶质的质量分数运 用于化学方程式的计算
18.25%。
课堂练习
1. 溶 液 加 水 稀 释 时 , 没 有 发 数 B.溶质的质量
C.溶剂的质量 D.溶液的质量
《溶解与乳化》溶液PPT课件

7.1 溶解与乳化
第七章 溶液
溶解
乳化
内容提要
溶解时的吸热或放热现象
1.认识溶解现象,知道溶液、溶剂、溶质等概念;2.能说出一些日常生活中常见的乳化现象;3.了解物质溶解时伴随的能量变化。
学习目标
实验探究一:认识溶解现象在3支试管中各放入少量硫酸铜、蔗糖、细沙石的固体,各加入约10ml水,充分振荡,观察现象。
第七章 溶 液
第七章 溶 液
[课堂速记]
[应用示例]
第七章 溶 液
例1 2013·厦门下列洗涤或除污过程应用乳化原理的是( )A.用汽油除去衣服上的油污B.用酒精除去衣服上的碘C.用洗洁精洗去餐具上的油脂D.用刷子刷除杯子上的污垢
C
第七章 溶 液
[解析] C 根据乳化作用的定义分析:洗洁精或洗衣粉等物质使植物油分散成无数细小的液滴,而不聚成大的油珠,这些细小的液滴能随着水冲走,洗洁精或洗衣粉所起的这种作用属于乳化作用。
①
②
③
④
X
双氧水
水
水
水
Y
二氧化锰
氯化钠
氢氧化钠
硝酸铵
B
知能训练
End
Thankyou
7.1 溶解与乳化
第七章 溶 液
1.乳浊液
第七章 溶 液
一 乳浊液、乳化剂、乳化作用
[实验]
第七章 溶 液
试管内加入物质
现象
把液体倒掉后的试管是否干净
振荡前
振荡后
静置后
水和植物油
液体分两层
液体不分层
第七章 溶 液
大于
硝酸铵
氯化钠
探究点一 乳浊液、乳化剂、乳化作用
[情景展示]认识溶解现象
第七章 溶液
溶解
乳化
内容提要
溶解时的吸热或放热现象
1.认识溶解现象,知道溶液、溶剂、溶质等概念;2.能说出一些日常生活中常见的乳化现象;3.了解物质溶解时伴随的能量变化。
学习目标
实验探究一:认识溶解现象在3支试管中各放入少量硫酸铜、蔗糖、细沙石的固体,各加入约10ml水,充分振荡,观察现象。
第七章 溶 液
第七章 溶 液
[课堂速记]
[应用示例]
第七章 溶 液
例1 2013·厦门下列洗涤或除污过程应用乳化原理的是( )A.用汽油除去衣服上的油污B.用酒精除去衣服上的碘C.用洗洁精洗去餐具上的油脂D.用刷子刷除杯子上的污垢
C
第七章 溶 液
[解析] C 根据乳化作用的定义分析:洗洁精或洗衣粉等物质使植物油分散成无数细小的液滴,而不聚成大的油珠,这些细小的液滴能随着水冲走,洗洁精或洗衣粉所起的这种作用属于乳化作用。
①
②
③
④
X
双氧水
水
水
水
Y
二氧化锰
氯化钠
氢氧化钠
硝酸铵
B
知能训练
End
Thankyou
7.1 溶解与乳化
第七章 溶 液
1.乳浊液
第七章 溶 液
一 乳浊液、乳化剂、乳化作用
[实验]
第七章 溶 液
试管内加入物质
现象
把液体倒掉后的试管是否干净
振荡前
振荡后
静置后
水和植物油
液体分两层
液体不分层
第七章 溶 液
大于
硝酸铵
氯化钠
探究点一 乳浊液、乳化剂、乳化作用
[情景展示]认识溶解现象
3.2.1 溶解组成的表示方法 课件(共26张PPT)鲁教版九年级上册

是( B )
A. 加入8 g NaCl 固体 C. 倒掉40 g 溶液
B. 加入80 g 水 D. 加入40 g 5% 的NaCl 溶液
感悟新知
方法点拨
知2-练
要使溶液的溶质质量分数减小,可用的方法有:
加水稀释。可利用稀释前后溶质的质量不变来列式
计算,若要使溶液的溶质质量分数减小至原来的一半,
加入水的质量应等于原溶液质量;
感悟新知
知2-讲
1. 溶液稀释的方法与计算公式 (1)加水稀释:A 为浓溶液质量,a% 为浓溶液溶质的质
量分数;B 为稀释后溶液质量,b% 表示稀释后溶 质的质量分数;M 水表示加入水的质量。稀释前后 溶质质量不变。则有:A·a%=B·b% 或A·a%= (A+M 水)·b%。
感悟新知
知2-讲
(2)加入稀溶液稀释浓溶液:A 为浓溶液质量,a% 为 浓溶液溶质的质量分数;B 为稀溶液质量,b% 表 示稀溶液溶质的质量分数;c% 代表混合后所得溶 液溶质的质量分数。则有:A·a%+B·b%= (A+B)·c%。
感悟新知
二氧化氯(ClO2)1 000 mL
溶质的质量分数
80%
密度
1.2 g/mL
相对分子质量
67.5
强腐蚀性,阴冷处密封储藏
综合应用
(3)欲配制30 kg 质量分数为20% 的稀二氧化氯消 毒液用于消毒,需要 ____7_.5___ kg 这种二氧化氯消毒液和 ___2_2_.5___ kg 水。
(4)若往上述溶液中加入45 g 12% 的硝酸钾溶液, 所得溶液的溶质质量分数为 ___1_5_.5_%____ 。
感悟新知
方法点拨 计算溶质质量分数时应注意:
化学“溶液”三张图

溶液是一种或几种物质分散到另一种物质里形成均一、稳定的混合物,在有关溶液的计算中,要准确分析溶质、溶剂、溶液的质量,它们最基本的质量关系是:
溶质质量+溶剂量=溶液质
注意:溶质质量不包括在溶液中未溶解的溶质的质量。
一、溶解度
固体物质溶解度:在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
(马上点标题下蓝字"初中化学"关注可获取更多学习方法、干货!)
二、溶液中溶质质量分数
溶质的质量分数是溶质质量与溶液质量之比。
初中化学中常用百分数来表示。
三、溶解度与溶液质量分数之间的换算
在一定温度下,饱和溶液里溶质质量、溶剂质量、溶液质量之比,是一个固定的值,也就是说饱和溶液里溶质质量分数是恒定的。
Tips:
大家在化学学习过程中还有哪方面知识学起来比较吃力,欢迎给化学姐留言,化学姐会尽力帮助大家。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Page 6
【结论】密度小于水的溶液与水等质量混合后,质量分数减半,
物质的量浓度大于原来的一半。推而广之,密度小于水的两种
溶液等质量混合后,质量分数
˃
1 2
(c1+c2) 。
=
1 2
(w1+w2) ,物质的量浓度
【例3】若以w1和w2分别表示物质的量浓度为amol/L和bmol/L
氨水的质量分数,且w2=2w1,则下列判断正确的是( D )
物质等的质量量浓混度合˂ 后12 ,c1 得(到混的合稀体硫积酸大的于质浓量硫分酸数体为积的122w倍); 。
Page 2
【结论】密度大于水的溶液与水等质量混合后,质量分数减半,
物质的量浓度小于原来的一半。推而广之,密度大于水的两种
溶液等质量混合后,质量分数
˂
1 2
(c1+c2) 。
=
1 2
(w1+w2),物质的量浓度
m1、V c1、w1
m2、V
氨水
水
质量分等数体˂积12 混w1(合混后合,后得溶到液新质的量氨大水于的氨物水质质的量量的浓度2倍为)。12 c1 ;
Page 8
结束语
当你尽了自己的最大努力时,失败也是伟大的 ,所以不要放弃,坚持就是正确的。
When You Do Your Best, Failure Is Great, So Don'T Give Up, Stick To The End
Page 4
【结论】密度大于水的溶液与水等体积混合后,物质的量浓度
减半,质量分数大于原来的一半。推而广之,密度大于水的两
种溶液等体积混合后,物质的量浓度
˃
1 2
(w1+w2)。
=
1 2
(c1+c2),质量分数
【例2】 质量分数为3.9%、物质的量浓度为1mol·L-1
和14.3%、4mol·L-1的NaOH溶液等体积混合后,所得
混合液的质量分数 ˃ 9.1%(填“˃”、“=”或“˂”)。
【练习2】把70% HNO3(密度为1.40 g·cm-3)加到等体积 的水中,稀释后HNO3(aq)中溶质的质量分数是( C )
A.0.35 B.<0.35 C.>0.35 D.≤0.35
【提示】密度与水相比是大还是小?等质量还是等体积混合?
我们分两类四种情况来讨论: 第一类、密度大于水(1.0g·cm-3)的溶液混合˳大多数 酸、碱和盐的溶液的密度都大于水,可以归为一类分析。
情形1 溶液与等质量的水混合
质量均为m的浓硫酸和水。浓硫酸:密度1.84g·cm-3, 水:1.0g·cm-3。图示如下:
m、V1 c1、w1
m、V2
浓硫酸 水
感谢聆听
不足之处请大家批评指导
Please Criticize And Guide The Shortcomings
演讲人:XXXXXX 时 间:XX年XX月XX日
A.2a析】w2=2w1,可以看作:将bmol/L的氨水加等质量的水 稀释得到amol/L的氨水。
m、V2 b、w2
氨水
m、V1 则有物质的量浓度
大于原来的一半,即
水
a˃
1 2
b
从而
a˂b˂2a
Page 7
情形4 溶液与等体积的水混合
体积均为V的氨水和水。氨水:密度0.73g·cm-3, 水:1.0g·cm-3。图示如下:
A.等于9.2 B.小于9.2 C.大于9.2 D.无法确定
【提示】硫酸的密度大于水;质量分数减半,等质量加水。
Page 3
情形2 溶液与等体积的水混合
体积均为V的浓硫酸和水。浓硫酸:密度1.84g·cm-3, 水:1.0g·cm-3。图示如下:
m1、V c1、w1
m2、V
浓硫酸 水 质量分等数体˃积12 混w1(合混后合,后得溶到液的质稀量硫小酸于的浓物硫质酸的溶量液浓质度量为的122倍c1 ); 。
图示法分析溶液混合引起的浓度变化
——形象思维与极限思维的培养
溶液混合会引起质量分数和物质的量浓度的变化,分析 起来比较复杂。老师们常引导大家用数学推导的方法进行分 析,虽然思路清晰,但大家接受起来较难,结论也不易记忆。 现在我们尝试用图示法予以分析,直观地显示变化情况,相 信大家理解记忆起来会方便很多。
Page 5
第二类、溶液密度小于水(1.0g·cm-3)的溶液混合˳ 氨水、酒精等溶液的密度都小于水,可以归为一类分析。
情形3 溶液与等质量的水混合
质量均为m的氨水和水。浓硫酸:密度0.73g·cm-3, 水:1.0g·cm-3。图示如下:
m、V1 c1、w1
m、V2
氨水 水 物质等的质量量浓混度合˃ 后12 ,c1 得(到混新合的体氨积水小的于质氨量水分体数积为的2倍12 )w1。;
【例1】质量分数为98%、物质的量浓度为18.4mol·L-1
的浓硫酸和质量分数为24%、物质的量浓度为3.2mol·L-1的
稀硫酸等质量混合后,溶液的密度为1.18g·cm-3,硫酸的物质
的量浓度 ˂ 10.3mol·L-1(填“˃”、“=”或˂”)。
【练习】已知质量分数为98%的硫酸溶液的物质的量的浓度为 18.4mol/L,则质量分数为49%的硫酸溶液的物质的量浓度为 ( B )mol/L
