氧化剂和还原剂课件(人教版必修Ⅰ)
合集下载
高中化学-2.3.2 氧化剂和还原剂课件 新人教版必修1

得电子,化合价降低,被还原
1.氢化钠(NaH)是一种生氢剂,可发生如下反应: NaH+H2O====NaOH+H2↑对这一反应的描述正确的 是(D ) A.NaH是氧化剂 B.NaH是氧化产物 C.NaOH是还原产物 D.氧化产物与还原产物的质量比是1:1
23
2.氧化还原反应在生产、生活中具有广泛的用途。 下列生产、生活中的事例不属于氧化还原反应的是
总结氧化还原反应的基本概念:
1.氧化剂:得到电子,化合价降低的物质。 2.还原剂:失去电子,化合价升高的物质。 3.氧化性和还原性:
氧化性:氧化剂具有氧化性。 还原性:还原剂具有还原性。
【练一练】
下列反应中,哪些是氧化剂?哪些是还原剂?
Cu + Cl2 点==燃== CuCl2
还原剂 Zn +
氧化剂 H2SO4 ==== ZnSO4 + H2↑
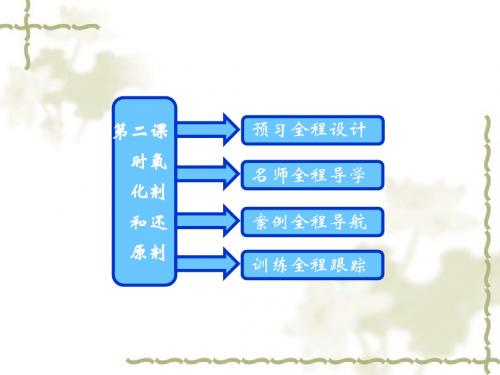
第2课时 氧化剂和还原剂
幽深的水域隐藏着许 多危险的动物,其中最危 险的当属放电鱼。它能放 出一千多伏的电流,即便 是最庞大的猎物也不堪一 击。生物体的氧化反应与 放电有什么关系呢?
1.掌握氧化剂和还原剂的概念和判断。(重点) 2.了解生活中的氧化还原反应。
【复习回顾】
1.下列化学反应中,哪些属于氧化还原反应? Cu + Cl2 =点==燃= CuCl2 √ Zn + H2SO4 ==== ZnSO4 + H2↑ √ CaCO3+ 2HCl ====CaCl2+H2O+CO2↑ × Cl2 + H2O==== HCl + HClO √
还原剂
氧化剂
Cl2 + H2O==== HCl + HClO
既是氧化剂又是还原剂
1.氢化钠(NaH)是一种生氢剂,可发生如下反应: NaH+H2O====NaOH+H2↑对这一反应的描述正确的 是(D ) A.NaH是氧化剂 B.NaH是氧化产物 C.NaOH是还原产物 D.氧化产物与还原产物的质量比是1:1
23
2.氧化还原反应在生产、生活中具有广泛的用途。 下列生产、生活中的事例不属于氧化还原反应的是
总结氧化还原反应的基本概念:
1.氧化剂:得到电子,化合价降低的物质。 2.还原剂:失去电子,化合价升高的物质。 3.氧化性和还原性:
氧化性:氧化剂具有氧化性。 还原性:还原剂具有还原性。
【练一练】
下列反应中,哪些是氧化剂?哪些是还原剂?
Cu + Cl2 点==燃== CuCl2
还原剂 Zn +
氧化剂 H2SO4 ==== ZnSO4 + H2↑
第2课时 氧化剂和还原剂
幽深的水域隐藏着许 多危险的动物,其中最危 险的当属放电鱼。它能放 出一千多伏的电流,即便 是最庞大的猎物也不堪一 击。生物体的氧化反应与 放电有什么关系呢?
1.掌握氧化剂和还原剂的概念和判断。(重点) 2.了解生活中的氧化还原反应。
【复习回顾】
1.下列化学反应中,哪些属于氧化还原反应? Cu + Cl2 =点==燃= CuCl2 √ Zn + H2SO4 ==== ZnSO4 + H2↑ √ CaCO3+ 2HCl ====CaCl2+H2O+CO2↑ × Cl2 + H2O==== HCl + HClO √
还原剂
氧化剂
Cl2 + H2O==== HCl + HClO
既是氧化剂又是还原剂
高中化学必修一(人教版)教学课件1.3.2氧化剂和还原剂

A.①⑥ B.②③ C.④⑤ D.②③④⑤
答案:C
技能素养
目标一 物质的氧化性、还原性强弱比较
把四个反应中的氧化剂、还原剂、氧化产物、还原产物按氧化性
或还原性强弱排序,然后对比选项进行判断。
[例 1] 有 A、B、C、D 四种物质,已知它们能发生下列反应:
①A2++B===B2++A ②A2++C===C2++A ③B2++C===C2++B ④C2++D===D2++C
(5)在反应 2KClO3=M=△n=O==2 2KCl+3O2↑,KClO3 既表现氧化性,又
表现还原性。( √ ) (6)在氢气燃烧生成水的反应中,氢气作还原剂。( √ ) (7)一种物质若具有氧化性,则不具有还原性,反之亦然。( × )
2.下列反应中,CO2 作氧化剂的是( ) A.Ca(OH)2+CO2===CaCO3↓+H2O B.CO2+C=高==温==2CO C.2Fe2O3+3C=高==温==4Fe+3CO2↑ D.C+2H2O==△===2H2↑+CO2↑
解析:由题中信息知氧化性的强弱顺序为 XO-4 >Z2>B2>A3+,所以 A、 C 正确;在反应①中 Z 元素被氧化,在反应③中 Z 元素被还原,所以 B 项正确;还原性为 A2+>B->Z->X2+,D 项错。
答案:D
状元随笔 判断氧化还原反应能否发生的方法
[核心能力] 物质氧化性、还原性强弱的比较方法
根据上述关系,由①知,氧化性:A2+>B2+,还原性:B>A;由②知, 氧化性:A2+>C2+,还原性:C>A;由③知,氧化性:B2+>C2+,还原性: C>B;由④知,氧化性:C2+>D2+,还原性 D>C。综合①~④可得,氧化 性:A2+>B2+>C2+>D2+,还原性:D>C>B>A。
答案:C
技能素养
目标一 物质的氧化性、还原性强弱比较
把四个反应中的氧化剂、还原剂、氧化产物、还原产物按氧化性
或还原性强弱排序,然后对比选项进行判断。
[例 1] 有 A、B、C、D 四种物质,已知它们能发生下列反应:
①A2++B===B2++A ②A2++C===C2++A ③B2++C===C2++B ④C2++D===D2++C
(5)在反应 2KClO3=M=△n=O==2 2KCl+3O2↑,KClO3 既表现氧化性,又
表现还原性。( √ ) (6)在氢气燃烧生成水的反应中,氢气作还原剂。( √ ) (7)一种物质若具有氧化性,则不具有还原性,反之亦然。( × )
2.下列反应中,CO2 作氧化剂的是( ) A.Ca(OH)2+CO2===CaCO3↓+H2O B.CO2+C=高==温==2CO C.2Fe2O3+3C=高==温==4Fe+3CO2↑ D.C+2H2O==△===2H2↑+CO2↑
解析:由题中信息知氧化性的强弱顺序为 XO-4 >Z2>B2>A3+,所以 A、 C 正确;在反应①中 Z 元素被氧化,在反应③中 Z 元素被还原,所以 B 项正确;还原性为 A2+>B->Z->X2+,D 项错。
答案:D
状元随笔 判断氧化还原反应能否发生的方法
[核心能力] 物质氧化性、还原性强弱的比较方法
根据上述关系,由①知,氧化性:A2+>B2+,还原性:B>A;由②知, 氧化性:A2+>C2+,还原性:C>A;由③知,氧化性:B2+>C2+,还原性: C>B;由④知,氧化性:C2+>D2+,还原性 D>C。综合①~④可得,氧化 性:A2+>B2+>C2+>D2+,还原性:D>C>B>A。
《氧化剂和还原剂》课件

氧化还原反应的判据
通过观察物质的氧化态和还原态的变化以及电子的转移,可以判断是否发生了氧化还原反应。
还原剂的定义
还原剂是指在化学反应中能够捐赠电子,同时还原其他物质的物质。
氧化还原反应中的电荷转移
氧化还原反应涉及电子的转移,其中氧化剂接受电子,而还原剂捐赠电子。
氧化还原反应的基本过程
氧化还原反应包括氧化剂氧化其他物质、还原剂还原其他物质以及电荷的转移过程。
氧化剂和还原剂的比较
氧化剂和还原剂在氧化还原反应中具有不同的作用和性质,氧化剂是电子接 受者,还原剂是电子捐赠者。
《氧化剂和还原剂》PPT 课件
通过本课件,我们将深入探讨氧化剂和还原剂的概念和应用。了解化学反应 中的电荷转移,以及氧化还原反应在各个领域的重要性。
什么是氧化还原反应
氧化还原反应是指物质通过电子的转移而导致氧化态的物质与还原态的物够接受电子,同时氧化其他物质的物质。
人教版高一化学必修一第三节氧化剂与还原剂的强弱比较课件

人教版高一化学必修一第三节氧化剂 与还原 剂的强 弱比较 课件
(1)常见的氧化剂:
①活泼的非金属单质,如:X2、O2等
②含高价态元素的化合物,如:KNO3、KMnO4 等 ③过氧化物,如:Na2O2、H2O2等
(2)常见的还原剂:
①活泼的金属单质,如:Na、K、Zn 等
②某些非金属单质,如:H2、C、Si等
3、同种元素的不同价态物质氧化性和还原性强弱的判断
① 一种元素处于最高价态时,只能得到电子显氧化性; ② 当处于最低价态时,只能失去电子显还原性; ③ 当处于中间价态时,既能得到电子又能失去电子, 故既显氧化性又显还原性。
如:S -2 0 +4 +6
低价到高价,氧化性渐增,还原性渐减 高价到低价,氧化性渐减,还原性渐增
例1、已知有如下反应:
①2+B5rO3-+C0l2==B0r2+2+C5lO3-,
BrO3- > ClO3-
②+Cl5O3-+5C-1l-+6H+==3C0l2+3H2O, ClO3- > Cl2
③2+Fe3Cl3+2K-I1==2+F2eCl2+2KCl+I02, Fe3+ > I2
+2 0 +3 -1
还原产物 氧化产物
结论:氧化性:CuO > H2O
还原性: H2 > Cu
人教版高一化学必修一第三节氧化剂 与还原 剂的强 弱比较 课件
人教版高一化学必修一第三节氧化剂 与还原 剂的强 弱比较 课件
2、根据活动性顺序判断 (1)根据金属活动顺序判断
K、Ca、Na、Mg、Al、Zn、Fe、Sn、 (接上)Pb、(H)、Cu、Hg、Ag、Pt、Au
《氧化剂和还原剂》课件 新人教版必修1
C.CaH2是还原剂,H2O是氧化剂
D.氧化产物与还原产物的质量比为1∶1
[解析] 解答此题的关键是确定CaH2中氢元素的化合价为- 1价.反应中只有氢元素化合价发生了变化,其余元素化合 价均未变化.生成物Ca(OH)2中的氢为+1价,这两个氢原 子一定来自H2O分子,而H2O中共4个+1价的氢原子,显然
3.根据金属活动性顺序判断
其一般的反应规律是:“上左下右可反应,隔之愈
远愈易行.”
4.根据变价元素被氧化或被还原的程度判断 点燃 △ 如:2Fe+3Cl2=====2FeCl3,Fe+S=====FeS,根据变价金属元素 Fe 被氧化的程度:被 Cl2 氧化成+3 价,而 S 只能把其氧化成+2 价,判断氧化性:Cl2>S. 5.根据氧化还原反应进行的难易程度(反应条件)来判断 如:①2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O, △ ②MnO2+4HCl(浓)=====MnCl2+Cl2↑+2H2O, 前者比后者容易, 可判断氧化性:KMnO4> MnO2.
金属单质一般具有较强的还原性,但其还原性强弱 与失去电子的多少无关,只与失电子的难易程度有关.
考查点一
氧化还原反应基本概念的判断—————
[例1]
(2010· 临沂高一期中检测)氢化钙可作为生氢剂,
反应的化学方程式为:CaH2+2H2O===Ca(OH)2+2H2↑, 下列说法错误的是 A.CaH2既是氧化剂,又是还原剂 B.H2既是氧化产物,又是还原产物 ( )
应时所含元素的化合价 升高 ,本身被 氧化 .
(2)氧化性和还原性 ①氧化性:氧化剂在反应中所表现出来的性质. ②还原性:还原剂在反应中所表现出来的性质.
一种物质若具有氧化性,则不具有还原性,反之亦 然,这种观点是否正确? 提示:不正确.物质是否具有氧化性或还原性,与物 质的性质有关,有些物质只具有氧化性,如F2,有些物 质只具有还原性,如K、Ca等,也有些物质既具有氧化 性又具有还原性,如SO2在反应SO2+2H2S===3S↓+
氧化剂和还原剂ppt课件

1) 活泼的非金属单质: O2 , Cl2 2) 高价的氧化物:CuO , Fe2O3 3) 高价的含氧酸及其盐:KMnO4 , K2Cr2O7 , 浓H2SO4 , HNO3 , KClO3 4) 某些阳离子:Fe3+ , H+
还原剂: 具有还原性,失去电子,化合价升高
中间价态的化合物,在氧化还原
C.Br-、I-、Fe2+
D.Fe2+、I-、Br-
课堂探究
物质的氧化性或还原性强弱的比较
(3) 根据元素周期表比较: 同一周期,从左往右,氧化性逐渐增强,还原性逐渐减弱; 同一主族,从上往下,还原性逐渐增强,氧化性逐渐减弱。
(4) 根据反应条件比较: 2KMnO4+16HCl(浓) === 2MnCl2+2KCl+5Cl2↑+8H2O
C. 氧化性:Co2O3>Cl2>HIO3 D. 还原性:CoCl2>HCl>I2
解析: 反应Ⅰ中Cl元素的化合价部分升高,则HCl为还原剂,A错误;反应Ⅱ中Cl元素的化合价
降低,则Cl2发生还原反应,B错误;由氧化剂的氧化性强于氧化产物的氧化性可知,反应Ⅰ中氧 化性:Co2O3>Cl2,反应Ⅱ中氧化性:Cl2>HIO3,则氧化性:Co2O3>Cl2>HIO3,C正确;由还 原剂的还原性强于还原产物的还原性可知,反应Ⅰ中还原性:HCl>CoCl2,反应Ⅱ中还原性:I2 >HCl,故还原性:I2>HCl>CoCl2,D错误。
Fe2O3 + 3CO
高温
0
+4 -2
2Fe + 3CO2↑
化合价降低
氧
还
化
原
剂
剂
还氧 原化 产产 物物
氧化剂 + 还原剂 = 还原产物 + 氧化产物
还原剂: 具有还原性,失去电子,化合价升高
中间价态的化合物,在氧化还原
C.Br-、I-、Fe2+
D.Fe2+、I-、Br-
课堂探究
物质的氧化性或还原性强弱的比较
(3) 根据元素周期表比较: 同一周期,从左往右,氧化性逐渐增强,还原性逐渐减弱; 同一主族,从上往下,还原性逐渐增强,氧化性逐渐减弱。
(4) 根据反应条件比较: 2KMnO4+16HCl(浓) === 2MnCl2+2KCl+5Cl2↑+8H2O
C. 氧化性:Co2O3>Cl2>HIO3 D. 还原性:CoCl2>HCl>I2
解析: 反应Ⅰ中Cl元素的化合价部分升高,则HCl为还原剂,A错误;反应Ⅱ中Cl元素的化合价
降低,则Cl2发生还原反应,B错误;由氧化剂的氧化性强于氧化产物的氧化性可知,反应Ⅰ中氧 化性:Co2O3>Cl2,反应Ⅱ中氧化性:Cl2>HIO3,则氧化性:Co2O3>Cl2>HIO3,C正确;由还 原剂的还原性强于还原产物的还原性可知,反应Ⅰ中还原性:HCl>CoCl2,反应Ⅱ中还原性:I2 >HCl,故还原性:I2>HCl>CoCl2,D错误。
Fe2O3 + 3CO
高温
0
+4 -2
2Fe + 3CO2↑
化合价降低
氧
还
化
原
剂
剂
还氧 原化 产产 物物
氧化剂 + 还原剂 = 还原产物 + 氧化产物
1氧化剂和还原剂(共15张PPT)

小结:
1、氧化剂、还原剂均指反应物物
氧化产物与还原产物均指生成物
2、二者相互依存,对立统一
3、有时可为同一物质,也可为不同 物质。(参加反应的元素可全部或 部分参与氧化还原反应)
分析下列反应是否是氧化还原反 应,若是,则分析元素化合价的 变化与氧化还原反应的关系:
1.Zn + 2HCI == ZnCI2 + H2↑ 2.H2 + Cl2 点=燃= 2HCl
一 氧化还原反应
1 化学反应与元素化合价的变化
氧化还原反应: 化 (1)概念:凡是有元素化合价升 学 降的反应 反 (2)特征:元素的化合价在化学
应 反应中有变化(。判断依据 )
非氧化还原反应:
(3)氧化反应:反应物所含某种或某些元素 化合价升高的反应。
(4)还原反应:反应物所含某种或某些元素 化降低的反应。
a 双线桥法 b 单线桥法
△
CuO + H2 = Cu + H2O
定义
1、氧化产物:还原剂失去电子被氧化 经过氧化反应得到的产物。
2、还原产物:氧化剂得到电子被还原 经过还原反应得到的产物。
小结:
还原剂 +
氧化剂
价升高、失电子、 被氧化、氧化反应
价降低、得电子 被还原、还原反应
还原产物 +
氧化产物
Cl
Cl- +17 2 8 8
2 氧化还原反应的实质(1)氧化还原
反应的实质电子转移
失电子,化合价升高,被氧化
0
0 点燃 +1 -1
2Na + Cl2==== 2NaCl
得电子 ,化合价降低,被还原
讨论化合价升降与电子转移有何关系?
Zn + CuSO4 = Zn SO4 + Cu
课件_人教版高一化学上册必修一《氧化剂和还原剂》PPT课件_优秀版

失去电子,化合价升高,被氧化
判断方法(口诀):
升、失、氧;降、得、还;若说剂,则相反。
升、 失、 氧
化合价
降、
电 子 反应类型
得、 还
还原剂 氧化剂
【练习1】:指出下列反应的氧化剂、还原剂、氧化产物和还原产物。
H2 + CuO=△==Cu + H2O
还原剂 氧化剂 2H2S + SO2 == 3S ↓ + 2H2O 氧化产物 还原产物
第三节 氧化还原反应
第二课时 氧化剂和还原剂
知识回顾
2H2S + SO2 == 3S ↓ + 2H2O
⑶含高价金属的盐:KMnO4、 Fe3+等
1、化学反应 (从还原剂指向氧化剂)
第三节 氧化还原反应
化合价是否升降
(7)分别用双线桥和单线桥表示该反应的电子得失和转移情况
氧化还原反应
非氧化还原反应 物质所含元素化合价升高的反应是还原反应
(7)分别用双线桥和单线桥表示该反应的电子得失和转移情况
(1)氧化剂是
,(2)还原剂是
。
重点:(1)单箭号(在反应物之间) 其中化合价降低的元素被氧化。
氧化剂
还原产物
(3)氧化产物是___________,
Cl2 + 2KOH === KCl + KClO 练习1、在H2S+H2SO4(浓)=SO2 +S ↓+2H2O的反应中: 失去电子,化合价升高,被氧化
三、用单线桥表示电子转移情况 还原反应:物质所含元素化合价降低的反应,
其中化合价降低的元素被氧化。
3、本质: 有电子得失(或偏移)
还原剂
氧化剂
一、氧化剂和还原剂、 氧化产物和还原产物
判断方法(口诀):
升、失、氧;降、得、还;若说剂,则相反。
升、 失、 氧
化合价
降、
电 子 反应类型
得、 还
还原剂 氧化剂
【练习1】:指出下列反应的氧化剂、还原剂、氧化产物和还原产物。
H2 + CuO=△==Cu + H2O
还原剂 氧化剂 2H2S + SO2 == 3S ↓ + 2H2O 氧化产物 还原产物
第三节 氧化还原反应
第二课时 氧化剂和还原剂
知识回顾
2H2S + SO2 == 3S ↓ + 2H2O
⑶含高价金属的盐:KMnO4、 Fe3+等
1、化学反应 (从还原剂指向氧化剂)
第三节 氧化还原反应
化合价是否升降
(7)分别用双线桥和单线桥表示该反应的电子得失和转移情况
氧化还原反应
非氧化还原反应 物质所含元素化合价升高的反应是还原反应
(7)分别用双线桥和单线桥表示该反应的电子得失和转移情况
(1)氧化剂是
,(2)还原剂是
。
重点:(1)单箭号(在反应物之间) 其中化合价降低的元素被氧化。
氧化剂
还原产物
(3)氧化产物是___________,
Cl2 + 2KOH === KCl + KClO 练习1、在H2S+H2SO4(浓)=SO2 +S ↓+2H2O的反应中: 失去电子,化合价升高,被氧化
三、用单线桥表示电子转移情况 还原反应:物质所含元素化合价降低的反应,
其中化合价降低的元素被氧化。
3、本质: 有电子得失(或偏移)
还原剂
氧化剂
一、氧化剂和还原剂、 氧化产物和还原产物
新教材高中化学第一章物质及其变化第三节第2课时氧化剂和还原剂课件新人教版必修第一册

B.CO2+C
C.2Fe2O3+3C
D.CO+H2O
2CO
4Fe+3CO2↑
H2+CO2
)。
答案:B
解析:若CO2在反应中是氧化剂,则其所含碳元素的化合价降
低。A项,CO2中碳元素的化合价无变化;B项,CO2中碳元素的
化合价由+4价降低为+2价;C、D两项中,CO2均为氧化产物。
故B项符合题意。
2.氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧
化剂又是还原剂、既非氧化剂又非还原剂等。下列反应中水
的作用与Br2+SO2+2H2O══H2SO4+2HBr中水的作用不相
同的是(
)。
A.3NO2+H2O══2HNO3+NO
B.4Fe(OH)2+O2+2H2O══4Fe(OH)3
C.Cl2+H2O══HCl+HClO
D.2Al+2NaOH+2H2O══2NaAlO2+3H2↑
泼得多,Na更容易失去电子,因此Na比Al的还原性强。
(2)氧化性、还原性与元素化合价的关系:
最高价 ——只有氧化性
↓↑
中间价态——既具有氧化性,又具有还原性
↓↑
最低价 ——只有还原性
对于同一元素而言,一般价态越高,氧化性越强,价态越低,氧
化性越弱。如氧化性Fe3+>Fe2+,S<SO2<H2SO4。
答案:D
解析:该反应属于置换反应,A项错误。
+
2KO3+
+
2K O3
+ ↑
C.2Fe2O3+3C
D.CO+H2O
2CO
4Fe+3CO2↑
H2+CO2
)。
答案:B
解析:若CO2在反应中是氧化剂,则其所含碳元素的化合价降
低。A项,CO2中碳元素的化合价无变化;B项,CO2中碳元素的
化合价由+4价降低为+2价;C、D两项中,CO2均为氧化产物。
故B项符合题意。
2.氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧
化剂又是还原剂、既非氧化剂又非还原剂等。下列反应中水
的作用与Br2+SO2+2H2O══H2SO4+2HBr中水的作用不相
同的是(
)。
A.3NO2+H2O══2HNO3+NO
B.4Fe(OH)2+O2+2H2O══4Fe(OH)3
C.Cl2+H2O══HCl+HClO
D.2Al+2NaOH+2H2O══2NaAlO2+3H2↑
泼得多,Na更容易失去电子,因此Na比Al的还原性强。
(2)氧化性、还原性与元素化合价的关系:
最高价 ——只有氧化性
↓↑
中间价态——既具有氧化性,又具有还原性
↓↑
最低价 ——只有还原性
对于同一元素而言,一般价态越高,氧化性越强,价态越低,氧
化性越弱。如氧化性Fe3+>Fe2+,S<SO2<H2SO4。
答案:D
解析:该反应属于置换反应,A项错误。
+
2KO3+
+
2K O3
+ ↑
人教版必修一课件:第二章第三节氧化剂还原剂 单双线桥

氧化剂 还原剂
还原产物
氧化产物
2、有反应:
①Zn 2HCl ZnCl 2 H 2 ②2KClO 3 MnO 2
2KCl 3O 2 MnCl 2 Cl 2 2H 2 O
③MnO 2 4HCl
④5KCl KClO 3 3H 2 SO 4 3K 2 SO 4 3Cl 2 3H 2 O
MnO2 + 4HCl === MnCl2 + Cl2↑+ 2H2O
氧化剂 还原剂 还原产物 氧化产物
△
2H2S + SO2 == 3S ↓ + 2H2O
还原剂 氧化剂
△
氧化产物 还原产物
2KClO3 === 2KCl + 3O2 ↑
氧化剂 还原剂
还原产物
氧化产物
Cl2 + H2O = HCl + HClO
氧化剂 还原剂 还原产物 氧化产物
三、氧化还原反应的表示方法:
(1)“双线桥”法
化合价降低,得到2e-,被还原 +2 0 △ 0 +1
注意:
A、箭头连接反应前后 不同 价态的同种元素, 且从 反应物指向生成物。 B、标得失 (得失电子总数相等) C 、电子转移的数目 m × n em 反应中实际有多少个原子 发生了电子转移 n 1个原子转移的电子数目
△
练习:用“单线桥”法表示下列氧化还原反应电子转移的方向和数 目,并指出氧化剂、还原剂和氧化产物、还原产物。
Cl2+2NaBr=2NaCl+Br2 2KMnO4 = K2MnO4 + MnO2+ O2↑
NaBrO3+5NaBr +3H2SO4 = 3Na2SO4 +3Br2 + 3H2O
还原产物
氧化产物
2、有反应:
①Zn 2HCl ZnCl 2 H 2 ②2KClO 3 MnO 2
2KCl 3O 2 MnCl 2 Cl 2 2H 2 O
③MnO 2 4HCl
④5KCl KClO 3 3H 2 SO 4 3K 2 SO 4 3Cl 2 3H 2 O
MnO2 + 4HCl === MnCl2 + Cl2↑+ 2H2O
氧化剂 还原剂 还原产物 氧化产物
△
2H2S + SO2 == 3S ↓ + 2H2O
还原剂 氧化剂
△
氧化产物 还原产物
2KClO3 === 2KCl + 3O2 ↑
氧化剂 还原剂
还原产物
氧化产物
Cl2 + H2O = HCl + HClO
氧化剂 还原剂 还原产物 氧化产物
三、氧化还原反应的表示方法:
(1)“双线桥”法
化合价降低,得到2e-,被还原 +2 0 △ 0 +1
注意:
A、箭头连接反应前后 不同 价态的同种元素, 且从 反应物指向生成物。 B、标得失 (得失电子总数相等) C 、电子转移的数目 m × n em 反应中实际有多少个原子 发生了电子转移 n 1个原子转移的电子数目
△
练习:用“单线桥”法表示下列氧化还原反应电子转移的方向和数 目,并指出氧化剂、还原剂和氧化产物、还原产物。
Cl2+2NaBr=2NaCl+Br2 2KMnO4 = K2MnO4 + MnO2+ O2↑
NaBrO3+5NaBr +3H2SO4 = 3Na2SO4 +3Br2 + 3H2O
氧化剂和还原剂(课件)

03
常见的氧化剂和还原剂
常见的氧化剂
01
02
03
04
氧气
在许多氧化反应中,氧气是最 常见的氧化剂,如燃烧反应。
高锰酸钾
高锰酸钾是一种强氧化剂,常 用于氧化还原反应实验。
硝酸
硝酸是一种强氧化剂,常用于 制备硝酸盐和氮肥。
过氧化氢
过氧化氢在特定条件下可以分 解产生氧原子,是一种强氧化
剂。
常见的还原剂
对于无法回收再利用的氧化剂和还原 剂废液,应按照实验室规定进行安全 处理,确保不对环境造成危害。
废弃物分类
将使用过的氧化剂和还原剂废液按照 实验室规定进行分类,并贴上相应的 废弃物标签。
THANKS
感谢观看
避免混合
氧化剂和还原剂不应与其他物质混合,特别是与易燃、易 爆或有毒物质混合,以防发生剧烈反应或产生有毒气体。
应急处理
如果不慎接触到氧化剂或还原剂,应立即用大量清水冲洗, 并寻求医疗帮助。如果发生火灾或爆炸,应立即撤离现场, 并采取适当的灭火措施。
实验操作注意事项
实验前准备
在进行实验前,应仔细阅读实验 指导书,了解实验步骤、操作方 法及注意事项。准备好所需的仪 器、试剂和材料,并确保实验场
消毒剂等。
02
还原剂的应用
还原剂在化工、医药、环保等领域也有广泛应用,如制备金属单质、脱
Байду номын сангаас
氧剂、催化剂等。
03
总结
氧化剂和还原剂是化学反应中常见的物质,它们在化工、医药、环保等
领域有广泛的应用。了解常见的氧化剂和还原剂以及它们的性质和反应
特点,有助于更好地应用它们解决实际问题。
04
氧化剂和还原剂的实验
氧化剂和还原剂_课件

2.非金属单质在氧化还原反应中作反应物时一定是氧化剂吗? 不一定。非金属单质在氧化还原反应中,可能作氧化剂如C2l 、2O ,也可能作还原剂。
氧化产物和还原产物
氧化产物:还原剂失去电子被氧化后的产物。 还原产物:氧化剂得到电子被还原后的产物。
如,在下列反应中:
氧化剂发生还原反应
+2 0
0 +1
还原剂发生氧化反应
精品 课件
高中化学必修1
第一章 物质及其变化
氧化剂和还原剂
新人教版
特级教师优秀课件精选
教学目标
通过具体实例识别氧化剂和还原剂; 理解氧化剂、还原剂、氧化性、还原性的概念; 了解氧化还原反应在生活和生产中的重要应用。
教学重点
氧化还原反应的本质 氧化还原反应的基本概念 教学难点
氧化还原反应的本质 氧化还原反应的基本概念
(NaCl 既是氧化产 物又是还原产物)
练习
判断反应中的氧化剂、还原剂、氧化产物、还原产物。 1.
还原剂 氧化剂 还原产物 氧化产物
2.
氧化剂 还原剂
还原产物 氧化产物
氧化还原反应2
什么是氧化剂、还原剂? 什么是氧化产物、还原产物? 如何从一个反应中判别氧化剂、还原剂、氧化产物、还原产物?
氧化性和还原性的概念
课本练习 C
A. B. C. D.
课本练习
D A. B. C. D.
课本练习
课本练习
课本练习
课本练习 还原性
课本练习
C S、KNO3
课本练习
课本练习
2C
Zn
3
C
课本练习 B
A. B. C. D.
课本练习 14.在西汉刘安组织偏授的《淮南万毕术》中,有“曾青得铁则化为 铜”的记载。这说明早在西汉时期,我国劳动人民就已经发现铁能从 某些含铜( +2价)化合物的溶液中置换出铜,这个反应是现 代湿法冶金的基础。下列关于该反应的说法中, 不正确的是(D )。. A.该反应说明铁的金属活动性比铜的强 B.该反应的离子方程式为: C.该反应属于氧化还原反应。反应中铁被氧化 D.该反应说明金居单所都维与盐发生反应
氧化产物和还原产物
氧化产物:还原剂失去电子被氧化后的产物。 还原产物:氧化剂得到电子被还原后的产物。
如,在下列反应中:
氧化剂发生还原反应
+2 0
0 +1
还原剂发生氧化反应
精品 课件
高中化学必修1
第一章 物质及其变化
氧化剂和还原剂
新人教版
特级教师优秀课件精选
教学目标
通过具体实例识别氧化剂和还原剂; 理解氧化剂、还原剂、氧化性、还原性的概念; 了解氧化还原反应在生活和生产中的重要应用。
教学重点
氧化还原反应的本质 氧化还原反应的基本概念 教学难点
氧化还原反应的本质 氧化还原反应的基本概念
(NaCl 既是氧化产 物又是还原产物)
练习
判断反应中的氧化剂、还原剂、氧化产物、还原产物。 1.
还原剂 氧化剂 还原产物 氧化产物
2.
氧化剂 还原剂
还原产物 氧化产物
氧化还原反应2
什么是氧化剂、还原剂? 什么是氧化产物、还原产物? 如何从一个反应中判别氧化剂、还原剂、氧化产物、还原产物?
氧化性和还原性的概念
课本练习 C
A. B. C. D.
课本练习
D A. B. C. D.
课本练习
课本练习
课本练习
课本练习 还原性
课本练习
C S、KNO3
课本练习
课本练习
2C
Zn
3
C
课本练习 B
A. B. C. D.
课本练习 14.在西汉刘安组织偏授的《淮南万毕术》中,有“曾青得铁则化为 铜”的记载。这说明早在西汉时期,我国劳动人民就已经发现铁能从 某些含铜( +2价)化合物的溶液中置换出铜,这个反应是现 代湿法冶金的基础。下列关于该反应的说法中, 不正确的是(D )。. A.该反应说明铁的金属活动性比铜的强 B.该反应的离子方程式为: C.该反应属于氧化还原反应。反应中铁被氧化 D.该反应说明金居单所都维与盐发生反应
氧化剂和还原剂课件高一化学人教版(2019)必修第一册

16HCl(稀)+2KMnO4===2KCl+2MnCl2+8H2O+5Cl2↑ 氧化性:KMnO4>MnO2。 判断还原剂的还原性的原理类似。
4.根据氧化产物的价态高低判断 当变价的还原剂在相似的条件下作用于不同的氧化剂时,可由氧化产物元素价态 的高低来判断氧化剂氧化性的强弱。即在相同条件下,使还原剂价态升得越高, 则氧化剂的氧化性越强。 例如:2Fe+3Cl2==△=== 2FeCl3 Fe+S==△=== FeS 氧化性:Cl2>S。 判断还原剂的还原性的原理类似。
其中:Fe2+、SO2 主要表现_还__原__性,H2O2 主要表现_氧__化___性。
【典例1】氢气还原氧化铜:CuO+H2==△=== Cu+H2O,在该反应中( )
A.Cu作还原剂 B.铜元素化合价降低,Cu作氧化剂 C.CuO作氧化剂 D.氢元素化合价升高,H2O是还原产物
【解题指南】(1)标出化学方程式中各元素的化合价。 (2)明确氧化剂和还原剂的概念。
氧化性、还原性强弱的判断 1.根据氧化还原反应方程式比较
2.根据元素的活动性顺序 规律巧记:上左下右可反应,隔之愈远愈易行。
3.根据反应条件判断 当不同氧化剂作用于同一还原剂时,如氧化产物价态相同,可根据反应条件的难 易来进行判断。反应越易进行或越剧烈,则氧化剂的氧化性越强。例如: 4HCl(浓)+MnO2==△=== MnCl2+2H2O+Cl2↑
反应前后,铜元素的化合价由+2价变为0价,所以铜元素的化合价降 低,CuO作氧化剂,Cu为还原产物,A、B错误、C正确;反应前后,氢元素化 合价升高,被氧化发生氧化反应,H2O是氧化产物,D错误。 答案:C
氧化还原反应概念间的关系
【典例2】[情境素材]“84”消毒液的主要成分为次氯酸钠(NaClO),可以作为医院 病房或器具的一种有效杀菌剂。判断司机是否酒后驾车,用的是K2Cr2O7,它是 一种橙红色化合物,当它在酸性条件下生成三价铬时,颜色变为绿色。让司机对 填充了吸附有酸化的K2Cr2O7的硅胶颗粒的装置吹气,若发现硅胶变色达到一定 程度即可证明司机是酒后驾车。
4.根据氧化产物的价态高低判断 当变价的还原剂在相似的条件下作用于不同的氧化剂时,可由氧化产物元素价态 的高低来判断氧化剂氧化性的强弱。即在相同条件下,使还原剂价态升得越高, 则氧化剂的氧化性越强。 例如:2Fe+3Cl2==△=== 2FeCl3 Fe+S==△=== FeS 氧化性:Cl2>S。 判断还原剂的还原性的原理类似。
其中:Fe2+、SO2 主要表现_还__原__性,H2O2 主要表现_氧__化___性。
【典例1】氢气还原氧化铜:CuO+H2==△=== Cu+H2O,在该反应中( )
A.Cu作还原剂 B.铜元素化合价降低,Cu作氧化剂 C.CuO作氧化剂 D.氢元素化合价升高,H2O是还原产物
【解题指南】(1)标出化学方程式中各元素的化合价。 (2)明确氧化剂和还原剂的概念。
氧化性、还原性强弱的判断 1.根据氧化还原反应方程式比较
2.根据元素的活动性顺序 规律巧记:上左下右可反应,隔之愈远愈易行。
3.根据反应条件判断 当不同氧化剂作用于同一还原剂时,如氧化产物价态相同,可根据反应条件的难 易来进行判断。反应越易进行或越剧烈,则氧化剂的氧化性越强。例如: 4HCl(浓)+MnO2==△=== MnCl2+2H2O+Cl2↑
反应前后,铜元素的化合价由+2价变为0价,所以铜元素的化合价降 低,CuO作氧化剂,Cu为还原产物,A、B错误、C正确;反应前后,氢元素化 合价升高,被氧化发生氧化反应,H2O是氧化产物,D错误。 答案:C
氧化还原反应概念间的关系
【典例2】[情境素材]“84”消毒液的主要成分为次氯酸钠(NaClO),可以作为医院 病房或器具的一种有效杀菌剂。判断司机是否酒后驾车,用的是K2Cr2O7,它是 一种橙红色化合物,当它在酸性条件下生成三价铬时,颜色变为绿色。让司机对 填充了吸附有酸化的K2Cr2O7的硅胶颗粒的装置吹气,若发现硅胶变色达到一定 程度即可证明司机是酒后驾车。
氧化剂与还原剂ppt课件

14
意味着什 么变化呢?
1.下列反应中,SO2被还原的是( C ) A.SO2 + 2NaOH = Na2SO3+H2O B. SO2+Cl2+2H2O = H2SO4+2HCl C.SO2+2H2S = 3S ↓+2H2O D.SO2+NO2 = SO3+NO
精选编辑ppt
15
2. 某元素在反应中由化合物存在形式变成单 质的存在形式,则该元素( B )
3.元素处于中间价态,则既有氧化性又有还原性
精选编辑ppt
12
关于“双线桥”:
①表示元素化合价的变化过程。 ②表示变价过程中的反应过程。 ③表示变价过程中的电子转移情况。
化合价升高,失2×e- , 被氧化(H2是还原剂)
+2
CuO
+
0
H2
=△
0
Cu
+
+1
H2O
化合价降低,得2e- ,被还原(CuO是氧化剂)
A、被氧化 B、可能被氧化也可能被还原
C、被还原 D、由高价态变成0价
3. “服用维生素C可防食物中的Fe2+变成Fe3+”,
这句话说明维生素C在这一反应中作(
)
剂,还具原有( )性。还原
精选编辑ppt
16
精选编辑ppt
17
此课件下载可自行编辑修改,供参考! 感谢您的支持,我们努力做得更好!
精选编辑ppt
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
从左到右,单质的还原性逐渐减弱;对应的阳 离子的氧化性逐渐曾强。
(3) 根据元素的化合价来判断:
化学新教材人教版高中化学必修第一册1.3.2 氧化剂和还原剂课件(1)

A.O2>I2>S
B. O2>S>I2
C.I2>O2>S
D.S>I2>O2
(A )
同学们学习过金属的置换反应:金属活动性较强的金 属可以将金属活动性较差的金属从其盐溶液中置换出来。 请同学们互相讨论,用氧化还原的理论解释如上的结论。
这里金属活动性可以认为代表金属还原性,只有活动 性强的金属置换活动性差的金属,才能保证反应中,还原 剂的还原性强于还原产物。
F还e+Cu氧SO4= C还u+Fe氧SO4
原化 原化 剂剂 产产
物物
氧化性:CuSO4>FeSO4 还原性:Fe>Cu
练习 根据下列反应,判断氧化性强弱正确的是
(1)2H2S+O2===2S↓+2H2O O2>S
(2)4NaI+O2+2H2O===4NaOH+2I2 O2>I2
(3)Na2S+I2===2NaI+S↓ I2>S
得到2×e-,化合价降低,被还原
单对线下桥面分的析反:应进行双线桥分析:
2e-
2Na + Cl2 2NaCl
2e-
2Na + Cl2 2Na+ 2Cl-
2NaCl
反应中,Na失去的 电子给了Cl,Cl得到 的电子来自于Na, 所以说,反应中电子 从Na转移到了Cl中。
2e-
科 2Na + Cl2 2NaCl
氧化还原反应是一类重要的 化学反应类型,广泛存在于日 常的生产生活中。
有的反应是有益于人类活动的
金属的冶炼
电镀
燃料的燃烧 光合作用
氧化还原反应是一类重要的化 学反应类型,广泛存在于日常 的生产生活中。
有的反应是有益于人类活动的 有的反应对人类活动是有害的
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
-
-
答案:C 名师点睛:依据化学方程式判断物质氧化性、还原性的 强弱关键是找对反应中的氧化剂、还原剂、氧化产物、还原 产物。氧化性比较:氧化剂>氧化产物>还原产物>还原剂; 还原性比较:还原剂>还原产物>氧化产物>氧化剂。
变式应用 2.已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+
Sn2++2Fe3+
0
+3
Cl2得到电子,Cl2是氧化剂,Cl被还原,Cl2发生还原反应,
FeCl3是还原产物。 答案:Cl2 Fe FeCl3 FeCl3 Fe Cl2
二、氧化性、还原性的强弱比较 已知反应①2 BrO- 3 +Cl2
- Br2+2 ClO3 - ③ ClO3 +5Cl-+
②5Cl2+I2+6H2O
解析: O 物;
+5
-2
―→O
0
,KClO3失去电子,KClO3是
还原剂,O被氧化,KClO3发生氧化反应,O2是氧化产
C l―→ C l ,KClO3得到电子,KClO3是氧化剂,
答案:KClO3 KClO3 O2 KCl KClO3 KClO3
-1
Cl被还原,KClO3发生还原反应,KCl是还原产物。
第一类
活泼的 金属单质
Na、Zn、Fe 等 KI Na2S FeSO4 CO SO2 Na2SO3 H2 C 等
第二类 较低价态元素的 氧化物和盐
第三类 非金属单质
自主预习
一 二 知识精要
合作探究
典题例解
触类旁通
迁移应用
二、物质氧化性、还原性强弱的比较方法 (1)根据氧化还原反应方程式比较。
氧化性:氧化剂>氧化产物
△ 2Na S+Na SO +3H O反应 2.在3S+6NaOH ===== 2 2 3 2 △
中,被氧化的元素是____,被还原的元素是__,氧化产物 是________,还原产物是________,氧化剂与还原剂的质 量比是______。 答案:1.HNO3 2.S S Na2SO3 C Na2S 1∶2
Fe3++Ce3+
2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性
由强到弱的顺序是( ) B.Sn2+、Ce3+、Fe2+ D.Fe2+、Sn2+、Ce3+
A.Sn2+、Fe2+、Ce3+ C.Ce3+、Fe2+、Sn2+
解析:氧化还原反应Ce4++Fe2+
Fe3++Ce3+中,
名师点睛:化合价的变化是指元素,得失电子的物质 是指反应物,氧化剂和还原剂是指反应物,氧化产物和还 原产物是指生成物,氧化反应和还原反应是指反应物。
变式应用 1.分析下列氧化还原反应并按要求填空。 2Fe+3Cl2
点燃 =====
2FeCl3
氧化剂:________,还原剂:________,氧化产物: ________,还原产物:________,发生氧化反应的是 ________,发生还原反应的是________。 解析:(1) Fe―→ F e ,Fe失去电子,Fe是还原剂,Fe -1 0 被氧化,Fe发生氧化反应,FeCl3是氧化产物 ; Cl―→ C l ,
(3)氧化产物和还原产物ห้องสมุดไป่ตู้① 氧化产物:还原剂被氧化生成的物质 ②还原产物: 氧化剂被还原生成的物质
化合价降低、得电子、被还原,生成还原产物
化合价升高、失电子、被氧化,生成氧化产物产物
口诀:升失氧氧,降得还还
一、氧化还原反应各概念之间的关系及其应用
1.氧化还原反应中各概念间的关系
尝试应用 1.在C+4HNO3(浓) ===== CO2↑+4NO2↑+2H2O反应 中,氧化剂是________,还原剂是__。
以强制弱!
还原性:还原剂>还原产物
(2).根据物质活动性顺序表判断 应用:例如根据金属活动性顺序表判断 单质还原性逐渐减弱
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+ H+ Cu2+ Hg2+ Ag+
氧化剂为Ce4+,还原剂为Fe2+,氧化产物为Fe3+,还原产物 为Ce3+;氧化还原反应Sn2++2Fe3+ 2Fe2++Sn4+中,氧
化剂为Fe3+,还原剂为Sn2+,氧化产物为Sn4+,还原产物为 Fe2+。根据氧化性:氧化剂>氧化产物,还原性:还原剂
>还原产物,可得微粒氧化性顺序为Ce4+>Fe3+>Sn4+,
6H+ 的是( )
2HIO3+10HCl
3Cl2+3H2O,下列物质氧化能力强弱顺序正确
- 解析:反应①中 BrO- 为氧化剂, ClO 3 为氧化产物,氧 3
化剂氧化性强于氧化产物,所以氧化性 BrO3>ClO3 ;②中
- Cl2为氧化剂,HIO3为氧化产物,氧化性Cl2>IO- ;③中 ClO 3 3 - 为氧化剂,Cl2为氧化产物,氧化性ClO3 >Cl2,综上氧化 - - 性:BrO- > > Cl > ClO IO 3 3 2 3 。
氧化剂
还原剂
还原产物
氧化产物
二、氧化剂和还原剂
1.氧化还原反应的有关概念 (1)定义
①氧化剂:在反应中得到电子;所含元素的化合价降低的物质。
②还原剂:在反应中失去电子;所含元素的化合价升高的物质。
(2).氧化性、还原性 ①氧化性:氧化剂在反应中表现出 得 电子的性质。 ②还原性:还原剂在反应中表现出 失 电子的性质
还原性顺序为Sn2+>Fe2+>Ce3+。 答案:A
水平测试 1.下列反应中水既不作氧化剂,又不作还原剂的氧 化还原反应是( ) A.Cl2+H2O HCl+HClO
B.CaO+H2O
C.2Na+2H2O D.C+H2O
Ca(OH)2
2NaOH+H2↑ CO+H2
解析:有化合价变化的A、C、D属于氧化还原反 应,H2O中氢、氧元素无化合价变化的是A。C、D中 H2O作氧化剂。 答案:A
练习:练习册P41:例1
3、常见的氧化剂和还原剂
(1)常 见 的 氧 化 剂
第一类
活泼的 非金属单质
Cl2 HNO3
O2 H2SO4(浓)
较高价态元素的 第二类 含氧酸
较高价态元素的 KMnO 4 第三类 盐
其它
FeCl3 KClO3
MnO2 等
HClO Na2O2 H2O2
(2)常 见 的 还 原 剂
化学物质及其变化
第三节 第2课时
氧化还原反应 氧化剂和还原剂
1.理解氧化剂和还原剂的概念。 2.理解氧化性、还原性与得失电子及化合价变 化的关系。
【温故· 求新】
化合价升高 失去电子 发生氧化反应(被氧化) +2 0 0 +1
CuO + H2 = Cu + H2O
化合价降低 得到电子 发生还原反应(被还原)
能力提升
7.(2011年武汉高一检测)已知下列几个反应的化学方程式:
①2KI+Cl2 === 2KCl+I2
②2FeCl2+Cl2 === 2FeCl3 ③2FeCl3+2HI === 2FeCl2+I2+2HCl ④I2+SO2+2H2O === H2SO4+2HI 下列有关物质的氧化性的强弱排列顺序中正确的是( )
阳离子氧化性逐渐增强
3.根据产物的价态判断
4.根据反应的难易判断
尝试应用 3.下列物质中,按只有氧化性、只有还原性、既
有氧化性又有还原性的顺序排列的一组是( A )
A.F2、K、HCl B.Cl2、Al、H2
C.NO2、Na、Br2
D.O2、SO2、H2O
一、氧化剂与还原剂及其对应产物
MnO2 在2KClO3 ――→ 2KCl+3O2↑反应中,氧化 △ 剂:________,还原剂:________;氧化产物: ________;还原产物:________,发生氧化反应的是 ________,发生还原反应的是________。
A.Cl2>Fe3+>I2>SO2
B.Cl2>I2>Fe3+>SO2 C.Cl2>Fe3+>SO2>I2 D.Fe3+>I2>Cl2>SO2
解析:氧化性:由①知Cl2>I2,由②知Cl2> Fe3+,由③知,Fe3+>I2,由④知,I2>SO2(因I2 作氧化剂,SO2作还原剂)。
答案:A
