032-多组分系统热力学C
大学物理化学 第三章 多组分系统热力学习指导及习题解答

RT Vm p A Bp
积分区间为 0 到 p,
RT
p
d ln
f=
(p RT
A Bp)dp
0
0p
RT p d ln( f )= (p A Bp)dp Ap 1 Bp2
0
p0
2
因为
lim ln( f ) 0 p0 p
则有
RT ln( f )=Ap 1 Bp2
为两相中物质的量浓度,K 为分配系数。
萃取量
W萃取
=W
1
KV1 KV2 V2
n
二、 疑难解析
1. 证明在很稀的稀溶液中,物质的量分数 xB 、质量摩尔浓度 mB 、物质的量浓度 cB 、质量分数 wB
之间的关系: xB
mBM A
MA
cB
MA MB
wB 。
证明:
xB
nA
nB nB
nB nA
)pdT
-S
l A,m
dT
RT xA
dxA
-S(mg A)dT
-
RT xA
dxA =
S(mg A)-S
l A,m
dT
Δvap Hm (A) T
dT
-
xA 1
dxA = xA
Tb Tb*
Δvap Hm (A) R
dT T2
若温度变化不大, ΔvapHm 可视为常数
- ln
xA =
Δvap Hm (A) R
真实溶液中溶剂的化学势 μA μ*A(T, p) RT ln γx xA =μ*A(T, p) RT ln aA,x
真实溶液中溶质 B μB μB* (T, p) RT ln γx xB =μ*A(T, p) RT ln aB,x
物理化学:第4章_多组分系统热力学_
真实混合物:实曲线
Vm xBVB xCVC VB (VC VB)xC
当混合物组成改变时,两组 分偏摩尔体积随之改变,且二者 变化相互关联。
组成接近某纯组分,其偏摩 尔体积也接近该纯组分摩尔体积。
5. 吉布斯 − 杜亥姆方程
对广度量 X (T , p, nB, nC , nD ,) 求全微分:
dX
X T
p,nB
dT
X p
T ,nB
dp
B
X nB
dnB T , p,nC
恒温、恒压
另一方面,由加和公式
,恒温恒压下求导:
比较两式,得
或
或
吉布斯-杜亥姆方程--在一定温度压力下,当混合物
组成变化时,各组分偏摩尔量变化的相互依赖关系。
➢ 系统中各组分的偏摩尔量并非完全独立,而是相 互依存的。
➢ 例:固体溶解、过饱和溶液析出、…
组分B在α、β两相中迁移达平衡的条件:该组分
在两相中的化学势相等。
➢ 物质总是从其化学势高的相向化学势低的相迁移, 直至物质迁移达平衡时为止,此时系统中每个组分在 其所处的相中的化学势相等。
化学势 判据
② 化学平衡
<0:自发不可逆; =0:平衡、可逆
任一化学反应,假定系统已处于相平衡,
任一组分B在每个相中的化学势都相等: Bα B
B
B
整个系统中B组分物质的量的变化量: dnBα dnB
α
BdnB
B
化学平衡时
平衡条件:与化学反应达到平衡的方式无关。
§4.3 气体组分的化学势
1、纯理想气体的化学势 2、理想气体混合物中任一组分的化学势 3、纯真实气体的化学势 4、真实气体混合物中任一组分的化学势
多组分系统热力学

第三章 多组分系统热力学§ 引言基本概念 1、多组分系统两种或两种以上的物质(或称为组分)所形成的系统称为多组分系统。
多组分系统可以是均相的,也可以是多相的。
它(如:多组分单相系统)的热力学性质,则不仅由系统的温度、压力所决定,还与系统的相的组成有关。
2、混合物(mixture )多组分均匀系统中,各组分均可选用相同的方法处理,有相同的标准态,遵守相同的经验定律,这种系统称为混合物。
混合物有气相、液相和固相之分。
3、溶液(solution )含有一种以上组分的液体相或固体相称之为溶液。
溶液有液态溶液和固态溶液之分,但没有气态溶液。
4、溶剂(solvent )和溶质(solute )如果组成溶液的物质有不同的状态,通常将液态物质称为溶剂,气态或固态物质称为溶质。
如果都具有相同状态,则把含量多的一种称为溶剂,含量少的称为溶质。
溶剂和溶质要用不同方法处理,他们的标准态、化学势的表示式不同,服从不同的经验定律。
溶质有电解质和非电解质之分,本章主要讨论非电介质所形成的溶液。
如果在溶液中含溶质很少,这种溶液称为稀溶液,常用符号“∞”表示。
多种气体混合在一起,因混合非常均匀,称为气态混合物,而不作为气态溶液处理。
多组分系统的组成表示法 1、B 的质量浓度B def(B)m Vρ 即用B 的质量m B 除以混合物的体积V 。
B ρ的单位是: kg ·m —3。
2、B 的质量分数BAAdef(B)m w m ∑ 即B 的质量m B 与混合物的质量之比。
w B 的单位为1。
3、B 的浓度B Bdefn c V即B 的物质的量与混合物体积V 的比值。
c B 常用单位是mol ·L —1。
4、B 的摩尔分数B BAAdefn x n ∑ B 的物质的量与混合物总的物质的量之比称为溶质B 的摩尔分数,又称为物质的量分数。
摩尔分数的单位为1。
气态混合物中摩尔分数常用y B 表示。
多组分系统

例如:一个封闭容器中,装有一定数量的乙醇水
溶液,上方为蒸气,整个容器是一个封闭系统, 若分别选取液相或气相作为系统,由于两相之间 有物质交换,所以液相或气相都是敞开系统。
(2)多组分系统的广度性质,一般说来不 多组分系统的广度性质, 再具有简单的加和性, 再具有简单的加和性,即并不等于各组分 在纯态时该广度性质之和。 在纯态时该广度性质之和。
19
在等温等容且定组成的条件下
µ
B
∂A = ( )T ∂nB
,V , n ( C ' , C ' ≠ B )
三 个 偏 导 数 都 叫 化 学 势
20
在等熵等压且定组成的条件下
µB
∂H = ( ) S , P , n ( C ' ,C ' ≠ B ) ∂nB
在等熵等容且定组成的条件下
∂U µB = ( ) S ,V , n ( C ' ,C ' ≠ B ) ∂n B
>自发 =平衡
相平衡判据
22
它表明,在等温等压且没有非体积功的条件下, 它表明,在等温等压且没有非体积功的条件下, 则组分B将自动由α 若 α β ,则组分B将自动由α相转移
µB > µB µB = µB
α
到 β相 。 则组分B 则组分B在α和β两相中达 平衡。 平衡。
若
β
纯物质B*达成两相平衡的条件是: 纯物质 达成两相平衡的条件是: 达成两相平衡的条件是
Z = f (T , P, nB , nC ......)
12
若系统的状态发生任意一个微小变化,即T,P,nB,nC,诸 变量任意独立改变无限小量时,则Z也会有相应的微 小变化,其全微分为:
∂Z ∂Z dZ = ( ) P ,n ( B ) dT + ( )T ,n ( B ) dP ∂P ∂T ∂Z +( )T , P ,n ( C ,C ≠ B ) + ...... ∂nB
《多组分系统热力学》课件

02
03
气候变化
多组分系统热力学可用于研究温室气 体在大气中的分布和变化,为气候变 化研究提供数据支持。
在生物学中的应用
生物代谢过程
多组分系统热力学可用于研 究生物体内的代谢过程,分 析代谢产物的生成和能量转
换效率。
生物分子相互作用
利用多组分系统热力学模型 ,可以研究生物分子之间的 相互作用和结合机制,为药 物设计和生物工程提供理论
依据。
生物系统稳定性
通过多组分系统热力学模型 ,可以分析生物系统的稳定 性和动态变化,为生物保护 和生态平衡提供理论支持。
THANK YOU
感谢聆听
相变过程
相变的概念
物质在一定条件下,从一种相转变为另一种相的过程 。
相变的热力学条件
相变过程总是向着熵增加的方向进行,同时满足热力 学第一定律和第二定律。
相变过程的分类
根据相变过程中物质状态的变化,可以分为凝聚态物 质相变和气态物质相变等。
化学反应过程
化学反应的概念
化学反应是指分子破裂成原子,原子 重新排列组合生成新分子的过程。
化学势具有加和性,即对于多组分 系统中的某一组分,其化学势等于 其他组分的化学势之和。
相平衡和化学平衡
相平衡是指多组分系统中各相之间的平衡状态,是 热力学的基本概念之一。
化学平衡是指多组分系统中化学反应达到平衡状态 时的状态,是热力学的基本概念之一。
相平衡和化学平衡是相互关联的,可以通过化学势 来判断是否达到相平衡或化学平衡状态。
04
多组分系统的热力学过程
热力学过程
热力学第一定律
能量守恒定律,即在一个封闭系统中,能量不能被 创造或消灭,只能从一种形式转化为另一种形式。
物化第四章 多组分系统热力学

BdnB0
自 发 =平衡
B
(dT0, dp0, W0)
BdnB0(化学势平 ) 衡
2021/7/9
B
3. 化学势判据及其应用举例
假设系统由和两相构成,有dn()的物质B由相转移 至相,整个体系吉布斯自由能的改变:
dG=dG( ) +dG()
当恒温恒压,W’=0
β相
d G ()()d n () d G ()()d n ()
1.偏摩尔量
XB
X nB
T,p,nC
2.吉布斯–杜亥姆方程 nBdXB0 xBdXB 0
B
B
二元系统 x A d X A x B d X B 0
3. 化学势
B
G nB
T, p,nC
30
4.单相多组分系统热力学基本方程
d G S d T V d p B d n B
B
d A S d T p d V B d n B
BdefGB nGBT,p,nC
化学势的狭义定义就是偏摩尔Gibbs自由能 化学势与势能类似,能反映出反应的方向性和限度
18
G G ( T ,p ,n B ,n C ,, n K )
dG G Tp,nBdT G pT,nBdpBn G BT,p,nCdnB G Tp,nBdT G pT,nBdpBGBdnB
y B = 1 *( p) g ( g)Rl Tpn/p( )
B (p g ) B * ( T ,p ) R T ln y B
B*(T, p)是纯气体B在指定T,p时的化学势。
2021/7/9
3.纯真实气体的化学势
pg, p
1mol,
Gm
θ(g)
g, p 1mol,
多组分系统热力学

多组分系统热力学
多组分系统热力学是研究多个组分构成的系统的热力学行为的科学。
在多组分系统中,各个组分之间可能会相互作用,从而影响整个系统的热力学性质。
多组分系统热力学的研究内容包括:
1.热力学第一定律:能量守恒定律,即在一个封闭系统中,能量不
能被创造或消除,只能从一种形式转化为另一种形式。
2.热力学第二定律:熵增定律,即在一个封闭系统中,熵(即系统
的混乱程度)只能增加,不能减少。
这意味着,系统总是朝着熵增的方向演化,而不是熵减的方向。
3.相平衡:研究在给定的温度和压力下,不同物质之间是如何平衡
的。
4.化学平衡:研究在给定的温度和压力下,化学反应是如何平衡的。
5.热力学第三定律:绝对零度不能达到原理,即任何物质在绝对零
度下的熵均为零。
这些定律和原理对于理解多组分系统的热力学行为非常重要。
在化学工程、材料科学、生物工程等领域中,多组分系统热力学被广泛应用于研究复杂系统的热力学性质和行为。
物理化学第七版第三章 多组分系统热力学

B1
常见偏摩尔量如下:
VB ,m
V ( nB
)T , p,n jB
U B ,m
U ( nB
)T , p,n jB
H
H B,m
( nB
)T , p,n jB
S SB,m ( nB )T , p,njB
F FB,m ( nB )T , p,njB
G
GB,m
( nB
)T , p,n jB
注意:1、只有广度性质才有偏摩尔量,偏摩尔量是 强度性质的状态函数。
广义化学势:保持特征变量和除B以外其它组分不变 时,某热力学函数随物质的量 nB的变化率称为广义化 学势。
注意:任意热力学函数的偏摩尔量并不都是化学势, 只有偏摩尔吉布斯能才是化学势。
二、化学势与温度及压力的关系(自学)
G f (T , p, n1, n2 , ...) 组成恒定时 dG -SdT Vdp
dG SdT Vdp BdnB
恒温恒压下: dG BdnB
化学势判据:恒温恒压且不做非体积功时:
dG BdnB 0
dG BdnB 0
k
dG BdnB 0 B1
自发进行 可逆或平衡 不能进行
1、化学势在相平衡中的应用
恒温恒压下,dnB摩尔的B物质由 相转移到 相:
dG=dG+dG 相 dnB
H* m,A
(s)
RT 2
dT
ln
xA
fus
H* m,A
R
1
Tf
1 Tf*
Tf
RTf*Tf
fus
H* m,A
ln xA
K f
ln
xA
K f
ln(1
xB )
多组分系统热力学

第四章 多组分系统热力学 主要内容1.混合物和溶液(1)多组分系统的分类含一个以上组分的系统称为多组分系统。
多组分系统可以是均相(单相)的,也可以是非均相(多相)的。
将多组分均相系统区分为混合物和溶液,并以不同的方法加以研究:(Ⅰ)混合物:各组分均选用同样的标准态和方法处理;(Ⅱ)溶液:组分要区分为溶剂及溶质,对溶剂及溶质则选用不同的标准态和方法加以研究。
(2)混合物及溶液的分类混合物有气态混合物液态混合物和固态混合物;溶液亦有气态溶液液态溶液和固态溶液。
按溶液中溶质的导电性能来区分,溶液又分为电解质溶液和非电解质溶液(分子溶液)。
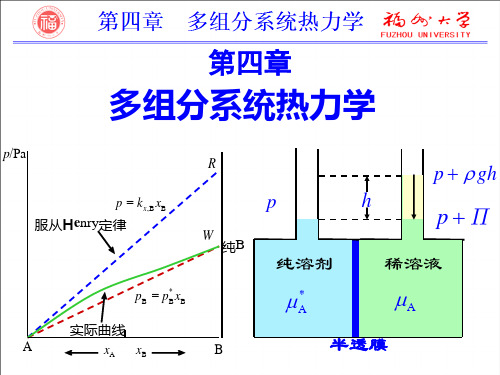
2.拉乌尔定律与亨利定律拉乌尔定律与亨利定律是稀溶液中两个重要的经验规律。
(1)拉乌尔定律平衡时,稀溶液中溶剂A 在气相中的蒸气分压A p 等于纯溶剂在同一温度下的饱和蒸气压与该溶液中溶剂的摩尔分数A x 的乘积。
这就是拉乌尔定律。
用数学式表达拉乌尔定律为 A *A Ax p p = (2)亨利定律一定温度下,微溶气体B 在溶剂A 中的溶解度B x 与该气体在气相中的分压B p 成正比。
也可表述为:一定温度下,稀溶液中挥发性溶质B 在平衡气相中的分压力B p 与该溶质B 在平衡液相中的摩尔分数B x 成正比。
这就是亨利定律。
用数学式表达亨利定律为: B B ,B x k p x =B ,x k 、B ,b k 为以不同组成标度表示的亨利系数,其单位分别为Pa ,Pa·kg·mol -1。
应用亨利定律时,要注意其不同表达式所对应的亨利系数及其单位。
还要注意亨利定律适用于稀溶液中的溶质分子同气相同种分子相平衡,即亨利定律适用于稀溶液中的溶质在液相及气相中具有相同分子形态的场合。
3.偏摩尔量(1)偏摩尔量的定义设X 代表V ,U ,H,S ,A ,G 这些广度性质,则对多组份系统(混合物或溶液)即 X =f (T ,p ,n A ,n B ,…)定义 ()B C C,,,B B def ≠⎪⎪⎭⎫ ⎝⎛∂∂n p T n X X式中,X B称为广度性质X (X=V ,U ,H ,S ,A ,G 等)的偏摩尔量,它们分别为只有系统的广延量才具有偏摩尔量,偏摩尔量是强度量。
第三章_多组分系统热力学讲义

上一内容
下一内容
回主目录
返回
2017/10/30
3.0 引言
2.质量摩尔浓度mB(molality)
mB
def
nB mA
溶质B的物质的量与溶剂A的质量之比称为 溶质B的质量摩尔浓度,单位是 mol kg -1 。这个 表示方法的优点是可以用准确的称重法来配制溶 液,不受温度影响,电化学中用的很多。
135ml乙醇+65ml乙醇=200ml; 100ml乙醇+100ml乙醇=200ml; 150ml水+50ml乙醇<200ml; 135ml水+65ml乙醇<200ml; 100ml水+100ml乙醇<200ml;
20%乙醇水溶夜100ml+20%乙醇水溶夜100ml=200ml.
上一内容 下一内容 回主目录
上一内容
下一内容
回主目录
返回
2017/10/30
3.0 引言
3.物质的量浓度cB(molarity)
cB
def
nB V
溶质B的物质的量与溶液体积V的比值称为溶 质B的物质的量浓度,或称为溶质B的浓度,单位 是 mol m 3 ,但常用单位是 mol dm 3 。
上一内容
下一内容
3.0 引言
混合物(mixture) 多组分均匀体系中,溶剂和溶质不加区分,各 组分均可选用相同的标准态,使用相同的经验定律, 这种体系称为混合物,也可分为气态混合物、液态 混合物和固态混合物。
上一内容
下一内容
回主目录
返回
2017/10/30
3.0 引言
在液态的非电解质溶液中,溶质B的浓度表 示法主要有如下四种:
多组分体系热力学.ppt

常用的偏摩尔量:
XB
def
X nB
T , p,nC
U nBUB B
H nB HB B
A nB AB B
S nB SB B
G nBGB B
U
UB
( nB
)T , p,nC (CB )
偏摩尔热力学能
H
HB
( nB
)T ,
p,nC (CB)
A
AB
( nB
)T , p,nC (CB )
dp
B
nB
T , p,nC
dnB
偏摩尔量
X B def
X nB
T , p,nC
X
X
dX
T
p,nB
dT
p
T ,nB
dp
B
X BdnB
2、偏摩尔量的物理含义:
X B def
X nB
T , p,nC
偏摩尔量XB是在恒温、恒压及除组分B以外其余各 组分的物质的量均保持不变的条件下,系统广度量X随 组分B的物质的量的变化率
四、同一组分的各种偏摩尔量之间的关系 对单组分系统有:
H=U+pV A=U-TS G=H-TS
G S T p
对多组分系统有:
G p
T
V
HB=UB+pVB AB=UB-TSB GB=HB-TSB
GB T
p
SB
GB p
T
VB
§4.2 化学势
定义:
B
GB
( G nB
)T , p,nC (CB)
3、偏摩尔量的加和公式
X nB X B
B
多组分系统的广度量X为系统各组分的物质的量与其偏摩尔量 XB乘积的加和。
第三章 多组分系统热力学

各组分的物质的量不变的条件下,若增加 dnB 的 B 物质,
等于B。
• 化学势也是一种偏摩尔量, 因G的偏摩尔量在化学
中特别重要,故人们特意定义它为化学势。
二、多组分均相系统的热力学基本方程
• Problem: bB与xB之间存在什么关系?
3· 2 偏摩尔量 一、 多组分系统的广延性质
• 系统中存在一种以上组分或物质时,统称为多组 分系统; • 多组分系统中,质量及物质的量等于各个组分之 和; • 多组分系统的广延性质 (容量性质 )并不一定是体 系中各组分相应性质的简单加合。
×
A B
• 溶质B的物质的量浓度cB的定义为:
cB=nB/V (2)
• (2)式中: V是溶液体系的体积, 单位常用L或m3表示.
• 物质的量浓度 cB 的物理含义是 : 在单位体积 (如 1L) 中所 含溶质B的摩尔数. 其单位是: mol.L-1或mol.m-3.
• 3. 质量摩尔浓度bB(或mB)
• 质量摩尔浓度的定义为: bB=nB/mA (3) • (3)式中, mA是溶剂A的质量, 其单位可取kg等. • bB的物理含义是 : 单位质量 (1kg) 溶剂中所溶解的溶质 B 的数量. 质量摩尔浓度的单位常取: mol.kg-1.
dX X 1,m dn1 X 2,m dn2
X k ,m dnk X B ,m dnB
B 1
k
• 定义:
X B ,m
X ( ) T , p ,nC ( C B ) n B
XB,m:物质B的某种容量性质X的偏摩尔量
物理化学04多组分系统热力学

dG=dG( ) +dG()
当恒温恒压,W’=0 时
β相
dG() ()dn()
dG( ) ( )dn( )
dn( ) dn()
dX
X T
p,nB ,nc ,nD
X
dT
p
T ,nB ,nc ,nD
X
dp
nB
T , p,nc ,nD
dnB
X
X
nC
T , p,nB p,nB ,nc
dnD
2021/1/6
偏摩尔量XB的定义为: X B def
X ( nB )T , p,nc
2021/1/6
解:取1kg溶液
nH2O
mH2O M H2O
(1 0.12)1 18.015 103
mol
48.85mol
nAgNO3
mAgNO3 M AgNO3
0.12 1 169.89 103
mol
0.7064mol
xAgNO3
nAgNO3
n n AgNO3
H2O
0.01425
cAgNO3
2021/1/6
由题意:
VA 17.35cm3 / mol
VB 39.01cm3 / mol
由集合公式,混合后:
V nAVA nBVB {0.617.35 0.4 39.01}cm3 26.01cm3
混合前:
VA '
nAM A A
10.84cm3
VB'
nB M B B
16.19cm3
dA SdT pdV BdnB
dA
B
BdnB 0
自发 =平衡
B
(dT 0,dV 0, W ' 0)
物理化学:第三章 多组分系统

dU TdS - pdV BdnB
B
B
U nB
S ,V ,nj B
二、广义化学势和热力学基本公式
同样的方法,按H=f(S,p,n1,n2……),F=f(T,V,n1,n2……) 及H、F的定义进行处理,可得化学势的另一些表示式:
B
U nB
S ,V ,nj B
H nB
S , p ,nj B
二广义化学势和热力学基本公式对于组成可变的系统四个热力学基本公式为???bbbddddnvpstu??bbbddddnpvsth????bbbddddnvptsf???bbbddddnpvtsg三温度压力对化学势的影响bbbbb????????????????????????????????????????????????????????????????????????????????????????????????????jiijinptntntnptntpgnngppvpgt????????????????????代入上式得压力对化学势的影响
(与等温、等压下某均相体系任一容量性质的全微分比较)
得 dX = n1dX1,m n2dX2,m … nidXi,m=0
吉布斯—杜亥姆公式
nBdXB,m =0
B
当一个组分的偏摩尔量增加时,另一个组分的偏摩尔量必将
减少,其变化是以此消彼长的方式进行。偏摩尔量之间是具
有一定联系的。某一偏摩尔量的变化可从其它偏摩尔量的变化
B
三、温度、压力对化学势的影响
B
p
T ,ni
p
G nB
T
,
p
,n
j
B
T
,ni
nB
G p
T ,ni T , p ,nj B
多组分热力学复习题答案

多组分热力学复习题答案多组分热力学复习题答案热力学是研究物质能量转化和宏观性质变化的学科,而多组分热力学则是研究多种组分混合体系的能量转化和性质变化。
在多组分热力学中,我们需要掌握各种物质的性质、相互作用以及它们在不同条件下的行为。
下面,我将为大家提供一些多组分热力学复习题的答案,希望能够帮助大家更好地理解和应用多组分热力学知识。
1. 什么是理想混合物?如何计算理想混合物的混合焓和混合熵?理想混合物是指在混合过程中没有相互作用的组分之间的混合物。
对于理想混合物,混合焓和混合熵可以通过以下公式计算:混合焓= ∑(x_i * h_i)混合熵 = -R * ∑(x_i * ln(x_i))其中,x_i表示第i个组分的摩尔分数,h_i表示第i个组分的摩尔焓,R表示气体常数。
2. 什么是非理想混合物?如何计算非理想混合物的混合焓和混合熵?非理想混合物是指在混合过程中组分之间存在相互作用的混合物。
对于非理想混合物,混合焓和混合熵的计算需要考虑组分之间的相互作用。
一种常用的方法是利用活度系数来描述组分之间的相互作用。
混合焓= ∑(x_i * h_i * γ_i)混合熵 = -R * ∑(x_i * ln(x_i * γ_i))其中,γ_i表示第i个组分的活度系数。
3. 什么是理想溶液?如何计算理想溶液的混合焓和混合熵?理想溶液是指在混合过程中组分之间相互作用的影响非常小的溶液。
对于理想溶液,混合焓和混合熵可以通过以下公式计算:混合焓= ∑(x_i * h_i)混合熵 = -R * ∑(x_i * ln(x_i))其中,x_i表示第i个组分的摩尔分数,h_i表示第i个组分在纯液态下的摩尔焓,R表示气体常数。
4. 什么是非理想溶液?如何计算非理想溶液的混合焓和混合熵?非理想溶液是指在混合过程中组分之间相互作用的影响较大的溶液。
对于非理想溶液,混合焓和混合熵的计算需要考虑组分之间的相互作用。
一种常用的方法是利用活度系数来描述组分之间的相互作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
98.3 / 18 95.5 / 80 4 p 1.997 10 Pa 4.000 10 98.3 / 18 1.7/80 95.5 / 80 4.5/18
4
p 52.96kP a
yA
p* x A A
p
1.997 104 0.956 0.376 52.16
4.6
拉乌尔定律和亨利定律
拉乌尔(Raoult)定律 亨利(Henry)定律
1
溶液的气液平衡
液态混合物及溶液的气、液平衡 一般:xA≠yA, xB≠yB, xC≠yC……
p=pA+pB+pC……
分压定律: pA=yAp,pB=yBp, pC=yCp……
2
溶液的气液平衡
A solution and a pure solvent in a closed environment (a) initial stage. (b) after a period of time, the solvent is completely transferred to the solution
溶剂蒸气压下降的相对值决定于溶质的浓 度或数量,与其本性无关。
Raoult定律适用范围:
(1) 无限稀溶液中的溶剂,且其蒸气服从理想气体 状态方程,无论溶质挥发与否。
(2) 如果两种分子大小和结构越相近,则适用浓度 范围越宽。
5
拉乌尔(Raoult)定律
p
* B
p
* pB pB xB
p
* A
p A p* A xA
α β
pB pB xB
β * β
算出 可求
xB
pB
可求 p .
气相组成 yB 可求.
β
β
根据 p pA pB 根据
pB yB p
答案
p 52.96kPa
yA 0.376
26
yB 0.624
解题过程 解:理想稀溶液,溶剂符合拉乌尔定律。
* * p pA xA pB xB
Henry常数可看作是虚拟的(具有无限稀释溶液性 质)单位浓度的溶液中溶质的蒸气压。
11
亨利(Henry)定律
适用范围
(1)稀溶液中的挥发性溶质;
(2)若上方是混合气体,定律中对应的是B的分压;
(3)溶质在气液两相中的分子形态相同; 例1:HCl溶解于苯中形成的稀溶液; HCl溶解于水 。 例2:同核双原子分子气体:O2、N2、H2、…
若两层均可看成理想稀溶液, 求此混合系统的气相 总压及气相组成。 已知在60℃,pA = 19.97kPa,pB = 40.0kPa,有机 物的摩尔质量为 80g· mol-1。
24
分 析
根据平衡条件
α A β A
g A
α B β B
g B
p pA pB
9
亨利(Henry)定律
图形表示
10
亨利(Henry)定律
Henry定律的不同形式
pB=K Hx ,B xB K Hc ,BcB KHb , BbB ...
Henry常数 : K Hc , B , K Hx , B , K Hb , B, ... 其数值与温度、压力、 溶剂、 溶质的性质及浓度的表 示有关, 单位不同。
0
xB
6
1
定律的微观解释
不同溶剂蒸气压的大小由液体分子间相互作用力决定 实际上只有溶液很稀时才能遵守拉乌尔定律。
A A A A A A B A
A A A A A A A A
溶液很稀时,溶质的分子很少,溶质分子与溶 剂分子之间的作用力才能很小,以至可以忽略,只 有这样,溶剂的蒸气压才能与它本身在溶液中的分 子数成正比,而与溶质的本性无关。
* x A p* x p A; B B yA p yB p
15
理想混合物(理想溶液)
p
* pB
p p A pB
p* A
p A p* A xA
* pB pB xB
0
xB
16
1
理想混合物(理想溶液)
从分子模型上看, (1)fAA=fBB=fAB
(2)V(A分子)=V(B分子)
α p p pA 是与α相平衡的气相中A的分压, A A
pA 也是与β相平衡的气相中A的分压, pA p A
β
所以
α pA pA pβ A
同理
pB pB pB
α
β
* α * α pα p x pA 1 xB A A A
算出
xB
α
可求
25
pA
α
分
析
又
pB p B p B
7
定律的微观解释
稀溶液中的溶质
A B A A A B A
B B B
A
B B B B B
气液平衡规律还服从拉乌尔定律吗?
8
亨利(Henry)定律
1803年 亨利(Henry W) 一定温度下,微溶气体B在溶剂A 中的溶解度xB与该气体在气相中的分 压 pB 成正比。
pB=K Hx , B xB
实验表明,享利定律也适用于稀溶液中挥发性溶 质的气、液平衡(如乙醇水溶液)。
3
拉乌尔(Raoult)定律
1886年,拉乌尔(Raoult F M) 恒温下,稀溶液中溶剂A在气相中的蒸气分压 pA等于该纯溶剂的饱和蒸气压pA*与该溶液中溶剂的 摩尔分数xA的乘积。
pA p x
* A A
4
拉乌尔(Raoult)定律
p pA p x
* A
* A B
p* A pA xB * pA
各组分分子彼此相似,在混合时没有热效应和体积变化。 光学异构体、同位素和立体异构体混合物属于这种类型。 例:同位素混合物(H2O+D2O) 同分异构体(对、邻或间二甲苯) 同系物(苯+甲苯;正己烷+正庚烷) 冶金上的炉渣
17
理想稀溶液
理想稀溶液: 溶剂服从Raoult定 律,溶质服从Hen物两组分都遵守拉乌尔定律,应 用拉乌尔定律,即可求得平衡气相的蒸气总压与平 衡液相组成的关系
* * * p pA pB pA xB
(2) 开始沸腾时第一个气泡的组成,即上述溶液的
平衡气相组成,由分压定义和拉乌尔定律,即可求
* x A p* x p A; B B yA p yB p
yB 1 yA 0.624
27
作业3-5 总结刚刚讲的三道例题的解题思路即可
当xB = 0.020时,设仍可看作理想稀溶液,
p = pA + pB = pA*×(1 xB) + Kh,x × xB = 108 kPa
yB = pB /p = Kh,x × xB / p = 927 × 0.020 / 108 = 0.172
23
举 例
3
在 60℃ ,把水( A )和某有机物( B )混合形成两 个液层。一层(α) 为水中含质量分数 wB=0.017 的有机 物的水溶液; 另一层(β) 为有机物液体中含质量分数 为wA=0.045的水的有机物溶液。
溶于水:
溶于金属液:
12
4.7 理想混合物
理想混合物 (ideal mixture)(理想溶液) 理想稀溶液(ideal dilute solution)
13
理想混合物(理想溶液)
理想混合物:又称理想溶液。
在一定温度下,任意组分在全部组成范围内都 遵守Raoult定 律。
pA=p x
* A A
得平衡气相组成。
答
案
xB = 0.726
20
yA= 0.523
解题过程
解:(1) 分别以A和B代表CCl4和SnCl4,则 pA*=1.933×105Pa;pB*=0.666×105Pa
* * * p pA pB pA xB
* p pA 1.013105 Pa 1.933105 Pa xB * 0.726 * 5 5 pB pA 0.66610 Pa -1.93310 Pa
pA=p x
* A A
pB K Hx , B xB K Hc , B cB K Hb, BbB
18
举 例 1
100℃时,纯CCl4及纯SnCl4的蒸气压分别为1.933×105Pa 及 0.666×105Pa。这两种液体可组成理想液态混合物。 假定以某种配比混合成的这种液态混合物,在外压力为 1.013×105Pa的条件下,加热到100℃时开始沸腾。 计算: (1)沸腾时该液态混合物的液相组成; (2)该液态混合物开始沸腾时的第一个气泡的组成。
(2) 开始沸腾时第一个气泡的组成,即上述溶液的平衡 气相组成,设为yB,则 yB p = pB =xB pB*
* xB pB 0.726 0.666105 Pa yB 0.477 5 p 1.01310 Pa
yA=1-yB=0.523
21
举 例
2
97.11 ℃时, wB=0.030的乙醇水溶液的蒸气总压为101.3 kPa, 纯水的pA*=91.3kPa。设可看作理想稀溶液,试 求xB=0.020时的蒸气总压和气相组成。 解: 根据题意,先求亨利常数Kh,x: 首先将 w (质量百分浓度) x (物质的量分数)
wB / M B xB ( w A / M A ) ( wB / M B )
3.000/ 46 0.012 (97.00 / 18) (3.000/ 46)
22
在稀溶液中
溶剂遵守拉乌尔定律: pA = pA* × (1 xB)=91.3×0.988 Pa 溶质遵守亨利定律: pB = Kh,x ×xB = Kh,x ×0.012 p = pA+ pB = pA* × (1 xB) + Kh,x ×xB= 101.3 kPa 解得 Kh,x = 927 kPa
