[推荐学习]2019年高考化学一轮复习训练(鲁科版): 课时分层训练2 氯及其化合物 鲁科版
2019年高考化学一轮复习训练(鲁科版) 课时分层训练22 化学反应的方向、限度 鲁科版

课时分层训练(二十二) 化学反应的方向、限度(建议用时:45分钟)A级基础达标1.下列说法不正确的是( )A.焓变是一个与反应能否自发进行有关的因素,多数能自发进行的反应是放热反应B.在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大C.一个反应能否自发进行取决于该反应是放热还是吸热D.一个反应能否自发进行,与焓变和熵变的共同影响有关C[一个反应能否自发进行,与焓变和熵变的共同影响有关。
]2.(2015·天津高考,改编)下列说法不正确的是( )A.Na与H2O的反应是熵增的放热反应,该反应能自发进行B.某吸热反应能自发进行,因此该反应是熵增反应C.FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同D.2NO(g)+2CO(g)===N2(g)+2CO2(g)常温下能自发进行,说明该反应的ΔH<0C[C项,不同催化剂的催化效率不同。
]3.(2018·天水模拟)下列说法中,正确的是( )A.反应产物的总能量大于反应物的总能量时,ΔH<0B.已知反应H 2(g)+I2(g)2HI(g)平衡常数为K,则2H2(g)+2I2(g)4HI(g)的平衡常数为2KC.ΔH<0、ΔS>0的反应在温度低时不能自发进行D.在其他外界条件不变的情况下,使用催化剂,不能改变化学反应进行的方向D[ΔH=生成物能量总和-反应物能量总和,当生成物的总能量大于反应物的总能量时,ΔH>0,A错误;因为相同温度下,系数变为原来的n倍,则化学平衡常数为原来的n次方,所以反应2H 2(g)+2I2(g)4HI(g)的平衡常数为K2,B错误;根据ΔG=ΔH-TΔS判断,对于ΔH<0、ΔS>0的反应在温度低时ΔG<0,反应能自发进行,C错误;催化剂只改变反应速率,不改变化学反应进行的方向,D正确。
]4.在密闭容器中,反应X(g)+2Y(g)Z(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(X)=0.100 mol·L-1,c(Y)=0.200 mol·L-1,c(Z)=0 mol·L-1。
2019年高考化学一轮复习训练(鲁科版) 课时分层训练3 物质的量 气体摩尔体积 鲁科版

课时分层训练(三) 物质的量气体摩尔体积(建议用时:45分钟)A级基础达标1.下列几种说法中正确的是( )A.摩尔是化学上常用的一个物理量B.某物质含有6.02×1023个微粒,含有这个数目微粒的物质一定是1 molC.1 mol氢气分子可以表示为1 mol H2D.硫酸的摩尔质量为98 gC[摩尔是物质的量的单位,A项错误;B项6.02×1023个微粒是1 mol,但含有这个数目微粒的物质不一定是1 mol,如含6.02×1023个Na+的Na2CO3为0.5 mol,B项错误;D 项单位错误。
]2.下列叙述中正确的是( )①标准状况下,1 L HCl和1 L H2O的物质的量相同②标准状况下,1 g H2和14 g N2的体积相同③28 g CO的体积为22.4 L④两种物质的物质的量相同,则它们在标准状况下的体积也相同⑤同温同体积下,气体物质的物质的量越大,则压强越大⑥同温同压下,气体的密度与气体的相对分子质量成正比A.①②③B.②⑤⑥C.②③⑥D.④⑤⑥B[标准状况下H2O不是气体,而HCl为气体,所以虽然二者等体积,但物质的量不同,①错误;同样在④中所指的物质不一定是气体,④错误;标准状况下,1 g H2和14 g N2的物质的量均为0.5 mol,故体积相同,②正确;28 g CO的物质的量是1 mol,但条件不确定,所以体积不一定是22.4 L,③错误;同温同体积下,气体的压强与物质的量成正比,所以物质的量越大,则压强越大,⑤正确;同温同压下,气体的密度与其相对分子质量成正比,⑥正确。
]3.(2018·张家口模拟)已知14.2 g X气体在标准状况下的体积是4.48 L,则X气体的摩尔质量是( )A.71 g B.71C.71 g·mol-1D.142 g·mol-1C[M=14.2 g 4.48 L22.4 L·mol-1=71 g·mol-1。
2019届鲁教版高中化学高考第一轮专题复习综合测试卷(含答案解析版)

2019 届鲁教版高中化学高考第一轮专题复习综合测试卷一、单项选择题 (共 15 小题 )1.以下所述事实与化学 (离子 )方程式不符合的是()A .能说明盐酸是强酸 : 2HCl+CaCO 322↑+H2 ====CaCl +CO OB .能说明氧化性 H 2O2>Fe3+: 2Fe2++H2O2+2H +====2Fe 3++2H 2O+能力比 H2O 强 : NH +++H 2OC.能说明 NH3联合 H3+H 3O ====NH 4D .能说明 CH3COOH 是弱电解质 :CH 3COO -+H2 O CH3COOH+OH -2.用以下装置进行相应实验,能达到实验目的的是( )A .图 1 所示装置用于Cu 和浓 H 2SO4反响制取少许的SO2气体B .图 2 所示装置用于除掉碳酸氢钠固体中的少许碳酸钠C.图 3 所示装置用于制备并采集NO 气体D .图 4 所示装置用于分别出溴苯3.已知 Co2O3在酸性溶液中易被复原成Co2+,Co2O3、Cl 2、FeCl3、I 2的氧化性挨次减弱。
下列反响在水溶液中不行能发生的是()A . 3Cl2+6FeI2===2FeCl 3+ 4FeI3B . Cl2+ FeI2===FeCl 2+ I2C.Co2O3+ 6HCl===2CoCl2+Cl 2↑3H 2O+D . 2Fe3++ 2I- ===2Fe 2++I24.下边的排序不正确的选项是()A .晶体熔点由低到高:CF4<CCl 4<CBr 4<CI 4B .硬度由大到小:金刚石>碳化硅 >晶体硅C.熔点由高到低: Na>Mg>AlD .晶格能由大到小:NaF>NaCl>NaBr>NaI5.某烷烃相对分子质量为86,假如分子中含有 3 个 -CH 2、 2 个 -CH 2-和一个 -CH- ,切合条件的该烃的构造式有(不考虑立体构造)()A. 1种B. 2种C. 3种D . 4 种6.以下说法或表示方法中正确的选项是)(A .等质量的硫蒸气和硫固体分别完整焚烧,后者放出的热量多B .由 C(金刚石)→C(石墨) +119kJ 可知,金刚石比石墨稳固C.在 101kpa 时, 2gH 2完整焚烧生成液态水,放出285.8kJ 热量,氢气焚烧的热化学方程式为: 2H2( g) +O 2( g)→2H 2O( l )+285.8kJD .在稀溶液中: H+(aq) +OH ﹣( aq)→H2O( l) +53.7kJ,若将含 0.5molH 2SO4的浓溶液与含 1 molNaOH 的溶液混淆,放出的热量大于53.7kJ7.以下对于某溶液所含离子查验的方法和结论正确的选项是()A .加入碳酸钠溶液产生白色积淀,再加盐酸白色积淀消逝,说明有 Ca2+B .通入少许 Cl2后 ,溶液变为黄色 ,再加入淀粉溶液后,溶液变蓝 ,说明有 I-C.加入盐酸产生能使澄清石灰水变污浊的气体,则原溶液中必定有 CO或 SOD .往溶液中加入 BaCl2溶液和稀 HNO 3,有白色积淀生成 ,说明必定有 SO8.以下说法正确的选项是 ( )A . 0.5 mol O 3与 11.2 L O 2所含的分子数必定相等B . 25℃与 60℃时,水的 pH 相等C.中和等体积,等物质的量的浓度的盐酸和醋酸所耗费的n(NaOH) 相等D . 2SO2(g)+O 2(g)=2SO 3(g) 和 4SO2(g)+2O 2(g)=4SO 3(g) 的△ H 相等9.以下物质中属于天然高分子化合物的是()A.纤维素B.蔗糖C.油脂D.麦芽糖10.以下对σ键的认识不正确的选项是()A . s-sσ与键s-pσ键的对称性同样B .烯烃分子中的碳碳双键的键能是碳碳单键键能的二倍C.分子中含有共价键,则起码含有一个σ键D .含有π键的化合物与只含σ键的化合物的化学性质不一样11.镁燃料电池在可挪动电子设施电源和备用电源等方面应用远景广阔.如图为“镁一次氯酸盐”燃料电池表示图,电极为镁合金和铂合金.对于该电池的表达正确的选项是()A . E 为该燃料电池的正极B .负极发生的电极反响式为ClO ﹣ +2e﹣ +H 2O=Cl ﹣+2OH ﹣C.电池工作时,正极四周溶液的pH 将不停变小D .镁燃料电池负极能发生自腐化产生氢气,使负极利用率降低12.已知下表数据:对含等物质的量的CuSO4、 FeSO4、 Fe2 (SO4)3的混淆溶液的说法,不正确的选项是()A .向该混淆溶液中逐滴加入NaOH溶液,最初看到红褐色积淀B .该溶液中c(SO):[ c(Cu2+)+ c(Fe2+ )+ c(Fe3+)]>5:4C.向该溶液中加入适当氯水,并调理pH到 3.4 后过滤,可获取纯净的CuSO4溶液D .在pH = 5 的溶液中Fe3+不可以大批存在()13.下述有关实验操作正确的选项是A .溴苯中混有溴:加入碘化钾溶液后分液B .除掉 CO2中的少许 SO2: 经过盛有饱和Na2CO3溶液的洗气瓶C.用玻璃棒在过滤器上搅拌以加快AgCl 积淀的清洗D .中和滴定实验中,锥形瓶用蒸馏水洗净后未干燥,不影响测定结果14.制肥皂时,皂化反响后加盐的作用是()A .加大溶液密度B .催化作用C.与甘油反响D .盐析使肥皂析出15.以下金属防腐的举措中,使用外加电流的阴极保护法的是()A .水中的钢闸门连结电源的负极B .金属护拦表面涂漆C.枪炮表面涂上一层油D .地下钢管连结镁块二、填空题 (共 3 小题 )16.C 和 Si 元素在化学中据有极其重要的地位。
【鲁科版】2019年高考化学一轮复习:配套训练 汇编 390页含答案

【鲁科版】2019年高考化学一轮复习:配套训练汇编目录2019年高考化学一轮复习训练(含答案):课时分层训练1 钠及其化合物鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练2 氯及其化合物鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练3 物质的量气体摩尔体积鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练4 物质的量在化学实验中的应用鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练5 元素与物质的分类鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练6 电解质鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练7 氧化剂和还原剂鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练8 铁及其化合物鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练9 碳的多样性鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练10 氮的循环鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练11 硫的转化鲁科版2019年高考化学一轮复习训练含答案:课时分层训练12海水中的元素绿色化学与环境保护鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练13 硅无机非金属材料鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练14 铝及其化合物鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练15 金属材料复合材料鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练16 原子结构核外电子排布鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练17 元素周期律和元素周期表鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练18 化学键鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练19 化学反应的热效应鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练20 电能转化为化学能——电解鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练21 化学能转化为电能——电池鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练22 化学反应的方向、限度鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练23 化学平衡状态和平衡移动鲁科版2019年高考化学一轮复习训练含答案:课时分层训练24 化学反应的速率化学反应条件鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练25 水溶液酸碱中和滴定鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练26 弱电解质的电离鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练27 盐类的水解鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练28 沉淀溶解平衡鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练29 认识有机化合物重要的烃鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练30 饮食中的有机化合物鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练31 化学实验仪器和基本操作鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练32 物质的分离、提纯和检验鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练33 化学实验方案的设计与评价鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练34 有机物的结构、分类与命名鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练35 烃和卤代烃鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练36 烃的含氧衍生物鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练37 基本营养物质有机合成鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练38 原子结构鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练39 化学键与分子间作用力鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练40 物质的聚集状态与物质性质鲁科版2019年高考化学一轮复习训练(含答案):专题突破训练(一)气体的制法及其性质探究鲁科版2019年高考化学一轮复习训练含答案:专题突破训练(二)化学工艺流程试题的突破方略鲁科版2019年高考化学一轮复习训练含答案:专题突破训练(三)化学工艺流程试题的突破方略鲁科版2019年高考化学一轮复习训练含答案:专题突破训练(四)化学工艺流程试题的突破方略鲁科版2019年高考化学一轮复习训练含答案:专题突破训练(五)化学工艺流程试题的突破方略鲁科版2019年高考化学一轮复习训练含答案:专题突破训练(六)化学工艺流程试题的突破方略鲁科版专题突破训练(一) 气体的制法及其性质探究1.根据侯氏制碱原理制备少量NaHCO 3的实验,经过制取氨气、制取NaHCO 3、分离NaHCO 3、干燥NaHCO 3四个步骤。
2019届鲁教版高中化学高考第一轮专题复习综合测试卷II(含答案解析版)

2019届鲁教版高中化学高考第一轮专题复习综合测试卷II一、单选题(共15小题)1.据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池可用作空军通信卫星电源,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。
下列说法正确的是()A.电池放电时Na+从b极区移向a极区B.电极b采用MnO2,MnO2既作电极材料又有催化作用C.每消耗1 mol H2O2,转移的电子为1 molD.该电池的正极反应为BH+8OH--8e-===BO+6H2O2.1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125 ℃,反应装置如图。
下列对该实验的描述错误的是()A.不能用水浴加热B.长玻璃管起冷凝回流作用C.提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤D.加入过量乙酸可以提高1-丁醇的转化率3.化学与生产、生活、社会密切相关。
下列说法中不正确的是()A.绿色化学的核心是从源头上消除工业生产对环境的污染。
B.“硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致。
C.铁在潮湿的空气中放置,易发生化学腐蚀而生锈。
D.华商科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的二氧化硅。
4.经一定时间后,可逆反应aA+bB cC中物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是()A.该反应在T1、T3温度时达到化学平衡B.该反应在T1温度时达到化学平衡C.该反应为放热反应D.升高温度,平衡会向正反应方向移动5.下列说法不正确的是()A.等物质的量的苯和苯甲酸完全燃烧消耗氧气的量相等B.乙酸乙酯在H218O中水解,产物乙酸中将含有18O同位素C.淀粉与稀硫酸混合加热一段时间后,滴加碘水溶液变蓝,说明淀粉没有水解D.Na2SO4•10H2O失水时吸热,结晶时放热,因而该晶体可作储热材料实现化学能与热能相互转化6.已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是三种酸的电离平衡常数,若已知这些酸可发生如下反应:①NaCN+HNO2===HCN+NaNO2,②NaCN+HF===HCN+NaF,③NaNO2+HF===HNO2+NaF。
[推荐学习]2019年高考化学一轮复习训练(鲁科版): 课时分层训练39 化学键与分子间作用力 鲁科
![[推荐学习]2019年高考化学一轮复习训练(鲁科版): 课时分层训练39 化学键与分子间作用力 鲁科](https://img.taocdn.com/s3/m/ab7ceb5531b765ce0508149c.png)
课时分层训练(三十九) 化学键与分子间作用力(建议用时:45分钟)A级基础达标1.(1)(2015·山东高考,节选)OF2分子构型为________,其中氧原子的杂化方式为________。
(2)(2015·海南高考,节选)①V2O5常用作SO2转化为SO3的催化剂。
SO2分子中S原子价层电子对数是________对,分子的空间构型为________;SO3气态为单分子,该分子中S 原子的杂化轨道类型为______ ;SO3的三聚体环状结构如图1所示,该结构中S原子的杂化轨道类型为________ ;该结构中S—O键长有两类,一类键长约140 pm,另一类键长约160 pm,较短的键为________ (填图1中字母),该分子中含有________个σ键。
图1图2②V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的空间构型为________;也可以得到偏钒酸钠,其阴离子呈如图2所示的无限链状结构,则偏钒酸钠的化学式为________。
(3)(2015·全国Ⅰ卷,节选)①碳在形成化合物时,其键型以共价键为主,原因是________________________________________________________________ ___________________________________________________。
②CS2分子中,共价键的类型有________,C原子的杂化轨道类型是________,写出两个与CS2具有相同空间构型和键合形式的分子或离子_________________。
(4)(2015·江苏高考,节选)①配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是________(填元素符号)。
②H2O与CH3CH2OH可以任意比例互溶,除因为它们都是极性分子外,还因为_________________________________________________________。
【配套K12】2019年高考化学一轮复习训练(鲁科版): 课时分层训练7 氧化剂和还原剂 鲁科版

课时分层训练(七) 氧化剂和还原剂(建议用时:45分钟)A级基础达标1.生活中碰到的某些问题,常涉及氧化还原反应知识,下列说法正确的是( ) A.Fe的生锈原理是Fe被还原B.含乙醇、NaClO、H2O2等的消毒液均可以将病毒氧化而达到消毒目的C.喝补铁剂时,加服维生素C效果更好,原因是维生素C具有还原性D.保存FeSO4溶液时常加入Fe粉的目的是防止Fe2+被还原C[A项,Fe被氧化;B项,乙醇消毒原理不是氧化;D项,防止Fe2+被氧化。
]2.(2018·山东省实验中学高三质检)LiNi0.25Co0.75O2是锂离子电池的一种高性能的二元正极活性材料,其制备原理可表示为4Ni0.25Co0.75(OH)2+4LiOH+O2===4LiNi0.25Co0.75O2+6H2O(已知Ni与Co的化合价均有+2和+3)。
下列说法不正确的是( ) A.Ni0.25Co0.75(OH)2中Ni的化合价是+2B.LiNi0.25Co0.75O2中Co的化合价是+3C.该反应中LiOH是还原剂D.该反应中O2是氧化剂C[根据化合物中化合价代数和为0的原则,Ni0.25Co0.75(OH)2中Ni和Co的化合价均是+2,LiNi0.25Co0.75O2中Ni和Co的化合价均是+3,A、B项正确;该反应中LiOH既不是氧化剂,也不是还原剂,C项错误;O2得电子化合价降低,O2是氧化剂,D项正确。
] 3.已知硫酸亚铁溶液中加入Na2O2时发生反应:4Fe2++4Na2O2+6H2O===4Fe(OH)3↓+O2↑+8Na+。
下列说法正确的是( )A.该反应中氧化剂是Na2O2,还原剂是FeSO4B.若Fe2+失去4 mol电子,生成氧气的体积约为22.4 LC.4 mol Na2O2参加反应,共得到6 mol电子D.反应过程中可以看到白色沉淀先转化为灰绿色后转化为红褐色C[该反应中转移6e-,且只有Na2O2中的O元素得电子,故4 mol Na2O2参加反应,共得到6 mol电子,C项正确。
高考化学一轮复习 章末总结练2(含解析)鲁科版-鲁科版高三全册化学试题

章末总结(1)Na2SO3既属于钠盐又属于亚硫酸盐,这是交叉分类法。
( )提示:√。
交叉分类法是利用不同的标准对同一物质进行分类的方法。
(2)只含一种分子的物质是纯净物,冰水混合物是纯净物,只含一种元素的物质也是纯净物。
( )提示:×。
只含一种元素的物质可以是同素异形体的混合物。
(3)化学变化中一定存在化学键的断裂和形成,所以有化学键断裂或形成的变化一定是化学变化。
( )提示:×。
既有化学键断裂,又有化学键形成的变化一定是化学变化。
(4)在溶于水或熔融状态下能够自身发生电离的化合物一定是电解质。
( )提示:√。
根据电解质的定义可知该说法正确。
(5)CO2、C6H12O6、CH4、CH3CH2OH、HCOOH都是非电解质。
( )提示:×。
HCOOH在水中能电离,是电解质。
(6)NaHSO4能完全电离出一个H+,所以它是一元强酸。
( )提示:×。
NaHSO4是酸式盐。
(7)化学变化中常伴随着发光、放热和颜色变化,有发光、发热或颜色变化的变化一定是化学变化。
( )提示:×。
焰色反应是物理变化。
(8)向Fe(OH)3胶体溶液中逐滴加入稀硫酸,会逐渐生成红褐色沉淀,当稀硫酸过量,又变成棕黄色溶液,整个过程发生的都是化学变化。
( )提示:×。
刚开始会生成红褐色沉淀是胶体的聚沉,是物理变化。
(9)分离浊液和胶体的方法是渗析。
( )提示:×。
分离浊液和胶体的方法是过滤。
分离溶液和胶体的方法是渗析。
(10)Na2O2固体与水反应:2+2H2O4OH-+O2↑( )提示:×。
Na2O2不拆。
(11)将Na投入CuSO4溶液中:2Na+Cu2+2Na++Cu。
( )提示:×。
将Na投入CuSO4溶液中,生成Cu(OH)2和H2 ,题给方程式不符合客观事实。
(12)Fe和稀盐酸反应:2Fe+6H+2Fe3++3H2↑。
( )提示:×。
2019-2020学年高三高考(鲁科版)化学一轮复习
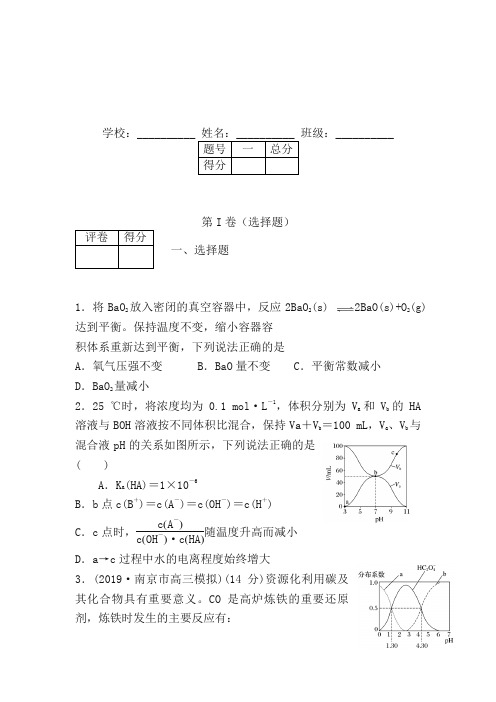
学校:班级:__________第I 卷(选择题)一、选择题1.将BaO 2放入密闭的真空容器中,反应2BaO 2(s) 2BaO(s)+O 2(g)达到平衡。
保持温度不变,缩小容器容 积体系重新达到平衡,下列说法正确的是A .氧气压强不变B .BaO 量不变C .平衡常数减小D .BaO 2量减小2.25 ℃时,将浓度均为0.1 mol·L -1,体积分别为V a 和V b 的HA 溶液与BOH 溶液按不同体积比混合,保持Va +V b =100 mL ,V a 、V b 与混合液pH 的关系如图所示,下列说法正确的是( )A .K a (HA)=1×10-6B .b 点c(B +)=c(A -)=c(OH -)=c(H +)C .c 点时,c (A -)c (OH -)·c (HA )随温度升高而减小D .a →c 过程中水的电离程度始终增大3.(2019·南京市高三模拟)(14分)资源化利用碳及其化合物具有重要意义。
CO 是高炉炼铁的重要还原剂,炼铁时发生的主要反应有:Ⅰ.Fe2O3(s)+3C(s)2Fe(s)+3CO(g)ΔH=+489 kJ·mol-1Ⅱ.Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)ΔH=-27 kJ·mol-1Ⅲ.C(s)+CO2(g)2CO(g) ΔH=X kJ·mol-1(1)试计算,X=________。
反应Ⅲ中,正反应的活化能________(填“大于”“小于”或“等于”)逆反应的活化能。
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应Ⅰ,反应达到平衡后,在t1时刻改变某条件,v逆随时间t的变化关系如图1所示,则t1时刻改变的条件可能是________(填序号)。
a.保持温度、体积不变,使用催化剂b.保持体积不变,升高温度c.保持温度不变,压缩容器体积d.保持温度、体积不变,充入CO(3)在一定温度下,向某体积可变的恒压(p总)密闭容器中加入1 mol CO2与足量的碳发生反应Ⅲ,平衡时体系中气体体积分数与温度的关系如图2所示。
2019年高考化学一轮复习训练(鲁科版) 课时分层训练36 烃的含氧衍生物 鲁科版

课时分层训练(三十六) 烃的含氧衍生物(建议用时:45分钟)A级基础达标1.(2018·云南七校联考)有机物F的合成路线如下:已知:请回答下列问题:(1) F的结构简式为________________;F中所含官能团名称为________________。
(2)简述检验有机物C中官能团的方法_________________________________________________________________________________________。
(3)反应④~⑦中,属于取代反应的是___________________________。
(4)写出反应②的化学方程式__________________________________________________________________________________________________。
(5)反应④⑥的作用是__________________________________________。
(6)有机物D的同分异构体有________________种(包括D)。
(7)有机物的同分异构体有多种,写出能发生银镜反应和水解反应、遇FeCl3溶液显紫色、苯环上的一氯代物只有两种的结构简式________________。
【解析】(1)由题给框图和已知条件可推出A为CH3CH2OH,B为CH3CHO,C为CH3CH===CHCHO,D为CH3CH2CH2CH2OH,E为,F为。
(2)先取一份物质C,加入银氨溶液,加热,有银镜生成,证明含醛基(或先取一份物质C,加入新制氢氧化铜悬浊液,煮沸,有砖红色沉淀生成,证明含醛基);然后酸化后滴入溴水,振荡、退色,证明含有碳碳双键。
(5)酸性高锰酸钾既能氧化羟基,又能氧化甲基,为使羟基不被氧化,先将羟基保护起来。
(6)符合条件的同分异构体有CH3CH2CH2CH2OH、CH3CH2CHOHCH3、(CH3)2CHCH2OH、(CH3)3COH、CH3OCH2CH2CH3、CH3OCH(CH3)2、CH3CH2OCH2CH3,共7种。
2019年高考化学一轮复习训练(鲁科版) 课时分层训练37 基本营养物质 有机合成 鲁科版

课时分层训练(三十七) 基本营养物质有机合成A级基础达标1.下列说法正确的是( )A.糖类、油脂、蛋白质都属于高分子化合物B.汽油、柴油和植物油都是碳氢化合物C.将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性D.加热、重金属盐、紫外线对蛋白质的作用为变性D[A项,单糖、双糖、油脂均不是高分子化合物;B项,植物油为油脂,含有C、H、O 元素;C项,(NH4)SO4不会使蛋白质变性,而是使其盐析。
]2.(2018·陕西咸阳模拟)下列说法正确的是( )A.糖类化合物都具有相同的官能团B.酯类物质是形成水果香味的主要成分C.油脂的皂化反应生成脂肪酸和丙醇D.蛋白质的水解产物都含有羧基和羟基B[A项,糖类化合物有的是多羟基醛,有的是多羟基酮;C项,皂化反应生成脂肪酸盐和丙三醇;D项,蛋白质的水解产物为氨基酸,含—COOH和—NH2。
]3.工程塑料PBT的结构简式为下列有关PBT的说法正确的是( )A.PBT是通过加聚反应得到的高分子化合物B.PBT分子中含有羧基、羟基和酯基C.PBT的单体中有芳香烃D.PBT的单体均能与Na、NaOH、Na2CO3反应B[A项,PBT为缩聚产物;C项,PBT的单体为羧酸和醇,为烃的衍生物;D项,醇与NaOH、Na2CO3不反应。
]4.今有高聚物对此分析正确的是( )A.它是一种体型高分子化合物D[A项,由高聚物的结构可知,该高聚物应是线型结构,错误;B项,此高分子化合物是由加聚反应形成的,其单体为CH2===CHCOOCH3,错误;C项,链节是,错误;D项正确。
]5.聚苯乙烯塑料性质稳定,会造成严重的“白色污染”。
为此人们开发出一种聚乳酸塑料来替代聚苯乙烯。
聚乳酸合成过程如下:(1)淀粉和纤维素的分子式均可表示为(C6H10O5)n,下列关于淀粉和纤维素的说法正确的是________。
A.互为同分异构体B.水解最终产物相同C.纤维素是纯净物 D.均是高分子化合物(2)乳酸分子所含官能团有________________________(填名称)。
2019届鲁教版高中化学高考第一轮专题复习专题2《物质及变化》测试卷(含答案解析版)

2019届鲁教版高中化学高考第一轮专题复习专题2《物质及其变化》测试卷一、单选题(共15小题)1.下列化学反应属于区域3的是 ()A. 4Fe(OH)2+O2+2H2O===4Fe(OH)3B. 2NaHCO3Na2CO3+H2O+CO2↑C. 4NH3+5O24NO+6H2OD. Zn+H2SO4ZnSO4+H2↑2.下列离子或分子在溶液中能大量共存,通入CO2后仍能大量共存的一组是()A. K+、Ca2+、Cl-、NB. K+、Na+、Br-、SiC. H+、Fe2+、S、Cl2D. K+、Ag+、NH3·H2O、N3.在水溶液中能大量共存的一组离子是A. H+、Na+、SO42-、SiO32-B. Ba2+、Al3+、Cl-、SO42-C. K+、Mg2+、SO42-、NO3-D. H+、Fe2+、ClO-、NO3-4.将KSCN、NH4HCO3、BaCl2、Na2S、NaOH等五种无色溶液鉴别出来的最佳方法是 () A.不加任何试剂,将溶液两两混合B.加入一种试剂C.不加任何试剂,将溶液分别加热D.加入两种试剂5.下列表示对应化学反应的离子方程式正确的是()A .硫化钠的水解反应:S2—+2H2O H2S+2OH-B.硫酸亚铁溶液中滴加酸化的双氧水:2Fe2++2H++H2O22Fe3++2H2OC .碳酸氢钙溶液中加入足量烧碱溶液:HC+OH-C+H2OD.玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-Na2SiO3↓+H2O6.水溶液X中只可能溶有K+、Mg2+、Al3+、、、、、中的若干种离子。
某同学对该溶液进行了如下实验:下列判断正确的是( )A.气体甲一定是纯净物B.沉淀甲是硅酸和硅酸镁的混合物C. K+、和一定存在于溶液X中D.和一定不存在于溶液X中7.下列说法正确的一组是()①不溶于水的盐(CaCO3、BaSO4等)都是弱电解质②盐都是强电解质③0.5mol/L的所有一元酸中氢离子浓度都是0.5mol/L④强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度⑤电解质溶液导电的原因是溶液中有自由移动的阴、阳离子⑥熔融的电解质都能导电A.①③⑤⑥B.②④⑤⑥C.只有⑤D.只有⑥8.下列有关化学用语使用正确的是A.钾离子结构示意图:B. NH4I的电子式:C. CO2分子比例模型:D.甲烷的结构简式:CH49.下列物质属于电解质的是()A.氯化钠B.铜C.蔗糖D.乙醇10.下列说法正确的是()A.可用丁达尔现象区分溶液与胶体B.生石灰与水混合的过程只发生物理变化C. O3是由3个氧原子构成的化合物D. CuSO4·5H2O是一种混合物11.下列分类或归类正确的是()①液氯、氨水、干冰、碘化银均为纯净物②CaCl2、NaOH、HCl、IBr均为化合物③明矾、水银、烧碱、硫酸均为强电解质④C60、C70、金刚石、石墨均为碳的同素异形体⑤碘酒、淀粉、水雾、纳米材料均为胶体A.①③④B.②③C.②④D.②③④⑤12.亚氨基羟(Li2NH)是一种储氢容量器,安全性好的固体储氢材料,其储氢原理可表示为Li2NH+H2=LiNH2+LiH。
【配套K12】2019年高考化学一轮复习训练(鲁科版): 课时分层训练28 沉淀溶解平衡 鲁科版

课时分层训练(二十八) 沉淀溶解平衡(建议用时:45分钟)A级基础达标1.(2018·黄冈高三模拟)有关CaCO3的沉淀溶解平衡的说法中,不正确的是( )【导学号:95160295】A.CaCO3沉淀析出和沉淀溶解不断进行,但速率相等B.CaCO3难溶于水,其饱和溶液不导电,属于弱电解质C.升高温度,CaCO3沉淀的溶解度增大D.向CaCO3溶解平衡体系中加入纯碱固体,会有CaCO3析出B[CaCO3固体在溶液中达到溶解平衡后,沉淀溶解与沉淀生成速率相等,但不为0;CaCO3难溶于水,但溶解的部分是完全电离的,电离出Ca2+和CO2-3,属于强电解质;一般来说,升高温度,有利于固体物质的溶解;向CaCO3溶解平衡体系中加入纯碱固体,增大了CO2-3浓度,使溶解平衡向左移动,从而析出CaCO3。
]2.下列说法正确的是 ( )【导学号:95160296】①难溶电解质达到沉淀溶解平衡时,溶液中各种离子的溶解(或沉淀)速率都相等②难溶电解质达到沉淀溶解平衡时,增加难溶电解质的量,平衡向溶解方向移动③向Na2SO4溶液中加入过量的BaCl2溶液,则SO2-4沉淀完全,溶液中只含Ba2+、Na+和Cl-,不含SO2-4④K sp小的物质其溶解能力一定比K sp大的物质的溶解能力小⑤为减少洗涤过程中固体的损耗,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀⑥洗涤沉淀时,洗涤次数越多越好A.①②③ B.①②③④⑤⑥C.⑤ D.①⑤⑥C[①难溶电解质达到沉淀溶解平衡时,不同离子溶解(或沉淀)的速率不一定相等,这与其系数有关;②难溶电解质是固体,其浓度可视为常数,增加它的量对平衡无影响;③生成BaSO4沉淀后的溶液中仍然存在Ba2+和SO2-4,因为有BaSO4的沉淀溶解平衡存在;④同类型物质的K sp越小,溶解能力越小,不同类型的物质则不能直接比较;⑤稀H2SO4可以抑制BaSO4的溶解;⑥洗涤沉淀一般2~3次即可,次数过多会使沉淀溶解。
2019年高考化学一轮复习训练(鲁科版): 课时分层训练35 烃和卤代烃 鲁科版

课时分层训练(三十五) 烃和卤代烃(建议用时:45分钟)A级基础达标1.(2018·合肥模拟)下列判断,结论正确的是( )四面体结构,所有原子不可能在同一平面内,A错误;由溴丙烷水解制丙醇属于取代反应,由丙烯与水反应制丙醇属于加成反应,二者不属于同一反应类型,B错误;乙烯与溴水发生加成反应,使溴水退色,苯萃取溴水中的溴,使溴水退色,退色原理不同,C错误;—C4H9的同分异构体有—CH2CH2CH2CH3、—CH(CH3)CH2CH3、—CH2CH(CH3)2、—C(CH3)3四种,所以C4H9Cl 有4种同分异构体,D正确。
]2.某有机物结构简式为,下列叙述不正确的是( )【导学号:95160382】A.1 mol该有机物在加热和催化剂作用下,最多能与4 mol H2反应B.该有机物能使溴水退色,也能使酸性KMnO4溶液退色C.该有机物遇硝酸银溶液产生白色沉淀D.该有机物在一定条件下能发生消去反应或取代反应C[该有机物中含有1个苯环和1个碳碳双键,1 mol该有机物能与4 mol H2加成,A 项正确;与苯环相连的碳原子、碳碳双键均能使酸性KMnO4溶液退色,B项正确;有机物中的Cl为原子而非离子,不能与Ag+产生沉淀,C项错误;分子中含有Cl原子,在NaOH溶液、加热条件下可以水解,且与Cl原子相连的碳原子的邻位碳原子上有氢原子,在NaOH醇溶液、加热条件下能发生消去反应。
D项正确。
]3.(2018·金华模拟)有甲、乙两种物质:(1)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):其中反应Ⅰ的反应类型是____________,反应Ⅱ的条件是____________,反应Ⅲ的化学方程式为________________(不需注明反应条件)。
(2)下列物质不能与乙反应的是________(填字母)。
a.金属钠b.溴水c.碳酸钠溶液d.乙酸(3)乙有多种同分异构体,任写其中一种能同时满足下列条件的同分异构体结构简式:________________。
2019高三化学(鲁科版)一轮课时规范练:2 氯及其重要化合物 Word版含解析

课时规范练2氯及其重要化合物一、选择题(本大题包括10小题,每小题5分,共50分。
每小题只有一个选项符合题目要求)1.25 ℃时,下列关于饱和氯水的叙述中正确的是()A.在饱和氯水中加入CaCO3,溶液的pH变小B.在饱和氯水中通入SO2气体,溶液的pH变大C.在饱和氯水中通入H2S气体,H2S与HClO反应Cl2+H2O HCl+HClO正向进行D.在饱和氯水中[H+]>[Cl-]>[ClO-]2.(2017安徽安庆一中月考)实验室既可利用浓盐酸与MnO2在加热时反应制备Cl2,也可利用KMnO4与浓盐酸在常温下反应制备Cl2,下列有关说法不正确的是()A.KMnO4的氧化性比MnO2的强B.制备Cl2的整个实验过程中,只需要使用氧化剂与还原剂C.用排空气法收集氯气,不需要利用其他试剂就能确定集气瓶中是否收集满气体D.用足量MnO2与含有4 mol HCl的浓盐酸在加热条件下反应,得到Cl2的物质的量小于1 mol3.有关漂白粉和漂白液的说法正确的是()A.漂白粉是纯净物,漂白液是混合物B.漂白粉的有效成分是Ca(ClO)2C.工业上将氯气通入澄清石灰水制取漂白粉D.漂白液的有效成分是Na2O24.Cl2有毒,常用于自来水和游泳池的消毒杀菌。
已知硫氰[(SCN)2]的化学性质与Cl2的类似,被称为“拟卤素”,如(SCN)2+2NaOH NaSCN+NaSCNO+H2O,阴离子的还原性顺序为I->SCN->Br->Cl-。
下列说法中不正确的是()A.若Cl2、(SCN)2发生泄漏,均可喷洒石灰水进行处理B.KSCN可以与FeCl3溶液反应C.Cl2与KSCN溶液发生反应的离子方程式为Cl2+2SCN-(SCN)2+2Cl-D.(SCN)2可以与KBr溶液发生反应:(SCN)2+2KBr2KSCN+Br25.(2017湖北襄阳五中月考)用下列方法测定空气中污染物的含量:将一定体积的空气通入吸收剂,并测定其电导的变化(导体的电阻越大,它的电导越小)。
2019年高考化学一轮复习 课时分层训练2 氯及其化合物 鲁科版

课时分层训练(二) 氯及其化合物(建议用时:45分钟)A级基础达标1.某地化工厂的贮氯罐意外发生泄漏,下列关于安全处理措施不正确的是( )A.紧急组织群众沿逆风方向疏散B.消防队员向贮氯罐周围空气中喷洒稀NaOH溶液C.处在该环境中的群众,应用浸有稀氨水的毛巾捂住鼻子,趴在低洼处等待救援D.处在该环境中的群众,应用浸有一定浓度NaHCO3的毛巾捂住鼻子,向高处转移C[稀氨水挥发出的NH3具有强烈的刺激性气味,氯气的密度比空气的密度大,应往高处转移。
]2.(2018·宁德模拟)某同学在一pH试纸上滴几滴新制的氯水,现象如图所示,下列有关该实验的说法中正确的是( )A.该实验说明Cl2具有漂白性B.该实验说明H+扩散速度比HClO快C.将实验后的pH试纸在酒精灯上微热,试纸又恢复为原来的颜色D.若用久置的氯水进行实验,现象相同B[HClO具有漂白性,Cl2无漂白性,A项错误;HClO的漂白持久、稳定,实验后的pH 试纸加热不会恢复原来的颜色,C项错误;久置的氯水主要成分为稀盐酸,无漂白性,D项错误。
]3.水处理包括水的净化、杀菌消毒、蒸馏等。
其中常见的杀菌消毒剂包括氯气、臭氧、漂白粉等。
游泳场馆往往用臭氧、活性炭对游泳池进行消毒和净化。
下列说法中正确的是( )A.臭氧、活性炭处理水的原理相同B.氯气是一种常用的消毒剂,用氯气消毒的水也可以用于配制各种化学试剂C.氯气和二氧化硫都具有漂白性,等体积的两者混合会提高漂白的效率D.漂白粉长期露置在空气中会失效D[A项,臭氧具有氧化性,活性炭具有吸附性,二者的漂白原理不同,错误;B项,新制氯水中含有氯气、HClO、H+、Cl-等多种粒子,如配制硝酸银溶液时会导致药品变质,错误;C项,氯气和二氧化硫发生氧化还原反应,生成硫酸和盐酸,漂白效率降低,错误;D项,漂白粉的主要成分为次氯酸钙,可与空气中二氧化碳反应生成不稳定的次氯酸,易变质,正确。
]4.(2013·海南高考)如图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是( )A.a-b-c-d-e-f-g-hB.a-e-d-c-b-h-i-gC.a-d-e-c-b-h-i-gD.a-c-b-d-e-h-i-fB[装置顺序为:制氯气、除杂(HCl、水蒸气)、反应制备、尾气处理,注意洗气瓶中导管为“长进短出”。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
课时分层训练(二) 氯及其化合物(建议用时:45分钟)A级基础达标1.某地化工厂的贮氯罐意外发生泄漏,下列关于安全处理措施不正确的是( )A.紧急组织群众沿逆风方向疏散B.消防队员向贮氯罐周围空气中喷洒稀NaOH溶液C.处在该环境中的群众,应用浸有稀氨水的毛巾捂住鼻子,趴在低洼处等待救援D.处在该环境中的群众,应用浸有一定浓度NaHCO3的毛巾捂住鼻子,向高处转移C[稀氨水挥发出的NH3具有强烈的刺激性气味,氯气的密度比空气的密度大,应往高处转移。
]2.(2018·宁德模拟)某同学在一pH试纸上滴几滴新制的氯水,现象如图所示,下列有关该实验的说法中正确的是( )A.该实验说明Cl2具有漂白性B.该实验说明H+扩散速度比HClO快C.将实验后的pH试纸在酒精灯上微热,试纸又恢复为原来的颜色D.若用久置的氯水进行实验,现象相同B[HClO具有漂白性,Cl2无漂白性,A项错误;HClO的漂白持久、稳定,实验后的pH 试纸加热不会恢复原来的颜色,C项错误;久置的氯水主要成分为稀盐酸,无漂白性,D项错误。
]3.水处理包括水的净化、杀菌消毒、蒸馏等。
其中常见的杀菌消毒剂包括氯气、臭氧、漂白粉等。
游泳场馆往往用臭氧、活性炭对游泳池进行消毒和净化。
下列说法中正确的是( )A.臭氧、活性炭处理水的原理相同B.氯气是一种常用的消毒剂,用氯气消毒的水也可以用于配制各种化学试剂C.氯气和二氧化硫都具有漂白性,等体积的两者混合会提高漂白的效率D.漂白粉长期露置在空气中会失效D[A项,臭氧具有氧化性,活性炭具有吸附性,二者的漂白原理不同,错误;B项,新制氯水中含有氯气、HClO、H+、Cl-等多种粒子,如配制硝酸银溶液时会导致药品变质,错误;C项,氯气和二氧化硫发生氧化还原反应,生成硫酸和盐酸,漂白效率降低,错误;D项,漂白粉的主要成分为次氯酸钙,可与空气中二氧化碳反应生成不稳定的次氯酸,易变质,正确。
]4.(2013·海南高考)如图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是( )A.a-b-c-d-e-f-g-hB.a-e-d-c-b-h-i-gC.a-d-e-c-b-h-i-gD.a-c-b-d-e-h-i-fB[装置顺序为:制氯气、除杂(HCl、水蒸气)、反应制备、尾气处理,注意洗气瓶中导管为“长进短出”。
]5.实验室既可用浓盐酸与MnO2在加热时反应制备Cl2,也可用KMnO4与浓盐酸在常温下反应制备Cl2。
下列有关说法不正确的是( )【导学号:95160009】A.KMnO4的氧化性比MnO2的强B.启普发生器可用于MnO2与浓盐酸反应制备Cl2C.用排气法收集不需要利用其他试剂就能确定集气瓶中已收集满气体D.用足量MnO2与含有4 mol HCl的浓盐酸在加热条件下反应,得到Cl2的物质的量少于1 molB[比较反应的条件即可说明KMnO4的氧化性强于MnO2,A正确;启普发生器不能用于加热,B错;当整个集气瓶充满黄绿色时表明已收集满了,C正确;浓盐酸变稀后不再与MnO2反应,生成Cl2的物质的量少于1 mol,D正确。
]6.氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是( ) A.加入少量水,水的电离平衡向电离的方向移动B.再通入少量氯气,c(H+)/c(ClO-)减小C.通入少量SO2,溶液漂白性增强D.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-)A[氯气溶于水达到平衡:Cl2+H2+HClO,加水后溶液中H+浓度减小,促进了水的电离,平衡向电离的方向移动,A项正确;再通入少量氯气,氯水浓度增大,但c(H+)要比c(ClO-)增大程度大,所以c(H+)/c(ClO-)应该增大,B项错误;通入少量SO2,发生反应Cl2+SO2+2H2O===H2SO4+2HCl,溶液漂白性减弱甚至消失,C项错误;加入少量固体NaOH,应有c(Na+)+c(H+)=c(Cl-)+c(ClO-)+c(OH-),但是溶液的酸碱性不知道,故不一定有c(Na+)=c(Cl-)+c(ClO-),D项错误。
]7.某实验小组用下图装置制备家用消毒液,并探究其性质。
(1)写出装有浓盐酸的仪器名称________,A中烧瓶内进行的反应中浓盐酸体现出的化学性质是________。
(2)写出装置B中发生的所有反应化学方程式:________________________________________________________________________________________________________________________。
(3)装置C的作用是____________________________。
反应停止后,各取洗气瓶中无色溶液5 mL分别进行了如下实验:究操作①中溶液退色的原因,又补充了如下实验:(5)操作②中溶液变成黄绿色的原因:____________________(用离子方程式表示)。
【解析】(2)在装置B中氯气和氢氧化钠反应生成次氯酸钠、氯化钠和水,从而制得消毒液,反应的化学方程式为Cl2+2NaOH===NaCl+NaClO+H2O。
另外生成的氯气中还含有挥发出的氯化氢,氯化氢与氢氧化钠发生中和反应,化学方程式为HCl+NaOH===NaCl+H2O。
(3)氯气有毒,则装置C的作用是吸收多余氯气,避免污染空气。
(4)酚酞在强碱性溶液中红色会退去,但同样体积、同pH的氢氧化钠溶液,滴加2滴酚酞溶液变红,30 min后退色,而消毒液pH=13,溶液变红,5 min后退色,退色时间短,说明此实验小组制备的消毒液具有漂白性。
(5)①次氯酸根中氯元素为+1价,盐酸中氯元素为-1价,在酸性条件下发生归中反应,生成氯气,反应的离子方程式为2H++ClO-+Cl-===Cl2↑+H2O。
【答案】(1)分液漏斗酸性和还原性(2)Cl2+2NaOH===NaCl+NaClO+H2O、HCl+NaOH===NaCl+H2O(3)吸收多余氯气,避免污染空气(4)5 mL,pH=13(5)2H++ClO-+Cl-===Cl2↑+H2OB级能力提升8.(2015·江苏高考有改动)实验室用如图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4。
已知K2FeO4具有下列性质:①可溶于水、微溶于浓KOH溶液,②在0~5 ℃、强碱性溶液中比较稳定,③在Fe3+和Fe(OH)3催化作用下发生分解,④在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。
(1)装置A中KMnO4与盐酸反应生成MnCl2和Cl2,其离子方程式为____________________________________________________________,将制备的Cl2通过装置B可除去________(填化学式)。
(2)Cl2与KOH在较高温度下反应生成KClO3。
在不改变KOH溶液的浓度和体积的条件下,控制反应在0~5 ℃下进行,实验中可采取的措施是____________________________________________________________、____________________________________________________________。
(3)制备K2FeO4时,KClO饱和溶液与Fe(NO3)3饱和溶液的混合方式为____________________________________________________________,其反应的离子方程式为____________________________________________________________。
(4)Cl2与KOH溶液反应生成KClO3的化学方程式为____________________________________________________________。
(5)D装置的作用是________________________,其反应离子方程式为____________________________________________________________。
【解析】(1)该反应的实质是MnO-4氧化Cl-,离子方程式为2MnO-4+16H++10Cl-===2Mn2++5Cl2↑+8H2O。
这样制得的Cl2中含有HCl,将Cl2与HCl的混合气体通过饱和食盐水,可除去HCl 。
(2)缓慢滴加盐酸,对装置C 用冰水浴降温,均有利于Cl 2与KOH 在0~5 ℃的温度下发生反应生成KClO 。
(3)根据题中给出的K 2FeO 4的性质,KClO 饱和溶液与Fe(NO 3)3饱和溶液混合时,应在搅拌下,将Fe(NO 3)3饱和溶液缓慢滴加到碱性KClO 饱和溶液中。
其离子方程式可利用化合价升降法配平。
(4)、(5)两问均可用倒配法配平方程式。
【答案】 (1)2MnO -4+16H ++10Cl -===2Mn 2++5Cl 2↑+8H 2O HCl(2)缓慢滴加盐酸 装置C 用冰水浴降温(3)在搅拌下,将Fe(NO 3)3饱和溶液缓慢滴加到KClO 饱和溶液中 3ClO -+2Fe 3++10OH -===2FeO 2-4+3Cl -+5H 2O(4)3Cl 2+6KOH===5KCl +KClO 3+3H 2O(5)吸收尾气Cl 2,防止污染空气 Cl 2+2OH -===Cl -+ClO -+H 2O下列对氯及其化合物的说法正确的是( )A .过量的铁在氯气中燃烧可生成氯化亚铁B .用pH 试纸测得氯水的pH =4C .溴化钠溶液中加入少量新制氯水振荡,再加入少量四氯化碳振荡,静置后,上层颜色变浅,下层颜色变为橙红色D .由Ca(ClO)2+CO 2+H 2O===CaCO 3↓+2HClO 可推出Ca(ClO)2+SO 2+H 2O===CaSO 3↓+2HClOC [Cl 2与变价金属反应生成高价金属氯化物,其产物与氯气和金属的相对量无关,A 错误;氯水中含有漂白作用的HClO ,不能用pH 试纸测定氯水的pH ,B 错误;2NaBr +Cl 2===2NaCl +Br 2,Br 2易溶于CCl 4而被萃取,故上层颜色变浅,下层颜色变为橙红色,C 正确;HClO 有强氧化性,能将CaSO 3氧化为CaSO 4,D 错误。
]。
