周环反应练习
周环反应

例1
CH3 H CH3 CH3
非键张力小 比
H H H
快 103倍
H
CH3 H3C C (H3C)3C
反 -1.3-戊 二 烯
例3
H3C H
比
快 27倍
例2
Ph H
H Ph
H
S-顺 式 构 象 ( 稳 定 )
S-反 式 构 象
快 102-103倍
H
比
H H H
反 -1-苯 基 -1.3-丁 二 烯
其 HOMO为 1
C C C
△
对旋
即:
例:1967年Kirmse发现下列实例
断裂
Ph H
△ -N2
N
Ph H H
H C Ph C
CH2
H
CH2OCH3 C C H
CH3OH Ph
H
N
4. 戊二烯基正负离子的电环化(正离子顺旋开环,负离子对旋开环)
O OH O
H3PO4
CHH 3 3C CHH 3 3C
四. 电环化反应
1.定义:在一定条件下,链状共轭多烯分子的两端构成一个 键形成 环状分子的反应及其逆反应,称电环化反应。 2.电环化反应的一般选择性规则
含偶数碳原子共轭体系的电环化反应的选择性规则 共轭体系的π电子数 4n(n=1、2、3……) 4n+2(n=0、1、2……) 例1
Ph CD3 Ph CH3 Ph Ph Ph
v
HOMO π( S) <2> 对称性匹配(允许)易反应
v
例3 (2+2)环加成,基态时
LUMO
π*( A)
HOMO
v
有机化学Chap18~21-周环杂环糖脂类氨基酸复习重点资料

D. 油脂易酸败
7. 维生素 A 为动物生长发育所必须,人体缺乏它,会导致夜盲症。它属于( )
A. 单萜
B. 倍半萜
C. 双萜
D. 三萜
8. 下列属于甾族化合物的是( )
有机化学
第4页
有机化学习题集
Chap20、21-杂环、脂类、氨基酸
Chap18-杂环化合物 参考答案
Chap19-杂环化合物 参考答案
A. 葡萄糖
B. 蔗糖
5. α-D-吡喃葡萄糖的 Haworth 式为()
C. 糖原
D. 麦芽糖
6. 下列糖与 HNO3 反应后,产生内消旋体的是()
7. D-吡喃葡萄糖与 1mol 无水乙醇和干燥 HCl 反应得到的产物属于()
A. 醚
B. 酯
C. 缩醛
D. 半缩醛
8. 下列叙述正确的是()
A. 糖类又称为碳水化合物,都符合 Cm(H2O)n 通式
一、选择题 1. D 2. A
二、是非题 1. × 2. √
3. C 4. C 5. A 6. A 3. √ 4. × 5. √
参考答案
7. C 8. B
Chap21 脂类、氨基酸 参考答案
一、选择题 1. C 2. C 3. A 4. B 5. B 6. C 7. C 8. A
有机化学
第5页
3. 由于β-D-葡萄糖的构象为优势构象,所以在葡萄糖水溶液中,其含量大于α-D-
葡萄糖。( )
有机化学
第3页
有机化学习题集
Chap20、21-杂环、脂类、氨基酸
4. 葡萄糖、果糖、甘露糖三者既为同分异构体,又互为差向异构体。( ) 5. β-D-甲基吡喃葡萄糖苷在酸性水溶液中会产生变旋光现象。( )
李景宁《有机化学》(第五版)笔记和课后习题(含考研真题)详解-周环反应【圣才出品】

HOMO 决定。
17.2 课后习题详解
1.推测下列化合物电环化反应产物的结构。
((11))
(2) HH
(1)
(2)(1)
(2)
HH
((12))
(2)
)
H H3C
H CH3
H
(3)
H3C
CH3
hv
(2)
HH
H CH3
hv
(3) H(4) H
(3) H3HC HCH3
(3) H3CHH3C CHHC3H3 (5)
8 / 18
圣才电子书
答:
十万种考研考证电子书、题库视频学习平台
9.通过什么反应和条件,完成下面的反应。
Ph
O
O
O
Ph
O
O
Ph
Ph
O
答:通过光照和加热能得到给出的结果,反应过程如下:
Ph
hv
对旋
Ph
Ph
O
O
O
Ph
Ph
Ph
O
O O
10.如何使反-9,10-二氢萘转化为顺-9,10-二氢萘?
圣才电子书
十万种考研考证电子书、题库视频学习平台
第 17 章 周环反应
17.1 复习笔记
一、电环化反应 1.电环化反应 (1)电环化反应的概念 电环化反应是指在加热或光照条件下,共轭多烯烃环合形成环烯烃的反应及其逆反应。 (2)电环化反应的规律性 共轭多烯烃电环化反应有高度的立体选择性,反应与共轭体系的π电子数目有关,主要 分为 4n 型共轭多烯和 4n+2 型共轭多烯。其关系见表 17-1。
子的 HOMO 与另一个反应分子的 LUMO 对称性符合正正重叠或者负负重叠,形成化学键,
16 周环反应问题参考答案
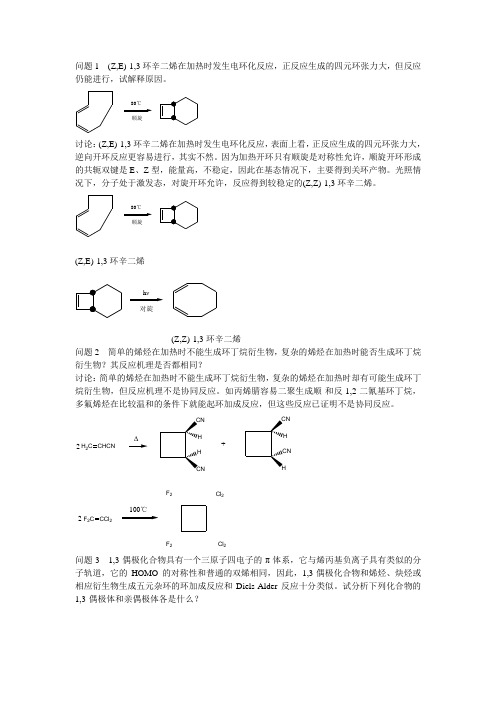
问题1 (Z,E)-1,3环辛二烯在加热时发生电环化反应,正反应生成的四元环张力大,但反应仍能进行,试解释原因。
顺旋80℃讨论:(Z,E)-1,3环辛二烯在加热时发生电环化反应,表面上看,正反应生成的四元环张力大,逆向开环反应更容易进行,其实不然。
因为加热开环只有顺旋是对称性允许,顺旋开环形成的共轭双键是E 、Z 型,能量高,不稳定,因此在基态情况下,主要得到关环产物。
光照情况下,分子处于激发态,对旋开环允许,反应得到较稳定的(Z,Z)-1,3环辛二烯。
顺旋(Z,E)-1,3环辛二烯对旋(Z,Z)-1,3环辛二烯问题2 简单的烯烃在加热时不能生成环丁烷衍生物,复杂的烯烃在加热时能否生成环丁烷衍生物?其反应机理是否都相同?讨论:简单的烯烃在加热时不能生成环丁烷衍生物,复杂的烯烃在加热时却有可能生成环丁烷衍生物,但反应机理不是协同反应。
如丙烯腈容易二聚生成顺-和反-1,2-二氰基环丁烷,多氟烯烃在比较温和的条件下就能起环加成反应,但这些反应已证明不是协同反应。
H 2C CHCN2+F 2C CCl 22Cl 2Cl 2F 2F 2问题3 1,3-偶极化合物具有一个三原子四电子的π体系,它与烯丙基负离子具有类似的分子轨道,它的HOMO 的对称性和普通的双烯相同,因此,1,3-偶极化合物和烯烃、炔烃或相应衍生物生成五元杂环的环加成反应和Diels-Alder 反应十分类似。
试分析下列化合物的1,3-偶极体和亲偶极体各是什么?ON R'R 6H 5N R'R R'''NN R'R 6H 5S N R'R S R''(1)(2)(3)(4)讨论:上述化合物的1,3-偶极体均为亲偶极体分别为: (1)(2)(3)(4)C 6H 5CHO R''C C R"'C 6H 5N O S C S问题4 5-氘代-5-甲基环戊二烯在加热条件下可以得到几个异构体?指出得到这些异构体的反应途径,写出这些异构体的名称。
湖南大学有机化学-课后例题习题-第十一章
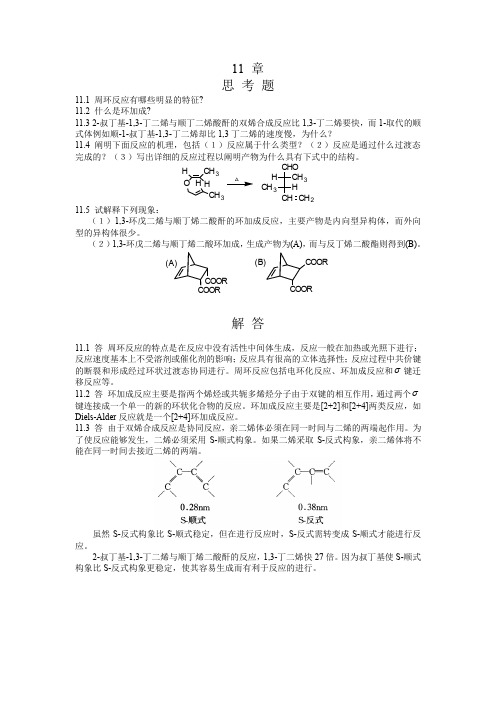
11 章 思 考 题11.1 周环反应有哪些明显的特征? 11.2 什么是环加成?11.3 2-叔丁基-1,3-丁二烯与顺丁二烯酸酐的双烯合成反应比1,3-丁二烯要快,而1-取代的顺式体例如顺-1-叔丁基-1,3-丁二烯却比1,3丁二烯的速度慢,为什么?11.4 阐明下面反应的机理,包括(1)反应属于什么类型?(2)反应是通过什么过渡态完成的?(3)写出详细的反应过程以阐明产物为什么具有下式中的结构。
H O HCH 3CH 3HH CHO CH 3CH CH 3HCH 2 △11.5 试解释下列现象:(1)1,3-环戊二烯与顺丁烯二酸酐的环加成反应,主要产物是内向型异构体,而外向型的异构体很少。
(2)1,3-环戊二烯与顺丁烯二酸环加成,生成产物为(A),而与反丁烯二酸酯则得到(B)。
解 答11.1 答 周环反应的特点是在反应中没有活性中间体生成,反应一般在加热或光照下进行;反应速度基本上不受溶剂或催化剂的影响;反应具有很高的立体选择性;反应过程中共价键的断裂和形成经过环状过渡态协同进行。
周环反应包括电环化反应、环加成反应和σ键迁移反应等。
11.2 答 环加成反应主要是指两个烯烃或共轭多烯烃分子由于双键的相互作用,通过两个σ键连接成一个单一的新的环状化合物的反应。
环加成反应主要是[2+2]和[2+4]两类反应,如Diels-Alder 反应就是一个[2+4]环加成反应。
11.3 答 由于双烯合成反应是协同反应,亲二烯体必须在同一时间与二烯的两端起作用。
为了使反应能够发生,二烯必须采用S-顺式构象。
如果二烯采取S-反式构象,亲二烯体将不能在同一时间去接近二烯的两端。
虽然S-反式构象比S-顺式稳定,但在进行反应时,S-反式需转变成S-顺式才能进行反应。
2-叔丁基-1,3-丁二烯与顺丁烯二酸酐的反应,1,3-丁二烯快27倍。
因为叔丁基使S-顺式构象比S-反式构象更稳定,使其容易生成而有利于反应的进行。
邢其毅《基础有机化学》笔记和课后习题(含考研真题)详解(周环反应)

第16章周环反应16.1 复习笔记一、周环反应和分子轨道对称守恒原理1.周环反应(1)定义:在化学反应过程中,能形成环状过渡态(cyclic transition state)的协同反应(synergistic reaction)统称为周环反应。
(2)协同反应是一种基元反应(elementary reaction)。
其含义是:在反应过程中,若有两个或两个以上的化学键破裂和形成时,都必须相互协调地在同一步骤中完成。
(3)周环反应具有如下的特点:①反应过程中没有自由基或离子这一类活性中间体产生。
②反应速率极少受溶剂极性和酸、碱催化剂的影响,也不受自由基引发剂和抑制剂的影响。
③反应条件一般只需要加热或光照,而且在加热条件下得到的产物和在光照条件下得到的产物具有不同的立体选择性(stereoselectivity),是高度空间定向反应。
④遵循微观可逆性原理。
(4)周环反应主要包括电环化反应(electrocyclic reaction)、环加成反应(cycloaddition)和σ迁移反应(σmigrate reaction)。
2.分子轨道对称守恒原理电环化反应在加热和光照条件下具有不同的立体选向性。
分子轨道对称性是控制这类反应进程的关键因素。
分子轨道对称守恒原理认为:化学反应是分子轨道进行重新组合的过程,在一个协同反应中,分子轨道的对称性是守恒的,即由原料到产物,轨道的对称性始终不变。
因此分子轨道的对称性控制着整个反应的进程。
二、前线轨道理论1.前线轨道理论的概念和中心思想(1)基本概念①最高占有轨道(HOMO):已占有电子的能级最高的轨道。
②最低未占有轨道(LUMO):未占有电子的能级最低的轨道。
③单占轨道(single occupied molecular orbital):有的共轭体系中含有奇数个电子,它的已占有电子的能级最高的轨道中只有一个电子。
用SOMO表示。
单占轨道既是HOMO,又是LUMO。
第五版 有机化学 周环反应

周环反应:不经过活性中间体,只经过环状过渡态
的一类协同反应(Concerted reaction)。
5
周环反应的特点:
Jiaying University
①反应进行的动力,是加热或光照。 ②反应进行时,有两个以上的键同时断裂或 形成,是多中心一步反应。 ③反应时作用物的变化有突出的立体选择性。 ④在反应过渡态中原子排列是高度有序的。 ⑤反应不受溶剂极性的影响,不被碱或酸所催化. 周环反应是分子轨道重新组合的过程,分子 轨道对称性控制化学反应的进程。
例:
CH2 [1,5]氢移位 △ H CD2
CH3 H2C H C9H17
CD2H
CH3 C9H17
[1,7] 氢移位 HO
H2CH
HO
35
Jiaying University
2. [ i , j ] 迁移
(1)[3,3]σ迁移
i j
C C C C C C C C C C
1' 2'
1 1' 2'
1
21
Jiaying University
环加成反应(Cycloaddition Reactions)
一、环加成反应 两分子烯烃或多烯烃生成环状化合物的反应。
hv + [ 2+2 ] 环加成
+
[ 4+2 ] 环加成
括号中的数字表示两个体系中参与反应的电子数。
22
Jiaying University
6
主要的三类周环反应:
1.环加成反应 Diels-Alder反应:
Jiaying University
2.电环化反应:
3.迁移反应
7
周环反应

CH3
CH3
基态
C2(S)
CH3
顺,反
C2(S)
CH3
如
ቤተ መጻሕፍቲ ባይዱ
对旋 C2(A)
不能形成σ-键,对称性禁阻
7
∴丁二烯型衍生物,加热条件下只能得到顺旋环
化的产物,只有顺旋环化,C2,C5的p轨道才能同
位相重叠,转变为环丁烯的σ-轨道,形成稳定的
顺旋产物。
▲ 当在光照条件下,基态丁二烯吸收光子能量,
发生电子跃迁,一个电子由ψ2 激发到 ψ3,ψ3是 HOMO,ψ3对镜面σv是对称的。
顺旋
4
电环化反应的选择规则
Woodward-Hoffmann规则 π-电子数 4n 4n+2 热反应 (△)顺旋 (△)对旋 光反应 (hυ)对旋 (hυ)顺旋
电子数是指链型共轭烯烃的 电子数。
允许是指对称性允许,其含义是反应按协同机理进行时活化能较低。
禁阻是指对称性禁阻,其含义是反应按协同机理进行时活化能很高。
据估计:轨道对称性禁阻途径所需活化能比对称性允许途径
约高63kJ/mol。
10
电环化反应选择规则的应用实例
Example.1:
CH 3
175oC
CH 3 H CH 3 H
顺旋开环
H 3C H
H
CH3 H H3C H
CH 3 H
顺旋开环
H
+
CH 3 CH 3 H
11
H CH 3
主要产物
Example.2:
CH3 CH3 CH3 CH3
对旋(加热)
顺旋(光照)
顺旋:两个键朝同一方向旋转(顺时或反时针旋转 取决于生成产物的稳定性,产生稳定产物的顺旋方
周环反应

实例一:写出下列反应的反应条件:
O
1
+
h
O
h
2
O
+
O
h
3
1,2,3均为π2s +π2s
4
h
π4s+π4s
实例二:写出下列反应的产物:
+ O
O
π4s+π6s
实例三:完成反应式:
H EtOOC
COOCH3
EtOOC H
+பைடு நூலகம்
COOCH3
COOCH3 COOCH3
π2s+π4s
实例四:完成反应式:
近,ΔE越大,体系能量降低越多)。
实例五 写出下列反应的机理
CH2Cl2 / SO2
CH2I
+
Cl3CCO2Ag
-H+
CH3 CH2
+
CH2
+
CH2
+
实例六 写出下列反应的机理
O
O
H3PO4
O
CH3 CH3 O
+
OH
OH
+
OH
O
+
O CH3
+
O CH3 CH3 OH
-H+
O
CH3
1,3-偶极环加成反应
O
O
O O
+
O
O
π4s+π2s
O H H O O O
O
140oC 逆向π4s+π2s
O
O
+ O=C=O
前线轨道理论认为: 两个分子之间的协同反应按照下列三项原则来进行:
曾昭琼《有机化学》(第4版)章节题库(周环反应)【圣才出品】

第17章 周环反应简答题1.下列化合物之一进行分子内环化得一三环酮,(Me 3Si)2NNa 作为缩合剂,另一则不能。
试写出产物的结构。
解释这一差别。
答:活性的差别主要是由于在环化时,原菠酮B 的3位不容易受到亲电试剂的进攻,因此不能环化。
2.答:3.指出下列周环反应过程中的机理名称。
答:(1)[1,5]氢原子的同面迁移(2)[1,3]碳原子的同面迁移(3)[1,5]碳原子的同面迁移(4)[5,5]σ迁移4.下列化合物在100℃时,其谱中只有一个信号,δ=4.22ppm(s ,10H ),给出合理解释。
答:在瞬烯分子中,由于三元环张力较大,分子有通过相邻π键经[3,3]σ迁移反应打开三元环释放张力的趋势。
但由于分子结构的特殊性,一旦[3,3]σ迁移反应完成,在分子的另一端恰巧又产生一个三元环,重新回到起点,使得分子始终不停地进行[3,3]σ迁移:在此过程中,由于所有氢原子都在轮流扮演顶角氢、烯键氢和三元环氢原子的角色,使得它们的信号平均化,因此谱中只在δ=4.22ppm 处出现单峰。
5.解释下列实验事实:答:首先是原料中环丁烯部分发生4π顺旋开环反应,得到己三烯衍生物。
然后发生6π体系对旋成环反应,生成环己二烯衍生物。
具体反应如下:6.解释下列实验事实:答:首先是两个原料之间发生光照条件下的[2+2]环加成反应,生成氧杂环丁烯衍生物,然后该衍生物再发生光照条件下的4π对旋开环反应,生成最终产物。
7.解释下列实验事实:答:原料首先发生逆第尔斯-阿尔德反应,生成邻苯二甲酸二甲酯和环丁烯衍生物,环丁烯衍生物再发生4π顺旋开环反应得到产物。
具体反应如下:8.按题意要求选择正确答案。
(1)下列分子轨道中,哪个是丁二烯的HOMO?(2)下列分子轨道中.哪个是己三烯的LUMO?(3)烯丙基自由基的非键轨道是(4)烯丙基负离子的LUMO是(5)下列四个分子轨道中,能级最高的是(6)戊二烯正离子的HOMO是答:(1)(c)(2)(d)(3)(d)(4)(b)(5)(b)轨道中节面越多,能级越高。
周环反应(04)

[ 2+2 ] 环加成
+
[ 4+2 ] 环加成
电子数。 括号中的数字表示两个π体系中参与反应的π电子数。 环加成反应的立体选择性表示方法: 环加成反应的立体选择性表示方法: 同面加成(s):加成时 键以同侧的两个轨道瓣发生加成。 同面加成 :加成时, π键以同侧的两个轨道瓣发生加成。 异面加成(a):加成时 键以异侧的两个轨道瓣发生加成。 异面加成 :加成时, π键以异侧的两个轨道瓣发生加成。
sp3 CH3 hv sp2 CH3 H CH3 CH3 H CH3 sp3 CH 3
p轨道与 3杂化轨道的相互转化、π电子与σ电子的相互转化, 轨道与sp 杂化轨道的相互转化、 电子与σ电子的相互转化, 轨道与 伴随π键的重新组合。 伴随π键的重新组合。
CH3 H CH3 H
CH3 CH3 H CH3 CH3 H
HOMO*
LUMO
LUMO [ 4+2 ] 环加成光反应禁阻
HOMO*
参与加成的是一个分子的 参与加成的是一个分子的HOMO和另一个分子的 和另一个分子的LUMO, 电子 和另一个分子的 由一个分子的HOMO流向另一个分子的 流向另一个分子的LUMO; 由一个分子的 流向另一个分子的 ; 两分子相互作用时,轨道必须同相重叠; 两分子相互作用时,轨道必须同相重叠; 两作用轨道能量必须接近。 两作用轨道能量必须接近。
[1,5] A H B C 同 面迁移 D A H A D H B C 异面迁移 D H C [1,5] B C A B D
2. H[1, j] σ 迁移 一个氢原子在一个奇数碳共轭体系自由基上的移动。基态时, 一个氢原子在一个奇数碳共轭体系自由基上的移动。基态时, 奇数碳共轭体系含有单电子的非键轨道(NBMO)是前线轨道 是前线轨道, 奇数碳共轭体系含有单电子的非键轨道 是前线轨道 它的对称性决定[1, 迁移的难易和途径。 它的对称性决定 j] σ 迁移的难易和途径。
高中化学竞赛【周环反应】

under thermal condition CH3
CH3 H
H CH3
6
7
CH3
H CH3
H
CH3
H
hv
CH3
H
CH3
H CH3
CH3 H H
H
CH3
CH3
CH3
H
H
hv
H
H
CH3
CH3
CH3 H H
CH3
CH3 H CH3 H
8
CH3
H H CH3
CH3 hv
H H CH3
CH3 CH3
第三部分
反应与机理
§3.7 周环反应
1
一. 电环化反应
共轭多烯环化及其逆反应称为电环化反应。 反应条件: 加热或光照 反应立体化学:与体系的π电子数有关
2
4n 电子共轭体系:
HOMO 热反应:顺旋
4n+2 电子共轭体系
LUMO 光反应:对旋
HOMO 热反应:对旋
LUMO 光反应:顺旋
3
Woodward-Hoffmann 规则
CH3 CH3
CH3
H CH3 H
CH3 hv
H CH3 H
CH3 CH3
CH3 CH3
9
CH3
H hν
CH3 DR
H
H
H3C
CH3 CR
H
CH3 H H
CH3
10
hν
11
12
O
hν
O
O
O OO
Pb(OAc)4
13
H
20°C
H
H
20°C
H
14
有机II练习题-周环反应习题-答案

一、回答问题:
1.前线轨道理论中,HOMO轨道是指(最高占据轨道),LUMO轨
道是指(最低空轨道)。
2.在电环化反应中,光照条件下,具有4n π电子的共轭烯烃以( 对
旋)方式成环?而具有4n+2 π电子的共轭烯烃以(顺旋)方式成环?
3.在Diels-Alder反应中([4+2]环加成),内式产物是由亲双烯体和
双烯体(过渡态中亲双烯体上的取代基接近双烯体上的π轨道)方式形成的,而外式产物由亲双烯体和双烯体(过渡态中亲双烯体上的取代基远离双烯体上的π轨道)方式形成的。
4.为何在下面[4+2]环加成反应中内式产物是主产物?
内式过渡态中亲双烯体的不饱和取代基π电子与双烯体形成的C2-C3之间π电子有次级作用,可降低过渡态能量,因此在动力学控制条件下,内式产物为主产物。
5.在σ-迁移重排反应中,在加热条件下,1,5-H迁移是(同面)迁移,
而1,7-H迁移是(异面)迁移。
二、完成反应:
H 3CO
O
100o C
3.O
H 3CO
O
4.
O
hv
5.
+
CO 2CH 3
H 3CO 2C
N N N
Ph 6.
N N
Ph H 3COOC
COOCH 3
三、 写出下面反应历程:
2.
电环化开环
H
H
顺旋
3.
加热
四、
合成下列化合物。
周环反应7

[2+2]环加成反应,光照是轨道对称性允许的途径,加
热是轨道对称性禁阻的途径。
一、分子间进行协同反应的原则
环加成反应,是分子间的加成环化反应。
两个分子发生环加成反应时,起决定作用的轨道是一个分子的 HOMO和另一个分子的LUMO。 反应过程中电子由一个分子的HOMO流入另一个分子的LUMO 。 当两个分子相互作用形成σ键时,两个起决定作用的轨道必须发 生同位相重叠。 相互作用的两个轨道,能量必须接近,能量越接近,反应越易
加热条件下反应物处于基态:
乙烯B的LUMOψ '2
乙烯A的HOMOψ 1
加热条件下的[2+2]环加成是轨道对称性禁阻的途径。
在光照条件下,一个乙烯(A)的激发态分子HOMO与另一个乙烯
(B)的基态分子LUMO作用。
乙烯B的LUMOψ '2
乙烯A的HOMOψ 2 光照条件下的[2+2]环加成是轨道对称性允许的途径。
进行。
二、[2+2]环加成
乙烯的二聚生成环丁烷的反应,要在光照条件下完成。
+
对称性禁阻的途径。
hν
乙烯的环加成反应,光照是轨道对称物分子的HOMO轨道
与另一反应物分子的LUMO轨道的对称性是否匹配。
一分子的HOMO中已充满电子,要求另一分子的轨道是空的,而
且能量要接近,所以LUMO最合适。
乙烯分子中有一个π键,π分子轨道的图形如下,其中
ψ1是成键轨道,ψ2是反键轨道。
ψ2
LUMO HOMO
ψ 2
ψ 1
HOMO
ψ 1
激发态
基态 乙烯π分子轨道图形 电子分布
两分子乙烯二聚为环丁烷时,两个π键变成两个σ键,成
