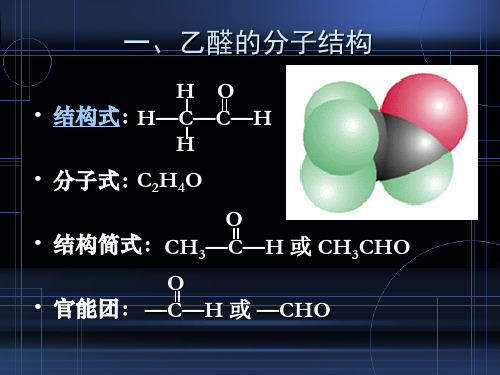
乙醛的结构
乙醛

乙醛【知识要点】1.乙醛的分子组成与结构乙醛的分子式是O H C 42,结构式是,简写为CHO CH 3。
注意 对乙醛的结构简式,醛基要写为—CHO 而不能写成—COH 。
2.乙醛的物理性质乙醛是无色、具有刺激性气味的液体,密度小于水,沸点为C 8.20。
乙醛易挥发,易燃烧,能与水、乙醇、氯仿等互溶。
注意 因为乙醛易挥发,易燃烧,故在使用纯净的乙醛或高浓度的乙醛溶液时要注意防火。
3.乙醛的化学性质从结构上乙醛可以看成是甲基与醛基()相连而构成的化合物。
由于醛基比较活泼,乙醛的化学性质主要由醛基决定。
例如,乙醛的加成反应(碳氧双键)和氧化反应(醛基氢),都发生在醛基上。
(1)乙醛的加成反应乙醛分子中的碳氧双键能够发生加成反应。
例如,使乙醛蒸气和氢气的混合气体通过热的镍催化剂,乙醛与氢气发生加成反应:说明:①在有机化学反应中,常把有机物分子中加入氢原子或失去氧原子的反应叫做还原反应。
乙醛与氢气的加成反应就属于还原反应。
②从乙醛与氢气的加成反应也属于还原反应的实例可知,还原反应的概念的外延应当扩大了。
(2)乙醛的氧化反应在有机化学反应中,通常把有机物分子中加入氧原子或失去氢原子的反应叫氧化反应。
乙醛易被氧化,如在一定温度和催化剂存在的条件下,乙醛能被空气中的氧气氧化成乙酸:注意 ①工业上就是利用这个反应制取乙酸。
②在点燃的条件下,乙醛能在空气或氧气中燃烧。
乙醛完全燃烧的化学方程式为: O H CO O CHO CH 22234452+−−→−+点燃乙醛不仅能被2O 氧化,还能被弱氧化剂(如银氨溶液和新制备氢氧化铜悬浊液)氧化。
银氨溶液的制备: 在洁净的试管里加入1 mL 2%的3AgNO 溶液,然后一边摇动试管,一边逐滴滴入2%的稀氨水,至最初产生的沉淀恰好溶解为止(此时得到的溶液叫做银氨溶液)。
再滴入3滴乙醛,振荡后把试管放在热水中温热。
实验现象 不久可以看到,试管内壁上附着一层光亮如镜的金属银。
《乙醛》 讲义

《乙醛》讲义一、乙醛的基本信息乙醛,化学式为 C₂H₄O,结构简式为 CH₃CHO,是一种醛类有机化合物。
它在常温常压下是一种无色、易挥发、具有刺激性气味的液体。
乙醛能与水、乙醇、乙醚等多种有机溶剂混溶。
二、乙醛的物理性质1、外观与气味乙醛为无色透明液体,具有强烈的刺激性气味。
这股气味类似于水果熟透或者发酵的味道。
2、沸点和熔点乙醛的沸点约为 208℃,熔点约为-1235℃。
由于其沸点较低,所以在常温下容易挥发。
3、密度相对密度为 07834(水= 1),这意味着它比水的密度小。
4、溶解性乙醛能与水、乙醇、乙醚等有机溶剂以任意比例互溶。
三、乙醛的化学性质1、加成反应乙醛分子中的碳氧双键可以发生加成反应。
例如,在催化剂的作用下,乙醛可以与氢气发生加成反应,生成乙醇。
CH₃CHO + H₂ → CH₃CH₂OH2、氧化反应(1)乙醛可以被氧气氧化为乙酸。
2CH₃CHO + O₂ → 2CH₃COOH(2)乙醛也能被一些弱氧化剂氧化,比如银氨溶液和新制的氢氧化铜悬浊液。
与银氨溶液反应,会产生银镜现象,化学方程式为:CH₃CHO + 2Ag(NH₃)₂OH → CH₃COONH₄+2Ag↓ + 3NH₃+ H₂O与新制的氢氧化铜悬浊液反应,会产生砖红色沉淀,化学方程式为:CH₃CHO + 2Cu(OH)₂+NaOH → CH₃COONa + Cu₂O↓ +3H₂O3、缩合反应乙醛在一定条件下可以发生自身缩合反应,生成β羟基丁醛。
2CH₃CHO → CH₃CH(OH)CH₂CHO四、乙醛的制备方法1、乙醇氧化法乙醇在催化剂(如铜或银)的作用下,加热可以被氧化为乙醛。
这是工业上制备乙醛的常用方法之一。
2CH₃CH₂OH + O₂ → 2CH₃CHO + 2H₂O2、乙烯氧化法乙烯在催化剂(如钯盐)和氧气的作用下,可以被氧化为乙醛。
CH₂=CH₂+ 1/2 O₂ → CH₃CHO五、乙醛的用途1、化工原料乙醛是合成乙酸、乙酸酐、季戊四醇、丁醇、三氯乙醛等多种有机化工产品的重要原料。
选修5 第三章 第二节 乙醛

4、乙醛与氢气在一定条件下反应生成乙醇, 此反应属于: AC A、还原反应 B、氧化反应 C、加成反应 D、消去反应 5、下列有机物在反应中被氧化的是 BD A、CH2=CH2转化成CH3CH3 B、CH3CH2OH转化成CH3CHO C、CH3CHO转化成CH3CH2OH D、CH3CHO转化成CH3COOH
H
O
R-CH-C-H
R-CH-C-H
△ -H2O
O R-CH2-CH=C-C-H R O
以乙烯合成1-丁醇 资料36页 15题 现有一化合物A,是由B、C两物质通 过上述原理的反应生成的。试根据A的结 构式写出B、C的结构式 CH3 CH3CHO A:CH3 C CH2CHO O OH CH3 C CH3
聚甲醛, 假象牙,是一 种很好的有机塑料 nHC≡CH
一定条件
— [ CH=CH— ]n 聚乙炔,导电塑料
苯酚与甲醛的缩聚反应
OH
n
O + n HCH
OH
]n -CH2-
缩聚反应——单体间相互反应生成高分子 化合物的同时还生成小分子的反应 条件: 每一种单体必须有能够形成两条 半键的原子或原子团
-
1mol 甲醛~
2
mol Cu2O
若分子中有1个醛基: 若1个分子中有 1mol该醛 —— 2mol Ag 多个醛基,依 若分子中有2个醛基: 次类推 1mol该醛 —— 4mol Ag 所以可根据醛的物质的量和生成的Ag 的物质的量的关系,可知醛分子中所含醛 基的个数 但需注意:甲醛(HCHO)是一元醛,分子中 只有1个醛基,但在发生氧化反应时,相当 于二元醛,如与银氨溶液反应时: 1mol HCHO —— 4mol Ag
了解 2、乙醛也可和HX、HCN加成 O OH CH3CH + HX
乙醛讲课

又有还原性能被O 又有还原性能被 2氧化
(2)乙醛的还原性 ) ①乙醛在点燃条件下与氧气的反应
点燃 4CO +4H O 2 2
2CH3CHO+5O2 CHO+
被氧气氧化
醛基中碳氢键较活泼,能被氧化成相 醛基中碳氢键较活泼,能被氧化成相 应羧基
②乙醛的催化氧化
2CH3CHO+O2 催化剂 2CH3C、乙醇催化氧化法 、
2CH3CH2OH + O2
Cu或Ag 或 △
2CH3CHO + 2H2O
2、乙炔水化法 、
CH CH + H2O
催化剂
CH3CHO
3、 3、乙烯氧化法
2CH2 CH2 + O2
催化剂
加热 加压
2CH3CHO
一、甲醛结构 : 分子式:CH2O 分子式: 结构简式: 结构简式:HCHO
三、甲醛的化学性质 甲醛中有2个活泼氢可被氧化 甲醛中有 个活泼氢可被氧化
①、HCHO+H2 + ②、HCHO+O2 +
催化剂 催化剂
CH3OH CO2 ↑ +H2O CO2 ↑
③、HCHO+4Ag(NH3)OH +
+8NH3 ↑ +4Ag ↓ +3H2O ④、HCHO+4Cu(OH)2 + CO2 ↑ +2Cu2O ↓ +5H2O
此外,醛类都可以发生银镜反应, 此外,醛类都可以发生银镜反应,也 可以和新制Cu(OH)2反应 可以和新制
②、加成反应(还原反应) 加成反应(还原反应)
O || R-C-H+H2 - - +
催化剂
R-CH2-OH -
③、醛既有氧化性,又有还原性 醛既有氧化性,
醇
氧化 还原
醛
氧化
羧酸
三、醛基的检验 哪些有机物中含有—CHO? 1、*哪些有机物中含有 、 哪些有机物中含有 ? 醛、HCOOH、HCOOR、 、 、 葡萄糖、 葡萄糖、麦芽糖
乙醛化学式结构式

乙醛化学式结构式及其相关性质和应用1. 乙醛的基本信息乙醛(英文名:acetaldehyde),又被称为醋醛,分子式为CH₃CHO,是一种醛类有机化合物。
乙醛是一种无色、易燃、易挥发的液体,具有辛辣、刺激性的臭味。
乙醛可溶于水,混溶于乙醇、乙醚、苯、甲苯、丙酮等有机溶剂。
由于乙醛含有羰基基团,且与羰基相连的碳上具有α氢,所以乙醛容易发生加成、氧化、还原等反应。
乙醛是一种重要的化工中间体,可通过氧化反应合成乙酸、乙酸酐等化合物,还可以通过缩合反应制得丁醇、季戊四醇等化合物,还可以合成乳酸、吡啶等化合物。
乙醛对人体的眼、鼻、呼吸道等有强烈的刺激作用,长时间接触可引发中毒。
2. 乙醛的化学结构乙醛是带有一个羰基的醛类化合物,乙醛分子由一个醛羰基和一个甲基构成。
乙醛甲基中的碳原子以sp杂化轨道成键,和所有的醛基化合物一样,乙醛羰基中的碳原子以三个sp杂化轨道形成三个σ键,其中一个是和氧形成的,这三个键处于同一平面,碳原子的一个p轨道和氧原子的一个p轨道重叠形成一个π键,与σ键所成的平面垂直,因此羰基的碳氧双键是由一个σ键和一个π键形成的。
羰基中氧原子的电负性大于碳原子,因此羰基是一个极性基团,具有偶极矩,偶极矩的负极在氧原子这一端,正极在碳原子这一端,因此羰基中的碳原子带有部分正电荷,氧原子带有部分负电荷。
3. 乙醛的理化性质3.1 物理性质乙醛是一种无色有刺激性臭味的液体,常温下密度为0.785 g/mL,沸点为20.8℃,熔点为-123.4 °C。
乙醛可以溶于水,混溶于乙醇、乙醚、苯、甲苯、丙酮等有机溶剂。
乙醛的闪点是-38 ℃,自燃温度为175 °C。
3.2 化学性质乙醛含有羰基,具有醛类化合物的某些化学性质,可以发生亲核加成、氧化、还原等反应。
乙醛的甲基与羰基相连,因此甲基碳上的氢原子具有一定的活泼性,可以发生卤代、卤仿等取代反应。
3.2.1 加成反应乙醛与格氏试剂加成有机镁试剂(格氏试剂)容易对含羰基的化合物进行亲核加成反应,在无水无氧的条件下,格氏试剂对乙醛的加成反应如下:CH₃CHO + CH₃MgBr → CH₃CH (OMgBr)CH₃ — H₃O⁺ → CH₃CH (OH)CH₃乙醛与亚硫酸氢钠加成亚硫酸氢钠与乙醛反应可以生成一种溶于水的盐。
乙醛的化学式和结构式-概述说明以及解释

乙醛的化学式和结构式-概述说明以及解释1.引言1.1 概述乙醛是一种重要的有机化合物,它在化工、医药、食品等领域都有着广泛的应用。
乙醛具有独特的化学性质和结构特征,其化学式为CH3CHO,结构式为CH3-CHO。
乙醛在化学反应中扮演着重要角色,其重要性不可忽视。
本文将深入探讨乙醛的定义、性质、化学式和结构式,以及乙醛在化学领域的应用和未来发展方向。
通过对乙醛的全面了解,可以更好地认识和利用这种重要的有机化合物。
文章结构部分的内容应包括对整篇文章的组织和安排进行说明。
在这篇关于乙醛的化学式和结构式的文章中,我们将按照以下结构展开讨论:1. 引言部分:1.1 概述:简要介绍乙醛的基本信息和重要性。
1.2 文章结构:介绍本文的组织结构和讨论内容。
1.3 目的:明确本文撰写的目的和意义。
2. 正文部分:2.1 乙醛的定义和性质:详细介绍乙醛的定义、性质和特点。
2.2 乙醛的化学式:分析乙醛的化学式及其组成元素。
2.3 乙醛的结构式:探讨乙醛的分子结构和构造特点。
3. 结论部分:3.1 总结乙醛的重要性:概括乙醛在化学领域的重要作用。
3.2 乙醛在化学领域的应用:列举乙醛在实际应用中的具体场景和用途。
3.3 展望乙醛的未来发展:展望乙醛在未来的应用前景和发展趋势。
通过以上结构安排,我们将全面深入地探讨乙醛的化学式和结构式,展示其重要性和潜在应用价值,为读者提供详尽的信息和知识内容。
1.3 目的本文的目的在于深入探讨乙醛这一化合物的化学式和结构式,并分析其定义、性质以及在化学领域的应用。
通过对乙醛的研究,我们可以更加全面地了解这一化合物的特点和重要性,为化学领域的研究提供更为深入的参考和理解。
同时,通过展望乙醛的未来发展,可以为相关研究的方向和发展趋势提供一定的参考和借鉴,促进乙醛在化学领域的更广泛应用和推广。
通过本文的研究,旨在为读者提供关于乙醛的详尽信息,增强对该化合物的理解和认识。
2.正文2.1 乙醛的定义和性质乙醛,化学式为CH3CHO,又称乙醛醛,是一种有机化合物,属于醛类化合物。
乙醛的分子结构
工业制乙酸
乙醇 氧化(脱氢)乙醛 氧化(加氧)乙酸
还原(加氢)
三、乙醛的化学性质
2、乙醛的氧化反应 b 燃烧 2CH3CHO + 5O2 点燃 4CO2 + 4H2O
三、乙醛的化学性质
2、乙醛的氧化反应
c 被弱氧化剂氧化
I 银镜反应
AgNO3溶液 + 稀氨水
生成白色沉淀
继续滴加氨水 沉淀恰好 完全溶解
银氨溶液
滴入3滴乙醛 试管内壁上附有一层 水浴加热 光亮如镜的金属银
1、检验醛基的存在 2、工业上利用这个反应,把银均匀地镀在玻璃上
制镜或者保温瓶胆
三、乙醛的化学性质
2、乙醛的氧化反应
c 被弱氧化剂氧化
制银氨溶液:
AgNO3 + NH3·H2O = AgOH↓+ NH4NO3
AgOH + 2NH3·H2O = [Ag(NH3)2]OH + 2H2O
加成反应 燃烧
CO2、H2O
催化氧化
氧化反应
银镜反应 羧
被弱氧化剂氧化
酸
Cu(OH)2 能使高锰酸钾、溴水褪色
精品课件!
作业
• P113~114 一、二、三、四(三、四做在 作业本上)
三、乙醛的化学性质
1、乙醛的加成反应
HH H—C—C=O + H2
Ni △
HH H—C—C—OH
H
HH
把有机物分子中加入氢原子或失去氧
原子的反应叫做还原反应。
把有机物分子中加入氧原子或失去氢 原子的反应叫做氧化反应。
三、乙醛的化学性质
2、乙醛的氧化反应
a 催化氧化
O
催化剂
2CH3—C—H + O2 △ 2CH3COOH
(一)乙醛的结构(1)41页PPT
(三)乙醛的化学性质:
2、氧化反应(醛基的C-H中加O成羧基) (2)新制Cu(OH)2悬浊液:[演示] 过量的NaOH溶液中滴加几滴CuSO4溶液。
Cu2++2OH-= Cu(OH)2↓ 红色沉淀反应-费林反应:
CH3CHO + 2Cu(OH)2 2CH3COOH +红Cu色2O沉↓淀+ 2H2O
• 福尔马林是质量分数含___________的甲 醛水溶液。
• 【思考】下列物质属于纯净物的是( ) • A.甲醛 B.福尔马林 C.石碳酸
D.沼气
3.列举甲醛的重要用途:
• 4.甲醛的化学性质(写出反应的化学方程 式):
• (1)与氢气加成____________________ • (2)银镜反应
(一)乙醛的结构(1)
51、山气日夕佳,飞鸟相与还。 52、木欣欣以向荣,泉涓涓而始流。
53、富贵非吾愿,帝乡不可期。 54、雄发指危冠,猛气冲长缨。 55、土地平旷,屋舍俨然,有良田美 池桑竹 之属, 阡陌交 通,鸡 犬相闻 。
乙醛 醛类
一、乙醛:
(一)乙醛的结构:
结构式:
官能团醛基本身 有一个C原子, 命名时包含在主 链内。
(3)乙炔水化法
• 用硫酸汞做催化剂 HC≡CH +H2O→CH3CHO
五、醛类
• (一)甲醛 • 1.甲醛的分子式_________,结构简式
________。 • 【思考】(1)从结构上看甲醛与其他醛
类,有什么区别? • (2)在甲醛中的两个氢原子有没有区别?
2.甲醛的物理性质
• 甲醛又叫________,_______色________ 气味的________体。溶解性_________。
乙醛的分子结构

△
CH3COONH4
解释: 银被还原,乙醛被氧化成乙酸, 解释: 银被还原,乙醛被氧化成乙酸,乙酸又和氨 反应生成乙酸铵。 反应生成乙酸铵。
银镜反应注意事项
(1)试管内壁必须洁净; )试管内壁必须洁净; (2)60℃水浴加热,不能用酒精灯直接 ) ℃水浴加热, 加热; 加热; (3)加热时不可振荡和摇动试管; )加热时不可振荡和摇动试管; (4)须用新配制的银氨溶液,氨水不能 )须用新配制的银氨溶液, 过量(防此生成易爆炸的物质); 过量(防此生成易爆炸的物质); (5)乙醛用量不可太多; )乙醛用量不可太多; (6)实验后,银镜用 浸泡, )实验后,银镜用HNO3浸泡,再用水 洗。
燃烧 催化氧化 被弱氧化剂氧化 Cu(OH)2 能使高锰酸钾、 能使高锰酸钾、溴水褪色
CO2、H2O
银镜反应
羧 酸
作业
P113~114 一、二、三、四(三、四做在 作业本上)
能被还原成醇 甲醛的化学性质 与乙醛相似 能被氧化成羧酸 能起银镜反应, 能起银镜反应,能与新制的 氢氧化铜反应
用途:浸制标本,制药,香料,燃料。 用途:醛类:含有醛基 的有机物
饱和一元醛的通式: 饱和一元醛的通式: CnH2n+1CHO 或者: 或者: CnH2nO 醛类具有和乙醛类似的化学性质: 醛类具有和乙醛类似的化学性质: 加成反应 氧化反应
三、乙醛的化学性质
2、乙醛的氧化反应 c 被弱氧化剂氧化 Ⅱ 和Cu(OH)2反应
现象:试管内有红色沉淀产生 红色沉淀产生 现象:试管内有红色沉淀 注意: 注意:a 氢氧化铜必须 新制; 新制;b 直接加热
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4 CH3CHO + 2Cu(OH)2 2Cu(OH) + 2H2O
高二化学乙醛、醛类知识精讲

高二化学乙醛、醛类【本讲主要内容】乙醛、醛类乙醛的结构、物理性质、化学性质、制法和用途;醛类的结构、通性和检验方法;对照醛的内容简要了解其同分异构体酮的知识。
【知识掌握】 【知识点精析】 一. 乙醛1. 分子式结构式结构简式官能团 C 2H 4OC H HHCHOH 3C C H O或CH 3CHO醛基2. 物理性质 乙醛是无色、具有刺激性气味的液体,密度比水小,沸点很低(20.8℃,比乙醇低得多),易挥发,易燃烧,能跟水、乙醇、氯仿等互溶。
3. 化学性质 (1)加成反应NiOH CH 3-C+H 2CH 3CH 2OH注:① 该反应实质为加氢还原反应。
有机化学反应中,通常把有机物分子中加入氢原子或失去氧原子的反应叫做还原反应,而加氧去氢的反应称为氧化反应。
如乙醇的催化氧化。
② 醛基与H 2的加成是在分子中引入—OH 的一种方法。
但工业上并不用此法合成乙醇。
③ C =O 键和C =C 键不同,只能与H 2加成,但不能与溴水加成。
(2)氧化反应① 剧烈氧化——燃烧2CH 3CHO+5O 2点燃4CO 2+4H 2O② 催化氧化2CH 3CHO+O 2催化剂2CH 3COOH③ 被弱氧化剂氧化 a. 银镜反应 Ag ++NH 3·H 2O =AgOH ↓+NH 4+AgOH+2NH 3·H 2O =[23)(NH Ag ]++OH -+2H 2O CH 3CHO+223)(NH Ag ]++2OH-水浴2Ag ↓+CH 3COO -+NH 4++3NH 3+H 2O这个反应叫银镜反应。
银镜反应常被用于检验醛基的存在。
也常用于测定有机物中醛基的数目。
b. 与新制2)(OH Cu 悬浊液反应CuSO 4+2NaOH =2)(OH Cu ↓+Na 2SO 4 22)(OH Cu +CH 3CHOCu 2O ↓+CH 3COOH+2H 2O乙醛与新制2)(OH Cu 悬浊液的反应也可用于检验醛基的存在。
醛化学式及结构式

醛化学式及结构式醛是一类含有羰基(C=O)的有机化合物,通式为R-CHO。
其中R代表烃基,可以是烷基(含有烷基基团),也可以是芳基(含有芳族基团)。
醛的命名通常以醛作为词尾,如甲醛、乙醛等。
醛常见的结构式有以下几种:线性结构、环状结构和酸醛(醛羧酸)结构。
一、线性醛的结构式:1. 甲醛(HCHO):该化合物为最简单的醛,由单个碳原子和一个氢原子组成。
其结构式为:HCHO。
2. 乙醛(CH3CHO):该化合物由两个碳原子、四个氢原子和一个氧原子组成。
其结构式为:CH3CHO。
3. 丙醛(CHO-CH2-CH3):该化合物由三个碳原子、六个氢原子和一个氧原子组成。
其结构式为:CHO-CH2-CH3。
二、环状醛的结构式:1. 环戊醛(C5H8O):该化合物由一个五元环状结构和一个羰基组成。
其结构式为:O||CH2--CH-[CH2]-CH2 ||CH2--CH-[CH2]-CH2 2. 环己醛(C6H10O):该化合物由一个六元环状结构和一个羰基组成。
其结构式为:O||CH2-CH2-CH2-CH2-CH2-[CH2]三、酸醛(醛羧酸)的结构式:1. 甲酸(HCOOH):该化合物由一个羰基和一个羧基组成。
其结构式为:O||H-[C=O]-OH2. 乙酸(CH3COOH):该化合物由两个碳原子、两个羰基和一个羧基组成。
其结构式为:O||CH3-[C=O]-OH||CH3以上仅为醛的一些典型结构式示例,实际上醛具有很多不同的结构式。
因为醛以其独特的结构和性质在有机合成、药物化学、食品添加剂等领域有着广泛的应用。
通过研究醛的结构式,可以更好地理解其性质与反应机制。
(一)乙醛的物理性质

A 10个 B 100个
C 20个 D 200个
6、 简解
M(Cu2O)=144g/mol
n(Cu2O)=14.4g÷144g/mol=0.1mol
CH3CHO+2Cu(OH)2
CH3COOH+Cu2O↓+2H2O
——CHO ~ Cu2O
1 :1
x=0.1mol 0.1mol
CH3CHO+2Ag(NH3)2OH ——CHO ~ 2Ag
CH3CHO+2[Ag(NH3)2]OH CH3COONH4+2Ag↓+3NH3+H2O
实验注意事项: (1)试管内壁应洁净。 (2)银氨溶液必须新配制,不可久置,用稀氨水且 不能过量. (防止生成易爆物质) (3)加热时不能振荡试管和摇动试管。 (4)必须用水浴加热,不能用酒精灯直接加热。
(三)乙醛的化学性质:
[ CH3COOH ]
氧化反应(加氧去氢)
3、醛基的定量分析
—CHO~2Ag n : 2n
-CHO~2Cu(OH)2~Cu2O n : 2n : n
板书设计 第五节 乙醛 醛类
一乙醛的化学性质
1、与H2加成反应(还原反应) CH3CHO+H2催化剂 CH3CH2OH
乙醛 醛类
一、乙醛:
(一)乙醛的物理性质: 无色,有刺激性气味的液体,密度比水小, 沸点20.8℃,易挥发,能和水、乙醇、 乙醚、氯仿等互溶。
(二)乙醛的结构: 结构式:
官能团醛基本身 有一个C原子, 命名时包含在主 链内。
O
H
官能团:-CHO 或-C-H 或-C=O
╳ ╳ 不能写成-COH 或-CH=O
酸性溶液或溴水
乙醛,醛类

3、制法: 、制法: ①乙烯氧化法: 乙烯氧化法:
催化剂
2CH2=CH2 + O2
加热加压
2CH3CHO
②乙炔水合法: 乙炔水合法: CH≡CH + H2O ≡
催化剂
CH3CHO
醛 类
一、醛 1、定义:烃基和醛基相连而构成的化合物。 定义:烃基和醛基相连而构成的化合物。 2、通式:RCHO(醛基碳一定在第一个位置) 通式: (醛基碳一定在第一个位置) 饱和一元醛通式: 饱和一元醛通式:CnH2n+1CHO 或 CnH2nO 饱和一元醇通式: 饱和一元醇通式:CnH2n+1OH 或 CnH2n+2O 练习:判断下列物质的类别? 练习:判断下列物质的类别? C 2H 4O
催化剂 CH3CHO + H2 → CH3CH2OH (加成反应) 加成反应) △ 催化剂 RCHO + H2 → RCH2OH △
O 催化剂 ‖ → △ CH3-C-CH3 + H2 H - H 醛和酮都能与H 醛和酮都能与 2加成生成醇
CH3-CH-CH3 H H H OH
2、氧化反应(醛基中C—H键断开,再加氧) 、氧化反应(醛基中 键断开, 键断开 再加氧) O O 被氧化 ‖ ‖ 氧化剂 羧酸 醛 R—C—H → R—C—O—H
催化剂 + n HCHO → △
OH
[
CH2— + nH2O ]n
酚醛树脂 反应机理: 甲醛断 亮键) 反应机理:①甲醛断C=O双键 (亮键) 双键 苯酚断羟基相邻的苯环上的C—H键 ②苯酚断羟基相邻的苯环上的 键 缩聚反应有小分子生成,加聚反应没有。 缩聚反应有小分子生成,加聚反应没有。 3、甲醛应用:合成酚醛塑料 电木 、防腐剂杀菌剂 电木)、 、甲醛应用:合成酚醛塑料(电木
乙醛的结构

乙醛的结构
乙醛(乙醛)是由两个氢原子和一个氧原子组成的有机化学物质,符号为CH3CHO或HCHO。
它在常温常压下是无色无味的液体。
它的分子结构如下
H–C–O–H
/
H H
这种结构形式是分子中的氢原子和氧原子通过单键双键形成的
单一碳原子,碳原子上有三个氢原子,一个氧原子,这种结构形式也称为碳氧式有机物。
它有一个氢原子的IUPAC名称是甲醛,分子式为CH3-CHO。
乙醛具有一个碳-氧双键(C=O),因此它也被称为一种碳氧双键化合物,并且乙醛在水溶液中具有极佳的溶解性,同时它也具有易挥发性。
- 1 -。
乙醛和丙醛的结构-概述说明以及解释

乙醛和丙醛的结构-概述说明以及解释1.引言1.1 概述概述乙醛和丙醛是两种常见的有机化合物,它们都属于醛类化合物。
醛类化合物是含有醛基(-CHO)的有机化合物,它们在许多化学和生物过程中具有重要的作用。
乙醛的结构简单而紧凑,由一个碳原子与一个醛基(-CHO)组成。
乙醛的分子式为C2H4O,它是一种无色液体,具有特殊的刺激性气味。
乙醛广泛应用于化学工业中,用于制备各种化学品,如有机合成中的中间体和溶剂。
此外,乙醛还可用作某些食品添加剂,例如味精的原料。
丙醛与乙醛相比稍复杂一些,它的结构由一个碳原子和一个醛基(-CHO)组成,加上一个甲基基团(-CH3)。
丙醛的分子式为C3H6O,它也是一种无色液体,具有特殊的气味。
丙醛在医药和农药工业中广泛应用,也可用于有机合成和溶剂。
乙醛和丙醛具有一些相似的物理性质和化学性质,但它们也存在一些差异。
通过比较它们的结构、物理性质和化学性质,我们可以更好地了解它们各自的特点和应用领域。
本文将从乙醛和丙醛的结构描述、物理性质、化学性质以及两者之间的区别等方面进行详细介绍和分析。
最后,我们将总结乙醛和丙醛的结构特点,并展望它们在未来的应用前景。
通过这篇文章,读者将能够更全面地了解乙醛和丙醛的结构和性质,以及它们在化学和工业领域的重要性。
1.2 文章结构文章结构部分的内容可以包括以下内容:文章结构部分是对整篇文章的组织和安排进行说明,主要是为读者提供一个清晰的导引,使读者能够更好地理解和把握文章的内容和逻辑结构。
本文采用以下结构:引言部分包括文章的概述、文章结构、文章的目的和总结。
在概述部分,将简要介绍乙醛和丙醛的结构以及它们在化学领域中的重要性和应用。
在文章结构部分,将详细介绍每个章节的内容和组织方式,以便读者能够清楚地了解整篇文章的结构。
在目的部分,说明文章撰写的目的是为了深入探讨乙醛和丙醛的结构,并对其进行比较分析。
最后,在总结部分,将简要总结乙醛和丙醛的结构特点和应用前景,以及本文的主要观点和结论。
乙醛的结构视图分析方法

乙醛的结构视图分析方法
乙醛的结构可以通过以下几种视图分析方法进行分析:
1. 线结构:乙醛的线结构表示乙醛的原子连接顺序和原子之间的键连接关系。
乙醛的线结构中包括一个碳原子和一个氧原子,碳原子与氧原子之间有一个双键,碳原子还与两个氢原子相连。
2. 键线结构:乙醛的键线结构表示乙醛中的化学键和原子之间的连接关系。
乙醛的键线结构中可以看到碳原子与氧原子之间的双键、碳原子与一个氢原子之间的单键、碳原子与另一个氢原子之间的单键。
3. 空间结构:乙醛的空间结构表示乙醛中原子的空间排列方式。
乙醛的空间结构是一个平面分子,氧原子和碳原子在同一个平面上,氢原子位于该平面之上。
4. 骨架结构:乙醛的骨架结构表示乙醛中的主要碳原子框架,即去除所有氢原子后的结构。
乙醛的骨架结构只包括碳原子和氧原子,无其他原子。
5. 分子式:乙醛的分子式表示乙醛中所有原子的数量和种类。
乙醛的分子式为C2H4O。
这些方法可以帮助我们全面了解乙醛的结构和组成,有助于进一步理解乙醛的性质和反应。
乙醛的结构与性质

B. HOCH2-CH-CH3 OH
√D.CH3CH2OH
5、一定量的某饱和一元醛发生银镜反应,析出21.6g银,
等量CD的)此醛完全燃烧时生成CO2 0.89L,则此醛是(
A、乙醛
B、丙醛
C、丁醛
D、2-甲基丙醛
8、下列有机物中,不仅能发生消去反应,而 且催化氧化产物还能发生银镜反应的是 BC
2CH3CHO + O2
Cu △
2CH3COOH
O= O=
⑵ —C—H 醛还原(加氢) ,断C=O键:
R—C—H + H2
Ni △
R—CH2—OH
(四)乙醛的用途
乙醛是有机合成工业中的重要原料, 主要用来生产乙酸、丁醇、乙酸乙 酯等。如:
2CH3CHO + O2
催化剂
2CH3CO OH乙酸
醛类
O
与银氨溶液的反应
• 在管洁,净一A的边g试逐++管滴N里滴H加入3·2入H%12的mO稀L=2氨%A水的g,AOg至NHO最3溶↓初+液产N,生H然的4后+沉一淀边恰摇好动溶试解 • 或A为荡:g止后不AO(把久gHO这试可+H时管以2+得放看N2到在到HN的热,3H·溶水试H3液中·管2HO叫温内2=O做热壁=银。[上A氨附[gA溶着(Ng液一(HN)层3H)。光23]再亮)+2+滴如]OO入镜HH3的滴-++金乙22属HH醛银22,OO。振
乙醛被还原为乙醇
注意:和OC=C双键不同的是,通O-常H情 况加成下CH反,3乙应-C。醛-H不能+和HH-HX、XC2、HH3-2CHO-发H 生
醛的性质与应用

2%CuSO4
乙醛
5%NaOH
现象:生成砖红色沉淀
加热
NaOH+ CH3CHO + 2Cu(OH)2
CH3COONa
+ Cu2O↓+3H2O
注意: 此反应必须在碱性条件下进行
应用:
此反应也用于醛基的检验和测定
(1)检验柠檬醛中的醛基的方法是
。
(2)检验柠檬醛中的C=C的方法是
。
(3)实验操作中哪一个官能团应先检验?
(1)加入银氨溶液后,水浴加热有银镜生成,可证明醛基存在; (2)在加银氨溶液氧化-CHO后,调PH至中性再加入溴水,看是否褪色; (3)由于Br2也以能氧化-CHO,所以必须先用银氨溶液氧化-CHO,又 因为氧化后溶液为碱性,可能还有过量的银氨溶液,它也能使溴水褪色且形 成淡黄色浑浊,不利于现象的观察,所以应先酸化后再加溴水检验双键。
水浴
CH3CHO + 2Ag(NH3)2OH → CH3COONH4 + 2Ag↓+ 3NH3 + H2O
1.试管要洁净
2.水浴加热时不可振荡和摇动试管 3.银氨溶液现用现制,不能久置 试管内壁银镜的处理:稀硝酸清洗
应用:用于醛基的定性和定量检测,工业上用来制瓶胆和镜子
c.与新制氢氧化铜的反应
新制Cu(OH)2的配制方法: 操作:在试管里加入2mL 5%NaOH溶液,滴 入3~4滴2%CuSO4溶液,振荡后加入0.5mL 乙醛溶液,加热。
(1)还原 (2)氧化
a甲醛发生银镜反应
HCHOபைடு நூலகம்
4Ag
b甲醛与新制的氢氧化铜反应
乙醛和醛类

穿越马路时,印地安人对纽约朋友说:"你听到蟋蟀的叫声了吗?" 纽约朋友笑着说:"您大概坐飞机太久了,这机场的引道连接到高速公路,怎么可能有蟋蟀的叫声呢?" 又走了几步路,印地安人又说:"真的有蟋蟀!我清楚地听到了它们的声音。" 纽约朋友笑得更大声了:"您瞧!
那边正在施工打洞,机械的噪音那么大,怎么会听得到蟋蟀叫声呢?" 印地安人二话不说,走到斑马线旁安全岛的草地上,翻开一段干枯的树干,招呼纽约朋友观看那两只正在高歌的蟋蟀! 纽约朋友当场露出了不可置信的表情,直呼不可能:"你的听力真是太好了,能在如此吵闹的环
有时她睡在床上,双眼无神地看着天花板,嘴里就喊着外公的名字。可她却不认得外公的人,就算外公站在她身边,她还会用拐杖打外公。但我们知道外婆的心里还是有外公的,毕竟外公是她这辈子最爱的人。 后来,外婆的病情变得更不乐观了,需要住院。一开始,外婆死也不肯去医院,
最后我们和她说外公在医院里等她,她这才妥协了。一路上她还不住地问我们,医院到了没,她要见外公。其实那时外公就坐在她的旁边。 到医院后,外婆渐渐喜欢上了吃橙子,并且只要外公喂她。我们还以为她认识外公了。谁知她说,"我就要他喂,他喂的样子像老头子。" 外婆得
如果我们能够清楚地知道与了解,再加上专注地倾听,就可以清晰地听到: 自己生命心灵深处的愿望、责任、自由与博爱。 自然循环进化跃升中的变异、无待、齐物与大道。 下雨 ? 小时候听过一个笑话,一直记着,但是
一直也没弄明白那其中的玄妙。说是有一个傻子,低着头在雨中走,慢腾腾地,就那么在雨中走。路人头上顶着各式各样的雨具或者权充雨具的东西急急忙忙地从他身边跑过,一边跑一边还喊:嗨,傻子,快点往前跑啊,下雨呢!傻子不紧不慢地回答说:前面不是也在下雨吗?因为天性愚钝,
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(2)与新制氢氧化铜反应
CH3CHO +2Cu(OH)2 CH3COOH + Cu2O+ 2H2O
(3)与氧气的反应
2CH3CHO + 催化剂 2CH3COO
O2
H
(4)与酸性KMnO4溶液及Br2水反应
酸性KMnO4溶液及Br2水都褪 色
加成
一、做银镜反应的注意几个事项
1.试管内壁应洁净 2.必须用水浴加热,不能用酒精灯加热。 3.加热时不能振荡试管和摇动试管。 4.配制银氨溶液时,氨水不能过多或过少(只能
乙醛脱氢酶的作用下将乙醛氧化为乙酸,并进
一步转化为CO2和H2O。如果人体内这两种脱 氢酶的含量都很大的话,酒精的代谢速度就很
快。但如果人体内这两种脱氢酶的含量不够大,
例如缺少乙醛脱氢酶,饮酒后就会 引起体内乙醛积累,导致血管扩张 而脸红。
原来如 此啊!
五、课堂检测
1.写出下列反应的化学方程式,并注明反应类型
课堂小结:
1、乙醛和氢气发生加成反应生成乙醇,
说明了醛基有氧化性。
2、氧气、Ag(NH3)2OH、Cu(OH)2、溴水、酸 性 高锰酸钾都溶液在一定条件下都能使乙醛氧
化
3、说由明以醛上基两具点有得较出强反的应还规原律性:
氧化
氧化
乙醇
乙醛
乙酸
还原
4、醛基的检验方法:
(1)与新制的银氨溶液反应有光亮的银镜生成
一、乙醛的结构
HO 结构式: H C C H
H
O
结构简式: CH3CH 型
分子式: C2H4 官能团: C H
O
醛基
能否写成-COH 或-CH=O 比例模型
二、乙醛的物理性质
乙醛是无色、有刺激性气味的液 体,密度比水小,沸点是 20.80C ,易挥发,易燃烧,能和水、乙 醇、乙醚、氯仿等互溶
2CH3CHO
+
O2
催化剂
△
2 CH3COOH
CH3CHO +
H2
催化剂
△
CH3CH2OH
② 乙醛分别与银氨溶液、新制的氢氧化铜反应
CH3CHO + 2[Ag(NH3)2]OH 水浴 CH3COONH4 + 2Ag↓+ 3NH3 +H2O
CH3CHO +2Cu(OH)2
CH3COOH + Cu2O + 2H2O
思考:乙醛、苯、CCl4均为无色液体, 如何用最简便的方法鉴别?
三、醛的化学性质
氧化反应:加O或失H 有机反应 还原反应:加H或失O
O
R C H不饱和 加成反应
饱 和
氧化反应
1.氧化反应
(1)与银氨溶液---银镜反应
水浴 CH3CHO+2[Ag(NH3)2]OH
CH3COONH4+3NH3 + 2Ag ↓ +H2O
① CH3CH2Br
CH3CH2OH
CH3COOH
CH3CHO
2. 以乙烯为原料制取乙酸,写出反应的化学方 程式,并注明反应类型。
① CH3CH2Br
CH3CH2OH
CH3COOH
CH3CHO
CH3CH2Br+NaOH
H2O △
CH3CH2OH+NaBr
Cu
2 CH3CH2OH + O2 △ 2 CH3CHO + 2 H2O
加到Ag2O棕色沉淀刚好消失) 5.乙醛用量不可太多; 6.实验后,银镜用HNO3浸泡,再用水洗
二、与新制氢氧化铜反应的注意几个事项
1、碱必须过量 2、加热至沸腾,但温度不能过高
返回
2.加成反应(碳氧双键上的加成)
O CH C H + H2催化剂
3
CH3CH2O H
注意:和C=C双键不同的是,通常 情况下,乙醛不能和HX、X2、H2O 发生加成反应
(2)与新制的Cu(OH)2共热煮沸有砖红色沉淀生
在日常生活中我们都会 有这样的疑问, 为什么有 的人喝酒“千杯万杯都不 醉”,而有的人喝一点酒后 就面红耳赤,情绪激动甚至 酩酊大醉?酒量的大小到底 与什么有关呢?
人的酒量大小,与酒精在人体内的代谢产
物和过程有很大关系。乙醇进入人体内,首先
在乙醇脱氢酶的作用下氧化为乙醛,然后又在
信息迁移应用
已知CH3-C=O +H-CH2→CHCOH3-CH-CH2-CHO OH
H
根据上述信息,用乙醛合成1-丁醇
