吖啶橙 溴化乙锭双荧光染色
常见细胞核荧光染料

细胞核常用荧光染料有:吖啶橙(Acridine Orange,AO)、溴化乙锭(Ethidium Bromide,EB)和碘化丙啶(Propidium Iodide,PI),DAPI、Hoechst染料、EthD III、7-AAD、RedDot1、2 等等。
透膜的染料如下:AO:具有膜通透性,能透过细胞膜,将核DNA和RNA分别染成绿色和红色,因此使细胞核呈绿色或黄绿色荧光。
EB:一种高度灵敏的荧光染色剂,在标准302nm处激发出橙红色信号。
DAPI:蓝色一种可以穿透细胞膜的蓝色荧光染料,其与DNA结合后可以产生比DAPI自身强20多倍的荧光,而与单链DNA结合无荧光的增强。
DAPI对双链DNA的染色灵敏度要高于EB和PI,荧光强度比Hoechst低,但光稳定性高于Hoechst。
Hoechst染料:蓝色一类在显微观察中标记DNA的荧光染料,最常见的两种是Hoechst33342和Hoechst33258。
这两种染料都在紫外350nm处被激发,在461nm处最大发射光附近发射青/蓝色荧光。
与DAPI相比,Hoechst33342加有乙基,具有更强的亲脂性,因此能更好的透过完整的细胞膜,并且细胞毒性更小。
RedDot 1染料:红色,超强的细胞核选择性,其光谱相似于Draq?5 和Draq?7。
RedDot?染料可被几种常见的激光激发并可在远红外区激发荧光。
RedDot? 的红色近红外荧光有效的与其他常用荧光探针区分开来。
不透膜的染料,如下:PI:不同通过活细胞膜,但却能穿过破损的细胞膜而对核染色。
PI作为红色荧光复染剂首选,PI经常与Calcein-AM或者FDA等荧光探针合用,区分死/活细胞。
EthD III、7-AAD、RedDot 2:不能透过细胞膜,但能将坏死细胞区分开来;更适合凋亡坏死实验的检测;细胞核荧光染料(PI DAPI Hoechst33342)细胞核荧光染料PI碘化丙啶(简称PI)是一种常用的细胞核荧光染色剂。
吖啶橙染色液

吖啶橙染色液吖啶橙染色液(1mg/ml)产品简介:吖啶橙(Acridine Orange, AO)属于三环杂芳香燃料,可以标记DNA、RNA,属于异染性荧光染料。
该染料具有膜通透性,能透过细胞膜,使核DNA 和RNA 染色。
因此AO 常用于细胞内DNA 和RNA 进行检测。
AO 与核酸结合方式主要有:1、插入性结合,AO 嵌入核酸双链的碱基对之间,这种结合方式主要为AO 与DNA 的结合,其荧光发射峰为530nm,激发后呈绿色荧光;2、静电吸引,带正电荷的AO 与单链核酸的磷酸根(带负电荷)产生静电间的吸引结合,这种结合方式主要为AO 与RNA 的结合,其荧光发射峰为640nm,激发后呈红色荧光,少量结合会呈桔黄色或桔红色荧光。
因此,吖啶橙嵌合到双链DNA 分子中显绿色,与DNA 单链或RNA 结合时发桔黄色或橙红色荧光。
(1mg/ml)为储存液,使用时应稀释到合适浓度后使用。
染色后在荧光显微镜下观察,吖啶橙可透过正常细胞膜,使细胞核呈绿色或黄绿色均匀荧光;而在凋亡细胞中,因染色质固缩或断裂为大小不等的片断,形成凋亡小体。
吖啶橙使其染上致密浓染的黄绿色荧光或黄绿色碎片颗粒;而坏死细胞黄荧光减弱甚至消失。
吖啶橙染色常与EB 染色合用双染,因EB 只染死细胞使之产生桔黄色荧光,由此可区分出正常细胞、凋亡细胞及坏死细胞。
自备材料:1、 荧光显微镜2、 低速离心机3、 PBS4、 细胞计数板5、 载玻片、盖玻片操作步骤(仅供参考):1、 收集细胞(采用流式细胞仪检测时,应先固定细胞),用PBS 清洗细胞1次,计数并调节细胞浓度至106/ml。
2、取适量的细胞悬液,加入Acridine Orange Stain(1mg/ml),使AO终浓度为8.5~17μg/ml,轻轻混匀。
3、室温避光染色15~20ml,滴加于载玻片上并加盖玻片或上流式细胞仪分析。
4、荧光显微镜下观察(激发滤光片波长488nm,阻断滤光片波长515nm),计数并拍照。
AO_EB双重染色法检测紫杉醇体外诱导犬乳腺肿瘤细胞凋亡

[8]张细元,邹开芳。钱伟。等.泰素诱导MI【N245胃癌细胞凋亡及 对cyclinEl、cyclinDl表达的影响[J】.华中科技大学学报: 医学版,2005。34(6):737—740.
华南宠物园地.41.
·组间差异极显著(P<O.01) 图3紫杉醇对CHMm细胞LDH活性的影响
撑组内差异极显著(P<O.01) 图4紫杉醇作用后CHMm凋亡率的变化
图5 荧光显微镜下AO/EB双荧光染色法紫杉醇致CHMm凋亡情况
并沉积在细胞中,而死细胞无此功能,其形成量与 细胞活力呈正比。但是MTT法只能间接反映细胞 活力,不能反映细胞死亡的数量。本实验用这两种 方法共同验证紫杉醇对犬乳腺肿瘤细胞的毒性。 实验结果显示台盼蓝排斥试验和MTT细胞活性检 测显示结果一致。表明紫杉醇对CH‰具有明显的 抑制作用,药物作用时间越长,抑制作用越强,并 且对细胞的抑制率呈明显的时间依赖性关系。崔 洪尊等同在紫杉醇抑制S删C一772l肝癌细胞增值 时也证明了这种结果。
apopto“c
mofph01嚼cal cllallges we托ex锄nined咖der a nuorescent InicrD§cope.The fesults showed that taxol could
inhibit也e prolif.鼬ti∞of canine b托勰t cancer cells锄d indllce印optosis with me t),pical mo印holo百cal featIlrcs
万方数据
.42. 华南宠物园地
AO/EB双重染色法检测紫杉醇体外诱导犬乳腺肿瘤细胞凋亡一陈萌,等
吖啶橙染色溶酶体原理

吖啶橙(Acridine Orange)是一种荧光染料,常用于细胞和组织的染色。
它可以与DNA和RNA结合,并发出绿色和橙色的荧光信号。
溶酶体是细胞内的一种细胞器,主要参与细胞内物质的降解和消化。
吖啶橙染色溶酶体的原理是,吖啶橙可以穿过细胞膜进入细胞内,并与溶酶体内的DNA结合。
在酸性环境下,吖啶橙与DNA结合的荧光信号会发生变化。
在弱酸性条件下,吖啶橙发出绿色荧光;而在强酸性条件下,吖啶橙发出橙色荧光。
通过观察细胞或组织中溶酶体的荧光颜色,可以了解溶酶体的酸性程度和功能状态。
正常情况下,溶酶体处于弱酸性状态,吖啶橙发出绿色荧光;而当溶酶体功能异常或酸性增加时,吖啶橙发出橙色荧光。
这种染色方法可以用于研究溶酶体相关的疾病,如溶酶体贮积病和溶酶体功能障碍等。
需要注意的是,吖啶橙染色溶酶体的原理是基于荧光信号的变化,因此在观察时需要使用荧光显微镜或其他荧光检测设备。
荧光显微镜的基本原理及应用

六、荧光组化实验中应注意的几个问题
1、每种荧光染料,均有自己的最适pH值,此时荧光最强。 当pH改变时,不仅荧光强度减弱,而且波长将有所改变,因 此荧光检测时要在一定的pH值的缓冲液中进行。 2、一放荧光染色在20。C以下时荧光比较稳定,温度升高常 出现温度猝灭。 3、在荧光观察中,常因激发光的增强而使样品荧光很快衰 竭,造成观察和照相困难。为此最好用能量小的长波长光进 行观察,需照相时再适当增强激发光。 4、一般荧光染液的浓度在万分之一以下,甚至亿万分之一, 也能使标本着色。在一定的限度内,荧光强度可随荧光素的 浓度增加而增强,但超过限度,荧光强度反而下降,这是由 于荧光分子间的缔合而使自身荧光猝灭所致。
2.药物筛选
荧光探针分布是利用信号传 导中信号分子的迁移功能,将 一荧光蛋白与信号分子相偶联, 根据荧光蛋白的分布情况即可 推断信号分子的迁移状况,并 推断该分子在迁移中的功能。 由于GFP分子量小,在活细胞 内可溶且对细胞毒性较小,因 而常用作荧光探针
八、使用注意事项
1 暗室内进行,打开汞灯5-10min稳定后再观察。
A filter set consists of two barrier filters (1 and 3) and a dichroic mirror (beam-splitting 2)
三、荧光显微镜的操作
(1)安装紫外防护罩。
(2)打开高压汞灯的电源控制箱开关。
(3)插入挡光板,中断光路。
七、荧光显微镜应用技术
1. 对细胞结构或组分的定性位、半定量研究
免疫荧光技术 用荧光标记的抗体或抗原与样品(细胞、组织或分离 的物质等)中相应的抗原或抗体结合,以适当检测荧光的 技术对其进行分析的方法。将抗原或抗体与荧光染料连 接,用于检测相应特异性的抗体或抗原的方法称“直接 免疫荧光技术(direct immunofluorescent technique)”。 用荧光染料标记的第二、第三抗体等检测相应抗原抗体 复合体的方法则称“间接免疫荧光技术(indirect immunofluorescent technique)”。
细胞凋亡染色方法

细胞凋亡染色方法
最常见的一种是吖啶橙/溴化乙锭(AO/EB)双染色法。
这个方法就像是给细胞穿上了不同颜色的小衣服来区分它们的状态。
AO可以嵌入双链核酸,让正常细胞和凋亡细胞的细胞核都呈现绿色荧光。
而EB呢,它只能进入那些膜完整性被破坏的细胞,像凋亡晚期细胞,这些细胞的核就会被染成橙红色荧光。
咱们把细胞一染,放在荧光显微镜下看,就可以很清楚地区分正常细胞、凋亡早期细胞(只有绿色荧光)和凋亡晚期细胞(绿色加橙红色荧光)啦,是不是很神奇 ?
还有一种是Annexin V - FITC/PI双染法。
Annexin V是个很聪明的小蛋白,它对磷脂酰丝氨酸(PS)有很高的亲和力。
在细胞凋亡早期,细胞膜的PS会从膜内侧翻转到外侧,这时候Annexin V - FITC就能结合上去,发出绿色荧光。
PI呢,它和EB有点像,是不能进入活细胞和早期凋亡细胞的,只有当细胞死亡,细胞膜完全破损了,它才能进去把细胞核染成红色。
这样通过双染,我们就能准确地检测到凋亡细胞啦,就像给细胞们做了个精准的小体检 。
另外,TUNEL染色法也很厉害哦。
这个方法主要是检测细胞凋亡时断裂的DNA。
细胞凋亡的时候,内源性核酸内切酶会被激活,把染色体DNA在核小体间切断,产生180 - 200bp整数倍的寡核苷酸片段。
TUNEL法就是利用末端脱氧核苷酸转移酶(TdT)把生物素或地高辛等标记的dUTP连接到3' - OH末端,然后再用相应的荧光标记的抗体或者酶标抗体去检测这些标记的dUTP,这样凋亡细胞就能被染上色啦,在显微镜下就可以看到那些凋亡的小细胞们啦,是不是感觉像在细胞世界里玩侦探游戏一样 ?。
四环素对糖皮质激素诱导的骨髓间充质干细胞损伤的保护作用

四环 素对 糖 皮 质激 素诱 导 的骨髓 间 充 质 干 细胞 损 伤 的保 护 作 用
杨 智洋 张德 志 。 , 仲 兴 崔凤 荣 郭 , , 涛 张 , 男 刘丹 平 ,
( 1辽 宁 医学 院 , 宁锦 州 110 ; 宁医学 院附属 第一 医院 ) 辽 20 12辽
摘要: 目的
探讨四环素对糖皮质激素诱导大 鼠骨髓 间充质干细胞 ( MS s 损伤 的保 护作 用。方法 B C)
体外 建
立糖皮 质激 素诱导大 鼠 B C 损伤模型 , MS s 分离与体外培养大 鼠 B C 。将大 鼠 B S s MS s M C 分为正常对照组 、 激素对 照
组, 四环素 4、0 10 50 / l 2 、0 、0 g m 浓度组。采用 吖啶橙/ 溴化乙锭双荧 光染 色法观察 四环素对激素诱导 的 B C 凋 MS s 亡的影响 ; 采用 MT 法检测各组 B C 活性 , r MS s 绘制细胞生长 曲线 ; 用免疫组织化 学方法对细胞 凋亡 因子 bl 、a c2bx 一 进行分析 ; s r l 测定细胞凋亡因子 csae3表达 。结果 吖啶橙/ Wet nb t e o aps一 溴化 乙锭染色显示细胞损伤 为凋亡。 四 环素对激素抑制 B C 的增殖有 明显保护作用 , 与 四环素 的浓度成一 定的量效 关系 ;0 MS s 并 10 m 的 四环 素能 明 l 显阻断激素诱导的 B C 凋亡 , MS s 其机制可能与提高 bl c 2表达 、 - 降低 bx csa一 a 、ap s 3表达 有关。结论 四环 素具有保
Y G iy n L ZHAN G —hi AN Zh — o g Dez ,ZHONG n ,CUI F n r n ,GUO T o,ZHANG n,L U n p n Xig e g—o g a Na I Da - i g
吖啶橙染色原理

吖啶橙染色原理
吖啶橙是一种双碱性染料,具有两个氨基和两个芳香环结构。
它可以与DNA
和RNA结合,通过静电作用和氢键作用,与核酸中的腺嘌呤和胞嘧啶基团结合,
从而实现对核酸的染色。
吖啶橙的结构中含有芳香环和氨基,使其具有较强的荧光性能,能够在紫外光下产生橙色荧光。
在细胞或组织染色实验中,吖啶橙可以通过渗透染色或者固定染色的方式,将
其加入到待染细胞或组织中,与核酸结合形成吖啶橙-核酸复合物。
当使用荧光显
微镜观察时,激发波长为紫外光,吖啶橙-核酸复合物会发出橙色荧光信号,从而
实现对核酸的观察和检测。
吖啶橙染色的原理基于其与核酸的结合特性,通过与核酸的特异性结合,实现
对核酸的染色和检测。
由于吖啶橙具有较强的荧光性能,能够产生明亮的橙色荧光信号,因此在细胞生物学和分子生物学研究中得到了广泛的应用。
吖啶橙染色原理的了解对于科研工作者在实验设计和数据解读中具有重要意义。
在细胞和组织的荧光染色实验中,科研人员需要根据样本的特点和实验要求,选择合适的染色方法和条件,合理设计实验方案,以确保获得准确可靠的实验结果。
总之,吖啶橙作为一种重要的荧光染料,在生物学和医学领域发挥着重要作用。
了解其染色原理,可以帮助科研人员更好地应用吖啶橙进行细胞和组织的荧光染色实验,为科研工作提供有力支持。
希望本文对吖啶橙染色原理有所帮助,同时也希望科研人员能够在实验中充分
发挥吖啶橙的优势,取得更多有意义的研究成果。
吖啶橙染色法

吖啶橙染色法检测细胞凋亡
实验试剂、仪器:
吖啶橙,稀释液PBS(磷酸缓冲液pH7.0~7.2),1%吖啶橙贮存液,细胞爬片,载玻片,盖玻片,荧光显微镜。
吖啶橙:3,6-(二甲胺基)吖啶盐酸盐,分子式C17H19N3·HCl ·ZnCl2, 分子量438.12g/mol,是一种荧光色素,其检测激发滤光片波长488nm,阻断滤光片波长515nm。
它与细胞中DNA和RNA结合量存在差别,可发出不同颜色的荧光,与DNA结合量少发绿色荧光,与RNA结合量多发桔黄色或桔红色荧光。
该染料具有膜通透性,能透过细胞膜,使核DNA和RNA染色。
因此,在荧光显微镜下观察,吖啶橙可透过正常细胞膜,使细胞核呈绿色或黄绿色均匀荧光;而在凋亡细胞中,因染色质固缩或断裂为大小不等的片断,形成凋亡小体。
吖啶橙使其染上致密浓染的黄绿色荧光,或黄绿色碎片颗粒;而坏死细胞黄荧光减弱甚至消失。
吖啶橙染液有毒,操作时要戴手套,需避光。
实验步骤:
1.配置吖啶橙贮存液(1%):300mg吖啶橙溶解于30mlPBS缓冲液中,滤过,4
度避光保存。
2.染色时,稀释100倍至终浓度为0.01%。
取300微升的PBS缓冲液,加3微
升的吖啶橙贮存液混匀,室温避光染色5min。
3.在荧光显微镜下选520nm的激发光观察。
实验结果:
正常细胞核的DNA为黄色或黄绿色均匀荧光,细胞质和核仁的RNA为桔黄或桔红荧光。
出现细胞凋亡时,细胞核或细胞质内可见致密浓染的黄绿色荧光,甚至见黄绿色碎片。
细胞坏死时,细胞质内黄绿色或桔黄色荧光均减弱或消失。
荧光显微镜的基本原理及应用

(10)打开与显微镜连接的计算机,点 击数码成像系统软件,采集. 数码图像。
四、荧光显微镜标本制作要求
(一)载玻片
载玻片厚度应在0.8~1.2mm之间,太厚 的坡片,一方面光吸收多,另一方面不能 使激发光在标本上聚集。载玻片必须光洁, 厚度均匀,无明显自发荧光。有时需用石 英玻璃载玻片。
2、一放荧光染色在20。C以下时荧光比较稳定,温度升高常 出现温度猝灭。
3、在荧光观察中,常因激发光的增强而使样品荧光很快衰 竭,造成观察和照相困难。为此最好用能量小的长波长光进 行观察,需照相时再适当增强激发光。
4、一般荧光染液的浓度在万分之一以下,甚至亿万分之一 ,也能使标本着色。在一定的限度内,荧光强度可随荧光素 的浓度增加而增强,但超过限度,荧光强度反而下降,这是 由于荧光分子间的缔合而使自身荧光猝灭所致。
.
.
.
二、荧光显微镜的组成
1、光源:一般采用高压汞灯
2、滤色系统:由激发滤板和压制滤板组成
a、激发滤板:提供一定范围的激发光
b、压制滤板:完全阻挡激发光通过,提供相应滤长范围荧光
3、反光镜:一般采用平面反光镜
4、聚光镜:用石英玻璃或其他透紫外光的玻璃制成
5、物镜和目镜
.
The optical system of a fluorescence microscope.
(6)选择接物镜(按照先低倍,后高倍顺序)。
.
(7)旋转分光镜组件转盘,选择所需要 的分光镜组件:“O”为观察透射光时 用;“WU”为观察蓝色荧光时用(如 DAPl);“WB”为观察绿色荧光时用(如 FITC);“WG"为观察红色荧光时用(如 TRITC)。
(8)使用阻断滤片(目前多数阻断滤片内 置于荧光显微镜)。
吖啶橙染色原理

吖啶橙染色原理
吖啶橙染色是一种常用于核酸和蛋白质检测的荧光染料,其原理基于荧光共振能量转移(FRET)和DNA或蛋白质的特定
亲和性。
在实验中,通常将吖啶橙与目标分子(如DNA或蛋
白质)结合,通过观察荧光信号的强度和变化来进行检测。
吖啶橙具有两个荧光基团:供体荧光基团(通常为吖啶基团)和受体荧光基团(通常为橙色基团)。
当吖啶橙与目标分子结合时,两个基团之间的距离和相对位置可能会发生改变。
如果供体荧光基团与受体荧光基团的距离在合适的范围内,并且相对位置适当,FRET就会发生。
在FRET过程中,供体荧光基团受到激发光刺激并产生激发态,在受体荧光基团的作用下,供体荧光信号以非辐射方式传递给受体荧光基团。
作为结果,亮一些的橙色荧光发生。
通过观察橙色荧光信号的强度和变化,可以确定目标分子的存在和特定的相互作用。
吖啶橙染色的原理基于荧光共振能量转移和目标分子的亲和性,是一种有效的分析方法。
它常用于实验室研究、生物学检测和医学诊断等领域,具有高灵敏度和广泛的应用前景。
核酸染料成分

核酸染料成分核酸染料是一类广泛应用于生物学和化学领域的重要物质,其可以用来检测、标记和研究生物分子,如DNA和RNA。
核酸染料的成分多种多样,下面将介绍几种常见的核酸染料成分及其应用。
1. 乙溴蓝(Ethidium Bromide):乙溴蓝是一种常用的核酸染料,可以通过与DNA或RNA分子的双螺旋结构相互作用而发出荧光。
乙溴蓝主要用于琼脂糖凝胶电泳中的核酸分离和检测。
它可以在紫外光照射下与DNA分子结合并发出橙红色荧光,从而可以直观地观察到DNA分离带或RNA分离带。
2. SYBR Green:SYBR Green是一种常用的核酸染料,它与DNA或RNA结合后能发出绿色荧光。
SYBR Green广泛应用于实时荧光定量PCR(qPCR)技术中,用于检测和定量PCR反应体系中产生的DNA分子。
其优点是灵敏度高、特异性好,可以实时监测PCR反应的进程,并定量分析反应体系中的DNA含量。
3. GelRed:GelRed是一种相对较新的核酸染料,它具有与乙溴蓝类似的性质,但更加安全和稳定。
GelRed可以在琼脂糖凝胶电泳中用于检测和定量DNA或RNA分子。
与乙溴蓝相比,GelRed对生物体和环境的毒性更低,使用更加方便和安全。
4. Methylene Blue:亚甲基蓝是一种常用的核酸染料,可以通过与DNA或RNA分子的碱基相互作用而发出蓝色荧光。
亚甲基蓝可以用于琼脂糖凝胶电泳中的核酸分离和检测。
与乙溴蓝相比,亚甲基蓝对生物体和环境的毒性较低,但其荧光强度相对较弱。
5. acridine orange:吖啶橙是一种双功能核酸染料,可以发出绿色荧光或橙色荧光,具有荧光探针和核酸染色剂的双重作用。
吖啶橙可以用于细胞核酸的染色和细胞活力的检测。
在荧光显微镜下观察,吖啶橙可以染色细胞核酸,并显示出不同类型的细胞核和胞质。
6. Propidium Iodide:碘化丙啶是一种常用的核酸染料,主要用于细胞凋亡和细胞周期分析。
核酸染色剂

电泳后,核酸需经染色才能显色出带型,常用以下核酸染色剂:1. 溴化乙锭(ethidium bromide, EB)最常用的核酸荧光染料,这种扁平分子可嵌入核酸双链的配对碱基之间,在紫外线激发下,发出桔红色荧光。
激发荧光的能量来源于两个方面,一是核酸吸收波长为 260nm的紫外线后能将能量传送给溴化乙锭,二是结合在DNA分子中的EB本身,主要吸收波长为 300nm和360nm的紫外线的能量,来源于这两方面的能量,最终激发EB发射出波长为590nm的可见光谱红橙区的红色荧光。
EB-DNA 复合物中的EB发出的荧光,比游离的凝胶中的EB发出的荧光强度大10倍,因此无需洗净背景即可清楚观察核酸带型。
若EB背景太深,可将凝胶浸泡于1mmol/LMgSO仲1h或10mmol/L MgCI2中5min,使非结合的 EB褪色,这样可检查到 10ng的DNA羊品, EB也可用于检测单链 DNA或 RNA但其对单链核酸的亲和力相对较小,荧光产率也相对较低。
在凝胶或电泳缓冲液中加入终浓度为0.5卩g/ml的EB,染色可在电泳过程中进行,能随时观察核酸的迁移情况,这种方法使用于一般性的核酸检测。
但EB带正电荷,嵌入碱基后增加了核酸分子的刚性,使迁移率减慢,故不宜用于测定核酸分子量的大小,这时应在电泳后将凝胶浸入0.5卩g/ml的EB水溶液中10min进行染色。
EB见光易分解,应于4 C避光保存。
2. 吖丫啶橙(acridine orange,AO ):吖丫啶橙可嵌入双链核酸碱基对之间,在254nm紫外线激发下发出530nm的绿色荧光;还通过静电与单链核酸的磷酸基结合,在254nm紫外线激发下产生640nm的红色荧光。
因此可区分单链和双链核酸,灵敏度分别为0.1卩g 和0.05卩g。
但吖丫啶橙的染色操作要求严格,应在22 C, 0.01mol/L 磷酸钠缓冲液(pH7.0 )中避光浸泡30min,然后在搪瓷盘中用该缓冲剂 4 C脱色过夜或22 C脱色1~2 小时。
吖啶橙荧光染色原理

吖啶橙荧光染色原理吖啶橙荧光染色原理一、前言吖啶橙荧光染色是一种常用的细胞核染色方法,其原理基于吖啶橙能够与DNA结合形成复合物,并且在紫外线或蓝光的激发下能够发生荧光发射。
本文将详细介绍吖啶橙荧光染色的原理。
二、吖啶橙的结构和性质吖啶橙是一种双氮杂环化合物,其分子式为C17H19N4Cl。
它是一种黄色晶体,可以通过溶解在水中形成黄色溶液。
吖啶橙分子中含有两个氮原子和两个苯环,这些结构使得它具有与DNA结合的能力。
三、DNA与吖啶橙的相互作用DNA是由四种碱基组成的双链螺旋结构,其中腺嘌呤(A)和胸腺嘧啶(T)之间形成两个氢键,鸟嘌呤(G)和胞嘧啶(C)之间形成三个氢键。
这些氢键使得DNA分子具有稳定的结构,并且能够与吖啶橙形成复合物。
当吖啶橙溶液与DNA接触时,它能够通过静电作用结合到DNA的磷酸基团上。
此外,吖啶橙的分子中含有苯环,这些苯环可以穿过DNA 的双链螺旋,与碱基形成π-π堆积作用。
这些相互作用使得吖啶橙能够与DNA形成稳定的复合物。
四、吖啶橙荧光发射原理在紫外线或蓝光的激发下,吖啶橙分子会从基态跃迁到第一激发态。
在回到基态时,它会通过荧光发射释放出能量。
这种荧光发射是一种特殊的电子跃迁过程,其波长通常在500-600nm之间。
由于DNA和吖啶橙形成了稳定的复合物,并且吖啶橙分子在紫外线或蓝光的激发下能够发生荧光发射,因此在细胞核染色中加入吖啶橙可以使得细胞核产生荧光信号。
五、吖啶橙荧光染色的实验步骤1. 取一定量的细胞样品,离心沉淀后用PBS洗涤。
2. 加入适量的吖啶橙溶液,静置15-30分钟。
3. 用PBS洗涤样品,去除未结合的吖啶橙。
4. 在荧光显微镜下观察细胞核荧光信号。
六、吖啶橙荧光染色的应用吖啶橙荧光染色是一种常用的细胞核染色方法,它可以被广泛应用于生物学和医学研究中。
例如,在癌症诊断中可以利用吖啶橙染色技术对肿瘤组织进行检测;在细胞分裂和凋亡等过程中也可以利用吖啶橙技术进行观察和分析。
AO EB染色的讨论

吖啶橙/溴化乙锭双荧光染色AO / EB原理与流程zhongyisheng:1 原理:吖啶橙(AO)能透过胞膜完整的细胞,嵌入细胞核DNA,使之发出明亮的绿色荧光。
溴乙锭(E仅能透过胞膜受损的细胞,嵌入核DNA,发橘红色荧光。
凋亡的细胞呈现为染色增强,荧光更为明亮,均匀一致的圆状或固缩状、团块状结构。
非凋亡细胞核呈现荧光深浅不一的结构样特征。
二者形态迥然相异,很易判别。
在荧光显微镜下观察,可见四种细胞形态:活细胞(VN),核染色质着绿色并呈正常结构;早期凋亡细胞(VA),核染色质着绿色呈固缩状或圆珠状;非凋亡的死亡细胞(NVN),核染色质着橘红色并呈正常结构;晚期凋亡细胞(NVA),核染色质为橘红色并呈固缩状或圆珠状。
2 AO/EB染色及观察结果:取20-100μl的1:100稀释的染色剂置于载玻片的贴壁细胞上室温下静置20min,PBS洗涤2-3遍,上覆盖玻片,荧光显微镜下观察结果并计数20-200个细胞。
ym1051: 1.能否提供具体实验步骤?2.您在文中所说的"1:100稀释的染色剂"是怎样稀释的?如何在载玻片上种上贴壁细胞? zhongyisheng:1 用1mlEP管稀释时,先取微量的染色剂,然后再取稀释剂(如BSA)加入EP管吹打即可。
2 消毒灭菌处理后的盖玻片平放入培养皿或中即可实验。
ym1051:我好像已明白具体过程了:首先要进行细胞爬片,然后将染色剂滴加在已爬有细胞的盖玻片上,温育后洗涤,再盖上盖玻片则可进行观察了.是这样吗?如果不经过爬片处理而将细胞进行消化,再将细胞和染色剂滴加在盖玻片上进行观察,行吗?zhongyisheng:的确,不经过爬片而是将贴壁细胞消化下来一样可以进行进一步的实验。
这是悬浮细胞的典型方法。
当然,由于进行免疫组化染色进行的形态学检查经常考虑到细胞的原貌,在国际上比较通用,尤其是在进行动态检查时。
医琳师妹:我将我所作的方法与大家共享:吖啶橙/溴化乙锭双荧光染色测定PC12细胞凋亡(acridine orange/ethidium bromide, AO/EB):1)细胞爬片:在6孔培养板中预先置入玻璃盖玻片,接种细胞悬液,干预后,予95%乙醇固定15分钟,微干,然后准备荧光染色。
细胞生物学实验-细胞凋亡观察

色加深,或核染色质聚集于核膜一边,呈新月状;晚期凋亡细胞胞核碎裂成大小 不等的原形小体,并被细胞膜所包绕,即凋亡小体。 ⑤ AO(吖啶橙)和EB(溴化乙锭)双染色:AO可以透过细胞膜完整的细胞而嵌入 核DNA呈绿色,EB只能透过细胞膜破损的细胞而嵌入核DNA呈红色。显微镜下 观察,活细胞为荧光深浅不一的结构样特征,核染色质为绿色;凋亡细胞染色强, 亮度高,核染色质呈黄绿色浓聚在核膜内侧,可见细胞膜呈泡状膨出及凋亡小体 或均匀一致的圆状或固缩团状结构。 ⑥ 透射电镜观察:凋亡细胞表面微绒毛消失,核染色质固缩、边集,常呈新月形, 核膜皱褶,胞质紧实,细胞器集中,胞膜起泡或出“芽”,同时可以观察到凋亡 小体和凋亡小体被临近巨噬细胞吞噬。
细胞凋亡检测
保留的细胞
不健康的细胞
细胞开 始收缩
细胞崩 溃分解 成碎片
不健康的细胞已被除去, 组织内附近的细胞进行 有丝分裂,合上缺口
细胞凋亡检测
细胞凋亡的诱导试剂:
名称 Actinomycin D
Aphidocolin A23187 Caffeine
Camptothecin Cycloheximide Dexamethasone
溶剂 甲醇 二甲亚砜 二甲亚砜 沸水 二甲亚砜
水 乙醇
水
二甲亚砜, 热水 水
二甲亚砜 二甲亚砜 磷酸盐缓冲液
甲醇
细胞凋亡检测
细胞凋亡的检测方法:
荧光染色检测细胞凋亡

荧光染色检测细胞凋亡1、吖啶橙AO/溴乙锭EB双染色吖啶橙(acridine orange,简称AO):3,6-(二甲胺基)吖啶盐酸盐,分子式C17H19N3 · HCl · ZnCl2, 分子量438.12g/mol,是一种荧光色素,其检测激发滤光片波长488nm,阻断滤光片波长515nm。
它与细胞中DNA和RNA结合量存在差别,可发出不同颜色的荧光,与DNA结合量少发绿色荧光,与RNA结合量多发桔黄色或桔红色荧光。
该染料具有膜通透性,能透过细胞膜,使核DNA和RNA染色。
因此,在荧光显微镜下观察,吖啶橙可透过正常细胞膜,使细胞核呈绿色或黄绿色均匀荧光;而在凋亡细胞中,因染色质固缩或断裂为大小不等的片断,形成凋亡小体。
吖啶橙使其染上致密浓染的黄绿色荧光,或黄绿色碎片颗粒;而坏死细胞黄荧光减弱甚至消失。
吖啶橙AO常与溴化乙啶EB合用双染,因EB只染死细胞使之产生桔黄色荧光,由此可区分出正常细胞、凋亡细胞及坏死细胞.它还可以用作移码突变的诱变剂,能镶嵌于两个相邻的碱基对之间,这样在DNA复制过程中,会使DNA链增加或缺失一个碱基,造成移码突变。
吖啶橙染液有毒,操作时要戴手套,需避光。
吖啶橙/溴化乙锭双荧光染色测定PC12细胞凋亡(acridineorange/ethidium bromide, AO/EB)悬浮细胞AO/EB双染步骤1.调整细胞密度为106/ml,将细胞种至6孔板,每孔2ml细胞;2.向每孔加入相应浓度药物,培养至不同时间点;3.1000转/min离心5min收集细胞,PBS洗涤1次;4.PBS重悬细胞,使悬浮细胞浓度达106/ml左右;5.取100μl受检细胞悬液,各加2μl AO和EB(AO/EB染料配制:AO、EB各1mg,分别溶于10ml pH7.2 PBS中,使之配成100μg/ml的储备液,4℃保存,用前等量混合);6.取上述染色液一滴,滴在洁净玻片上,加盖玻片后立即置荧光显微镜下观察,计取5个视野,共100个细胞中凋亡细胞百分数。
吖啶橙荧光染色法
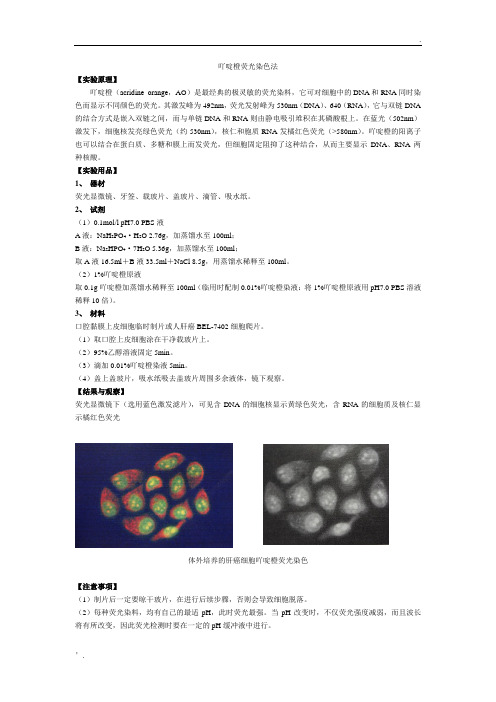
. ’. 吖啶橙荧光染色法【实验原理】吖啶橙(acridine orange ,AO )是最经典的极灵敏的荧光染料,它可对细胞中的DNA 和RNA 同时染色而显示不同颜色的荧光。
其激发峰为492nm ,荧光发射峰为530nm(DNA )、640(RNA ),它与双链DNA 的结合方式是嵌入双链之间,而与单链DNA 和RNA 则由静电吸引堆积在其磷酸根上。
在蓝光(502nm )激发下,细胞核发亮绿色荧光(约530nm ),核仁和胞质RNA 发橘红色荧光(>580nm )。
吖啶橙的阳离子也可以结合在蛋白质、多糖和膜上而发荧光,但细胞固定阻抑了这种结合,从而主要显示DNA 、RNA 两种核酸。
【实验用品】1、 器材荧光显微镜、牙签、载玻片、盖玻片、滴管、吸水纸。
2、 试剂(1)0.1mol/l pH7.0 PBS 液A 液:NaH 2PO 4·H 2O 2.76g ,加蒸馏水至100ml ;B 液:Na 2HPO 4·7H 2O 5.36g ,加蒸馏水至100ml ;取A 液16.5ml +B 液33.5ml +NaCl 8.5g ,用蒸馏水稀释至100ml 。
(2)1%吖啶橙原液取0.1g 吖啶橙加蒸馏水稀释至100ml (临用时配制0.01%吖啶橙染液:将1%吖啶橙原液用pH7.0 PBS 溶液稀释10倍)。
3、 材料口腔黏膜上皮细胞临时制片或人肝癌BEL-7402细胞爬片。
(1)取口腔上皮细胞涂在干净载玻片上。
(2)95%乙醇溶液固定5min 。
(3)滴加0.01%吖啶橙染液5min 。
(4)盖上盖玻片,吸水纸吸去盖玻片周围多余液体,镜下观察。
【结果与观察】荧光显微镜下(选用蓝色激发滤片),可见含DNA 的细胞核显示黄绿色荧光,含RNA 的细胞质及核仁显示橘红色荧光体外培养的肝癌细胞吖啶橙荧光染色【注意事项】(1)制片后一定要晾干玻片,在进行后续步骤,否则会导致细胞脱落。
吖啶橙染色原理

吖啶橙染色原理
吖啶橙是一种有机化合物,化学式为C17H19N3,是一种荧光色素,主要用作荧光指示剂,可发出不同颜色的荧光。
其染色原理主要基于它能够与细胞中的DNA和RNA结合,并且具有膜通透性,能够透过细胞膜,使核DNA和RNA染色。
在应用方面,吖啶橙可以用于检测凋亡细胞。
在凋亡过程中,染色质固缩或断裂为大小不等的片断,形成凋亡小体,使得吖啶橙能够染上致密浓染的黄绿色荧光,或黄绿色碎片颗粒。
此外,吖啶橙还可以用于检测坏死细胞,因为坏死细胞黄荧光减弱甚至消失。
此外,吖啶橙还可以用作移码突变的诱变剂。
在DNA复制过程中,吖啶橙能镶嵌于两个相邻的碱基对之间,导致DNA链增加或缺失一个碱基,从而造成移码突变。
需要注意的是,虽然吖啶橙是一种非常有用的荧光指示剂和细胞染色剂,但在使用过程中也需要遵守相应的安全操作规范,避免直接接触皮肤和眼睛,并确保在通风良好的环境中使用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
吖啶橙/溴化乙锭双荧光染色AO / EB原理与流程zhongyisheng:1、原理:吖啶橙(AO)能透过胞膜完整的细胞,嵌入细胞核DNA,使之发出明亮的绿色荧光。
溴乙锭(E仅能透过胞膜受损的细胞,嵌入核DNA,发橘红色荧光。
凋亡的细胞呈现为染色增强,荧光更为明亮,均匀一致的圆状或固缩状、团块状结构。
非凋亡细胞核呈现荧光深浅不一的结构样特征。
二者形态迥然相异,很易判别。
在荧光显微镜下观察,可见四种细胞形态:活细胞(VN),核染色质着绿色并呈正常结构;早期凋亡细胞(VA),核染色质着绿色呈固缩状或圆珠状;非凋亡的死亡细胞(NVN),核染色质着橘红色并呈正常结构;晚期凋亡细胞(NVA),核染色质为橘红色并呈固缩状或圆珠状。
2、AO/EB染色及观察结果:取 20-100μl的1:100稀释的染色剂置于载玻片的贴壁细胞上室温下静置20min,PBS洗涤2-3遍,上覆盖玻片,荧光显微镜下观察结果并计数20-200个细胞。
ym1051:1、能否提供具体实验步骤?2、您在文中所说的"1:100稀释的染色剂"是怎样稀释的?如何在载玻片上种上贴壁细胞?zhongyisheng:1、用1mlEP管稀释时,先取微量的染色剂,然后再取稀释剂(如BSA)加入EP 管吹打即可。
2、消毒灭菌处理后的盖玻片平放入培养皿或中即可实验。
ym1051:我好像已明白具体过程了:首先要进行细胞爬片,然后将染色剂滴加在已爬有细胞的盖玻片上,温育后洗涤,再盖上盖玻片则可进行观察了.是这样吗?如果不经过爬片处理而将细胞进行消化,再将细胞和染色剂滴加在盖玻片上进行观察,行吗?zhongyisheng: 的确,不经过爬片而是将贴壁细胞消化下来一样可以进行进一步的实验。
这是悬浮细胞的典型方法。
当然,由于进行免疫组化染色进行的形态学检查经常考虑到细胞的原貌,在国际上比较通用,尤其是在进行动态检查时。
医琳师妹:我将我所作的方法与大家共享:吖啶橙/溴化乙锭双荧光染色测定PC12细胞凋亡(acridine orange/ethidium bromide, AO/EB):(1)细胞爬片:在6孔培养板中预先置入玻璃盖玻片,接种细胞悬液,干预后,予95%乙醇固定15分钟,微干,然后准备荧光染色。
将100mg/L溶于PBS的吖啶橙和100mg/L溶于PBS的溴化乙锭各5μl(临用前混合加入,加样量宜小,有时各2μl-5μl足够,量太大容易形成细胞凋亡的假阳性),在照相前混匀后加入,轻轻吹打,30秒后用激光共聚焦显微镜观察照相。
(有人用15mg吖啶橙溶于100ml pH6.8的PBS中过滤,避光保存)计取5个视野,共100个细胞中凋亡细胞百分数。
(2)如制成细胞悬液:取100μl PBS稀释的细胞悬液,加2μl的染色液,其中AO/EB,各含100μg/ml,加入染料30秒后观察摄像。
(有人用PBS配制吖啶橙/溴化乙锭(AO/EB)混合液,各含100μg/ml。
细胞离心,悬液于PBS中,取100μl细胞悬液加4μl荧光染色液,轻轻吹打,滴至载玻片上,加盖玻片后立即置荧光显微镜下观察。
)fffwu: 请问:请评价AO/EB法观察细胞凋亡的方法! 哪里有相关图片!jmtang: 尤其第一篇文献!1.Critical evaluation of techniques to detect and measure cell death –study in a model of UV radiation of the leukaemic cell line HL60Marina Leite A1, Margarida Quinta-Costa A1, Pedro Simas Leite A1, José Eduardo Guimarães A1A1 IPATIMUP, Instituto de Patologia e Imunologia Molecular da Universidade do Porto, PortugalAbstract:The reliability of eight distinct methods (Giemsa staining, trypan blue exclusion, acridine orange/ethidium bromide (AO/EB double staining for fluorescence microscopy and flow cytometry, propidium iodide (PI) staining, annexin V assay, TUNEL assay and DNA ladder) for detection and quantification of cell death (apoptosis and necrosis) was evaluated and compared. Each of these methods detects different morphological or biochemical features of these two processes. The comparative analysis of the 8 techniques revealed that AO/EB (read in fluorescence microscopy) provides a reliable method to measure cells in different compartments (or pathways) of cell death though it is very time consuming. PI staining and TUNEL assay were also sensitive in detecting very early signs of apoptosis, but do not allow precise quantification of apoptotic cells. These threemethods were concordant in relation to induction of apoptosis and necrosis in HL60 cells with the various UV irradiation time periods tested. Both AO/EB (read by flow cytometry) and annexin V-FITC/PI failed to detect the same number of early apoptotic cells as the other three methods. Trypan blue is valueless for this purpose. Giemsa and DNA ladder might be useful as confirmatory tests in some situations.2.Zhang JH, Yu J, Li WX, Cheng CP. Related Articles, LinksEvaluation of Mn2+ stimulated and Zn2+ inhibited apoptosis in rat corpus luteal cells by flow cytometry and fluorochromes staining.Chin J Physiol. 1998 Jun 30;41(2):121-6.中华血液学杂志 1998年第1期 No.1 JANUARY 1998细胞凋亡与肿瘤的发生和治疗之间的关系是近年来国际上研究的热点,目前细胞凋亡的检测方法有DNA凝胶电泳法、电子显微镜法、染料透过法、TUNEL法和流式细胞仪法等。
我们用染料透过检测法[1]测定阿糖胞苷(Ara-C)诱导的HL-60细胞凋亡,取得了满意的结果,现报道如下。
材料和方法1.原理吖啶橙(AO)能透过胞膜完整的细胞,嵌入细胞核DNA,使之发出明亮的绿色荧光。
溴乙锭(EB仅能透过胞膜受损的细胞,嵌入核DNA,发橘红色荧光。
凋亡的细胞呈现为染色增强,荧光更为明亮,均匀一致的圆状或固缩状、团块状结构。
非凋亡细胞核呈现荧光深浅不一的结构样特征。
二者形态迥然相异,很易判别。
在荧光显微镜下观察,可见四种细胞形态:活细胞(VN),核染色质着绿色并呈正常结构;早期凋亡细胞(VA),核染色质着绿色呈固缩状或圆珠状;非凋亡的死亡细胞(NVN),核染色质着橘红色并呈正常结构;晚期凋亡细胞(NVA),核染色质为橘红色并呈固缩状或圆珠状。
细胞凋亡率由以下公式计算:2.材料细胞来源:HL-60细胞株,由南京铁道医学院血液科研究室提供。
AO/EB染料: 精确称取AO(Fluka产品)、EB(Fluka产品 )各1mg,分别溶于10ml pH7.2 PBS中使之配成100μg/ml的储备液,用前等量混合,备用。
3.方法3.1 HL-60细胞培养:将1×106/ml HL-60细胞接种于含20%小牛血清的RPMI 1640培养液中,加Ara-C终浓度为10μg/ml,置37℃、5%CO2浓度及饱和湿度的恒温培养箱中悬浮培养,孵育后分别于3,6,12,24及48小时观察结果。
3.2 AO/EB染色及观察结果:取细胞悬液 100μl,加入AO/EB染料4μl混匀,置1滴于载玻片,上覆盖玻片,荧光显微镜下观察结果并计数200个细胞。
3.3 DNA抽提及电泳:用酚、氯仿、异戊醇抽提DNA,1.5%琼脂糖凝胶电泳(0.5×TBE缓冲液,电压30V,电泳7~8小时),在紫外透射仪下观察结果并拍照。
结果Ara-C诱导HL-60细胞凋亡,在0,3,6,12,24和48小时其凋亡率分别为1.5%,14%,57.5%,66%,70.5%和60.5%。
实验显示于第6小时开始,随诱导时间延长,其凋亡率增高,但观察至48小时,凋亡率却减低,此时显微镜下可见许多细胞碎片(附表)。
DNA电泳在Ara-C诱导6小时后均见梯形条带。
讨论Ara-C是作用于细胞S期的特异性抗代谢药物,临床上用于各种白血病的治疗,过去认为其作用机制是杀细胞性的,但近年来认为小剂量Ara-C有诱导分化作用。
本实验显示Ara-C的作用机制是诱导细胞凋亡,且诱导作用在24小时内随诱导时间延长,其凋亡率逐渐增高,而经药物作用48小时后细胞凋亡率反而减低,并且在显微镜下可见较多的细胞碎片,考虑为细胞凋亡后继发性坏死所致,由于碎片无法计数,故导致计数时凋亡细胞相对减少,凋亡率相对下降。
