高中生物___检测生物组织中的糖类、脂肪和蛋白质PPT课件
高中生物必修一课件:2.1 糖类、脂肪、蛋白质的检测

你能举例说出哪些植物 器官的细胞中富含糖类,脂质 和蛋白质吗?如何从这些植物 器官中提取呢?
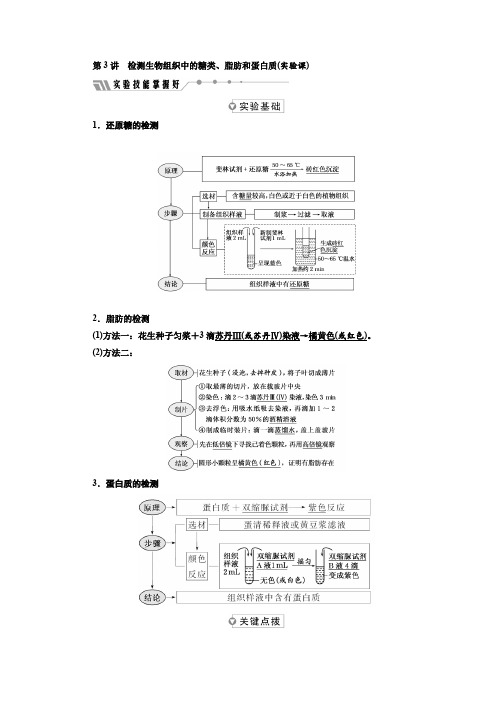
检测生物组织中的 糖类、脂肪和蛋白质
一、实验原理 二、实验目的要求
三、实验材料用具
四、实验方法步骤 五、注意事项
一、实验原理 某些化学试剂能够使生物组织中的有关有机化合物产
生特定的颜色反应。如:
△
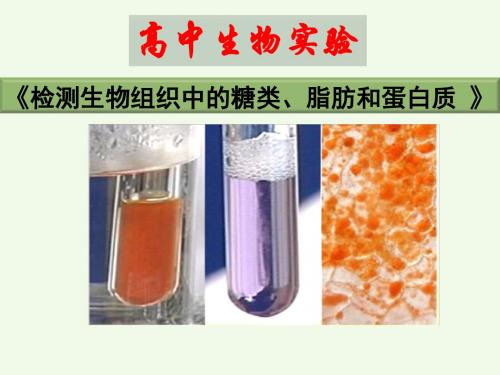
还原糖 + 斐林试剂 → 砖红色沉淀 脂肪 + 苏丹Ⅲ→橘黄色 或 + 苏丹Ⅳ→红色 蛋白质 + 双缩脲试剂→紫色
淀粉 + 碘→蓝色
二、目的要求:
尝试用化学试剂检测生物组织中糖类、脂肪和蛋白质。
三、材料用具:
1.实验材料:苹果汁、花生种子、花生汁、马铃薯 片、豆浆、鲜肝液
2.仪器: 3.试剂:斐林试剂、苏丹Ⅲ、碘液、双缩脲
四、方法步骤:
1.实验材料、仪器和试剂的选择
2.设计记录表格,记录预测结果 ★
3.检测的方法步骤 (1)还原糖的检测和观察; (2)脂肪的检测和观察; (3)蛋白质的检测和观察;
2.设计记录表格,记录预测结果
成分 待测样品
还原糖
*
#
脂肪
Hale Waihona Puke 蛋白质淀粉*处填写预测结果 #处填写实测结果
五、注意事项
(1)、检测还原糖时应水浴50~60度加热 (2)、检测脂肪时,切片要薄,用苏丹Ⅲ 染色时间不宜过长,用显微镜观察。
(3)
斐林试剂是甲乙两液等量混匀后立即使用,即 现配现用。颜色变化:浅兰色 棕色 砖 红色沉淀
高中生物___检测生物组织中的糖类、脂肪和蛋白质 PPT课件 图文

2mL 组织 样液
双缩脲试 剂A 2mL
双缩脲试 剂B 3-4滴
(创造碱性条件) (提供Cu2+)
水浴保温5 min
(3)冲洗涂片:用蒸馏水的缓水流冲洗载玻片10秒
吸水纸吸去载玻片上的水分
(4)染色
在载玻片上滴加两滴2滴用吡罗红,甲基绿染色剂,染 色5分钟
吸去多余的染色剂,盖上盖玻片
(5)观察:先低倍镜:选染色均匀,色泽浅的区域,移到视野中央 。后
高倍镜:观察细胞核和细胞质的染色情况。
0.9%生理盐水? 8%盐酸?
R—CHO+2Cu(OH)2→R—COOH+Cu2O↓+2H2O
甲液乙液等量混合,现用现配,切不可分开滴 加,或者久置后才用。
制备组织样液
砖红色的糖(还原糖)非(斐林试剂)常好吃
洗净、去皮、切块
梨或苹果
研磨
取5g,放入研钵中
过滤
滤液
(用单层纱布)
显色反应
向试管中加入 2ml组织样液
向试管中加入2ml 振荡混匀 50~65℃水
甲基绿使DNA呈现绿色,吡罗红使RNA呈现红色,通过观 察两种颜色出现的部位来判断DNA和RNA在细胞中的分布。
方法步骤:
(1)取材和制片
在洁净的载玻片上滴1滴0.9%NaCl溶液 用消毒牙签刮口腔内侧壁后涂抹在液滴上 将涂有口腔上皮细胞的载玻片在酒精灯上烘干
(2)水解:将烘干的载玻片放入盛有30 mL 8%盐酸的小烧杯中,30℃
检测生物组织中的糖类,脂肪和蛋白质

检测生物组织中的糖类、脂肪和蛋白质一、实验目的:尝试用化学试剂检测生物组织中糖类、脂肪和蛋白质二、实验原理:某些化学试剂能使生物组织中的有关有机化合物,产生特定的颜色反应。
思考2.试以葡萄糖为例写出相应方程式:思考3.蛋白质检测的反应机制是什么?三.实验材料思考4.做可溶性还原性糖鉴定实验应选择什么样的实验材料?为什么?思考5.做脂肪的鉴定实验应选择什么样的实验材料?思考6.做蛋白质的鉴定实验应选择什么样的实验材料?四、实验试剂斐林试剂(包括甲液:质量浓度为0.1g/ mL NaOH溶液和乙液:质量浓度为0.05g/ mL CuSO4溶液)、苏丹Ⅲ或苏丹Ⅳ染液、双缩脲试剂(包括A液:质量浓度为0.1g/ mL NaOH溶液和B液:质量浓度为0.01g/ mL CuSO4溶液)、体积分数为50%的酒精溶液,碘液、蒸馏水。
思考7.斐林试剂与双缩脲试剂相同吗?为什么?思考8.上述的酒精溶液起作用?五、方法步骤:1、还原糖检测和观察的操作方法:制备组织样液(去皮、切块、研磨、过滤)→取1支试管,向试管内注入2mL组织样液→向试管内注入1mL新制的斐林试剂,振荡→试管放在盛有50-650C温水的大烧杯中,加热约2分钟,观察到溶液颜色。
思考9.为什么苹果或梨组织液必须临时制备?思考10.实验中应将组成斐林试剂的甲液、乙液分别配制、储存,使用前才将甲、乙液等量混匀成斐林试剂,为什么?思考11.实验中能否将甲液、乙液分别加入苹果组织样液中进行检测?为什么?思考12.还原糖溶液检测过程中出现的颜色变化过程是怎样的?2、脂肪检测和观察的操作方法:方法一:向待测组织液中滴加3滴苏丹Ⅲ染液,观察样液被染色的情况;方法二:取材→切片→制片→观察思考13.为什么切片要尽可能薄些?思考14.制片过程中为什么要洗去浮色?思考15.制片过程中为什么要用吸水纸吸去花生子叶周围的酒精?思考16.制片过程中为什么在盖上盖玻片前要滴加蒸馏水?3、蛋白质检测和观察的操作方法:制备组织样液(浸泡、去皮研磨、过滤)→加样液约2ml于试管中→加入双缩脲试剂A,摇匀→再加入双缩脲试剂B液3~4滴,摇匀→观察颜色变化。
5检测生物组织中的还原糖脂肪和蛋白质

五、练习题
(一)单选题 1.下列糖类中属于可溶性还原糖的是:① 葡萄糖 ②淀粉 ③纤维素 ④蔗糖 ⑤果糖 ⑥ 麦芽糖 A.①⑤⑥ B.①② C.①②③④ D.②③④⑥
2.某学生在显微镜下观察花生子叶的切片 ,当转到细准焦螺旋时,有一部分细胞看得 清晰,另一部分细胞较模糊,这是由于 A.反光镜未调节好 B.标本切得厚薄不均 C.细准焦螺旋未调节好 D.显微镜物镜损坏
反应条件
反应现象 样液变 色 样液变 色
2、思考
(1)鉴定还原糖的选材为何不选用双子叶植 物或单子叶植物的叶片?理想的实验材料是 什么?
①在双子叶植物中,光合作用的主要产物 葡萄糖形成后,合成为淀粉,暂时贮藏在 叶子内,而淀粉属于非还原糖,因此,选 材时最好不用双子叶植物的叶子作实验材 料。
②有些单子叶植物,如韭菜、鸢尾等,并不 将光合作用的初始产物转变为淀粉,因此叶 内含有大量的还原糖。但是,由于叶片中叶 绿素含量高而颜色较深,对于鉴定时的颜色 反应起着掩盖作用,导致实验现象不明显, 因此,也不宜用单子叶植物的叶子作实验材 料。 本实验最理想的实验材料是还原糖含量 较高的植物组织或器官,而且组织的颜色较 浅或近于白色,如苹果和梨的果实。经实验 比较,颜色反应的明显程度依次为:苹果→ 梨→白色甘蓝叶→白萝卜。
四、例题 (一)考查实验材料
1.在生物组织中还原糖、脂肪、蛋白质的鉴定 实验中,对实验材料选择的叙述中错误的是 A.甘蔗茎的薄壁组织、甜菜的块根等,都含 有较多的糖且近于白色,故可以用于进行 还原糖的鉴定 B.花生种子含脂肪多且子叶肥厚,是用于脂 肪鉴定的理想材料 C.大豆种子蛋白质含量高,是进行蛋白质鉴 定的理想植物材料 D.鸡蛋清含蛋白质多,是进行蛋白质鉴定的 动物材料
7.脂肪鉴定实验时,切片做好后应进行的操 作步骤依次是 A.削片-染色-洗浮色-镜检 B.染色-洗浮色-制片-镜检 C.制片-镜检-染色-洗浮色 D.染色-制片-洗浮色-镜检
2.1检测生物组织中的糖类、脂肪和蛋白质课件

课堂教学
创设情境
以大头娃娃图片引起学生关注
实验一 模仿探究 由易到难、循序渐进学生完
成后直接展示结果。
实验二 尝试探究 用对照实验区分优质奶粉和劣
质奶粉。照应导入部分,激发 学生探究热情。创新实验材料、拓展实验思路,探 讨新的实验方法,逆向思考实验过程,深入思考实 验原理。
完成以上实验达成能力目标
2
学情分析
高中生的思维水平、学习能力已经发展到较高 阶段,乐于并有能力进行自主探究性的学习, 实验的内容与日常饮食有关,注重与现实生活 的联系,学生极易产生学习兴趣,设置不同层 3 次的探究,以适应不同智力水平、性格、兴趣、 思维方式学生的需要。但材料试剂多,规范操 作细节多,合作学习显得尤为重要
◆ 2. 双缩脲试剂B液也加1ml,观察到的颜色 是蓝色(B液的颜色掩盖了紫色导致)。
鸡蛋清稀释与不稀释对照
不稀释的蛋白将粘附在试管壁上,难以清洗
1.创新之处
2.设置拓展探究激发探究兴趣
本实验设计的最大的特点是进行了书本以外 的探究实验,每一个活动主题之后都有一 系列相关的小探究。为学生创造自主探究 的平台,引导学生自主探究。在分享探究 的过程中进一步激发学生兴趣,进一步强 化实验的原理。并且可以改变学生的一些 思维定势。让学生在探究过程中不断进行 总结和比较,进而得出最佳实验方法以及 掌握相关生物组织中的主要有机物。
斐林试剂甲液和乙液分别加入结果
1号先配置斐林试剂 2号甲液乙液分别加入 1.斐林试剂等量分别加入,对实验结果的影响不大 。培养学生不囿于权威,敢于质疑的精神。
选择番茄研磨液来探究是否含有还原糖
番茄研磨液作为实验材料,也可以观察到砖红色沉淀,但 是为了防止研磨液本身颜色的干扰,最好选择颜色较浅的 材料作为还原糖鉴定的材料。培养学生善于比较的态度。
第三讲 检测生物组织中的糖类、脂肪和蛋白质(实验课)

(2)用到有色材料的实验有: ①观察植物细胞的质壁分离和复 原;②观察叶绿体;③叶绿体色素的提取和分离。
(3)在选择实验材料时,不仅要考虑材料本身颜色的影响,还 要特别注意材料中是否包含实验对象,如甘蔗汁不能用来检测还 原糖,菠菜叶的表皮细胞不能用来观察叶绿体。
上表皮受光照强,叶绿体小而多
返回
命题点(二) 以种子成熟和萌发为素材, 考查有机物的检测
红色沉淀;黑暗中生长 24 h 的天竺葵叶片,淀粉被消耗,加入 碘液后不发生蓝色反应;玉米根尖经甲基绿染色后,在显微镜 下观察细胞核呈绿色;花生子叶经苏丹Ⅲ染色后,在显微镜下 观察脂肪颗粒呈橘黄色。 答案:B
返回
生物实验中的材料选取原则
(1)凡是用到染色剂的实验,一般都需要选择无色材料,涉及 的实验有:①还原糖、脂肪、蛋白质的检测;②观察 DNA、RNA 在细胞中的分布;③观察线粒体;④观察细胞的有丝分裂;⑤观 察细胞的减数分裂;⑥低温橘黄色颗粒
结论:花生种子的子叶中有脂肪存在
3.蛋白质的检测
鲜肝提取液或蛋清稀释液 选材与制备 黄豆浆滤液
颜色反应
结论:组织样液中存在蛋白质
三、疑难点拨
1.斐林试剂与双缩脲试剂比较
比较 项目 甲液 成分 0.1 g/mL NaOH溶液 斐林试剂 乙液 0.05 g/mL CuSO4溶液 A液 0.1 g/mL NaOH溶 液 双缩脲试剂 B液 0.01 g/mL CuSO4 溶液
返回
种子成熟与萌发时有机物的变化
(1)种子成熟时有机物的变化: 种子成熟时, 小分子有机物转化为大分子物质, 以便于储存, 主要营养物质变化如下:
①可溶性糖类→不溶性糖类(如淀粉)。
②非蛋白质氮→蛋白质。 ③糖类→脂肪。
人教版高中生物必修一2.1《实验:检测生物组织中的糖类、脂肪和蛋白质》说课课件(共31张PPT)

01 教材分析
3 教学目标
知识目标:
①尝试用化学试剂检测生物组
织中的糖类、脂肪和蛋白质 01
②推断组织液中有机物的种类
和大致含量
能力目标:
①学习实验探究的方法
情感态度价值观: ①充分发挥团队合作,交流互
02
②初步掌握评价和报告实验结 果的能力
动,获得成功体验的情感需要 ②进一步激发学生探求生命科
03
01 教材分析
2 教材地位和作用
新教材把实验安排在学习蛋白质、糖 类和脂质等知识内容之前,一方面为接下 来的学习各类有机物奠定感性认识基础, 另一方面,由于实验内容的设置上注重学 生对材料的选择,对检测结果的预期和实 验方案的设计,因此有利于培养学生的实 验探究的能力,为以后各章节的探究性实 验的顺利开展搭建了一个较高的起点。
学奥秘的兴趣
01 教材分析
4 教学重、难点
重点:检测生物组织中的糖类,脂肪和蛋白质的 原理和方法。 难点:1、实验所用材料多,试剂种类和使用方法 多,课堂容量大,一课时完成会很紧。2、脂肪检 测实验中徒手切片和显微镜的使用。
突破:充分准备、精心设计、分组实施
02 学情分析
1 对生物很感兴趣 学生情况 2 有化学实验操作经验
要求学生思考这个实验如何设计? • 激发学生的学习兴趣,促进其自主预习学习
04 教学设计
改 二、复习导入、知识讲解
• 基本原理 • 操作要点 • 注意事项
✓ 菲林试剂和双缩脲试剂 ✓ 器材的使用、材料的处理
• 多媒体演示显色反应的颜色
04 教学设计
改 三、分组讨论、实验设计ABCDE
F
按照6人划分一个学习小组、两个操作平 台,小组内成员分工明确,也就是说每个人 要清楚他负责做那些实验,哪些同学负责记 录现象,实验结束后哪些同学负责整理实验 用具等。
新教材高中生物探究实践检测生物组织中的糖类脂肪和蛋白质课件新人教版必修1ppt

项目
CuSO4溶液 浓度
不 检测物质
同 点
使用方法
反应条件
反应现象
相同点
斐林试剂
双缩脲试剂
0.05 g/mL
0.01 g/mL
还原糖
蛋白质
甲、乙两液等量 混合均匀使用
先加入A液, 再加入B液
50~65 ℃水浴加热
不需要加热
蓝色→棕色→砖红色
浅蓝色→紫色
含有NaOH和CuSO4两种成分,且NaOH的质量浓度都是 0.1 g/mL
3.用碘液、苏丹Ⅲ染液和双缩脲试剂测得甲、乙、丙三种植物的干种子中三
大类有机物颜色反应,其中“+”的数量代表颜色反应深浅程度,有关叙述错误
的是 ( )
碘液
苏丹Ⅲ染液
甲
++ቤተ መጻሕፍቲ ባይዱ+
++
乙
++
++++
丙
+
++
双缩脲试剂 + ++
++++
A.乙种子中含蛋白质最多 B.碘液、苏丹Ⅲ染液和双缩脲试剂与相应物质的颜色反应分别是蓝色、橘黄 色和紫色 C.在观察颜色时有可能用到光学显微镜 D.这三种试剂使用时均不需要水浴加热
【解析】选A。乙种子中,用苏丹Ⅲ染液进行染色时,颜色反应最深,说明乙种子 中含脂肪最多,A错误;碘液用于检测淀粉,其颜色反应为蓝色;苏丹Ⅲ染液用于 检测脂肪,其颜色反应为橘黄色;双缩脲试剂用于检测蛋白质,其颜色反应为紫 色,B正确;在检测种子是否含有脂肪时,要用到光学显微镜进行观察,C正确; 这 三种试剂使用时均不需要水浴加热,D正确。
检测生物组织中的糖类、脂肪和蛋白质(14张PPT)

2.生物组织中还原糖、脂肪和蛋白质三种有机物
A 的鉴定实验中,以下操作错误的是(
)
A、可溶性还原糖的鉴定,可用酒精灯直接加热产
生砖红色沉淀
B、只有脂肪的鉴定需要使用显微镜
C、用双缩脲试剂检测蛋白质不需要加热
D、使用斐林试剂和双缩脲试剂最好是现配现用
实验原理:某些化学试剂能够使生物组织中的有关 有机化合物产生特定的颜色反应。如下表
鉴定物质
鉴定试剂
颜色变化
还原糖 淀粉
脂肪
斐林试剂
碘液
苏丹Ⅲ染液(或苏丹 Ⅳ染液)
砖红色沉淀 蓝色
橘黄色(或红色)
蛋白质
双缩脲试剂
紫色
• 2. 操作流程
• (1)还原糖的检测
还原糖 白色或近于白色
斐林
呈现蓝色 还原糖
4.淀粉的鉴定
取材:马铃薯匀浆
检测:
碘液2滴
现象:
摇匀后变成蓝色
4、斐林试剂与双缩脲试剂比较
比较项 目
试剂及成分
溶液浓度
方法
可溶还 原糖的
鉴定
斐林试剂 NaOH和 CuSO4
NaOH浓 度为
0.1g/mL
CuS04 浓度为
0.05g/mL
先把NaOH 溶液和
CuSO4 溶液混合, 而后立即使 用。
砖红
还原糖的检测和观察:
2.脂肪的鉴定
取材:花生种子(浸泡3-4h),去皮,将子叶削成薄片
①选取最薄的薄片移至载玻片中央 ②在薄片上滴加苏丹Ⅲ(或苏丹Ⅳ) 染液2 - 3滴,染色
制片: 2-3min
③滴加体积分数为50%的酒精溶液1—2滴,洗去浮色
色(多余的苏丹Ⅲ )
④吸去余液,滴1-2滴蒸馏水,盖上盖玻片,制成临时装片
检测生物组织中的糖类、脂肪和蛋白质(实验课)
第3讲检测生物组织中的糖类、脂肪和蛋白质(实验课)1.还原糖的检测2.脂肪的检测(1)方法一:花生种子匀浆+3滴苏丹Ⅲ(或苏丹Ⅳ)染液→橘黄色(或红色)。
(2)方法二:3.蛋白质的检测1.三类有机物检测在操作步骤上的“三个唯一”(1)唯一需要加热——还原糖检测,且必须水浴加热,不能用酒精灯直接加热。
若不加热,则无砖红色沉淀出现。
(2)唯一需要使用显微镜——脂肪检测。
(3)唯一使用酒精——脂肪的鉴定,实验用体积分数为50%的酒精洗去浮色。
2.斐林试剂与双缩脲试剂的“一同、三不同”3.检测生物组织中还原糖、脂肪和蛋白质实验的四个注意事项1.料均较合理的一组是()A.韭菜叶、豆浆、大豆、洋葱鳞片叶内表皮B.梨、鸡蛋清、花生子叶、人口腔上皮细胞C.苹果、花生子叶、大豆、洋葱鳞片叶外表皮D.番茄、豆浆、花生子叶、人口腔上皮细胞解析:选B由于韭菜叶和番茄都具有颜色,会干扰实验效果,不能用于鉴定可溶性还原糖;花生子叶含脂肪较多而大豆和鸡蛋清含蛋白质较多。
2.(2016·海南高考)下列实验中,加入试剂后不能产生特定颜色的是()A.取成熟香蕉匀浆,用斐林试剂检测还原糖B.黑暗中生长24 h的天竺葵叶片,用碘液检测淀粉C.玉米根尖经甲基绿染色后,在显微镜下观察细胞核D.花生子叶经苏丹Ⅲ染色后,在显微镜下观察脂肪颗粒解析:选B成熟香蕉中含有较多葡萄糖,用斐林试剂检测会出现砖红色沉淀;黑暗中生长24 h的天竺葵叶片,淀粉被消耗,加入碘液不产生蓝色;玉米根尖经甲基绿染色后,在显微镜下观察细胞核呈绿色;花生子叶经苏丹Ⅲ染色后,在显微镜下观察脂肪颗粒呈橘黄色。
3.)①蛋白质鉴定时,将NaOH溶液和CuSO4溶液混合后再加入样液②还原糖鉴定时,进行水浴加热③淀粉鉴定时,直接将碘液滴加到淀粉样液中④鉴定酵母菌是否产生酒精,直接将重铬酸钾加入到酵母菌培养液的滤液中A.①④B.①③C.②③D.③④解析:选A蛋白质鉴定时,先向样液中加双缩脲试剂A液(NaOH溶液),摇匀后再加双缩脲试剂B液(CuSO4溶液);用重铬酸钾鉴定酒精时需要在酸性条件下进行。
高中生物检测生物组织中的糖类、脂肪和蛋白质
2min
2.操作步骤:课本P18
3.反应效果参考
葡萄糖 蛋白质 淀粉 花生油
显微镜下看到被染 成橘黄色的脂肪颗粒
作出预测 设计实验
第一步 小组讨论(5分钟)
第二步 小组分享,教师点评。 (3分钟)
实验记录表参考:
待侧 成分 样生物 材料
A 预实
B
C
D
分组探究,自主学习(15分钟)
最近,想要落在笔尖的话语实在太多,像是汩汩泉水不断的渗透着,滋养着每日的生活,多么想停下来好好的醉一场,多么想停下来好好的笑一场,就如同胖大星昨天发我的那种,等你熬过这段低谷期,也一定要找一个山花烂漫的地方,发自内心的笑出灿烂。 从早上起来时,内心的自己就呼唤出一个声音:好累啊!陪完客户,坐地铁回家,就在自己感觉疲惫不堪时,看到对面一位大叔,40来岁的年纪,提着一个曼玲粥店的袋子坐在边上,掏出了盒饭,大口大口的吃了起来,同行的老周碰了碰我说:“看!对面没有一个人是容易的。”
最近,想要落在笔尖的话语实在太多,像是汩汩泉水不断的渗透着,滋养着每日的生活,多么想停下来好好的醉一场,多么想停下来好好的笑一场,就如同胖大星昨天发我的那种,等你熬过这段低谷期,也一定要找一个山花烂漫的地方,发自内心的笑出灿烂。 从早上起来时,内心的自己就呼唤出一个声音:好累啊! 是啊,好累啊!哪里累?累什么?说不出来。 有点扎心,但是事实。没有一个人的生活是容易的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
使用方法
甲液和乙液混合均匀后方可 使用,且现配现用
使用时先加A液再加B液
反应条件
不 同
反应原理 点
颜色
需50-65℃水浴加热
不需加热即可反应
还原糖中的醛基被Cu(OH) 具有两个以上肽键的化合物
2 悬浊液氧化,Cu(OH)2被 在碱性条件下与Cu2+反应生
还原为砖红色Cu2O沉淀
成紫色络合物
砖红色
紫色
先加入A液1 mL,摇匀, 再加入B液4滴(不能过 量),摇匀
反应 条件
50~65 ℃水浴加热
不需加热,摇匀即可
反应 现象
样液变砖红色沉淀
样液变紫色
斐林试剂用的是甲液和乙液,须现配现用,混合均匀,水 浴加热。双缩脲试剂用的是A液和B液,先加A液,后滴B 液,不用水浴加热。
比较项目斐林ຫໍສະໝຸດ 剂双缩脲试剂选取最薄的切片置于洁净的载玻片中央
染色:在薄片上滴加23滴苏丹Ⅲ染液,染色23min
制片
洗去浮色:用吸水纸吸去染液,滴加体积分数为50%的酒精12滴
制成临时装片:滴12滴蒸馏水,盖上盖玻片
镜检观察:在低倍镜下寻找到已着色的 圆形小颗粒,然后用高倍镜观察。
视野中 有橘黄 色颗粒
橘黄色小圆颗粒 即为脂肪颗粒
化学试剂+有机化合物→特定的颜 色
斐林试剂与双缩脲试剂的比较
斐林试剂
甲液
乙液
双缩脲试剂
A液
B液
成分
鉴定 物质
0.1 g/mL 0.05 g/mL 0.1 g/mL 0.01 g/mL NaOH溶液 CuSO4溶液 NaOH溶液 CuSO4溶液
可溶性还原糖
蛋白质或多肽
添加 甲乙两液等量混匀后立即 顺序 使用(现配现用)
高中生物___检测生物组织中的 糖类、脂肪和蛋白质
实验:检测生物组织中的糖类、脂肪和蛋白质
实验原理:某些化学试剂能够使生物组织中的有关 有机化合物产生特定的颜色反应。
水浴加热
①还原糖 + 斐林试剂
砖红色沉淀
②脂肪 + 苏丹Ⅲ(或苏丹Ⅳ)染液→橘黄色(或红色)
③蛋白质 + 双缩脲试剂→紫色
④淀粉 + 碘→蓝色
R—CHO+2Cu(OH)2→R—COOH+Cu2O↓+2H2O
甲液乙液等量混合,现用现配,切不可分开滴 加,或者久置后才用。
制备组织样液
砖红色的糖(还原糖)非(斐林试剂)常好吃
洗净、去皮、切块
梨或苹果
研磨
取5g,放入研钵中
过滤
滤液
(用单层纱布)
显色反应
向试管中加入 2ml组织样液
向试管中加入2ml 振荡混匀 50~65℃水
浓度 相同点
乙液CuSO4浓度为0.05 g/mL B液CuSO4浓度为0.01g/mL
都含有NaOH、CuSO4两种成分,且所用NaOH浓度都是 0.1g/mL
双缩脲反应:含有两个或两个以上肽键的化合物与碱性硫酸 铜作用,生成蓝紫色的复合物
斐林试剂与双缩脲试剂都由NaOH和CuSO4组成,但二者有如 下三点不同: ①溶液浓度不同。斐林试剂中NaOH的浓度为0.1g/mL, CuSO4的浓度为0.05g/mL;双缩脲试剂中NaOH的浓度为 0.1g/mL,CuSO4的浓度为0.01g/mL。
三、蛋白质的检测: 双(双缩脲)子(紫色)弹(蛋白质)
(1)原理:蛋白质 + 双缩脲试剂
紫色络合物
(2)选材:黄豆、鸡蛋清(稀释)、牛奶、豆浆
(3)检测过程:
3-4滴双缩脲试剂B液,摇匀
2 ml组织样液
2 ml双缩脲试剂A液,摇匀
观察颜色变化
紫 色
双缩脲≠双缩脲试剂
将尿素加热,两分子尿素放出一分子氨而缩合成双缩脲。 反应式为:
双缩脲(H2NOC-NH-CONH2)在碱性环境(NaOH)中 能和Cu2+作用生成紫色的络化物,这个反应叫做双缩脲反应。 蛋白质分子中含有的肽键结构与双缩脲结构相似,因此,蛋白 质也可与双缩脲试剂发生颜色反应。
2mL 组织 样液
双缩脲试 剂A 2mL
双缩脲试 剂B 3-4滴
(创造碱性条件) (提供Cu2+)
脂肪 + 苏丹Ⅲ(或苏丹Ⅳ)染液 橘黄色(或红色)
注意事项:
(1)若用花生种子作实验材料,必须提前浸泡3~4小时,浸 泡时间短了,不容易切片,浸泡时间过长,则组织太软,切 下的薄片不易成形,切片要尽可能的薄。
(2)染色后一定要用50%的酒精溶液洗去浮色(酒精能溶解 苏丹Ⅲ),染色和洗浮色时间不宜过长。
②使用原理不同。斐林试剂实质是新配制的Cu(OH)2溶液; 双缩脲试剂实质是在碱性环境下的Cu2+。
③使用方法不同。使用斐林试剂时,先把NaOH溶液和CuSO4 溶液混合,然后立即使用。使用双缩脲试剂时,先加入NaOH 溶液,然后再加入CuSO4溶液。
一、可溶性还原糖的检测:
(1)原理:还原糖 + 斐林试剂 水浴加热 砖红色沉淀。 (2)选材:苹果、梨、白萝卜。含糖量较高,颜色为 白色或近于白色的植物组织。 (3)检测过程:
还原糖的检测结果
斐林试剂与可溶性还原糖在水浴热的条件下,生成砖红色的 Cu2O沉淀。
-CHO+Cu(OH)2悬浊液
-COOH+Cu2O↓(砖红色)
二、脂肪的检测 (1)选材:经浸泡去种皮的花生种子。 (2)检测过程: 苏三(苏丹Ⅲ)送了我一个橘黄色的胭脂(脂肪) 切片:花生种子(浸泡3-4h),去皮,将子叶削成薄片。
新配制的斐林试剂
浴加热2min
或本尼迪特试剂
观察现象 观察溶液颜色变化:浅蓝色→棕色→砖红色
结论:生成砖红色沉淀,说明梨或苹果中含有还原糖。
2 ml组织样液
1 ml新配制的斐林试剂
5065℃水浴加热 约2min
浅蓝色
棕色
观察颜色变化 砖红色
【斐林试剂】:甲液:0.1g/mL的NaOH溶液,乙液:0.05 g/mL的CuSO4溶液,使用前等体积混合均匀(生成浅蓝色 的Cu(OH)2悬浊液),现配现用(时间一长,Cu(OH) 2 沉淀在溶液底部无法发生反应。且需要水浴加热。
2mL 组织 样液
刚配制的斐 林试剂2mL
振荡混匀
呈现浅蓝色
50~65℃水浴 加热2min
变成砖红色(Cu2O)
还原糖:含有半缩醛羟基的糖类,主要是葡萄糖、果糖和 麦芽糖。蔗糖、淀粉和纤维素属于非还原糖。
当质量浓度为0.1g/mL的氢氧化钠溶液与质量 浓度为0.05g/mL的硫酸铜溶液混合后,立即生成淡 蓝色的Cu(OH)2悬浊液。 Cu(OH)2与葡萄糖、 果糖、麦芽糖等可溶性还原糖共热,能够生成砖红 色的Cu2O沉淀。因此,利用该反应,可证明样液中 含可溶性还原糖。
