醇的催化氧化ppt课件
高中化学《乙醇催化氧化》最新公开课PPT课件

实验改进后的优点
1.希夫试剂制取原料易得,价格经济,操作简便。 2.通过冰水浴和加橡胶塞,减少了乙醛的挥发,使学生能
够明显体验到乙醇到乙醛的气味变化。 3.通过添加希夫试剂改良了乙醛的检测方法,学生可以在
直观的颜色变化中感受到乙醛的生成。
实验改进后的优点
4.50℃以下,热铜丝两次以上插入到无水 乙醇中,再滴加希夫试剂可以观察到明 显的实验现象。 5.运用手持传感技术(或pH计),通过 测定混合液pH的变化定量测量乙醛的产 生的量。
实验缺点: 气味的变化,学生很难感觉到差别。
实验改进原理与方法
乙醛的沸点只有20.8℃,选用冰水浴和加橡胶 塞减少乙醛的挥发,使学生能感受到气味的变化。
运用新的试剂希夫试剂检测醛基的存在,通 过观察颜色的变化来体验乙醇催化氧化中产生了 新的物质乙醛,增强了实验的效果和功能。
R-CHO+Na2SO3→R-CH(OH)SO3Na+NaOH不但可以 定性判断醛的产生,还可以采用手持传感技术 (或pH计),通过测定混合液pH的变化定量测量 乙醛的产生的量。
3. pH传感器标定和显示方式的设定
pH计只有经过标定和补偿才能采集正确的数值。一般选 择两点标定法,实验前首先必须准备pH值为4.00和6. 86的 标准溶液。将实验数据显示方式设为数字方式。
4. pH值的测定
待标定和显示方式设定结束,将pH计分别插入待测液 中。记录显示的pH值。
插入热铜丝的次数越多,pH计读数逐渐增大,碱性逐 渐增强,说明产生的乙醛的量越多。
乙醇催化氧化产物的定性 与定量检测
秀水青山就是 金山银山
原实验
在苏教版高中《化学2(必修)》中,乙醇的 催化氧化实验的做法是:
向试管中加入3~4mL无水乙醇,浸入50℃ 左右的热水中,以保持反应所需的温度。将铜丝 烧热,迅速插入乙醇中,反复多次,观察并感受铜 丝颜色和乙醇气味的变化。
醇的催化氧化规律

醇的催化氧化规律可以根据不同的醇类和催化剂进行研究和描述。
一般而言,醇的催化氧化规律包括以下几个方面:
催化剂选择:不同的催化剂对醇的氧化反应具有不同的催化活性和选择性。
常见的催化剂包括过渡金属催化剂如铂、钯、钌等,以及非金属催化剂如氧化铁、二氧化锰等。
选择合适的催化剂对于实现高效催化氧化具有重要意义。
氧化剂选择:氧化剂是促使醇氧化反应进行的重要组成部分。
常见的氧化剂包括氧气、过氧化氢、过氧化苯甲酰等。
氧化剂的选择和使用方式会影响醇的氧化反应速率和产物选择性。
反应条件:反应温度、压力、溶剂选择等反应条件对醇的催化氧化具有影响。
适当的反应条件可以提高反应速率和选择性,同时确保反应的安全性和高效性。
催化氧化机制:不同醇的催化氧化反应机制可能存在差异。
一般而言,催化氧化反应涉及醇分子的活化、氧化剂和催化剂之间的相互作用,以及反应中间体的生成和转化等过程。
醇的氧化 PPT

3.2、琼斯氧化反应(Jones氧化) 3.3、Corey和Schmidt法:伯醇与PDC“使用二甲基甲酰胺” (Me2NCHO, DMF)作为溶剂,可氧化伯醇至羧酸而不是 醛。有趣的是,当底物为烯丙基或者苄基伯醇时,反应产物 则到不了羧酸阶段。Corey和Schmidt的氧化饱和伯醇至羧酸 的反应需要在中性条件下进行
1.3.2、2-碘酰基苯甲酸(IBX) 1.3.3、二醋酸碘苯 1.4、Ley-Griffith 氧化反应 (TPAP/NMO) 1.5、Anelli氧化 1.6、MnO2的氧化 2、氧化成酮 3、氧化成羧酸 3.1、KMnO4 3.2、琼斯氧化反应 3.3、Corey和Schmidt法 4、二醇的氧化
一级醇(伯醇)可以被氧化为醛。 二级醇(仲醇)可被 许多氧化剂氧化为酮,但通常不能被氧化成醛,如:三氧化 铬(CrO3)的硫酸溶液(琼斯试剂),或在异丙醇铝条件下, 使用丙酮作为氧化剂(沃氏氧化反应)。 三级醇(叔醇)既 不可被氧化为醛又不可被氧化为酮。
Oppenauer氧化:是二级醇与丙酮(或甲乙酮、环己酮)在 碱存在下一起反应,醇被氧化为酮,ey-Griffith 氧化反应(TPAP/NMO):TPAP(四丙基高 钌酸铵)是一个温和的、在中性条件下使用的氧化试剂,对 带有酸敏基团或者多官能团取代底物的氧化反应,选择 TPAP/NMO组合试剂是非常合适的,它能够将伯醇和仲醇氧 化成相应的醛和酮,其高度的化学选择性对许多其它官能团 不产生影响,例如:烯键、炔键、内酯、环氧,甚至缩醛、 硅醚、四氢吡醚等。
Parikh- Doering 氧化反应的机理也与体系中形成烷氧基锍 盐中间体 相似,该反应的优点是副产物烷氧基甲基硫醚很 少
1.3、高价态碘化合物
1.3.1、 Dess-Martin Oxidation:戴斯-马丁氧化剂作为一种容 易制备、性能温和、选择性高而且环境友好的有机合成新试 剂,经常用于将伯醇氧化成醛、仲醇氧化成酮。其优点是反 应条件温和、速度适中、用量少、后处理简单。
乙醇的氧化反应

酶氧化的定义
01
酶氧化是一种生物化学反应,其中酶作为催化剂,加速化学反
应的速率。
乙醇酶氧化的过程
02
在酶氧化过程中,乙醇在乙醇脱氢酶的作用下被氧化成乙醛,
同时生成氢离子。
酶氧化的产物
03
在酶氧化过程中,乙醇被氧化成乙醛,进一步氧化可生成乙酸。
乙醇的化学氧化
化学氧化的定义
化学氧化是一种通过使用化学试剂将有机物氧化成更高级别的化 合物的反应。
THANKS
感谢观看
然而,过高的温度可能导致副反应增 多,降低产物的纯度。因此,选择适 当的温度是乙醇氧化反应的重要因素 。
催化剂的影响
催化剂可以降低乙醇氧化的活化能,使反应更容易进行。
不同的催化剂对乙醇氧化反应的催化效果不同,选择高效的催化剂可以提高产物 的选择性,减少副产物的生成。
压力的影响
在一定范围内,提高反应压力可以促 进乙醇的氧化反应。
乙醇的氧化反应概述
乙醇的氧化反应是指醇羟基在一 定条件下被氧化生成相应的醛或
酮的反应。
乙醇的氧化反应在化学工业、燃 料工业等领域具有广泛的应用,
如生产乙醛、乙酸等化学品。
乙醇的氧化反应可以通过不同的 途径和催化剂来实现,如空气氧
化、金属氧化物催化氧化等。
02
乙醇的氧化反应机理
乙醇的自由基氧化
自由基氧化的定义
乙醇氧化反应在可持续发展中的地位
替代化石燃料
乙醇作为一种可再生能源,通过氧化反应可以转化为燃料 或化学品,替代部分化石燃料的使用,降低碳排放和环境 污染。
化工原料来源
乙醇可以通过氧化反应转化为多种重要的化工原料,如乙 醛、乙酸等,为化学工业提供可持续的原料来源。
醇的氧化

酯化反应
• R1-CH2-OH+HOOC-R2 →R1-CH2-OOC-R2+H2O
饱和Na2CO3 作用
• 吸收挥发出来的乙酸 • 溶解乙醇 • 减少乙酸乙酯 在水中的溶解
酯类水解
• R1-CH2-OOC-R2+H2O → HOOC-R2 + R1-CH2-OH
• 酸性条件水解不彻底 • 碱性条件水解彻底
醇醛酸酯的相互转化
醇
醛
酯
酸
醇的氧化
• 伯醇(R-CH2-OH)可被氧化 氧化为醛(R氧化 CHO) • 2R-CH2-OH+O2→2R-CHO+2H2O (R-是 烃基) 2CH3CH2OH+O2→2CH3CHO+2H2O(乙 醇的氧化,催化剂Cu、Ag,加热
氧பைடு நூலகம்与还原
• 加氧脱氢为氧化,加氢脱氧为还原 • 醛既可以被氧化也可以被还原 • 注意: 所得到的羧酸不可以加氢 注意:
醛基与新制Cu(OH)2
• R-CHO + 2Cu(OH)2 → R-COOH + Cu2O (红色沉淀) + 2H2O
• • • •
条件加热 新制Cu(OH)2 增大反应接触面 用于医学上还原糖的鉴定 银镜反应: 银镜反应: CH3CHO + 2Ag(NH3)2OH →CH3COONH4 +1H2O + 2Ag↓+ 3NH3
醇的氧化反应原理和现象

醇的氧化反应原理和现象
醇的氧化反应是指醇分子中的氢原子转移给氧气,形成水和相应的醛或酮的反应过程。
这样的氧化反应通常需要催化剂的存在,常见的催化剂有氧化剂如二氧化铬(CrO2)、高价铜氯(CuCl2)、酸性高锰酸钾(KMnO4)等。
醇的氧化反应是一种氧化还原反应,即醇的氧化态提高,同时氧化剂的还原态降低。
在反应过程中,醇中的氢原子被氧化剂的氧原子取代,形成水分子,同时产生相应的醛或酮。
例如,乙醇(CH3CH2OH)可以氧化为乙醛(CH3CHO)或乙酸(CH3COOH)。
氧化反应可由如下反应式表示:
乙醇+ 氧气→乙醛+ 水
乙醇+ 氧气→乙酸+ 水
氧化反应通常在一定的温度和压力条件下进行。
反应的速率和产物的选择取决于氧化剂的性质和反应条件的控制。
此外,氧化反应还可能伴随着其他反应,如分解、重排等。
催化氧化(烃类选择性氧化)
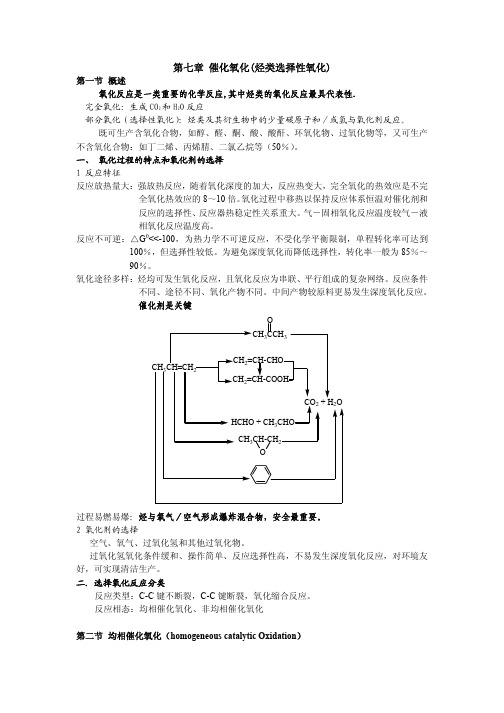
催化自氧化、络合催化氧化、烯烃的液相环氧化
一.催化自氧化 1 反应特征
O2 + CH3CHO(l)
CH3COOH 诱导期长,开始慢,迅速完成反应
O2 + CH3CHO(l) Mn(Ac)2 CH3COOH
O
CH3CCH3
CH3CH=CH2
CH2=CH-CHO CH2=CH-COOH
CO2 + H2O HCHO + CH3CHO
CH3CH-CH2 O
过程易燃易爆:烃与氧气/空气形成爆炸混合物,安全最重要。 2 氧化剂的选择
空气、氧气、过氧化氢和其他过氧化物。 过氧化氢氧化条件缓和、操作简单、反应选择性高,不易发生深度氧化反应,对环境友 好,可实现清洁生产。 二.选择氧化反应分类
CH2=CH2 + 1/2O2 H2O
CH3CHO
烯烃与亲核试剂不反应,当与高价金属离子配位后,电子云密度降低,方与亲核试剂
反应,氧化最容易在最缺氢原子的碳原子上进行。由于空间位阻效应和钯催化异构化的影响,
氧化反应速度随碳原子数的增多而递减,选择性降低。
2、 Wacker 反应的作用
乙烯均相络合催化氧化工艺的选择性高,促进了过渡金属络合物催化剂对烯烃液相氧
在下才能使丙烯环氧化。
CH3 CH3-C-H + O2
CH3
H3C
CH3
HOOC
COOH 反应产物为稳定的有机物,不易进一步氧化
CH3CHO
CH3COOH 高转化率和高选择性
而对于目的产物为中间产物的,由于中间产物较原料更易氧化,故应控制单程转化率,
醇的催化氧化的机理

醇的催化氧化的机理
醇的催化氧化机理可以分为两步骤:首先是醇的氧化步骤,其次是产物的分解和重新组合步骤。
1. 醇的氧化步骤:
在催化剂的作用下,醇分子首先与氧气发生氧化反应。
对于一般的醇分子,其氧化反应可以分为两种类型:
a) 亲氧性氧化(alcohol dehydrogenation):醇中的氢原子被去除,生成相应的醛或酮。
这一步骤可以通过醇分子在催化剂表面上的吸附形成活化中间体来实现。
在活化中间体的形成过程中,醛基或酮基与催化剂通过化学键相连。
b) 氧辅助氧化(oxygen-assisted oxidation):醇中的氧原子被氧气的氧原子取代,生成相应的酮或醛。
该反应可以通过醇分子在催化剂表面上的吸附形成活化中间体来实现。
2. 产物分解和重新组合步骤:
在醇经历氧化步骤后,生成的酮或醛可能会进一步发生分解和重新组合反应,生成更多的副产物。
这些反应通常发生在醇的氧化反应的副产物和催化剂表面的氧而不是醇分子之间。
总体来说,醇的催化氧化机理涉及醇的氧化反应和产物的分解和重新组合反应两个主要步骤。
具体的反应机制可能受到催化剂的种类、反应条件和醇分子的结构等多种因素的影响。
根据醇类催化氧化反应的原理

催化剂的影响
催化剂是醇类催化氧化反应中的关键因 素之一,它可以加速反应速率并提高反
应选择性。
催化剂的种类和性质对催化氧化反应的 常见的催化剂包括金属氧化物、金属盐、
活性和选择性有重要影响。
金属络合物等,不同的催化剂具有不同
的活性中心和反应机理,因此选择合适
的催化剂是实现高效催化氧化的关键。
反应条件的影响
醇类催化氧化反应的原理
• 醇类催化氧化反应概述 • 醇类催化氧化反应的机理 • 醇类催化氧化反应的影响因素 • 醇类催化氧化反应的应用 • 醇类催化氧化反应的未来研究方向
01
醇类催化氧化反应概述
醇类催化氧化反应的定义
01
醇类催化氧化反应是指醇在催化 剂的作用下与氧气发生化学反应 ,生成相应的醛、酮、酸等化合 物的过程。
例如,在醇类催化氧化反应中,可以将伯醇转化为醛,将仲醇转化为酮,将叔醇转化为羧酸。这些化 合物在医药、农药、香料等领域具有广泛的应用。
在燃料工业中的应用
醇类催化氧化反应在燃料工业中也有重要的应用,可以用于 生产燃料添加剂和燃料替代品。例如,通过醇类催化氧化反 应可以将甲醇转化为甲醛,甲醛可以作为燃料添加剂,提高 燃料的燃烧性能和减少污染物排放。
在均裂脱氢机理中,醇分子中的C-H键在催化剂的作用下发生均裂,产生一个碳正离子和一个自由基。这个过程 中,电子从C-H键转移到催化剂上,使C-H键断裂。碳正离子随后与氧气结合,形成过氧化物,而自由基则与另 一个醇分子反应,继续传递电子。
氢原子转移机理
总结词
氢原子转移机理是另一种重要的醇类催化氧化反应机理,涉及醇分子中的氢原子在催化剂的作用下转 移到另一个醇分子上。
详细描述
在氢原子转移机理中,醇分子中的氢原子在催化剂的作用下转移到另一个醇分子的氧原子上,形成水 和醇的过氧化物。这个过程中,催化剂通过接受和传递电子来促进氢原子的转移。随后,过氧化物分 解成水和二氧化碳,完成氧化反应。
醇类发生催化氧化
H O H C C H H 氧化 氧化 总结: CH3CHO CH3COOH 总结:CH3CH2OH 还原
CnH2n+2O
CnH2n O
CnH2nO2
醛表现为具有氧化性、还原性。但以还原性为主。 醛表现为具有氧化性、还原性。但以还原性为主。
学 与 问
写出甲醛发生银镜反应, 写出甲醛发生银镜反应,以及与新制的 氢氧化铜反应的化学方程式
2、定量关系 3、该反应的用途 4、试管壁上附着的银镜要如何清洗? 试管壁上附着的银镜要如何清洗? 5、反应条件
(2)与新制的氢氧化铜反应 [实验 ] 新制的氢氧化铜反应 实验 实验3-6
2Cu(OH)2+CH3CHO
弱氧化剂
△
Cu2O↓+CH3COOH+H2O
现象:有红色( 现象:有红色(Cu2O)沉淀生成 活动:1、Cu(OH)2的作用?反应类型? 活动: 的作用?反应类型? 2、定量关系。 定量关系。 3、反应条件:加热、碱过量 反应条件:加热、 4、医疗上的用途? 医疗上的用途? 5、乙醛能否使酸性 乙醛能否使酸性KMnO4、溴水褪色? 使酸性 、溴水褪色?
O
H C H
讨论并总结能使酸性高锰酸钾褪色的有机物有哪些? 讨论并总结能使酸性高锰酸钾褪色的有机物有哪些?
分子结构中: 分子结构中:
碳碳三键; 有机物; 含有碳碳三键;碳碳双键的不饱和有机物; 苯的同系物; 以及苯的同系物; 羟基、 含有羟基、醛基的物质一般能被酸性高锰酸钾溶液氧化
O
科学视野
丙酮
CH3-C-CH3
这个反应属于氧化反应还是还原反应?为什么? 这个反应属于氧化反应还是还原反应?为什么?
小结:有机化学反应还原、氧化反应的判断方法 小结:有机化学反应还原、
乙醇的催化氧化反应 高中化学必修二教学课件PPT 人教版

2CH3CHO+2H2O+2Cu 有刺激性气味 红色
Cu
2C2H5OH + O2
2CH3CHO +2 H2O
工业上利用该反应制取乙醛!
乙醇的催化氧化反应
谢谢!
乙醇的催化氧化反应
为什么人会喝醉酒?
酒
的
乙醛的毒性大概
主 要
是乙醇的10倍
成
分
是
乙
醇
学生实验:乙醇被氧化成乙醛
(1)点燃酒精灯,拿一根洁净 的铜丝在酒精灯外焰灼烧
注意铜丝前后颜色的变化!
(2)把灼热的铜丝放入盛有 乙醇的小烧杯中。
注意铜丝前后颜色的变化!
(3)闻液体的气味。
乙醇被氧化成乙醛
实验现象
加热
插入 乙醇
2Cu + O2=== 2CuO
闻到刺激性气味
乙醇被氧化成乙醛
实验现象
插入 乙醇
HH || H—C— C—H || H O—H
+ CuO
闻到刺激性气味
HH || H—C — C =O | H
+ Cu +HΒιβλιοθήκη O乙醇的催化氧化反应叠
2Cu + O2 === 2CuO
加
红色
黑色
2C2H5OH+2 CuO 黑色
醇 课件

放热
CH3CHO+Cu+H2O。 (2)乙醇和乙醛沸点都不高,乙醇受热蒸发变成蒸气,乙醛遇冷变 为液体。 (3)加热条件下,醇可以与CuO反应生成铜。 (4)2-甲基-2-丙醇分子中与羟基相连的碳原子上没有氢原子,故不 能发生催化氧化反应。
答案(1)2Cu+O2 2CuO
CH3CH2OH+CuO CH3CHO+Cu+H2O (2)加热 冷却 (3)固体由黑色变为红色 (4)不能反应
2.醇类发生催化氧化反应的一般规律 醇类的催化氧化反应与羟基直接相连的碳原子上的氢原子数有 关:
典例引领 【例题2】 某实验小组用下列装置进行乙醇催化氧化的实验。
(1)实验过程中铜网交替出现红色和黑色的现象,请写出相应的化
学方程式:
、
。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明乙
例如:①
命名为 3-甲基-2-戊醇;
②
命名为 3,4-二甲基-2-戊醇。
二、醇的性质 1.物理性质
2.化学性质
醇的消去反应和取代反应 问题探究
1.如何配制1∶3的酒壁缓慢注入浓硫酸,并边加边用玻璃 棒搅拌。
2.乙醇与浓硫酸混合加热可能生成哪些产物?属于什么反应类型? 写出相关反应方程式。
3.乙醇发生催化氧化反应中哪些键断裂?
提示乙醇发生催化氧化时,断键部位为
。
4.
、
、
能否发生催化氧化反应?若能发生催化氧化反应,写出有机产物 的结构简式。
提示
;
;
不能发生催化氧化反应。
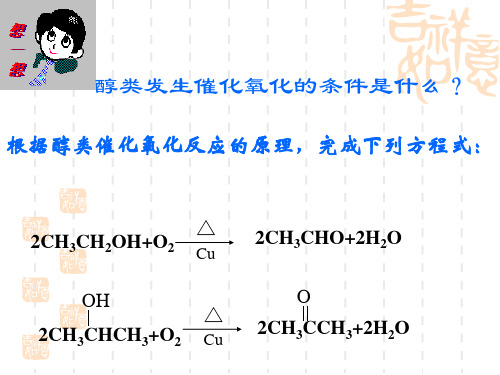
1.乙醇的催化氧化原理
2Cu+O2 2CuO ① CH3CH2OH+CuO CH3CHO+H2O+Cu ② ①+②×2 得: 2CH3CH2OH+O2 2CH3CHO+2H2O
最新《醇》课件幻灯片

二、乙醇
(一)乙醇的结构
分子式 结构式
结构简式 官能团
C2H6O
HH
CH3CH2OH
H—C—C—O—H HH
或C2H5OH
—OH (羟基)
(二)乙醇的物理性质:
让我 想一想?
颜 色 : 无色透明 气 味 : 特殊香味 状 态: 液体 挥发性: 易挥发 密 度: 比水小
乙醇
O
乙醛
氧化
CH3COOH
乙酸
乙醇 K2Cr2O7 (橙红色)
驾 驶 员 正 在 接 受 酒 精 检 Cr2(SO4)3 查
(绿色)
三、消去反应
HH
HC
C
H
浓H2SO4 1700C
CH2=CH2
+H2O
H OH
羟基和氢脱去结合成水
反应 与金属反应
催化氧化 消去反应 分子间脱水 与HX反应
⑤
H H② ①
+2H2O
启迪思考:
当--C上没有氢或只有 一个氢的情况又如何氧 化呢?
思考:
CH3
CH3
CH3-C-OH、 CH3-CH-OH、 CH3
都属于与乙醇同类的烃的衍生物,它们能否发生象乙 醇那样的催化氧化反应?如能,得到什么产物?
结论:羟基碳上有2个氢原子的醇被催化氧化成醛。
羟基碳上有1个氢原子的醇被催化氧化成酮。 羟基碳上没有氢原子的醇不能被催化氧化。
CH3CHO+Cu+H2O 乙醛
现象:Cu丝黑色又变为红色,产生特殊 气味(乙醛的气味)液体。
催ቤተ መጻሕፍቲ ባይዱ剂
2CH3CH2OH + O2 2CH3CHO + 2H2O 由此可见,实际起氧化作用的是CuO而
醇的氧化

应用 :乙苯脱氢制苯乙烯
将新鲜乙苯于回收循环乙苯混合后,与过热蒸汽一起进入两个串 连的固定床脱氢反应器,控制反应温度550~650℃。Fe2O3为主催
化剂,CrO3、Cu2O等助催化剂涂于氧化铁、碳酸钾等载体上,投
料比水蒸气:乙苯=2~3:1(质量)。反应所得气体混合物经冷凝、 油水分离、单塔分离和精制,得苯乙烯。
1.铬酸
(1)氧化醇
铬酸氧化仲醇生成酮比由伯醇制备醛的收率好,
尤其适用于一些水溶度较小的酮的制备;若加入
Mn2+,则可以减少副反应,收率更好。
醋酸可的松的合成。
CH2OAc HO C O OH O
AcOH,CrO3,MnSO4
CH2OAc C O OH (2) O
O
1.铬酸
仲醇被铬酸氧化
活性MnO2氧化不饱和醇成不饱和醛、酮,氧化时双键构型不受影响。
2KMnO4+3MnSO4+2H2O
5MnO2↓+K2SO4+2H2SO4
2.活性二氧化锰
CH2OH 活性MnO2 CH2Cl2 r.t CH2OH
HO OH
CHO
CH2OH
HO OH
活 性 MnO2
HO
Me Me Me CH2OH Me MnO2 >95% Me
应用实例
O CH3 3O2 CH3 C O C O 3H2O
邻苯二甲酸酐的合成
由邻二甲苯为原料经气相催化氧化法生产。采用V2O5为
催化剂,反应温度为375~460 ℃ ,邻二甲苯浓度为 40~60g/m3,进料空速2000~3000h-1,苯酐选择性以邻二 甲苯计为78%。
生产工艺流程图
乙醇和铜的催化氧化

乙醇和铜的催化氧化醇氧化催化是一种反应,它能将一种有机物质如乙醇,氧化成另一种物质,并且在这个反应过程中会使用铜作为催化剂。
乙醇氧化催化具有很多优势,包括低能耗、高效率以及不受外界影响的稳定性,使得这种反应被广泛应用于化学和药物行业。
一、乙醇氧化催化的基本原理乙醇氧化催化反应的基本原理是,当原料中的乙醇经过铜催化剂的作用,它的反应单位——羟基可以和氧分子形成羟基氧化物(乙醇氧化物),从而在反应传递过程中有效地生成了乙醇氧化物。
二、乙醇氧化催化反应的原料1. 乙醇:乙醇是醇氧化反应的基本原料,几乎所有乙醇氧化反应都以乙醇为主要输入原料,乙醇氧化反应中乙醇会和氧分子发生反应并产生乙醇氧化物,从而达到乙醇氧化反应的目的。
2. 铜:铜是乙醇氧化催化反应的关键催化剂,铜能够使乙醇的羟基发生亲和作用,从而促进氧化反应的发生。
而且,铜在乙醇氧化催化反应中具有抑制反应中间产物的功能,有效地降低了反应中的化学耗能。
三、乙醇氧化催化反应的应用1. 工业应用:乙醇氧化催化反应在工业中有着广泛的应用,它能够有效把乙醇氧化为一种醇类化合物,并应用于制造医药行业,生产羟乙基溴化钠等产品。
2. 生物学应用:乙醇氧化反应在生物学中有着重要的应用,它可以帮助有机生物体分解乙醇,使其得到更多的能量,并分解出更多的物质,达到更好的代谢效果。
四、乙醇氧化催化反应的优势1. 低能耗:乙醇氧化催化反应比起普通的氧化反应能耗更低,因为乙醇氧化催化反应可以有效减少反应过程中的化学耗能。
2. 高效:乙醇氧化催化反应反应速度比普通的氧化反应要快,因为催化剂可以促进反应速度,从而大大提高氧化反应的效率。
3. 稳定性:乙醇氧化催化反应具有比较稳定的反应性,反应过程不受外界因素的影响,这使得乙醇氧化催化反应能够更好地被应用于工业生产中。
醇催化氧化的条件

醇催化氧化的条件
醇催化氧化的条件是,Cu或Ag等过渡金属做催化剂和加热;与羟基相连接的碳原子即α碳原子上有氢原子。
同时还要有催化剂,并且在加热的条件下发生催化氧化。
因为醇有α-H,也就是与C-OH相连的C上的H,就比如CH3CH2OH 可以发生催化氧化,而(CH3)3COH却不能够发生催化氧化。
醇要发生催化氧化,与羟基相连的碳原子上就必须要有氢,有一个氢就会生成酮,有两个氢就会生成醛。
因为催化氧化是要脱去羟基上的一个氢,并且跟与羟基相连的碳原子上的一个氢发生反应,如果没有氢是没有办法完成脱氢的。
醇氧化产物是由羟基所连接的碳原子种类来决定的。
醇,有机化合物的一大类,是脂肪烃、脂环烃或芳香烃侧链中的氢原子被羟基取代而成的化合物。
醇类化合物受羟基的影响,存在分子间的氢键,在水中还有醇分子和水分子间的氢键。
所以,它们的物理性质与相应的烃差异较大。
主要表现在熔沸点比较高,在水中有一定的溶解度等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
.
3
(四)乙醇用途
乙醇是重要有机溶剂,还可作燃料,制饮料,作有机化工原料。 医疗上用75%酒精作消毒杀菌剂。
(五)乙醇工业制法
1、发酵法
以含糖类很丰富的农产品为原料经过发酵,再进行分馏可制得乙醇。 如:淀 粉 酶 葡萄 酒 糖 化 乙 酶 醇
2、乙烯水化法
以乙烯为原料,以H2SO4或H3PO4作催化剂,在加热、加压下与 水反应生成乙醇
件下的氧气
。
引申:C2H4和C2H5OH的混合气体中,C%=a,求O%。
.
7
3、催化氧化产物是
的醇是 ( )
(1)发生催化氧化后不能产生醛的醇是? (2)四个选项中的醇属于同分异构体的是?属于同系物的是?
.
8
CH2—CH2 浓H2SO4 170℃
H
OH
CH2=CH2 + H2O
CH3CH2OH
浓H2SO4 170℃
CH2=CH2+
Hபைடு நூலகம்O
浓硫酸:催化剂、脱水剂
消去反应:有机物在一定条件下从一个分子中脱去一 个小分子(如H2O、HX等),而生成含不饱和键化 合物的反应。
醇发生消去反应的条件: 与羟基相连的碳原子的. 相邻碳原子上有氢原子2。
4、取代反应 注意:若温度更低,则分子间脱水生成乙醚
(1)醇分子间脱水 C 2 H 5 O H H O C 2 H 5 浓 H 2 S O 4 C 2 H 5 O C 2 H 5 H 2 O
1 4 0 C
(2)与氢卤酸发生取代反应 C 2 H 5 O H H B r C 2 H 5 B r H 2 O
.
5
1、下列说法正确的是( ) A.获得无水乙醇的方法通常是先用无水硫酸铜吸水,然后
再加热蒸馏 B.除去乙醇中的微量水可加入金属钠,使其完全反应 C.获得无水乙醇的方法是通常先用浓硫酸吸水,然后再加
热蒸馏 D.获得无水乙醇的方法通常是先用生石灰吸水,然后再加
热蒸馏
.
6
2、有C2H4和C2H5OH的混合气体aL,完全燃烧需要相同条
C2 H C2 H H O H 催 加 化 压 C剂 3 H C2 H OH
.
4
总结
H⑤H② ①
H―C―C―O―H
④
③
HH
(1)乙醇的燃烧 (全断) (2)乙醇和钠反应键①断裂 (3)乙醇的催化氧化(断键①③ ) (4)乙醇的消去反应(断键②④ ) (5)乙醇和HX取代反应(断键①③ )
判断下列三种醇能否发生上述的催化氧化反应?
√ ①CH3CHCH3
OH ②CH3CCH3
CH2OH
CH3
判断① ③可否氧化成醛?
√ ③CH3CH2CHCH3 OH
(1)醇催化氧化的条件:与羟基相连的碳原子上有氢原子 (2)醇催化氧化生成醛的条件:
与羟基相连的碳原子上有两. 个或两个以上的氢原子 1
3、消去反应
