第6章 单组元相图及纯晶体的凝固1
材料学热力学篇第六章单组元相图及纯晶体凝固

返回
多相平衡状态1
当温度、压力、组分 的浓度改变时
相的个数 相的组成 相的相对含量
2020/11/19
多相平衡状态2
材料学热力学篇第六章单组元相图
及纯晶体的凝固
返回
• 材料的显微组织取决于成分、温度、压力等变量。 • 描述材料的组织与温度、压力、成分之间关系的工具:相图 • 相图是反映物质状态(固态、液态或气态)随温度、压力变
及纯晶体的凝固
返回
3、独立组元 系统中每一个能单独分离出来并能独立存在的化学纯物质。
4、自由度 在一定范围内,可以任意改变而不引起旧相消失或新相产生
的独立变量称为自由度。
2020/11/19
材料学热力学篇第六章单组元相图
及纯晶体的凝固
返回
二、相图热力学基础
1、相平衡的热力学条件
• 在平衡条件下,系统中各相的成分都保持着相对的稳定 性。
及纯晶体的凝固
返回
2020/11/19
纯材料铁学的热力相学篇图第六章单组元相图
及纯晶体的凝固
返回
二元系物质相图的表示方法
2020/11/19
二元Pb-Sb合金相图
材料学热力学篇第六章单组元相图
及纯晶体的凝固
返回
三元系物质相图的表示方法
2020/11/19
材三料学元热匀力学晶篇第相六图章单组元相图
• 单组分平衡体系最多能3相共存。
•
一个纯物质可以有许多不同的相态。例如炭:气相、
液相、固相 (无定形碳、石墨、金刚石、富勒烯族(C60)。
• 但碳的相图中最多只能三相共存,不可能四相共存.
2020/11/19
材料学热力学篇第六章单组元相图
及纯晶体的凝固
第六章单组元相图及纯晶体的凝固

P ——系统中能够同时存在的相(如:固相、液相、α相等)数。 2 ——表示温度和压力两个变量。
对于绝大多数的常规材料系统而言,压力的影响极小, 可看作常量(1个大气压),因此自由度数减少一个,相律 的表达式为:
(1 相) 组元:Fe
(1 相) 组元:Fe和C
(2相) 组元:Fe和C
●相图(Phase diagrams):是一个材料系统在不同的化学成分、 温度、压力条件下所处状态的图形表示,因此,相图也称为状态 图。由于相图都是在平衡条件(极缓慢冷却)下测得的,所以,相 图也称为平衡相(状态)图。
对于常用的合金相图,因为压力的影响很小,况且一般都是
等温等压下
……
……
如果体系中只有a和b两相,当极少量(dn2)的组元2从a相转到b
相,以dGa和dGb分别代表此时a相和b相的自由能变化,则引 起的总的自由能变化为:
由于 故 因此,组元2从a相自发转到b相的条件是:
当dG=0,即 内没有物质传输。
,a相和b相处于平衡状态,此时体系
同理,其他组元也应有同样的属性。 对于多元系的多相平衡条件可普遍写成:
2.过冷与过冷度 纯金属都有一个理论结晶
温度Tm(熔点或平衡结晶温度 )。在该温度下, 液体和晶体 处于动平衡状态。
结晶只有在Tm以下的实际 结晶温度下才能进行。
●凝固:由液相至固相的转变,如果凝固后的固体是晶体,则又 可称之为结晶。
●固态相变:不同固相之间的转变。
例1:糖水
相与组元的关系
第六章单组元相图及纯晶体的凝固

吉布斯相律对于单元系统(C=1)的应用 :
●压力可变(相图是由温度和压力两个变量组成的二维平面) 0≤ f≤2 f= 0时,由公式f =C-P+2,可知P = 3 意味着单元系统最多可以有三相共存。
●压力不变(相图是由温度一个变量组成的直线) 0≤ f≤1 f= 0时,由公式f =C-P+1,可知P = 2 意味着单元系统最多只能有二相同时存在。
纯水的相图
纯铁的相图(具有同素异构转变)
6.2 纯晶体的凝固 6.2.1 液态结构
固态下为晶体的材料,液态时结构介于晶态与气态之间 对液态结构X射线研究表明: 1)液体中原子之间的平均距离比固体中略大; 2)液体中原子的配位数比密排结构的固体的配位数减少,熔化
时体积略微膨胀,但对一些非密排结构(如Sb、Bi、Ga、Ge 等)的晶体例外; 3)液态中原子排列混乱的程度增加。
第六章 单组元相图及纯晶体的凝固
纯水的相图
纯铁的(PT)平衡相图
铜-银合金相图
基本概念 ●组元:组成一个体系的,且相互独立的基本单元。
可以是单质也可以是化合物( 如:Fe3C)
●单组元系统(单元系):由一种元素或化合物组成的材料或体系 金刚石、 二氧化碳(CO2)、石英(SiO2)、纯铁、纯铜……
dG
2ba2d来自2b0即,2b 2a 0
当dG=0,即 2b 2a ,a相和b相处于平衡状态,此时体系
内没有物质传输。
同理,其他组元也应有同样的属性。 对于多元系的多相平衡条件可普遍写成:
1a 1b 1 1P 2a 2b 2 2P
Ca Cb C CP
相平衡条件:处于平衡状态下的多相(P个相)体系,每个组 元(共有C个组元)在各相中的化学势都必须彼此相等。
第六章单组元相图及纯金

不同的是液态金属原子不象固态金属原子那 样作长程有序规则排列。由于液态金属所处的 温度较高,原子活动能力较强,所以它只能作 短程(近程)有序长程(远程)无序分布。其 结构示意图如右:
液态金属为什么会具有短程有序,长程无 序的结构?这主要是因为在液态金属内部存 在着较大的能量起伏和结构起伏所造成的。 ①能量起伏:由于液态金属所处的温度较高, 原子的热运动比较强烈,使各原子的能量 不相等,一些原子的能量高于整个体系原 子的平均能量,而另一些原子的能量低于 整个体系原子的平均能量,并且这种现象 瞬息万变,此起彼伏。 我们把这种原子能量的不均匀性称为能量 起伏。
2.纯金属凝固的一般过程
由于液态金属是不透明的,所以目前还无法直 接观察到它的凝固过程。但人们在显微镜下可直接 观察到透明物质的凝固过程,如观察到有机物氯化 铵饱和水溶液的凝固过程如下图:
该图可用来近似地描述纯金属的凝固过程,由 图可知纯金属的凝固过程,主要是通过形核和长大 两个步骤来完成。
①形核:液态金属通过能量起伏和结构起 伏,形成具有一定尺寸的晶胚的过 程。该一定尺寸的晶胚称为晶核。 ②长大:液态金属原子不断地迁移到晶核表 面上去的过程。
另外由纯金属的凝固过程示意图还可以看 出,液态金属在凝固后是由许多晶粒和晶界 组成的多晶体。 晶粒:由一个晶核长大形成的小晶体。 晶界:是晶粒与晶粒之间的交界面。 液态金属在凝固过程中形成的晶核数目越 多,晶粒越细小,晶界总面积就越大。
6.2.3纯金属凝固的热力学条件
1.液、固态金属的自由能-温度曲线 由物理化学可知,体系的自由能G可用下式 表示:G=H-TS。H-热焓,T-绝对温度,S-熵, 求体系的自由能与温度的关系曲线,只需求 出自由能随温度的变化率,即自由能对温度的 一阶导数。
第六章 单组元相图及纯晶体的凝固

L. Baykal
Dnieper
nu MA E ON A CD I be A AIA LB N B LGA I A U R
GR E E EC
Da
MOLD A OV
Sea of Japan
JA A PN
N TH K E OR OR A
MA LI
Black Sea
K ZA H TA A KS N
Irtysh
组元:基本单元- 单质或化合物 单质或化合物) ⅰ 组元:基本单元-(单质或化合物 ⅱ 相:相同的物理与化学性质;与其他部 相同的物理与化学性质; 分之间有界面 分之间有界面 元系: 个组元都是独立的体系 ⅲ n元系:n个组元都是独立的体系 元系
CND AAA
Hudson Bay Gulf of Alaska
Ar abian Sea
INIA D
C GO ON
Bay of Bengal
TH I LA D A N
K MP C E A UHA
I N ON S A D EI
BUE RNI MA Y I A LA S
L. Victoria
KNA EY S I LA K R NA TA ZA I A N N MA Y I A LA S SN P E I GA OR
B LGI U E M C anary I sl ands S AN PI AD R N OR A FR N E AC LU . X GE MA Y R N
Sea Baltic
Ob'
E TON A S I
ne Rhi
C C ZE H
S TZE LA D WI R N P N OLA D
LA I A TV LI TH A I A UN
学基础-第6章-单组元相图及纯晶体的凝固

7
第六章
单组元相图及纯晶体的凝固
二、晶体凝固的热力学条件 恒压时,dG/dT=-S,因SL>SS , G △G 故有:(dG/dT)L<(dG/dT)s 曲线GL-T与Gs-T必相交,交点对
(3) 螺位错生长机制(光滑界面的横向生长)
螺位错提供永不消失的小台阶,长大速度较慢
生长特点: ★不需在固-液界面上反复形核,不需形核功,生长连续; ★生长速率为:vg=μ3△Tk2 (μ3为常数)
27
第六章
单组元相图及纯晶体的凝固
五、结晶动力学及凝固组织
单组元相图及纯晶体的凝固
(2)二维晶核台阶生长(光滑界面 的横向生长) 生长特点:
★需要不断地形成新的二维晶核, 需形核功,生长不连续;
★晶体生长需要较大动态过冷度 △Tk(1~2℃); ★生长速率:vg=μ2exp(-b/△Tk) 式中,μ2、b为常数
二维晶核形核
26
第六章
单组元相图及纯晶体的凝固
固相晶面上原子所占位置分数 x
23
第六章
单组元相图及纯晶体的凝固
凝固时的固-液界面微观和宏观形态 粗糙界面:界面微观粗 糙,而宏观平直。
液 液
光滑界面:微观为由许多光滑 的小平面组成,而宏观不平。
液
液
固
微观
固
宏观
固
微观
固
宏观
粗糙界面中原子的堆放
光滑界面中原子的堆放
24
第六章
单组元相图及纯晶体的凝固
3
)
第6章 单组元相图及纯晶体的凝固

金属结晶微观过程=形核+长大
两个过程重叠交织
形核
长大
形成多晶体
三、金属结晶的热力学条件
思考:为什么液态金属在理论结晶温度不能结晶,而必须在一定过冷度下才
能进行?
热力学第二定律指出:在等温等压条件下,物质系统总是自发地从自由能较 高的状态向自由能较低的状态转变。
G H TS dG VdP SdT
G
4 3 r Gv 4r 2 3
分析:①r↑,体积自由能的减小的速率比表面能的增
加的速率要快,但开始时表面能占优; ②r增加到某一极限值,体积自由能的减小占优,出现 极大值ΔGK,对应 rK; ③r<rK,随晶胚尺寸r↑→ΔG↑(过程不能自动进行,
晶胚不能成为稳定晶核,瞬时产生,瞬时消失); ④ r>rK,随晶胚尺寸r↑→ΔG↓(自动进行→形成 稳定晶核) r=rK→临界晶核半径
不同润湿角的晶核形貌
非均匀形核
2)形核率
①过冷度的影响
非均匀形核可在较小过冷度下获得较高的形核率; 非均匀形核的最大形核率小于均匀形核 。
②固体杂质结构的影响 W cos LW L L固定不变,那么θ 角只 当液态金属确定之后,
近于 LW ,才能越接近于1。
均匀形核率和非均匀形核率 随过冷度变化的对比
则临界晶核中晶胞的数目:
n
VC 173 VL
铜是面心立方晶体结构,每个晶胞中的原子数为4,则一个临界晶核的原子
数目为1734=692个原子
思考:均匀形核所需要的过冷度很大,而在实际结晶中
并不需要这么大的过冷度,为什么?
上节重点内容回顾
1、液态金属结晶的结构条件—结构起伏或相起伏 2、均匀形核、非均匀形核 3、形核时的能量变化和临界晶核半径 4、形核功:能量起伏 5、形核率 rk、rmax rk rmax Δ Gk
第6章单组元相图及纯晶体的凝固

纯铁在固态下 有三种同素异 构体, -Fe 、 -Fe 体心立方 结构, -Fe 面 心立方结构。
6
6.2 纯晶体的凝固
6.2.1、液态结构
晶体材料的液态结构从长程上来说是无序的,而在近程范 围内却存在着晶态的原子排列情况即近程有序;而且由于 原子的热运动,这种排列是在不断变动的,称为“结构起 伏”。
(3)振动和搅拌: 在浇注和结晶过程中实施振动和搅拌,可以达到细化晶 粒的目的。 这是因为振动和搅拌可使结晶的枝晶碎化,增加晶核数 量;另外还能向液体中输入额外能量以提供形核功。
25
2、单晶的制备 (1)垂直提拉法: 先用感应加热或电阻加热方法熔化坩埚中的材料,使液 体保持稍高于熔点的温度,然后将夹有一个籽晶的杆下 移,使籽晶与液面接触。缓慢降低炉内温度,将籽晶杆 一边旋转一边提拉,使籽晶作为唯一的晶核在液相中结 晶,最后成为一块单晶体。 (2)尖端形核法:
8
6.2.3、形核
晶体的凝固是通过形核与长大两个过程进行的,即固相 核心的形成与晶核生长至液相耗尽为止。 形核的方式有两类: (1)均匀形核:新相晶核在母相中均匀地生成。 ( 2 )非均匀形核:新相优先在母相中存在的异质处形核。
实际溶液的凝固方式主要是非均匀形核。非均匀形核的 原理是建立在均匀形核基础上的。
(2)必须具备与一定过冷度相适应的能量起伏( G* )和 结构起伏( r* )。
12
形核率 N:当温度低于熔点时,单位体积液体内,在单位
时间所形成的晶核数。 形核率受两个因素控制,形核功因子和原子扩散的几率因子。
G * Q N K exp( ) exp( ) kT kT
形核率先随过冷度增大 而增大,有一极大值, 超过极大值后,形核率 又随过冷度进一步增大 而减小。
第六章 单组元相图纯晶体的凝固

第六章 单组元相图及纯晶体的凝固
概
•
述
•
• • • • •
单组元晶体(纯晶体):由一种化合物或金属组成的晶体。该体系称 单组元晶体(纯晶体) 由一种化合物或金属组成的晶体。 单元系( system) 为单元系(one component system)。 从 一 种 相 转 变 为 另 一 种 相 的 过 程 称 为 相 变 ( phase transformation) transformation)。 若 转 变 前 后 均 为 固 相 , 则 成 为 固 态 相 变 ( solid phase transformation ) 。 从 液 相 转 变 为 固 相 的 过 程 称 为 凝 固 solidification)。若凝固后的产物为晶体称为结晶 crystallization)。 结晶( (solidification)。若凝固后的产物为晶体称为结晶(crystallization)。 金属转变过程为:汽态←→液态←→ ←→液态←→固态 金属转变过程为:汽态←→液态←→固态 组元(component) 组成合金的最基本、独立的物质。 组元(component):组成合金的最基本、独立的物质。可以是单一 元素也可以是稳定的化合物。 元素也可以是稳定的化合物。 相图( diagram):表示合金系中合金的状态与温度、 相图(phase diagram):表示合金系中合金的状态与温度、成分之间 的关系的图形,又称为平衡图或状态图。 的关系的图形,又称为平衡图或状态图。 单组元相图( diagram)是表示在热力学平衡条件下所 单组元相图 ( single phase diagram) 是表示在热力学平衡条件下所 存在的相与温度,压力之间的对应关系的图形。 存在的相与温度,压力之间的对应关系的图形 合金系( system) 合金系 ( alloy system): 由给定的组元可以以不同比例配制成一 系列成分不同的合金,这一系列合金就构成一个合金系统。 系列成分不同的合金,这一系列合金就构成一个合金系统。单、二、三、 多元系。 多元系。 多相合金: 单、双、多相合金:
第6章 单元系相图

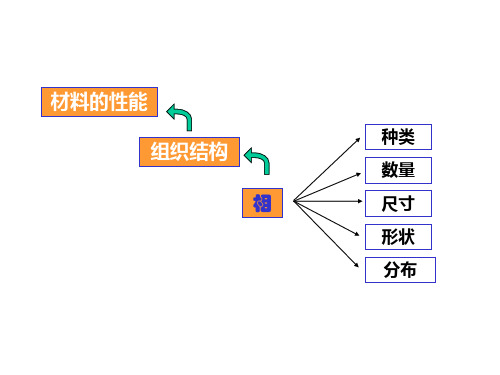
第6章单组元相图及纯晶体的凝固物质由液态转变为固态的过程称为凝固。
物质由液态转变为晶态的过程称为结晶材料的性能组织结构相种类数量尺寸形状分布C ONTENTS6.1 单元系相变的热力学及相平衡6.2纯晶体的凝固6.1单元系相变的热力学及相平衡1. 相(Phase)在一个系统中,成分、结构相同,性能一致的均匀的组成部分叫做相,不同相之间有明显的界面分开,该界面称为相界面。
注意:相在物理性能和化学性能上是均匀的。
相界面和晶界的区别。
6.1单元系相变的热力学及相平衡2. 组元(Component)组元通常是指系统中每一个可以单独分离出来,并能独立存在的化学纯物质,在一个给定的系统中,组元就是构成系统的各种化学元素或化合物。
按组元数目,将系统分为:一元系二元系三元系……化学元素:Cu, Ni, Fe 等化合物:Al 2O 3, MgO, Na 2O, SiO 2等6.1单元系相变的热力学及相平衡3. 相平衡在某一温度下,系统中各个相经过很长时间也不互相转变,处于平衡状态,这种平衡称为相平衡。
各组元在各相中的温度、压力和化学势相同。
A B热力学动态平衡6.1单元系相变的热力学及相平衡4.吉布斯相律(Gibbs Phase Rule)处于热力学平衡状态的系统中自由度与组元数和相数之间的关系定律,通常简称为相律。
f = C-P+N只考虑温度和压力对系统平衡状态的影响:f = C-P+2凝聚系统:f = C-P+1式中:f(freedom)是自由度数;C(component)是组成材料系统的独立组元数;P(phase)是平衡相的数目。
吉布斯相律的应用和局限性相律是检验、分析和使用相图的重要工具,利用它可以分析和确定系统中可能存在的相数,检验和研究相图。
注意使用相律有一些限制:(1)只适用于热力学平衡状态,各相温度相等、压力相等、化学势相等(化学平衡)。
(2)只表示体系中组元和相的数目,不能指明组元和相的类型和含量。
第六章、单组元相图及纯晶体的凝固

凝固4.1.2相律4.1 相图的基本知识相律:在平衡条件下,一个系统的组成物的组元数、相数、和自由度数之间的关系可以由相律来确定。
相律的数学表达式如下:F ——系统的自由度数C ——组成物的组元数P ——系统中能够同时存在的相数2 ——表示温度和压力两个变量,对于不含气相的凝聚体系,压力的影响极小,可以不把压力当作变量而看作常量:1个大气压(atm),因此自由度数减少一个,相律的表达式为:4.1.2 相律☐在压力不变(1atm )的条件下,F = C –P +1 = 2–P。
F = 0的含义是:在保持系统平衡状态不变的条件下,没有可以独立变化的变量。
即,任何变量的变化都会造成系统平衡状态的变化。
◼自由度数F 的最小值为0,当F = 0时,P = 2。
◼这说明,在压力不变(1atm)条件下,单元系统最多只能有二相同时存在。
(表现为??图形)☐如果压力可变,◼F = 0时,由公式F = C -P + 2 可知P = 3,◼单元系统最多可以有三相共存。
(表现为??图形)4.1.2 相律☐在压力不变(1atm)的条件下,F = C–P+1 = 3–P。
◼自由度数F的最小值为0,当F= 0时,P= 3。
◼这说明,当二元合金系统同时出现三个相时,就没有可以变化的因素了☐也就是说,只有在一定的温度、成分所确定的某一点才会出现三相同时存在的状态。
☐表现为??图形4.1.2 相律☐在压力不变(1atm)的条件下,F = C–P+1 = 3–P。
◼可以推断出,二元合金系统存在“三相共存状态”的平衡反应,仅有二大类型:A→B+C,A+B→C。
☐由于自由度数为0,这些平衡反应都是恒温反应,并且反应中的三个相(无论是反应相,还是生成相)的化学成分都是固定的。
☐只有当反应结束后(相数小于3时),随着温度的变化,相的化学成分才可能发生变化。
❶液体中原子间的平均距离比固体中略大;液态结构的特征❷液体中原子的配位数•对于密排结构晶体,液态时配位数减小——导致熔化时体积略为增加,•但对非密排结构的晶体,则液态时配位数反而增大,故熔化时体积略为收缩。
15材料科学基础第六章__单组元相图及纯晶体的凝固01
在熔点(Tm) Gs =Gl, △G = 0 △Gv =-Lm ·△ T/Tm △T= Tm-T △Gv < 0 △T>0 才能发生凝固。
即凝固热力学条件是:需要有过冷度
6.2.3 形 核
凝固过程包括形核和长大
形核方式分为: (1) 均匀形核 新相晶核在母相中均匀生成,
(5)熔融过程出现升温现象(边熔融边升温)。
6.2.6 高分子的结晶特征
高分子结晶与低分子结晶的异同性。
高分子中的晶体像金属、陶瓷及低分子有机物一样 ,三维方向长程有序,与低分子结晶具有相似性。
高分子是长链结构,使高分子长链排入晶格要困难 得多,呈现出不完全性和不完善性、熔融升温和结 晶速度慢的特点。
1. 相似性 (1) 晶粒尺寸受过冷度影响。△T越大,形核率升 高,球晶尺寸小,密度大。 (2) 包括形核和长大两个过程。
生长形态为树枝状长大:
a 光滑界面,树枝晶不明显 b 粗糙界面,树枝晶明显
负温度梯度下的界面形状
树枝晶长大 具有一定的 晶体取向, 与晶体结构 类型有关。
面心立方 <100> 体心立方 <100> 密排六方 1010
钢中的树枝状晶体
Ni-Ta-Mn-Cr合金中的树枝状晶体
3. 凝固后晶粒大小控制
即晶核由液相中的一些原子团直接形成。
(2) 非均匀形核 新相晶核优先在母相中的异 质处形核,即依附于液相中的杂质或表面形核。
1. 均匀形核
A. 晶核形成时能量变化 B. 临界晶核 只有达到临界半径时才能使晶胚成为稳定晶核 过冷度越大,临界半径越小,则形核几率增大, 晶核的数目增多。
C. 形核率
材料科学基础(上海交大)_第6章.答案

第6章 单组元相图及纯晶体凝固
6.1 单元系相变的热力学与相平衡
6.2 纯晶体的凝固
6.3 气固相变与薄膜生长
重点与难点:
• • • • • 结晶的热力学、结构和能量条件; 相律的应用; 克劳修斯——克拉珀龙方程的应用; 亚稳相出现的原因; 均匀形核的临界晶核半径和形核功的推 导; 润湿角的变化范围及其含义;
• 两条斜率不同的自由能曲线必然相交于一点
• 液、固两相的自由能相等 • 两相处于平衡而共存。 事实上, Tm—既不能完全结晶,也不能完全熔化 • 要发生结晶则体系必须降至低于Tm温度, • 而发生熔化则必须高于Tm 。
(2) 热力学条件
a △T>0, △Gv<0-过冷是结晶的
必要条件(之一)。
b △T越大, △Gv越小-过冷度越
图6.4
大, 越有利于结晶。
c △Gv的绝对值为凝固过程的驱 动力。
ΔT=Tm-T,是熔点Tm与实际凝固温度T之差 Lm是熔化热,
要使 ΔGv<0,必须使Δ T>0,即 T<Tm,故ΔT
称为过冷度。
晶体凝固的热力学条件——实际凝固温度应低于
熔点Tm,即需要有过冷度,其中热分析实验装置示 意图见图6.5。
如果外界压力保持恒定(例如一个标准大气 压),那么单元系相图只要一个温度轴来表示,如 水的情况见图6.1(b)。根据相律,在汽、水、冰
的各单相区内(f=1),温度可在一定范围内变动。
在熔点和沸点处,两相共存,f=0,故温度不能变
动,即相变为恒温过程。
在单元系中,除了可以出现气、液、固三相之
间的转变外,某些物质还可能出现固态中的同素异
构转变,见图6.2和图6.3。
• bcc • fcc
第六章 单组元相图及纯晶体的凝固

rK
的晶核叫做临界晶核,而称为晶核的临界半径。
dG dr
0
得出
rK 2G V
由此可见,临界晶核尺寸除与 σ 有关外,主要决定于过冷度 ΔT , 过冷度越大,临界晶核的尺寸变 小,形核功也大大减少,这意味 着形核的几率增大
rK ) 2
当N与时间相关时,阿弗拉密(Avrami)考虑形核率与时间呈指 数关系变化后,得到
上式称为阿弗拉密方程。式中n称为阿弗拉密指数,与相 变机制相关,一般在1~4范围内取值,式中k为常数。
2.纯晶体凝固时的生长形态
纯晶体凝固时的生长形态不仅与液 - 固界面的微观结构有关, 而且取决于界面前沿液相中的温度分布情况
6.3 凝固理论的应用
1 材料铸态晶粒度的控制
单位体积中晶粒数目
Zv=0.9(N/G)3/4
ZV 增大,晶粒变细
(1)提高过冷度。降低浇铸温度,提高散热导热能力,适用于小 件。
(2)化学变质处理。促进异质形核,阻碍晶粒长大。
1 液态材料的结构
结构:液态结构的最重要特征是原子排列为长程无序,短程有序,并 且短程有序原子集团不是固定不变的,它是一种此消彼长,瞬息万变, 尺寸不稳定的结构,这种现象称为结构起伏,这有别于晶体的长程有 序的稳定结构。 特点(与固态相比):原子间距较大、原子配位数较小、原子排列较 混乱。
2 晶体凝固的热力学条件
因此体系总的吉布斯自由能变化为:
G GV V A
式中Δ是液、固两相单位体积吉布斯自由能之差,为负值;σ是晶胚单 位面积表面能,为正值;V和A分别是晶胚的体积和表面积,为减少表 面积,设晶胚为球形,其半径为r
G GV r 4r
4 3 3
2
材科第六章单组元相图及纯晶体的凝固

非均匀形核时的形核功:
G h* e t G ho* m (23co 4 sco 3)s
Ghom *f()
由于0 ≤ f(θ) ≤ 1,所以 Ghe*tGho* m
当 0 0 ,完全润湿;外延生长; 当 1800,完全不润湿;均匀形核;
当 001800 ,部分润湿。
通常情况下,非均匀形核所需的形核功小于均匀形核功, 故非均匀形核所需的过冷度较均匀形核时小。
形核率与温度的关系
对于易流动液体来说,如金属,存在有效形核温度,如图所示 对于高粘滞性的液体,均匀形核速率 很小,以致常常不存在有效形核温度 结论:均匀形核的难度较大。
形核率与过冷度的关系
2. 非均匀形核
由于均匀形核难度较大,所以液态金属多为非均匀形核。
非均匀形核示意图(α为晶核;L为液相)
若晶核形成时体系表面能的变化为 GS ,则 G S A L L A W W A W LW
液态材料在理论结晶温度以下仍保持液态的现象称为过冷。
6.2.3 形核
晶体的凝固是通过形核与长大两个过程进行的 ,形核方式可以分为两类: 1)均匀形核核 (Homogeneous nucleation) 2)非均匀形核(Heterogeneous nucleation)
晶核 新的晶核 晶核长大 晶粒相互接触 液体消失,结晶完成
6.2.2 晶体凝固的热力学条件
自由能
GHTS dGVdpSdT
H是焓; T是热力学温度; S是熵
在等压时,dp=0,所以可推导得:
dG S dT
由于熵S恒为正值,所以自由能是随温 度而减小
自由能随温度变化示意图
在一定温度下,从一相转变为另一相的自由能变化为
G H T S
第六章 单组元相图及纯晶体的凝固

1
内容简介
相变规律:相律、 相变规律:相律、相平衡 纯晶体的凝固的热力学及动力学:形核、 纯晶体的凝固的热力学及动力学:形核、长大 热力学及动力学 凝固后组织结构及其影响因素
问题:学习相图干什么用的? 问题:学习相图干什么用的?
CND AAA
BU N H TA
P I LI P I N S H P E
GA ON B
CAR . . .
U A E . . .
BN DS A GLA E H
Ganges
E I TR A R E OMA N MY N R A MA
LA OS
VE A I TN M
South China Sea
C GO ON Y ME E N D B TI JI OU E I OP A TH I U NA GA D A GOLA N R NA WA D BRNI UUD S OMA A LI
组元:基本单元- 单质或化合物 单质或化合物) ⅰ 组元:基本单元-(单质或化合物 ⅱ 相:相同的物理与化学性质;与其他部 相同的物理与化学性质; 分之间有界面 分之间有界面 元系: 个组元都是独立的体系 ⅲ n元系:n个组元都是独立的体系 元系
CND AAA
Hudson Bay Gulf of Alaska
L. Malawi
ZA I A MB MA WI LA
I N ON S A D EI
INDIAN
MOZA I QU MB E
MA A S A D GA C R
2
lw n S a ee
Co ng o
Mek on g
OCEAN
本章章节结构
[工学]第六章单组元相图及纯金
![[工学]第六章单组元相图及纯金](https://img.taocdn.com/s3/m/d34835808e9951e79a892734.png)
6.1相图热力学基础 6.2纯金属的凝固
1
6.1相图热力学基础
6.1.1相平衡和相律 6.1.2单元系相图
2
6.1相图热力学基础
1.相图:是反映物质状态(固态,液态或气态)随 温度,压力变化的关系图,所以也称为状 态图。
由于物质在同一状态(如固态)时,当温度 改变时它可能存在的相是不同的(如晶体的同 素异晶转变),而且各相之间的相平衡关系也 是不同的,所以相图又称为平衡图或平衡状态 图。
转变为固态冰。 金属的凝固:就是液态金属转变为固态金属的
过程。 由于金属在熔点以下一般都是以晶体形式 存在,所以金属的凝固又称为金属的结晶。
25
液体 -->固体(晶体或非晶体)-- 凝固 液体 -->晶体 -- 结晶
液体
凝固过程是重要的液-固相变过程,了解 和掌握凝固过程与规律,对于控制凝固后形 成的固态物质的质量与性能,以及理解其它 各类固态相变都具有十分重要的意义。
理论基础。
相律可用来确定相平衡时,体系的组元数 (C),平衡相数(P)与自由度数(f)三者 之间的关系。 在温度和压力改变时,相律的表达式为: f=C-P+2。 (6.1)
12
当压力恒定不变时,相律的表达式为: f=C-P+1 (6.2) 相律的应用范围很广,如可以用它来确定 体系在组元数不同时,各体系最多能够实现平 衡共存的相数。如纯金属C=1,在恒压时,当 f=0时,有0=1-P+1,则P=2,即纯金属最多能实 现两相平衡共存。如纯金属的凝固只能在恒温 下进行,并且在该温度时能实现液、固两相平 衡共存。
33
2.纯金属凝固的一般过程
由于液态金属是不透明的,所以目前还无法直 接观察到它的凝固过程。但人们在显微镜下可直接 观察到透明物质的凝固过程,如观察到有机物氯化 铵饱和水溶液的凝固过程如下图:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
把上述三式代入,整理后得 GS AL L r 2 sin 2 cosL AL r 2 sin 2 cos L
不均匀形核示意图
32
非均匀形核
2 3 cos cos3 球冠晶核的体积:V r 3
ΔTK
rk rk、rmax
rmax
过冷度ΔT
过冷只是金属结晶的必要条件
26
2)形核功
思考:晶核半径在rK~r0范围内的晶核能够成为稳定晶核吗?
当r=rK→ΔG出现极大值ΔGK,
2 4 2 GK G 4 v G 3 GV V 形核功 2 1 2 1 2 4 4 r k 3 G 3 V
2 3 2
液相中的能量起伏
过冷度增大,临界形核功显著 降低,结晶过程易于进行。
28
小结:
液相必须处于一定的过冷条件时方能结晶, 而液体中客观存在的结构起伏和能量起伏是促 成均匀形核的必要因素。
b 形核率
当温度低于Tm时,单位体积液体内在单位 时间所形成的晶核数(形核率)受两个因素的 控制,即形核功因子和原子扩散的几率因子。
相晶核的几率都是相同的。
非均匀形核(异质形核、非自发形核):新相优
先在母相中存在的异质处形核,即依附于液相中
的杂质或外来表面形核。
实际金属结晶:非均匀形核
23
1、均匀形核
思考:为什么过冷液体形核要求晶胚具有一定的临界尺寸? 1)晶核形成时的能量变化和临界晶核
(液→固)→自由能↓←结晶驱动力 晶胚出现 新的表面→表面能→自由能↑←结晶阻力 能量变化
设晶胚体积为 V ,表面积为 S ,液、固两相单位体积自由 能差为ΔGV,
单位面积的表面能σ,则系统自由能的总变化为: G VGV S
设过冷液体中出现一个半径为 r 的球状晶胚,它所引起的自由 能变化为: 4 3 G r Gv 4r 2 3
24
分析 :① r<r K ,随晶胚尺寸 r ↑→ ΔG ↑ (过程不能自动进行,晶胚不能成为稳 定晶核,瞬时产生,瞬时消失); ② r>rK,随晶胚尺寸r↑→ΔG↓(自动进 行→形成稳定晶核) 4
19
事实上,在此两相共存温度 Tm ,液相既不能 完全结晶,也不能完全熔化,要发生结晶则体系必 须降至低于Tm温度,而发生熔化则必须高于Tm。
在一定温度下,从一相转变为另一相的自由能变化 为:
G H T S
令液相转变为固相的单位体积自由能变化为: GV
GV GS GL
3
2
Δ Gk
r0
rk
分析: 形成临界晶核时,体积自由能的下降只补偿了表面能的 2/3,还有1/3的表面能没有得到补偿,需要另外供给,即需要 对形核做功。
27
形核功
能量起伏:体系中每个微小体积所实际具有的能量会偏离 体系平均能量水平而瞬时涨落的现象→形核时所需能量的 来源
2Tm 4 2Tm Lm T GK 4 3 Lm T Tm Lm T 16 3Tm 1 2 T 2 3Lm
第六章 单组元相图及纯系相变的热力学及相平衡 6.2 纯晶体的凝固 6.3 气-固相变与薄膜生长
6.4
高分子的结晶特征
3
6.1 单元系相变的热力学及相平衡
6.1.1 相平衡条件和相律
组成一个体系的基本单元,如单质(元素)和化 合物,称为组元。
体系中具有相同物理与化学性质的,且与其他部
已知纯铜的凝固的温度 T m =1356K , ΔT =236K ,熔化热 Lm=1628106J/m3,比表面能σ=17710-3J/m3。
求解: 2Tm 2 177 103 1356 9 rK 1 . 249 10 m 6 Lm T 1628 10 236 铜的点阵常数a0=3.61510-10m,晶胞体积为VL=(a0)3=4.72410-29m3 而临界晶核的体积为: Vc
相变为恒温过程。 在单元系中,除了可以 出现气、液、固三相之间 的转变外,某些物质还可 能出现固态中的同素异构 转变。
9
10
SiO2相平衡图:化合物的多晶型转变
11
达到相平衡有时需要很长时间,稳定相形成速度
甚慢—在稳定相前,先形成自由能较高的亚稳相。
稳定相:α—石英 亚稳相:低温鳞石英、低温方石英、玻璃…… 12
H S H L T S S S L
H S H L Lm
Lm S S S L Tm
20
Lm T 整理后得: GV Tm
要使 ΔGv<0,必须使ΔT>0,即 T<Tm,故ΔT称为过 冷度。 晶体凝固的热力学条件表明,实际凝固温度应低于熔 点Tm,即需要有过冷度。 液、固两相的吉布斯自由能差构成了凝固的驱动力。 这就是晶体凝固的热力学条件。
13
本章章节结构
6.1 单元系相变的热力学及相平衡 6.2 纯晶体的凝固 6.3 气-固相变与薄膜生长
6.4
高分子的结晶特征
14
6.2 纯晶体的凝固
纯晶体(单组元晶体):由一种元素或化合物构 成的晶体,该体系称为单元系。
相变:从一种相到另一种相的转变。
固态相变:不同固相之间的转变。 凝固:由液相至固相的转变。 结晶:如果凝固后的固体是晶体。
相图中两相平衡时温度和压力的定量关系: 克劳修斯---克拉泊龙方程
dp H dT T Vm H 为相变潜热,Vm为摩尔体积变化,是两相平衡温度。 多数晶体由液相变为固相或高温固相变为低温固相时, dp 会放热和收缩,H 0, Vm 0,由此 0. 故相界线斜率为正。 dT dp 少数晶体膨胀,H 0, Vm 0,由此 0. 故相界线斜率为负。 dT
分以界面分开的均匀部分称为相。
通常把具有n个组元都是独立的体系称为n元系,
组元数为一的体系称为单元系。
4
吉布斯相律:
f CP2
式中,f为体系的自由度数.它是指不影响体
系平衡状态的独立可变参数(如温度、压力、浓度
等)的数目;C为体系的组元数;P为相数。 对于不含气相的凝聚体系,压力在通常范围的 变化对平衡的影响极小,一般可认为是常量。因此 相律可写成下列形式:
冰三相平衡点。根据相律,此时f=0,因此要保此三
相共存,温度和压力都不能变动。
8
如果外界压力保持恒定(例如一个标准大气压),那
么单元系相图只要一个温度轴来表示。根据相律,在汽、 水、冰的各单相区内( f = 1 ),温度可在一定范围内变动。 在熔点和沸点处,两相共存, f = 0 ,故温度不能变动,即
第 5章
内容回顾
5.3 冷塑性变形后,回复、再结晶和晶粒长大:
回复的特点、机制,再结晶的过程,形核机制,
影响再结晶的因素,晶粒长大方式等;
5.4 热变形与动态回复、再结晶:
动态回复、再结晶的真实应力-真实应变曲线,蠕
变曲线,蠕变机制,超塑性等; 5.5-5.6 陶瓷材料和高聚物的变形特点。
(1)过冷:液态材料在理论结晶温度以下仍保持液态的现 象。
(2)过冷度:液体材料的理论结晶温度(Tm) 与其实际温度 之差。 △T=Tm-T
21
6.2.3 形核
结晶的基本过程:形核-长大
图6.7
22
形核方式:均匀形核、非均匀形核
均匀形核(均质形核、自发形核):新相晶核是
在母相中均匀地生成,即液相中各个区域出现新
6
6.1.2 单元系相图
单元系相图是通过几何图形描述由单一组元构成 的体系在不同温度和压力条件下所可能存在的相及多 相的平衡。现以水为例说明单元系相图的表示和测定
方法。
7
根据相律
一
图6.1
由于f≥0,所以P≤3,故 在温度和压力这两个外界条
件变化下,单元系中最多只
能有三相平衡。 OA,OB和OC这3条曲线交于O点,它是汽、水、
H是焓;T是绝对温度;S是熵,可推导得:
18
在等压时,dp=0,故上式简化为: 由于熵恒为正值,所以自由能是随温度增高而减小。 纯晶体的液、固两相的自由能随温度变化规律如图所 示。 两条曲线的交 点表示液、固两相 的自由能相等,故 两相处于平衡而共 存,此温度即为理 论凝固温度,也就 是晶体的熔点Tm。
f C P 1
5
相律的应用
相律是检验、分析和使用相图的重要工具。利用它可以 分析和确定系统中可能存在的相数,检验和研究相图。 注意使用相律有一些限制: ( 1 )只适用于热力学平衡状态,各相温度相等(热量平 衡)、各相压力相等(机械平衡)、各相化学势相等(化 学平衡)。 (2)只表示体系中组元和相的数目,不能指明组元和相的 类型和含量。 (3)不能预告反应动力学(即反应速度问题)。 (4)f≧0
4 3 rk 8.157 10 27 m 3 3
则临界晶核中晶胞的数目: n
VC 173 VL
铜是面心立方晶体结构,每个晶胞中的原子数为4,则一个临界晶核的原子 数目为1734=692个原子
思考:均匀形核所需要的过冷度很大,而在实际结 晶中并不需要这么大的过冷度,为什么?
31
3
2 3 cos cos3 则晶核由体积引起的自由能变化为:Gt V GV r GV 3 晶核形核时体系总的自由能变化: G Gt GS
3
3 4 3 2 3 cos cos 2 将 G 和G 代入整理得: G r GV 4r L t S
2、非均匀形核
1)临界形核半径和形核功
晶核形成时体系表面能的变化为ΔGS,则 GS AL L AW W AW LW
