《一次性使用麻醉用过滤器》行业标准编制说明
一次性使用过滤器标准

YZB 医疗器械注册产品标准YZB/国 XXXX-20XX一次性使用过滤器20XX-X-X 发布 20XX-X-X 实施XXXXXXX医疗器械有限公司发布前言本标准根据临床使用的要求,对一次性使用过滤器进行了分类,规定了产品型号的表示方法、使用范围,以及要求、试验方法、检验规则等内容。
本标准根据中华人民共和国国家标准GB/T1.1-2000《标准化工作导则第一部分:标准的结构和编写规则》的规定进行编写。
一次性使用过滤器适用于气体、药液的过滤,与一次性使用的医疗器械配套使用。
该产品尚无国家标准和行业标准,特制定本标准。
本标准中附录A、B为规范性附录。
本标准由XXXX医疗器械有限公司提出。
本标准起草单位:XXXX医疗器械有限公司。
本标准主要起草人:XXX。
本标准于20XX年X月发布。
一次性使用过滤器1 范围本标准规定了一次性使用过滤器的分类、要求、试验方法、检验规则、标志、包装、运输、贮存的要求。
本标准适用于与一次性使用的精密过滤输液器、避光输液器、麻醉包、输注泵、血浆管路等医疗器械配套使用的各类过滤器。
2 规范性引用文件下列文件中的条款通过本标准的引用而成为本标准的条款。
凡是注明日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修定版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。
凡是不注日期的引用文件,其最新版本适用于本标准。
GB8368-2005 一次性使用输液器GB18458.1 一次性使用精密过滤输液器YY0451- 一次性使用输注泵YY0321.3-2009 一次性使用麻醉过滤器YY0326.2- 一次性使用离心式血浆分离器第二部分血浆管路GB/T1962.1 注射器、注射针及其他医疗器械6:100圆锥接头第一部分通用要求GB/T1962.2 注射器、注射针及其他医疗器械6:100(鲁尔)圆锥接头第二部分锁定接头GB2828.1-2003 逐批检查记数抽样程序及抽样表(适用于连续批的检查)GB2829-2002 周期检查记数抽样程序及抽样表(适用于生产过程稳定性的检查)GB9969.1 工业产品使用说明书总则GB/T14233.1 医用输液、输血注射器器具检验方法,第一部分:化学分析法GB/T14233.2 医用输液、输血注射器器具检验方法,第二部分:生物试验方法GB/T16886.1 医疗器械生物学评价第一部分:评价与试验GB/T16886.5 医疗器械生物学评价第五部分:细胞毒性试验:体外法GB/T16886.10 医疗器械生物学评价第十部分:刺激与致敏试验YY/T0313- 医用高分子制品包装、标志、运输和贮存3 分类3. 1 过滤器分为以下二类。
一次性使用透析器产品注册技术审查指导原则

附件6一次性使用透析器产品注册技术审查指导原则一、前言本指导原则系对一次性使用透析器产品注册申报资料的一般要求,旨在提高注册申报资料质量及技术审评效率。
申请人/生产企业应依据具体产品的特性对注册申报资料的内容进行充实和细化。
申请人/生产企业还应依据具体产品的特性确定其中的具体内容是否适用,若不适用,需具体阐述其理由及相应的科学依据。
本指导原则是对申请人/生产企业和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善、科学技术的不断发展,其相关内容也将进行适时的调整。
本指导原则是该类产品注册申报资料一般性要求,注册申报资料可依据产品自身特点有所侧重。
二、适用范围本指导原则适用于直接采用行业标准YY 0053-2008《心血管植入物和人工器官血液透析器、血液透析滤过器、血液滤过器和血液浓缩器》及部分采用本标准的透析器类产品,包括传统透析器和高通量(超滤系数大于20ml/mmHg.h)透析器。
三、基本要求(一)产品的技术报告产品的技术报告应系统地论述申报产品的研究、设计、开发过程。
提供申报产品的用途、技术特征、产品的设计、工艺方案及有效性验证、安全性评价、标准的制订及依据等技术资料。
1、原材料(1)材料组成应明确产品各部分组成材料(包括透析膜、外壳、封口胶、粘合剂、端盖、密封圈等)的化学名称、分子量、型号(或级别)等。
生产企业应尽量选择有相关医学应用史的原材料,同时提供原材料生产厂家的资质证明。
(2)材料特性包括各种原材料的物理、化学特性、质量标准、生物学评价资料及相关研究报告。
原材料特性是产品最终质量控制的重要因素,建议提供申报产品原材料完整配方(包括增塑剂、添加剂和着色剂等)。
医疗器械产品标准
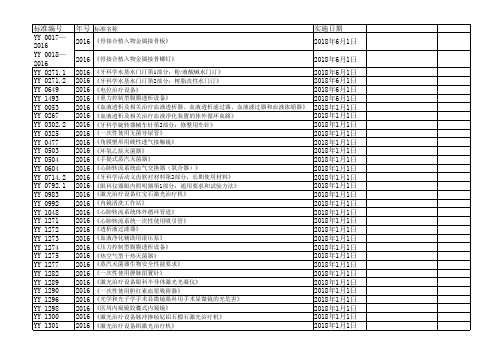
2013 子宫颈活体取样钳 2013 医用超声雾化器 2013 压力蒸汽灭菌设备用弹簧式安全阀 2013 一次性使用无菌阴道扩张器 2013 医用电气设备 第2部分:手术台安全专用要求 2013 医用电气设备 第2部分:医院电动床安全专用要求 2013 医用呼吸机 基本安全和主要性能专用要求 第4部分 人工复苏器 2013 吸入式麻醉系统 第1部分:麻醉呼吸系统 2013 医用电气设备 放射治疗计划系统的安全要求 2013 直线型吻合器及组件 2013 直线型切割吻合器及组件 2013 荷包缝合针 2013 一次性使用植入式给药装置专用针 2013 医用电气设备 第2部分:动态心电图系统安全和基本性能专用要求 2013 医用气体混合器 独立气体混合器 2013 医用电气设备第2部分:肌电及诱发反应设备安全专用要求 2013 耳鼻喉射频消融设备 2013 毫米波治疗设备 2013 医用微波设备附件的通用要求 2013 减重步行训练台 2013 紫外治疗设备 2013 接触式远红外理疗设备 2013 脑电生物反馈仪 2013 电池供电骨组织手术设备 2013 含动物源材料的一次性使用医疗器械的灭菌液体灭菌剂灭菌的确认与常规控制 2013 子宫颈钳 2013 输卵管提取钩 2013 心电诊断设备 2012 医用电气设备第1-2部分:安全通用要求-并列标准:电磁兼容-要求和试验 2011 牙科学 基托聚合物 第1部分:义齿基托聚合物 2011 牙科学 基托聚合物 第2部分:正畸基托聚合物 2011 连续波掺钕钇铝石榴石激光治疗机 2011 植入式给药装置 2011 外科植入物 金属骨针 第1部分 材料和力学性能要求 2011 医用电气设备 第2部分:婴儿辐射保暖台安全专用要求
2018年6月1日 2018年6月1日 2018年6月1日 2018年6月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日
一次性使用麻醉用药液过滤器微粒含量测试方法的研究

l 1 8 4 9
可通过下式简单求得 :
S 。 b =S 一S () 1
方法 中,所 用的冲洗液 以及本底液微 粒残 留量是造成过滤器 自身微粒含量试验错误 的根本原 因。结论 :一 次性
使 用麻醉 用药液过 滤器微粒含 量的检 测方法 中,本底液的微粒残 留量和冲洗液 的选择是影响试验 的关键 。本底
液的微粒残 留量控制在 5u bn以上的微粒 不 大于 1 O个 ( 6 I 在 0l l L中) ,并且 选用 纯净水作 为 冲洗液 时,结果 可
粒分析仪进行计数 ,测得该洗脱液中的微粒数。
收稿 日期 :2O O7—0 0 3—3
重复上述过程 3 ,可得 3 次 个试样的测试微粒
5
医疗 装备 2 O 第 6 析验证 ..
()计算 :洗脱液单位 m 4 L中平均微粒数 s 的 。 求取 ,可通过计算 3 个试样微粒数 的算术平均值 ,
作 为试 验液 。 () 本 底 液 中 微 粒 数 取 得 :用 注 射 器 吸 取 2
11 测试 原 理简介 .
Y 02 .—20 一次性使用麻 醉用过滤器》 Y 313 0O《
标 准的 中有 关 过 滤 器 微 粒 含 量 的测 试 方 法 简 述 如
6 m 试验 液 作 为 本 底 液 ,注入 取 样 杯 中 ,测 得 该 0L
1 2 4 步 骤 ..
20 一次性使用麻醉用过滤器》标准中 423 0 O《 .. 条 有明确规定 ,但是 ,标准中给出的测试方法在实际 应用中却常常会 由于干扰而不可行 ,因此有必要对
一次性使用配药用注射器产品注册 技术审查指导原则

附件14一次性使用配药用注射器产品注册技术审查指导原则本指导原则旨在指导和规范一次性使用配药用注射器产品的技术审评工作,帮助审评人员理解和掌握该类产品原理/机理、结构、性能、预期用途等内容,把握技术审评工作基本要求和尺度,对产品安全性、有效性作出系统评价。
本指导原则所确定的核心内容是在目前的科技认识水平和现有产品技术基础上形成的,因此,审评人员应注意其适宜性,密切关注适用标准及相关技术的最新进展,考虑产品的更新和变化。
本指导原则不作为法规强制执行,不包括行政审批要求。
但是,审评人员需密切关注相关法规的变化,以确认申报产品是否符合法规要求。
一、适用范围本指导原则的适用范围为《医疗器械分类目录》中第二类一次性使用配药用注射器产品首次注册和重新注册时注册申报资料的准备及产品技术审评的参考。
本指导原则所适用的一次性使用配药用注射器产品是指临床用于配制药品时所用到的普通型配药用注射器(不包括带有各种过滤器或直接连接粉针瓶与输液软袋的配药装置)。
二、技术审查要点(一)产品名称的要求产品的命名参照《医疗器械分类目录》及行业标准YY/T 0821-2010《一次性使用配药用注射器》制定。
产品通用名称定为“一次性使用配药用注射器”。
(二)产品的结构和组成一次性使用配药用注射器产品由配药器配药针组成。
典型的配药器结构为二件、三件;型式为中头式、偏头式;容量有10 mL、20 mL、30 mL、50 mL、100 mL等。
一般由标尺、零刻度线、分度容量线、公称容量刻度线、外套卷边、锥头、外套、活塞、芯杆、按手组成。
典型的配药针型式为侧孔针、斜面针;规格有0.9、1.2、1.4、1.6、1.8、2.1、2.4等;一般由针座、针管、护套组成。
一次性使用配药用注射器结构如如图1所示。
侧孔针管图11-按手; 8-活塞;2-芯杆; 9-零刻度线;3-外套卷边; 10-锥头;4-公称容量刻度线; 11-针座;5-分度容量线; 12-针管;6-标尺; 13-护套。
一次性使用配药用注射器产品注册 技术审查指导原则

附件14一次性使用配药用注射器产品注册技术审查指导原则本指导原则旨在指导和规范一次性使用配药用注射器产品的技术审评工作,帮助审评人员理解和掌握该类产品原理/机理、结构、性能、预期用途等内容,把握技术审评工作基本要求和尺度,对产品安全性、有效性作出系统评价。
本指导原则所确定的核心内容是在目前的科技认识水平和现有产品技术基础上形成的,因此,审评人员应注意其适宜性,密切关注适用标准及相关技术的最新进展,考虑产品的更新和变化。
本指导原则不作为法规强制执行,不包括行政审批要求。
但是,审评人员需密切关注相关法规的变化,以确认申报产品是否符合法规要求。
一、适用范围本指导原则的适用范围为《医疗器械分类目录》中第二类一次性使用配药用注射器产品首次注册和重新注册时注册申报资料的准备及产品技术审评的参考。
本指导原则所适用的一次性使用配药用注射器产品是指临床用于配制药品时所用到的普通型配药用注射器(不包括带有各种过滤器或直接连接粉针瓶与输液软袋的配药装置)。
二、技术审查要点(一)产品名称的要求产品的命名参照《医疗器械分类目录》及行业标准YY/T 0821-2010《一次性使用配药用注射器》制定。
产品通用名称定为“一次性使用配药用注射器”。
(二)产品的结构和组成一次性使用配药用注射器产品由配药器配药针组成。
典型的配药器结构为二件、三件;型式为中头式、偏头式;容量有10 mL、20 mL、30 mL、50 mL、100 mL等。
一般由标尺、零刻度线、分度容量线、公称容量刻度线、外套卷边、锥头、外套、活塞、芯杆、按手组成。
典型的配药针型式为侧孔针、斜面针;规格有0.9、1.2、1.4、1.6、1.8、2.1、2.4等;一般由针座、针管、护套组成。
一次性使用配药用注射器结构如如图1所示。
侧孔针管图11-按手; 8-活塞;2-芯杆; 9-零刻度线;3-外套卷边; 10-锥头;4-公称容量刻度线; 11-针座;5-分度容量线; 12-针管;6-标尺; 13-护套。
一次性使用配药用注射器产品注册 技术审查指导原则

附件14一次性使用配药用注射器产品注册技术审查指导原则本指导原则旨在指导和规范一次性使用配药用注射器产品的技术审评工作,帮助审评人员理解和掌握该类产品原理/机理、结构、性能、预期用途等内容,把握技术审评工作基本要求和尺度,对产品安全性、有效性作出系统评价。
本指导原则所确定的核心内容是在目前的科技认识水平和现有产品技术基础上形成的,因此,审评人员应注意其适宜性,密切关注适用标准及相关技术的最新进展,考虑产品的更新和变化。
本指导原则不作为法规强制执行,不包括行政审批要求。
但是,审评人员需密切关注相关法规的变化,以确认申报产品是否符合法规要求。
一、适用范围本指导原则的适用范围为《医疗器械分类目录》中第二类一次性使用配药用注射器产品首次注册和重新注册时注册申报资料的准备及产品技术审评的参考。
本指导原则所适用的一次性使用配药用注射器产品是指临床用于配制药品时所用到的普通型配药用注射器(不包括带有各种过滤器或直接连接粉针瓶与输液软袋的配药装置)。
二、技术审查要点(一)产品名称的要求产品的命名参照《医疗器械分类目录》及行业标准YY/T 0821-2010《一次性使用配药用注射器》制定。
产品通用名称定为“一次性使用配药用注射器”。
(二)产品的结构和组成一次性使用配药用注射器产品由配药器配药针组成。
典型的配药器结构为二件、三件;型式为中头式、偏头式;容量有10 mL、20 mL、30 mL、50 mL、100 mL等。
一般由标尺、零刻度线、分度容量线、公称容量刻度线、外套卷边、锥头、外套、活塞、芯杆、按手组成。
典型的配药针型式为侧孔针、斜面针;规格有0.9、1.2、1.4、1.6、1.8、2.1、2.4等;一般由针座、针管、护套组成。
一次性使用配药用注射器结构如如图1所示。
侧孔针管图11-按手; 8-活塞;2-芯杆; 9-零刻度线;3-外套卷边; 10-锥头;4-公称容量刻度线; 11-针座;5-分度容量线; 12-针管;6-标尺; 13-护套。
一次性使用麻醉穿刺包

一次性使用麻醉穿刺包1 范围本部分规定了一次性使用麻醉穿刺包的分类与标记、配置器械、物理性能、化学性能、生物性能、标志、包装、运输和贮存的要求。
本部分适用于人体硬脊膜外腔神经阻滞(简称硬膜外麻醉)、蛛网膜下腔阻滞(简称腰椎麻醉)、硬膜外和腰椎联合麻醉、神经阻滞局部麻醉的一次性使用麻醉穿刺包。
2 规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅所注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 1962.2 注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头第2部分:锁定接头GB/T 6682 分析实验室用水规格和试验方法GB/T 14233.1-2008 医用输液、输血、注射器具检验方法第1部分:化学分析方法GB/T 14233.2 医用输液、输血、注射器具检验方法第2部分:生物学试验方法GB/T 16886.1 医疗器械生物学评价第1部分:风险管理过程中的评价与试验GB/T 18457 制造医疗器械用不锈钢针管YY/T 0313 医用高分子产品包装和制造商提供信息的要求YY 0321.2 一次性使用麻醉用针YY 0321.3 一次性使用麻醉用过滤器YY/T 0466.1 医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求3 分类与标记3.1 分类一次性使用麻醉穿刺包(以下简称麻醉包)可分为以下几类:a)硬膜外麻醉包;b)腰椎麻醉包;c)硬膜外和腰椎联合麻醉包;d)神经阻滞包。
3.2 标记3.2.1 产品型号产品型号由产品名称代号和分类代号组成。
产品名称代号:麻醉包以AS表示。
分类代号:硬膜外麻醉以E表示;腰椎麻醉以S表示;硬膜外和腰椎联合麻醉以E/SⅡ表示;神经阻滞以N表示。
配置Ⅱ型刃口腰椎穿刺针的麻醉包,在分类代号后加注刃口型式代号“Ⅱ”。
示例1:硬膜外麻醉用的一次性使用麻醉穿刺包AS—E示例2:配置硬膜外穿刺针和Ⅱ型刃口腰椎穿刺针的联合麻醉用的一次性使用麻醉穿刺包AS-E/SⅡ3.2.2 麻醉包内所配置的一次性使用麻醉用针的标记按YY 0321.2中的要求。
国家食品药品监督管理局关于认可河南省医疗器械检验所对一次性使
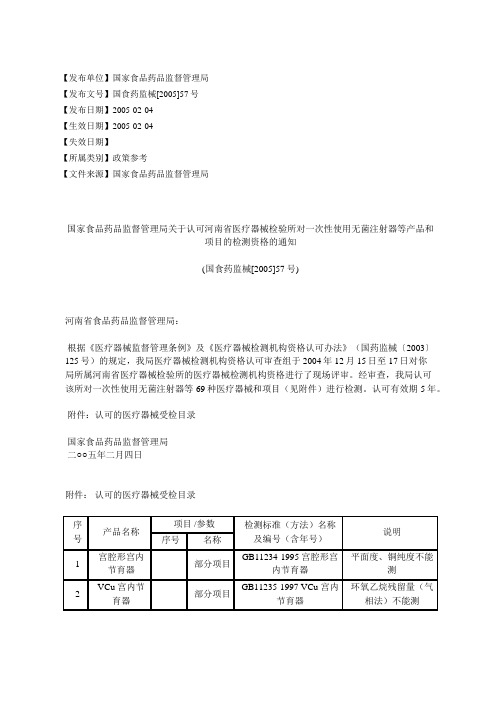
【发布单位】国家食品药品监督管理局【发布文号】国食药监械[2005]57号【发布日期】2005-02-04【生效日期】2005-02-04【失效日期】【所属类别】政策参考【文件来源】国家食品药品监督管理局国家食品药品监督管理局关于认可河南省医疗器械检验所对一次性使用无菌注射器等产品和项目的检测资格的通知(国食药监械[2005]57号)河南省食品药品监督管理局:根据《医疗器械监督管理条例》及《医疗器械检测机构资格认可办法》(国药监械〔2003〕125号)的规定,我局医疗器械检测机构资格认可审查组于2004年12月15日至17日对你局所属河南省医疗器械检验所的医疗器械检测机构资格进行了现场评审。
经审查,我局认可该所对一次性使用无菌注射器等69种医疗器械和项目(见附件)进行检测。
认可有效期5年。
附件:认可的医疗器械受检目录国家食品药品监督管理局二○○五年二月四日附件:认可的医疗器械受检目录本内容来源于政府官方网站,如需引用,请以正式文件为准。
出师表两汉:诸葛亮先帝创业未半而中道崩殂,今天下三分,益州疲弊,此诚危急存亡之秋也。
然侍卫之臣不懈于内,忠志之士忘身于外者,盖追先帝之殊遇,欲报之于陛下也。
诚宜开张圣听,以光先帝遗德,恢弘志士之气,不宜妄自菲薄,引喻失义,以塞忠谏之路也。
宫中府中,俱为一体;陟罚臧否,不宜异同。
若有作奸犯科及为忠善者,宜付有司论其刑赏,以昭陛下平明之理;不宜偏私,使内外异法也。
侍中、侍郎郭攸之、费祎、董允等,此皆良实,志虑忠纯,是以先帝简拔以遗陛下:愚以为宫中之事,事无大小,悉以咨之,然后施行,必能裨补阙漏,有所广益。
将军向宠,性行淑均,晓畅军事,试用于昔日,先帝称之曰“能”,是以众议举宠为督:愚以为营中之事,悉以咨之,必能使行阵和睦,优劣得所。
亲贤臣,远小人,此先汉所以兴隆也;亲小人,远贤臣,此后汉所以倾颓也。
先帝在时,每与臣论此事,未尝不叹息痛恨于桓、灵也。
侍中、尚书、长史、参军,此悉贞良死节之臣,愿陛下亲之、信之,则汉室之隆,可计日而待也。
一次性使用呼吸过滤器_产品技术要求

一次性使用呼吸过滤器_产品技术要求医疗器械产品技术要求编号:一次性使用呼吸过滤器1.产品型号/规格及其划分说明1.1呼吸过滤器分为单过滤型(BVF)和过滤加湿化复合型(HEMF)1.2呼吸过滤器规格分为:新生儿、儿童、成人。
1.3呼吸过滤器产品结构图示及说明:1.3.1HMEF由上盖、过滤膜、湿化纸、下盖组成;BVF由上盖、过滤膜、下盖组成。
见图1HMEF BVF①BVF/HMEF上盖②过滤膜③湿化纸④HMEF下盖⑤BVF下盖图1、过滤器结构图示1.3.2呼吸过滤器规格尺寸见表1:表1呼吸过滤器尺寸表单位:mm 规格高度mm壳体直径mm上盖接口下盖接口备注新生儿533915M15F没有单过滤型儿童784822F22M/15F没有单过滤型成人HMEF726922F22M/15F 成人BVF646922F22M/15F2.性能指标2.1外观2.1.1应光洁,无明显注塑缺陷,毛刺、飞边和异物。
2.2尺寸2.2.1儿童和成人过滤器下盖端口应是一个符合YY1040.1的15mm内/22mm外同轴圆锥接头,上盖端口为一个符合YY1040.1的22mm内圆锥接头。
新生儿型下盖端口为15mm内的圆锥接头。
上盖端口为15mm外的圆锥接头。
2.3使用性能2.3.1滤除空气中0.3μm以上微粒的滤除率应不小于99.99%;2.3.2压降应符合表2的规定:表2呼吸过滤器压降流量最大压降(气道阻力)/cmH2O压力30L/min≤2.0cm60L/min≤5.0cm90L/min≤6.0cm2.3.3泄漏速率应不超过25mL/min2.4无菌过滤器应无菌。
2.5环氧乙烷残留量过滤器采用环氧乙烷灭菌,环氧乙烷残留量应不大于10μg/g。
3检验方法3.1外观手感、目测应符合2.1的要求。
3.2尺寸3.2.1用塞规进行检测,结果应符合2.2.1的要求。
3.3使用性能3.3.1用尘埃粒子计数器测量,结果应符合2.3.1的要求。
3.3.2用压差表进行测量,结果应符合2.3.2的要求。
国家食品药品监督管理局关于认可山西省医疗器械检测中心对一次性使用无菌注射器等产品和项目检测资格的通知

国家食品药品监督管理局关于认可山西省医疗器械检测中心对一次性使用无菌注射器等产品和项目检测资格的通知文章属性•【制定机关】国家食品药品监督管理局(已撤销)•【公布日期】2007.03.30•【文号】•【施行日期】2007.03.30•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家食品药品监督管理局关于认可山西省医疗器械检测中心对一次性使用无菌注射器等产品和项目检测资格的通知山西省食品药品监督管理局:根据《医疗器械监督管理条例》及《医疗器械检测机构资格认可办法》(国药监械〔2003〕125号)的规定,2006年10月23日至24日,国家局医疗器械检测机构资格认可审查组对山西省医疗器械检测中心的医疗器械检测能力进行了现场评审。
经审查,认可该中心对一次性使用无菌注射器等43种产品和项目(见附件)进行检测的资格。
有效期5年。
附件:认可的医疗器械受检目录国家食品药品监督管理局二○○七年三月三十日附件:认可的医疗器械受检目录┌──┬───────────────┬──────────────┬───────────────────────┬────────────────┐│序号│产品名称│项目/参数│检测标准(方法)名称及编号(含年号)│说明│││├────┬─────────┤│││││序号│名称│││├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 1│一次性使用无菌注射器││部分项目│GB15810-2001《一次性使用无菌注射器》│溶血、急性全身毒性不能测│├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 2│一次性使用无菌注射针││部分项目│GB15811-2001《一次性使用无菌注射针》│溶血、急性全身毒性不能测│├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 3│一次性使用输液器重力输液式││部分项目│GB8368-2005《一次性使用输液器重力输液式》│药液过滤器滤除率、溶血、毒性、生│││││││物学评价项目不能测│├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 4│一次性使用静脉输液针││部分项目│GB18671-2002《一次性使用静脉输液针》│溶血不能测│├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 5│一次性使用滴定管式输液器││部分项目│GB18458.2-2003《一次性使用滴定管式输液器》│溶血、急性全身毒性、生物学评价项│││││││目不能测│├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 6│一次性使用输血器││部分项目│GB8369-2005《一次性使用输血器》│血液及血液成份过滤效率、溶血、毒│││││││性、生物学评价项目不能测│├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 7│一次性使用麻醉穿刺包││部分项目│YY0321.1-2000《一次性使用麻醉穿刺包》│热原、细胞毒性、皮内刺激反应、皮│││││││肤致敏反应不能测│├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 8│一次性使用麻醉用针││部分项目│YY0321.2-2000《一次性使用麻醉用针》│热原不能测│├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 9│一次性使用麻醉用过滤器││部分项目│YY0321.3-2000《一次性使用麻醉用过滤器》│热原、细胞毒性、皮内刺激反应、皮│││││││肤致敏反应不能测│├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 10 │一次性使用产包││全部项目│Q/HXWC001-2000《一次性使用产包》││├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 11 │一次性使用无菌手术包││全部项目│Q/XPY008-1999《一次性使用无菌手术包》││├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 12 │一次性真空采血针││部分项目│YZB/国0091-2005│溶血、急性全身毒性不能测││││││《一次性真空采血针》││├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 13 │医用脱脂纱布││全部项目│YY0331-2002《医用脱脂纱布》││├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 14 │医用脱脂棉││全部项目│YY0330-2002《医用脱脂棉》││├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 15 │医用橡皮膏││全部项目│YY0148-1993《医用橡皮膏》││├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 16 │石膏绷带(粘胶型)││全部项目│YY/T1118-2001《石膏绷带粘胶型》││├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 17 │直管型直管型石英紫外线低压汞消││部分项目│YY/T0160-94《直管型石英紫外线低压汞消毒灯》│寿命试验不能测│││毒灯│││││├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 18 │电子血压计││全部项目│YZB/辽0046-2003《电子血压计》││├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 19 │低频电子脉冲治疗仪││全部项目│YY0016-93《低频电子脉冲治疗仪》、YZB/粤0071-20│││││││04《低频电子脉冲治疗仪》││├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 20 │中频电疗仪││全部项目│YY91093-1999《中频电疗仪》、YZB/京0225-2002《J│││││││系列电脑中频治疗仪》││├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 21 │显微图像分析系统││全部项目│YZB/晋0019-2004《显微图像分析系统》││├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 22 │颅脑降温治疗仪││全部项目│YZB/晋0027-2003《颅脑降温治疗仪》││├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 23 │全自动电脑验光仪││部分项目│YZB/晋0012-2003《全自动电脑验光仪》│散光、散光光轴不能测│├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 24 │定制式活动义齿││全部项目│YZB/晋0027-2005《定制式活动义齿》││├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 25 │定制式固定义齿││全部项目│YZB/晋0026-2005《定制式固定义齿》││├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 26 │天然石膏枕││部分项目│YZB/晋0004-2006《天然石膏枕》│放射性比活度不能测│├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 27 │制氧器、复方制氧剂││全部项目│YZB/晋0014-2003《制氧器、复方制氧剂》││├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 28 │多参数监护仪││部分项目│YZB/晋0005-2006《MP2001多参数监护仪》│除颤不能测│├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 29 │褥疮防治装置││全部项目│YZB/晋0006-2006《SFY褥疮防治装置》││├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 30 │自动肢体手术止血带││全部项目│YZB/晋0007-2006《SCB自动肢体手术止血带》││├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 31 │温热理疗按摩床││全部项目│YZB/晋0018-2006《温热理疗按摩床》││├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 32 │磁疗贴││全部项目│YZB/晋0012-2006《筋骨磁疗贴》││├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 33 │红外胃肠治疗仪││全部项目│YZB晋0013-2006《红外胃肠治疗仪》││├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 34 │红外咳喘治疗仪││全部项目│YZB晋0014-2006《红外咳喘治疗仪》││├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 35 │红外乳腺治疗仪││全部项目│YZB晋0015-2006《红外乳腺治疗仪》││├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 36 │红外前列腺治疗仪││全部项目│YZB晋0016-2006《红外前列腺治疗仪》││├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 37 │红外盆腔治疗仪││全部项目│YZB晋0017-2006《红外盆腔治疗仪》││├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 38 │针灸针││全部项目│GB2024-94《针灸针》││├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 39 │医用输液、输血、注射器具检验方││全部项目│GB/14233.1-1998《医用输液、输血、注射器具检验││││法│││方法第1部分:化学部分》││││第1部分:化学部分│││││├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 40 │医药工业洁净室(区)测试方法││悬浮粒子、浮游菌、│GB/16292-1996《医药工业洁净室(区)悬浮粒子的││││││沉降菌、换气次数、│测试方法》GB/16293-1996《医药工业洁净室(区)││││││静压差、温度、相对│浮游菌的测试方法》GB/16294-1996《医药工业洁净││││││湿度│室(区)沉降菌的测试方法》YY0033-2000《无菌医│││││││疗器具生产管理规范》││├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 41 │齿科藻酸盐印模材││部分项目│YY1027-2001《齿科藻酸盐印模材》、YZB/沪0465-6│与石膏的配伍性和复制再现性、短期││││││4-2005《齿科藻酸盐印模材》│全身毒性试验、细胞毒性、口腔粘膜│││││││刺激性、致敏毒性不能测│├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 42 │医用电气设备环境要求及试验方法││部分项目│GB/T14710-1993《医用电气设备环境要求及试验方法│碰撞试验不能测││││││》││├──┼───────────────┼────┼─────────┼───────────────────────┼────────────────┤│ 43 │医用电气设备第一部分:安全通用││部分项目│GB9706.1-1995《医用电气设备第一部分:安全通用│离子辐射、AP型和APG型设备(59、6│││要求│││要求》│1~68项)液体泼洒、清洗、灭菌、│││││││消毒、压力容器、电源变压器、设备│││││││稳定性不能测│└──┴───────────────┴────┴─────────┴───────────────────────┴────────────────┘。
威高包类配置汇总(现行)

配置器械与辅料
4
导针
1
5
负压管
1
6
消毒液刷
3
7
橡胶医用手套
1
8
敷料巾
1
9
手术巾
1
10
脱脂纱布
3
11
创可贴
1
一次性使用穿刺包 <YZB/国 0407—2006>
X:胸腔穿刺包 ;F:腹腔穿刺包 ;
部件名称
材料
数量
基本配置
穿刺针
1
一次性使用无菌注射器
1
一次性使用无菌注射针
1
其他配置的器械和辅料
镊子
1
器械名称
材料
A
B
C
D
E
F
G
托盘
★
★
★
★
★
★
塑料镊子
★
★
★
★
方巾
★
★
★
★
纱布
★
★
棉球
★
★
★
★
★
围巾
★
手套
★
★
★
碘伏
★
备皮刀
★
海绵块
★
消毒刷
★
手术刀片
★
缝合针
★
★
洞巾
★
★
1
★
★
★
★
6
一次性使用麻醉用过滤器——空气过滤器
1
★
★
7
硬膜外麻醉导管(以下简称导管)
1
★
★
8
导管接头
1
★
★
注:
1各类麻醉包的基本配置按表1中打“*”的内容配置。
一次性使用麻醉呼吸机用过滤器产品技术要求天地和协

一次性使用麻醉呼吸机用过滤器组成:本产品由上盖、滤膜、下盖三部分组成,分为机械式和静电式两种类型。
一次性使用麻醉呼吸机用过滤器壳体采用医用聚碳酸酯(PC),滤膜孔径为0.45μm机械式过滤器采用聚丙烯纤维微孔滤膜,静电式过滤器滤膜分为聚丙烯纤维微孔滤膜和驻极聚丙烯超细纤维过滤纸两层,均为疏水性滤膜材料。
适用范围:本产品与麻醉呼吸机或呼吸机配套使用,作为截留气体或管路中的各种有效物质进入患者体内的过滤介质。
1.1产品规格/型号及其划分说明一次性使用麻醉呼吸机用过滤器规格型号及相关尺寸由表1确定,特殊规格尺寸按合同规定。
表1一次性使用麻醉呼吸机用过滤器规格型号一次性使用麻醉呼吸机用过滤器是连接麻醉机或呼吸机气体管路,过滤进入人体气体灰尘和细菌的装置。
因其原理不同分为机械式和静电式两种型号,划分说明按图1规定的方法。
图2~图4给出了一次性使用麻醉呼吸机用过滤器的示意图,图5给出了延长管的示意图。
图 1 一次性使用麻醉呼吸机用过滤器的规格编号图 2 22F-22M规格一次性使用麻醉呼吸机用过滤器示意图图3 22F/15M-22M/15F 规格一次性使用麻醉呼吸机用过滤器示意图图4 22F-22M/15F 规格一次性使用麻醉呼吸机用过滤器示意图图5 延长管示意图1.2 一次性使用麻醉呼吸机用过滤器材料一次性使用麻醉呼吸机用过滤器壳体采用医用聚碳酸脂(PC),滤膜孔径为0.45μm机械式过滤器采用聚丙烯纤维微孔滤膜,静电式过滤器滤膜分为聚丙烯纤维微孔滤膜和驻极聚丙烯超细纤维过滤纸两层,均为疏水性滤膜材料。
2.1 外形尺寸一次性使用麻醉呼吸机用过滤器端口规格应符合表1的要求,相应规格的外形尺寸应符合YY 1040.1-2015标准第5节非金属材料圆锥接头的规定,配置的延长管应具有符合YY 1040.1-2015标准第5节非金属材料圆锥接头规定的15mm圆锥接头。
2.2 外观一次性使用麻醉呼吸机用过滤器外表面应光洁、无毛刺,无明显的气泡、杂质、裂痕等缺陷。
认可的医疗器械受检目录一次性使用麻醉用针等
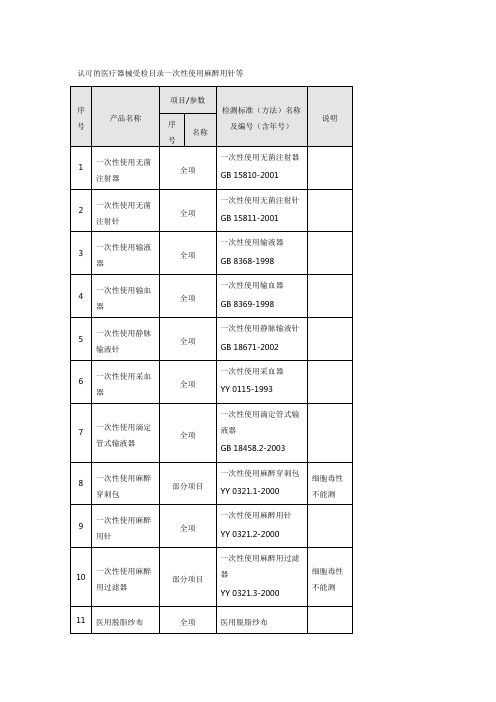
一次性使用输血器
全项
一次性使用输血器
GB 8369-1998
5
一次性使用静脉输液针
全项
一次性使用静脉输液针
GB 18671-2002
6
一次性使用采血器
全项
一次性使用采血器
YY 0115-1993
7
一次性使用滴定管式输液器
全项
一次性使用滴定管式输液器
GB 18458.2-2003
8
一次性使用麻醉穿刺包
YZB/宁0003-2003
18
妇科暖舒敷袋
全项
妇科暖舒敷袋
YZB/宁0005-2004
19
妇科经贴片
全项
妇科经贴片
YZB/宁0006-2004
20
妇科热疗贴
全项
妇科热疗贴
YZB/宁0007-2004
21
妇科热敷贴
全项
妇科热敷贴
YZB/宁0008-2004
22
妇女熨灸袋
全项
妇女熨灸袋
YZB/宁0008-2002
橡胶医用手套
全项
橡胶医用手套
GB 7543-1996
27
医用橡皮膏
全项
医用橡皮膏
YY 0148-93
部分项目
一次性使用麻醉穿刺包
YY 0321.1-2000
细胞毒性不能测
9
一次性使用麻醉用针
全项
一次性使用麻醉用针
YY 0321.2-2000
10
一次性使用麻醉用过滤器
部分项目
一次性使用麻醉用过滤器
YY 0321.3-2000
细胞毒性不能测
11
医用脱脂纱布
全项
一次性使用热湿交换器 过滤器产品技术要求maikang

一次性使用热湿交换器/过滤器适用范围:适用于经人工气道自主呼吸及呼吸机或麻醉机机械通气的病人,起到加温保湿的作用。
1.1 一次性使用热湿交换器/过滤器仅有一种结构型式,因此不做规格型号划分。
1.2 一次性使用热湿交换器/过滤器由壳体、滤膜和热湿交换材料组成。
其中壳体上设有呼吸系统端口、患者连接端口、辅助端口。
基本组成如下图所示:壳体材质为丙烯腈-丁二烯-苯乙烯(ABS),滤膜材质为聚丙烯复合材料,热湿交换材料为湿化纸。
2.1 物理要求2.1.1 外观热湿交换器/过滤器外壳表面应光洁,以目力及手感检查不应有明显的斑点、杂质、划痕等缺陷。
2.1.2 过滤性能热湿交换器/过滤器对空气中0.5μm以上微粒的滤除率应大于95%。
2.1.3 患者端口接头患者端口接头应是一个符合YY1040.1-2015的15mm的内圆锥接头或是一个15mm 内/22mm外同轴圆锥接头,尺寸应符合YY1040.1-2015中的要求。
2.1.4 呼吸系统端口接头呼吸系统端口接头应是一个符合YY1040.1-2015的15mm的外圆锥和(或)22mm 圆锥接头,尺寸应符合YY1040.1-2015中的要求。
2.1.5 辅助端口如果含一个辅助端口,该端口应不能与符合YY1040.1-2015和YY1040.2-2008中15mm或22mm的圆锥接头连接,应提供一个封堵装置。
2.1.6 水分损失在一定的试验条件下,水分损失应为:2.1.7 压降在气体流量为30L/min的情况下,热湿交换器/过滤器的压降不得超过400Pa。
2.1.8 气体泄漏热湿交换器/过滤器气体泄漏应不大于10ml/min。
2.1.9 顺应性热湿交换器/过滤器顺应性应不大于10ml/kPa。
2.2 化学要求2.2.1 环氧乙烷残留量热湿交换器/过滤器环氧乙烷残留量应不大于10µg/g。
2.3 生物要求2.3.1 无菌热湿交换器/过滤器经过环氧乙烷灭菌后,应无菌。
一次性使用麻醉机和呼吸机用呼吸管路企业技术标准规范

Q/LYQ医疗器械有限公司企业标准Q/LYQ302—2018一次性使用麻醉机和呼吸机用呼吸管路2018-10-18发布2018-11-15实施发布目次前言 (Ⅱ)1范围 (1)2规范性引用文件 (1)3术语与定义 (1)4分类与命名 (3)5材料 (4)6要求 (4)7试验方法 (6)8检验规则 (7)9标志、标签、使用说明书 (8)10包装、运输、贮存 (9)附录A(规范性附录)容量的测定 (11)附录B(规范性附录)生物学评价方法 (12)前言本标准参考YY0461-2003《麻醉机和呼吸机用呼吸管路》编制。
本标准的编写遵循GB/T1.1-2009《标准化工作导则第1部分:标准的结构和编写》规范的要求。
本标准的附录A、附录B是规范性附录。
本标准由浙江灵洋医疗器械有限公司技术部提出。
本标准起草单位:浙江灵洋医疗器械有限公司。
本标准主要起草人:夏丹平。
一次性使用麻醉机和呼吸机用呼吸管路1范围本标准规定了一次性使用麻醉机和呼吸机用呼吸管路的术语和定义、分类和命名、材料、设计、要求、试验方法、检验规则、标志和包装等要求。
本标准适用于本公司生产一次性使用麻醉机和呼吸机用呼吸管路(以下简称呼吸管路)产品。
临床上用于与呼吸机或麻醉机配套使用。
2规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T191-2008包装储运图示标志GB/T2828.1-2012计数抽样检验程序第1部分:按接收质量限(AQL)检索的逐批检验抽样计划GB/T2829-2002周期检验计数抽样程序及表(适用于对过程稳定性的检验)GB/T4999-2003麻醉呼吸设备术语GB/T14233.1-2008医用输液、输血、注射器具检验方法第1部分:化学分析方法GB/T14233.2-2005医用输液、输血、注射器具检验方法第2部分:生物学试验方法GB15593-1995输血(液)器具用软聚氯乙烯塑料YY/T0114-2008医用输液、输血、注射器具用聚乙烯专用料YY0461-2003麻醉机和呼吸机用呼吸管路YY0466.1-2016医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求YY/T1040.1-2015麻醉和呼吸设备圆锥接头第1部分:锥头与锥套GB/T16886.1-2011医疗器械生物学评价第1部分:风险管理过程中的评价与试验GB/T16886.10-2017医疗器械生物学评价第10部分:刺激与皮肤致敏试验ISO11607-1:2006最终灭菌医疗器械的包装第1部分:材料、无菌屏障系统、和包装系统要求GB18279.1-2015医疗保健产品灭菌环氧乙烷第1部分:医疗器械灭菌过程的开发、确认和常规控制的要求3术语和定义标准GB/T4999和YY0461中所给的术语定义适用。
医用雾化器注册技术审查指导原则(2016年修订版)

精心整理附件11医用雾化器注册技术审查指导原则(2016年修订版)本指导原则旨在指导注册申请人对医用雾化器注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。
本指导原则所称的医用雾化器属于《医疗器械分类目录》中6823-6超声雾化器,以及《关于冷热双控消融针等166个产品医疗器械分类界定的通知》(国食药监械〔2011〕231号)文中二(六十三)规定的压缩式雾化器,管理类别代号为6821。
本指导原则不适用于网式雾化器和采用外接气源的方式将药物雾化的器具(如由医院中心供气系统或其他的经过压缩的氧气或医用气体作为气源的药物雾化器具),但可以参考本指导原则对这些产品进行技术审查。
二、技术审查要点(一)产品名称要求产品的名称应为通用名称,并符合《医疗器械命名规则》、《医疗器(三)产品的工作原理/作用机理1.医用超声雾化器工作原理超声雾化器由超声波发生器产生的高频电流经过安装在雾化缸里的超声换能器使其将高频电流转换为相同频率的声波,由换能器产生的超声波通过雾化缸中的耦合作用,通过雾化杯底部的超声薄膜,从而使超声波直接作用于雾化杯中的液体。
当超声波从杯底经传导到达药液表面时,液—气分界面即药液表面与空气交界处,在受到垂直于分界面的超声波的作用后(即能量作用),使药液表面形成张力波,随着表面张力波能量的增强,当表面张力波能量达到一定值时,在药液表面的张力波波峰也同时增大,使其波峰处的液体雾粒飞出(雾粒直径的大小随超声波的频率增大而缩小)。
由于超声波而产生的雾粒具有尺寸均一,动量极小,故容易随气流行走,药液产生雾粒的数量随超声波能量的增加而增多(即超声波的功率越大,则产生的雾粒的数量越多)。
在医用超声雾化器将药液分裂成微图3 医用超声雾化器工作原理示意图图4医用超声雾化器雾化装置图示例2.医用压缩式雾化器工作原理医用压缩式雾化器应用的是文丘里效应的原理,一般是通过气体压缩机产生的压缩气体为驱动源来产生及传输气雾的,其工作原理示意图如图5所示,其中的雾化装置工作原理示例如图6所示:压缩机产生的压缩空气从喷嘴喷出时,通过喷嘴与吸水管之间产生的负压作用,向上吸起药液。
【指导原则】呼吸系统过滤器注册审查指导原则

附件7呼吸系统过滤器注册审查指导原则本指导原则旨在指导注册申请人对呼吸系统过滤器(Breathing system filter,简称BSF)产品注册申报资料的准备及撰写,同时也为技术审评部门提供参考。
本指导原则是对呼吸系统过滤器产品的一般要求,申请人应依据具体产品的特性对注册申报资料的内容是否适用。
若不适用,需具体阐述其理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是供注册申请人和技术审评人员使用的指导性文件,但不包括审评审批所涉及的行政事项,亦不作为法规强制执行,应在遵循相关法规的前提下使用本指导原则。
如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将进行适时的调整。
一、适用范围本指导原则适用的呼吸系统过滤器通常由壳体和滤芯组成,包含一个进气口和一个出气口,可有若干气体采样口和密封盖,一般为无菌供应,一次性使用。
该类产品与麻醉和呼吸设备和肺功能仪相配套,供降低患者吸入或呼出颗粒性物质(包括微生物)的数量用。
二、注册审查要点(一)监管信息1.产品名称产品名称应符合《医疗器械通用名称命名指导原则》的要求,也可参考《医疗器械分类目录》《免于临床评价医疗器械目录》中的名称。
如呼吸系统过滤器、呼吸气体过滤器、一次性使用呼吸气体过滤器、麻醉呼吸过滤器等。
根据产品一次性使用或者灭菌情况,产品名称中可带有“一次性使用”或“无菌”字样。
2.分类代码呼吸系统过滤器在《医疗器械分类目录》中管理类别为Ⅱ类,分类编码为08-05-03。
3.注册单元划分注册单元划分参照《医疗器械注册单元划分指导原则》的要求,原则上以产品的技术原理、结构组成、性能指标、适用范围为划分依据。
产品结构组成或加工处理方式不同而导致产品性能指标不同时,原则上划分为不同注册单元。
医疗器械国家标准、行业标准目录教程

134 135 136 137 138 139 140 141 142 143 144 145 146 147 148 149 150 151 152 153 154 155 156 157 158 159 160 161 162 163 164 165 166 167 168 169 170 171 172 173 174 175 176 177 178 179 180
GB 10149-1988 GB 10151-1988 GB/T10160-1995 GB/T10162-1988 GB 10035-1994 GB10213-1995 GB10586-89 GB10793-2000 GB 11243-2000 GB 11246-1989 GB 11751-1989 GB 11755.1-1989 GB 11756-1989 GB 11757-1989 GB/T12256-1990 GB 12259-1990 GB 12260-1990 GB 12279-1990 GB 13074-1991 GB 13797-1992 GB 14232-1993 GB 14233.1-1998 GB14223.2-1993 GB14710-1993 GB 15213-1994 GB/T15261-94 GB/T15953-1995 GB18671-2002 GB15811-2001 GB15810-2001 GB15812-1995 GB15979-2002 GB 16175-1996 GB /T16402-1996 GB 16886.1-2000 GB16886.2-2000 GB16886.3-1997 GB16886.4-2003 GB16886.5-2003 GB16886.6-1997 GB16886.7-2001 GB16886.9-2001 GB16886.10-2000 GB16886.11-2000 GB16886.12-2000 GB16886.13-2001 GB16886.14-2003
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《一次性使用麻醉用过滤器》行业标准编制说明
一、工作简况
1.任务来源
根据食药监办械管[2018]XX号文和财社[2018]XX号文的有关内容,行业标准《一次性
使用麻醉用过滤器》列入“2018年医疗器械行业标准制修订项目(计划项目号为NXXXX-T-SH)”。
本标准由全国医用注射器(针)标准化技术委员会归口管理。
由浙江伏尔特
医疗器械股份有限公司、上海市医疗器械检测所、河南驼人医疗器械集团有限公司、江西洪
达医疗器械集团有限公司、贝朗医疗(上海)国际贸易有限公司、武汉智迅创源科技发展股
份有限公司等单位负责起草。
2.工作过程
在接到标准修订任务后,全国医用注射器(针)标准化技术委员会秘书处召集浙江伏尔
特医疗器械股份有限公司、上海市医疗器械检测所、河南驼人医疗器械集团有限公司、江西
洪达医疗器械集团有限公司、贝朗医疗(上海)国际贸易有限公司等单位召开了标准起草会议,会议确定由浙江伏尔特医疗器械股份有限公司负责起草,上海市医疗器械检测所、河南
驼人医疗器械集团有限公司、江西洪达医疗器械集团有限公司、贝朗医疗(上海)国际贸易
有限公司、武汉智迅创源科技发展股份有限公司参与起草、验证。
接受任务后浙江伏尔特医
疗器械股份有限公司立即着手开展了标准起草和初步验证工作。
在工作组讨论稿完成后,由
全国医用注射器(针)标准化技术委员会秘书处于2018年4月召集浙江伏尔特医疗器械股
份有限公司、上海市医疗器械检测所、河南驼人医疗器械集团有限公司、江西洪达医疗器械
集团有限公司、贝朗医疗(上海)国际贸易有限公司、碧迪医疗器械(上海)有限公司等单
位在浙江桐乡召开了第一次工作组会议。
会议就标准工作组草案进行了建设性的讨论,并提
出了相应的修改意见。
随后对工作组草案进行了修改,并形成了征求意见稿,拟于2018年
7月广泛征求意见。
二、标准编制原则和确定标准主要内容的依据
本标准依据GB/T1.1-2009《标准化工作导则第1部分标准的结构和编写》给出的原
则编制。
本部分与YY0321.3-2009相比主要变化如下:
——修改了3.3标记条款,在药液过滤器的标称孔径中增加了0.22μm的过滤器;
——修改了5.3过滤性能要求,增加了0.22μm药液过滤器性能要求;
——修改了6化学要求中的检验液制备方法,与一次性使用麻醉穿刺包检验液制备方法保持一致,放到附录B中;
——将原附录B型式检验规则更新为附录C。
说明:YY0321.3-2009标准实施至今已有7年,本标准产品供一次性使用麻醉穿刺包
配套使用,但是编制时化学性能检验液制备方法放在正文中,且与YY0321.1-2009《一次性
使用麻醉穿刺包》中附录E的化学性能检验液制备方法不一致,会导致检测上的差异,应给
予统一。
本标准中规定的药液过滤器过滤介质标称孔径为2um,但是在临床应用过程中,麻
醉医生普遍认为在做腰麻或联合麻醉时,麻醉药液经腰麻针与脑积液接触,临床上发生的化
学性脑膜炎或与药物的微粒有关,因此,目前国外进行腰麻麻醉用的药液过滤器大多采用
0.22um。
为了与国际接轨,提高该类产品的技术水平,更好地适用于临床,特对现有行业
标准进行修订。
三、主要实验(或验证)的分析、综述报告、技术经济论证、预期经济效果
本标准所规定的主要性能指标经上海市医疗器械检测所、浙江伏尔特医疗器械股份有限公司、河南驼人医疗器械集团有限公司、江西洪达医疗器械集团有限公司等单位验证,被证实标准中涉及的条款和试验方法均为可行有效的,各项性能指标均能符合本部分规定要求。
四、采用国际标准和国外先进校准的程度,以及与国际国外同类标准水平的对比情况
无。
五、与有关的现行法律、法规和其他相关标准的关系等协调性问题
本标准未发现与有关的现行法律、法规和其他强制性国际标准有冲突的地方。
六、重大分岐意见的处理经过和依据
工作中就标准是否引用ISO80369-6(YY/T0916.6-XXXX)《医用液体和气体小孔径连接件第6部分:轴索应用连接件》发生了重大分岐,河南驼人医疗器械集团有限公司、江西洪达医疗器械集团有限公司表示应该引用,碧迪、贝朗等单位表示反对。
最后决定暂时先不引用,待征求意见时听取各方面意见,再决定是否引用该标准。
七、本标准按强制性或推荐性实施的建议及理由
根据目前一次性使用麻醉用过滤器产品的市场以及管理的现状,建议作为强制性标准实施。
八、贯彻本标准的要求和措施建议
拟以宣贯会的形式进行宣传和贯彻。
九、废止现行有关标准的建议
建议自本标准实施之日起代替YY0321.3-2009标准。
十、其他必须说明的事项
无。
十一、主要参考文献和标准
[1]GB/T1962.1注射器、注射针及其它医疗器械6%(鲁尔)圆锥接头第1部分:通用要求
[2]GB/T1962.2注射器、注射针及其它医疗器械6%(鲁尔)圆锥接头第2部分:锁定接头
[3]GB/T6682分析实验室用水规格和试验方法(GB/T6682-2008,ISO3696:1987,MOD)
[4]GB/T14233.1医用输液、输血、注射器具检验方法第1部分:化学分析方法
[5]GB/T14233.2医用输液、输血、注射器具检验方法第2部分:生物学试验方法
[6]GB15811一次性使用无菌注射针(GF15811-2016,ISO7864:1993,NEQ)
[7]GB/T16886.1医疗器械生物学评价第1部分:风险管理过程中的评价与试验(GB/T16886.1-2011,ISO10993-1:2009,IDT)
[8]YY/T0313医用高分子产品包装和制造商提供信息的要求
[9]YY/T0466.1医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求(YY/T0466.1-2016,ISO15223-1:2012,IDT)
[10]YY/T0929.1输液用除菌级过滤器第1部分:药液过滤器完整性试验
[11]中华人民共和国药典(2015年版二部)
一次性使用麻醉用过滤器行业标准起草小组
2018年7月10日。
