物理化学10 胶体分散系统
大学物理化学--第10章

上一内容 下一内容 回主目录
返回
2020/8/23
分散系统分类
根据分散相颗粒大小,分散系统可分为三类:
真溶液: d 1nm 胶体系统: 1nm d 1000nm 粗分散系统: d 1000nm
根据分散相和分散介质聚集状态不同,分散系统 可分为气溶胶、液溶胶、固溶胶等。
上一内容 下一内容 回主目录
如图所示,在CDFE 的桶内盛溶胶,在某一 截面AB两侧溶胶浓度不 同,C1>C2;可以观察到 胶粒从C1区向C2区迁移 的现象。
上一内容 下一内容 回主目录
返回
2020/8/23
3. 沉降与沉降平衡
分散相粒子受力情况分析:
一方面是重力场的作用,它力图把粒子拉向容器 的底部,使之发生沉降。
另一方面当沉降作用使底部粒子数密度高于上部 时,由数密度差引起的扩散作用使粒子均匀分布。
第十章 胶体化学(Colloid Chemistry)
上一内容 下一内容 回主目录
返回
2020/8/23
分散系统(dispersion system)
一种或几种物质分散在另一种物质中就构成 分散系统;被分散的物质称为分散相,另一种物质 称为分散介质。
分散相总是不连续的,又称为不连续相或内相; 分散介质一般都是连续的,又称为连续相或外相。
返回
2020/8/23
胶体系统 (1nm < d<1000nm)
(1)溶胶:分散相不溶于分散介质,有很大相 界面,是热力学不稳定系统。(憎液溶胶)
胶
(2)高分子溶液: 高分子以分子形式溶于介质,
体
分散相与分散介质间无相界面,是热力学稳定
系
系统。(亲液溶胶)
统
物理化学第十章 胶体化学

3. 沉降与沉降平衡
多相分散系统中的粒子,因受重力作用而下 沉的过程,称为沉降。沉降与扩散为一对矛盾 的两个方面
沉降 扩散 分散相分布
真溶液
粗分散系统 胶体系统 平衡
均相
沉于底部 形成浓度梯度
贝林(Perrin)导出沉降平衡时粒子浓度随高度的分布:
o c2 Mg ln 1 ( h2 h1 ) c1 RT
胶核 可滑动面
胶粒
{[AgI]m nI-(n-x)K+}x- xK+ 胶团结构
K+
K+
I-
K+
(AgI)m
I-
I-
K+
特点:
1) 胶核:首先吸附过量的成核离子,然后吸附反离子; 2) 胶团整体为电中性
I-
§10.5
溶胶的稳定与聚沉
Derjaguin&Landau(1941)
1. 溶胶的经典稳定理论DLVO理论
溶胶粒子间的作用力:
Verwey &Overbeek(1948) van der Waals 吸引力:EA -1/x2
势 能 ER
双电层引起的静电斥力:ER ae-x 总作用势能:E = ER + EA
E
EA 曲线的形状由粒子本
性决定,不受电解质影响;
Emax
0 x 第二最小值 EA 第一最小值
势 能 ER 电解质浓度: c1 < c2 < c3 ,
0EAc3源自c2c1E电解质浓度,ER,E,
溶胶稳定性。在 c3 以后, 引力势能占绝对优势,分散 相粒子一旦相碰,即可聚合。
41
电解质对溶胶的聚沉规律:
(i)反离子的价数起主要作用
10.胶体分散系统及粗分散系统
ρB、ρ0分别为分散相( 粒子) 及分散介质的体积质量;
22
M B为粒子的摩尔质量;g为重力加速度。
n2 M B g ⎛ ρB ⎞ ⎜1 − ⎟(h2 − h1 ) ln = n1 RT ⎜ ρ0 ⎟ ⎝ ⎠
(1)粒子的摩尔质量愈大,平衡体积粒子数随高度 的降低愈大; (2)对于粒子不太小的分散系统,通常沉降较快, 可以较快地达到平衡。而高度分散的系统中,粒子则 沉降缓慢,需较长时间才能达成平衡。
K
I
+
-
K+
K+
I-
I-
K+
I-
K+
K
+
K+
(2)胶粒一般先吸附水化 能力较弱的阴离子。
I-
(1)优先吸附与溶胶粒子 中某一组成相同的离 子;
胶团结构
(AgI)m
I-
K
+
I- I -
K+
K+
I-
K+
K
I
-
+
I-
I-
32
电动现象
由于胶粒是带电的,在电场作用下,或在外加压力、自身重 力下流动、沉降时产生电动现象。
+ + + + + + ++ +
1963年博克里斯、德瓦纳塞恩和缪勒在斯特恩模型 的基础上作了更细致的改进。 IHP
– 固体表面 + (带负电荷) OHP 滑动面 水化阳离子 + – + 特性吸附阴离子
内亥姆霍茨层(IHP) 外亥姆霍茨层(OHP)
++ + + + + ++ +
胶体分散系统

溶胶的制备
2. 凝聚法:用物理、化学等方法使分散介质粒子凝聚。
1)物理凝聚法
• 过饱和法 (更换溶剂法) 利用分散相在不同溶剂中的溶解
度差别制备溶胶。 如溶于乙醇的硫倾入水中制备硫溶胶。
• 蒸气凝聚法 将分散相先蒸气化再冷凝制备溶胶。 如汞蒸气通入冷水制备共溶胶。钠苯分别蒸气化后, 在同一容器冷冻,形成微小晶粒,再升温,苯熔化连 钠微粒形成钠的苯溶胶。
烟,尘 云,雾
气体 泡沫
肥皂泡沫
液体
液体 乳状液
牛奶
固体 溶胶(sol)或悬浮液 油墨,泥浆
气体 固体泡沫
泡沫塑料,馒头
固体
液体 凝胶(gel)
珍珠
固体 固溶胶(solidsol) 有色玻璃,某些合金
分散系统的分类与特征
分散系统按分散相颗粒大小分类
类型
颗粒大小/nm
主要特征
非 均 粗分散系统 相 (悬浮液) 分 (乳状液) 散 系 胶体分散系统 统 (溶胶)
质点的形状与大小
憎液溶胶胶粒的形状:
胶粒形状对胶体性质有重要影响。 胶粒并非都是球形。还有带状的,丝状的质点。 球形质点流动性好, 带状的流动性较差, 易产生 触变现象(在一定温度下静置时,逐渐变为半固体状凝胶,当 振摇时,复又变成可流动的胶体溶液 )。
聚苯乙烯乳胶球状质点 V2O5溶胶的带状质点
溶胶的净化
溶胶制备中常生成过量电解质,多余电解质 会导致溶胶凝聚,须除去。常用渗析法。
渗析法:利用胶体粒子不能透过半透膜的特点,将溶
胶置于半透膜内,膜外为纯溶剂如水,多余电解质或其 它杂质向膜外扩散而分离除去。为加快进程,可用电渗 析或加压超过滤的方法。
第三节 胶体的光学性质
物理化学核心教程(第二版)思考题习题答案—第10章 胶体分散系统

第十章胶体分散系统一.基本要求1.了解胶体分散系统的特有的分散程度、多相不均匀性和热力学不稳定性等三个主要基本特性。
2.了解憎液溶胶在动力性质、光学性质和电学性质等方面的特点,以及如何应用这些特点,对憎液溶胶胶粒的大小、形状和的带电情况等方面进行研究。
3.掌握憎液溶胶在稳定性方面的特点,知道外加电解质对憎液溶胶稳定性影响的本质,会判断电解质的聚沉值和聚沉能力的大小。
4.了解大分子溶液与憎液溶胶的异同点,了解胶体分散系统的平均摩尔质量的多种测定方法。
5.了解凝胶的基本性质和纳米科技的基本内容和广泛的应用前景。
二.把握学习要点的建议胶体分散系统以其特有的分散程度、多相不均匀性和热力学不稳定性这三个基本特性,使得与一般的分子分散系统或粗分散系统在性质上有很大的不同,主要表现在:动力性质、光学性质和电学性质等方面。
不能把憎液溶胶的三个基本特性与它在动力、光学和电学方面的性质混为一谈。
了解憎液溶胶的动力性质、光学性质和电学性质,目的是将它区别于分子分散系统和粗分散系统,利用这些性质可以对胶粒的大小、形状和带电情况进行研究。
大分子溶液与憎液溶胶在组成上完全是两回事,大分子溶液是分子分散系统,是亲液溶胶,仅仅是因为大分子溶液的分子大小与憎液溶胶胶粒的大小相仿,在粒度效应方面有一点共同之处,才放在一起研究,其实两者在光学性质、电学性质和受外来电解质影响方面有很大的区别。
大分子是由小分子单体聚合而成的,由于聚合的程度不同,所形成分子的大小也不同,所以大分子物质的摩尔质量只是一个平均值,而且随着摩尔质量测定方法的不同,所得的摩尔质量的值也不同。
纳米科技目前是许多学科的研究热点,采用较多的溶液相制备纳米材料的的方法是类似于制备溶胶的方法,学好胶体分散系统的性质,对纳米材料的研究有很大的帮助。
这一章的计算题不多,主要是掌握憎液溶胶的制备、净化、各种性质以及广阔的应用前景。
三.思考题参考答案1.憎液溶胶有哪些特征?答:主要有三个特征:(1)特有的分散程度。
物理化学课件---第十章胶体分散系统资料

例如:云,牛奶,珍珠
2020/11/3
10.1 胶体分散系统概述
分类系统通常有三种分类方法:
1. 按分散相粒子的大小分:
•分子分散系统 •胶体分散系统 •粗分散系统
•液溶胶 2. 按分散相和介质的聚集状态分: •固溶胶
3. 按胶体溶液的稳定性分:
•气溶胶 •憎液溶胶 •亲液溶胶
•缔合溶胶
2020/11/3
粒子粉碎,将固体磨细。 (1) 胶体磨
这种方法适用于脆而易碎的物质,对于柔 韧性的物质必须先硬化后再粉碎。例如,将废 轮胎粉碎,先用液氮处理,硬化后再研磨。
胶体磨的形式很多,其分散能力因构造和 转速的不同而不同。
2020/11/3
10.1.2 憎液溶胶的制备
盘式胶体磨
2020/11/3
10.1.2 憎液溶胶的制备
2020/11/3
(2)按分散相和介质聚集状态分类
2.固溶胶 将固体作为分散介质所形成的溶胶。当分散相为 不同状态时,则形成不同的固溶胶:
A.固-固溶胶 如有色玻璃,不完全互溶的合金 B.固-液溶胶 如珍珠,某些宝石 C.固-气溶胶 如泡沫塑料,沸石分子筛
2020/11/3
(2)按分散相和介质聚集状态分类
(2) 喷射磨 在装有两个高压喷嘴的粉碎室中,一个喷
高压空气,一个喷物料,两束超音速物流以一 定角度相交,形成涡流,将粒子粉碎。 (3) 电弧法
电弧法主要用于制备金、银、铂等金属 溶胶。
制备过程包括先分散后凝聚两个过程。
2020/11/3
10.1.2 憎液溶胶的制备
(3)电弧法
2020/11/3
10.1.2 憎液溶胶的制备
2020/11/3
(3)按胶体溶液的稳定性分类
胶体分散系统与粗分散系统

{U}
Born排斥 Umax
UR ∝exp{-x} —德拜参量
0 C
势垒
U F {x}
1 xn
UA∝
图 9胶粒间斥力势能、吸力 势能及总势能曲线
4.电解质及高聚物分子对溶胶聚沉的影响
(1)电解质对溶胶聚沉的影响
少量电解质的存在对溶胶起稳定作用;过量电解质的存在 对溶胶起破坏作用(聚沉)。
丁达尔现象的实质是溶胶对光的散射作用(散射是指除入射 光方向外,四面八方都能看到发光的现象),它是溶胶的重要性 质之一,如图1所示。
光源 透镜 溶胶 丁达尔效应
图1
丁达尔现象
散射光的强度可用瑞利(Rayleigh)公式表示:
2 9v 2n n2 n 2 2 0 I 42 1 cos I 0 2 2 20l n2 2n 0
1 2 Π B RT B2 B B3 B MB
(3)膜平衡与唐南效应 以大分子电解质Na2P(蛋白质钠盐)为例,说明膜平衡与唐 南(Donnan)效应。
今将Na2P的水溶液及NaCl的水溶液分别置于膜的两侧(见图 10)。图中的b′及b分别为开始时,左右两侧Na+离子的浓度。bx为 Na+或Cl-从半透膜右侧渗透到左侧的质量摩尔浓度。
+ + + + + +++
压力
V
毛细管
气体
V
Hale Waihona Puke + + + + + +++
图7流动电势
图8 沉降电势
3.溶胶的稳定性 (1)溶胶的动力稳定性
物理化学考研章节题库-第10章 胶体化学【圣才出品】

第10章 胶体化学一、选择题1.用相同体积0.01mol·dm-3KI和0.15mol·dm-3AgNO3溶液制备的AgI溶胶,分别加入相同浓度的下列电解质,聚沉能力最强的是:()。
A.NaClB.FeCl3C.MgSO4D.K3PO4【答案】D【解析】所制备的AgI溶胶为AgI的正溶胶,即胶粒带正点,起聚沉作用的主要是负离子。
比较选项中阴离子的价位可知,聚沉能力最强的是K3PO4。
2.向溶胶中加入电解质可以:()。
A.降低热力学电势B.减小扩散层厚度C.减小紧密层厚度D.减少胶团荷电量【答案】B【解析】处在溶液中的带电固体表面,由于静电吸引力的作用,必然要吸引等量的相反电荷的离子形成双电层。
电解质的加入会改变存在于溶液中的离子状态。
3.若需研究电解质对某一溶胶稳定性的影响,最好的方法是测定:()。
A.电泳速度B.电渗速度C.电解质的聚沉D.沉降速度【答案】C【解析】电解质对溶胶的影响主要是改变扩散层的厚度,也即斥力势能的大小,从而改变胶体的稳定性。
4.丁铎尔现象的本质是光的散射,下列说法中错误的是:()。
A.大分子溶液中大分子的大小与胶粒相近,两者丁铎尔效应的强弱也相近B.小分子溶液中溶质粒子小,故丁铎尔效应不明显C.散射现象仅是光传播方向发生变化其波长不变D.在超显微镜下观察到的光点不是胶粒的真实形状【答案】A【解析】丁铎尔效应是胶体粒子的一种特殊的光学性质。
其本质是光的散射,散射光强度与粒子大小成正比。
5.Tyndall现象是发生了光的什么作用的结果()。
A.散射B.反射C.折射D .透射【答案】A【解析】当入射光的波长远大于胶粒半径时,入射光会在胶粒上发生散射现象,产生一束乳白色的散射光,即Tyndall 现象。
6.日出和日落时太阳呈鲜红或橙黄色的原因是( )。
A .蓝光波长短,透射作用显著B .蓝光波长短,折射作用显著C .红、黄光波长长,透射作用显著D .红、黄光波长长,散射作用显著【答案】C【解析】日出和日落时太阳光透过厚厚的大气层时,散射作用显著的短波长光如蓝光、紫光等大部分已被散射,剩下了透射作用显著的长波长光,如红光、黄光等。
胶体分散系优秀课件

四. 溶胶的稳定和聚沉
• 1. 胶团的结构 • AgI溶胶的胶团结构示意图(以KI稳定)
溶胶的胶团结构也常用结构简式表示,如 AgI 负溶胶 的结构简式表示为:
第三节 溶胶
• 一. 胶体分散系的分类 • 1. 按分散相和分散介质关系分类 • 憎液溶胶:是多相热力学不稳定体系,是热力学不
可逆体系,需要稳定剂。 • 亲液溶胶:均相热力学稳定体系,不需要稳定剂。 • 2. 按胶体聚集状态分类 • P93,8类 • 3. 按分散体系的流动性分类 • 流动性大的:气溶胶,水溶胶,高分子稀溶液 • 半流动性或半固体:凝胶,冻胶,干凝胶(固体)
剧烈,能克服重力引起的沉降作用。 • B:溶胶的电学稳定作用 同一种溶胶的胶粒带有相同电荷,当彼此接近时,
由于静电作用相互排斥而分开。胶粒荷电量越多, 胶粒之间静电斥力就越大,溶胶就越稳定。胶粒带 电是大多数溶胶能稳定存在的主要原因。
C:溶剂化的稳定作用 溶胶的吸附层和扩散层的离子都是水化的(如为非 水溶剂,则是溶剂化的),在水化膜保护下,胶粒 较难因碰撞聚集变大而聚沉。水化膜越厚,胶粒就 越稳定。 (2)溶胶的聚沉 胶体具有巨大的表面积,体系界面能高,胶粒间的 碰撞有使其自发聚集的趋势。减弱或消除胶粒的电 荷,可以促使胶粒聚集成较大的颗粒,这个过程称 为凝聚,当分散相粒子增大到布朗运动克服不了的 重力的作用时,最后从介质中沉淀析出的现象称聚 沉。
二、分散系的分类
分散相粒子 分散系类型 直径
分散相粒子的组 成
实例
小于1nm
低分子分散系 小分子或小离子 生 理 盐 水 体
物理化学-胶体分散系统

溶胶分类
按分散相与分散介质聚集状态分类(列举)
分散介质
分散相
气
液
固
气溶胶
雾
烟
液溶胶
灭火泡沫 牛奶、石油 油漆、泥浆
固溶胶
沸石
珍珠
有色玻璃
本章主要讨论的是液溶胶,特别是液液溶胶和固液溶胶
溶胶基本特性
高度分散性:与粗分散系统比具有相对稳定性,粒径 小,不易沉降,动力学上是稳定的。
多相性:为多相分散系统,存在相界面(相不均匀性), 而大分子溶液是均相的。
§9.1 溶胶的分类和基本特征 §9.2 溶胶的制备和净化 §9.3 溶胶的动力性质 §9.4 溶胶的光学性质 §9.5 溶胶的电学性质 §9.6 溶胶的稳定性和聚沉 §9.7 乳状液及微乳状液
第一节 溶胶的分类和基本特征
胶 体(colloid)
定义:分散相的粒径为1-100 nm之间的分散系统 特点:扩散慢,能通过滤纸但不能透过半透膜。 分类:
平衡时两侧化学势相等
可导出稀溶液的 = cRT ( c: mol/m3 )
范霍夫(Van’t Hoff)公式
= (W/VM)RT
p1
渗透压
渗= 透p1压
溶剂
溶液
半透膜 (只容许溶剂通过)
重力沉降与沉降平衡
溶胶粒子在外力场定向移动称沉降
沉降与扩散是两个相对抗的运动
沉降粒子浓集 扩散粒子分散
例如:金属镍纳米粒在低温下保持顺磁性
产品
Gd-DTPA Dimeglumine (钆喷酸葡胺)
Feridex I.V. (菲立磁)
描述
技术平台
MRI成像的顺磁性造影剂,可能缩短组织中质 子的T1及T2驰豫时间,从而增强图像的清晰度 和对比度。
物理化学教学课件第九章胶体分散系统

第二节 溶胶的性质
第二节 溶胶的性质
三、溶胶的电学性质
(2)电渗。在外加电场作用下,若溶胶粒子不动(如将其吸附固 定于棉花或凝胶等多孔性物质中),而液体介质做定向移动,这种 现象称为电渗。图9-7所示为电渗管,即在U形管中盛入液体,将 电极接通直流电后,可从有刻度的毛细管中准确地读出液面的变化, 其中U形管中的多孔膜只允许介质通过,阻止胶体粒子通过。电渗 也可用以判断粒子所带电荷的正负。如果多孔膜吸附带负电荷的粒 子,则介质带正电,通电时向负极移动;反之,如果多孔膜吸附带 正电荷的粒子,带负电的介质向正极移动。
一、溶胶的光学性质
2. 1871年,英国科学家瑞利(Rayleigh)研究了大量的光散射现象, 发现散射光强度与诸多因素有关,其中最主要的因素有以下四个方面。
(1)散射光强度与入射光波长的4次方成反比,即入射光波长愈 短,散射愈显著,因此可见光中的蓝色光、紫色光的散射作用比较强。 当用白光照射溶胶时,在与入射光垂直的方向上观察呈淡蓝色,而透
斯特恩(Stern)对扩散双电层 模型作了进一步修正,并提出了更加接 近实际的Stern扩散双电层模型,如图9 -8所示。
第二节 溶胶的性质
三、溶胶的电学性质
3. 根据上述扩散双电层理论,可以想象出溶胶的胶团结构。
第三节 溶胶的稳定与聚沉
一、溶胶的经典稳定理论——DLVO理论
这里定性地介绍DLVO (1) (2)溶胶的相对稳定性或聚沉取决于斥力势能和引力势能的相 对大小。当斥力势能大于引力势能时,溶胶处于相对稳定状态;当
胶体分散系统ppt课件

上一内容 下一内容 回主目录
返回
2024/8/7
Brown运动的本质
Brown运动的公式
1
x
RT L
t
3r
2式Leabharlann x 是在观察时间t内粒子沿x轴方向的平均位移; r为胶粒的半径;
为介质的粘度;
L为阿伏加德罗常数。
这个公式把粒子的位移与粒子的大小、介质粘度、 温度以及观察时间等联系起来。
分散相与分散介质
把一种或几种物 质分散在另一种物质 中就构成分散系统。 其中,被分散的物质 称为分散相,另一种 物质称为分散介质。
例如:云,牛奶,珍珠
上一内容 下一内容 回主目录
返回
2024/8/7
(1)按分散相粒子的大小分类
1.分子分散系统 分散相与分散介质以分子或离子形式彼此混溶,
没有界面,是均匀的单相,分子半径大小在10-9 m以 下 。通常把这种体系称为真溶液。 2.胶体分散系统
分散相粒子的半径在1 nm~100 nm之间的系统。目 测是均匀的,但实际是多相不均匀系统。 3.粗分散系统
当分散相粒子大于100 nm,目测是混浊不均匀体系, 放置后会沉淀或分层。
上一内容 下一内容 回主目录
返回
2024/8/7
(2)按分散相和分散介质的聚集状态分类
1.液溶胶 将液体作为分散介质所形成的溶胶。当分散
因为粒子小,比表面大,表面自由能高,是热力学不 稳定体系,有自发降低表面自由能的趋势,即小粒子会自 动聚结成大粒子。
上一内容 下一内容 回主目录
返回
2024/8/7
胶团的结构
形成憎液溶胶的必要条件是: (1)分散相的溶解度要小; (2)还必须有稳定剂存在,否则胶粒易聚结而
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
x
是在观察时间t内粒子沿x轴方向的平均位移;
r 为胶粒的半径;
L 为 Avogadro 常量
为介质的黏度;
这个公式把粒子的位移与粒子的大小、介质 黏度、温度以及观察时间等联系起来。
10.2.1 动力性质
2. 扩散与渗透压
Einstein 对球形粒子导出了胶粒在时间t内,平 均位移与扩散系数D之间的定量关系
10.2.1 动力性质
Einstein认为,溶胶粒子的Brown运动与分子运
动类似,平均动能为 3 kT 。
2
并假设粒子是球形的 运用分子运动论的一些基本概念和公式,得 到Brown运动的公式为
RT t x L 3 r
1
2
10.2.1 动力性质
RT t x L 3 r
2. 按分散介质的物态分类
(1)液溶胶
将液体作为分散介质所形成的溶胶。当
分散相为不同状态时,则形成不同的液溶胶 A. 液-气溶胶 B. 液-液溶胶 C. 液-固溶胶 如泡沫 如牛奶,石油原油等 如油漆,AgI溶胶等
2. 按分散介质的物态分类
(2) 固溶胶 将固体作为分散介质所形成的溶胶。当分 散相为不同状态时,则形成不同的固溶胶 A. 固-气溶胶 B. 固-液溶胶 泡沫塑料,沸石分子筛 珍珠,某些宝石
物理化学核心教程电子教案
第10章 胶体分散系统
2017/3/26
1、把人工培育的珍珠长期收藏在干燥箱内,为什么会失去原有的光泽? 能否再恢复? 2、为什么晴天的天空呈蓝色?为什么日出、日落时的彩霞特别鲜艳? 3、为什么表示危险的信号灯用红色?为什么车辆在雾天行驶时,装在车 尾的雾灯一般采用黄色?
4、为什么明矾能使浑浊的水很快澄清?
一旦将介质蒸发,再加入介质就无法再形成溶 胶,是 一个不可逆系统,如氢氧化铁溶胶、碘化 银溶胶等。 这是胶体分散系统中主要研究的内容。
3. 按胶体分散系统的性质分类
(1)憎液溶胶 形成憎液溶胶的必要条件是: (A)分散相的溶解度要小。
(B)还必须有稳定剂存在,否则胶粒容易 聚结,而发生聚沉现象。
(2) 憎液溶胶的特性
10.1.3 胶团的结构
AgNO3 (aq) KI(aq) KNO3 (aq) AgI(溶胶)
过量的 AgNO3 作稳定剂
胶团的结构表达式: [(AgI)m n Ag+ (n-x)NO3–]x+ x NO3– 胶核 胶粒(带正电) 胶团(电中性) 胶核 胶粒 胶团
胶团的图示式:
10.1.4 溶胶的净化
3. 按胶体分散系统的性质分类
(3)缔合胶体
由表面活性物质缔合形成胶束,分散在介质中,
胶束半径已落在胶体粒子范围内。
或由缔合表面活性物质保护的一种微小液滴,
均匀地分散在另一种液体介质中,形成半径落在胶
体粒子范围内的微乳状液。
10.1.2 憎液溶胶的制备
制备溶胶必须使分散相粒子的大小落在胶体分 散系统的范围之内,并加入适当的稳定剂。制备方
(a)特有的分散程度 粒子的大小在10-9—10-7 m之间,因而扩散较慢,不 能透过半透膜。 (b)多相不均匀性
具有纳米级的粒子是由许多离子或分子聚结而成, 结构复杂,与介质之间有明显的相界面,比表面很大。
(c)热力学不稳定性 因为粒子小,比表面大,表面自由能高,是热力 学不稳定体系,有自发降低表面自由能的趋势,即 小粒子会自动聚结成大粒子。
x (2Dt )1 2
这就是Einstein-Brown 位移方程。 因为 代入得
RT t x L 3 r
1 2
RT 1 D L 6 r
10.2.1 动力性质
2. 扩散与渗透压
RT 1 D L 6 r
从 Brown 运动实验,测出平均位移,就可求 出扩散系数D 扩散系数D的物理意义是:在单位时间内、单 位浓度梯度下通过单位截面积的物质的质量。 有了扩散系数,就可以从上式求粒子半径 r。 已知 r 和粒子密度 , 可以计算粒子的摩尔质量
10.2.2 光学性质
1. Tyndall 效应
光源
CuSO4溶液
Fe(OH)3溶胶
10.2.2 光学性质
2. Rayleigh 散射定律 Rayleigh研究了大量的光散射现象,发现散射光 的强度与多种因素有关,主要因素为:
1. 散射光强度与入射光波长的四次方成反比。入 射光波长越短,散射越显著。所以可见光中,蓝、 紫色光散射作用强。
10.1.4 溶胶的净化
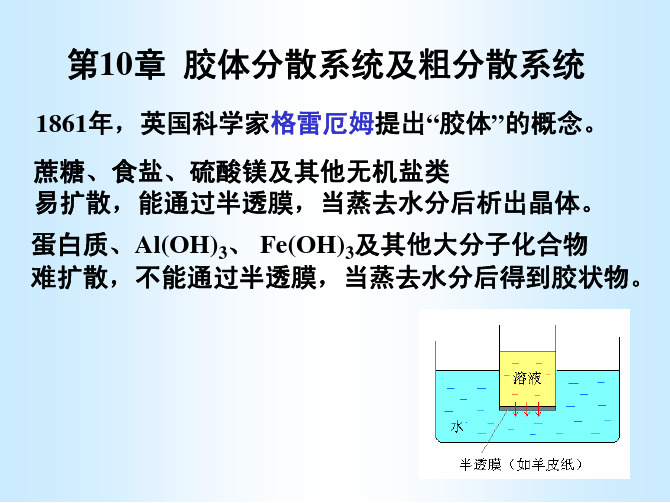
1. 渗析法
简单渗析 将溶胶放在羊皮纸或 动物膀胱等半透膜制成的 容器内,膜外放纯水。 利用浓差,多余的电 解质离子不断向膜外渗透
H 2O H 2O
溶胶
经常更换溶剂,就可以净化半透膜容器内的溶胶。 如将装有溶胶的半透膜容器不断旋转,可以加 快渗析速度。
10.1.4 溶胶的净化
1. 分散系统的分类
2. 憎液溶胶的制备 3. 胶团的结构
4. 溶胶的净化
2017/3/26
10.1 胶体分散系统概述
把一种或几种物质分散在另一种物质中就构成 散系统。 被分散的物质称为分散相(dispersed phase) 另一种物质称为分散介质(dispersing medium) 云: 水分散在空气中 牛奶:乳脂分散在水中 珍珠:水分散在蛋白质中
10.2.2 光学性质
1. Tyndall 效应 1869年,Tyndall发现,若令一束会聚光通过溶胶 从侧面(与光束垂直的方向)可以看到一个 发光的圆锥体,这就是Tyndall效应。 其他分散系统也会产生一点散射光,但远不如 溶胶显著。 Tyndall效应实际上已成为判别溶胶与分子溶 液的最简便的方法。
10.2.1 动力性质
1. Brown运动
通过大量观察,得 出结论:粒子越小,布 朗运动越激烈。
其运动激烈的程度 不随时间而改变,但随 温度的升高而增加。
10.2.1 动力性质
1. Brown运动
1905年Einstein(爱因斯坦)等人才阐述了Brown 运动的本质。 认为Brown运动是分 散介质分子以不同大小 和不同方向的力对胶体 粒子不断撞击而产生的. 由于受到的力不平衡,所以连续以不同方向、 不同速度作不规则运动。
悬浮在液面上的花粉粉末不断地作不规则的运动。 后来又发现许多其它物质如煤、 化石、金属等
的粉末也都有类似的现象。人们称微粒的这种运动
为Brown运动。 但在很长的一段时间里,这种现象的本质没有 得到阐明。
10.2.1 动力性质
1. Brown运动
1903年发明了超显 微镜,为研究布朗运动 提供了物质条件。 用超显微镜可以观察 到溶胶粒子不断地作不规 则“之”字形的运动 从而能够测出在一定时间内粒子的平均位移。
5、用电解质把豆浆点成豆腐,如果有三种电解质,石膏、氯化镁、氯化 钠,哪种电解质的聚沉能力最强? 6、江河入海口为什么会形成三角洲?
第10章 胶体分散系统
10.1 胶体分散系统概述
10.2 溶胶的动力和光学性质
10.3 溶胶的电学性质 10.4 溶胶的稳定性和聚沉作用
2017/3/26
10.1 胶体分散系统概述
气溶胶
晨雾
烟
白云
3. 按胶体分散系统的性质分类
(1)憎液溶胶
由 AgI(s) , Au(s) 和 Fe(OH)3 (s) 等难溶物质分散 在液体介质(通常是水)中形成的溶胶。
半径为1 ~100 nm的难溶物固体粒子保持了原有 的性质,分散在液体介质中,有很大的相界面,易 聚沉,是热力学上的不稳定系统。
10.1.3 胶团的结构
现以制备碘化银溶胶为例
AgNO3 (aq) KI(aq) KNO3 (aq) AgI(溶胶)
过量的 KI 作稳定剂
胶团的结构表达式 : 胶团的图示式: 胶核
[(AgI)m n I – (n-x)K+]x– xK+
胶核 胶粒(带负电) 胶团(电中性)
胶粒 胶团
在制备溶胶的过程中,常生成一些多余的电解 质,如制备 Fe(OH)3溶胶时生成的HCl。
Fe(OH)3 HCl FeOCl 2H2O
少量电解质 FeO 可以作为溶胶的稳定剂
过多的电解质 HCl 的存在会使溶胶不稳定, 容易聚沉,所以必须除去。 净化的方法主要有渗析法和超过滤法。
10.2.2 光学性质
光散射现象 (3)当光束通过分子溶液时,由于溶液十分均匀, 散射光因相互干涉而完全抵消,看不见散射光。 光散射现象的本质 光是一种电磁波,照射溶胶时,分子中的电子 分布发生位移而产生偶极子,这种偶极子像小天线 一样向各个方向发射与入射光频率相同的光,这就 是散射光。 溶胶是多相不均匀系统,在胶粒和介质分子 上产生的散射光不能完全抵消,因而能观察到散 射现象。
3. 按胶体分散系统的性质分类
(2)亲适的溶剂中形成的溶胶。
分散相分子本身的大小已达到胶粒范围,它的扩 散速率小、不能透过半透膜等性质与胶体系统相似。 一旦将溶剂蒸发,大分子化合物凝聚,再加入
溶剂,又可形成溶胶。
亲液溶胶是热力学上稳定、可逆的系统。
2. 分散相与分散介质的折射率相差越显著,则散射 作用也越显著。 3. 散射光强度与单位体积中的粒子数成正比。
10.1 胶体分散系统概述
分类系统通常有三种分类方法:
1. 按分散相粒子的大小分
{ {
•分子分散系统 •胶体分散系统 •粗分散系统 •液溶胶 •固溶胶 •气溶胶 •憎液溶胶 •亲液溶胶 •缔合溶胶
2. 按分散介质的物态分
3. 按胶体分散系统的性质分
{
1. 按分散相粒子的大小分类
(1) 分子分散系统 分散相与分散介质以分子或离子形式彼此混溶, 没有界面,是均匀的单相,分子半径大小在10-9 m以 下 。通常把这种系统称为真溶液,如CuSO4水溶液。 (2)胶体分散系统 分散相粒子的半径在1~100 nm的系统。目测是均匀 的,但实际是多相不均匀系统。也有的将1 ~ 1000 nm的 粒子归入胶体范畴。 (3)粗分散系统 当分散相粒子大于1000 nm,目测是混浊不均匀系 统,放置后会沉淀或分层,如黄河水。
