二氧化碳的性质与用途
二氧化碳资料

知识整合:二氧化碳的性质、用途及制法1.二氧化碳的性质(1)物理性质:无色,无味的气体,密度比空气大,能溶于水,固态:白色,俗称“干冰”(2)化学性质①一般情况下不能燃烧,也不支持燃烧,不能供给呼吸②与水反应生成碳酸:CO2+H2O一→ H2CO3 生成的碳酸能使紫色的石蕊试液变红H2CO3一→ H2O+ CO2碳酸不稳定,易分解③能使澄清的石灰水变浑浊:CO2+Ca(OH)2一→CaCO3 +H2O 本反应用于检验二氧化碳。
2.二氧化碳的用途:①灭火(利用性质:二氧化碳密度大于空气,不可燃,不助燃)阶梯蜡烛实验现象:蜡烛自下而上依次熄灭。
②干冰用于人工降雨、制冷剂、舞台云雾效果③温室肥料④制碳酸饮料3.二氧化碳对环境的影响:过多排放加剧温室效应。
4.二氧化碳的制法(1)实验室制取气体的思路:(原理、装置、检验)(2)二氧化碳的实验室制法:①原理:石灰石(大理石)和稀盐酸反应:CaCO3+ HCl一→ CaCl2+ H2O+ CO2不用碳酸钙粉末的原因:反应速率过快,不易控制与收集气体不用稀硫酸:反应生成的微溶于水的硫酸钙覆盖在大理石表面,阻止反应的进一步发生不用浓盐酸:浓盐酸有强挥发性,使收集的二氧化碳中混有氯化氢气体而不纯②发生装置:固液不加热型③收集方法:向上排空气法④验满方法:将点燃的木条放在集气瓶口,木条熄灭。
证明已集满二氧化碳气体。
检验方法:将制得的气体通入澄清的石灰水,若变浑浊,则是二氧化碳。
5.气体制取装置优缺点利用分液漏斗:可以控制反应速率。
长颈漏斗加止水夹:控制反应的发生和停止多功能瓶:(排空气法)密度大的长导管进气,密度小的短导管进气。
(排水法)短导管进气。
二氧化碳 二氧化碳的性质及用途

3.为了制取 CO2 并验证它的性质,张林同学设计并进行了下图 所示的实验,请根据要求回答有关问题。
(1)仪器 a 的名称是 长颈漏斗 。
高温 2CO CO + C===== 2 (2)B 中玻璃管内发生化学反应的方程式为 ,
酒精灯加上网罩的作用是 使火焰集中,并稍稍提高火焰的温度 。 (3)D 中石蕊溶液始终没有变红,则 C 装置中 M 最有可能是
⑤在实验室中两种
ห้องสมุดไป่ตู้
2.下列物质用途与性质对应关系错误的是( B ) A.活性炭用于净水——吸附性 B.二氧化碳用于灭火——能与水反应 C.金刚石用于裁玻璃——硬度大 D.硫酸用于金属除锈——能与金属氧化物反应
二氧化碳的实验室制取
1.原料:利用石灰石和稀盐酸反应可制取二氧化碳。 2.原理: CaCO3+2HCl===CaCl2+H2O+CO2↑ 3.装置: 4.收集方法:向上排空气法。 5. 二氧化碳气体的检验: 如果能使澄清石灰水变浑浊 则是二氧化碳。 。
1.下列关于氧气和二氧化碳两种气体的说法正确的是( A ) ①氧气在空气中的体积分数约为 78% ②二氧化碳没有毒性, 但 不能供给呼吸 ③氧气能支持燃烧,是一种可燃性气体 ④二氧化碳
能参与绿色植物的光合作用,是最好的气体肥料 气体可以用相同的装置制取 A.②④⑤ C.②③④ B.①③⑤ D.①③④⑤
例4.下列装置常用于实验室制取气体,根据给出的装置回答下 列问题。
(1)指出编号仪器名称:② 长颈漏斗 。 (2)制取并收集二氧化碳应选择的装置是 BE (从 A~E 中选择), 使用该套装置制取气体的突出优点是可随时使反应进行,也可随时使反应停止 ,
+CO2↑ 该反应原理用化学方程式表示为 CaCO3+2HCl===CaCl2+H2O ,
二氧化碳的性质与用途

二氧化碳的性质与用途二氧化碳是一种无色、无臭的气体,化学式为CO2、它是地球大气中最重要的温室气体之一,并在许多行业和领域中具有广泛的应用。
现在我们将详细介绍二氧化碳的性质和用途。
1.性质1.1物理性质:二氧化碳是一种相对较重的气体,在常温下为无色、无臭的气体。
它比空气重约1.5倍,凝固点为-78.5℃,沸点为-56.6℃。
此外,二氧化碳具有较高的溶解度,可以溶解于许多溶剂中。
1.2化学性质:二氧化碳是一种稳定的分子,不容易发生化学反应。
它不易燃烧,不支持燃烧。
但在高温和高压条件下,二氧化碳还是可以和一些物质发生反应。
2.用途2.1工业用途:二氧化碳在工业中拥有广泛的用途。
一方面,在食品饮料行业中,二氧化碳被用作充气剂,为饮料增加气泡和口感。
此外,它还用于制作碳酸饮料、啤酒等。
二氧化碳还可作为冷却剂和气雾剂在一些喷涂和清洁过程中使用。
另一方面,二氧化碳还是钢铁、煤矿和水泥等工业中的还原剂。
2.2医疗应用:二氧化碳在医疗领域中也有着重要的用途。
利用其特性,二氧化碳可以用作治疗呼吸道疾病的气体。
例如,在肺功能测试中,患者需要吸入含有二氧化碳的气体来评估肺功能。
此外,二氧化碳还被用于一些医疗手术,例如腹腔镜手术,可以通过将二氧化碳充入腹腔来创造一个操作空间。
2.3温室气体:二氧化碳是地球大气中最重要的温室气体之一、在大气中,二氧化碳可以吸收和辐射地球表面的热能,通过这种方式,二氧化碳的存在会影响地球的气候。
然而,由于人类活动的增加,二氧化碳的排放量大大增加,导致地球温室效应加剧,引发了全球变暖的问题。
2.4消防灭火:二氧化碳具有窒息作用,可用于灭火。
在火灾发生时,将二氧化碳注入火源中,由于二氧化碳的密度较大,它能从下往上覆盖火焰,减少火焰周围氧气浓度,以达到灭火的效果。
因此,二氧化碳广泛应用于电气设备、机械设备和航空航天等领域的灭火系统中。
2.5聚合物加工:二氧化碳还可作为聚合物加工中的膨胀剂使用。
例如,在注塑过程中,通过向聚合物中注入二氧化碳,可以在聚合物内产生气泡,这样可以降低聚合物的密度,减少材料的成本。
二氧化碳的性质

二氧化碳的性质、用途及可能的减排措施性质:二氧化碳是空气中常见的化合物,碳与氧反应生成其化学式为CO2,一个二氧化碳分子由两个氧原子与一个碳原子通过共价键构成,常温下是一种无色无味气体,密度比空气大,能溶于水,与水反应生成碳酸,不支持燃烧。
固态二氧化碳压缩后俗称为干冰。
二氧化碳被认为是加剧温室效应的主要来源。
常温下是一种无色无味气体,密度比空气略大(1.977g/L,所以实验室收集二氧化碳可用向上排空气法),能溶于水,没有闪点。
无色无味,液体状态表面张力:约3.0dyn/cm密度:1.816kg/m3 粘度:比四氯乙烯粘度低得多,所以液体二氧化碳更能穿透纤维。
二氧化碳分子结构很稳定,化学性质不活泼,不会与织物发生化学反应。
它沸点低(-78.5℃),常温常压下是气体。
加压降温可得无色CO2液体,再降温可得雪花状固体,再压缩可得干冰,干冰达到-78.5℃,会升华成为气体CO2,不会形成CO2液体。
干冰不是冰,是固态二氧化碳。
用途:二氧化碳可注入饮料中,增加压力,使饮料中带有气泡,增加饮用时的口感,像汽水、啤酒均为此类的例子。
固态的二氧化碳(或干冰)在常温下会气化,吸收大量的热,因此可用在急速的食品冷冻。
二氧化碳的重量比空气重,不助燃,因此许多灭火器都通过产生二氧化碳,利用其特性灭火。
而二氧化碳灭火器是直接用液化的二氧化碳灭火,除上述特性外,更有灭火后不会留下固体残留物的优点。
二氧化碳也可用作焊接用的保护气体,其保护效果不如其他稀有气体(如氩),但价格相对便宜许多。
二氧化碳激光是一种重要的工业激光来源。
二氧化碳是植物光合作用的主要碳源,可以用作植物温室的气体肥料和水草缸水族箱的肥料。
二氧化碳可用来酿酒,二氧化碳气体创造一个缺氧的环境,有助于防止细菌在葡萄生长。
二氧化碳可控制pH值,游泳池加入二氧化碳以控制pH值,加入二氧化碳从而保持pH值不上升。
二氧化碳可用于制碱工业和制糖工业。
二氧化碳可用于塑料行业的发泡剂。
二氧化碳的物理性质和化学性质

二氧化碳的物理性质和化学性质
一、物理性质:
二氧化碳在常温下是一种无色无味的气体,密度比空气大,微溶于水,二氧化碳固体俗称干冰,可做致冷剂,用于保藏食品、人工降雨.
二、化学性质:“三不二水”
二氧化碳不能燃烧,不能助燃,也不能供呼吸.
二氧化碳能与水反应生成使紫色石蕊试液变红的碳酸:CO2 + H2O = H2CO3.但碳酸不稳定,受热易分H2CO3=△= CO2 ↑+ H2O。
二氧化碳通入澄清的石灰水,能使石灰水变浑浊 ,这也是检验二氧化碳的方法.Ca(OH)2+CO2 = CaCO3↓ + H2O。
另外,二氧化碳还是光合反应的原料:6CO2 + 6H2O =叶绿体、光照=C6H12O6 + 6O2 二氧化碳,一种碳氧化合物,化学式为CO2,化学式量为44.0095,常温常压下是一种无色无味或无色无嗅而其水溶液略有酸味的气体,也是一种常见的温室气体,还是空气的组分之一(占大气总体积的0.03%-0.04%)。
在物理性质方面,二氧化碳的熔点为-56.6℃,沸点为-78.5℃,密度比空气密度大(标准条件下),溶于水。
二氧化碳的性质用途及制法

二氧化碳的性质用途及制法二氧化碳(CO2)是一种无色、无味的气体,由一个碳原子与两个氧原子组成。
它具有多种性质、用途和制法。
1.膨胀性:二氧化碳是一种高度可压缩的气体,在温度和压力条件下可以变成固体或液体。
在常温和大气压下,它是气体状态。
2. 密度:二氧化碳的密度为1.98 kg/m³,比空气稍重。
3.不可燃性:二氧化碳是一种非可燃性气体,不支持燃烧或脱氧作用。
4.酸性:二氧化碳可与水反应,形成碳酸,使水呈酸性。
5.可溶性:二氧化碳可以溶解在水中形成碳酸溶液。
1.饮料和食品工业:二氧化碳是一种重要的食品加工辅助剂,可用于饮料和一些食品的碳化处理,增加其口感和保鲜效果。
2.焊接和金属加工:二氧化碳可以用作保护性气体,防止金属在焊接和切割过程中与空气中的氧气发生反应。
3.灭火器的驱动剂:二氧化碳是常见的灭火器的驱动剂,利用其惰性和高压来抑制火焰。
4.水处理:二氧化碳可以在水中形成碳酸,用于调整水的酸碱度。
5.医疗应用:二氧化碳可以用作麻醉剂,如在一些手术中用于气腹或心血管手术中维持心功能。
1.燃烧法:通过燃烧含碳物质(如煤、木材等)可以得到二氧化碳。
反应方程式为:C+O2->CO22.酸碱反应法:将碳酸盐与酸反应可以得到二氧化碳。
最常用的方法是将碳酸氢钠和醋酸反应,产生二氧化碳气体。
反应方程式为:NaHCO3+CH3COOH->CO2+H2O+CH3COONa3.碳酸化法:通过在自然气田中注入二氧化碳来提高石油和天然气开采的效率。
这种方法通常被称为二氧化碳驱油法。
总结起来,二氧化碳具有膨胀性、密度适中、不可燃性、具有酸性、可溶性等性质。
它在工业、农业、医疗和环境保护等方面有广泛的用途。
制法包括燃烧法、酸碱反应法和碳酸化法等。
CO2的性质及其用途

CO2的性质及其用途二氧化碳(CO2)是一种无色、无味、无毒的气体,分子式CO2,分子量约为44克/摩尔。
它是由碳与氧元素形成的化合物,是地球大气中最重要的温室气体之一二氧化碳具有许多重要的性质。
首先,CO2是一种稳定的分子,它不易参与化学反应。
这种稳定性使得CO2可以在大气中存在相对较长的时间,因此在地球的碳循环中起着重要的角色。
此外,二氧化碳在常温常压下为气态,如果减少温度和增加压力,二氧化碳可以转化为液态或固态。
例如,当CO2处于超临界流体状态时,它既具有液体的高扩散性,又具有气体的低粘度。
这种特性使其在许多工业应用中具有广泛的用途。
CO2具有许多重要的用途。
首先,CO2是植物进行光合作用的必需物质之一、植物通过光合作用吸收二氧化碳,并将其转化为有机物质和氧气。
二氧化碳的供给对于植物的生长和繁殖非常重要,并且被广泛应用于温室园艺和农业领域。
其次,二氧化碳是一种重要的化学原料。
它可以用作氮化硅和卡宾基合成的原料,以及合成其他有机化合物的中间体。
此外,二氧化碳可以作为酸催化剂和溶剂,用于化学反应的催化和催化剂的再生。
此外,二氧化碳还用作制冷剂和干燥剂,在食品、制药和化妆品等行业中得到广泛应用。
此外,CO2还可以用作火灾灭火剂。
二氧化碳是一种有效的灭火剂,其灭火机理主要是通过抑制火焰中的氧气供应来控制火源。
CO2灭火系统广泛应用于机舱、电子设备和其他易燃易爆地区,因为CO2不导电、不腐蚀且不会残留在灭火区域。
另外,CO2还可以用于饮料和食品工业中的饮料和食物的碳酸化处理。
二氧化碳可以通过注入或溶解的方式添加到饮料和食物中,以增加其口感和延长其保存期限。
例如,碳酸饮料、啤酒和巧克力等产品通常都含有二氧化碳。
此外,CO2还可以作为一种环境保护材料进行回收利用。
例如,二氧化碳可以被捕获、压缩和储存,以减少大气中的温室气体浓度。
这种CO2的捕获和储存技术被广泛应用于工业排放和能源生产过程中,以减少对气候变化的负面影响。
二氧化碳四种用途及性质

二氧化碳四种用途及性质二氧化碳是一种无色、无味、无毒的气体,化学式为CO2,由一个碳原子和两个氧原子组成。
它在大气中广泛存在,是地球上重要的温室气体之一。
除了对大气层有重要影响外,二氧化碳还有许多其他用途。
下面将详细介绍二氧化碳的四种用途及性质。
首先,二氧化碳用于工业生产。
二氧化碳在许多工业领域都有广泛的应用。
例如,它被用作食品和饮料行业的膨松剂。
在饮料中,二氧化碳被注入以增加气泡和起泡作用。
在食品行业,二氧化碳被用于制造蛋糕、面包等面食产品时,可以使面团膨胀、变得松软,提高其口感。
此外,二氧化碳还被用于制造化肥、火箭燃料、气雾剂、冷冻食品等产品。
其次,二氧化碳用于医疗领域。
在医疗领域,二氧化碳有多种应用。
其中最常见的是用于产科手术中的腹腔镜和人工呼吸器。
在腹腔镜手术中,医生通过将二氧化碳注入腹腔,可以扩大视野、减少出血,并便于进行手术操作。
此外,二氧化碳还可以用于治疗高血压、心脏病、肺病等病症。
例如,通过吸入含有二氧化碳的气体,可以改善肺功能,促进气体交换,减轻呼吸困难。
第三,二氧化碳用于环境保护。
由于二氧化碳是全球变暖的主要原因之一,在环境保护中的应用日益重要。
二氧化碳可以用于捕捉和封存(CCS)技术,将工业排放的二氧化碳捕集、转运、储存起来,以减少其对大气的排放。
此外,二氧化碳还被用于增加植物的生长。
在温室中,增加二氧化碳的浓度可以提高植物的光合作用效率,促进植物生长,增加农作物产量。
最后,二氧化碳用于消防灭火。
二氧化碳具有灭火性能,因为它可以抑制火焰的氧气供应,并降低燃料的温度。
这使得二氧化碳成为一种常用的灭火剂。
它主要用于电气设备和化学设备的灭火,因为它不导电、不具有腐蚀性,可以有效地灭火,并不会对设备造成损坏。
除了上述四种主要用途外,二氧化碳还有许多其他的性质。
首先,二氧化碳是一种不可燃气体,不支持燃烧反应。
其次,二氧化碳是相对稳定的化合物,不容易被分解。
此外,二氧化碳的溶解度随温度和压力的变化而变化。
二氧化碳的性质与用途(共19张PPT)
二、CO2的化学性质
1、一般情况下,CO2不能燃烧,不能支持燃烧。
2、CO2不能供呼吸。
3、CO2跟水反应。
CO2
CO2
CO2+H2O = H2CO3
醋酸
石蕊固体
石蕊溶液
一、CO2的物理性质
1、通常情况下是无色、无气味的气体。
2、能溶于水(1:1)
3、标态下, CO2=1.977 克 /升, 比空气的密度大。
H2CO3 = CO2↑ +H2O
4、CO2与石灰水[Ca(OH)2]反应。
CO2+ Ca(OH)2 = H2O +CaCO3 ↓
一、CO2的物理性质
1、通常情况下是无色、无气味的气体。
2、能溶于水(1:1)
3、标态下, CO2=1.977 克 /升, 比空气的密度大。
二、CO2的化学性质
1、一般情况下,CO2不能燃烧,不能支持燃烧。 2、CO2不能供呼吸。
1、通常情况下是无色、无气味的气体。
2、能溶于水(1:1)
3、标态下, CO2=1.977 克 /升, 比空气的密度大。
二、CO2的化学性质
1、一般情况下,CO2不能燃烧,不能支持燃烧。
2、CO2不能供呼吸。
一、CO2的物理性质
1、通常情况下是无色、无气味的气体。
2、能溶于水(1:1)
3、标态下, CO2=1.977 克 /升, 比空气的密度大。
最简便且可行的方法是
A、用燃着的木条分别伸入集气瓶中
B、分别加入石灰水并振荡 C、分别滴入紫色石蕊试液
D、分别加入水并振荡
A
B
C
D
结束
2、CO2能使紫色石蕊试液变红是因为 A、密度比空气大
二氧化碳的用途及物理性质

二氧化碳的用途及物理性质
积极思考造成积极人生,消极思考造成消极人生。
想要了解二氧化碳的小伙伴快来看看吧!下面由小编为你精心准备了“二氧化碳的用途及物理性质”,持续关注本站将可以持续获取更多的考试资讯!
二氧化碳的用途
二氧化碳,一种碳氧化合物,常温常压下是一种无色无味或无色无嗅而略有酸味的气体,也是一种常见的温室气体,还是空气的组分之一,能够溶于水,能够液化。
二氧化碳的用途非常广,它可以做为防腐剂、制冷剂、灭火剂,同时也是化学工业中的一种重要的原料。
它对人类既有好处,同时也有一定的害处。
二氧化碳可以作为灭火剂,这是因为在一般条件下,二氧化碳不支持燃烧且比空气重,将二氧化碳覆盖在燃着的物体表面,可使物体跟空气隔绝而停止燃烧,因此二氧化碳可用灭火,是常用的灭火剂。
二氧化碳可以作为防腐剂,在现代化仓库里常充入二氧化碳,防止粮食虫蛀和蔬菜腐烂,延长保存期。
贮藏粮食、水果、蔬菜。
二氧化碳可以作为制冷剂,固态的二氧化碳就是我们所说的“干冰”,主要用作致冷剂,用飞机在高空喷撒“干冰”,可以使空气中水蒸气冷凝,形成人工降雨;“干冰”还可以做食品速冻保鲜剂。
二氧化碳还可以用于化学工业中的一些物品制作,如我们常说的碳酸饮料、啤酒、汽水等。
二氧化碳的物理性质:
1、常温常压下是一种无色无味或无色无嗅(嗅不出味道)而略有酸味的气体;
2、溶于水和烃类等多数有机溶剂;
3、密度比空气大;
4、熔点为-56.6℃,沸点为-78.5℃。
二氧化碳的性质和用途-化学

二氧化碳的制备方法
1
燃烧石油和煤
石油和煤中的碳燃烧可以产生大量的二氧化碳。
2
化石燃料的氧化
通过氧化燃烧化石燃料,如天然气和石油,可以得到二氧化碳。
3
碳酸盐的分解
将碳酸盐加热分解,可以释放出二氧化碳。
二氧化碳的主要用途
饮料制造
二氧化碳用作饮料中的气泡, 增加口感和爽快感。
灭火器
二氧化碳被用作非导电的灭火 剂,能够扑灭火焰。
二氧化碳的性质和用途化学
二氧化碳是一种无色、无味、可燃性和无毒的气体。它具有许多重要的物理 和化学性质,被广泛应用于各个领域。
二氧化碳的物理性质
高溶解度
二氧化碳在水中具有较高 的溶解度,导致可口可乐 等饮料中的气泡。
密度与空气接近
二氧化碳比空气密度高, 易聚集在低洼地区,有应的主要原因,对 气候变化产生重要影响。
二氧化碳的化学性质
1 不易燃烧
二氧化碳具有较高的燃 点,不易燃烧,可以用 作灭火剂。
2 无毒
3 与水反应生成碳酸
二氧化碳在常温下无毒, 可以安全地用于食品加 工和饮料制造。
二氧化碳与水反应生成 碳酸,对水质和水环境 具有重要影响。
随着人们对可持续发展和环境保护的重视,二氧化碳的减排和利用成为全球 关注的焦点。创新技术和可再生能源的应用将推动二氧化碳减排和利用的发 展。
温室种植
二氧化碳可以提供植物所需的 碳源,促进植物生长。
二氧化碳的环境影响
温室效应
大量释放的二氧化碳导致地球的温度上升,引发全球气候变化。
海洋酸化
大量溶解在海洋中的二氧化碳会导致海水酸化,对海洋生态系统产生负面影响。
空气污染
高浓度的二氧化碳会影响空气质量,对人体健康产生潜在威胁。
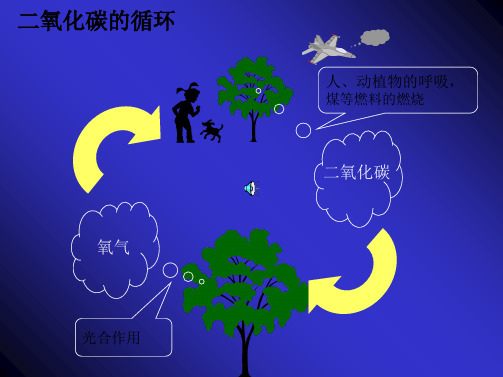
二氧化碳的相关性质

第二节二氧化碳的相关性质讲方法一、考查二氧化碳的性质和用途1.物理性质:无色、无味的气体,密度比空气大,能溶于水,固态二氧化碳叫做干冰。
2.化学性质:(1)一般情况下,二氧化碳不能燃烧,也不支持燃烧,不能供给呼吸。
(2)与水反应生成碳酸: CO2+H2O=H2CO3碳酸不稳定,易分解:H2CO3 = H2O+ CO2↑(3)能使澄清的石灰水变浑浊:CO2+Ca(OH)2=CaCO3↓+H2O 该反应用于检验二氧化碳;这也是久置装石灰水的试剂瓶壁有一层白膜的原因。
(4)与灼热的碳反应: C + CO2高温2CO (吸热反应,既是化合反应又是氧化还原反应,CO2是氧化剂,C是还原剂)3.用途:(1)灭火(灭火器原理:Na2CO3+2HCl=2NaCl+H2O+CO2↑)既利用其物理性质(密度比空气大),又利用其化学性质(不能燃烧,也不支持燃烧)。
(2)干冰用于人工降雨、制冷剂(利用干冰升华时要吸收大量的热)。
(3)气体肥料。
(4)光合作用。
(5)化工产品的原料。
4.二氧化碳对环境的影响:(1)过多排放引起温室效应。
①造成温室效应的主要原因:人类消耗的化石能源急剧增加,森林遭到破坏等。
②减轻温室效应的措施:减少化石燃料的燃烧;植树造林;使用清洁能源等。
(2)由于二氧化碳不能供给呼吸,因此在人群密集的地方要注意通风换气。
二、考查实验室制取二氧化碳的方法1.药品:石灰石与稀盐酸。
2.原理:CaCO3+2HCl=CaCl2+H2O+CO2↑3.装置图:4.气体收集方法:向上排空气法(密度比空气大,能溶于水)。
5.检验方法:将制得的气体通入澄清的石灰水,石灰水变浑浊,则是二氧化碳气体。
6.验满方法:将点燃的木条放在集气瓶口,如木条熄灭,证明已集满二氧化碳气体。
7.二氧化碳的工业制法:CaCO3高温CaO+CO2↑生石灰和水反应可得熟石灰:CaO+H2O=Ca(OH)2学思路铺垫1. (江苏中考)下列关于二氧化碳的说法错误的是()A.二氧化碳可用于制碳酸类饮料B.干冰(固体二氧化碳)可用于人工降雨C.常温下二氧化碳是一种有刺激性气味的有毒气体D.大气中二氧化碳的消耗途径主要是植物的光合作用【解析】二氧化碳与水反应生成碳酸,碳酸具有酸性,所以二氧化碳可用于制碳酸叫做“干冰”,其升华时会吸收大量的热,因而具有很多重要的类饮料。
初中化学-二氧化碳的性质和用途

7.下列关于二氧化碳的叙述正确的是( ) A.在5.2个大气压下,将二氧化碳冷却到- 56.6 ℃能得到液态二氧化碳,所以二氧化碳 是一种极难于液化的气体。 B.二氧化碳在空气中能形成酸雾 C.二氧化碳有毒 D.二氧化碳气不能燃烧
D
8.成“温室效应”,使全球气候升温的气体是 () A.氮气 B.氧气
A
5. 有关“物质──性质──用途”的叙 述中,用途与性质不相关的是( )
A. 氢气─密度小─可用于充灌探空 B. 二氧化碳──与水反应──灭火 C. 氧气─能与许多物质反应并放出热量─冶 炼钢铁 D. 干冰─蒸发时吸收热量─制冷剂
B
6.下列变化中包含化学变化的是( ) A.二氧化碳溶于水 B.二氧化碳制成干冰 C.二氧化碳通入澄清石灰水中出现浑浊 D.放在空气中的干冰不一会就消失了
3. 下列物质的性质不属于化学性质的是( )
A. 木炭在氧气中燃烧 B.二氧化碳使紫色石蕊试液变红 C.在天然物质里,金刚石的硬度最大 D.氢气使黑色氧化铜变成红色铜
C
4. 二氧化碳使澄清的石灰水变浑浊是因为( )
A.生成不溶于水的碳酸钙 B.生成碳酸氢钙 C.二氧化碳不溶与水 D.通入二氧化碳后,分离出氢氧化钙固体
2. 在学生实验时,有一位同学发现实验室 中石灰水试剂瓶内表面有一层白膜,问其 化学成分是什么?如何形成的?
白膜的主要成分是CaCO3。石灰水的主要 成分是Ca(OH)2。当长期放置时,表面 的溶液与空气接触,发生如下反应: CO2+Ca(OH)2===CaCO3↓+H2O。生 成的CaCO3是难溶于水的白色固体物质, 故飘浮在溶液表面形成白膜。
──CO2+Ca(OH)2=CaCO3↓+H2O
二氧化碳的性质及用途

二氧化碳的性质及用途二氧化碳(CO2)是一种无色无味的气体,由一个碳原子和两个氧原子组成。
它在常温下存在于大气中,占据地球大气的0.04%。
二氧化碳是地球上非常重要的一个化学物质,在自然界中起着多种重要的作用。
以下将详细介绍二氧化碳的性质及其在不同领域中的用途。
1.性质:(1)物理性质:二氧化碳是一种不可燃性气体,密度比空气高约1.98倍。
在常温和常压下,它是无色无味的。
它在-78.5°C时会凝结成固态,凝固后呈白色。
同时,二氧化碳可以在常温下直接转化成固态二氧化碳,这种固态二氧化碳又被称为干冰。
它不会变成液体状态,而是在减压时直接蒸发成气体。
(2)化学性质:二氧化碳是一种相对稳定的物质。
它在标准条件下几乎不与其他物质反应。
但是,它可以在高温和高压下与一些物质如氢气、氢氧化钠等反应。
2.自然界中的作用:(1)植物光合作用:二氧化碳是光合作用的重要原料之一、植物通过与阳光和水反应,将二氧化碳转化为有机物质(如葡萄糖)并释放出氧气。
(2)酸碱平衡:二氧化碳可以与水反应生成碳酸,维持自然界中的酸碱平衡。
通过呼吸作用,动物体内产生二氧化碳并与血液中的水反应形成碳酸,然后呼出体外。
(3)温室效应:二氧化碳是温室气体之一,对地球能量平衡起关键作用。
它可以吸收并保持地球表面的一部分热量,使地球能够维持适宜的温度。
3.工业与应用领域的用途:(1)食品与饮料产业:二氧化碳被用作一种添味剂和保鲜剂,在软饮料中可以为其提供起泡效果。
它还用于食品和饮料的冷冻、冷藏和杀菌过程。
(2)消防灭火:二氧化碳具有扑灭火焰的作用,常用于气体灭火系统中。
它可以在火灾发生时迅速喷洒到火源附近,降低氧气浓度,从而扑灭火焰。
(3)气体溶剂:二氧化碳在高压下可以作为溶剂使用,并具有无毒、不易燃和不残留的特性。
它在医药、化妆品、印刷和清洗等领域有广泛的应用。
(4)石油开采:二氧化碳可以以气体或液态注入到油井中,以增加井底压力并驱出石油。
二氧化碳的性质和用途--化学课件

第1课时 二氧化碳的性质和用途
1.了解探究物质性质时设计实验的方法。 2.了解二氧化碳的性质和用途。
二氧化碳可用于制汽水
汽水配料表: 水、果葡糖浆、白砂糖 食品添加剂(二氧化碳、柠檬酸、柠 檬酸钠、苯甲酸钠等)、食用香精
研究物质性质的一般思路
已有事实
完成 练习与应用 第1、5题。
CO2+Ca(OH)2=CaCO3↓+H2O
二氧化碳的用途
气体肥料
消防灭火
人工降雨
想一想,二氧化碳这些用途都利用了它的什么性质?
色、味、态
不支持
与
能 溶 于
密度比 空气大
燃烧, 不能燃 烧
水 反 应
水
物理性质
化学性质
二 氧 化 碳
与澄清石 灰水反应
一、CO2的性质及其探究实验 二、CO2的用途
2.与水反应生成碳酸。 3.能使澄清的石灰水变浑浊。
设计实验验证相关性质: 实验一 验证CO2不燃烧也不支持燃烧
现象:上下两层的蜡烛,自下而上依次熄灭。 结论:二氧化碳密度比空气大,
不支持燃烧也不能燃烧。
实验二 验证CO2是否溶于水
现象:塑料瓶变瘪了 结论:二氧化碳能溶于水
实验三 验证二氧化碳溶于水是否生成了碳酸
资料
石蕊是一种从地衣中提取的色素。 石蕊溶于水配制成的紫色石蕊溶液,遇酸变成红色。
编号
Ⅰ
Ⅱ
Ⅲ
现象 无变化
无变化 变红色,加热后变紫色
分析
水不能使紫 色石蕊变色
CO2不能使 CO2与H2O反应生成酸 紫色石蕊变 使紫色石蕊变红。碳酸
色
不稳定,易分解。
二氧化碳的用途

二氧化碳的用途二氧化碳的物理性质:无色、无臭、无味的气体。
化学式CO2,地球大气层重要组分之一。
密度1.977克/厘米3,二氧化碳能溶于水。
二氧化碳气体容易液化,液态二氧化碳可以贮存在高压钢瓶内。
当液态二氧化碳蒸发时,会吸收大量的热,使温度迅速降低,这样又会使一部分二氧化碳气体冷凝成雪花状固体,这种固体可从周围吸收热量,直接变成气体(升华),因此把它叫做干冰。
大气中二氧化碳的含量为0.03%;海洋中为0.014%。
它们来源于:①有机体腐烂过程。
②人和动物呼出二氧化碳。
③煤、石油、天然气等的燃烧。
二氧化碳的化学性质不活泼,只在高温下能与镁等金属反应(生成氧化镁和碳),也与红热的炭发生反应(生成一氧化碳);二氧化碳气体溶于水生成碳酸(使紫色石蕊变成红色),是一种二元弱酸(不稳定,遇热或强酸容易分解成二氧化碳和水)。
最常用的检验二氧化碳气体的方法是让它通入澄清的石灰水,即有白色沉淀(碳酸钙)产生: Ca(OH)2+CO2=CaCO3↓+H2O 继续通入二氧化碳,碳酸钙沉淀转变为可溶性的碳酸氢钙,溶液又变为澄清:CaCO3+CO2+H2O =Ca(HCO3)2二氧化碳本身无毒,但在空气中含量达到3%时,人体会感到呼吸急促,达到10%时,就会丧失知觉、呼吸停止而死亡。
随着工业高度发展,大气中的二氧化碳含量日益增高,它能够吸收地面放出的红外辐射,在地球周围形成绝热层,阻止热量向外层空间扩散,使平均气温上升,此即二氧化碳的温室效应。
工业上用的二氧化碳大多是石灰窑、水泥厂、酿酒厂(发酸过程)的副产物,天然气井和煤气厂也有大量二氧化碳。
主要用于制造碳酸钠,及生产充碳酸气的饮料。
用干冰冷冻水果或肉类,不但温度低,而且无污染。
二氧化碳又是有效的灭火剂,用于不能用水来扑灭的火灾,如油、电、金属钠引起的火灾。
液态二氧化碳已成为高效无污染的萃取剂,所用的工艺称为超临界萃取,多用于食品等工业。
“干冰”的故事:在美国南部的得克萨斯州,一个钻探队曾遇到了一件怪事:当他们用钻探机往地下打孔勘探油矿时,突然有一股强大的气流从管口喷出,立刻在管口形成一大堆雪花似的”冰”。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
九年级化学导学案
年级:九年级(上)编制:田中义
课型:预习探知课审核人:张凤山时间:
课题:5.3二氧化碳的性质
学习目标:1.二氧化碳的物理性质。
2. 二氧化碳的化学性质。
3. 二氧化碳的用途。
学习重点:二氧化碳与水、石灰水的反应。
学习难点:二氧化碳的检验方法及相应的化学方程式。
【自学导航】
知识点一:(第一组)二氧化碳的物理性质:
色、味、态
密度
溶解性
知识点二:二氧化碳的化学性质:
(第二组)根据[实验5—11]你能总结出什么结论?
(第三组)讨论:①二氧化碳是否有毒?②在进入深井或深洞的底部
时,应先采取怎样的措施来保证安全? (第四组)根据[实验5—12]写出观察到的实验现象,解释实验现象产
生的原因。
写出反应方程式,并判断“二氧化碳能使紫色的石蕊变成红
色’这句话是否正确。
(第五组)根据[实验5—13]写出观察到的实验现象,写出反应方程
式,
知识点三:(第六组)二氧化碳的用途:
【达标检测】
一、我来选
1.通常状况下,二氧化碳的密度与空气相比()
A.比空气大 B.比空气小 C.与空气相等 D.无法判断2.下列操作中只发生物理变化的是()
A.将二氧化碳通入水中 B.将二氧化碳通入澄清石灰水中
C.将二氧化碳倾倒入盛有燃着蜡烛的烧杯中 D.将二氧化碳加压降温压缩成干冰
3.将二氧化碳气体通入紫色石蕊试液中,石蕊试液会变成()A.红色 B.紫色 C.蓝色 D.无色
4.关于二氧化碳的用途中,既跟它的物理性质有关,也跟它的化学
性质有关的是( )
A. 人工降雨 B.植物的光合作用 C. 灭火 D.用作化工原
料
5.由于大气中CO2含量增加,产生“温室效应”,使地球变热,海平面升高,陆地面积减少。
为了减少大气中CO2的含量,下列措施可行的是( )
A. 改变能源结构,发展太阳能、核能、水能、以代替化石燃料B.用石灰水吸收空气中的CO2
C.限制汽车工业的发展,减少汽车数量 D.大量滥砍乱伐,减少绿化面积
6.国外试行用“汽水”(碳酸饮料)浇灌植物,它的作用是()A.对植物的呼吸作用有利 B.能改良酸性土壤
C.加速光合作用的进行 D.产生温室对植物起保护作用
7.有关二氧化碳的说法中错误的是()
A.二氧化碳在高压、低温下能变成“干冰” B.密度大于空气的气体一定是二氧化碳
C.二氧化碳是呼吸作用的产物,也是光合作用的原料
D.二氧化碳是一种化学性质比氧气活泼的气体
8.在右图所示装置中,有四支充满不同气体的试管,倒立在水槽中,当拔开塞子时,试管中水位上升最高的是()
A.空气 B.氧气 C.二氧化碳 D.氮气
9.下列反应中既是氧化反应,又是化合反应的是()
A.炭在氧气中燃烧生成二氧化碳 B.二氧化碳与水反应
C.加热碳酸产生二氧化碳 D.“干冰”气化成二氧化碳气体二、我来填空
10.二氧化碳在空气中只占,但它是作用中并不可少的物质之一。
通常状况下,二氧化碳是一种色味的气体,其密度比空气的密度,溶于水。
在一定条件下,二氧化碳变成固体,俗称。
11.如图所示,将集气瓶中的二氧化碳往烧杯中倾倒时,梯形白铁皮架上的两支点燃的短蜡烛由下至上先后熄灭,试根据此实验现象总结出有关二氧化碳性质的结论:
①________________________;②________________________。
