羧酸的性质和应用课件
合集下载
《羧酸的性质与应用》课件

功能性高分子
高分子材料改性
羧酸常用于高分子材料的改性,通过 与高分子链上的反应基团反应,改善 高分子材料的性能,如提高耐热性、 增强力学性能等。
通过在羧酸分子中引入特定的功能基 团,可以合成具有特殊性能的高分子 材料,如导电、发光、吸附等功能。
合成有机化合物
有机药物
许多药物分子中含有羧酸基团, 通过羧酸的酯化、成盐等反应,
香料
一些羧酸衍生物具有芳香气味,可以作为香料添 加到化妆品、洗涤剂和香水等产品中。
04
羧酸的生产方法
天然提取法
01
天然提取法是从天然资源中提取 羧酸的方法,如植物果实、动物 脂肪等。
02
优点是来源广泛,成本较低,但 提取纯度不高,且受资源限制较 大。
化学合成法
化学合成法是通过一系列化学反应将原料转化为羧酸的方法 。
研究和发展绿色合成方法,减少羧酸生产过程中的环境污染和资源 消耗。
智能化技术
利用人工智能、大数据等技术手段,实现羧酸生产过程的智能化和 精细化控制。
绿色合成方法的研究
高效催化体系
01
研究和发展高效、环保的催化体系,用于羧酸的生产和制备。
循环利用资源
02
通过循环利用资源,实现羧酸生产的可持续发展和资源的高效
THANKS FOR WATCHING
感谢您的观看
羧酸的酸性
相对强弱
羧酸的酸性受其结构的影响,一 般来说,烷基取代的羧酸酸性较 弱,而芳香取代的羧酸酸性较强
。
影响因素
诱导效应、共轭效应和空间效应等 都会影响羧酸的酸性。
比较
与无机酸相比,有机酸的酸性较弱 ,但某些有机酸(如甲酸、乙酸) 的酸性较强。
03
羧酸的性质与应用

缩聚反应:有机化合物分子间脱去小分子获得 高分子化合物的反应。
聚对苯二甲酸乙二酯(PET)的用途
5.羟基酸自身酯化反应
(1)分子间生成普通酯,如: 2
(2)分子间生成环酯,如:
2
(3)分子内生成酯,如:
2
(4)分子间生成聚酯,如:
聚乳酸(PLA)
聚乳酸(PLA)的用途
手术缝合线
接骨螺钉
+nH2O
【归纳】
1.酯类在酸性溶液中水解生成羧酸和醇
RCOOR'+H2O
RCOOH+R'OH
2.酯类在碱性溶液中水解生成羧酸盐和醇
RCOOR'+NaOH
RCOONa+R'OH
请写甲酸与乙醇、异丙醇反应的化学方程式
活学活用
1.书写下列物质分别在酸性和碱性条件下的水解 反应方程式 COOCH2 || COOCH2
O
稀硫酸
O
CH3C-OC2H5+H-OH
CH3C-OH+CC2H5+NaO-H
CH3C-ONa+C2H5OH
碱的存在使水解趋于完全
酯水解的反应方程式
稀硫酸
CH3COOC2H5 +H2O △ CH3COOH +C2H5OH
CH3COOC2H5 +NaOH △ CH3COONa + C2H5OH
3.二元羧酸与一元醇的酯化反应 HOOC—COOH+CH3CH2OH HOOC—COOH+HOCH2CHH3OOC—COOCH2CH3+H2O
HOOC—COOH+2CH3CH2OH CH3CH2OOC—COOCH2CH3+2H2O 乙二酸二乙酯
4.二元羧酸与二元醇的酯化反应 (1)生成普通酯,如: HOOCCOOH+HOCH2CH2OH
高中化学《羧酸的性质和应用》课件ppt

【知识归纳】
醇、酚、羧酸中羟基的比较
羟基
代表 结构简 氢的
物
式 活泼
酸性
与Na 反应
性
乙醇 CH3CH2OH 苯酚 C6H5OH
中性 能
增 强 比碳酸弱
能
乙酸 CH3COOH
比碳酸强 能
与 NaOH 的反应
不能
能
能
与 Na2CO3 的反应
不能 能,得到 HCO3-
能
【知识应用】
1、可以把乙醇、乙酸、乙醛溶液区别开的一种试剂
饱和碳酸钠溶液的液面 上有透明的油状液体, 并可闻到香味。乙酸乙 酯:CH3COOCH2CH3
1.怎样检查气密性?
2.为什么要加碎瓷片? 防暴沸
3.加试剂的顺序是怎样的?乙醇→浓硫酸→醋酸
4.长导管有什么作用? 导气、冷凝
5.长导管为何不能伸入溶液中? 防倒吸
6.为何用饱和的Na2CO3溶液吸收乙酸乙酯?
缩聚反应:有机化合物分子间脱去二甲酸乙二酯(PET)的用途
饮料瓶
聚酯纤维(涤纶) 胶卷片基
聚乳酸(PLA)
是一种新型的生物降解材料,其具有良好的生物可降解性, 使用后能被自然界中微生物完全降解,最终生成二氧化碳和 水,不污染环境。
快餐盒
手术缝合线
思考:合成该新型高分子物质的单体是什么?
专题4 第三单元
羧酸的性质和应用
资料卡片
食物中常见的有机酸
醋酸 (乙 酸)
CH3COOH
青梅
草酸
(乙二酸)
酒石酸
COOH ︳
CHOH ︳
CHOH ︳
COOH
柠檬酸 CH2—COOH
HO—C—COOH
CH2—COOH
羧酸的性质和应用

C5H10O2 C18H36O2
117.9 141
186 360
∞ ∞
3.3 0.043
饱和一元羧酸:沸点随分子中碳原子数目的增加逐 渐升高;水中溶解度随分子中碳原子数目的增加而 减小。
二、羧酸的性质
2、羧酸的化学性质
1)酸性
A、使紫色石蕊试液变色: 变红 B、与活泼金属反应:
2CH3COOH + Mg = (CH3COO)2Mg+H2↑ C、与碱性氧化物反应: 2CH3COOH+CuO=(CH3COO)2Cu+2H2O D、与碱反应: 2CH3COOH + Cu(OH)2 = (CH3COO)2Cu+ 2H2O E、与某些盐(如碳酸盐) CH3COOH + NaHCO3 = CH3COONa+H2O+CO2↑
①
②
③
加热煮沸
④
有砖红色沉淀
预测可 能发生 的反应 ① ②
③ ④ ⑤ ⑥
化学方程式
Mg+2HCOOH==(HCOO)2Mg+H2↑ 2HCOOH+CuO==(HCOO)2Cu+2H2O HCOOH+NaOH==HCOONa+H2O 2HCOOH+Na2CO3==2HCOONa+CO2 +H2O HCOOH+CH3OH
。
推测甲酸性质?
O H—C—OH
醛基 羧基 有酸性
银镜反应 与新制Cu(OH)2既可以 中和,加热后又会有部 分变成红色的Cu2O沉淀
能发生酯化反应
3、甲酸的化学性质
预测甲酸可能具有的化学性质
O
H—C—OH
试设计实验证明你对甲酸化学性质的预测
117.9 141
186 360
∞ ∞
3.3 0.043
饱和一元羧酸:沸点随分子中碳原子数目的增加逐 渐升高;水中溶解度随分子中碳原子数目的增加而 减小。
二、羧酸的性质
2、羧酸的化学性质
1)酸性
A、使紫色石蕊试液变色: 变红 B、与活泼金属反应:
2CH3COOH + Mg = (CH3COO)2Mg+H2↑ C、与碱性氧化物反应: 2CH3COOH+CuO=(CH3COO)2Cu+2H2O D、与碱反应: 2CH3COOH + Cu(OH)2 = (CH3COO)2Cu+ 2H2O E、与某些盐(如碳酸盐) CH3COOH + NaHCO3 = CH3COONa+H2O+CO2↑
①
②
③
加热煮沸
④
有砖红色沉淀
预测可 能发生 的反应 ① ②
③ ④ ⑤ ⑥
化学方程式
Mg+2HCOOH==(HCOO)2Mg+H2↑ 2HCOOH+CuO==(HCOO)2Cu+2H2O HCOOH+NaOH==HCOONa+H2O 2HCOOH+Na2CO3==2HCOONa+CO2 +H2O HCOOH+CH3OH
。
推测甲酸性质?
O H—C—OH
醛基 羧基 有酸性
银镜反应 与新制Cu(OH)2既可以 中和,加热后又会有部 分变成红色的Cu2O沉淀
能发生酯化反应
3、甲酸的化学性质
预测甲酸可能具有的化学性质
O
H—C—OH
试设计实验证明你对甲酸化学性质的预测
第四单元--羧酸的性质和应用PPT课件

O H—C—O—H
结构特点:既有羧基又有醛基
醛基 氧化反应(如银镜反应) 化学性质
羧基 酸性,酯化反应
常见羧酸酸性强弱顺序:
.
21
乙二酸 > 甲酸 > 乙酸 > 丙酸
【应用】
五、酯化反应与高分子材料P84
缩聚反应
❖概念: 由有机化合物分子间脱去小分子
获得高分子化合物的反应
v 写出对苯二甲酸与乙二醇发生缩聚反应的
HO-C-COOH
| CH2-COOH
【探究1】 阅读课本p82“信息提示”内容,说明上 述物质为什么都可以划分为有机酸?
都含有 -COOH 这样的官能团
【小结】 羧酸:
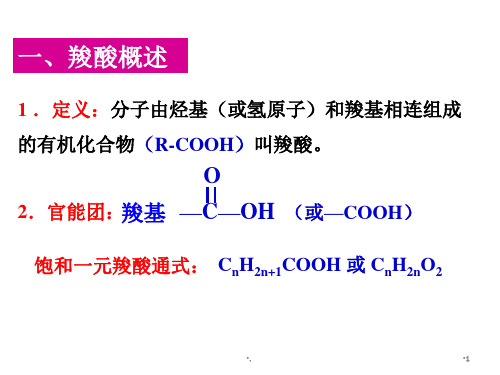
一、羧酸的概念:分子中烃基(或氢 原子)跟羧基相连的化合物。
举例:
二、饱和一元羧酸的通式:
CnH2n+1COOH
p 三、羧酸的分类:(阅读 83最后一段内容) CH3COOH CH2=CHCOOH
,
该物质与甲醇反应,生成的有机物结构简式
为
,这一产物又可以发生加聚
反应,反应方程式为
。
(5)写出缩聚反应的方程式___________________
专题4 烃的衍生物 第三单元 醛 羧酸
羧酸的性质和应用
食物中存在的酸 COOH
|
你有知机道酸我 吗们 ?CH熟3C悉O的OH一些水C果H3与CH食O品HC中O分OH酒别石含酸有哪CC| HH些--OOHH
醋酸
乳酸
| COOH
COOH
|
CH-OH 苹果 酸 |
CH2 |
COOH
CH2-COOH
柠檬酸 |
18
(2)酯化反应
浓硫酸
化学课件《羧酸的性质与应用》优秀ppt 人教课标版

――[阿萨·赫尔帕斯爵士] 115.旅行的精神在于其自由,完全能够随心所欲地去思考.去感觉.去行动的自由。――[威廉·海兹利特]
116.昨天是张退票的支票,明天是张信用卡,只有今天才是现金;要善加利用。――[凯·里昂] 117.所有的财富都是建立在健康之上。浪费金钱是愚蠢的事,浪费健康则是二级的谋杀罪。――[B·C·福比斯] 118.明知不可而为之的干劲可能会加速走向油尽灯枯的境地,努力挑战自己的极限固然是令人激奋的经验,但适度的休息绝不可少,否则迟早会崩溃。――[迈可·汉默] 119.进步不是一条笔直的过程,而是螺旋形的路径,时而前进,时而折回,停滞后又前进,有失有得,有付出也有收获。――[奥古斯汀] 120.无论那个时代,能量之所以能够带来奇迹,主要源于一股活力,而活力的核心元素乃是意志。无论何处,活力皆是所谓“人格力量”的原动力,也是让一切伟大行动得以持续的力量。――[史迈尔斯] 121.有两种人是没有什么价值可言的:一种人无法做被吩咐去做的事,另一种人只能做被吩咐去做的事。――[C·H·K·寇蒂斯] 122.对于不会利用机会的人而言,机会就像波浪般奔向茫茫的大海,或是成为不会孵化的蛋。――[乔治桑] 123.未来不是固定在那里等你趋近的,而是要靠你创造。未来的路不会静待被发现,而是需要开拓,开路的过程,便同时改变了你和未来。――[约翰·夏尔] 124.一个人的年纪就像他的鞋子的大小那样不重要。如果他对生活的兴趣不受到伤害,如果他很慈悲,如果时间使他成熟而没有了偏见。――[道格拉斯·米尔多] 125.大凡宇宙万物,都存在着正、反两面,所以要养成由后面.里面,甚至是由相反的一面,来观看事物的态度――。[老子]
97.有三个人是我的朋友爱我的人.恨我的人.以及对我冷漠的人。 爱我的人教我温柔;恨我的人教我谨慎;对我冷漠的人教我自立。――[J·E·丁格] 98.过去的事已经一去不复返。聪明的人是考虑现在和未来,根本无暇去想过去的事。――[英国哲学家培根] 99.真正的发现之旅不只是为了寻找全新的景色,也为了拥有全新的眼光。――[马塞尔·普劳斯特] 100.这个世界总是充满美好的事物,然而能看到这些美好事物的人,事实上是少之又少。――[罗丹] 101.称赞不但对人的感情,而且对人的理智也发生巨大的作用,在这种令人愉快的影响之下,我觉得更加聪明了,各种想法,以异常的速度接连涌入我的脑际。――[托尔斯泰] 102.人生过程的景观一直在变化,向前跨进,就看到与初始不同的景观,再上前去,又是另一番新的气候――。[叔本华] 103.为何我们如此汲汲于名利,如果一个人和他的同伴保持不一样的速度,或许他耳中听到的是不同的旋律,让他随他所听到的旋律走,无论快慢或远近。――[梭罗] 104.我们最容易不吝惜的是时间,而我们应该最担心的也是时间;因为没有时间的话,我们在世界上什么也不能做。――[威廉·彭] 105.人类的悲剧,就是想延长自己的寿命。我们往往只憧憬地平线那端的神奇【违禁词,被屏蔽】,而忘了去欣赏今天窗外正在盛开的玫瑰花。――[戴尔·卡内基] 106.休息并非无所事事,夏日炎炎时躺在树底下的草地,听着潺潺的水声,看着飘过的白云,亦非浪费时间。――[约翰·罗伯克] 107.没有人会只因年龄而衰老,我们是因放弃我们的理想而衰老。年龄会使皮肤老化,而放弃热情却会使灵魂老化。――[撒母耳·厄尔曼] 108.快乐和智能的区别在于:自认最快乐的人实际上就是最快乐的,但自认为最明智的人一般而言却是最愚蠢的。――[卡雷贝·C·科尔顿] 109.每个人皆有连自己都不清楚的潜在能力。无论是谁,在千钧一发之际,往往能轻易解决从前认为极不可能解决的事。――[戴尔·卡内基] 110.每天安静地坐十五分钟·倾听你的气息,感觉它,感觉你自己,并且试着什么都不想。――[艾瑞克·佛洛姆] 111.你知道何谓沮丧---就是你用一辈子工夫,在公司或任何领域里往上攀爬,却在抵达最高处的同时,发现自己爬错了墙头。--[坎伯] 112.「伟大」这个名词未必非出现在规模很大的事情不可;生活中微小之处,照样可以伟大。――[布鲁克斯] 113.人生的目的有二:先是获得你想要的;然后是享受你所获得的。只有最明智的人类做到第二点。――[罗根·皮沙尔·史密斯] 114.要经常听.时常想.时时学习,才是真正的生活方式。对任何事既不抱希望,也不肯学习的人,没有生存的资格。
116.昨天是张退票的支票,明天是张信用卡,只有今天才是现金;要善加利用。――[凯·里昂] 117.所有的财富都是建立在健康之上。浪费金钱是愚蠢的事,浪费健康则是二级的谋杀罪。――[B·C·福比斯] 118.明知不可而为之的干劲可能会加速走向油尽灯枯的境地,努力挑战自己的极限固然是令人激奋的经验,但适度的休息绝不可少,否则迟早会崩溃。――[迈可·汉默] 119.进步不是一条笔直的过程,而是螺旋形的路径,时而前进,时而折回,停滞后又前进,有失有得,有付出也有收获。――[奥古斯汀] 120.无论那个时代,能量之所以能够带来奇迹,主要源于一股活力,而活力的核心元素乃是意志。无论何处,活力皆是所谓“人格力量”的原动力,也是让一切伟大行动得以持续的力量。――[史迈尔斯] 121.有两种人是没有什么价值可言的:一种人无法做被吩咐去做的事,另一种人只能做被吩咐去做的事。――[C·H·K·寇蒂斯] 122.对于不会利用机会的人而言,机会就像波浪般奔向茫茫的大海,或是成为不会孵化的蛋。――[乔治桑] 123.未来不是固定在那里等你趋近的,而是要靠你创造。未来的路不会静待被发现,而是需要开拓,开路的过程,便同时改变了你和未来。――[约翰·夏尔] 124.一个人的年纪就像他的鞋子的大小那样不重要。如果他对生活的兴趣不受到伤害,如果他很慈悲,如果时间使他成熟而没有了偏见。――[道格拉斯·米尔多] 125.大凡宇宙万物,都存在着正、反两面,所以要养成由后面.里面,甚至是由相反的一面,来观看事物的态度――。[老子]
97.有三个人是我的朋友爱我的人.恨我的人.以及对我冷漠的人。 爱我的人教我温柔;恨我的人教我谨慎;对我冷漠的人教我自立。――[J·E·丁格] 98.过去的事已经一去不复返。聪明的人是考虑现在和未来,根本无暇去想过去的事。――[英国哲学家培根] 99.真正的发现之旅不只是为了寻找全新的景色,也为了拥有全新的眼光。――[马塞尔·普劳斯特] 100.这个世界总是充满美好的事物,然而能看到这些美好事物的人,事实上是少之又少。――[罗丹] 101.称赞不但对人的感情,而且对人的理智也发生巨大的作用,在这种令人愉快的影响之下,我觉得更加聪明了,各种想法,以异常的速度接连涌入我的脑际。――[托尔斯泰] 102.人生过程的景观一直在变化,向前跨进,就看到与初始不同的景观,再上前去,又是另一番新的气候――。[叔本华] 103.为何我们如此汲汲于名利,如果一个人和他的同伴保持不一样的速度,或许他耳中听到的是不同的旋律,让他随他所听到的旋律走,无论快慢或远近。――[梭罗] 104.我们最容易不吝惜的是时间,而我们应该最担心的也是时间;因为没有时间的话,我们在世界上什么也不能做。――[威廉·彭] 105.人类的悲剧,就是想延长自己的寿命。我们往往只憧憬地平线那端的神奇【违禁词,被屏蔽】,而忘了去欣赏今天窗外正在盛开的玫瑰花。――[戴尔·卡内基] 106.休息并非无所事事,夏日炎炎时躺在树底下的草地,听着潺潺的水声,看着飘过的白云,亦非浪费时间。――[约翰·罗伯克] 107.没有人会只因年龄而衰老,我们是因放弃我们的理想而衰老。年龄会使皮肤老化,而放弃热情却会使灵魂老化。――[撒母耳·厄尔曼] 108.快乐和智能的区别在于:自认最快乐的人实际上就是最快乐的,但自认为最明智的人一般而言却是最愚蠢的。――[卡雷贝·C·科尔顿] 109.每个人皆有连自己都不清楚的潜在能力。无论是谁,在千钧一发之际,往往能轻易解决从前认为极不可能解决的事。――[戴尔·卡内基] 110.每天安静地坐十五分钟·倾听你的气息,感觉它,感觉你自己,并且试着什么都不想。――[艾瑞克·佛洛姆] 111.你知道何谓沮丧---就是你用一辈子工夫,在公司或任何领域里往上攀爬,却在抵达最高处的同时,发现自己爬错了墙头。--[坎伯] 112.「伟大」这个名词未必非出现在规模很大的事情不可;生活中微小之处,照样可以伟大。――[布鲁克斯] 113.人生的目的有二:先是获得你想要的;然后是享受你所获得的。只有最明智的人类做到第二点。――[罗根·皮沙尔·史密斯] 114.要经常听.时常想.时时学习,才是真正的生活方式。对任何事既不抱希望,也不肯学习的人,没有生存的资格。
大学有机化学课件- 羧酸

H
O C=O
O
H
=
=
CH2
[ CH3 C ] = CH2
O CH3—C—CH3
=
27
3、通过自由基进行脱羧(p12)
羧酸钾或钠盐溶液的电解、其他羧酸金属盐的热 分解则是通过自由基历程进行脱羧。 ⑴、柯尔贝(kolbe)电解
2 RCOONa H2O R R CO2 H2 NaOH
O
阳极: 2R C O
通过空间传递的电子效应叫场效应。
H CO2H Cl COOH
δ
δ δ
H O C
Cl
O
pka
6.04
6.25
11
3、对芳羧酸酸性的影响
取代基具有+C、-I效应时:
( HO NH2
酸性: 邻
CH3O
间
X )
>
>
对
取代基具有-C、-I效应时:
(NO2.
酸性:
CN CHO COR )
邻
>
对
>
间
12
分析: 邻位: 诱导效应、共轭效应、 间位:以诱导效应为主,共轭效应很小 对位:以共轭效应为主,诱导效应较小
13
第四节:羧酸的化学性质
还原反应
O
脱羧反应
R C C O H H
酸性
羧羟基被取代(加成.消除) 转化成羧羟衍生物的反应. α-H被取 代的反应
14
一、与碱反应——羧酸的酸性
2e
阳极 O
阴极
2R
C
O.
2R.
O 2 C=O R R
=
阴极: 2 Na
=
+
=
羧酸课件PPT人教版

醇类物质反应得到的。
羧酸在医药领域的应用
药物合成
许多药物分子中含有羧酸的结构 ,这些药物可以通过羧酸的酯化
或成盐反应得到。
抗菌剂
一些羧酸衍生物可以用作抗菌剂 ,例如苯甲酸和山梨酸。
解热镇痛药
一些羧酸衍生物可以用作解热镇 痛药,例如阿司匹林和水杨酸。
羧酸在食品领域的应用
食品防腐剂
一些羧酸衍生物可以用作食品防 腐剂,例如苯甲酸和山梨酸。
羧酸的取代反应
羧酸的亲核取代
亲核试剂如氨、醇等进攻羧酸中 的羧基碳,取代羧基中的氢原子
。
羧酸的亲电取代
亲电试剂如卤素、硫酸等进攻羧酸 中的羧基碳,取代羧基中的氢原子 。
取代反应的机理
取代反应涉及电子的转移和键的断 裂与形成,最终实现取代反应。
03
羧酸的应用
羧酸在化工领域的应用
01
02
03
04
合成塑料
羧酸在生物体内的合成与分解
某些羧酸如柠檬酸、草酸等在 生物体内可以由简单的化合物 合成而来。
羧酸在酶的作用下进行分解, 释放出能量或转化为其他化合 物,以满足生物体的需求。
不同生物对羧酸的合成与分解 途径存在差异,这是生物多样 性的一个表现。
羧酸对生物体的影响
某些羧酸在生物体内具有调节代 谢、维持酸碱平衡等作用。
食品香料
一些羧酸衍生物可以用作食品香 料,例如柠檬酸和苹果酸。
04
羧酸的生物活性
羧酸与生物代谢
羧酸是生物体内重要的有机化合物之一,参与多种生物代谢反应。
在糖类、脂肪和蛋白质的分解和合成过程中,羧酸起到关键的中间代谢物的作用。
不同种类的羧酸在生物体内的代谢途径和功能各异,共同维持生物体的正常生理功 能。
羧酸在医药领域的应用
药物合成
许多药物分子中含有羧酸的结构 ,这些药物可以通过羧酸的酯化
或成盐反应得到。
抗菌剂
一些羧酸衍生物可以用作抗菌剂 ,例如苯甲酸和山梨酸。
解热镇痛药
一些羧酸衍生物可以用作解热镇 痛药,例如阿司匹林和水杨酸。
羧酸在食品领域的应用
食品防腐剂
一些羧酸衍生物可以用作食品防 腐剂,例如苯甲酸和山梨酸。
羧酸的取代反应
羧酸的亲核取代
亲核试剂如氨、醇等进攻羧酸中 的羧基碳,取代羧基中的氢原子
。
羧酸的亲电取代
亲电试剂如卤素、硫酸等进攻羧酸 中的羧基碳,取代羧基中的氢原子 。
取代反应的机理
取代反应涉及电子的转移和键的断 裂与形成,最终实现取代反应。
03
羧酸的应用
羧酸在化工领域的应用
01
02
03
04
合成塑料
羧酸在生物体内的合成与分解
某些羧酸如柠檬酸、草酸等在 生物体内可以由简单的化合物 合成而来。
羧酸在酶的作用下进行分解, 释放出能量或转化为其他化合 物,以满足生物体的需求。
不同生物对羧酸的合成与分解 途径存在差异,这是生物多样 性的一个表现。
羧酸对生物体的影响
某些羧酸在生物体内具有调节代 谢、维持酸碱平衡等作用。
食品香料
一些羧酸衍生物可以用作食品香 料,例如柠檬酸和苹果酸。
04
羧酸的生物活性
羧酸与生物代谢
羧酸是生物体内重要的有机化合物之一,参与多种生物代谢反应。
在糖类、脂肪和蛋白质的分解和合成过程中,羧酸起到关键的中间代谢物的作用。
不同种类的羧酸在生物体内的代谢途径和功能各异,共同维持生物体的正常生理功 能。
羧酸的性质和应用(共20张PPT)

苹果酸
酒石酸
柠檬酸
酒石酸
H HO C COOH HO C COOH
H
乳酸
H HO C COOH
HCH H
共同基团:羧基
官能团
醋酸
CH3COOH
从结构上看,由烃基(或氢原子)和羧基相连组成的有机物。
R-
-COOH
特点:具有相同的官能团,性质相似
从结构上看,由烃基(或氢原子)和羧基相连组成的有机物。
1、物理性质
俗称
颜色 气味 状态 熔沸点 挥发性 溶解性
醋酸(纯净的乙 酸称为冰醋酸)
无 色 刺激性
_液___
_低___
_易___
易溶于水和 _有__机__溶__剂__
2、分子结构
分子式 (化学式)
结构式
C2H4O2
结构简式
官能团 (特征基团)
CH3COOH ___________
结构简式
—COOH _________ 名称_羧__基__
。
②羧酸与醇发生酯化反应时,酸脱羟基,醇脱氢;酯化反应一般是可逆反应。
③乙酸与乙醇反应时,增大乙酸乙酯产率的方法:移去产物乙酸乙酯或增大乙醇的浓 度。
甲酸
又叫蚁酸,可看作分子中含有羧基和醛基两种官能团,所以甲酸不仅有羧 酸的通性,还兼有醛的性质。
(1)甲酸是弱Biblioteka ,但比乙酸酸性强。(2)甲酸可以与醇发生酯化反应。
(3)甲酸可以发生银镜反应,并在一定条件下能使氢氧化铜悬浊液还原为砖红 色的氧化亚铜沉淀。而甲酸中的醛基被氧化为羧基。
3、分枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述 正确的是
(分枝酸)
A.分子中含有2种官能团 B.可与乙醇、乙酸反应,且反应类型相同
酒石酸
柠檬酸
酒石酸
H HO C COOH HO C COOH
H
乳酸
H HO C COOH
HCH H
共同基团:羧基
官能团
醋酸
CH3COOH
从结构上看,由烃基(或氢原子)和羧基相连组成的有机物。
R-
-COOH
特点:具有相同的官能团,性质相似
从结构上看,由烃基(或氢原子)和羧基相连组成的有机物。
1、物理性质
俗称
颜色 气味 状态 熔沸点 挥发性 溶解性
醋酸(纯净的乙 酸称为冰醋酸)
无 色 刺激性
_液___
_低___
_易___
易溶于水和 _有__机__溶__剂__
2、分子结构
分子式 (化学式)
结构式
C2H4O2
结构简式
官能团 (特征基团)
CH3COOH ___________
结构简式
—COOH _________ 名称_羧__基__
。
②羧酸与醇发生酯化反应时,酸脱羟基,醇脱氢;酯化反应一般是可逆反应。
③乙酸与乙醇反应时,增大乙酸乙酯产率的方法:移去产物乙酸乙酯或增大乙醇的浓 度。
甲酸
又叫蚁酸,可看作分子中含有羧基和醛基两种官能团,所以甲酸不仅有羧 酸的通性,还兼有醛的性质。
(1)甲酸是弱Biblioteka ,但比乙酸酸性强。(2)甲酸可以与醇发生酯化反应。
(3)甲酸可以发生银镜反应,并在一定条件下能使氢氧化铜悬浊液还原为砖红 色的氧化亚铜沉淀。而甲酸中的醛基被氧化为羧基。
3、分枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述 正确的是
(分枝酸)
A.分子中含有2种官能团 B.可与乙醇、乙酸反应,且反应类型相同
羧酸.PPT
•10
三、几种常见的羧酸
名称
结构简 式 俗名
甲酸 HCOOH 蚁酸
色态
无色液体
溶解性
与水、乙醇、乙 醚、甘油等互溶
苯甲酸
安息香酸 白色针状晶体 微溶于水,易溶 于乙醇和乙醚
乙二酸
HOOC— COOH
草酸
无色透明晶 体
能溶于水 和乙醇
•.
•11
1 .甲酸(HCOOH) ——俗称蚁酸
根据其结构可推断出甲酸具有些什么性质?
可能存在H——易取代
•.
•5
1 .酸性
受羰基影响,羟基上 的氢变得活泼
R—COOH
R—COO- + H+
使紫色的石蕊溶液变红
Байду номын сангаас
具 有
与活泼金属(如Na、Mg等)反应放出氢气
酸 的
与金属氧化物(如Na2O、CaO等)
通 与碱(如NaOH、KOH等)发生中和反应
性 与部分盐(如碳酸盐等)反应
例如:
2RCOOH
A.新制生石灰
B.银氨溶液
C.浓溴水
D.新制Cu(OH)2
解析:可用新制Cu(OH)2来鉴别四种溶液。其实验现象 是:向四种溶液中加入新制Cu(OH)2,仅乙酸、甲酸 使Cu(OH)2溶解而溶液不浑浊,再将两组溶液分别加 热时,乙醛、甲酸能产生砖红色沉淀,从而将它们
区别开来。
答案:D
•.
•15
+ Na2CO3
→ 2RCOONa •.
+
CO2↑ + H2O•6
不同衍生物中的羟基的活泼性
羟基中氢 物质 结构简式 原子的活
泼性
酸性
与金属 与NaOH 钠反应 反应
专题4 第3单元 第2课时 羧酸的性质和应用

下一页
重要有机物之间的相互转化
[合作·探究] [探究问题] 1.以乙烯为有机原料,无机原料自选,合成乙酸乙酯的方案,请写出转化 关系。 【提示】
上一页
返回首页
下一页
2.特殊的酯化反应 (1)二元羧酸与二元醇之间的酯化反应 此时反应有三种情况:
上一页
返回首页
下一页
上一页
返回首页
下一页
上一页
返回首页
____________________________________
_____________________,此反应中浓 H2SO4 的作用是__催__化__剂__和__吸__水__剂__。 此反应为可逆反应。
上一页
返回首页
下一页
教材整理 2 羧酸的分类和甲酸的性质 1.概念:由烃基(或氢原子)和__羧__基__相连的化合物。 2.一元羧酸的通式:R—COOH,官能团—__C__O_O__H__。 3.分类 (1)按与羧基连接的烃基的结构分类
________________________________________此反应的原理是_酯__化__反应。
上一页
返回首页
下一页
[题组·冲关] 题组 1 羧酸的结构与性质 1.下列化合物中,既显酸性又能发生酯化反应和消去反应的是( )
上一页
返回首页
下一页
【答案】 (1)①②④⑤⑥
上一页
返回首页
①酸性比乙酸强。 ②甲酸与乙醇反应的化学方程式为_H_C__O_O__H_+__C_2_H_5_O__H_浓__H_△2_S_O__4H__C_O__O_C_2_H_5_ _+__H_2_O___。
上一页
返回首页
下一页
③甲酸与银氨溶液反应的化学方程式为
有机化学羧酸ppt课件

羧酸基功能材料的开发与 应用
介绍基于羧酸基团的功能材料,如高分子材料、 液晶材料等,探讨其在材料科学领域的应用前 景。
THANKS FOR WATCHING
感谢您的观看
03 羧酸衍生物及其性质研究
酰卤、酯、酰胺等衍生物介绍
酰卤
酰卤是一类由羧酸与卤素反应形 成的衍生物,具有较强的反应活 性。常见的酰卤有酰氯、酰溴等。
酯
酯是由羧酸与醇反应形成的一类 衍生物,具有广泛的生物活性和 化学应用。酯类化合物在自然界
中广泛存在,如油脂、蜡等。
酰胺
酰胺是由羧酸与胺反应形成的一 类衍生物,具有良好的稳定性和 广泛的应用。酰胺类化合物在生 物医药、农药等领域有重要应用。
讨论三
总结本次实验的收获和不足,提出改进意见和建议
06 课程总结与拓展延伸
课程重点回顾
羧酸的结构与性质
羧酸分子中的羰基和羟基的结构特点, 以及它们对羧酸物理和化学性质的影 响。
羧酸的命名与分类
系统命名法、普通命名法以及根据羧 酸分子中碳原子数目的分类方法。
羧酸的合成与转化
通过酯化反应、酰卤的制备、酰胺的 制备等合成羧酸的方法,以及羧酸之 间的转化关系。
实验步骤和操作注意事项
步骤四
清洗实验器具,整理实 验报告
注意事项一
严格遵守实验室安全规 定,佩戴实验服和护目 镜
注意事项二
按照实验步骤进行操作, 不要随意更改实验条件
实验步骤和操作注意事项
注意事项三
注意实验过程中的温度变化,避免发生危险
注意事项四
实验结束后要及时清洗实验器具,保持实验室整洁
实验结果分析和讨论
分类
根据烃基R的不同,羧酸可分为脂 肪酸、芳香酸等。
介绍基于羧酸基团的功能材料,如高分子材料、 液晶材料等,探讨其在材料科学领域的应用前 景。
THANKS FOR WATCHING
感谢您的观看
03 羧酸衍生物及其性质研究
酰卤、酯、酰胺等衍生物介绍
酰卤
酰卤是一类由羧酸与卤素反应形 成的衍生物,具有较强的反应活 性。常见的酰卤有酰氯、酰溴等。
酯
酯是由羧酸与醇反应形成的一类 衍生物,具有广泛的生物活性和 化学应用。酯类化合物在自然界
中广泛存在,如油脂、蜡等。
酰胺
酰胺是由羧酸与胺反应形成的一 类衍生物,具有良好的稳定性和 广泛的应用。酰胺类化合物在生 物医药、农药等领域有重要应用。
讨论三
总结本次实验的收获和不足,提出改进意见和建议
06 课程总结与拓展延伸
课程重点回顾
羧酸的结构与性质
羧酸分子中的羰基和羟基的结构特点, 以及它们对羧酸物理和化学性质的影 响。
羧酸的命名与分类
系统命名法、普通命名法以及根据羧 酸分子中碳原子数目的分类方法。
羧酸的合成与转化
通过酯化反应、酰卤的制备、酰胺的 制备等合成羧酸的方法,以及羧酸之 间的转化关系。
实验步骤和操作注意事项
步骤四
清洗实验器具,整理实 验报告
注意事项一
严格遵守实验室安全规 定,佩戴实验服和护目 镜
注意事项二
按照实验步骤进行操作, 不要随意更改实验条件
实验步骤和操作注意事项
注意事项三
注意实验过程中的温度变化,避免发生危险
注意事项四
实验结束后要及时清洗实验器具,保持实验室整洁
实验结果分析和讨论
分类
根据烃基R的不同,羧酸可分为脂 肪酸、芳香酸等。
《羧酸及碳酸衍生物》课件

介绍羧酸的合成方法,包括从对应化合物进行氧化、羧酸加成等方式。
2 碳酸的制备方法
探索碳酸的制备方法,如酸碱反应和氧化法,并比较它们的优缺点。
结构与命名规则
1 羧酸和碳酸衍生物的命名规则
了解羧酸和碳酸衍生物的结构命名规则,包括系统命名法和传统命名法。
《羧酸及碳酸衍生物》 PPT课件
欢迎来到本课件《羧酸及碳酸衍生物》!在这个课件中,我们将一起探索羧 酸和碳酸的相关概念、性质与应用。让我们开始这段有趣的学习之旅吧!
羧酸的定义和结构
1 羧酸定义
了解羧酸的定义和特点,以及羧基在羧酸结构中的重要性。
2 羧酸结构
探索羧酸分子的结构,包括羧基的原子组成和它们在分子中的排列方式。
3 羧酸与酸碱反应
探索羧酸与碱反应的机制和条件,并了解这些反应在化学工业中的重要性。
碳酸及其衍生物的应用
1 碳酸的应用领域
2 碳酸衍生物的应用案例
探索碳酸在化学、医药和环境等领域的广 泛应用,并了解其重要性。
通过实例了解碳酸衍生物在日常生活中的 应用及其对社合成方法
碳酸的定义和结构
1 碳酸定义
了解碳酸的定义和特点,以及碳酸分子中碳酸基团的结构和组成。
2 碳酸结构
探索碳酸分子的结构,包括碳酸基团的原子组成和它们在分子中的排列方式。
羧酸的性质与反应
1 羧酸的物理性质
了解羧酸的物理性质,如熔点、沸点和溶解度,并探索它们与物质性质的关系。
2 羧酸的化学性质
研究羧酸的化学性质,包括酯化、酰化等常见反应,并了解它们在有机合成中的应用。
2 碳酸的制备方法
探索碳酸的制备方法,如酸碱反应和氧化法,并比较它们的优缺点。
结构与命名规则
1 羧酸和碳酸衍生物的命名规则
了解羧酸和碳酸衍生物的结构命名规则,包括系统命名法和传统命名法。
《羧酸及碳酸衍生物》 PPT课件
欢迎来到本课件《羧酸及碳酸衍生物》!在这个课件中,我们将一起探索羧 酸和碳酸的相关概念、性质与应用。让我们开始这段有趣的学习之旅吧!
羧酸的定义和结构
1 羧酸定义
了解羧酸的定义和特点,以及羧基在羧酸结构中的重要性。
2 羧酸结构
探索羧酸分子的结构,包括羧基的原子组成和它们在分子中的排列方式。
3 羧酸与酸碱反应
探索羧酸与碱反应的机制和条件,并了解这些反应在化学工业中的重要性。
碳酸及其衍生物的应用
1 碳酸的应用领域
2 碳酸衍生物的应用案例
探索碳酸在化学、医药和环境等领域的广 泛应用,并了解其重要性。
通过实例了解碳酸衍生物在日常生活中的 应用及其对社合成方法
碳酸的定义和结构
1 碳酸定义
了解碳酸的定义和特点,以及碳酸分子中碳酸基团的结构和组成。
2 碳酸结构
探索碳酸分子的结构,包括碳酸基团的原子组成和它们在分子中的排列方式。
羧酸的性质与反应
1 羧酸的物理性质
了解羧酸的物理性质,如熔点、沸点和溶解度,并探索它们与物质性质的关系。
2 羧酸的化学性质
研究羧酸的化学性质,包括酯化、酰化等常见反应,并了解它们在有机合成中的应用。
羧酸的性质与应用

迁移·应用
已知水垢的主要成分为碳酸钙,氢氧化镁,人们常 用食醋来清洗水垢,请用化学原理解释,并写出相 关方程式。
食醋除水垢原理
CaCO3 + 2CH3COOH = (CH3COO)2Ca + CO2↑+ H2O
Mg(OH)2+2CH3COOH =(CH3COO)2Mg + 2H2O
注意:醋酸盐大多易溶于水。
实验结论:在浓硫酸、加热的条件下,乙酸与乙 醇反应,生成无色、透明、不溶于水、 比水轻、有香味的油状液体。
(1)实验注意点:
①各试剂加入顺序: 先加乙醇再加浓H2SO4最后加乙酸
②浓H2SO4作用:催化剂、吸水剂
③长导管的作用: 导气、冷凝 注意: 不能伸到液面下(防倒吸)
④加热目的: 加快反应速率,使生成的乙酸乙酯挥发而收集, 增大乙酸乙酯的产率。
①
②
③
加热煮沸
④
有砖红色沉淀
小结:
O CH3—C—O—H
酸性
酯化反应
结构简式: CH3COOH
ห้องสมุดไป่ตู้
官能团: —C—OH (或—COOH)
羰基 O
羟基
羧基
结构分析 ②①
③
羧基
单受键C=CO-O的键影、更响易:断O开-H
1、断裂氢氧键(酸性) 2、断裂碳氧单键(酯化反 应)
3、断裂碳氧双键
受-OH的影响,碳氧双键不易断,不能发生加成反应
三、羧酸的性质
1、酸性(实验探究)
资料卡片
自然界中的有机酸
安息香酸
草酸
(苯甲酸) (乙二酸)
COOH
COOH COOH
蚁酸(甲酸)
HCOOH
CH2—COOH
高中化学选修5课件(苏教版)_4-3-2_羧酸的性质和应用

第2课时 羧酸的性质和应用
自主探究
精要解读
实验探究
活页规范训练
1.写出乙醛催化氧化的化学方程式。 提示 催化剂 2CH3CHO+O2 ― ― → 2CH3COOH △
2.写出乙酸发生下列反应的化学方程式 (1)乙酸与 CaCO3 反应 2CH3COOH+CaCO3→Ca(CH3COO)2+CO2↑+H2O。 (2)乙酸与乙醇在浓 H2SO4 作用下,加热
活页规范训练
(2)性质 ①酸的通性 乙酸是一种 弱 酸,酸性比碳酸 强 。电离方程式为: CH3COOH CH3COO-+H+。
自主探究
精要解读
实验探究
活页规范训练
②酯化反应
如乙酸与乙醇的反应:
自主探究
精要解读
实验探究
活页规范训练
2.甲酸 (1)组成和结构
分子式 CH2O2
结构简式 HCOOH
自主探究
精要解读
实验探究
活页规范训练
1.了解羧酸的结构特点及通性。 2.能从官能团的角度理解乙酸的性质,并能类比学习羧酸的 化学性质。 3.认识酯化反应的特点,认识酯的结构,会写酯的同分异构 体。 4.了解羧酸与醇之间发生的缩聚反应。
自主探究
精要解读
实验探究
活页规范训练
笃学一
羧酸的概念和分类
1.概念:由烃基(或氢原子)和 羧基 相连的化合物。 2.一元羧酸的通式: R—COOH ,官能团 —COOH 。
自主探究
精要解读
实验探究
活页规范训练
(1)利用羟基的活动性不同,可判断分子结构中羟基的类型。(2) 水分子中也有—OH,可看作—OH 上连有氢原子;醇分子可以 看作—OH 连在链烃基上,链烃基使—OH 中的 H 原子活性变
自主探究
精要解读
实验探究
活页规范训练
1.写出乙醛催化氧化的化学方程式。 提示 催化剂 2CH3CHO+O2 ― ― → 2CH3COOH △
2.写出乙酸发生下列反应的化学方程式 (1)乙酸与 CaCO3 反应 2CH3COOH+CaCO3→Ca(CH3COO)2+CO2↑+H2O。 (2)乙酸与乙醇在浓 H2SO4 作用下,加热
活页规范训练
(2)性质 ①酸的通性 乙酸是一种 弱 酸,酸性比碳酸 强 。电离方程式为: CH3COOH CH3COO-+H+。
自主探究
精要解读
实验探究
活页规范训练
②酯化反应
如乙酸与乙醇的反应:
自主探究
精要解读
实验探究
活页规范训练
2.甲酸 (1)组成和结构
分子式 CH2O2
结构简式 HCOOH
自主探究
精要解读
实验探究
活页规范训练
1.了解羧酸的结构特点及通性。 2.能从官能团的角度理解乙酸的性质,并能类比学习羧酸的 化学性质。 3.认识酯化反应的特点,认识酯的结构,会写酯的同分异构 体。 4.了解羧酸与醇之间发生的缩聚反应。
自主探究
精要解读
实验探究
活页规范训练
笃学一
羧酸的概念和分类
1.概念:由烃基(或氢原子)和 羧基 相连的化合物。 2.一元羧酸的通式: R—COOH ,官能团 —COOH 。
自主探究
精要解读
实验探究
活页规范训练
(1)利用羟基的活动性不同,可判断分子结构中羟基的类型。(2) 水分子中也有—OH,可看作—OH 上连有氢原子;醇分子可以 看作—OH 连在链烃基上,链烃基使—OH 中的 H 原子活性变
第十三章羧酸

§13.4.2 生成酰胺和腈
在羧酸中通入NH3或加入(NH4)2CO3生成羧酸 的铵盐,再加热失水得到酰胺。酰胺与脱水剂一起 加热,可以得到腈。
O R-C-O-NH4+
室温
O RC-OH + NH3
-H2O
O RC-NH2
P2O5
RCN + H2O
反应是可逆的,加热、脱水有利于正反应,为了使 正反应顺利进行,常采用苯、甲苯带水的方式除去反应 体系中产生的水。
O CH3(CH2)6COH + PCl5
O CH3(CH2)6CCl + POCl3 + HCl
§13.4 酰化反应
§13.4.4 生成(酸)酐
羧酸与强脱水剂一起加热生成酸酐。
O R C OH P2O5 R C OH
O
O RC R C O + H2O
O
产率很低
例如:
OO CH2COOH CH3COCCH3
§13.4.3
生成酰氯
羧酸的羟基被卤素取代生成物叫酰卤。
所用的试剂为: PX3 、PX5 、SOCl2 (亚硫酰氯)等。
适用于低沸 点酰卤制备
适用于高 沸点酰卤 制备
低、高沸点 的酰氯制备 都适合
O R C OH PBr3
O
R C Br
酰溴
H3PO3
亚磷酸 (200℃分解)
O R C OH PCl5
(1)加热
(2)碱性条件
(3)加热和碱性条件共存
A-CH2-COOH 加热 碱 ACH3 + CO2
当A为吸电子基团,如:A=COOH, CN, C=O, NO2, CX3, C6H5等时。失羧反应极易进行。
在羧酸中通入NH3或加入(NH4)2CO3生成羧酸 的铵盐,再加热失水得到酰胺。酰胺与脱水剂一起 加热,可以得到腈。
O R-C-O-NH4+
室温
O RC-OH + NH3
-H2O
O RC-NH2
P2O5
RCN + H2O
反应是可逆的,加热、脱水有利于正反应,为了使 正反应顺利进行,常采用苯、甲苯带水的方式除去反应 体系中产生的水。
O CH3(CH2)6COH + PCl5
O CH3(CH2)6CCl + POCl3 + HCl
§13.4 酰化反应
§13.4.4 生成(酸)酐
羧酸与强脱水剂一起加热生成酸酐。
O R C OH P2O5 R C OH
O
O RC R C O + H2O
O
产率很低
例如:
OO CH2COOH CH3COCCH3
§13.4.3
生成酰氯
羧酸的羟基被卤素取代生成物叫酰卤。
所用的试剂为: PX3 、PX5 、SOCl2 (亚硫酰氯)等。
适用于低沸 点酰卤制备
适用于高 沸点酰卤 制备
低、高沸点 的酰氯制备 都适合
O R C OH PBr3
O
R C Br
酰溴
H3PO3
亚磷酸 (200℃分解)
O R C OH PCl5
(1)加热
(2)碱性条件
(3)加热和碱性条件共存
A-CH2-COOH 加热 碱 ACH3 + CO2
当A为吸电子基团,如:A=COOH, CN, C=O, NO2, CX3, C6H5等时。失羧反应极易进行。
《羧酸的化学性质》PPT课件

3RCOOH + PCl RCOOH + SOCl
3 2
3RCOCl + H 3PO 3 RCOCl + SO
2
+ HCl
——亚硫酰氯是实验室制备酰氯最方便的试剂。原因:反应的副产 物都是气体,产物纯度和产率皆较高
意义
酰氯很活泼,是一类重要的有机试剂
2019/5/9
7
(2)酸酐的生成
除甲酸在脱水时生成CO外,其它一元羧酸在脱水剂(五 氧化二磷、乙酸酐)作用下,发生分子间脱水生成酸酐
2019/5/9
17
重要的羟基酸
——乳酸 因来自酸牛乳而得名,肌肉活动也会分解出乳酸。是一 个不对称的手性分子,是最早研究立体化学的化合物之一。广泛用 作皮革工业的脱灰剂,以及食品、饮料工业
——酒石酸 来自葡萄酿酒时产生的酒石(酸性酒石酸钾)而得名, 广泛存在于植物果实中。有旋光性,也是最早研究立体化学的化合 物之一。可作为盐类工业的媒染剂、鞣剂 ——水杨酸 因来自水杨柳中而得名。用途很广:可用作消毒剂、 防腐剂,退热解痛的阿司匹灵(乙酰水杨酸),抗结核的PAS(对 氨基水杨酸);也是染料中间体
二元羧酸的酸性
——概况 二元羧酸的pKa1较小而pKa2较大
——原因
羧基的-I效应和羧基负离子的+I效应共同作用的结果:COOH是 吸电基,有强的-I效应,使另一个羧基的氢较易解离,pKa1变 小,COO-是供电基,有强的+I效应,使pKa2变大 ——例,丙二酸的pKa1为2.83(较乙酸的4.75强),pKa2为5.69 (较乙酸弱)
2019/5/9
10
(4)酰胺的生成
羧酸与氨或胺反应生成羧酸铵,铵盐受热后脱水生成酰胺
化学课件--3.3羧酸

2.酯化反应 酸+醇
酯+水
【科学探究2】乙酸乙酯的酯化过程
——酯化反应的脱水方式
可能一
+ + CH3COOH
HOCH2CH3
浓硫
△
酸
CH3COOCH2CH3
H2O
可能二
+ + CH3COOH
HOCH2CH3
浓硫
△
酸
CH3COOCH2CH3
H2O
实验验证: 同位素原子示踪法
浓硫酸
+ + CH3COOH H18OCH2 CH3 △ CH3CO18OCH2 CH3 H2O
酯化反应的本质:酸脱羟基、醇脱氢。
【知识应用】
【知识应用】
【知识应用】
【知识回顾】
1、加药品顺序:乙醇→浓硫酸→乙酸
2、加碎瓷片 ——防暴沸 3、导管通到饱和Na2CO3溶液的液面上方——防倒吸 4、浓H2SO4的作用? 催化剂、吸水剂
5、为何用饱和的Na2CO3溶液吸收乙酸乙酯?
①乙酸乙酯在无机盐溶液中溶解度减小,容 易分层析出 ②吸收乙酸,溶解乙醇
第三章 烃的含氧衍生物 第三节 羧酸 酯
第一课时 羧酸
一、羧酸
1.定义:由烃基与羧基相连构成的有机化合物。 2.分类:
3.通式: 4.命名H10O2 可能的结构
相同碳原子数的羧酸和酯互为同分异构体
二、常见羧酸的物理性质
(冰醋酸--纯净的乙酸) 思考:在室温较低时,无水乙酸就会凝结成像冰 一样的晶体。请简单说明在实验中若遇到这种情 况时,你将如何从试剂瓶中取出无水乙酸。
二、常见羧酸的物理性质
三、羧酸的化学性质
日常生活中,为什么可以用醋除去水垢? (水垢的主要成分包括CaCO3)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
羧酸的性质和应用
19
四、 酯
1.酯类结构特征: R-COOR’(R和R’可相同可不同)
O
官能团: -C-O- (酯 键)
2.饱和一元羧酸酯通式: CnH2nO2
3.酯的命名: 某酸某(醇)酯(醇字省略)
CH3CH2COOCH3 (丙酸甲酯)
CH3COOCH2 (二乙酸乙二酯) CH3COO CH2
羧酸的性质和应用
14
生成乙酸乙酯的实验注意事项
➢ 如何混合反应液? 3mL乙醇→ 2mL浓硫酸→ 2mL冰醋酸 ➢ 长导管的作用: 导气、冷凝 ➢ 导管为何不伸入液面下? 防倒吸 ➢ 还有其他防倒吸的方法吗?
➢ 为什么用饱和Na2CO3溶液吸收乙酸乙酯?
吸收乙醇和乙酸、降低乙酸乙酯溶解度(盐析)
➢ 实验中采取了哪些措施提高乙酸乙酯的产率?
4.酯的物理性质:
低级酯为无色液体、难溶于水、密度比水小、 有特殊香味
羧酸的性质和应用
20
四、 酯
5.酯的化学性质: …酸性水解、碱性水解
仅做催化剂
无机酸
CH3COOC2H5 +H2O △ CH3COOH +C2H5OH
CH3COOC2H5 +NaOH △ CH3COONa + C2H5OH
既做催化剂又做反应物
结构简式:CH3COOH 官能团:羧基 (-COOH)
羧酸的性质和应用
9
二、 羧酸代表物…乙酸
2. 乙酸物理性质:
气味 : 强烈刺激性气味 色态 : 无色液体
溶解性 : 与水、酒精以任意比互溶
溶解性 : 熔点:16.6℃、沸点:117.9 ℃ (易结成冰状晶体,故称冰醋酸)
[思维延伸] 在室温较低时,无水乙酸会凝结成晶体。
(2) 沸点:
有机化合 物
Mr
沸点 /℃
有机化合物
Mr
沸点 /℃
HCOOH 46 100.7 CH3COOH 60 118
C2H5OH
46
78.5 CH3CH2CH2O 60 H
97.4
羧酸的沸点比相对分子质量相近的醇要高
羧酸的性质和应用
6
羧酸的沸点为什么比相对分子质量相近的醇高?
O ···H-O
乳酸
HOOC-COOH
草酸
CH3-COOH
醋酸
羧酸的性质和应用
3
常见的有机酸
HCOOH
蚁酸
羧酸的性质和应用
4
一、 羧 酸
1. 定义: 从结构上看,由烃基和羧基相连的有机物
醋酸:CH3COOH 软脂酸:C15H31COOH 苯甲酸:C6H5COOH
硬脂酸:C17H35COOH 油酸:C17H33COOH
乙二酸:HOOC-COOH
饱和一元脂肪酸的通式:CnH2nO2
羧酸与羧酸酯、羟基醛、羟基酮 互为同分异构体
试写出:C3H6O2各种异构体的结构简式
羧酸的性质和应用
5
一、 羧 酸
2. 物理性质及其变化:
(1) 溶解性: R-COOH中,≤C4 的羧酸可与水互溶,但 随着“R-”碳原子数的增加,水溶性减弱
专 题 4 烃的衍生物
第三单元:醛 羧酸
(二)羧酸的性质和应用
羧酸的性质和应用
1
常见的有机酸
我们常常会吃到一些酸味较浓的食物,这些食物为 什么有酸味?你能举例吗?
HOOC-CH-CH2-COOH OH
苹果酸
COOH
HOOC-CH2-C-CH2-COOH
OH
柠檬酸
羧酸的性质和应用
2
常见的有机酸
CH3-CH-COOH OH
若遇到这种情况,将如何方便从试剂瓶中取出乙酸。
用热毛巾捂或用温水浴加热
羧酸的性质和应用
10
二、 羧酸代表物…乙酸
2. 乙酸化学性质:
H 结构分析: H C
④H
受-OH的影响,
O ③ 碳氧双键不易断
C OH
② ① 受 C=O 影响, O-H键更易断
① 羧酸的酸性(弱电解质)
② 羟基被取代的反应(酯化反应) ③ C=O不能加H2还原 ④ 燃烧
,请写出两分子乳酸发生
酯化反应的化学方程式。
羧酸的性质和应用
16
1.甲酸:
三、几种重要的羧酸
O H—C—OH
醛基
羧基
化学性质: 既具有醛的性质又有羧酸的性质
羧酸的性质和应用
17
三、几种重要的羧酸 2.乙二酸: …俗称草酸
OO HO C C OH (饱和二元羧酸)
COOH + CH2OH COOH CH2OH
O CH3-C-OH + H-O-C2H5
酯化 水解
O CH3-C-O-C2H5 + H2O
酯化
水解
羧酸的性质和应用
21
R-C
C-R
O-H ···O
羧酸分子间形成氢键的机会比的醇多!
沸点: 羧酸>醇>烃(Mr相近)
羧酸的性质和应用
7
二、 羧酸代表物…乙酸
分析氢谱图写出乙酸(C2H4O2)可能的结构!
CH3COOH 或 HCOOCH3
羧酸的性质和应用
8Leabharlann 二、 羧酸代表物…乙酸1. 乙酸结构:
分子式:C2H4O2
结构式:
羧酸的性质和应用
11
二、 羧酸代表物…乙酸
2. 乙酸化学性质:
(1) 弱酸性: CH3COOH
CH3COO-+H+
代表物
醇、酚、羧酸中“-OH”氢活性的比较
结构简式
酸性
与Na 反应
与
NaOH 反应
与 N反aHC应O3
羟基氢 活泼性
乙醇 CH3CH2OH 中性
能
不能
不能
苯酚
C6H5OH <H2CO3 能
用浓硫酸吸水、及时蒸出乙酸乙酯
羧酸的性质和应用
15
二、 羧酸代表物…乙酸
(2) 羟基的取代反应…与醇的酯化
O CH3-C-O-H
+ H-18O-CH2-CH3浓△硫酸
O CH3C-18OC2H5 +
H2O
【知识迁移】
O
浓
CH2 O
H2SO4 CH2 O
C C
CH3 CH3
+ 2H2O
O
已知乳酸的结构为
能
不能
增
乙酸 CH3COOH >H2CO3 能
能
能
强
羧酸的性质和应用
12
【训练·提高】
COOH OH
COONa OH
NaOH
CO2
COONa ONa
要完成以上三种物质之间的转化需要加入什么试剂?
羧酸的性质和应用
13
二、 羧酸代表物…乙酸
(2) 羟基的取代反应…与醇的酯化
实 验:
活动与探究
在一支试管甲中加入3mL乙 醇,然后边振荡试管边慢慢 加入2mL浓硫酸和2mL乙酸 ,另一支试管装3mL饱和碳 酸氢钠溶液。按如图所示连 接好装置进行实验,小心均 匀加热3-5min 。
浓硫酸 △
O O
O
C C
O
CH2 CH2
+
2H2O
羧酸的性质和应用
18
三、几种重要的羧酸
3.对苯二甲酸: HOOC
COOH
n HOOC
COOH + n HOCH2CH2OH 催化剂
O
O
[C
C-OCH2CH2O ]n + 2nH2O
(聚酯纤维…俗称涤纶)
缩聚反应:有机物分子间脱去小分子,获得高分子 化合物的反应
