蒸馏优质课件PPT
合集下载
化工原理蒸馏.ppt

p
0 A
=116.9kPa,
pB0=45.8 kPa。求得
xA
P pB0
p
0 A
pB0
0.78 0.8
重设t=84.5 ℃,重复上述计算,可得 pA0=115.2 kPa,
p
0 B
=45
kPa,求得
xABiblioteka P pB0p0 A
pB0
0.802 0.8
说明所设温度正确,且 p=A0 115.2kPa,故 y 0.9
液体的蒸 馏
——沸点不同的液体混合物的分离
混合物的分类: 非均相物系(气固相混合物) 均相物系(液体混合物、气体混合物等)
均相物系分离的条件: 依据物系中不同组分之间的某些性质差异。
传质分离过程的概念: 将物质在相间的转移过程称为传质(分离)
过程。 常见的传质分离过程有精馏、吸收、萃取等。
蒸馏分离的对象:液体混合物的分离 利用被分离液体之间挥发度的差异, 采用加热的方式 在一定范围遵循拉乌尔定律
xA
P
p
0 B
p
0 A
p
0 B
0.26
yA
p
0 A
P
xA
0.46
已知双组分混合液中,苯(A)占80%,甲苯占20%(摩尔百
分率)。试求常压下与该液相相平衡的汽相组成及温度。苯、
甲苯的饱和蒸汽压可按上例中的Antoine公式计算。
解:由已知x=0.8,P=101.3 kPa,汽相平衡组成可利用
蒸馏过程的特点:
10 蒸馏过程 将液体溶液加热至沸腾,液体便汽化,由于溶液
中各组分的挥发性不同,即蒸汽压不同,产生的所 相与液相组成便不同,易挥发的组成较多地进入气 相,而难挥发组分则较多的留在液相,于是,由原 来单一的液体溶液分成接触的浓度不同的汽液两 相,——这样便实现了组份的初步分离——这种分 馏原理叫蒸馏原理,根据蒸馏原理而设计的各种分 离操作都属于蒸馏过程,常见的的蒸馏过程有闪蒸, 简单蒸馏、连续精馏和间隙精馏等。
必修一一蒸馏PPT课件
例:如图为实验室制【取例1蒸】馏水(2的011实·天验津装五置校示联意考图)如,图根为据实验室制取
图示回答下列问题:
1、图中的两处明显错水误的是装置:示__意__图__,__根_据__图__示__回__答__下_列__问__题_;。
______________________________。
2Hale Waihona Puke A仪器的名称是:___________;
试管内的溶液 产生了白色沉淀
2、在烧瓶中加入约1/3体积的自来水, 再加入几粒沸石,按图1-4连接好装置 ,向冷凝管中通入冷却水。加热烧瓶, 弃去开始馏出的部分液体,用锥形瓶收 集约10mL液体,停止加热。
蒸馏烧瓶中水沸腾, 冷凝管中有无色液体凝结, 并通过尾接管流入锥形瓶
3、取少量蒸馏出的液体加入试管中, 然后加入几滴AgNO3溶液和几滴稀硝酸。 (得到的液体中含有Cl-吗?)
试管内的溶液无明显现象
2019/9/19
3
2019/9/19
4
酒精和水的混合物能否用蒸馏法分离?
符合蒸馏 的条件
液体混合物——酒精与水以任意比例混合。 各组分沸点不同——酒精78℃,水100℃。
沸点( 低)的组分先蒸出,加热温度不超过混合物 中沸点( 最高)的物质的沸点!
2019/9/19
5
●典例剖析
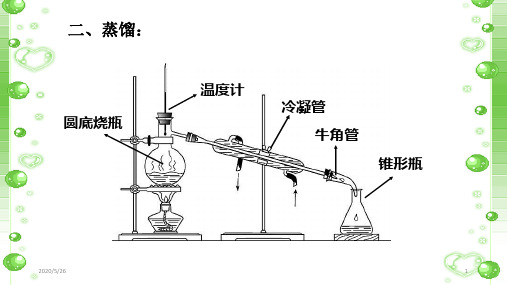
二、蒸馏:
圆底烧瓶
温度计
冷凝管 牛角管
锥形瓶
2019/9/19
1
二、蒸馏:
5.溶液体积 约为烧瓶体 积1/3—2/3
3.投放沸石或 瓷片防暴沸
4.烧瓶底加 垫石棉网
2019/9/19
2
【实验1-3】制取蒸馏水(除去Cl- 等杂质)
《常减压蒸馏》课件

产品质量是常减压蒸馏过程中的核心目标,需要通过对多个工艺参数的综合调控来实现 。
详细描述
在常减压蒸馏过程中,产品质量受到多种因素的影响,如原料的性质、工艺参数的选择 和控制等。为了确保产品质量达标,需要定期对产品进行化验分析,并根据分析结果对 工艺参数进行调整。此外,加强生产过程中的质量监控和质量管理也是提高产品质量的
重要措施。
05
常减压蒸馏的优化与改进
工艺参数优化
01
02
03
04
温度控制
通过精确控制加热温度,优化 蒸馏过程,提高产品质量和收
率。
压力调节
合理调节系统压力,改善传热 效果和分离效率,降低能耗。
液位控制
保持塔内液位稳定,防止溢流 和抽空现象,确保生产稳定。
进料流量与组成
优化进料流量和组成,提高轻 重组分的分离效果,降低能耗
原理
基于物质沸点的不同,通过加热 和冷凝的方式将石油中的不同组 分分离出来。
历史与发展
历史
常减压蒸馏技术起源于19世纪中叶 ,随着技术的不断发展和改进,已成 为石油工业中的重要工艺。
发展
近年来,随着环保要求的提高和能源 结构的调整,常减压蒸馏技术也在不 断优化和升级,以实现更加高效、环 保的生产。
分馏塔和冷凝器
分馏塔
是常减压蒸馏的核心设备,通过精馏原理将原料油分离成不同沸点的组分。
冷凝器
用于将蒸馏出的轻组分冷凝成液体,同时将过热蒸汽进行冷却和回收。
回流罐和产品罐
回流罐
用于收集和储存回流液,为蒸馏塔提 供回流热源,保持塔内温度稳定。
产品罐
用于储存不同沸点组分的油品,方便 后续处理和运输。
04
原料加热
通过加热使原料软化,降 低粘度,便于后续加工。
详细描述
在常减压蒸馏过程中,产品质量受到多种因素的影响,如原料的性质、工艺参数的选择 和控制等。为了确保产品质量达标,需要定期对产品进行化验分析,并根据分析结果对 工艺参数进行调整。此外,加强生产过程中的质量监控和质量管理也是提高产品质量的
重要措施。
05
常减压蒸馏的优化与改进
工艺参数优化
01
02
03
04
温度控制
通过精确控制加热温度,优化 蒸馏过程,提高产品质量和收
率。
压力调节
合理调节系统压力,改善传热 效果和分离效率,降低能耗。
液位控制
保持塔内液位稳定,防止溢流 和抽空现象,确保生产稳定。
进料流量与组成
优化进料流量和组成,提高轻 重组分的分离效果,降低能耗
原理
基于物质沸点的不同,通过加热 和冷凝的方式将石油中的不同组 分分离出来。
历史与发展
历史
常减压蒸馏技术起源于19世纪中叶 ,随着技术的不断发展和改进,已成 为石油工业中的重要工艺。
发展
近年来,随着环保要求的提高和能源 结构的调整,常减压蒸馏技术也在不 断优化和升级,以实现更加高效、环 保的生产。
分馏塔和冷凝器
分馏塔
是常减压蒸馏的核心设备,通过精馏原理将原料油分离成不同沸点的组分。
冷凝器
用于将蒸馏出的轻组分冷凝成液体,同时将过热蒸汽进行冷却和回收。
回流罐和产品罐
回流罐
用于收集和储存回流液,为蒸馏塔提 供回流热源,保持塔内温度稳定。
产品罐
用于储存不同沸点组分的油品,方便 后续处理和运输。
04
原料加热
通过加热使原料软化,降 低粘度,便于后续加工。
《化工原理蒸馏》课件

蒸馏的原理与流程
蒸馏原理
基于不同组分在汽化、冷凝过程中的物理性质差异,通过控制温度和压力,使 不同组分得以分离。
蒸馏流程
包括加热、汽化、冷凝、收集等步骤,通过优化流程参数,提高分离效果和效 率。
蒸馏在化工中的应用
01
02
03
石油化工
蒸馏是石油化工中常用的 分离方法,用于生产汽油 、柴油、煤油等。
02
数学模型通过建立数学方程来描述蒸馏塔内各相之间的传递和
反应过程,以便对蒸馏过程进行模拟和优化。
常见的蒸馏过程数学模型包括质量传递、动量传递和热量传递
03
模型,以及涉及化学反应的模型。
蒸馏过程的模拟软件介绍
01
蒸馏过程的模拟软件是用于模 拟和优化蒸馏过程的计算机程 序。
02
这些软件基于数学模型,通过 数值方法求解描述蒸馏过程的 偏微分方程,以预测蒸馏塔的 操作性能和优化设计。
蒸馏压力也影响蒸馏效率和产品质量。在 高压下,液体沸点升高,可分离沸点更接 近的组分。
蒸馏速率
回流比
蒸馏速率决定了蒸馏过程的效率。过快的 蒸馏速率可能导致产品质量下降,而慢速 蒸馏则可以提高产品质量和分离效果。
回流比是影响蒸馏效率和产品纯度的关键 参数。增大回流比可以提高产品纯度,但 也会增加能耗和操作成本。
新型塔板和填料的应用
采用新型塔板和填料可以提高蒸馏效率和分离效果,降低能耗和 操作成本。
强化传热传质技术
采用强化传热传质技术可以提高蒸馏效率,减小设备体积和操作成 本。
过程集成与优化
通过过程集成与优化,实现蒸馏过程的节能减排和资源高效利用。
04
蒸馏过程的模拟与计算
蒸馏过程的数学模型
01
化工原理蒸馏PPT课件

1
16
1. 利用饱和蒸气压计算气液平衡关系
在 一 定 的 压 力 下t fx
t gy
? 理想物系
在 一 定 的 温 度 下pAf x 理想物系 pBgx
p
A
pB
ห้องสมุดไป่ตู้
p
0 A
x
A
p
0 B
x
B
拉乌尔定律
理 想 物 系 的 t - x ( y ) 相 平 衡 关 系 :
对 理 想 物 系 , 汽 相 满 足 : P p A p B p0 AxpB 0(1x)
vA
pA xA
vB
pB xB
显 然 对 理 想 溶 液 , 根 据 拉 乌 尔 定 律 有 :
Ap0 A,BpB 0
什 么 是 相 对 挥 发 度 ?
相对挥发度
vA vB
pA pB
xA xB
yA yB
xA xB
显然对理想溶液,有:
p
0 A
p
0 B
y x 1( 1)x
8
液体混合物的蒸气压
10
§6.2 双组分溶液的气液相平衡
二元物系汽液相平衡时,所涉及的变量有:
温度t、压力P、汽相组成y、液相组成x等4个。
t, P, y
A
B
f C 2 2 2 2 2 t, x
溶 液 ( A+B)
加热
11
§6.2 二元物系的汽液相平衡
P 一定
B
露点线 汽相区
t-y
t 泡点线 两相区
露点线一定在泡点线上方。 杠杆原理: 力力臂 = 常数
t-x
L1
液相区
0
x 或y
本章主要介绍蒸馏的基本原理(共49张PPT)

由其泡点或露点计算确定。对液相则由泡点计算确定其
平衡常数 、泡点 及与之平衡气相组成 ,并
有
。对气相混合物,则由露点计算来确定
其 、 及。
第七页,共四十九页。
二元混合物相平衡关系
对于理想的二元混合物的相平衡(pínghéng)关系,由平衡 常 (pínghéng) 数表示,则有:
YA=KA.xA, KA =pA/P, yB=KB.xB, KB =pB/P
(10.27)
式( 10.27 )为提馏段操作方程常用表达式,亦为线性方 程,关联提馏段任意塔截面(jiémiàn)上,上升蒸气与流下液相组 成xn,yn+1 的关系。已知流下液相组成 ,即可由式 ( 10.27 )得来自n+1板上的蒸气组成 。
第二十五页,共四十九页。
若将精馏段及提馏段两操作线与平 衡曲线(y~x)同时(tóngshí)绘于同一 直角坐标中,如图10-7所示。精馏 段操作线如DC所示,提馏段操作线 如QW所示。
第三节 二元连续(liánxù)精馏的分析和计算
10-8 全塔物料(wùliào)衡算
应用全塔物料衡算可以找出经历塔顶、底 的产量与进料量及各组成之间的关系。如 图10-5所示。令:
F为料液流量;D为塔顶产品(馏出液) 流量;W为塔底产品(釜液)流量;ZF 为料液组成;xD、xW为塔顶、底产品的组成。
本章重点:
·连续精馏过程的基本原理及过程描述的基本方法 ·二元精馏过程的设计以及精馏过程的操作分析与诊断 ·精馏过程的塔设备
第三页,共四十九页。
第一节 二元物系的气液平衡(pínghéng)
a. 气液相平衡
b. 在一封闭容器中,如图6.1.1所示。在一 定条件下,液相中各组分均有部分(bùfen)分 子从界面逸出进入液面上方气相空间, 而气相也有部分(bùfen)分子返回液面进入液 相内。经长时间接触,当每个组分的分 子从液相逸出与气相返回的速度相同, 或达到动态平衡时,即该过程达到了相 平衡。平衡时气液两相的组成之间的关 系称为相平衡关系。它取决于体系的热 力学性质,是蒸馏过程的热力学基础和 基本依据。
蒸馏PPT课件

水蒸汽蒸馏应用于: 1)分离其中仅有一个组份能 同水蒸汽挥发的混合物; 2)纯化物质,以去掉树脂状 杂质; 3)如果它能比减压蒸馏更完 全地把挥发性物质分开。
在100℃时蒸汽压小的高沸点 物质用过热水蒸汽蒸馏。
连续水蒸汽蒸馏及少量物质的蒸馏
分子蒸馏
在实验室中常常需要纯化在 沸点分解而又不能用提取、 结晶、层析来纯化的高沸点 物质。用分子蒸馏可以达到 达个目的,此时物质的沸点 降低200—300℃。分子蒸馏 是减压蒸馏的一种变种,它 在压力不高于0.001毫米汞柱 的条件下进行。
(3).蒸馏是通过对混合物加热建立汽液两相体系的,汽相还需要再冷 凝液化,因此需要消耗大量的能量(包括加热介质和冷却介质)。另外, 加压或减压,将消耗额外的能量。蒸馏过程中的节能是个值得重视的问 题。
蒸馏操作的分类
1、按蒸馏方式可分为平衡(闪蒸)蒸馏、简单蒸馏、精馏和特殊精馏 平衡蒸馏和简单蒸馏常用于混合物中各组分的挥发度相差较大,对分 离要求又不高的场合; 精馏是借助回流技术来实现高纯度和高回收率的分离操作,它是应用 最广泛的蒸馏方式。如果混合物中各组分的挥发度相差很小(相对挥发度 接近于1)或形成恒沸液时,则应采用特殊精馏(恒沸精馏和萃取精馏)。 若精馏时混合液组分间发生化学反应,称反应精馏,这是将化学反应 与分离操作耦合的新型操作过程。 对于含有高沸点杂质的混合液,若它与水互不相溶,可采用水蒸气蒸 馏,从而降低操作温度。 对于热敏性混合液,则可采用高真空下操作的分子蒸馏。
仪器的效率由三个因素决定: (1) 装置中的压力 (0.001~0.0001mmHg, (2) 冷却面到蒸发面的距离 (1~2cm) , (3) 待蒸馏物层的厚度。
恒沸精馏和萃取精馏的比较
共同点: (1)都加入另一组分。 (2)使相对挥发度增大。 (3)计算过程所用的基本关系式都是物料衡算、热量衡算和相平衡关系。 不同点: (1)恒沸精馏塔形成恒沸物,从塔顶蒸出。 (2)萃取精馏不形成恒沸物,从塔釜离开。
在100℃时蒸汽压小的高沸点 物质用过热水蒸汽蒸馏。
连续水蒸汽蒸馏及少量物质的蒸馏
分子蒸馏
在实验室中常常需要纯化在 沸点分解而又不能用提取、 结晶、层析来纯化的高沸点 物质。用分子蒸馏可以达到 达个目的,此时物质的沸点 降低200—300℃。分子蒸馏 是减压蒸馏的一种变种,它 在压力不高于0.001毫米汞柱 的条件下进行。
(3).蒸馏是通过对混合物加热建立汽液两相体系的,汽相还需要再冷 凝液化,因此需要消耗大量的能量(包括加热介质和冷却介质)。另外, 加压或减压,将消耗额外的能量。蒸馏过程中的节能是个值得重视的问 题。
蒸馏操作的分类
1、按蒸馏方式可分为平衡(闪蒸)蒸馏、简单蒸馏、精馏和特殊精馏 平衡蒸馏和简单蒸馏常用于混合物中各组分的挥发度相差较大,对分 离要求又不高的场合; 精馏是借助回流技术来实现高纯度和高回收率的分离操作,它是应用 最广泛的蒸馏方式。如果混合物中各组分的挥发度相差很小(相对挥发度 接近于1)或形成恒沸液时,则应采用特殊精馏(恒沸精馏和萃取精馏)。 若精馏时混合液组分间发生化学反应,称反应精馏,这是将化学反应 与分离操作耦合的新型操作过程。 对于含有高沸点杂质的混合液,若它与水互不相溶,可采用水蒸气蒸 馏,从而降低操作温度。 对于热敏性混合液,则可采用高真空下操作的分子蒸馏。
仪器的效率由三个因素决定: (1) 装置中的压力 (0.001~0.0001mmHg, (2) 冷却面到蒸发面的距离 (1~2cm) , (3) 待蒸馏物层的厚度。
恒沸精馏和萃取精馏的比较
共同点: (1)都加入另一组分。 (2)使相对挥发度增大。 (3)计算过程所用的基本关系式都是物料衡算、热量衡算和相平衡关系。 不同点: (1)恒沸精馏塔形成恒沸物,从塔顶蒸出。 (2)萃取精馏不形成恒沸物,从塔釜离开。
第十章---蒸馏PPT课件

馏出液总量 V = L0 - L = 100-62 = 38mol 设馏出液中组分A的摩尔分数为ym , 作整个蒸馏过程组分A的物料衡算: L0x0 = Lx+Vym
y m L 0 x 0 V L x1 0 0 ..5 0 3 0 6 8 2 0 .2 8 0 .818 6
3.水蒸气蒸馏
ppwpA
(a)0.69,(b)0.88, (c) 0.92,(d)0.94。
.
27
10.3C 提馏段的物料衡算
LVW
LxmVym1WWx
提馏段操作线方程式:
ym1L'L W ' xmLW 'WxW
.
28
10-4 进料状态对精馏的影响
10.4A 进料热状态
1. 进料热状态参数 假设进料为汽液混合物, 每1mol进料中液相为qmol ,
轻组分 汽液两相单共存区
汽相线 汽相单相区
.
7
(2)定p下的T-x图 双组分体系
泡点(bubble point)
汽相单相区 露点
汽相线
露点(dew point)
汽液两相 平衡共存区。
泡点
液相线
液相单相区
.
8
(2)定p下的T-x图 双组分体系
恒沸物
恒沸物
最低恒沸点
.
最高恒沸点
9
(3)定p下的y-x图
.
43
,求 q 值:q H V H F V h c p ( T b T F ) 3 .1 2 0 .1 5 ( 3 9 6 3) 7 2 1 .2 8
H V H L V h
3 .1 2
q 1.20 6.00 q1 1.201
从对角线上y = x = xF = 0.45 的点作斜率为6.00 的直线,即为 q 线, 与精馏段操作线交于点d 。
y m L 0 x 0 V L x1 0 0 ..5 0 3 0 6 8 2 0 .2 8 0 .818 6
3.水蒸气蒸馏
ppwpA
(a)0.69,(b)0.88, (c) 0.92,(d)0.94。
.
27
10.3C 提馏段的物料衡算
LVW
LxmVym1WWx
提馏段操作线方程式:
ym1L'L W ' xmLW 'WxW
.
28
10-4 进料状态对精馏的影响
10.4A 进料热状态
1. 进料热状态参数 假设进料为汽液混合物, 每1mol进料中液相为qmol ,
轻组分 汽液两相单共存区
汽相线 汽相单相区
.
7
(2)定p下的T-x图 双组分体系
泡点(bubble point)
汽相单相区 露点
汽相线
露点(dew point)
汽液两相 平衡共存区。
泡点
液相线
液相单相区
.
8
(2)定p下的T-x图 双组分体系
恒沸物
恒沸物
最低恒沸点
.
最高恒沸点
9
(3)定p下的y-x图
.
43
,求 q 值:q H V H F V h c p ( T b T F ) 3 .1 2 0 .1 5 ( 3 9 6 3) 7 2 1 .2 8
H V H L V h
3 .1 2
q 1.20 6.00 q1 1.201
从对角线上y = x = xF = 0.45 的点作斜率为6.00 的直线,即为 q 线, 与精馏段操作线交于点d 。
化工原理蒸馏PPT

测数据或用安托因(Antoine )方程 进行推算:
p P
0 A
0 P pB 0 p0 p A B
B ln p A t C
0
2 用相对挥发度表示的气液平衡关系
对于混合液中的某一组分 i,挥发度i 定义为:
pA vA xA
vB pB xB
显然对理想溶液,根据拉乌尔定律有:
t f x
理想物系
?
理想物系的 t-x(y)相平衡关系:
0 对理想物系,汽相满足: P p A pB p 0 x p A B (1 x )
0 P pB x 0 0 p A pB pA p0 Ax y P P
0 p0 A 、 p B 仅与温度 t 有关,可采用实
纯组分的饱和蒸气压仅与温度 t 有关,可采用实测数据或用安托因 (Antoine)方程进行推算:
B ln p A t C
0
液体的饱和蒸气压是表示液体挥发能力的一种属性。 液体的挥发能力越大,其蒸气压就越大。
什么是挥发度?
对于纯液体,可以用蒸汽压 p0 大小表示其挥发度
对于混合液中的某一组分 i,挥发度i 定义为:
α的大小反映了混合液分离的难易程度。
表1
t, 0C
苯-甲苯物系的相对挥发度随温度的变化关系
80.1 760 292 2.60 84 856 334 2.56 88 963 381 2.53 92 1081 434 2.49 96 1210 492 2.46 100 1350 556 2.43 104 1502 627 2.40 108 1668 705 2.37 110.6 1783 760 2.35
液体混合物的蒸气压
1、对于二组分混合液,由于B组分的存在,使得A组 分在汽相中的蒸气分压比其在纯态下的饱和蒸气压 要小。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
XO之源, XO之本
20轩21/02尼/02 诗XO
国酒
蒸馏酒
茅台酒 8
葡萄 发酵
蒸馏 轩2021尼/02/0诗2 XO
高粱
发酵 蒸馏
八次发酵, 八次蒸馏
茅台酒 9
思考:怎样分离互不相溶的两种 液体呢?
2021/02/02
10
分液漏斗
2021/02/02
11
分液是将两种液体放在分液
漏斗中静置,带分层后将下层 液体从下面放出,上层液体从 上面倒出。如分离水与植物油
17
化学实验基本方法 —— 萃取和分液
实验过程
2. 碘水和 CCl4加入分液漏 斗中,并盖好玻璃塞。
3. 倒转漏斗用力振荡,并
不时旋开活塞放气,最
后关闭活塞,把分液漏
斗放正。 2021/02/02
18
实验过程
化学实验基本方法 —— 萃取和分液
4. 把分液漏斗放在铁架台 的铁圈中,静置,分层。
5. 将漏斗上口的玻璃塞打 开(或使塞上的凹槽或小 孔对准漏斗口上的小孔)。
水
萃取剂的选择条件:
1.萃取剂与原溶剂互不相溶、不发生化学反应
2.溶质在萃取剂中的溶解度大于在原溶剂中的溶解
度
3.溶质与萃取剂不发生任何反应
2021/02/02
16
化学实验基本方法 —— 萃取和分液
实 验:用CCl4萃取碘水中的碘并分液
实验过程:
1. 检验分液漏斗活塞和上口 的玻璃塞是否漏液
2021/02/02
确定是否符合蒸馏条件?
互溶液体混合物——酒精与水以任意比互溶 各组分沸点不同——酒精78℃,水100℃ 沸点( 低 )的组分先蒸出 -酒精
2021/02/02
6
• 酿造
战国时期保存在铜壶中 的酒——保留至今中国 最早202的1/02/古02 酒
16世纪欧洲的酒精蒸馏装置
7
酒精为alcohol,就是阿拉伯语中“蒸馏”
地球上水的储量很大,但淡水只占2.5%, 其中易供人类使用的淡水不足1%
2021/02/02
1
思考:怎样用海水制得淡水?
2021/02/02
2
1.原理——利用液态混合物(互溶)中各组分沸
点的不同,加热使其某一组分变成蒸气,经过冷
凝后再变成液体,从而跟其他组分分开,目的是
将易挥发、难挥发或不挥发的杂质除去.
化学实验基本方法 —— 萃取和分液
实验
➢ 碘加水振荡 ➢ 加CCl4(四氯化碳)振荡
问题: 为什么水的颜色变淡了,
CCl4的颜色变深了呢?
2021/02/02
15
水和四氯化碳 碘(I2) 利用某种物质(溶质)在①互不相溶的溶剂里②溶
解度的不同,用一种溶剂把溶质从它与另一种溶
四氯化碳
剂所组成的溶液中萃取出来。
23
Thank you
感谢聆听 批评指导
汇报人:XXX 汇报日期:20XX年XX月XX日
感谢您的观看!本教学内容具有更强的时代性和丰富性,更适合学习需要和特点。为了 方便学习和使用,本文档的下载后可以随意修改,调整和打印。欢迎下载!
2021/02/02
24
分离氯化钠溶液与苯
2021/02/02
12
分液实验步骤
• 1、查漏 • 2、静置 • 3、打开活塞 • 4、分液(上层:下层:)
2021/02/02
13
分液
1.分液漏斗使用之前要检验是否漏水,如何 检验?
2.静置分层之后,为什么要打开上口的玻璃 塞?液体分别是如何倒出的?
2021/02/02
14
萃取剂的选择
与原溶剂互不相溶 溶质在萃取剂中的溶解度较大 溶质与萃取剂不发生反应
2021/02/02
22
化学实验基本方法 —— 萃取和分液
特别注意事项:
下层液体由下口放出 上层液体由上口倒出
问题:萃取之后用何方法将有机溶剂与溶
质进一步分离开来?
2021/02/02
蒸发? 蒸馏!
浪费溶剂且污染空气!
2.装置
温度计
冷凝管
蒸馏烧瓶
牛角管
锥形瓶
2021/02/02
3
3.注意事项:
1.温度计水 银球位于 蒸馏烧瓶 支管口处
2.盛液: 1/3<V<2/3
5.冷凝水,下 口进,上口出
3.投放沸石 或碎瓷片防 暴沸
4.烧瓶底加
2021/02/02垫石棉网源自42021/02/02
5
酒精和水的混合物能否用蒸馏法分 离?先蒸馏出来的是什么组分?
2021/02/02
19
实验过程
化学实验基本方法 —— 萃取和分液
6. 旋开活塞,用烧怀接 收溶液
7. 将分液漏斗上口倒出 上层水溶液
2021/02/02
20
讨 论:
化学实验基本方法 —— 萃取和分液
碘易溶于酒精,能否用酒精将碘水 中的碘萃取出来?
2021/02/02
21
化学实验基本方法 —— 萃取和分液
20轩21/02尼/02 诗XO
国酒
蒸馏酒
茅台酒 8
葡萄 发酵
蒸馏 轩2021尼/02/0诗2 XO
高粱
发酵 蒸馏
八次发酵, 八次蒸馏
茅台酒 9
思考:怎样分离互不相溶的两种 液体呢?
2021/02/02
10
分液漏斗
2021/02/02
11
分液是将两种液体放在分液
漏斗中静置,带分层后将下层 液体从下面放出,上层液体从 上面倒出。如分离水与植物油
17
化学实验基本方法 —— 萃取和分液
实验过程
2. 碘水和 CCl4加入分液漏 斗中,并盖好玻璃塞。
3. 倒转漏斗用力振荡,并
不时旋开活塞放气,最
后关闭活塞,把分液漏
斗放正。 2021/02/02
18
实验过程
化学实验基本方法 —— 萃取和分液
4. 把分液漏斗放在铁架台 的铁圈中,静置,分层。
5. 将漏斗上口的玻璃塞打 开(或使塞上的凹槽或小 孔对准漏斗口上的小孔)。
水
萃取剂的选择条件:
1.萃取剂与原溶剂互不相溶、不发生化学反应
2.溶质在萃取剂中的溶解度大于在原溶剂中的溶解
度
3.溶质与萃取剂不发生任何反应
2021/02/02
16
化学实验基本方法 —— 萃取和分液
实 验:用CCl4萃取碘水中的碘并分液
实验过程:
1. 检验分液漏斗活塞和上口 的玻璃塞是否漏液
2021/02/02
确定是否符合蒸馏条件?
互溶液体混合物——酒精与水以任意比互溶 各组分沸点不同——酒精78℃,水100℃ 沸点( 低 )的组分先蒸出 -酒精
2021/02/02
6
• 酿造
战国时期保存在铜壶中 的酒——保留至今中国 最早202的1/02/古02 酒
16世纪欧洲的酒精蒸馏装置
7
酒精为alcohol,就是阿拉伯语中“蒸馏”
地球上水的储量很大,但淡水只占2.5%, 其中易供人类使用的淡水不足1%
2021/02/02
1
思考:怎样用海水制得淡水?
2021/02/02
2
1.原理——利用液态混合物(互溶)中各组分沸
点的不同,加热使其某一组分变成蒸气,经过冷
凝后再变成液体,从而跟其他组分分开,目的是
将易挥发、难挥发或不挥发的杂质除去.
化学实验基本方法 —— 萃取和分液
实验
➢ 碘加水振荡 ➢ 加CCl4(四氯化碳)振荡
问题: 为什么水的颜色变淡了,
CCl4的颜色变深了呢?
2021/02/02
15
水和四氯化碳 碘(I2) 利用某种物质(溶质)在①互不相溶的溶剂里②溶
解度的不同,用一种溶剂把溶质从它与另一种溶
四氯化碳
剂所组成的溶液中萃取出来。
23
Thank you
感谢聆听 批评指导
汇报人:XXX 汇报日期:20XX年XX月XX日
感谢您的观看!本教学内容具有更强的时代性和丰富性,更适合学习需要和特点。为了 方便学习和使用,本文档的下载后可以随意修改,调整和打印。欢迎下载!
2021/02/02
24
分离氯化钠溶液与苯
2021/02/02
12
分液实验步骤
• 1、查漏 • 2、静置 • 3、打开活塞 • 4、分液(上层:下层:)
2021/02/02
13
分液
1.分液漏斗使用之前要检验是否漏水,如何 检验?
2.静置分层之后,为什么要打开上口的玻璃 塞?液体分别是如何倒出的?
2021/02/02
14
萃取剂的选择
与原溶剂互不相溶 溶质在萃取剂中的溶解度较大 溶质与萃取剂不发生反应
2021/02/02
22
化学实验基本方法 —— 萃取和分液
特别注意事项:
下层液体由下口放出 上层液体由上口倒出
问题:萃取之后用何方法将有机溶剂与溶
质进一步分离开来?
2021/02/02
蒸发? 蒸馏!
浪费溶剂且污染空气!
2.装置
温度计
冷凝管
蒸馏烧瓶
牛角管
锥形瓶
2021/02/02
3
3.注意事项:
1.温度计水 银球位于 蒸馏烧瓶 支管口处
2.盛液: 1/3<V<2/3
5.冷凝水,下 口进,上口出
3.投放沸石 或碎瓷片防 暴沸
4.烧瓶底加
2021/02/02垫石棉网源自42021/02/02
5
酒精和水的混合物能否用蒸馏法分 离?先蒸馏出来的是什么组分?
2021/02/02
19
实验过程
化学实验基本方法 —— 萃取和分液
6. 旋开活塞,用烧怀接 收溶液
7. 将分液漏斗上口倒出 上层水溶液
2021/02/02
20
讨 论:
化学实验基本方法 —— 萃取和分液
碘易溶于酒精,能否用酒精将碘水 中的碘萃取出来?
2021/02/02
21
化学实验基本方法 —— 萃取和分液
