卤素置换反应(课堂PPT)
卤素ppt课件

H2+Br2====2HBr HBr较不稳定
I2
持续加热
H2+I2====2HI
HI很不稳定
H2+I2====2HI 把向生成物方向进行的反应叫做正反应, 把向反应物方向进行的反应叫做逆反应; 可逆反应: 在同一条件下,既能向正反 应方向进行,同时又能向逆反应方向进 行的反应叫做可逆反应。
思考
判断下列各对反应是 否为可逆反应:
- - 问题:怎样检验Cl 、Br 、I -
?
18
现有三瓶试剂(标签:1、2、3)分别是氯化 钠溶液、溴化钠溶液和碘化钾溶液,你该如何 鉴别?
19
比较两种检验Cl-、Br-、I-离子的方法,判断 -、Br-、I-离子 设计实验方案检验 Cl 哪种更好?
①加新制氯水,再通过加四氯化碳、振荡观察四氯化 碳层的颜色 ②加硝酸银,观察沉淀颜色。 四氯化碳层呈无色,是氯化钠 产生白色沉淀 →是氯化钠 产生淡黄色沉淀 → 是溴化钠 四氯化碳层呈橙色,是溴化钠 产生黄色沉淀→ 是碘化钠 四氯化碳层呈紫色,是碘化钠 AgNO3+ NaCl→ AgCl↓ (白色沉淀)+ NaNO 2NaBr + Cl → 2NaCl + Br 3 2 2 AgNO3+NaBr→ AgBr↓(淡黄色沉淀)+NaNO3 2NaI Cl 2NaCl + I2 2 → AgNO3+ KI + → AgI↓ (黄色沉淀)+ KNO3 20
光
24
感光胶 片—AgX 人工降 雨—AgI 变色眼 镜—AgBr
25
课堂练习
(1)思考如何检验自来水和蒸馏水 (2)如今在中国某些地区,依然私盐猖獗,冒充 碘盐贩卖,请你想一个方法来检验真假碘盐? (补充资料:碘盐中碘的存在形态为IO3-。而碘酸 根离子的性质IO3- + 5I- + 6H+ → 3I2 + 3H2O)
卤素置换反应PPT课件

• 卤化物的卤素交换反应 • 磺酸酯的卤置换反应 see • 芳香重氮盐化合物的卤置换反应 see
1
卤化物的卤素交换反应的定义
• 定义:有机卤化物与无机卤化物之间进行 卤原子交换反应,称为Finkelstein卤素交换 反应,在合成上常常利用来制备某些直接 用卤化方法难以得到的碘代烃和氟代烃.
路易斯酸催化
Cl Cl
亚铜盐催化
Ph
Ph
Br
Br
HBr / FeBr3 HBr / FeBr3 CH2Cl2 , 25 C CH2Cl2 , 25 C
KI /CuI /HMPT Ph KI /CuI /HMPT Ph
120 C ,10 h 120 C ,10 h
[143a,b] [143a,b] Br (99%) Br (99%)
[143c]
I I
[(18453%c]) (85%)
卤代烯烃分为三类: 1.卤素原子与双键间隔两个以上碳原子,
与卤烷中的卤原子活性相同。 2.卤素原子与烯丙位相连,活泼,
很容易发生亲核取代;3.卤素原子与双键碳原子相连,形成p2-0 共轭体系,很不活泼,需要一些过渡金属催化剂。
碘化物(MI)与氯(溴)代烃(RCl(Br))的交换实例
• DMF、丙酮、四氯化碳、二硫化碳、丁酮,它 们均为非质子溶剂。
• 溶剂的选择要有利于无机卤化物在其中的溶解 度大,但生成的无机卤化物的溶解度小或几乎 不溶,这样可使卤素-卤素置换反应完全。
RCl/RBr
NaI/acetone
RI + NaCl(NaBr)
NaF、NaCl、NaBr、NaI在丙酮中的溶解度(g/100g)分别为
亲核试剂
卤素ppt优秀课件(2024)

了解卤素在周期表中的位置及其性质变化规律。
2024/1/26
27
实验目的和原理
实验原理
卤素单质具有相似的化学性质,如与金属反应生成卤化 物、与非金属反应生成卤化氢等。
卤素位于元素周期表的第ⅦA族,包括氟(F)、氯(Cl )、溴(Br)、碘(I)等元素。
随着原子序数的增加,卤素单质的颜色、密度、熔沸点 等物理性质呈现规律性的变化。
2024/1/26
8
氯气
物理性质
氯气是一种黄绿色、有刺激性气 味的气体,密度比空气大,可溶
于水。
2024/1/26
化学性质
氯气化学性质活泼,可以与多种元 素和化合物发生反应。
用途
氯气是一种重要的化工原料,用于 制造氯化物、漂白剂、消毒剂、农 药等。此外,氯气还用于自来水的 消毒和游泳池水的处理。
9
2024/1/26
34
THANKS
感谢您的观看
2024/1/26
35
对人体健康的影响:长期摄入过量溴和碘可能导致甲状 腺疾病等健康问题。
2024/1/26
工业排放:如石油化工、制药等工业生产过程中产生的 含溴和碘的废气、废水。
溴和碘污染危害
对生态环境的影响:溴和碘对植物的生长具有抑制作用 ,对水生生物也有毒性作用。
22
治理措施和政策建议
2024/1/26
工业污染治理
生活垃圾焚烧:垃圾焚烧过程中产生 的氟化物。
2024/1/26
氟污染危害
对人体健康的影响:长期摄入过量氟 化物可能导致氟斑牙、氟骨症等疾病 。
对生态环境的影响:氟化物对植物的 生长具有抑制作用,对水生生物也有 毒性作用。
20
氯污染来源及危害
卤素总结与卤素间的置换

通式:X2 + H2O 通式: (X:Cl、Br、I)
写出卤素单质与氢氧化钠溶液反应的方程式
卤素原子的结构
练习: Cl、Br、 练习:写出卤素原子 F、Cl、Br、I 的 原子结构示意图。 原子结构示意图。
F
Cl
Br
I
At
思考:它们的原子结构有什么相同点和不同点? 思考:它们的原子结构有什么相同点和不同点?
卤素原子的结构
易得1个电子, 最外层7 最外层7个电子 易得1个电子,氧化性强 相同点: 相同点:
不同点: 不同点:核电荷数递增
电子层数递增 原子半径依次增大
原子得电子的能力 逐渐减弱 元素非金属性逐渐减弱 单质氧化性逐渐减弱
卤素活泼性顺序: 卤素活泼性顺序:Cl2 > Br2 > I2 原子结构 决定 元素及其单质的性质
分层,上层几乎无色, 分层,上层几乎无色, 下层红棕色, 下层红棕色,有Br2
活泼性: 活泼性:Cl2 > Br2
现象
Cl2 +2KI→2KCl +I2 Cl2 + 2I- → 2Cl- + I2 活泼性: 活泼性:Cl2 > I2
分层,上层几乎无色, 分层,上层几乎无色, 下层紫色, 下层紫色,有I2
卤素单质的化学性质
卤素原子结构的相似性,决定了单质化学性质的相似性 相似性。 卤素原子结构的相似性,决定了单质化学性质的相似性。 与金属反应, 与金属反应,生成卤化物 与氢气反应, 与氢气反应,生成卤化氢 与水反应,生成氢卤酸和次卤酸( 特例) 与水反应,生成氢卤酸和次卤酸(F2特例) 与碱反应, 与碱反应,生成卤化物与次卤酸盐等 卤素原子结构的差异性,决定了单质化学性质的差异性 卤素原子结构的差异性,决定了单质化学性质的差异性 和递变性。 和递变性。 活泼的卤素单质, 活泼的卤素单质,可以把不活泼的卤素单质从它的 盐溶液中置换出来。 盐溶液中置换出来。 卤素之间的置换反应
卤素置换反应

卤化物的卤素交换反应—— 溶剂的选择
• DMF、丙酮、四氯化碳、二硫化碳、丁酮,它 们均为非质子溶剂。 • 溶剂的选择要有利于无机卤化物在其中的溶解 度大,但生成的无机卤化物的溶解度小或几乎 不溶,这样可使卤素-卤素置换反应完全。
RCl/RBr
NaI/acetone
RI + NaCl(NaBr)
NaF、NaCl、NaBr、NaI在丙酮中的溶解度(g/100g)分别为 1.010-4,3.010-5,0.008,26;
溶剂的分类
• 属于质子极性溶剂的有:水、甲酸、甲醇、 乙醇、正丁醇、乙二醇及其单甲醚和单乙 醚等; • 属于质子非极性溶剂的有:乙酸、戊醇、 乙二醇单丁醚等; • 属于非质子极性溶剂的有:二甲基亚砜、 环丁砜、乙腈、DMF、硝基苯、N-甲基 吡咯烷酮、乙酐、丙酮等; • 属于非质子非极性溶剂的有:烃类、卤代 烃、醚类、酯类、吡啶、二硫化碳等;
RX + X' RX' + X
(X=Cl, Br, X'=I , F, )
I-可以取代Cl-、 Br-; F-也可以取代Cl-、 Br-; 这到底是逆原子量顺序,还 是顺原子量顺序呢?
卤化物的卤素交换反应机理
• 反应机理:大多属于SN2机理
离去基团
RX + X'
RX' + X
(X=Cl, Br, X'=I , F, )
高一化学卤素(PPT)5-2

(死去的)母亲:先~|考~。 【彼】代①指示代词。那;那个(跟“此”相对):~时|此起~伏|由此及~。②人称代词。对方;他:知己知~|~退 我进。 【彼岸】’名①〈书〉(江、河、湖、海的)那一边;对岸。②佛教认为有生有死的境界好比此岸,超脱生死的境界(涅槃)好比彼岸。③比喻所向 往的境界:走向幸福的~。 【彼此】代人称; 少儿作文加盟 少儿作文加盟 ;代词。①那个和这个;双方:不分~|~互助。②客套 话,表示大家一样(常叠用作答话):“您辛苦啦!”“~~!” 【彼一时,此一时】ī,ī那是一个时候,现在又是一个时候,表示时间不同,情况有了改 变:~,不要拿老眼光看新事物。 【秕】(粃)①秕子:~糠。②形(子实)不饱满:~粒|~谷子。③〈书〉恶;坏:~政。 【秕谷】名不饱满的稻谷或 谷子。 【秕糠】名秕子和糠,比喻没有价值的东西。 【秕子】?名空的或不饱满的子粒:谷~。 【笔】(筆)①名写字画图的用具:毛~|铅~|钢~| 粉~|一支~|一管~。②(写字、画画、作文的)笔法:伏~|工~|败~|曲~。③用笔写出:代~|直~|亲~。④手迹:遗~|绝~。⑤笔画:~ 顺|~形。⑥量a)用于款项或跟款项有关的:一~钱|三~账|五~生意。)用于字的笔画:“大”字有三~。)用于书画艺术:写一~好字|他能画几~ 山水画。⑦()名姓。 【笔触】名书画、文章等的笔法和格调:他用简练而鲜明的~来表现祖国壮丽的河山|他以锋利的~讽刺了旧社会的丑恶。 【笔答】 动书面回答:~试题。 【笔底生花】比喻所写的文章非常优美。也说笔下生花。参看页〖生花之笔〗。 【笔底下】?ɑ名指写文章的能力:他~不错(会写文 章)|他~来得快(写文章快)。 【笔调】名文章的格调:~清新|他用文学~写了许多科普读物。 【笔端】〈书〉名指写作、写字、画画时笔的运用以及 所表现的意境:~奇趣横生|愤激之情见于~。 【笔伐】动用文字声讨:口诛~。 【笔法】名写字、画画、作文的技巧或特色:他的字,~圆润秀美|他以 豪放的~,写出了大草原的风光。 【笔锋】名①毛笔的尖端。②书画的笔势;文章的锋芒:~苍劲|~犀利。 【笔杆儿】名笔杆子??。 【笔杆子】?名①笔 的手拿的部分。②指写文章的能力:耍~|他嘴皮子、~都比我强。‖也说笔杆儿。③指擅长写文章的人。 【笔耕】动指写作:伏案~|~不辍。 【笔供】 名受审讯者用笔写出来的供词。 【笔管条直】〈口〉笔直(多指直立着):这棵树长得~|大家~地站着等点名。 【笔画】(笔划)名①组成汉字的横 (一)、
第七节第六节 羧酸的卤置换反应

❖ 二溴异氰尿酸、Cl2O/(CF3SO2)2/POCl3
❖
用于含吸电子基苯环的氯代或溴代P19
❖ I2/HNO3 ❖ I2/NaOH ❖ I2/HgO ❖ ICl RCO2I CF3CO2I ❖ 特点:
3)制备酮的α-卤取代物
X2/Lewis酸-酸催化特点
X2/NaOH-碱催化特点
(二) 卤化氢
❖ 1.用途:由醇制备卤烃
❖
由酚制备卤代芳烃
❖
由醚制备卤烃
❖ 2.特点:光学活性醇 PCl5+DMF/diox
❖
高收率、构型反转的氯代烃
❖
(六) 特殊的卤化剂
❖ CF3SO2Cl用途和特点 ❖ 四溴环己二烯酮用途和特点
❖ 5,5-二溴代-2,2-二甲基-4,6-二羰基-1,3-二噁烷
❖ 用途和特点
2、特点
❖ 1)制备二卤化物(与不饱和烃的加成)
❖
反应活性 Cl2>Br2
❖ 立体选择性 Cl2<Br2 对向加成、同向加成
❖ 溶剂 氯仿、二硫化碳
❖ 2) 制备卤代芳烃(芳环的电取代)
❖ 催化剂 Lewis酸
❖ AlCl3 FeCl3 FeBr3 SnCl4 ZnCl2
❖
❖ l2
❖ 1 用途:由醇制备卤烃
❖
由酸制备酰氯
❖ 2.特点:
❖ 1)反应温和产物易于纯化
❖ 2)由醇制备卤烃,使用不同的溶剂,得到不同构型的产物
❖ 3)SOCl2/DMF SOCl2/HMPA-选择性的置换伯羟基 ❖ 4)SOCl2/Py
(五) 卤化磷 PCl5、 PCl3
第六节 羧酸的卤置换反应
一、羧羟基的卤置换反应-酰卤的制备 1.反应通式
卤素单质性质的递变规律课件

溴与金属反应不如氯和氟剧烈,但也能生 成高价态的金属溴化物,如溴与铁、铜等 反应生成溴化铁、溴化铜。
碘与金属反应不如溴和氯剧烈,但也能生 成高价态的金属碘化物,如碘与铁、铜等 反应生成碘化铁、碘化铜。
与氢气的反应
氟与氢气的反应
氟与氢气在低温下反应生成氟 化氢,同时放出热量。
氯与氢气的反应
氯与氢气在光照条件下反应生 成氯化氢,同时放出热量。
氟(F):气体 溴(Br):液体
氯(Cl):气体 碘(I):固体
气味
01
02
03
04
氟(F):剧毒、刺激性 气味
氯(Cl):刺激性气味
溴(Br):刺激性气味
碘(I):轻微刺激性气 味
熔沸点
01
氟(F)
-188℃/-185℃
02
氯(Cl)
-31℃/-101℃
03
溴(Br)
-7.2℃/-112℃
04
控制用量
避免直接接触皮肤和眼睛
卤素单质有毒,应避免直接接触皮肤 和眼睛,如果不慎接触,应立即用大 量清水冲洗,并及时就医。
使用卤素单质的量应严格控制,避免 大量泄漏或挥发。
泄漏处理与应急措施
疏散人员
如果发生泄漏,应立即疏散人员,并确保安 全区域内的空气流通。
吸收泄漏物
可以使用干燥的砂土或其他不燃材料吸收泄 漏的卤素单质。
将氯化物与浓盐酸共热,后用水吸收得到。
氟的实验室制备
电解氟化物如氟化钠或氟化铵,再分离得到 。
碘的实验室制备
将碘化物与浓硝酸共热,后用水吸收得到。
制备过程中的注意事项
溴、氯、碘的制备过程中需注意通风 橱的使用,防止中毒。
氟气的制备需使用特殊设备,并确保 在专业人员的指导下进行。
卤素间的置换反应PPT课件

Br2
橙 橙红
I2
紫 深紫
口诀:有机溶剂,氯离不开黄,溴离不开橙,碘离不开紫!
精选ppt课件最新
7
实验现象
加入Cl2
加入CCl4
NaBr溶液
溶液变成 浅黄色
精选ppt课件最新
分层,下层 橙红色
8
实验现象
加入Br2
加入CCl4
KI溶液
溶液变成 黄色
精选ppt课件最新
分层,下层 紫红色
9
实验现象
加入Cl2
化
Br2
性 依 次
减
I2 弱
卤素间能否发生 的置换反应?
精选ppt课件最新
4
实验设计
实验仪器
试管、胶头滴管
试剂清单
1
新制氯水(Cl2)
2
NaBr溶液
精选ppt课件最新
5
实验现象
加入Cl2
置换反应 发生了吗?
NaBr溶液
溶液变成 浅黄色
精选ppt课件最新
CCl4
6
忆一忆
溶剂 溶质
CБайду номын сангаас2
CCl4
黄绿色
Cu
强置弱规则
AgNO3
类比
Ag
还原性较弱的 金属析出
精选ppt课件最新
盐溶液
氧化性较弱的 卤素析出
12
此课件下载可自行编辑修改,供参考! 感谢您的支持,我们努力做得更好!
此课件下载可自行编辑修改,供参考! 感谢您的支持,我们努力做得更好!
选自人教版必修二《元素周期表》第二课时
卤素单质间的置换反应
精选ppt课件最新
1
忆一忆
金属活动性顺序:
卤素ppt课件

{H + O
2H2O
2
通电 点燃
2H2 + O2
2H2O
2
× √
(2)
{
高温、高压 2SO2+ O2 2SO3 催化剂 高温、高压 2SO3 2SO2+ O2 催化剂
总结
①:通式 H2+X2=2HX(X:F、Cl、Br、I) ②:从氢气和卤素单质的反应条件 黑暗→强光→高温→持续加热 及生成的气态氢化物的稳定性顺序: HF>HCl>HBr>HI 卤素单质氧化性的强弱顺序为: F2>Cl2>Br2>I2。
3.卤素和水反应
反 F2 + H2O == HF + HFO 应 2 F + 2 H O == 4HF + O 2 2 2 越 来 Cl2 + H2O == HCl + HClO 越 难 Br + H O == HBr + HBrO 2 2 以 发 I2 + H2O == HI + HIO 生
通式:X2+H2O=HX+HXO(X:Cl、Br、I)
Br
+35 2 8 18 7
I
+53 2 8 18 18 7
原子结构
决定
性质
易得一个电子,具有氧化性 得电子能力逐渐减弱 氧化性逐渐减弱
相 同 点:最外层7个电子 核电荷数递增 递变规律: 电子层数递增 原子半径依次增大
氯气的化学性质
和金属反应 2Na + Cl2 == 2NaCl
H2 + Cl2 == 2HCl
点燃 点燃
点燃
结论: ①卤素单质都能与金属反应,表现氧化性
第一章卤化反应4
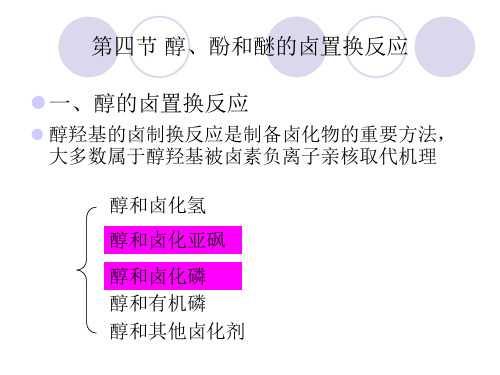
一、醇的卤置换反应
醇羟基的卤制换反应是制备卤化物的重要方法, 大多数属于醇羟基被卤素负离子亲核取代机理 醇和卤化氢 醇和卤化亚砜 醇和卤化磷 醇和有机磷 醇和其他卤化剂
第四节 醇、酚和醚的卤置换反应
1.醇和卤化氢或氢卤酸的反应
(1) 反应通式
R-OH + HX
R-X + H2O
(3)影响因素
(1)叔醇、苄醇、烯丙醇倾向于SN1机理,其它 醇大多数属于SN2反应。 (2)卤负离子亲核性顺序 HI>HBr>HCl>HF
第四节 醇、酚和醚的卤置换反应
(1)醇的碘置换反应:碘化氢具有还原性,不宜 直接使用碘化氢为碘化剂,使用KI和磷酸或多 聚磷酸
第四节 醇、酚和醚的卤置换反应
3、醇和卤化磷的反应
用三卤化磷(PCl3,PBr3)、五卤化磷(PCl5, PBr5)置换醇,比氢卤酸活性大,重排副反应少。 大多数属于SN2机理,得到构型翻转的产物
ROH + PX3 -HX
P O R
X
R-X
第四节 醇、酚和醚的卤置换反应
应用特点
①将醇转变为相应的卤代物
PhCH2CH2OH
(1)适用于甾体醇的卤置换
(PhO)3P-CH3I DMF
HO
I
(2)三苯磷和六氯代丙酮(HCA)复合物,在温和条 件下得到构型翻转产物,适用于其它方法易引起重排的 烯丙醇
第四节 醇、酚和醚的卤置换反应
二、酚的卤置换反应 酚羟基活性小,不适合使用卤化氢、卤化亚砜。 一般采用五卤化磷,或氧卤化磷,加入吡啶等 催化剂有利于反应。
CH3
PCl5或POCl3
CH3
卤素置换反应

卤族元素置换反应

卤族元素置换反应卤族元素是周期表中第17组元素,包括氟、氯、溴、碘和砹。
这些元素在化学反应中具有一定的活性,尤其是置换反应。
卤族元素置换反应是指卤族元素与其他元素或化合物发生反应,将其置换出来的过程。
卤族元素的活性主要体现在其原子结构中的外层电子。
卤族元素的外层电子结构为ns^2np^5,其中n代表能级数。
由于外层电子的不稳定性,卤族元素容易与其他元素发生反应。
在置换反应中,卤族元素可以将其外层电子提供给其他物质,完成化学键的形成或断裂。
卤族元素置换反应的典型例子是与金属发生反应。
卤素原子通过提供外层电子,与金属原子形成离子键。
例如,氯气与钠金属反应,生成氯化钠。
在这个反应中,氯原子提供一个电子给钠原子,形成氯离子和钠离子。
这种置换反应是卤族元素与金属之间的常见反应,也是工业上制取盐的重要方法。
除了与金属反应,卤族元素还可以与非金属原子或化合物发生置换反应。
例如,氯气可以与氢气反应生成盐酸。
在这个反应中,氯原子提供一个电子给氢原子,形成氯离子和氢离子。
这种置换反应是卤族元素与非金属之间的典型反应,也是工业上制取盐酸的重要方法。
卤族元素置换反应的反应性随原子序数的增加而减小,即从氟到碘的反应性逐渐降低。
这是因为原子序数的增加导致原子半径增大,外层电子离原子核的距离增加,电子和原子核的相互作用减弱。
因此,较大原子半径的卤族元素对外层电子的保护能力增强,反应性降低。
卤族元素置换反应在生活和工业中有着广泛的应用。
例如,氯化物和溴化物在水处理中用作消毒剂,能有效杀灭细菌和病毒。
此外,卤族元素还可以用于有机合成反应中,如氟化反应和氯化反应等。
尽管卤族元素置换反应在许多领域有着重要的应用,但在进行这些反应时需要注意安全问题。
卤族元素具有一定的毒性,使用时应遵循安全操作规程,防止卤素泄漏和接触。
卤族元素置换反应是卤族元素与其他元素或化合物发生的化学反应。
这些反应可以用于制取盐和盐酸等工业产品,也可以用于水处理和有机合成等领域。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.010-4,3.010-5,0.008,26;
14
卤化物的卤素交换反应—卤代烃的活 性顺序
• 由于大多数为SN2,亲核试剂是从离去基 团的背面进攻碳原子的,烷基的结构如 能对亲核试剂的接近起阻碍作用,反应 速度就会慢。所以活性顺序为:
– 伯卤烷>仲卤烷>叔卤烷。
• 而对于SN1机理的取代,活性顺序则相反:
– 叔卤烷>仲卤烷>伯卤烷。 因为决定SN1反应 速度的一步是正碳离子的形成,正碳离子越 稳定,越活跃。
15
碘化物(MI)与氯(溴)代烃(RCl(Br))的交换
• 碘化物与氯(溴)代烃的交换
– 碘代烃很活泼,常作为药物合成的中间体,某些 碘化物本身就是药物,但碘代烃往往难于通过加 成、取代等反应获得,所以通过卤素交换反应是 制备碘代烃类化合物的重要途径。
RX+ X'
RX' + X
(X=Cl, Br, X'=I , F, )
I-可以取代Cl-、 Br-;
F-也可以取代Cl-、 Br-;
这到底是逆原子量顺序,还
是顺原子量顺序呢?
2
卤化物的卤素交换反应机理
• 反应机理:大多属于SN2机理
离去基团
RX+ X'
RX' + X
(X=Cl, Br, X'=I , F, )
5
一些极性非质子溶剂
• N-甲基吡咯烷酮 • 环丁砜
6
在质子溶剂中亲核试剂的亲核性
• 卤代烷不溶于水,而亲核试剂往往是无机盐,无 机盐溶于水而不溶或几乎不溶于非极性有机溶剂 中,要使亲核取代反应在溶液中进行,常用醇或 其他溶液如丙酮中加水,使两者都能溶解。
• 在醇和水这样的质子溶剂中,亲核试剂与溶剂之 间可以形成氢键,即能发生溶剂化作用(溶剂与 分子或离子通过静电作用)。带相同电荷的原子, 体积小的亲核试剂,形成氢键的能力强,溶剂化 作用大,这样,削弱了亲核试剂与中心碳原子之 间的作用,其亲核性受到溶剂的抑制最为显著, 而象I-这样体积较大的试剂,被溶剂化较小,故表 现出强的亲核性能。
路易斯酸催化
Cl Cl
–在极性很大的溶剂(甲酸)中,伯卤代烷也 按SN1。
–在极性小的非质子性溶剂中(无水丙酮,介 电常数21)中,叔卤代烃也可按SN2进行。 (徐积功《有机化学》P166)
–如:C6H5CH2Cl水解的反应,在水中按SN1历 程,在极性较小的丙酮中则按SN2历程进行。
13
卤化物的卤素交换反应—— 溶剂的选择
1.6 其它官能团化合物的卤置换反应
• 卤化物的卤素交换反应 • 磺酸酯的卤置换反应 see • 芳香重氮盐化合物的卤置换反应 see
1
卤化物的卤素交换反应的定义
• 定义:有机卤化物与无机卤化物之间进行 卤原子交换反应,称为Finkelstein卤素交换 反应,在合成上常常利用来制备某些直接 用卤化方法难以得到的碘代烃和氟代烃.
9
卤化物的卤素交换反应— 溶剂对反应历程SN1的影响
• 过渡态的极性大于反应物,因此,极性大 的溶剂对过渡态溶剂化的力量也大于反应 物,这样溶剂化释放的能量也大,所以离 解就能很快地进行。增加溶剂的极性能够 加速卤代烷的离解,对SN1历程有利。
10
卤化物的卤素交换反应— 溶剂对反应历程SN2的影响
– 常用的无机碘化物有:碘化钠、碘化钾 – 催化剂:Lewis酸及某些金属催化剂。
16
碘化物(MI)与氯(溴)代烃(RCl(Br))的交换实例
Cl
NO2
NaI/ DMF
,15min
I NO2 [142] (70%)பைடு நூலகம்
NO2
NO2
相转移催化在芳香氟化反应中的应用
17
18
19
碘化物(MI)与氯(溴)代烃(RCl(Br))的交换实例
• 亲核试剂电荷比较集中,而过渡态的电 荷比较分散,也就是过渡态的极性不及 亲核试剂,因此,增加溶剂的极性,反 而使极性大的亲核试剂溶剂化,而对SN2 过渡态的形成不利。因此,在SN2历程中 增加溶剂的极性一般对反应不利。极性 小的溶剂对SN2有利。
11
卤化物的卤素交换反应—溶剂对反应 历程的影响的一般规律1
• DMF、丙酮、四氯化碳、二硫化碳、丁酮,它 们均为非质子溶剂。
• 溶剂的选择要有利于无机卤化物在其中的溶解 度大,但生成的无机卤化物的溶解度小或几乎 不溶,这样可使卤素-卤素置换反应完全。
R C l/R B r
N a I/a c e to n e
R I+ N a C l(N a B r)
NaF、NaCl、NaBr、NaI在丙酮中的溶解度(g/100g)分别为
7
在质子溶剂中亲核试剂的亲核性
亲核性:I->BBrr->Cl-
8
在非质子溶剂中亲核试剂的亲核性顺序
• 在非质子溶剂(DMSO,DMF)中,亲 核性为: F- > Cl- > Br- > I-.这是因 为非质子溶剂分子的负电荷裸露在 外,正电荷被掩蔽,它易溶剂化正 离子,而不易溶剂化亲核试剂负离 子。这样的负离子是“赤裸裸”的, 有较大的亲核性。亲核性即亲核试 剂与碳原子 结合的能力。F-与碳为 同周期,轨道大小相近、重叠好, F-C键能大,故在非质子溶剂中F的亲核性最大。
亲核试剂
3
卤化物的卤素交换反应——亲核 试剂的亲核能力
• 亲核试剂的亲核能力 – 在质子溶剂中,I-的亲核能力最大; – 在非质子溶剂中,F-的亲核能力最大.
RX+ X' 质子溶剂RX' + X
(X=Cl, Br, X'=I)
非质子溶剂
RX + X'
RX' + X
(X=Cl, Br, X'=F ) 4
• 一般来说,
–在极性不太弱的溶剂(如含水乙醇)中,叔 卤代烃的取代反应是按SN1历程进行。
–在极性不太强的溶剂(乙醇)中,伯卤代烃 的取代反应是按SN2进行。
–仲卤代烃的取代反应则按两种历程进行,通 常是以SN2为主。
12
卤化物的卤素交换反应—溶剂对反应历程 的影响的一般规律2
• 改变溶剂的极性和溶剂化的能力,常可 改变反应历程。
溶剂的分类
• 属于质子极性溶剂的有:水、甲酸、甲醇、 乙醇、正丁醇、乙二醇及其单甲醚和单乙 醚等;
• 属于质子非极性溶剂的有:乙酸、戊醇、 乙二醇单丁醚等;
• 属于非质子极性溶剂的有:二甲基亚砜、 环丁砜、乙腈、DMF、硝基苯、N-甲基 吡咯烷酮、乙酐、丙酮等;
• 属于非质子非极性溶剂的有:烃类、卤代 烃、醚类、酯类、吡啶、二硫化碳等;
