醇(酚)、醛、羧酸、酯及相互关系
高考化学一轮复习 第九章 有机化学基础(必考+选考)第三讲 烃的含氧衍生物课件

4.化学性质 以断键方式理解醇的化学性质(以乙醇为例):
反应 断裂的化学键
化学方程式
与活泼 金属反应
催化氧 化反应
① ①③
2CH3CH2OH+ 2Na―→2CH3CH2ONa+H2↑
2_C_H__3C_H__2O_H__+__O_2―__C△ ―_u_→_2_C_H__3C__H_O_+__2_H_2_O
官能团
—OH
结构 —OH 与链烃基相 —OH 与芳香烃 —OH 与苯环直接
特点 连
侧链相连
相连
(1)与钠反应(置换反应); 主要化 (2)取代反应;(3)消去反应; 学性质 (4)氧化反应;(5)酯化反应;
(6)脱水反应 特性 将红热的铜丝插入醇中有刺激性气
味产生(生成醛或酮)
(1)弱酸性; (2)取代反应; (3)显色反应
第九章 有机化学基础(必修2+选修5)
第三讲 烃的含氧衍生物
第九章 有机化学基础(必修2+选修5)
1.掌握醇、酚、醛、羧酸、酯的结构与性质,以及它们之间 的相互转化。 2.了解有机分子中官能团之间的相互影响。 3.了解烃的衍生物的重要应用以及合成方法。
醇酚
[知识梳理] 一、醇 1.概念 羟基与烃基或苯环侧链上的碳原子相连的化合物称为醇。饱和 一元醇的分子通式为__C_n_H__2n_+__1O__H__或 CnH2n+2O(n≥1)。
(1)1mol 汉黄芩素与足量 H2 反应,消耗 H2 的物质的量是多少? (2)1mol 汉黄芩素与足量的 NaOH 溶液反应,消耗 NaOH 的物 质的量是多少?
答案:(1)8mol (2)2mol
脂肪醇、芳香醇、酚的比较
类别
2021年高考化学总复习第十一章《有机化学基础》第34讲烃的含氧衍生物

2021年高考化学总复习第十一章《有机化学基础》第34讲烃的含氧衍生物考纲要求 1.掌握醇、酚、醛、羧酸、酯的结构与性质,以及它们之间的相互转化。
2.了解烃的衍生物合成方法。
3.了解有机分子中官能团之间的相互影响。
4.根据信息能设计有机化合物的合成路线。
1.醇、酚的概念(1)醇是羟基与烃基或苯环侧链上的碳原子相连的化合物,饱和一元醇的分子通式为C n H2n+OH(n≥1)。
1(2)酚是羟基与苯环直接相连而形成的化合物,最简单的酚为苯酚()。
(3)醇的分类(4)几种常见的醇名称甲醇乙二醇丙三醇俗称木精、木醇甘油结构简式CH3OH状态液体液体液体溶解性易溶于水和乙醇2.醇类、苯酚的物理性质(1)醇类物理性质的变化规律物理性质递变规律密度一元脂肪醇的密度一般小于1 g·cm-3沸点①直链饱和一元醇的沸点随着分子中碳原子数的递增而升高②醇分子间存在氢键,所以相对分子质量相近的醇和烷烃相比,醇的沸点远高于烷烃水溶性低级脂肪醇易溶于水,饱和一元醇的溶解度随着分子中碳原子数的递增而逐渐减小(2)苯酚的物理性质3.醇和酚的官能团及化学性质官能团主要化学性质醇—OH ①跟活泼金属Na等反应产生H2;②消去反应,分子内脱水生成烯烃;③催化氧化;④与羧酸及无机含氧酸发生酯化反应酚—OH ①弱酸性;②遇浓溴水生成白色沉淀(定性检验,定量测定);③遇FeCl3溶液呈紫色(定性检验)理解应用由断键方式理解醇的化学性质如果将醇分子中的化学键进行标号如图所示,那么醇发生化学反应时化学键的断裂情况如下所示:以1-丙醇为例,完成下列条件下的化学方程式,并指明断键部位。
(1)与Na反应________________________________,______________。
(2)催化氧化________________________________,______________。
(3)与HBr的取代________________________________,______________。
第三节烃的含氧衍生物考点(二)醛、酮-课件新高考化学一轮复习

2.最简单的酮——丙酮 (1)物理性质:无色透明的液体,沸点 56.2 ℃,易挥发,能与水、乙醇等互 溶。 (2)化学性质:丙酮不能被银氨溶液,新制的 Cu(OH)2 等弱氧化剂氧化,在 催化剂条件下,可与 H2 发生加成 反应,生成 2-丙醇,反应的方程式为
3.酮的应用 酮是重要的有机溶剂和化工原料。如丙酮可以做化学纤维等的溶剂,还用 于生产有机玻璃、农药和涂料等。 [微点拨] 酮和同碳原子数的醛属于同分异构体,如丙酮和丙醛互为同分异构体。
式
CH3COONa+Cu2O↓+3H2O
[微点拨] 乙醛与银氨溶液或者新制氢氧化铜反应均在碱性环境中,所以乙 醛被氧化后的乙酸均以羧酸盐的形式存在。
③催化氧化 乙醛在有催化剂并加热的条件下,能被氧气氧化为乙酸,反应的化学方程式
催化剂 为 2CH3CHO+O2 ―△―→ 2CH3COOH 。
[微点拨] —CHO 具有明显的还原性,能被酸性高锰酸钾溶液等强氧化剂氧 化为—COOH,故能使酸性高锰酸钾溶液褪色。
[题点全盘查] 1.判断正误(正确的打“√”,错误的打“×”)。
(1)
属于饱和一元醛
(2)乙醛是无色体,不溶于水
(3)乙醛既能发生氧化反应又能发生还原反应
(4)能发生银镜反应的有机物都属于醛类有机物
(5)甲醛常温下为气体,其水溶液可用于浸制生物标本
答案:(1)× (2)× (3)√ (4)× (5)√
⑥银镜可用稀 HNO3 浸泡洗涤除去
色沉淀,这是 Cu(OH)2 受热分解生 成 CuO 所致
【解析】
A. O
B. P
C. Mn
D. Cr
D. 自由电子受外力作用时能迅速传递能量
谢 谢观
【答案】D
醇酚和醛的结构特点及其化学性质

醇酚和醛的结构特点及其化学性质醇酚和醛是有机化合物中常见的官能团,在化学领域中具有重要的地位。
本文将介绍醇酚和醛的结构特点以及它们的化学性质,帮助读者更好地了解这两类化合物。
一、醇的结构特点及其化学性质醇是碳链上有一个或多个羟基(-OH)官能团的有机化合物。
醇的结构特点如下:1.1 羟基:醇分子中的羟基是醇分子非常重要的官能团,它使得醇具有了一系列特殊的化学性质。
羟基的存在使得醇具有了亲水性,能够与水分子发生氢键作用,形成氢键网络。
1.2 单质醇与聚合物:醇可以存在于单质状态,也可以通过缩聚反应形成聚合物。
例如,简单的醇如乙醇、丙醇等可以形成氢键网络,并在晶体中呈现规则排列;而较长的醇链则可以通过缩聚反应形成聚醚、聚酯等高分子化合物。
1.3 溶解性:醇具有良好的溶解性,特别是低分子量的醇。
醇可以与水、有机溶剂等形成氢键或其他相互作用力,从而溶解于这些溶剂中。
关于醇的化学性质,主要包括以下几个方面:2.1 与酸的反应:醇可以与酸发生酸碱反应,生成相应的酯并释放出水。
例如,乙醇与乙酸反应生成乙酸乙酯。
2.2 氧化反应:醇可以被氧化剂氧化成醛、酮等化合物。
例如,乙醇可以被氧气氧化为乙醛。
2.3 酯化反应:醇可以与酸酐反应生成酯。
醇与酸酐反应中,羟基与酸酐中的羰基发生酯化反应,生成酯。
二、醛的结构特点及其化学性质醛是碳链上含有一个羰基(C=O)官能团的有机化合物。
醛的结构特点如下:1.1 羰基:醛分子中的羰基是醛分子的主要官能团,它赋予了醛一系列特殊的性质。
羰基的极性使得醛具有较强的亲电性。
1.2 极性:醛分子中的羰基使得醛具有较强的极性,使得醛分子能够与水分子等发生亲和作用。
1.3 氧化还原性:醛是容易发生氧化还原反应的化合物。
醛作为氧化剂可以与其他物质发生氧化反应,同时它也可以被还原为醇。
关于醛的化学性质,主要包括以下几个方面:2.1 氧化反应:醛可以被氧化剂氧化为相应的羧酸,例如,乙醛可以被氧气氧化为乙酸。
高中化学有机化合物分类与命名

高中化学有机化合物分类与命名在高中化学的学习中,有机化合物是一个重要的板块。
了解有机化合物的分类与命名,对于深入理解有机化学的知识体系、掌握化学反应的规律以及进行相关的实验和研究都具有关键意义。
首先,让我们来看看有机化合物的分类。
从结构特点和官能团的角度出发,可以将有机化合物大致分为烃和烃的衍生物两大类。
烃,仅由碳和氢两种元素组成。
其中又包括烷烃、烯烃、炔烃和芳香烃。
烷烃是饱和烃,其分子中的碳原子之间都以单键相连。
比如甲烷(CH₄)、乙烷(C₂H₆)等。
烯烃含有碳碳双键,具有一定的不饱和性,像乙烯(C₂H₄)就是常见的烯烃。
炔烃则含有碳碳三键,如乙炔(C₂H₂)。
芳香烃通常具有苯环结构,比如苯(C₆H₆)。
烃的衍生物,是指烃分子中的氢原子被其他原子或原子团所取代后的产物。
常见的衍生物包括卤代烃、醇、酚、醛、酮、羧酸、酯等。
卤代烃是烃分子中的氢原子被卤素原子取代后的产物,例如氯乙烷(C₂H₅Cl)。
醇,是烃分子中的氢原子被羟基(OH)取代后的产物,像乙醇(C₂H₅OH)。
酚则是羟基直接连在苯环上形成的化合物。
醛的官能团是醛基(CHO),典型的如乙醛(CH₃CHO)。
酮的官能团是羰基(),丙酮(CH₃COCH₃)就是常见的酮。
羧酸含有羧基(COOH),乙酸(CH₃COOH)是我们熟悉的羧酸。
酯则是由羧酸和醇发生酯化反应生成的,比如乙酸乙酯(CH₃COOC₂H₅)。
接下来,我们再聊聊有机化合物的命名。
这可是个有规律可循的过程。
对于烷烃的命名,通常采用系统命名法。
第一步,选择分子中最长的碳链作为主链,根据主链所含碳原子的数目称为“某烷”。
第二步,给主链上的碳原子编号,从距离支链最近的一端开始。
第三步,将支链的名称写在主链名称的前面,在支链名称的前面用阿拉伯数字注明它在主链上所处的位置,数字与支链名称之间用短线“”隔开。
例如,C₅H₁₂有三种同分异构体,分别是正戊烷(CH₃CH₂CH₂CH₂CH₃)、异戊烷(CH₃)₂CHCH₂CH₃和新戊烷(CH₃)₄C。
醇、醚、酚和醛的结构和性质

氧化性:醛基可被氧化成羧 酸
还原性:醛基可被还原成醇
亲核加成:醛基可与亲核试 剂发生加成反应
聚合反应:某些醛可以发生 聚合反应生成高分子化合物
醇的氧化:通过醇与氧气在催化剂的作用下反应生成醛
醛的还原:醛与氢气在催化剂的作用下反应生成醇
酯的水解:酯在酸或碱的作用下水解生成相应的醇和羧酸,然后通过还原ited possibilities
汇报人:XX
01
03
05
02
04
官能团:醇羟基(-OH) 分类:伯醇、仲醇、叔醇
状态:醇类化合物多为液体,沸点 较高,易挥发
溶解性:醇类化合物易溶于水,也 易溶于有机溶剂
添加标题
添加标题
气味:具有特殊香味
添加标题
添加标题
烯烃的氧化:烯烃与氧气在催化剂的作用下反应生成环氧乙烷,再通过水解环氧乙烷生成相 应的醛
汇报人:XX
颜色:醇类化合物多为无色或淡黄 色透明液体
醇可以与金属钠反应生成氢气 醇可以发生氧化生成酮或醛 醇可以发生酯化反应生成酯和水 醇可以与羧酸发生酯化反应生成酯
发酵法:利用微生物发酵将糖 类物质转化为乙醇
合成法:通过乙烯和水在催化 剂作用下合成乙醇
干馏法:将煤隔绝空气加热, 得到焦炉气、煤焦油和焦炭等 产物,其中焦炉气中含有乙醇
醚键:由氧原 子和两个烃基 组成,键能较 高,稳定性较
好。
醚的酸性:醚分 子中氧原子具有 部分负电荷,可 以作为质子受体, 表现出一定的酸
性。
醚的氧化:醚容 易被氧化生成过 氧化物,过氧化 物不稳定易分解, 可能产生自由基
或氧气。
醚的水解:在 酸或碱催化下, 醚与水反应生 成醇和烃基卤
化物。
烃的衍生物概念乙醇醇类苯酚乙醛乙酸羧酸
四、醛类
1、醛的概念
分子由烃基跟醛基(—CHO)相连而构成的化合物
2、饱和一元醛的通式
O
CnH2nO
CnH2n+1 —C—H
3、甲醛的性质
分子式、结构简式、被氧化的特点、 物理性质、用途
一、乙酸的物理性质
有强烈刺激性气味的无色液体,沸点117.9oC,熔点16.6oC,当 温度低于16.6oC时,乙酸就凝结成冰一样的晶体,故无水乙酸又称 冰醋酸,易溶于水和乙醇。
二、乙酸的结构性质
分子式、结构式、结构简式、官能团
三、乙酸的化学性质 注意断键的位置
1、乙酸的酸性——弱酸性 电离方程式的书写、酸性强弱比较
2、乙酸的酯化反应 酸跟醇起作用,生成酯和水的反应叫做酯化反应
结合教材120面实验图和资料11面内容理解
四、羧酸
1、羧酸的概念 2、羧酸的分类 3、饱和一元羧酸的组成和结构特点 4、羧酸的重要性质
纯净的苯酚是无色晶体,有特殊气味,熔点43OC,易溶于有机 溶剂,常温下在水中溶解度不大,高于65OC时能与水以任意不互溶。
强调:苯酚有毒,对皮肤有强烈的腐蚀作用,使用时要小心。 苯酚露置于空气中会因小部分发生氧化而呈粉红色
用途:重要的化工原料、可作防腐剂和消毒剂、配成有杀菌和 止痛作用的洗剂和软膏
如与Na、K、Ca、Mg、Al等反应
2、氧化反应
(1)燃烧: 燃烧现象
(2)催化氧化: 断键位置
有机反应中的氧化反应和还原反应概念:有机化学反应中的 加氧或去氢的反应叫做氧化反应;加氢或去氧的反应叫做还原反应
3、消去反应
有机化合物在一定的条件下,从一个分子中脱去一个小分子 (如H2O、HBr等),而生成不饱和(含双键或三键)化合 物的反应,叫做——消去反应
高二化学有机化合物按官能团分类

高二化学有机化合物按官能团分类有机物可分为烯烃、醇、酚、醚、醛、酮等。
按官能团分类:醇、酚:羟基(-OH);伯醇羟基可以消除碳双键,酚羟基可以与NaOH反应产生水,与反应产生水NaHCO3.两者都能与金属钠反应产生氢气醛:醛基(-CHO);银镜反应可与斐林试剂反应氧化成羧基.加氢产生羟基.酮:基础(>C=O);它可以与氢加成形成羟基羧酸:羧基(-COOH);酸性,与NaoH反应产生水NaHCO3.反应产生二氧化碳硝基化合物:硝基(-NO2);胺:氨基(-NH2).弱碱性烯烃:双键(>C=C加成反应.炔烃:三键(-C≡C-)加成反应醚:醚键(-O-)醇羟基脱水可由醇羟基脱水形成磺酸:磺基(-)酸性,可替代浓硫酸腈:氰基(-CN)酯:酯(-COO-)羧基和羟基的水解产生,醇、酚和羧酸的反应产生注:苯环不是官能团,但苯基(-)在芳香烃中具有官能团的性质.苯基是过去的提法,但现在不认为苯基是官能团官能团:指决定化合物化学特性的原子或原子团.或称功能团.卤素原子、羟基、醛基、羧基、硝基以及不饱和烃中碳碳双键和碳碳三键都是官能团。
官能团在有机化学中起着以下五个作用.1.决定有机物的类型有机物的分类依据包括组成、碳链、官能团和同系物.烃类和烃类衍生物的分类依据不同,从以下两表可以看出.烃类分类方法:烃类衍生物分类方法:2.位置异构和类型异构产生官能团中学化学中有机物的同分异构有三种类型:碳链异构、官能团位置异构和官能团.对于类似的有机物,由于官能团的位置不同,同分异构是由官能团的位置异构引起的。
例如,以下8种氯乙烯异构反映了碳双键和氯原子的不同位置.对于相同的原子组成,形成不同的官能团,从而形成不同的有机物类别,即官能团的异构类型.例如,相同碳原子数的醛和酮、相同碳原子数的羧酸和酯都是由不同类型的异构引起的,由不同的官能团形成.3.决定一种或几种有机物的化学性质官能团决定了有机物的性质,-X、-OH、-CHO、-COOH、-NO2、-、-NH2、RCO-,这些官能团决定了卤代烃、醇或酚、醛、羧酸、硝基化合物或亚硝酸酯、磺酸、胺和酰胺的化学性质.因此,学习有机物的性质实际上是学习官能团的性质,含有官能团的有机物应具有官能团的化学性质,不含官能团的有机物不具有官能团的化学性质,这是学习有机化学时应该认识到的一点.例如,醛可以发生银镜反应,或被新的氢氧化铜悬浮浊度液氧化,可以认为这是醛的特征反应;但这不是醛的特性,而是醛的特性,因此,所有含有醛基的物质,如葡萄糖、甲酸和甲酸酯,都可以发生银镜反应,或被新制的氢氧化铜悬浮液氧化.4.影响其他基团的性质有机物分子中的基团之间存在相互影响,包括官能团对烃基的影响、烃基对官能团的影响以及含有多官能团的物质中官能团的相互影响.①醇、苯酚和羧酸的分子都含有羟基,所以氢可以通过钠释放,但由于连接的基团不同,酸性也不同.R-OH中性,不能和NaOH、反应;-OH酸性极弱,比碳酸弱,不能使指示变色,能与NaOH反应,不能反应;R-COOH弱酸性,具有酸的通性,能与酸相匹配NaOH、反应.很明显,羧酸中羧基中的碱的影响使羟基中的氢容易电离.②醛和酮都有基础(>C=O),然而,醛中的碱基碳原子与氢原子相连,酮中的氢原子与烃基相连,因此前者具有还原性,后者相对稳定,不被弱氧化剂氧化.③同一分子中的原子团也相互影响.如苯酚,-OH苯环容易取代(致活),苯基使用-OH显示酸性(即电离出H ).多羟基影响果糖中的碱基,可发生银镜反应.从上面可以看出,我们不仅可以通过有机物中所含的官能团来决定有机物的化学性质,还可以通过物质的化学性质来判断其所含的官能团.如果葡萄糖能发生银镜反应,加氢还原成六元醇,可以看出它有醛基;葡萄糖五乙酸酯可以酯化成酸,说明它有五个羟基,所以是多羟基醛.5.有机物的许多性质发生在官能团上有机化学反应主要发生在官能团上,所以要注意反应发生在什么键上,以便正确书写化学方程式.如果醛的加氢发生在醛基碳氧键上,氧化发生在醛基碳氢键上;卤代烃的替代发生在碳卤键上,消除发生在碳卤键和相邻碳原子的碳氢键上;醇的酯化是羟基中的O—H键断裂,取代就是C—O 键断裂;加聚反应是含碳双键(>C=C。
有机化学基础知识点整理醇的反应机理

有机化学基础知识点整理醇的反应机理有机化学基础知识点整理:醇的反应机理醇是有机化合物中一类重要的功能化合物,广泛应用于有机合成和生物化学领域。
在有机化学中,醇的反应机理是非常重要的基础知识点。
本文将整理并介绍一些醇的常见反应机理。
一、醇的酸碱性质醇具有碱性和酸性两种性质。
它的碱性主要表现在与强酸反应生成醇的盐,如醇与盐酸反应生成氯化醇。
而醇的酸性则体现在它与碱反应生成醇的酸盐,如醇与氢氧化钠反应生成醇酸钠。
二、醇的脱水反应醇的脱水反应是指醇分子中的羟基(–OH)与其他官能团之间发生缩合反应,形成水分子的同时生成新的化合物。
常见的醇的脱水反应有以下几种机理:1. 亲核取代机制:醇与酸催化剂反应,羟基被酸催化剂的高活性物质攻击,生成电离态的醇,再发生消除反应生成烯烃。
2. β-消除机制:醇经过脱氢生成烯氧离子,然后发生质子转移,再经过质子化生成烯烃。
3. 气相脱水机制:醇在高温下蒸馏或蒸发时,直接发生脱水生成烯烃。
三、醇的酯化反应醇与酸酐或酸反应生成酯的反应称为酯化反应。
常见的酯化反应机理有以下几种:1. 醇缩酸生成酯:醇与羧酸经过酸催化反应,羟基被羧酸攻击,氧发生脱质子,形成酯。
2. 酯缩酸生成酯:酯与羧酸经过酸催化反应,羟基被羧酸攻击,形成酯。
四、醇的氧化反应醇的氧化反应是指醇中的碳氢键被氧化剂氧化成碳氧键的反应。
常见的醇的氧化反应机理有以下几种:1. 醇的不完全氧化:醇经过氧化剂作用,羟基被氧气或氧化剂攻击,形成酚。
2. 醇的完全氧化:醇经过强氧化剂作用,羟基被氧气或氧化剂攻击,形成羧酸。
3. 醇的醛化:醇在催化剂作用下,氧发生脱质子,生成醛。
五、醇的还原反应醇的还原反应是指醇中的碳氧键或者碳碳双键被还原剂还原成碳氢键的反应。
常见的醇的还原反应有以下几种机理:1. 醇的氧还原:醇经过还原剂作用,碳氧键被还原剂还原为碳氢键。
2. 醇的烯烃还原:醇经过硫酸铜作用,水发生消除反应,生成烯烃。
六、醇的裂解反应醇的裂解反应是指醇分子中的碳氧键断裂生成烷烃或芳香烃的反应。
高中化学烃及其衍生物知识点

高中化学烃及其衍生物知识点详解一、烃的概念与分类1. 概念:烃是只含有碳和氢两种元素的有机物。
2. 分类:饱和烃(烷烃):分子中所有的碳原子都形成四个单键,如甲烷(CH₄)、乙烷(C₂H₆)等。
不饱和烃:分子中含有碳碳双键或碳碳三键的烃。
烯烃:分子中含有一个或多个碳碳双键的烃,如乙烯(C₂H₄)、丙烯(C₃H₆)等。
炔烃:分子中含有一个或多个碳碳三键的烃,如乙炔(C₂H₂)、丙炔(C₃H₄)等。
二、烃的物理性质状态:随着碳原子数的增加,烷烃由气态逐渐过渡到液态、固态。
熔沸点:随着碳原子数的增加,熔沸点逐渐升高。
溶解度:烃类都不溶于水,但易溶于有机溶剂。
三、烃的化学性质1. 取代反应:烷烃在光照条件下与卤素单质发生取代反应,生成卤代烃和卤化氢。
例如:CH₄ + Cl₂ →CH₃Cl + HCl2. 加成反应:烯烃和炔烃能与卤素单质、氢气等发生加成反应。
例如:CH₂=CH₂ + Br₂ →CH₂BrCH₂BrCH₂=CH₂ + H₂ →CH₃CH₃3. 氧化反应:烷烃在燃烧时发生氧化反应,生成二氧化碳和水。
烯烃和炔烃也能被高锰酸钾等氧化剂氧化。
例如:2CH₃CH₂CH₂CH₃ + 13O₂ →8CO₂ + 10H₂OCH₂=CH₂ + KMnO₄ →CO₂ + H₂O四、烃的衍生物烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物称为烃的衍生物。
常见的烃的衍生物包括卤代烃、醇、酚、醛、酮、羧酸、酯等。
1. 卤代烃:烃分子中的氢原子被卤素原子取代而形成的化合物。
例如:氯乙烷(CH₃CH₂Cl)、溴苯(C₆H₅Br)等。
2. 醇:烃分子中的一个或多个氢原子被羟基(-OH)取代而形成的化合物。
例如:乙醇(C₂H₅OH)、丙三醇(C₃H₈O₃)等。
3. 酚:苯环上的氢原子被羟基取代而形成的化合物。
例如:苯酚(C₆H₅OH)。
4. 醛:烃基与醛基(-CHO)相连而形成的化合物。
例如:甲醛(HCHO)、乙醛(CH₃CHO)等。
常见的官能团对应关系如

常见的官能团对应关系如:(1)卤代烃:卤原子(-X),X代表卤族元素(F,CL,Br,I);在碱性条件下可以水解生成羟基(2)醇、酚:羟基(-OH);伯醇羟基可以消去生成碳碳双键,酚羟基可以和NaOH反应生成水,与Na2CO3反应生成NaHCO3,二者都可以和金属钠反应生成氢气(3)醛:醛基(-CHO);可以发生银镜反应,可以和斐林试剂反应氧化成羧基。
与氢气加成生成羟基。
(4)酮:羰基(>C=O);可以与氢气加成生成羟基(5)羧酸:羧基(-COOH);酸性,与NaOH反应生成水,与NaHCO3、Na2CO3反应生成二氧化碳(6)硝基化合物:硝基(-NO2);(7)胺:氨基(-NH2). 弱碱性(8)烯烃:双键(>C=C<)加成反应。
(9)炔烃:三键(-C≡C-)加成反应(10)醚:醚键(-O-)可以由醇羟基脱水形成(11)磺酸:磺基(-SO3H)酸性,可由浓硫酸取代生成(12)腈:氰基(-CN)(13)酯: 酯(-COO-) 水解生成羧基与羟基,醇、酚与羧酸反应生成注: 苯环不是官能团,但在芳香烃中,苯基(C6H5-)具有官能团的性质。
苯基是过去的提法,现在都不认为苯基是官能团甲烷燃烧CH4+2O2→CO2+2H2O(条件为点燃)甲烷隔绝空气高温分解甲烷分解很复杂,以下是最终分解。
CH4→C+2H2(条件为高温高压,催化剂)甲烷和氯气发生取代反应CH4+Cl2→CH3Cl+HClCH3Cl+Cl2→CH2Cl2+HClCH2Cl2+Cl2→CHCl3+HClCHCl3+Cl2→CCl4+HCl (条件都为光照。
)实验室制甲烷CH3COONa+NaOH→Na2CO3+CH4(条件是CaO 加热)乙烯燃烧CH2=CH2+3O2→2CO2+2H2O(条件为点燃)乙烯和溴水CH2=CH2+Br2→CH2Br-CH2Br乙烯和水CH2=CH2+H20→CH3CH2OH (条件为催化剂)乙烯和氯化氢CH2=CH2+HCl→CH3-CH2Cl乙烯和氢气CH2=CH2+H2→CH3-CH3 (条件为催化剂)乙烯聚合nCH2=CH2→-[-CH2-CH2-]n- (条件为催化剂)氯乙烯聚合nCH2=CHCl→-[-CH2-CHCl-]n- (条件为催化剂)实验室制乙烯CH3CH2OH→CH2=CH2↑+H2O (条件为加热,浓H2SO4)乙炔燃烧C2H2+3O2→2CO2+H2O (条件为点燃)乙炔和溴水C2H2+2Br2→C2H2Br4乙炔和氯化氢两步反应:C2H2+HCl→C2H3Cl--------C2H3Cl+HCl→C2H4Cl2乙炔和氢气两步反应:C2H2+H2→C2H4→C2H2+2H2→C2H6 (条件为催化剂)实验室制乙炔CaC2+2H2O→Ca(OH)2+C2H2↑以食盐、水、石灰石、焦炭为原料合成聚乙烯的方程式。
烃的衍生物

(2)α-H反应:
醛、酮分子中羰基相邻的碳原子上的α-H原子,由 于受羰基的影响活性增加,易发生卤代反应及羟醛缩 合反应。
O R C CH3 + 3NaOI R O C CI3 + 3NaOH
O R C CI3 + NaOH RCOONa + CHI3
上述反应又称碘仿反应。CHI3是不溶于水的黄色晶
HgSO4 H2SO4 H2O
CH3CHO CH3CH2CHO
CH2=CH2 + CO + H2
钴催 化剂 15MPa,100~115 ℃
六、羧酸及其衍生物 1、羧酸与酯
(1)羧酸和酯的物理性质:
低级脂肪酸是液体,能溶于水,具有刺激性气味,
高级脂肪酸是蜡状固体,无味、不溶于水。芳香酸是
晶体,在水中溶解度不大。羧酸的沸点较高。低级酯
例2、卤代烃可以跟金属镁反应得到有机合成很有用 的格氏试剂: RX + Mg 无水乙醚溶剂 RMgX
R=烃基 粘稠溶液(格氏试剂)
格氏试剂可以跟醛酮的羰基起加成反应,烃基加在羰 基碳原子上,得到的镁盐水解后生成相应的醇。
OMgX RMgX + C O C R
水 解
OH H
+
C R
(2) (6分) 设计一个合成路线,实现由正丙醇制备正丁 醇,写出各步反应的条件和产物。 (3) (6分)制备3-甲基-3-己醇可以选用3种不同的格 氏试剂和3种不同的醛或酮作反应物,试写出这3对反 应物。 (1996年江苏初赛试题)
主要反应如下: 羊 (1)碱性:与强酸形成钅 盐
H R O , + R + H R O , H2O R R O , R + H+
人教版高中化学有机化学中的醇酚和醛的性质与反应

人教版高中化学有机化学中的醇酚和醛的性质与反应有机化学是高中化学中的一个重要分支,研究有机化合物的结构、性质和反应。
其中,醇酚和醛是有机化学中的两个重要的官能团,它们具有独特的性质和反应。
本文将重点介绍人教版高中化学教材中关于醇酚和醛的性质和反应方面的内容。
一、醇的性质与反应1. 醇的性质醇是具有羟基(-OH)官能团的有机化合物,其性质主要受到羟基的影响。
一般来说,醇具有以下性质:(1)醇能与无水铜(Ⅱ)硫酸发生酸碱反应,生成相应的盐。
(2)醇能与酸催化下发生脱水反应,生成烯烃。
(3)醇在碱性条件下易氧化为醛和酮。
(4)醇可以进行氧化反应,生成相应的醛和酸。
2. 醇的反应(1)醇和酸催化剂反应:醇在酸性条件下,可以发生脱水反应,生成烯烃和水。
例如,乙醇可以与浓硫酸反应,生成乙烯。
(2)醇的氧化反应:醇能够进行氧化反应,生成相应的醛和酸。
例如,乙醇在氧气或氧化剂的存在下,可以被氧化为乙醛,再氧化为乙酸。
(3)醇的酯化反应:醇可以与羧酸酐发生酯化反应,生成相应的酯。
例如,醋酸与乙醇反应,生成乙醇酯(醋酸乙酯)。
二、酚的性质与反应1. 酚的性质酚是具有羟基(-OH)官能团的芳香化合物,其性质与醇有相似之处,但也有一些不同之处。
一般来说,酚具有以下性质:(1)酚能与无水铜(Ⅱ)硫酸发生酸碱反应,生成相应的盐。
(2)酚能够与酰氯发生酰基化反应,生成相应的酚醚。
(3)酚的芳香性使其具有较强的稳定性和亲电性。
2. 酚的反应(1)酚与酸催化剂反应:酚在酸性条件下,可以发生脱水反应,生成芳香醚。
例如,苯酚可以与浓硫酸反应,生成苯醚(苯基甲醚)。
(2)酚的酰基化反应:酚可以与酰氯反应,生成相应的酚醚。
例如,苯酚与乙酰氯反应,生成乙酰苯酚。
(3)酚的氧化反应:酚也可以进行氧化反应,生成相应的醛和酸。
例如,苯酚在氧气或氧化剂的存在下,可以被氧化为苯醛,再氧化为苯甲酸。
三、醛的性质与反应1. 醛的性质醛是具有羰基(C=O)官能团的有机化合物,其性质主要受到羰基的影响。
高考化学总复习 (教材精讲+典型例题+跟踪训练):有机化合物的合成
智能考点有机化合物的合成Ⅰ.课标要求1、认识有机合成对人类的重大影响。
2、认识烃、卤代烃、醇、酚、醛、羧酸、酯的典型代表物的组成和结构特点,知道它们的相互联系。
3、举例说明烃类物质在有机合成和有机化工中的重要作用。
Ⅱ.考纲要求1、举例说明烃类物质在有机合成和有机化工中的重要作用。
2、了解烃、卤代烃、醇、酚、醛、羧酸、酯的典型代表物的组成和结构特点以及它们的相互联系。
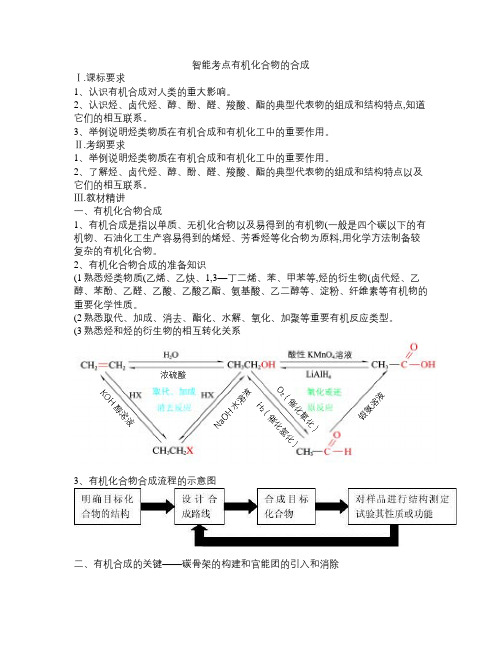
Ⅲ.教材精讲一、有机化合物合成1、有机合成是指以单质、无机化合物以及易得到的有机物(一般是四个碳以下的有机物、石油化工生产容易得到的烯烃、芳香烃等化合物为原料,用化学方法制备较复杂的有机化合物。
2、有机化合物合成的准备知识(1熟悉烃类物质(乙烯、乙炔、1,3—丁二烯、苯、甲苯等,烃的衍生物(卤代烃、乙醇、苯酚、乙醛、乙酸、乙酸乙酯、氨基酸、乙二醇等、淀粉、纤维素等有机物的重要化学性质。
(2熟悉取代、加成、消去、酯化、水解、氧化、加聚等重要有机反应类型。
(3熟悉烃和烃的衍生物的相互转化关系3、有机化合物合成流程的示意图二、有机合成的关键——碳骨架的构建和官能团的引入和消除1、碳骨架的构建:构建碳骨架是合成有机物的重要任务,包括在有机原料分子及中间化合物分子的碳骨架上增长或减短碳链、成环或开环等。
(1增长碳链的方法:常见有加聚、缩聚、酯化反应等,另外卤代烃与NaCN 在乙醇溶液的取代反应,溴乙烷和丙炔钠的反应等①CH 3CH 2Br + NaCN3CH 2CN + NaBrCH 3CH 2CN + 2H 2O CH 3CH 2COOH + NH3②CH3C CH + 2Na 2CH 3C CNa + H 2CH 3CH 2Br+NaCN + CH 3C CNa CH 3CH 2C CCH 3 + NaBr(2减短碳链的方法:烯烃、炔烃的部分氧化反应是减短碳链的有效途径,苯的同系物氧化成苯甲酸,羧酸或羧酸盐脱羧反应也使碳链减短。
CH 3COONa + NaOH 4↑+ Na 2CO 32、官能团的引入(1引入羟基:乙烯和水的加成反应,卤代烃的水解反应,醛酮的加H 2,此外,酯的水解,葡萄糖的分解反应,醛的部分氧化成羧酸、磺化反应中引入的-SO 3H 中也含的羟基等。
有机化学基础知识点整理功能团的化学性质与反应

有机化学基础知识点整理功能团的化学性质与反应有机化学基础知识点整理:功能团的化学性质与反应在有机化学中,功能团是有机分子中具有特定功能的化学官能团。
不同的功能团赋予有机分子不同的化学性质和反应特点。
本文将对常见的有机功能团进行整理,并探讨它们的化学性质和反应。
1. 羟基(-OH)羟基是醇和酚的官能团,常见于醇、酚、醚等有机物中。
它具有亲水性和碱性,可形成氢键。
羟基的化学反应包括醇的酸碱反应、醇的脱水反应、醚的加成反应等。
2. 羰基(C=O)羰基是醛、酮和羧酸的官能团。
醛和酮具有某种程度的极性,与亲核试剂发生加成反应,形成醇、酯、杂环化合物等。
羧酸具有酸性,可与碱反应生成盐和水。
3. 羧酸(-COOH)羧酸是含有羧基的有机化合物,具有强酸性。
它可与碱反应生成盐,并可参与酯化反应、酰化反应等。
羧酸的酸解离常引起酸碱中和反应,产生相应的盐和水。
4. 氨基(-NH2)氨基是胺类化合物的官能团,具有弱碱性。
氨基可以与酸发生酸碱中和反应,形成相应的盐。
氨基还能与醛或酮反应形成烯酮或亚胺。
5. 亚硝基(-NO2)亚硝基是含有-N≡O基团的有机官能团,具有强电子吸引性和电子浓缩性。
它可与亲核试剂进行加成和取代反应,生成亚硝基化合物。
亚硝基还可通过还原反应或氧化反应进行转化。
6. 氯代烷基(-Cl)氯代烷基是含有氯原子取代的有机官能团,具有较强的亲电性。
它可参与亲电取代反应、消除反应等。
氯代烷基还可通过碱催化下的消除取代反应生成烯烃。
7. 酰氯(-COCl)酰氯是羧酸与氯化物反应生成的产物,具有强亲电性和强酸性。
它可与亲核试剂发生取代反应,生成酰氯酸酯、酰氯酰胺等。
酰氯也可进一步水解生成酯、酸或醛。
8. 双键和三键(C=C,C≡C)双键和三键是含有碳碳多键的有机官能团,具有较强的反应活性。
它们可以进行加成反应、消除反应、氧化反应等。
双键还可进行环化反应,生成环化产物。
以上是常见的有机化学功能团的化学性质和反应特点的整理。
高中化学第三章烃的含氧衍生物知识点总结

学习必备欢迎下载醇酚一、认识醇和酚羟基与相连的化合物叫做醇;羟基与直接相连形成的化合物叫做酚。
二、醇的性质和应用1.醇的分类(1)根据醇分子中羟基的多少,可以将醇分为饱和一元醇的分子通式:(2)根据醇分子中羟基所连碳原子上氢原子数目的不同,可以分为2.醇的命名(系统命名法)一元醇的命名:选择含有羟基的最长碳链作为主链,把支链看作取代基,从离羟基最近的一端开始编号,按照主链所含的碳原子数目称为“某醇” ,羟基在 1 位的醇,可省去羟基的位次。
多元醇的命名:要选取含有尽可能多的带羟基的碳链作为主链,羟基的数目写在醇字的前面。
用二、三、四等数字表明3.醇的物理性质(1)状态: C1-C4是低级一元醇,是无色流动液体,比水轻。
C5-C11为油状液体,C12以上高级一元醇是无色的蜡状固体。
甲醇、乙醇、丙醇都带有酒味,丁醇开始到十一醇有不愉快的气味,二元醇和多元醇都具有甜味,故乙二醇有时称为甘醇(Glycol )。
甲醇有毒,饮用10 毫升就能使眼睛失明,再多用就有使人死亡的危险,故需注意。
(2)沸点:醇的沸点比含同数碳原子的烷烃、卤代烷。
且随着碳原子数的增多而。
(3)溶解度:低级的醇能溶于水,分子量增加溶解度就降低。
含有三个以下碳原子的一元醇,可以和水混溶。
4.乙醇的结构分子式: C2H6O结构式:结构简式: CH3CH2OH5.乙醇的性质(1)取代反应A .与金属钠反应化学方程式:化学键断裂位置:对比实验:乙醇和 Na 反应现象:水和钠反应现象:乙醚和钠反应:无明显现象结论:①②B.与 HX 反应化学方程式:断键位置:实验(教材P68 页)现象:实验注意:烧杯中加入自来水的作用:C.乙醇的分子间脱水化学方程式:化学键断裂位置:〖思考〗甲醇和乙醇的混合物与浓硫酸共热生成醚的种类分别为D .酯化反应温度计必须伸入化学方程式:断键位置:(2)消去反应化学方程式:断键位置:实验装置: ( 如图 )注:乙醇的消去反应和卤代烃的消去反应类似,都属于β-消去,即羟基的β碳原子上必须有 H 原子才能发生该反应(3)氧化反应A .燃烧点燃CH 3CH 2OH + 3O2C x H y O z+O2[ 思考 ]某饱和一元醇与氧气的混合气体,经点燃后恰好完全燃烧,反应后混合气体的密度比反应前减小了1/5,求此醇的化学式(气体体积在105℃时测定)B.催化氧化化学方程式:断键位置:说明:醇的催化氧化是羟基上的H 与α- H 脱去[ 思考 ] 下列饱和一元醇能否发生催化氧化,若能发生,写出产物的结构简式CH3OH CH 3CH3 C CH2CH CH3CH3 C OH CH 3CH3(CH2)5CH2OH CH 3A B C结论:伯醇催化氧化变成仲醇催化氧化变成叔醇C.与强氧化剂反应乙醇能使酸性KMnO 4溶液褪色三、其它常见的醇(1)甲醇结构简式:物理性质:甲醇俗称木精,能与水任意比互溶,有毒,饮用10 毫升就能使眼睛失明,再多用就有使人死亡的危险,故需注意。
有机合成课后习题答案

一、教学设计在前三节中,教科书以乙醇、苯酚、乙醛、乙酸、乙酸乙酯为例,介绍了醇、酚、醛、羧酸、酯等含氧衍生物的结构特点、物理性质、化学性质以及用途等方面的知识。
有机合成是本章的最后一节,在以往的教科书中没有专门讲解,是新增加的一节内容。
通过复习再现、资料给予、课件激发、课题探究等形式,分析有机合成过程,复习各类有机物的结构、性质、反应类型、相互转化关系。
教学时通过典型例题的分析,使学生认识到合成的有机物与人们生活的密切关系,对学生渗透热爱化学、热爱科学的教育;通过有机物逆合成法的推理,培养学生逻辑思维能力以及信息的迁移能力。
在课时分配上,建议“有机合成的过程”“逆合成分析法”各1课时。
教学重点:在掌握各类有机物的性质、反应类型、相互转化的基础上,初步学习设计合理的有机合成路线。
教学难点:初步学习逆向合成法的思维方法。
教学方案参考学生已初步掌握了烃及卤代烃、醇、酚、醛、羧酸、酯等含氧衍生物的结构、性质,为有机合成的学习奠定了理论基础。
本节教学要在帮助学生复习再现烃以及烃的衍生物结构、性质、相互转化的基础上,初步学习有机合成的过程:即目标化合物分子骨架的构建和官能团的转化。
理解有机合成遵循的基本原则,初步学会使用逆推法合理地设计出有机合成的路线。
【方案Ⅰ】复习再现,研究学习,迁移提高复习再现:复习重要的烃的衍生物的结构、性质、相互转化关系,可借助计算机课件,让学过的有机化学知识形成知识网,为合成指定结构的有机产物打下基础。
烃和烃的衍生物的相互转化以及反应类型研究学习:典型例题分析例题1教科书中“学与问”栏目中的问题解答解析:1.教科书所列举的合成药品──卡托普利,用于治疗高血压和充血性心力衰竭。
这样安排,呼应了本节开篇所讲的有机合成“甚至可以合成具有特定性质的、自然界并不存在的有机物,以满足人类的特殊需要”,以体现有机合成的重要性。
2 文献共报道了10条合成路线,其中最有价值的是以2 甲基丙烯酸为原料,通过4步反应得到目标化合物。
有机合成路线的设计与选择

有机合成路线的设计与选择专题复习——以“504医用胶”的合成为例时间:班级:一、内容分析有机合成是人教版选择性必修3《有机化学基础》第三章第五节的内容,是继醇、酚、醛、羧酸、酯、酰胺等含氧衍生物之后,通过综合应用各类有机物相互转化关系有机合成过程进行系统的分析和梳理,进一步认识各类有机物的结构、性质、反应类型、相互转化关系,进而使学生认识到合成的有机物与人们生活的密切关系,强化学生热爱化学、热爱科学的学科观念。
有机合成的关键问题有两个方面:(1)碳骨架的建构以及官能团的引入;(2)对目标物质的合成路线设计和评价。
有机合成在工业、农业和科学研究等方面都有广泛的应用,同时也是提升学生逻辑思维能力以及信息的迁移能力的载体。
医用胶是替代伤口缝合的有机高分子材料,我国主要使用的一种医用胶为504(α-氰基丙烯酸正丁酯)。
本专题以医用胶的合成线路设计为载体,结合通过对医用胶结构的分析,以官能团之间的转化关系为依据(证据),综合应用烃及其衍生物的性质等核心知识强化学生在有机合成中引入官能团、增长碳链学科思维方法,完成有机合成路线的设计,概括出有机合成路线设计的思维模型,提升基于证据推理的模型认知的化学学科核心素养,体会有机化学的价值,增强学生社会责任感。
凸显专题复习课“复习内容结构化、思维过程模型化、问题解决实际化、学科价值显性化”的基本特征和要求。
二、课标要求【内容要求】2.3 有机反应类型与有机合成:认识加成、取代、消去反应及氧化还原反应的特点和规律,了解有机反应类型和有机化合物组成结构特点的关系。
认识有机合成的关键是碳骨架的构建和官能团的转化,了解设计有机合成路线的一般方法。
体会有机合成在创造新物质、提高人类生活质量及促进社会发展方面的重要贡献。
【教学提示】进行有机合成的教学时,素材选取要兼顾目标物的应用价值和对学生思维的挑战性;活动类型要兼顾正向合成和逆向合成任务,引导学生关注结构对比、官能团转化和碳骨架构建;通过合成路线的评价活动使学生体会官能团保护、绿色设计等思想。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
乙烯、氯乙烯、苯乙烯的加聚 等
1.多元醇与多元羧酸反应生成 聚酯
2.氨基酸反应生成多肽 1.与 O2 反应 2.使 KMnO4 酸性溶液褪色的
反应 3.R—CHO 发生银镜反应或与
新制 Cu(OH)2 悬浊液的反应 1.烯、炔及其衍生物加氢 2.醛催化加氢生成醇 3.油脂的硬化
加成反应 消去反应 加聚反应 缩聚反应
有机物中不饱和碳原子跟其 他原子(或原子团)直接结 合生成新物质的反应
有机物从一个分子中脱去一 个小分子(如 H2O、HX)生 成不饱和化合物的反应 不饱和烃及其衍生物的单体 通过加成反应生成高分子化 合物 单体间相互反应生成高分 子,同时还生成小分子(如 H2O、HX 等)的反应
4.与 H2 加成
O
1.与 H2 加成生成醇
O R—C—H
—CHO
O R—C—OH
O —C—OH
O CH3CH
O CH3C—OH
—C—有 极 性 和 不 2.被氧化剂(如 O2、
饱和性
Ag(NH3)
2
、Cu(OH)2
等)氧化为酸
受 C=O 键影响, 1.具有酸的通性
O—H 键能电离出 H+ 2.酯化反应
醇(酚)、醛、羧酸、酯及相互关系
本专题是中学有机化学的核心内容,是历年高考的重点内容,重现率 100%。 其命题趋势是:(1)结合相关事件,考查主要官能团的性质;(2)将分子式、结构 简式与同分异构体的推导、书写糅合在一起;(3)创设情境,引入信息,依据官能 团的性质及相互关系组成综合性的试题。复习时要抓住“一官一代一衍变”,即官 能团对各类烃的衍生物的性质起决定作用,各类烃的衍生物的重要代表物的结构和 性质,各类烃的衍生物之间的衍变关系。在理解相关概念的基础上联点成线,联线 成网,形成知识的立体架构,通过典型题目的分析解答,归纳得出不同题型的解题 思路。
差 42,则生成 1mol 乙酸;若 A 与 B 的相对分子质量相差 84 时,则生成 2mol 乙酸。
七、七种有机反应类型
反应类型
概念
有机物中的某些原子(或原
卤代反应 子团)被卤素原子替代的反
应
取 代
酯化反应
羧酸与醇作用生成酯和水的 反应
反 应
水解反应
有机物与水反应,分解成两 种或多种物质
其他反应
1.烯烃与水加成 2.卤代烃碱性水解 3.醛基与 H2 加成 4.醛基被氧化 5.酯的水解
1.醇发生消去反应 2.被 O2 氧化 3.与羧酸的酯化 4.醇分子间的取代
醇羟基:与 Na 产生 H2,但不与 NaHCO3 产生气体 酚羟基:FeCl3 溶液, 浓溴水
—CHO
1.醇的催化氧化 2.炔烃与水的加成
一、一个知识网
二、两种活性氢 OH
1.
分子结构中氢原子活性的比较:羟基氢>邻对位上的氢>间位上的氢
2.羟基氢活性的比较: 羧基氢>酚羟基氢>水分子中的氢>醇羟基氢 三、三种基团连接方式
连接方式
举例
—OH
与苯环直接相连的是酚 不与苯环直接相连的是醇
O —C—
一边与 H 原子相连的是醛 两边都不与 H 原子相连的是酮
—COOH 1.—CHO 的氧化
2.酯、油脂的水解
O 酯化反应
—C—O—
1.与 H2 加成 2.被氧化
与醇的酯化
水解反应
银镜反应或与新制 Cu(OH)2 反应 与 NaHCO3 反应生 成 CO2
——
五、五种有机物的组成、结构和性质
类别 醇
酚
醛 羧酸 酯
通式
官能团 代表物结构
结构特点
主要化学性质
R—OH —OH
O
O
R—C—O—R′ —C—O—
O
分子中 RCO—和
CH3—C—O—C2H5 OR ′ 之间 的键 易
—
断裂
水解反应
六、六个有机计算的重要数据
1.与 H2 加成时所消耗 H2 物质的量:1mol C=C 需 1mol H2,1mol—C≡C—需
2mol H2,1mol —CHO 需 1mol H2,1mol 苯环需 3mol H2。
—OH —OH
HH
②① H—C—C—O—H
④③
HH
OH
羟基直接与链烃基 相连,O—H 键与 C—O 键均有极性
①
—OH 直接与苯环 相连
1.与活泼金属反应 产生 H2(断①)
2.消去反应(断②④) 3.催化氧化成醛(断
①③) 4.酯化反应(断①)
1.弱酸性
2.与浓溴水发生取
代反应
3.遇 FeCl3 呈紫色
八、八个规律 1.有机物溶解性规律:烃、卤代烃、酯均不溶于水;低级(即含碳原子数较
少的)醇、醛、羧酸等易溶于水,但随着碳原子数的增多,逐渐变得微溶或难溶。 如己醇、苯甲酸微溶于水,高级脂肪酸不溶于水等。
2.醇的氧化规律:与—OH 相连的 C 上有 H 原子才能被氧化,否则不能被氧
化。如 R—CH2OH 氧 化 R—CHO 氧 化 R—COOH 或 R—CH—OH 氧 化
氧原子与 H 原子相连的是羧酸 O
—C—O— 氧原子不与 H 原子相连是酯
—OH
C2H5OH O
CH3C—H
—CH3 —OH —CH2OH
O —CH
O
CH3—C—CH3
O
O
CH3C—O—H H—C—O—H
O
O
H—C—O—CH3 CH3—C—O—C2H5
四、四种官能团的引入、消除和检验 引入
消除
检验
—OH
2.1mol —CHO 完全反应时需 2mol Ag(NH3)2OH 或 2mol 新制的 Cu(OH)2,生 成 2mol Ag、1mol Cu2O。
3.2mol —OH 或 2mol —COOH 与活泼金属反应放出 1mol H2。 4.1mol —COOH 与 NaHCO3 溶液反应放出 1mol CO2。 5.1mol 一元醇与足量乙酸反应生成 1mol 酯时,其相对分子质量将增加 42; 1mol 二元醇与足量乙酸反应生成酯时,其相对分子质量将增加 84。 6.1mol 某酯 A 发生水解反应生成 B 和乙酸时,若 A 与 B 的相对分子质量相
氧化反应
有机物分子中加氧或去氢的 反应
还原反应
有机物分子中加氢或去氧的 反应
实例 1.烷烃的卤代 2.苯及其同系物的卤代 3.苯酚与浓溴水 1.酸(含无机含氧酸)与醇 2.葡萄糖与乙酸 1.酯的水解 2.卤代烃的水解 3.二糖、多糖的水解 4.蛋白质的水解 苯的硝化 醇分子间脱水成醚 1.烯烃、炔烃与 H2 加成 2.苯及苯的同系物与 H2 加成 3.醛或酮与 H2 加成 4.油脂的氢化
