空心纤维透析器临床试验
PHF透析治疗临床疗效观察

PHF透析治疗临床疗效观察摘要】目的探究带透析液输液的血液透析滤过(PHF)治疗临床疗效观察。
方法资料随机选取本院2016.1~2017.12收入100例尿毒症患者作为本次观察对象,按照入院先后顺序不同分为观察组和对照组,各50例,对照组予以常规血液透析治疗,观察组予以PHF透析治疗,对两组治疗前后生化检验值情况进行比较。
结果两组治疗前实验室各项指标比较差异无意义(P>0.05),治疗后观察组尿素氮、血肌酐、β2-微球蛋白优于对照组,两组差异有意义(P<0.05)。
结论PHF治疗模式能迅速将尿毒症患者体内中小分子物质迅速清除,提高患者耐受能力以及安全性,值得推广。
【关键词】带透析液输液的血液透析滤过;尿毒症;生活检验值;疗效观察尿毒症为肾病科常见一类疾病,临床病程时间长,随疾病进展会引起肾脏功能丧失,不能维持人体基本生理功能,临床主要表现为代谢产物潴留、水、电解质紊乱以及酸碱平衡失调等。
对该类患者治疗措施首选为血液冲洗透析,为疾病治疗重要方式,现逐渐应用于临床各类肾病治疗中,具有较好治疗效果[1]。
PHF是近些年来开展一项新型治疗模式,具有联机再现血液透析滤过优点。
PHF能有效清除人体大分子物质,相比较普通滤过透析治疗,大分子物质清除率更高,尤其为人体β2-微球蛋白,临床清除作用明显,表现出极高耐受性和安全性[2]。
本文就PHF治疗带透析液输液的临床疗效进行以下探讨,具体如下。
1 资料与方法1.1 一般资料资料随机选取本院2016.1~2017.12收入100例尿毒症患者作为本次观察对象,按照入院先后顺序不同分为观察组和对照组,各50例,纳入标准:本次试验所有患者均经过我院专业医师确诊;无严重心、肝、肾等严重原发疾病;无精神异常、抑郁症患者;治疗依从性好,能配合医护人员治疗。
排除标准:一般资料不全者;不愿参与本次研究者;存在凝血障碍者。
对照组中男30例,女20例,年龄41~71岁,平均(65.4±3.4)岁,观察组中男32例,女18例,年龄42~74岁,平均(64.3±2.4)岁,两组一般资料差异无意义(P>0.05)。
血液透析器的生物相容性研究及其临床应用现状

Bic m p t i t fHe o i l z r n i i a p ia o o o a i l y o m d a y e sa d Cl c l b i n Ap l t n ci
Y GL eg K AN in , E f
Y ANLn XUH nli i, oge
【 ywo d 】 H mo il es Di y e mb n s Bi o p t it, mo o p t it Ke r s e da z r; a z r me r e ; o m ai ly He c m ai ly y l s a c bi bi
血液透析器俗称人 工肾 ,其作用是替代 肾清 除体 内蓄积 的 2 血 液透 析膜 的 生物 相容 性
b o o a i i t n i l g c l v l a in o il ssme r n sh v e n c re t e e r h f c s s I i a e , e me r n t r l i c mp t l y a d b o o i a a u t fd ay i mb a e a eb e u r n s a c o u e . n t sp p r t mb a ema e i bi e o r h h a n l c l p i t f a y e s b o o a i l y a d b o o ia a u o f ay e s a d c i ia p l ai n o il z r, i c mp t i t n i l gc l v l ̄i n o il z r mb a e r to u e d s mma i e . n a c o d bi e d me r n swe e i r d c d a u n n rz d
一次性使用透析器临床试验报告

一次性使用透析器临床试验报告
• 临床试验报告 • (1)临床试验报告应与临床试验方案保持一致。 • (2)明确所有病例是否全部完成随访,完成随访病 例是否均纳入统(奥咨达医疗器械咨询)计,失 访病例需明确失访原因。 • (3)提交疗效评价与安全性评价统计过程中所涉及 到的原始数据。 • (4)报告所有不良事件发生的时间、原因、后果及 与试验用器械的关系,对于所采取的处理措施需 予以明确。
空心纤维透析器使用说明书

空心纤维透析器使用说明书(血仿膜)透析器主要有空心纤维组成,我们可提供透析面积不同、清除率和超滤值不同的一系列产品,性能可靠,适合于在医院或家中使用。
技术说明和数据表规格型号H1.0 H1.2 H1.4H1.6膜血仿膜MC55㎡有效面积() 1.0 1.2 1.4 1.6 膜壁厚 8.0μm膜内径200μm有效纤维长度240 mm消毒方式ETO原材料透析管血帽灌注材料O型胶环聚碳酸酯聚碳酸酯聚氨基甲酸乙酯 硅酸橡胶最大跨膜TMP: 500mmHg尺寸304mm×51mm重量(平均值)125g清除率的技术数据尿素(ml/min)164 175 184 190 肌酐(ml/min)142 150 160 166 磷酸盐(ml/min)126 138 145 148 VitB12(ml/min)44 55 63 68 超滤(ml/h.mmHg) 5.5 6.5 7.5 8.7 血室容量(ml)50 58 66 74 产品结构空心纤维透析器使用说明书(血仿膜)产品清除率曲线图用途:透析器一次性使用,仅用于治疗急慢性肾功能衰竭。
禁忌征象:在血液透析过程中,除了存在一些正常反应外,在临床治疗中还会有特殊的情况出现,故使用时应遵医嘱。
副作用:为避免产生副作用,有必要根据病人的要求和健康状况,选择合适的血液流量、超滤值和透析面积。
清洗过程按照该说明书“预充和清洗透析器”项下所述的进行,应严格观察,以避免任何过敏反应,一旦发生,应立即停止血液透析,封住血路管道,停止病人的体外血液循环,并开始正确治疗。
在这种情况下,禁止体外血液进入人体内,如病人曾有过敏反应,则必须持续地严格观察整个治疗过程。
肝素:我们建议在体外的血路管道和透析器预充过程中加入肝素,在透析期间,由主治医生来决定肝素的连续用量和使用方法。
消毒:透析器由环氧乙烷、高压蒸汽或γ射线消毒,若包装未损坏,在标签上标明的有效期内,该透析器均保持无菌、无热原。
高效液相色谱法测定血液透析器中N-甲基吡咯烷酮

高效液相色谱法测定血液透析器中N-甲基吡咯烷酮
沈永;郭利娟;薄晓文;孟凯
【期刊名称】《化学分析计量》
【年(卷),期】2022(31)2
【摘要】建立高效液相色谱法测定血液透析器中N-甲基吡咯烷酮溶出量的分析方法。
以超纯水为替代溶剂,模拟临床使用条件循环浸提5 h。
采用XSelect HSS T3柱为分析柱,乙腈–磷酸盐缓冲溶液(体积比为3∶97)为流动相洗脱,检测波长为200 nm。
N-甲基吡咯烷酮质量浓度在0.054 08~21.63 μg/mL范围内与色谱峰面积的线性关系良好,线性相关系数为0.999 9。
测定结果的相对标准偏差为
0.086%~1.332%(n=6),加标回收率为93.12%~95.13%。
该方法可测定血液透析器中N-甲基吡咯烷酮的溶出量,以评估血液透析器的安全风险。
【总页数】4页(P12-15)
【作者】沈永;郭利娟;薄晓文;孟凯
【作者单位】山东省医疗器械和药品包装检验研究院
【正文语种】中文
【中图分类】O657.7
【相关文献】
1.气相色谱法测定一次性使用空心纤维血液透析器中N-甲基吡咯烷酮在模拟临床过程中溶出量
2.在线固相萃取-高效液相色谱法测定人体尿液中的N-乙酰-S-(N-甲基甲氨酰)半胱氨酸
3.高效液相色谱法测定血液透析器中二苯基甲烷二异氰酸
酯的溶出量4.高效液相色谱法测定17AA氨基酸注射液中N-乙酰-L-半胱氨酸和N-乙酰-L-酪氨酸5.蒽在N,N-二甲基甲酰胺、N,N-二甲基乙酰胺和1-N-2-甲基吡咯烷酮中溶解度的测定与关联
因版权原因,仅展示原文概要,查看原文内容请购买。
血液透析设备相关的309例可疑医疗器械不良事件报告分析与警示

中国卫生产业CHINA HEALTHINDUSTRY[作者简介]潘芳芳(1982-),女,浙江湖州人,硕士,主管中药师,研究方向:医疗器械不良事件监测。
血液透析是急慢性肾功能衰竭患者肾脏替代治疗方式之一。
它通过将体内血液引流至体外,经一个由无数根空心纤维组成的透析器中,血液与含机体浓度相似的电解质溶液(透析液)在一根根空心纤维内外,通过弥散/对流进行物质交换,清除体内的代谢废物、维持电解质和酸碱平衡;同时清除体内过多的水分,并将经过净化的血液回输的整个过程称为血液透析。
血液透析设备主要由水处理系统、透析机、透析器、透析管路、透析液等组成,已在临床广泛使用,随着种类的增多,不良事件也随之不断增加。
该文就2011年12月—2018年12月国家药品不良反应监测系统中收集的全无锡市的血液透析设备相关的医疗器械不良事件报告进行统计、分析,以供临床安全用械以及生产企业改进产品提供参考。
1资料与方法1.1一般资料以“透析”为产品名称关键词,对在国家药品不良反应监测系统中收集的2011年12月—2018年12月全无锡市的医疗器械不良事件报告进行筛选,剔除非血液透析报告,共筛选出309例与血液透析设备相关的不良事件报告。
1.2统计方法利用Excel2010和人工筛选、整理的方法,将收集到的309例血液透析设备相关的不良事件报告作为整体样本进行分析。
对报告中的器械故障、主要伤害、事件后果进行归类、统计和分析。
2结果2.1器械故障与主要伤害对该组报告中血液透析设备各组成部分的不良事件占比、器械故障表现和主要伤害表现进行统计分析,梳理出以下汇总表,见表1。
2.2危险不良事件对该组报告按事件后果进行分类统计,其中危及生命有4例,占1.29%,需要内、外科治疗避免机体功能结构永久损伤的报告有7例,占2.26%。
以下列举危险伤DOI:10.16659/ki.1672-5654.2019.22.173血液透析设备相关的309例可疑医疗器械不良事件报告分析与警示潘芳芳无锡市药品不良反应监测中心,江苏无锡214029[摘要]为了有效利用不良事件监测数据,更好地防范和控制血液透析设备不良事件的发生,该文利用2011年12月—2018年12月收集的全无锡市的血液透析设备相关的医疗器械不良事件报告进行统计分析。
透析器企业标准

空心纤维透析器—产品企业标准1范围本标准规定了XXXXXXX有限公司生产的空心纤维透析器的分类、要求、试验方法、标志、包装、运输和贮存。
本标准适用于XXXXXX有限公司生产的空心纤维透析器,该产品配合血液透析装置供急慢性肾功能衰竭者进行血液透析。
2规范性引用文件下列文件中的条款通过本标准的引用而成为本标准的条款。
凡注日期的引用文件,其随后的修改单(不包括勘误的内容)或修订版均不适用本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。
凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T191-2000包装储运图示标志GB/T1962.2-2001注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头第2部分:锁定接头(GB/T1962.2-2001,ISO594-2:1998,IDT)GB/T2828.1计数抽样检验程序第1部分:按接收质量限(AQL)检索的逐批检验抽样计划(GB/T2828.1-2003,ISO2859-1:1999,IDT)GB/T1962.2-2001注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头第2部分:锁定接头GB/T14233.1—1998医用输液、输血、注射器具检验方法第1部分:化学分析方法GB/T16886.1医疗器械生物学评价第1部分:评价与试验(GB/T16886.1-2001,ISO 10993-1:1997,IDT)GB/T16886.4医疗器械生物学评价第4部分:与血液相互作用试验选择(GB/T16886.4-2003,ISO10993-4:2002,IDT)GB/T16886.5医疗器械生物学评价第5部分:体外细胞毒性试验(GB/T16886.5-2003,ISO10993-5:1999,IDT)GB/T16886.10医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验(GB/T 16886.10-2005,ISO10993-10:2002,IDT)GB/T16886.11医疗器械生物学评价第11部分:全身毒性试验(GB/T16886.11-1997,ISO10993-11:1993,IDT)YY0465-2003一次性使用空心纤维血浆分离器YY0053-2008心血管植入物和人工器官——血液透析器、血液透析滤过器、血液滤过器和血液浓缩器(ISO8637:2004,MOD)中华人民共和国药典2005年版ASTM F1980《Standard Guide For Accelerated Aging of sterile Medical Device Packages》3分类3.1产品型号:4.2.1结构完整性空心纤维血液透析器应无渗漏。
一次性空心纤维血液透析器

一次性空心纤维血液透析器(REGI)性能与用途透析器使用的空心纤维膜是由本公司研制并生产的聚砜类空心纤维膜(已申请中国专利)。
该膜具有较高的抗破坏性能;膜的微孔尺寸容易控制,适用范围较广;化学稳定性较高;可耐多种试剂和r射线消毒;玻璃化温度(Tg)较高,也可使用高温蒸汽消毒;膜的内外表面光滑,不易损伤血液中的有形物;易冲洗;残血小;有优良的血液相容性和抗凝血性;对肌酐,尿素等物质有优良的透过性。
由聚砜类空心纤维膜组装成的血液透析器,经环氧乙烷气体或r射线灭菌,本产品无致热原。
可用于因多种原因引起的急慢性肾功能衰竭患者的一次性医疗用品,也可用于抢救严重创伤的伤员及中毒病人。
使用方法1,血液透析器与导管的联接:自完整的包装袋内取出血液透析器,并把动脉管路,静脉管路以及滤液管路接在透析器相应的接管上。
把接好各种管道的透析器安装于透析器的夹具上。
2,用生理盐水(1000mL以上)充入器中,以清除透析器中残留环氧乙烷气体和器中和导管中的气泡。
3,用含肝素(1000IU/ML)的生理盐水将透析器和血液导管肝素化。
4,接通透析液系统(下进上出)并循环数分钟;接通动脉和静脉(血液流向自上而下)进行透析。
5,随时监察透析过程,并适时追加肝素,既要保证不发生凝血,又要避免肝素过多而引起出血。
6,透析结束后,将生理盐水(500mL)接入进血口,并逐渐把透析器内的残留血回输入体内。
使用及储存时注意事项1,使用产品前应严格检查包装袋是否破损,如有破损则禁止使用。
察看消毒日期是否在安全使用期内。
2,连接血液管道时要严格执行无菌操作,并尽快使用。
3,在预冲洗和冲洗过程中必须注意严禁空气进入透析器及血液管道,在冲洗过程中可能有液体从透析液口排出。
4,跨膜压应严格保持在66.5kPa(500mmHg)以下,不可对透析器和血液管道施加不必要的压力,以防泄露和连接部位的脱落。
5,该产品为一次性使用,用后销毁。
6,警告:请严格按照说明书的要求使用,若违反操作造成的后果,生产企业不承担任何责任。
《医疗器械分类目录》子目录10“输血、透析和体外循环器械”相关产品临床评价推荐路径
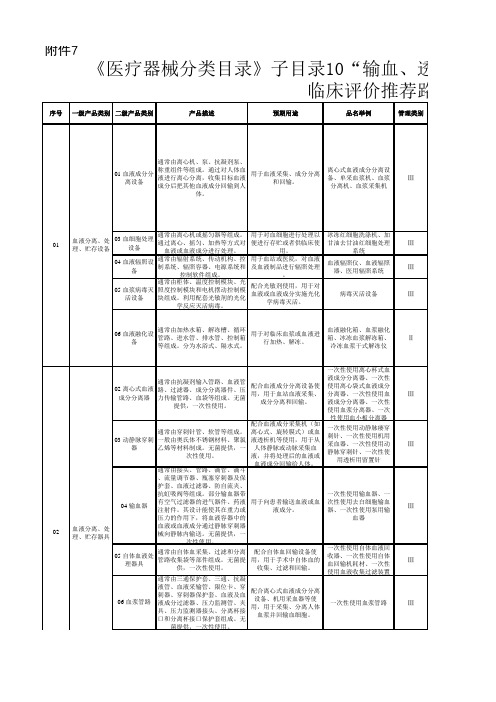
01 血液成分分离设备通常由离心机、泵、抗凝剂泵、称重组件等组成。
通过对人体血液进行离心分离,收集目标血液成分后把其他血液成分回输到人体。
用于血液采集、成分分离和回输。
离心式血液成分分离设备、单采血浆机、血浆分离机、血浆采集机Ⅲ03 血细胞处理设备通常由离心机或摇匀器等组成。
通过离心、摇匀、加热等方式对血液或血液成分进行处理。
用于对血细胞进行处理以便进行存贮或者供临床使用。
冰冻红细胞洗涤机、加甘油去甘油红细胞处理系统Ⅲ04 血液辐照设备通常由辐射系统、传动机构、控制系统、辐照容器、电源系统和控制软件组成。
用于血站或医院,对血液及血液制品进行辐照处理。
血液辐照仪、血液辐照器、医用辐照系统Ⅲ05 血浆病毒灭活设备通常由柜体、温度控制模块、光照度控制模块和电机摆动控制模块组成。
利用配套光敏剂的光化学反应灭活病毒。
配合光敏剂使用,用于对血液或血液成分实施光化学病毒灭活。
病毒灭活设备Ⅲ06 血液融化设备通常由加热水箱、解冻槽、循环管路、进水管、排水管、控制箱等组成。
分为水浴式、隔水式。
用于对临床血浆或血液进行加热、解冻。
血液融化箱、血浆融化箱、冰冻血浆解冻箱、冷冻血浆干式解冻仪Ⅱ02 离心式血液成分分离器通常由抗凝剂输入管路、血液管路、过滤器、成分分离器件、压力传输管路、血袋等组成。
无菌提供,一次性使用。
配合血液成分分离设备使用,用于血站血液采集、成分分离和回输。
一次性使用离心杯式血液成分分离器、一次性使用离心袋式血液成分分离器、一次性使用血液成分分离器、一次性使用血浆分离器、一次性使用血小板分离器Ⅲ03 动静脉穿刺器通常由穿刺针管、软管等组成。
一般由奥氏体不锈钢材料、聚氯乙烯等材料制成。
无菌提供,一次性使用。
配合血液成分采集机(如离心式、旋转膜式)或血液透析机等使用,用于从人体静脉或动脉采集血液,并将处理后的血液或血液成分回输给人体。
一次性使用动静脉瘘穿刺针、一次性使用机用采血器、一次性使用动静脉穿刺针、一次性使用透析用留置针Ⅲ04 输血器通常由接头、管路、滴管、滴斗、流量调节器、瓶塞穿刺器及保护套、血液过滤器、防自流夹、抗虹吸阀等组成。
血液透析中跨膜压监测的临床意义

中国血液净化2018年7月第17卷第7期 Chin J Blood Purif,July,2018,Vol.17,No.7
·血液净化中心管理·
血液透析中跨膜压监测的临床意义
董 斌 1 吴 丹 2 谭惠丽 2 于 颖 3 师维超 4 徐艳华 1
【摘要】本文详细分析了跨膜压变化的原因与可能造成的危害,并重点对透析机进行跨膜压监测的原 理进行论证,尤其强调对医护人员进行跨膜压监测重要性的教育,使其掌握相关预防措施,达到安全高效 透析的目的。
【Key words】Transmembrane pressure; Capacity control; Coagulation
跨膜压(transmembrane pressure,TMP)是指透 认识,根据跨膜压变化趋势及超限报警原因,及时采
析器的半透膜两侧的液体静压,为血液侧的正压与 取必要的措施,确保医疗安全。
因,导致反复报警,造成不良事件的发生 。 [2,3] 本文 线性压力降等也会对跨膜压产生影响。
将着重分析透析中跨膜压监测的原理及其临床意
跨膜压根据监测部位和监测方式不同,存在两
义,使医护人员进一步提高对跨膜压监测重要性的 套独立的定义:①透析器半透膜血液侧和透析液侧
作者单位:264200 威海 1威海威高血液净化中心 264205 威海 2威海经济技术开发区威高血液净化中心 250012 济南 3济南军区总医院,威高肾病研究中心 264210 威海 4山东威高医疗控股有限公司
心)的医护人员,对这方面问题缺乏必要的认识,往 空纤维内压力包括:血流速、纤维内阻力、血液粘滞
往不注意观察跨膜压的变化趋势。即使跨膜压超限 度、胶体渗透压、滤器血栓或气堵、静脉侧阻力等;中
触发透析机报警,也多是简单地消除报警音,未及时 空纤维外压力包括:滤液侧压力、滤过/透析液流速
国产SM160H高通量透析器有效性和安全性验证临床试验

国产SM160H高通量透析器有效性和安全性验证临床试验罗来敏;杨柳;鄢杰【期刊名称】《福建医科大学学报》【年(卷),期】2017(051)005【总页数】3页(P339-341)【关键词】肾透析;砜类;透析仪器和设备【作者】罗来敏;杨柳;鄢杰【作者单位】南昌大学第一附属医院肾内科 ,南昌 330006;南昌大学第一附属医院肾内科 ,南昌 330006;江西三鑫医疗科技股份有限公司法规注册部 ,南昌330002【正文语种】中文【中图分类】R459.5中空纤维型透析器是目前全世界广泛使用的主流透析器,透析膜是决定其性能的最关键组成部分。
从纤维素膜、铜仿膜、醋酸纤维素膜到现在广泛使用的合成膜,透析膜的发展经历了多次更新换代。
对水和溶质的高清除率以及良好的生物相容性是判断透析器性能的主要指标,聚醚砜膜透析器是目前临床上使用的性能最好的合成膜透析器之一[1-2]。
我国目前使用的聚醚砜膜高通量透析器大部分依赖进口,国内仅有少数几家企业能够生产。
三鑫医疗科技股份有限公司生产的SM160H聚醚砜膜高通量透析器尚未上市销售,为验证其在血液透析患者中使用的有效性和安全性,经国家食品药品监督管理局批准进行以下多中心临床试验,报道如下。
1.1 一般资料采用多中心、完全随机、平行对照设计,样本量按非劣性检验计算需224例,考虑到脱落率后确定为250例。
选取4家三级甲等医院血液透析中心为试验参加单位,样本量分配其中3个中心各70例(试验组和对照组各35例),1个中心40例(试验组和对照组各20例)。
250例按1∶1比例随机进入SM160H 组和B-16H组,其中SM160H组125例,男性80例,女性45例,年龄(53.6±13.5)岁(21~75岁);B-16H组125例,男性84例,女性41例,年龄(54.8±14.5)岁(20~75岁)。
本试验通过各参加单位伦理委员会审查并批准,所有受试者入组前均签署知情同意书。
透析器的分类及原理

透析器的分类及原理透析器是一种医疗设备,用于帮助肾脏功能受损的患者进行血液透析,以清除体内的废物和多余的水分。
根据其原理和结构的不同,透析器可以分为平板透析器和空心纤维透析器。
平板透析器是一种传统的透析器,由一个位于透析器内的平行安装的薄型平板组成。
这些平板上有许多微小的微孔,用于血液和透析液的交流。
当血液流经平板的一侧,废物和多余的水分通过微孔进入透析液侧,而红细胞和其他有益成分则保留在血液侧。
透析液由透析器外部一侧流过,与血液进行交换并吸收废物和多余的水分。
然后,通过透析器的另一侧,透析液排出体外。
平板透析器主要用于腹膜透析治疗。
空心纤维透析器是一种相对较新的透析器类型,由成千上万个微小的、中空的纤维组成。
这些纤维可被分为两个部分,其中一部分连接到血液供应,另一部分连接到透析液。
血液和透析液通过纤维分开流动,并通过纤维壁进行交换。
废物和多余的水分从血液侧穿过纤维壁进入透析液侧,而有益成分则保留在血液侧。
透析液在纤维壁上流动,并吸收废物和多余的水分,然后通过另一端排出。
空心纤维透析器中的纤维具有高度的微孔密度和大量表面积,因此能够更高效地进行物质交换。
空心纤维透析器通常用于血液透析治疗。
透析器的原理是利用体内和透析液之间的浓度梯度来推动废物和多余水分的交换。
在血液侧,废物、多余的水分和溶解在体内的电解质的浓度较高。
透析液侧的浓度则相对较低,使得废物和多余的水分能够顺利交换到透析液中。
这种浓度梯度的形成,是通过透析液中特定成分的配置实现的,这些成分的浓度和组成可以根据患者的个体需求进行调整,以达到理想的透析效果。
总结来说,透析器是一种用于血液透析的医疗设备。
根据其原理和结构的不同,透析器可以分为平板透析器和空心纤维透析器。
平板透析器由一个平板组成,通过微孔实现血液和透析液之间的交换。
空心纤维透析器由许多中空纤维组成,通过纤维壁实现血液和透析液之间的交换。
透析器的原理是利用浓度梯度促进废物和多余水分的交换,而透析液的浓度和组成可以根据患者的个体需求进行调整。
血液透析的历史演进

血液透析的历史演进
二、公元1940年代——临床应用之摇篮期 1943年,荷兰的Kolff医师和他的同事Berk先生合作了
旋转圆鼓式(rotating drum)人工肾脏。 他们将以制造香肠膜的赛路芬(cellophane)作为人工
肾脏的材质,利用肝素为抗凝剂。 从1943年开始,在第二次世界大战进行治疗尿毒症病
人的临床实验,经过了十几位病例的失败,直到1945 年的九月才成功救活了一位67岁急性肾衰竭的女性病 人。
血液透析的历史演进
1946年,瑞典Alwall医师发展出一种可控制 超滤过的垂直式圆鼓型人工肾脏。
1948年,Kolff医师在波士顿发展出改良型 旋转圆鼓式人工肾脏,称为Kolff-Brigham人 工肾脏。1952年应用于韩战,治疗外伤所 引起的急性肾衰竭及高钾血症。
血液透析的历史演进
1915年,美国Jay Mclean医师发现肝素 1924年
德国汉司医师(Haas)以类似Abel透析器首次 替病人做血液透析;
抗凝剂仍为水蛭素,但每次只进行15-60分钟。 但因人工肾脏材质及抗凝剂的问题无法突破, 没有得到实际的治疗效果。
血液透析的历史演进
1933年,肝素纯化制造成功,适于静脉注 射,血液透析技术才获得改善。
血液透析的历史演进
1964年,由Mion医师发明比例混合透析机, 以含醋酸盐的浓缩透析液,在床边与水混合 配置透析液。
1964年,美国的Brescia、Cimino两位医师发 表为长期血液透析另一时代进步。
血液透析的历史演进
1965年以后
到了1990年代,由于分子生物学的进步,已经 可将活体细胞或肾小管细胞植入薄膜表面,制 成生物型人工肝脏或人工肾脏,
气相色谱法测定一次性使用空心纤维血液透析器中N-甲基吡咯烷酮在模拟临床过程中溶出量

气相色谱法测定一次性使用空心纤维血液透析器中N-甲基吡咯烷酮在模拟临床过程中溶出量杨伟芳;李廷鑫;刘晓飞;张治凡;丁雪佳【摘要】建立血液透析器中N-甲基吡咯烷酮(NMP)在模拟临床试验过程中溶出量的测定方法,选择乙醇水混合溶液作为浸提模拟溶液,采用气相色谱(GC)检测.结果表明:该方法NMP的浓度在10~100μg/L范围内线性关系良好(r=0.9993),平均回收率为109.31%(RSD=1.74%,n=9).方法简单快速,重现性好,回收率高,精密度好,干扰少,定性定量准确,可用于一次性使用空心纤维血液透析器中NMP溶出量的日常监管检测.【期刊名称】《中国医疗器械信息》【年(卷),期】2018(024)007【总页数】3页(P27-29)【关键词】血液透析器;NMP;乙醇水溶液【作者】杨伟芳;李廷鑫;刘晓飞;张治凡;丁雪佳【作者单位】河南驼人医疗器械集团有限公司河南新乡 453400;河南驼人医疗器械集团有限公司河南新乡 453400;河南驼人医疗器械集团有限公司河南新乡453400;河南驼人医疗器械集团有限公司河南新乡 453400;北京化工大学北京100029【正文语种】中文【中图分类】R459.5一次性使用空心纤维血液透析器适用于急慢性肾功能衰竭的血液透析治疗,其聚砜膜多采用NMP和纯水作为溶剂和非溶剂。
聚砜可在N-甲基吡咯烷酮(N-methyl Pyrrolidone,NMP)中形成分散的、热力学稳定的均相体系,NMP含有羰基,易与水以氢键结合而完全互溶。
由成膜机制可知,聚合物溶液浸入水中,溶剂和非溶剂亲和性强,两者交换速度快,使聚合物在非溶剂中瞬时分层,可有效利用其溶解能力和扩散能力改善膜的结构和性能[1-3]。
国内外的相关报道表明,NMP被人体吸收后以消化系统作为主要靶器官,具有刺激作用及生殖毒性,可经消化道、呼吸道及皮肤吸收,损害多个脏器的毒物,在特定的环境下,会造成人体的损伤[4]。
血液透析器中空纤维体外血液相容性的评价

血液透析器中空纤维体外血液相容性的评价中国组织工程研究与临床康复74眷第382010—09—17出版JournalofClinicalRehabilitativeTissueEngineeringResearchSeptember77,2010V o1.14, No.38血液透析器中空纤维体外血液相容-I'$a9评价★许建霞,奚廷斐===!===三=j===z=二=E薹jz==譬/nvitrohemocompatibilityofhollowfiberinhemodialyzerXuJian—xia,XiTing?feiAbstractBACKGROUND:Thehollowfiberinhemodialyzerhasalarge—scaleandlong—timecontactwiththebloodoftherenaldialysispatients.Theevaluationofthehollowfiber'shemocompatibilityisveryimpo~ant OBJECTlVE:Theevaluationmethodof『力vitrohemocompatibilityofthehemodialyzerwasprimarilyestablishedbytwice evaluatinghollowfiber'shemocompatibilityjnahemodialyzer.METHoDS:Thehollowfiberofthesamplehemodialyzerwascutinto3一cmlength.and100hollowfiberswereputjntothe silicifiedglasstubeasasampleInthisexperiment.thesamplehemodialyzerwastestedtwice withtwodifferentcommerciallyavailablehemodialyzersascontrols.Thesimilarsurface—areahollowfiberofthecontroIhemodialyzerswasdisposedinthesameway.1.2mLfreshhumanbloodwasaddedintoeverysilicifiedglasstube.thenalltubeswasput ontotheslightlyslopingrotaryjncubatoral37℃androtatedatthespeedof30r/minf0r30minutesFinally,thebloodinalIsilicifiedglasstubeswasdetectedf0rbloodcelIanalysis.coagulationanalysisandserumtotaIcomplementsactivitydetermina tionrespectively.RESUL-TSANDCONCLUSlON:Differentparametersexhibitedsignificantdifferencesb etweenthesamplehollowfiberandtwocontrolhollowfibers.Buttheremarkableconsumeoffibrinogenandplateletwassimilarinthe twotests,andthe"l(parameterofsample—parameterofcontro1)l/parameterofcontroIx10O%"wasfargreaterthan15%.Sothedifieren ceonthehemocompatibility betweenthesamplehollowfiberandcontrolhollowfibersisnotacceptable.whichindicatesth attheinvitrohemocompatibility evaluationmethodhasagoodreproducibilityXuJX,XiTF.Invitrohemocompatibilityofhollowfiberinhemodialyzer.ZhongguoZuzhiG ongchengY anjiuyuLinchuangKangfu2010:14(38):7091-7094【http://en.zglckfcom】摘要背景:血液透析器中的中空纤维与肾透析患者的血液有大面积长时间的接触,对其进行血液相容性评价尤为重要.目的:通过对一种透析器中空纤维血液相容性的2次评价,拟初步建立透析器体外血液相容性评价的方法.方法:将样品透析器中的中空纤维截为3cm长,取10O根置于硅化玻璃管中,作为一个样品.两次评价试验中,选用不同的已经上市的血液透析器的中空纤维作为对照,对照中空纤维取与样品中空纤维相近表面积的数量,同样处理.每个硅化玻璃管中加入新鲜全血1.2mL,放在置于37℃隔水培养箱的略倾斜的旋转培养器七,以3Or,min的速率旋转.30min后取各硅化玻璃管中的全血,用于血细胞分析,凝血分析及血清总补体的检测.结果与结论:与两个对照透析器中空纤维相比,样品透析器中空纤维在不同指标上显示出一定差异,但样品透析器对纤维蛋白原和血小板的巨大消耗作用在2次试验中均有充分体现,且与对照参数差值的绝对值相对于对照参数的百分比远大于15%,可以认为样品透析器中空纤维与对照透析器中空纤维之间血液相容性的差异不被接受,说明实验中所使用的体外血液相容性评价方法具有很好的重现性.关键词:血液透析器;中空纤维;体外评价;方法;血液相容性doi:l0.3969~.issn.1673-8225.2010.38.015许建霞,奚廷斐.血液透析器中空纤维体外血液相容性的评价[J].中国组织工程研究与临床康复,2010,14(38):7091?7094【】0引言血液透析器中的中空纤维与.肾透析患者的血液有大面积长时间的接触,对其进行血液相容性评价具有非常重要的意义.体外血液相容性评价常用于对透析器中空纤维进行初筛,但在国内,生物材料及器械体外血液相容性评价多局限于血小板黏附,蛋白黏附,体外动态凝血时间及溶血这几方面.实验通过对一种透析器中空纤维血液相容性的两次评价,拟初步建立透析器体外血液相容性评价的方法.lSSN1673-8225CN21-1539,RcoDEN:zLKHAH1材料和方法设计:开放性实验.时间及地点:于2007—12/2008—03在中国药品生物制品检定所医疗器械检验中心完成.材料:仪器来源JT12A型数字式投影仪GH4000B型恒温隔水式培养箱himacCR21G型低温离心机,7080型生化分析仪Nationa『1nstitutefor theControIof PharmaceuticaIand BiologicalProducts, Beijing100050.China×uJian—xia-k Master,Assistant investigator,National lnstituteforthe Controfof PharmaceuticaIand BiologicalProducts, Beijing100050,Chinaxujianxia@nicpbp orgcnReceived:2010-06-09 Accepted:20104)7—16 中国药品生物制品检定所,北京市100050许建霞★,女,1976年生,山西省运城市人,汉族,2003年中国药品生物制品检定所毕业,硕士,助理研究员,主要从事医疗器械生物擘评价方面的研究xujianxia@nicpb贵阳新天光电科技有限公司中图分类号:R318 天津泰斯特仪器有限公司鐾..8225(2010)38—07091-04Hitach收稿日期:2010.0609修回日期:2010—0716(20100521003tZSY)7091W~许建霞.等血液透折器中空纤维体外m液相容性的评价实验用试剂:试剂来源血细胞分析仪用试剂凝血酶原时间,活化部分凝血活酶时间,纤维蛋白原检测试剂CH50检测试剂SysmexDadeBehringMarburgF1本和光实验方法:实验所要检测的透析器A(聚砜膜)是还未上市的产品,作为样品透析器,需要以批准上市的同类产品作为对照.试验在不同时间分2次进行,第1次以已经上市的透析器B(聚砜膜)作为对照,第2次以已经上市的透析器C(纤维素双乙酸酯膜)作为对照.锯开透析器,取出中间部分的空心纤维.用数字式投影仪检测测试透析器与对照透析器内中空纤维的直径.A,B,C血液透析器内中空纤维的直径分别为0.2931,0.3141,0.2288mm.取A血液透析器中的中空纤维,在加有生理盐水的平皿中数取1OO根.截取3cm长,用50mL的生理盐水分3次冲洗后,置于3mL的硅化玻璃采血管中作为一个样品,制备重复样5个.分别取对照B,C血液透析器中空纤维93,128根,同法处理.健康志愿者来源于中国药品生物制品检定所,抽取其肘静脉新鲜血20mL,3.8%柠檬酸钠溶液1:9抗凝.每个采血管中注入1.2mL血液,两个空的硅化玻璃采血管中加等量血液作为阴性对照.共17个硅化玻璃采血管,放在置于37℃隔水培养箱中略倾斜(约20.)的旋转培养器I,以30r/min的速率旋转.30min后取出所有硅化玻璃采血管,吸出其中的血液.部分血液用于血细胞分析,其余血液于4℃2000g离心10min后,吸取上层血浆,用凝血仪检测凝血酶原时间,活化部分凝血活酶时间,纤维蛋白原,用生化分析仪检测血清总补体活性.设计,实施,评估者:实验设计,干预实施,结果评估均为文章作者,全部经过系统培训,未使用盲法评估.统计学分析:由第一作者采用SPSS12.0进行统训'处理,采用单因素方差分析fANOV A),各总体方差相等,以P<0.05为差异有显着性意义.2结果2.1与透析器A,B的中空纤维接触后,血浆凝血酶原时间,活化部分凝血活酶时间及纤维蛋白原质量浓度的变化血液与透析器A,B中的中空纤维接触后,血浆凝血酶原时间无明显差异,而活化部分凝血活酶时间及纤维蛋白原质量浓度差异有显着性意义fP<0.o5),其中透析器A的活化部分凝血活酶时间更接近于空白对照, 7092提示透析器A优于B;而透析器B的纤维蛋白原质量浓度更接近于空白对照,提示透析器B优于A;关于纤维蛋白原质量浓度,透析器A与B之间差值的绝对值相对于透析器B的百分比为32.4%.见表1.2.2与透析器A,B的中空纤维接触后,血液白细胞,红细胞,血小板及血清总补体浓度的变化血液与透析器A,B中的中空纤维接触后,血液中的白细胞,红细胞,血小板,血清总补体浓度差异均有显着性意义fP<0.o5),其中透析器A的白细胞,红细胞,血清总补体浓度更接近于空白对照,提示透析器A优于B;而透析器B 的血小板数量更接近于空白对照,提示透析器B优于A; 关于血小板数量,透析器A与B之间差值的绝对值相对于透析器B的百分比为23-7%.见表2.表2与A.B两种透析器的中空纤维接触后,血液白细胞, 红细胞,血小板及血清总补体浓度的比较Table2ConcentrationofWBC,RBC,PLTandCH50in bloodafterCOntactedwithhollowfiberof hemodialyzersAandB}Hemodialyze(1WBC)(10RⅢBC,L)(1P0E9/LLT)(Cu,mLH50)B6.553.74.209.62325A7.093.92160.0.28.28.}Blankcontrol8.714.42279.0345WBC:whitebloodcell;RBC:redbloodcell;PLT:platelet;CH50:total hemolyticcomplemenactivity;.P<0.052.3与透析器A,C的中空纤维接触后,血浆凝血酶原时间,活化部分凝血活酶时间及纤维蛋白原质量浓度的变化血液与透析器A,C中的中空纤维接触后,血浆的凝血酶原时间,活化部分凝血活酶时间及纤维蛋白原质量浓度差异均有显着性意义f户<0.o5),其中透析器C的凝血酶原时间,纤维蛋白原质量浓度更接近于空白对照,提示透析器C优于A:而透析器A的活化部分凝血活酶时问更接近于空白对照,提示透析器A优于C;关于凝血酶原时间,纤维蛋白原质量浓度,透析器A与C之间差值的绝对值相对于透析器C的百分比分别为P.O.Box120&Shenyang110004cn.zglckf,com许建霞等血液透柝器中空纾锥体多}血液相容性酌评价 10.8%,51.5%.见表3.表3与A,C两种透析器的中空纤维接触后血浆凝血酶原时间,活化部分凝血活酶时间及纤维蛋白原质量浓度的比较Table3PTAPTTandfibrinogenofplasmaaftercontacted withhollowfiberofhemodialyzersAandCPT:prothrombintime;APTactivatedpartialthromboplastintime;.P(0.052.4与透析器A,C的中空纤维接触后,血液白细胞,红细胞,血小板及血清总补体浓度的变化血液与透析器A,C中的中空纤维接触后,血液中的白细胞数量无明显差异,而红细胞,血小板数量及血清总补体浓度差异均有显着性意义(P<0.05),其中透析器A的红细胞数量,血清总补体浓度更接近于空白对照,提示透析器A优于C;而透析器C的血小板数量更接近于空白对照,提示透析器C优于A;关于血小板数量,透析器A与C之间差值的绝对值相对于透析器C的百分比为27-7%.见表4.表4与A,C两种透析器的中空纤维接触后血液自细胞,红细胞,血小板及血清总补体浓度的比较Table4ConcentrationofWBC,RBC,PLTandCH50in bloodaftercontactedwithhollowfiberofhemodialyzersAandCHem.dialyze(1W.EB9/CL)(1ROB2C,L)(1PL9,TL)(Cu,Hm5L)C4,874.54.192.03164A5.024.74.138.833.40BlankcontroI5.35500206.0.3950llWBC:whitebloodcell;RBC:redbloodcell;PLT:platelet;CH50:total lhemolyticcomplementactivity;P<0.05I3讨论3.1对照透析器的选取实验中透析器A是还未上市的产品,而透析器B~I:IC是已经上市的产品.因为血液的不稳定,血液相容性的检测中需要设置对照组.在没有规定的特定产品或材料作为对照的情况下,选取已经上市的,没有不良事件报道的同类产品作为对照.3.2中空纤维表面积的估算中空纤维的表面积可以通过内外径来计算,但实际工作中有时很难得到内外径的具体数据.实验把中空纤维想象成一个实心的圆柱体,忽略内径对表面积的影响.用数字投影仪检测中空纤维外径,并以此来估算其表面积.实际工作中发现,通过这种方式所计算出来的样品与对照中空纤维表面|SsN1673—8225CN21—1539fRcoDEN:zLKHAH积的比例与用内外径具体数据计算出来的两者的比例基本一致.3.3血液一材料接触方式与ErlenkStter等¨用整个透析器做体外血液相容性评价的方法相比,实验中所用的血液-材料接触方式简单方便,容易操作,使整个试验过程得以流畅快速进行,缩短试验的时间,这一点对体外血液相容性试验具有很大的意义.另外样品和对照交叉进行试验更保证了两者试验条件的平行性.试验材料之外的影响因素很小,惟一试验材料外的影响因素是硅化玻璃管.硅化玻璃管本身具有良好的血液相容性,与试验用的中空纤维的表面积相比,它与血液的接触面积也相对很小.在略倾斜的旋转培养器上,以30r/min的速度旋转,这个速度可以保证血液与中空纤维是动态接触,又不至于有过大的机械力影响.作者认为在无法很好模拟血流动态的情况下,应减少机械力的影响.将硅化玻璃管保持一定的倾斜度,保证血液与中空纤维充分接触的同时,又避免了血液与硅化玻璃管及采血管胶塞额外不必要的接触.3.4检测指标实验对中空纤维的血液相容性从血细胞,凝血系统以及补体3个方面进行评价.白细胞,红细胞,血小板的浓度显示了中空纤维对血细胞的破坏作用,其中血小板是较为敏感的指标,样品与对照容易显示出统计学差异.活化部分凝血活酶时间与凝血酶原时问的不同在于前者在试剂中加了足够的活化剂,GB,_r16886.4中建议血液相容性评价中以部分凝血活酶时间作为评价指标而非活化部分凝血活酶时间,原因是加入的活化剂会掩盖检测样品对凝血系统的激活作用.但活化部分凝血活酶时间作为临床常用的检测项目,检测非常方便,又有商业化的试剂.实际工作中发现活化部分凝血活酶时间是比较敏感的指标.待试品与血液接触0.5h后,对凝血系统的激活作用越大,活化部分凝血活酶时间越长, 这可能与血浆中剩余有活性的凝血因子量有关.纤维蛋白原也是非常敏感的指标,用实验所述方法进行的中空纤维体外血液相容性评价中,通常空白对照的活化部分凝血活酶时间,凝血酶原时间最短,而纤维蛋白原最大. 补体系统激活作用的评价,通常用C3a,C5a多一些,这两个指标的检测方法多用酶联免疫法,而血清总补体活性是用生化分析仪来检测,更方便快捷客观.血清总补体活性也是较为敏感的指标,空白对照的血清总补体活性通常最大.3.5结果判定因为血液的复杂性,血液相容性的评定通常要综合所有的指标来评定.如欧盟采用了评分法J,以最后的总分数来评定待试品的血液相容性J.作者已经用这种方式对很多种已经上市的透析器中的中空纤维进行了互为对照的体外血液相容性评价,7093许建霞.等柱液透桥器中空纤维体外血液相容性的评价发现:①在这些检测指标中,活化部分凝血活酶时间,纤维蛋白原,血小板,血清总补体活性这4个指标相对比较敏感.②样品与对照会显示出统计学差异,但通常数值差别不大,样品与对照的百分比通常在85%一115%.因此,可以考虑初步使用这样的评判标准,对一个新的透析器中空纤维的评价,因对照(已经上市的同类产品)的不确定性,对结果的判定可以分为以下3种情况:①样品与对照无统计学差异.②样品与对照有统计学差异但样品优于对照.③样品与对照有统计学差异且劣于对照,但I(样品参数一对照参数)I/对照参数≤15%.如样品的所有指标均能够满足这3个条件中的任何1条,则可以认为样品的血液相容性与对照之问的差别可以接受.实验中,样品透析器A与对照透析器B相比,结果如下:①凝血酶原时间,样品与对照之间无统计学差异.②活化部分凝血活酶时问,白细胞,红细胞,血清总补体,样品与对照之间有统计学差异,样品优于对照.③纤维蛋白原,血小板,样品与对照之间有统计学差异,样品劣于对照.且I(样品参数一对照参数)l/对照参数分别为32.4%,23_7%.与对照透析器CtN比的结果如下:①白细胞,样品与对照之间无统计学差异.②活化部分凝血活酶时间,红细胞,血清总补体,样品与对照之间有统计学差异,样品优于对照.③凝血酶原时间,纤维蛋白原,血小板,样品与对照之间有统计学差异,样品劣于对照.且l(样品参数一对照参数)I,对照参数分别为10.8%,51.5%,27-7%.可以看出,与两个对照透析器相比,样品透析器在不同指标上显示出差异.但样品对纤维蛋白原和血小板的巨大消耗在2次试验中均有充分体现,且与对照参数差值的绝对值相对于对照参数的百分比远大于15%,可以认为样品透析器中空纤维与对照透析器中空纤维之7O94间血液相容性的差异不被接受.3.6不足实验中缺少对血小板激活作用的评价.如果能以某种上市的同类产品作为血液相容性评价的固定对照,则试验之间更具有可比性,结果的判定标准也可以进一步细化.另外如能将评价结果与血液透析器的临床使用情况相结合,并作对比,则更完善.4参考文献【1】EdenkS~erA.EndresP'NededofB,eta1.Though~andProgress. ArtificialOrgans.20O8:32(12):962—969.【2】SeyfertUT,BiehlVSchenkJ.Invitrohemocompatibilitytestingof biomaterialsaccordingtotheISO10993-4.Biomolecular Engineenng.2002;19:91—96P.O.Box1200,Shenyang110004crt.zglckf.,com。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
试验指标
观测两组的有效性、安全性、生物相容性、残余血量及不良反 应发生率等透析器质量相关指标及病情变化指标,以评价本产 品应用于临床的有效性和安全性。
4
Compaபைடு நூலகம்y name
总体设计与方法
实施机构
解放军第254医院 (试验机构A) 天津市人民医院 (试验机构B)
试验器械
试验组 NIPRO 对照组 Fresenius
2.经筛选符合入组条件且签订知情同意书的志愿者,根据其适用 透析面积按入选试验顺序依次给予相应的随机分配信封。试验 机构在获得密封的随机分配信件后,按患者的入组次序依次使 用,以确定每位志愿者的组别。
Company name
总体设计与方法
入组标准
1.自愿受试并签署知情同意书;
2.年龄在18-65岁,性别不限; 3.符合慢性肾衰竭诊断标准:内生肌酐清除率(Ccr)小于10ml/m in/1.73m2,糖尿病肾病Ccr小于15ml/min/1.73m2或血肌酐大于70 7umol/L; 4.病情相对稳定并符合血液透析指征的急性肾衰竭患者。
临床试验
例数要求
每组选取适用于 透析面积≤1.5m2的 入组例数不得少于 50例
随机、对照研究
评价指标
有效性 安全性 生物相容性 残余血量 不良反应发生率 病情变化等
Company name
5
总体设计与方法
试验器械
试验品
尼普洛医疗器械(合肥)有限公司生产的一次性空心 纤维透析器:ELISIO-13M、ELISIO-15M、ELISIO-17M、 ELISIO-19M、ELISIO-21M; 对照品 德国Fresenius Medical Care AG & Co.KGaA生产的 一次性空心纤维血液透析器,型号:F4HPS、F5HPS、 F6HPS、F7HPS、F8HPS、F10HPS;注册证书号码:国 食药监械(进)字2012第3452740号;
Company name
总体设计与方法
7.全身情况极差、恶性肿瘤、活动性结核、肢体缺陷或肢体血管 条件极差; 8.大手术后未过3天; 9.老年高危患者,精神病; 10.哺乳期、孕妇以及希望怀孕和有可能怀孕但本人或配偶不采取 有效的避孕措施的患者; 11.研究者认为存在肯定影响此次临床试验因素的患者; 12.3个月内参加过其他同种临床试验的患者。
Company name
总体设计与方法
剔除标准
1.试验期间加用或换用其他同类产品者;
2.使用透析器因故中断治疗,无法评价者; 3.依从性差,不能按试验方案完成试验者。
B: 天津市人民 医院 合计
脱落因素8%扩 脱落因素8%扩 脱落因素8%扩 脱落因素8%扩 104
大量)
104
大量)
大量)
104
大量)
Company name
208
总体设计与方法
随机化分组的确定
1.由北京市心肺血管疾病研究所在计算机上用EXCEL2007为每个试 验机构产生四个随机数字表,即每家试验机构适用透析面积≤1. 5m2随机数字表和适用透析面积>1.5m2随机数字表各一份,在产 生随机分配表的同时还为每个病例准备一个随机分配信件,信 封标有受试者的入组顺序编号(等同于病例报告表中的试验编 号,分别为:A-a-0××、A-b-0××、B-a-0××、B-b-0××, 其中A代表试验机构A,B代表试验机构B,a代表使用透析器面积 ≤1.5m2,b代表使用透析器面积>1.5m2)。密封的信封内纸注 明了该病例的随机号码,随机数字1-26的分配到试验组,随机 数字27-52分配到对照组。
5.肝功能:AST和ALT≤正常值上限的1.5倍,总胆红素<25mg/dl;
6.血白细胞≥3.0×109/L,血小板≥60.0×109/L,血红蛋白≥60. 0g/L;
7.能够与研究者良好交流及遵照整个试验要求。
Company name
总体设计与方法
排除标准
1.同时使用其他血液净化法并对试验的评价有影响的患者;
Company name
总体设计与方法
临床机构及病例分配
试验组病例数 试验机构 适用透析面积 适用透析面积 对照组病例数 合 适用透析面积 适用透析面积 计
≤1.5m2
A: 解放军第 24+2(考虑到
>1.5m2
24+2(考虑到
≤1.5m2
24+2(考虑到
>1.5m2
24+2(考虑到
254医院
脱落因素8%扩 脱落因素8%扩 脱落因素8%扩 脱落因素8%扩 104 大量) 24+2(考虑到 大量) 24+2(考虑到 大量) 24+2(考虑到 大量) 24+2(考虑到
2.近半个月内有急性感染性疾病; 3.反复发作低血压或高血压,且控制不良(低于90/60 mmHg或高 于200/100mmHg); 4.入选前4周以内严重活动性出血或贫血; 5.不可控制的或明显心脏病,过去6个月患有心梗、明显的充血性 心衰,明显的室上性或室性心律失常、II度以上心脏传导阻滞、 急性心肌缺血或QT间期延长; 6.合并严重心、肺、神经系统疾病、严重肝脏疾病、糖尿病酮症 酸中毒、高渗性昏迷和造血系统等严重原发疾病医师认为不适 宜纳入者;
空心纤维透析器 临床试验
2014.11
主要内容
1 2 3
4 5
2
临床试验背景 临床试验目的和内容 总体设计与方法 副作用预测及采取的措施
知情同意书
Company name
临床试验背景
空心纤维透析器是进行血液透析治疗的主要器械之一, 目前依赖血液透析治疗维持生命的肾衰竭患者逐年增加。 推广使用一次性空心纤维透析器具有重要的临床意义, 如果本试验临床验证有效,将为血液透析提供更广泛的 选择,有效提高透析充分性,改善患者的远期预后,具 有较强的社会意义。 尼普洛医疗器械(合肥)有限公司,作为尼普洛株式会 社在中国的全资子公司,于2013年开始在中国境内采用 原有技术与材料生产一次性空心纤维透析器。
3
Company name
临床试验目的和内容
ELISIO-M系列一次性空心纤维透析器,临床上可用于 急性或慢性肾衰竭患者的血液透析处理。 试验目的
旨在通过临床试验证明该产品用于人体后的安全性及有效性, 为在国内临床正式应用该产品提供依据。
试验内容
由两家临床试验机构选择适合的临床病例,随机分为试验组和 对照组,试验组使用本产品进行血液透析治疗,对照组须使用 经CFDA批准上市的同类产品进行随机对照试验。
