初中九年级(初三)化学课件 离子的形成
合集下载
九年级化学第三课离子的形成课件人教版

失去1个电子
离子: 离子:带有电荷的原子 Na 失去电子 阳离子 Cl
得到1个电子
Na是金属元素,最外层电 子层有一个电子,易失去最 外层电子。失去电子后: 质子数( ) 核外电子数(-) 质子数(+)> 核外电子数 阳离子:带正电荷的原子。( 。(如 阳离子:带正电荷的原子。(如:Na+) 所以带一个单位的正电荷 表示方法:Na+ 。(如 2、Cl非金 阴离子:带负电荷的原子。( 阴离子:带负电荷的原子。(如:Cl-) + Na 属元素,最外层电子层有七 个电子,易得到一个电子, 得到电子 达到相对稳定,得到电子后: 原子 阴离子 质子数( ) 核外电子数 ) 核外电子数( 质子数(+)<核外电子数(-) 所以带一个单位的负电荷,表 Cl示:Cl-
失去1个电子
离子: 离子:带有电荷的原子 Na 失去电子 阳离子 Cl
得到1个电子
Na是金属元素,最外层电 子层有一个电子,易失去最 外层电子。失去电子后: 质子数( ) 核外电子数(-) 质子数(+)> 核外电子数 阳离子:带正电荷的原子。( 。(如 阳离子:带正电荷的原子。(如:Na+) 所以带一个单位的正电荷 表示方法:Na+ 。(如 2、Cl非金 阴离子:带负电荷的原子。( 阴离子:带负电荷的原子。(如:Cl-) + Na 属元素,最外层电子层有七 个电子,易得到一个电子, 得到电子 达到相对稳定,得到电子后: 原子 阴离子 质子数( ) 核外电子数 ) 核外电子数( 质子数(+)<核外电子数(-) 所以带一个单位的负电荷,表 Cl示:Cl-
练习
金属元素的原子,最外层电子数目一般少于 金属元素的原子,最外层电子数目一般少于____个。在化学 个 反应中,这种原子容易______电子而变成 电子而变成______离子。非金 离子。 反应中,这种原子容易 电子而变成 离子 属元素的原子,最外层电子数一般都不少于______个。在化 属元素的原子,最外层电子数一般都不少于 个 学反应中,这种原子容易______电子,变成 电子, 离子。 学反应中,这种原子容易 电子 变成______离子。由 离子 ______、______离子相互作用而形成的化合物叫 离子相互作用而形成的化合物叫______,如 、 离子相互作用而形成的化合物叫 , ______、______。以______形成分子的化合物,叫______, 形成分子的化合物, 、 。 形成分子的化合物 , 如______、______。 、 。
人教版九年级化学上册《离子的形成》(课件)

离子 分子 原子
水
Cu Cu
氯化钠
NNaa+ Cl-
-
构成物质的微粒有:分子、原子、离子!
物质与构构成成微粒之铁间Fe 的关系:来自氦气He等原子
结合
分子 构成
分解
氧气 氢气 水等
构成
离子
NaCl 等
得到或失 去电子
课堂练习
1、下列五种微粒中最易失去电子的是,
最易A得到电子的是,原子化学E性质比较相
1、元素的原子最外层电 子数有什么特点?元素化 学性质主要决定于什么?
元素的分类 最外层电 得失电 化学性质 结论 子数 子趋势
金属元素
一般 小于4
非金属元素 稀有气体元素
一般大 于等于
4
等于8 (氦等 于2)
易失去 电子
易得到 电子
稳定结 构)
易发 生化 学反 应
难发生 化学反 应
元素的 化学性 质与原 子最外 层电子 数关系 密切
阳离子
Na+ Cl-
Cl- +17 2 8 8
阴离子
氯化钠由___氯__离__子_和__钠__离__子__构成.学.科.网
原子和离子的联系和区别:
联 系
阳离子失电子
原子 得电子
阴离子
原子中:质子数=电子数(原子不带电) 区 阳离子中:质子数>电子数(带正电) 别 阴离子中:质子数<电子数(带负电)
二、下列说法是否正确?若不正确请改正。 1、凡是最外层有8个电子的微粒,都是稀有气体元素的原子。
2、钠原子和钠离子都属于钠元素。
空白演示
在此输入您的封面副标题
初中化学课件
金戈铁骑整理制作
四、离子的形成
初中九年级(初三)化学课件 离子的形成

表示铁元素。
Fe
表示一个硫离子
这样加S你了2还-一会个做3吗你?表还示一会个表铁做示原硫子吗离子?带了2个
单位的负电荷。
3FFee3+3+
表示一个铁离子。
3S2- 表示3表个示铁3个离硫离子子
表示铁离子带3个单位的正电荷。
离子与原子的区别
原子
阳离 子
质子数与 所带 电子数 电荷
质子数=电 不带
子数
NaCl形成 合物还有氯化钾KCl、氯化镁MgCl2、、氢氧氧 化钙CaO、硫酸锌ZnSO4等。
Na 失去1个电子
) 化合物得到1个电子 Cl
Na+
阴、阳离子 相互作用
Cl-
NaCl(离子
构成物质的微粒有:分子、原子、离子!!!!
物质与构成微粒之间的关系:
单质
素同 组种 成元
元素
化合物
组不 成同
种 元 素
由______、______离子相互作用而形成的化合物叫_____4_。
得到
阴
阴
阳
离子化合物
一起练习:
答案是D,你选对了吗?
1.对于下面结构示意图所表示的微粒,说法错误 的是 [ ]
A.它们的核外电子排布相同 B.它们不是同一种元素 C.它们都具有稳定结构 D.它们都是离子
你会做了吗?
▪ Al 表示______和______. ▪ 3Al表示_____________. ▪ Al3+表示_失_失__3_个_电_子_____. ▪ 3Al3+表示_________.
电
质子数 (+)>电子 数(-)
带正 电化学性 电子 例如质源自层不稳定Na
人教版初中化学九年级上册《课题3离子:离子的形成》说课设计PPT
表示方法 联 系 相互转化 关系
第四单元课题3 离子
(三)联想反思、形成体系
单质
同种元 素组成
结合
金刚石、 汞等 氧气、 氢气、 水等 氯化钠 等
元素
具有相同核 电荷数的一 子 类原子
原
结合
分解
分子 聚集
化合物 不同种
元素组 成
得到或 失去电子
离子
结合
宏观组成 只讲种类,不讲个数。
微观构成 既讲种类,又讲个数。
第四单元课题3 离子
一、教 材 分 析
1、教材的地位、特点与作用 2、教学目标
(1)知识与技能目标:要求学生在了解原子最外层电子数与 元素化学性质的关系的基础上进一步了解离子形成的过程,认 识离子也是构成物质的一种微粒。从而培养学生从微观的角度 探究宏观物质变化的能力。 (2)方法与过程目标:要求学生学会“猜想交流、探究新知” 的学习方式。能在创设情景下,积极主动的从事各种化学活动 且探究新知,经历知识形成的全过程。 (3)情感与态度目标:通过创设情景,激发学生对微观世界 的学习兴趣,培养学生积极探索、勇于探究的学习精神;唤起 对科学的好奇与向往。初步体会物质构成的奥秘,树立“结构 决定性质”“物质的微粒性”等辨证唯物主义观点。
第四单元课题3 离子
二、教 法 学 法
1、学 情 分 析
2、教 法
依据新的教育理念我认真分析本课 教材特点和学生认知情况后,本着体现新 的教育方向和最大限度地完成教学目标的 原则,我对本课教学的采取了如下方法: 利用课件优势,充分展示NaCl的形成过 程,了解离子形成 的过程,认识离子也 是构成物质的一种微粒。
第四单元课题3 离子
二、教 法 学 法
1、学 情 分 析
初中化学九上 2.3 离子的形成 课件

要能够分清原子结构示意图、离子结构示意图 原子:核电荷数=核外电子数 离子:核电荷数≠核外电子数
3、根据右边的结构图回答:
• 如果该图表示的是原子,X值为 N_e__,该原子的符号是_10___。
• 如果该图表示的是带两个单位正 电荷的阳离子,X值为M_g_2+_,符号 是1_2___。
• 如果该图表示的是带两个单位负 电荷的阴离子,X值为_O2_-_,符号 是_8___。
3、稀有气体的原子和金属的原子、非金属的 原子最外层电子有何特点?
4、原子的化学性质是有什么决定的?
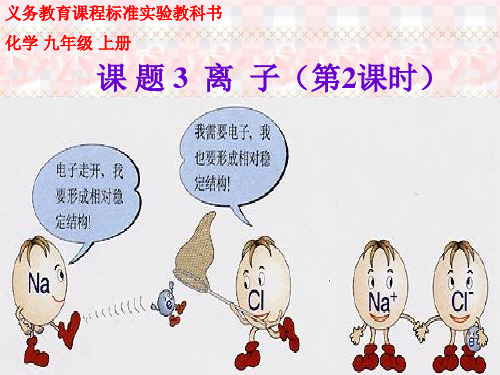
钠与氯气反应生成氯化钠的形成过程
Na
失 去
e-
Na+
e- +17 2 8 7 Cl
得 到
e-
+17 2 8 8 Cl-
Na+ Cl-
金属原子
失去电子
阳离子
Na
钠原子
失去 1个电子
Na+
钠离子
Mg
镁原子
想一想
一、离子的形成
钠原子最外层有1个
电子、氯原子最外层有
7个电子,最外层都没有
达到相对稳定结构,它
们发生化学反应时,怎
样才能达到相对稳定结
构?
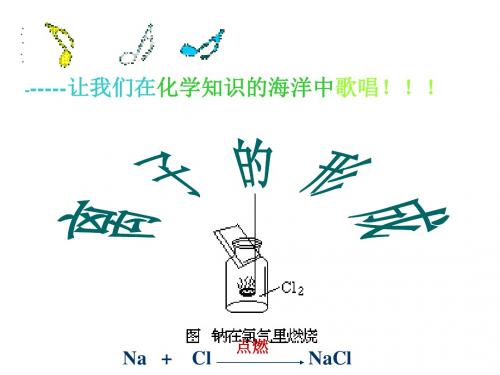
钠在氯气中燃烧
钠+氯气 加热 氯化钠
钠原子
氯原子
复习活动:
1、画出钠原子(质子数为11)原子结构示意 图并判断属于什么原子?
2、画出氯原子(质子数为17)原子结构示意 图并判断属于什么原子?
如 NaCl 是由Na+和Cl-构成的。
三、离子符号的含义
Mg2+ 镁离子,一个镁离子
Mg2+上的2表示每个镁离子带2个 单位的正电荷
九年级化学上册 第四单元 课题3《离子》离子的形成课件

12/10/2021
第一页ห้องสมุดไป่ตู้共二十二页。
知识 回 (zhī shi) 顾:
1、根据下列结构示意图判断,属于原子且容易(róngyì)
失去电子的是( ) D
+6 2 4 +13 2 8
A
B
+17 2 8 8
C
+11 2 8 1
D
12/10/2021
第二页,共二十二页。
2、下列(xiàliè)结构示意图中,表示化学性质最稳
3、离子符号的书写(shūxiě)方法以及意义。
12/10/2021
第十八页,共二十二页。
1. 在化学反应里,元素的原子结构发生变化的是( )
B
A 、质子数
B 、最外层电子(diànzǐ)数
C 、中子数
D、核电荷数
2. 某微粒的结构示意图
+13 2 8
A 下列有关说法中不正确(zhèngquè)的是 ( )
原子
第十四页,共二十二页。
得电子 失电子
阴离子
氯化钠的形成 : (xíngchéng)
钠+氯气
点燃
氯化钠
+11 2 8 1
钠原子
Na (yuánzǐ)
+11 2 8
Na 钠离子 +
12/10/2021
+17 2 8 7
氯原子
(yuánzǐ)Cl
+17 2 8 8
氯离子Cl-
第十五页,共二十二页。
NaCl
5、离子(lízǐ)化合物
像氯化钠这种由阴离子和阳离子相互作 用而形成的化合物,叫做离子化合物。 (一般(yībān)是金属与非金属结合的化合物)
内蒙古专用:人教版九年级化学《离子的形成》课件
表示铁元素。
表示一个硫离子
Fe
加这了S样2一-你个还3会你做表还吗示会?一表做个示硫铁吗离原?子子带了2个
单位的负电荷。
3FFee33+ +
表示一个铁离子。
3S2- 表示3个表铁示3个离硫子离子
表示铁离子带3个单位的正电荷。
离子与原子的区别
原子
阳离 子
质子数与 所带 电子数 电荷
质子数=电 不带
氧气
聚集
氢气
水等
结合
NaCl
、
CaO 等
小结
1、 什么是离子? 失去电子
阳离子
原子的表示和意义:在元素符号右上角写上离子所带 电荷数及所带电荷的正负。例如Mg2+、S2-
(表示一个离子,也告诉我们带什么单位的电荷及多少电荷)
3、离子和原子的区别与联系:
4、物质与构成微粒之间的关系:
失去1个电子
Na
Na+
得到1个电子
Cl
Cl-
阴、阳离子 相互作用
NaCl(离子化合物)
构成物质的微粒有:分子、原子、离子!!!!
物质与构成微粒之间的关系:
单质
素同 组种 成元
化合物
不
组 成
同 种 元
素
元素
具 的有 一相 类同 原质 子子
数
结合
原
结合
子 分解
分子
去 电 子
得 到 或 失
离子
硫S、铁Fe 等
__阴____、_阳_____离子相互作用而形成的化合物叫_离_子__化_合_。物
一起练习:
答案是D,你选 对了吗?
1.对于下面结构示意图所表示的微粒,
九年级化学上册 第四单元《离子》课件

课题 3 离子 (kètí)
第一页,共十七页。
核外电子(héwài diàn zǐ)分层排布示 意图
第二页,共十七页。
一、核外电子 的排布 (hé wài diàn zǐ)
1、核外电子(hé wài diàn zǐ)是分层排布的
电子层:1 2 3 4 5 6 7
离 核:近
远
能 量:低
高
能量低的在离核近的区域运动.
No 原子叫阴离子。(1)书写在元素符号的右上角标明离子所带的电荷。(数字在前,符号在后)。如NaCl、MgO、NaF
等
Image
12/10/2021
第十七页,共十七页。
非金属元 一般多于等于 易得电子,形成 不稳定
素
4个
阴离子
决定元素化学性质的是:最外层(wài 电子 cénɡ) 数
第七页,共十七页。
相对(xiāngduì)稳定结构:最外层有8个电子 (第一层为最外层有2个电子)的结构 稀有气体元素的原子最外层达到稳定结构(jiégòu), 性质稳定。
金属元素的原子(yuánzǐ)的最外层电子数一般少于4
点燃(化
qì)
钠与氯气反应(fǎnyìng)形成氯化钠
由原子变成离子或由离子变成原子的变化是化学变化
第十四页,共十七页。
离子与原子的区别(qūbié)和联系
第十五页,共十七页。
物质(wùzhì)与其构成粒子间的关系
第十六页,共十七页。
内容(nèiróng)总结
课题3 离子。课题3 离子。最外层最多容纳8个电子。(2)排布时能量低离核近,能量高离核远。质子数(核 电荷数)。3、元素性质与元素最外层电子数的关系。8个(He为2个)。稀有气体元素的原子最外层达到稳定结构,性 质稳定。1、离子:带电(dài diàn)的原子或原子团叫离子。阳离子:带正电荷的原子叫阳离子。阴离子:带负电荷的
第一页,共十七页。
核外电子(héwài diàn zǐ)分层排布示 意图
第二页,共十七页。
一、核外电子 的排布 (hé wài diàn zǐ)
1、核外电子(hé wài diàn zǐ)是分层排布的
电子层:1 2 3 4 5 6 7
离 核:近
远
能 量:低
高
能量低的在离核近的区域运动.
No 原子叫阴离子。(1)书写在元素符号的右上角标明离子所带的电荷。(数字在前,符号在后)。如NaCl、MgO、NaF
等
Image
12/10/2021
第十七页,共十七页。
非金属元 一般多于等于 易得电子,形成 不稳定
素
4个
阴离子
决定元素化学性质的是:最外层(wài 电子 cénɡ) 数
第七页,共十七页。
相对(xiāngduì)稳定结构:最外层有8个电子 (第一层为最外层有2个电子)的结构 稀有气体元素的原子最外层达到稳定结构(jiégòu), 性质稳定。
金属元素的原子(yuánzǐ)的最外层电子数一般少于4
点燃(化
qì)
钠与氯气反应(fǎnyìng)形成氯化钠
由原子变成离子或由离子变成原子的变化是化学变化
第十四页,共十七页。
离子与原子的区别(qūbié)和联系
第十五页,共十七页。
物质(wùzhì)与其构成粒子间的关系
第十六页,共十七页。
内容(nèiróng)总结
课题3 离子。课题3 离子。最外层最多容纳8个电子。(2)排布时能量低离核近,能量高离核远。质子数(核 电荷数)。3、元素性质与元素最外层电子数的关系。8个(He为2个)。稀有气体元素的原子最外层达到稳定结构,性 质稳定。1、离子:带电(dài diàn)的原子或原子团叫离子。阳离子:带正电荷的原子叫阳离子。阴离子:带负电荷的
沪教版九年级化学全册(全国版)《离子》课件(共27张PPT)

表示2个镁离子
练习:说出下符号的意义
一个硫离子
S2- 一个硫离子带了2个负电荷 3S2- 表示3个硫离子
练习:下列离子符号的意义
Na+
Mg2+
3Al3+
O2-
F-
3Ca2+
原子中: 核电荷数 =质子数 核=外电子数 阳离子: 核电荷数 =质子数 核>外电子数 阴离子: 核电荷数 =质子数 核<外电子数
二、离子的形成小结
1.离子的概念:带电荷的原子(或原子团)
2.阴离子:带负电荷的原子叫做阴离子。 如: O2- 、S2-、 F- 、Cl-、 阳离子:带正电荷的原子叫做阳离子。 如: H+ 、Na+、 Mg2+ 、Al3+
3.离子符号的书写:先写元素或原子团,再 把带电量标到右上角(数前号后1不写)例 :氢离子 硅离子 碳酸根离子 3个硫酸根 离子 4.离子所带电荷数由该元素原子的最外层电 子数决定。
离子——带电荷的原子或原子团
阳离子——带正电荷的原子或原子团
Na+ Ca2+ Mg2+ Al3+ H+ NH4+
阴离子——带负电荷的原子或原子团
Cl- O2- F- OH- SO42- NO3- CO32-
常见的离子
请思考如下问题
Na变成Na+有哪些变化?Cl变成Cl? 1、最外层电子数一定改变 。
A 、①② B、②③ C、①②④ D、②③④
28
B
+9 2 8
4、写出下列微粒的质子数和电子数
项目 Na 质子数 11
电子数 11
Na+ S2- Ne H2O NH4+ OH-
练习:说出下符号的意义
一个硫离子
S2- 一个硫离子带了2个负电荷 3S2- 表示3个硫离子
练习:下列离子符号的意义
Na+
Mg2+
3Al3+
O2-
F-
3Ca2+
原子中: 核电荷数 =质子数 核=外电子数 阳离子: 核电荷数 =质子数 核>外电子数 阴离子: 核电荷数 =质子数 核<外电子数
二、离子的形成小结
1.离子的概念:带电荷的原子(或原子团)
2.阴离子:带负电荷的原子叫做阴离子。 如: O2- 、S2-、 F- 、Cl-、 阳离子:带正电荷的原子叫做阳离子。 如: H+ 、Na+、 Mg2+ 、Al3+
3.离子符号的书写:先写元素或原子团,再 把带电量标到右上角(数前号后1不写)例 :氢离子 硅离子 碳酸根离子 3个硫酸根 离子 4.离子所带电荷数由该元素原子的最外层电 子数决定。
离子——带电荷的原子或原子团
阳离子——带正电荷的原子或原子团
Na+ Ca2+ Mg2+ Al3+ H+ NH4+
阴离子——带负电荷的原子或原子团
Cl- O2- F- OH- SO42- NO3- CO32-
常见的离子
请思考如下问题
Na变成Na+有哪些变化?Cl变成Cl? 1、最外层电子数一定改变 。
A 、①② B、②③ C、①②④ D、②③④
28
B
+9 2 8
4、写出下列微粒的质子数和电子数
项目 Na 质子数 11
电子数 11
Na+ S2- Ne H2O NH4+ OH-
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
+12 2 8 2
硫原子 氧原子 镁原子
请写出下列示意图所表示的微粒名称
+2 2
氦原子
+8 2
+17 2 8 7 +13 2 8
8
氧离子 氯原子 铝离子
练习:
下面的结构示意图正确的是:( A、C )
+3 2 1 A
+3 3 B
+11 2 8 1 C
+11 2 9 D
+13 2 8
+16 2 8 8
易失3个电子 带3个正电荷
+13 2 8 铝离子
S +16 2 8 6
易得2个电子 带2个负电荷
+16 2 8 8 硫离子
离子所带的电荷数=原子得失电子数 离子所带的电荷数=核电荷数—电子数
下列微粒的性质与质子数、电子数、中 子数、电子层数、最外层电子数等有关, 请你用它们填空
元素种类____质__子_数______; 元素分类_最__外__层_电__子__数____; 相对原子质量_质_子__数__、_中__子_数____; 元素的化学性质_最_外__层__电_子__数___; 离子所带电荷数_最_外__层__电_子__数____;
宏观 组成
微观 构成
只论种类 不论个数
既论种类 又论个数
离子是构成物 质的粒子么?
钠原子Na
+11 2 8 1
氯原子Cl
+17 2 8 7
+11 2 8
钠离子Na+
+17 2 8 8
氯离子Cl-
Na+ Cl-
NaCl
举例分析:
Na +11 2 8 1
Al +13 2 8 3
易失1个电子 带1个正电荷
金属 一般小于4 元素
易失去电子 阳离子
非金属 一般大于4 元素
易得到电子 阴离子
稀有气 体元素
等于8(氦=2)
难于得失电子 (为稳定结构)
不易形成离子
原子和离子的联系和区别
联系:
阳离子 失电子 原子 得电子 阴离子
得电子
失电子
原子中:质子数=电子数(原子不带电)
区 别
阳离子中:质子数>电子数(带正电) 阴离子中:质子数<电子数(带负电)
D
+11 2 8
B
+17 2 8 7
E
+10 2 8
C
【能力提高】
• 某离子带3个单位的正电荷,质子 数为13,该离子的核外电子数为 __1_0__,该离子的名称是_铝__离__子_, 符号是_A_l_3_+,该离子的结构示意图 是:
+13 2 8
• 根据右边的结构图回答:
• 如果该图表示的是原子,X值 • 为_1_0_,该原子的符号是_N_e__。
Na
Mg
S
Cl
+11 2 8 1
+12 2 8 2
+16 2 8 6
+17 2 8 7
原子:核电荷数=核外电子数
Na
Mg2
+ +11 2 8 + +12 2 8
S2 -+16 2 8 8
Cl -+17 2 8 8
离子:核电荷数≠核外电子数
判断下列原子结构示意图是否正确?
+16 2 6 8 +8 2 8
离子符号的含义
Mg2+ 镁离子,一个镁离子
Mg2+上的2表示每个镁离子带 2个单位的正电荷
Cl- 氯离子,一个氯离子
Cl-表示每个氯离子带1个单位 的负电荷 (1省略不写)
每个铝离子
带三个单位
3个 铝离
3Al3+ 正电荷
子
铝离子或 一个铝离 子
元素 最外层电子数 得失电子趋势 形成离子的类型 分类
+8 2 6
A
B
C
判断:微粒A是 铝离子 微粒 B 是硫离子 微粒C是氧原子 。
要能够分清原子结构示意图、离子结构示意图 原子:核电荷数=核外电子数 离子:核电荷数≠核外电子数
下列五种微粒中最易失去电子的是 A,最 易得到电子的是 ,原E子化学性质比较相 似的是 。 A、D
+11 2 8 1
A
+12 2 8 2
易失3个电子 带3个正电荷
+11 2 8 钠离子 +13 2 8 铝离子
Cl +17 2 8 7
易得1个电子 带1个负电荷
+17 2 8 8 氯离子
S +16 2 8 6
易得2个电子 带2个负电荷
+16 2 8 8 硫离子
由于金属元素、非金属元素的原 子核外最外层没有达到稳定结构, 在化学反应中容易得失电子,从而 达到稳定结构,那么,得失电子的 结果怎样呢?
离子的形成
NaCl的形成过程
+11 2 8 1
Na
+17 2 8 7
Cl
+11 2 8 Na +
+17 2 8 8 Cl-
离子——带电荷的原子或原子团。
阴离子:带负ቤተ መጻሕፍቲ ባይዱ荷的离子叫做阴离子。 如: S2-、 Cl- 阳离子:带正电荷的离子叫做阳离子。 如: Na+ 、Al3+
Al +13 2 8 3
练一练
1、二氧化碳由氧元素、碳元素 组成,二氧
化碳由二氧化碳分子 构成 ,二氧化碳分
子由碳原子、氧原子
构成。
2、氯化钠由氯元素、钠元素组成,氯化钠
由氯离子、钠离子
构成 。
1、物质由——元素组成;
固定说法
2、物质由——(分子或原子或离子)构成;
3、分子由——原子构成。
【基础练习】
1.要能够分清原子结构示意图、离子结构示意图 2.要能够根据示意图写出对应的符号
• 如果该图表示的是带两个单位正电 荷的阳离子,X值为_1_2_,符号是 _M_g_2_+。
• 如果该图表示的是带两个单位负电 荷的阴离子,X值为__8_,符号是 __O2_-_。
点评:求离子的核电荷数采用还原成原子的方法
本节课小节
1、离子形成、书写、意义 2、离子与原子的区别和联系 3、物质与其粒子的关系
