干细胞分离培养步骤
实验项目一猪骨髓间充质干细胞的分离和培养

猪骨髓间充质干细胞的培养与分离实验准备:器材:手术刀片,手术刀柄,剪刀,镊子,弯钳,5ml灭菌注射器,7号注射针头,10ml离心管,离心机,100mm培养皿,75ml培养瓶试剂:低糖DMEM(含有10%FBS,75μg/ml青霉素,50μg/ml硫酸链霉素)1000iu/ml青链霉素的PBS(生理盐水)(装入灭菌的洗瓶中)无血清低糖DMEM.2%台盼蓝染液材料采集:一,胎猪骨髓采集:【1】 1,无菌条件下从猪子宫内取出胎儿置入到保温瓶中,加入含有青链霉素的PBS或生理盐水中,立即送回实验室。
2,在无菌操作下取下左右股骨,除净肌肉、骨膜及股骨两端软骨组织;用PBS冲洗3-4次用灭菌生理盐水冲洗干净,在超净工作台内剥离肌肉和骨膜,得到完整的股骨。
立即用含有1.0ml DMEM+3000iu/ml肝素的注射器冲骨髓腔,迅速换上5号的针头将冲出的骨髓血轻轻吹打,再加入等量培养液(DMEM+10%FBS)稀释,然后以1:4比例缓慢加入到Percoll分离液(1.073g/ml)的表面,1000r/min 30min,小心吸取乳白色的有核细胞层。
目前用于分离MSCs的方法主要有密度梯度离心法,流式细胞仪分离法和贴壁筛选法。
密度梯度离心法目前主要包括利用percoll分离液分离MSCs和利用淋巴细胞分离液分离MSCs两种。
Percoll密度梯度离心法根据细胞密度不同将细胞分为数层,因此得到的MSCs纯度较高,但是操作繁琐,而淋巴细胞密度梯度离心法虽得到的MSCs不及percoll密度梯度离心法得到的细胞纯度高,但是操作简单,且获得的MSCs增殖活性较强。
【13】来自:胎猪骨髓间充质干细胞核移植及核移植胚胎干细胞的分离取2-3月龄猪胎儿,在无菌操作下取下左右股骨,用含1000iu/ml青链霉素的PBS浸泡30min,除净肌肉、骨膜及股骨两端软骨组织;用PBS冲洗3-4遍;用吸有4ml а-MEM细胞培养液的一次性无菌5ml注射器刺入处理好的股骨的一端,冲出骨髓,然后用7号针头轻轻吹吸数次,使冲出的骨髓尽可能分散为单个细胞,100目滤沙过滤;1000rpm/min,离心5min,用а-MEM细胞培养液制成细胞悬液,计数后,调整有核细胞的密度为1-2x107/ml.,然后接种培养。
动物克隆 第三章胚胎干细胞分离培养

第三章胚胎干细胞分离培养1981年,Evens等首次发现小鼠胚胎干细胞(embryonic stem cells,ESCs)在体外具有稳定增殖并维持未分化状态及分化全能性潜能的特性,并成功建立小鼠ESCs系[1]。
由于ESCs独特的生物学特性,ESCs方面的研究迅速成为生命科学研究领域的热点之一,1999年-2000年连续两年被评为世界十大科技新闻。
ESCs已成为分子遗传学、发育生物学、细胞工程、组织工程等研究的重要工具,在研究细胞分化机制、临床治疗、转基因等方面有着重要的意义。
随着对干细胞研究的不断深入,人们将逐渐掌握和利用干细胞,还将推动相关学科的发展。
文章综述了ESCs的研究概况、体外分离培养、生物学特性、鉴定方法、影响ESCs分离培养的因素、存在问题以及应用前景等。
1 胚胎干细胞研究概况ESCs的研究最早要追溯到畸胎瘤细胞的发现,但真正意义上的开始却是1981年Evens等首先从延缓着床的胚泡分离培养到小鼠的ESCs,并建立小鼠的ESCs系,之后ESCs研究迅速发展,已在大鼠、仓鼠、猪、牛、水貂、兔、山羊、绵羊、恒河猴和人等多种哺乳动物上建立了类ESCs系[2]。
近几年来,ESCs研究在ESCs来源与培养方法、探索建立和维持ESCs系的条件、定向诱导分化、遗传操作、疾病动物模型的治疗等方面取得了一定的进展。
研究人员利用体细胞核移植技术进行胚胎重建,从克隆胚胎中成功得到小鼠、兔和人等多种哺乳动物ESCs[3-5];利用孤雌激活技术建立小鼠和非人灵长类孤雌激活胚胎源的ESCs系[6],这些为ESCs的分离克隆开辟了新的途径。
利用定向诱导分化技术成功将ESCs分化为造血细胞、内皮细胞、肝细胞、脂肪细胞、软骨细胞、神经细胞、胰岛细胞、心肌细胞、成骨细胞,甚至滋养层细胞和生殖细胞等所有3 个胚层的细胞类型[7-13]。
试验表明,人ESCs 能有效治疗心肌梗死、糖尿病、中风等疾病。
国内在ESCs方面的研究起步较晚,但发展迅速,在相关领域做了大量的研究。
小鼠骨髓间充质干细胞培养

小鼠骨髓间充质干细胞培养目前常用的分离MSC的方法有全骨髓法和密度梯度离心法,全骨髓法即根据干细胞贴壁特性,定期换液除去不贴壁细胞,从而达到纯化MSC的目的。
密度梯度离心法即根据骨髓中细胞成分比重的不同,提取单核细胞进行贴壁培养。
随着对MSC表面抗原认识的深入,有人利用免疫方法如流式细胞仪法、免疫磁珠法等对其进行分离纯化,但经过流式或磁珠分选后的细胞出现了增殖缓慢等一些问题,加之耗费较大和技术的难度,在某种程度上限制了这些方法的广泛应用。
实验准备:1实验动物雄性,C57B L/6小鼠,清洁级,8周龄,体重18-20g。
2实验材料与试剂高糖DMEM培养基,胎牛血清,双抗(青霉素钠,链霉素),培养皿,镊子,眼科剪,止血钳,1mL注射器操作步骤1、小鼠骨髓间充质干细胞的分离及原代培养取8周龄雄性C57BL/6小鼠,颈椎脱臼法处死,75%酒精浸泡5分钟,取出双侧腿骨,置于培养皿中小心剔除粘连于骨上的肌肉组织,剪去腿骨两端,用1m l注射器抽取预冷的培养液反复冲洗骨髓腔,直至骨发白,冲洗液直接收集在插在冰上的离心管中,1500rpm离心5分钟,弃上清,用含10%胎牛血清的高糖DMEM培养液重悬细胞,接种于培养皿中(一只小鼠种一个60mm的培养皿),置于5�2,37℃,培养过夜,吸出上清,用PBS洗两遍,洗掉未贴壁的细胞,加入新鲜的培养液,继续培养。
以后每两天换液1次,并观察细胞形态。
待细胞长至80%-85%时传代(1传2)2、原代分离的间充质干细胞在接种后培养24小时,细胞开始贴壁,胞体呈圆形或多边形,培养第3-5天,细胞开始较紧密贴附壁上并开始有细胞呈梭形,并不断长大、变长,但未观察到细胞分裂,培养第7天开始观察到细胞分裂,随着细胞数的增加,细胞的生长速度变快,逐渐成漩涡状排列,培养第12天贴壁细胞长满瓶底的80%,并融合成片。
传代后细胞生长迅速。
采用贴壁培养法可获得足够数量、生长状态良好、增殖能力强的间充质干细胞,随传代数增加,其纯度增加,且该方法简单、实用。
干细胞培养全攻略

干细胞培养全攻略第一步:准备工作在开始干细胞培养之前,您需要准备一些实验室必需品,如无菌培养器皿、培养基、培养药品和设备。
确保所有的培养物品都是无菌的,以防止任何细菌或真菌的污染。
第二步:细胞分离从组织或器官中获得干细胞是干细胞培养的第一步。
这通常需要对组织进行消化和分离,以获得细胞悬浮液。
消化的方法因组织类型而异,可以使用酶来消化组织,如胰蛋白酶、胶原酶等。
第三步:培养细胞将分离得到的细胞悬浮液培养在无菌培养器皿中。
干细胞可以在不同类型的培养基中生长,包括含有营养物质的基础培养基和添加了细胞生长因子和分化因子的特定培养基。
根据需要,可以选择不同的培养基来促进干细胞的增殖或分化。
第四步:细胞分化干细胞具有自我更新和分化为任何类型细胞的潜能。
要促使干细胞向特定细胞类型分化,可以通过添加特定的分化因子或调节细胞培养条件来实现。
例如,如果要将干细胞分化为神经细胞,可以添加神经生长因子到培养基中。
第五步:细胞鉴定和纯化在干细胞培养过程中,很重要的一步是对细胞进行鉴定和纯化。
这可以通过使用特定的标记物或抗体来检测细胞表面的分子标记完成。
例如,可以使用流式细胞术来分析细胞表面的特定蛋白,从而鉴定和纯化干细胞。
第六步:细胞传代干细胞通常需要定期传代以维持其生长和增殖。
细胞传代是将细胞从旧的培养皿中收集,并将其移植到新的培养皿中的过程。
在传代过程中,确保培养基和设备的无菌性以防止细菌和真菌的污染。
总结干细胞培养是一项复杂的技术,需要严格的实验操作和无菌技术。
在进行干细胞培养时,务必注意细胞的无菌性和培养条件的控制。
同时,在进行细胞分化和纯化时,要使用适当的试剂和方法来鉴定和纯化特定类型的细胞。
干细胞培养需要耐心和经验,但也为细胞生物学研究和医学应用提供了巨大的潜力。
干细胞提取方法与技巧

干细胞提取方法与技巧干细胞是一类具有自我更新能力和多向分化潜能的细胞,具有广泛的应用前景,被广泛研究和应用于生物医学领域。
为了有效地提取干细胞,研究人员发展了多种提取方法和技巧。
本文将介绍几种常用的干细胞提取方法及其相关技巧。
一、初级培养法初级培养法是一种常见的干细胞提取方法,适用于无需大量提取的情况。
该方法的步骤如下:1. 细胞准备:收集组织样品,将其分解为细胞悬液。
2. 培养基配制:根据所需提取的干细胞类型,选择适当的培养基并加入适量的细胞因子。
3. 细胞培养:将细胞悬液加入培养基中并进行培养,在适当的培养条件下促进干细胞分化与增殖。
4. 细胞分离:通过倒置显微镜观察,使用悬液中的细胞管控探测器将干细胞从其他细胞中分离出来。
5. 干细胞纯化:将分离出的干细胞用干细胞培养基培养并纯化,去除其他非干细胞杂质。
二、流式细胞术流式细胞术是一种常用的干细胞提取方法,利用细胞的免疫表型可以从复杂的细胞混合物中识别并分离干细胞。
其步骤如下:1. 细胞样品准备:提取组织样品并制备单细胞悬液。
2. 细胞标记:将单细胞悬液与特定的细胞表面标记物结合,可通过免疫磁珠或荧光标记等方法实现。
3. 流式细胞术分选:使用流式细胞术仪器进行细胞分选,根据标记物的不同发射光强度,将目标干细胞从混合物中分选出来。
4. 干细胞的检验与分离纯化:将目标干细胞从其他细胞中纯化出来,根据需要采取不同的分离纯化方法。
三、单细胞测序法单细胞测序法是一种快速有效的干细胞提取方法,可在单个细胞层面进行分析,帮助揭示不同类型干细胞的功能和特性。
其具体步骤如下:1. 单细胞捕获:通过微流控装置将单个细胞捕获和固定在特定位置。
2. 细胞裂解:采用细胞裂解酶对细胞进行裂解,释放出细胞内的RNA和DNA。
3. RNA/DNA扩增:使用逆转录酶和DNA聚合酶对捕获的RNA和DNA进行逆转录和扩增。
4. 测序准备:将扩增的RNA/DNA片段进行文库建立准备,包括文库构建、PCR扩增等步骤。
大鼠骨髓间充质干细胞(BMSC)的分离、鉴定与培养

大鼠骨髓间充质干细胞(BMSC)的分离与鉴定大鼠骨髓间充质干细胞(BMSC)的分离与鉴定材料试剂(一)主要设备和产地1.手术器械上海手术器械厂2.台式水平离心机Eppendorf,5810R德国3.Nanopure超纯水仪日本SANYO公司4.AA一200型电子天平美国Denver Instrumol/Lent公司5.低温高速离心机ThermoForma公司6.90一2型磁力搅拌器上海沪西分析仪器厂7.电动匀速垂直转轮上海沪西分析仪器厂8.微量移液枪德国Eppendorf公司9.烧杯、容量瓶上海实生公司10.全自动酶标光度仪美国Bio-Rad公司11.6cm/10cm细胞培养皿美国Conring12.2mL冻存管、细胞冷冻储存器美国Conring13.低温高速离心机ThermoForma公司产品14.YJ-875超净工作台苏州工业园区三兴净化科技有限公司15.C02培养箱3111型美国Thermo Forma公司16.CK40-F200型倒置显微镜日本Olympus公司17.10ml注射器美国BD公司(二)试剂和材料1.谷氨酰胺(L-Glutamine)美国Hyclone公司2.75%消毒酒精上海生工3.肝素美国sigma公司4.胰蛋白酶美国Amresco公司5.胎牛血清美国Gibco公司6.α-MEM培养液美国Hyclone公司7.5-6周龄SD大鼠上海斯莱克实验动物有限公司8.Percoll细胞分离液美国GE公司9.DMSO(细胞培养级)美国Sigma公司Rat BMSC的分离与培养分离颈椎脱臼法处死大鼠,75%酒精中浸泡5分钟,超级工作台内依次取下大鼠两条胫骨及两条股骨。
用手术器械将长骨上附着的肌肉组织尽量去除干净,整个过程保持无菌。
用剪刀剪去长骨两端,10ml注射器吸取加入肝素的完全培养液(10%FBSα-MEM),从长骨一端开口处注入,将骨髓腔内的细胞出入到50ml离心管内,直至长骨冲洗的发白,认为骨髓腔内的细胞都被吹入离心管内。
间充质干细胞分离及培养方案
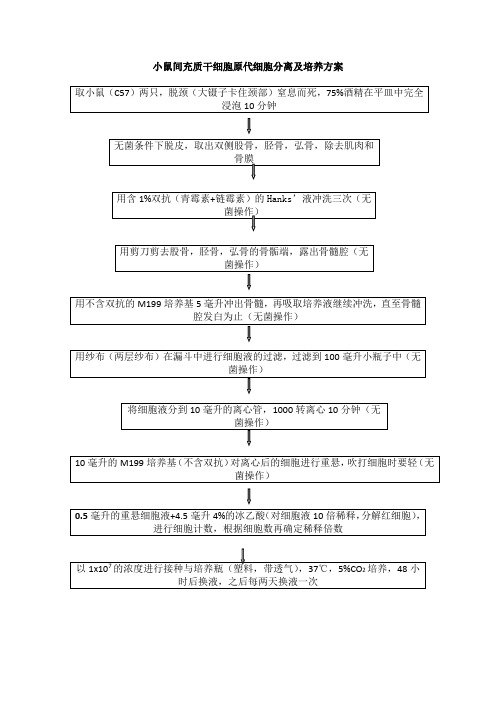
取小鼠(C57)两只,脱颈(大镊子卡住颈部)窒息而死,75%酒精在平皿中完全浸泡10分钟
无菌条件下脱皮,取出双侧股骨,胫骨,弘骨,除去肌肉和骨膜
用含1%双抗(青霉素+链霉素)的Hanks’液冲洗三次(无菌操作)
用剪刀剪去股骨,胫骨,弘骨的骨骺端,露出骨髓腔(无菌操作)
0.5毫升的重悬细胞液+4.5毫升4%的冰乙酸(对细胞液10倍稀释,分解红细胞),进行细胞计数,根据细胞数再确定稀释倍数
以1x107的浓度进行接种与培养瓶(塑料,带透气),37℃,5%CO2培养,48小时后换液,之后每两天换液一次
用不含双抗的M199培养基5毫升冲出骨髓,再吸取培养液继续冲洗,直至骨髓腔发白为止(无菌操作)
用纱布(两层纱布)在漏斗中进行细胞液的过滤,过滤到100毫小瓶子中(无菌操作)
将细胞液分到10毫升的离心管,1000转离心10分钟(无菌操作)
10毫升的M199培养基(不含双抗)对离心后的细胞进行重悬,吹打细胞时要轻(无菌操作)
干细胞流程及注意事项说明

干细胞流程及注意事项说明干细胞是一种具有自我更新和分化能力的细胞,具有广泛的应用前景。
在干细胞研究中,正确的操作流程和注意事项非常重要,下面将为您详细介绍干细胞流程及注意事项说明。
一、实验前准备1.1 实验室环境干细胞实验需要在严格的无菌条件下进行,因此实验室环境应该保持清洁、整洁、无尘,并且要定期消毒。
1.2 实验仪器干细胞实验所需的仪器设备包括显微镜、离心机、培养箱等。
这些设备应该经过严格的检测和保养,确保其正常运行。
1.3 培养基和试剂干细胞培养需要使用特殊的培养基和试剂,这些物品应该购买正规厂家生产的产品,并且要注意保存条件。
二、获取干细胞2.1 干细胞来源目前可以用于获取干细胞的方法有多种,包括体内分离、体外培养等。
其中较为常见的方法是从人类或动物组织中分离出干细胞。
2.2 干细胞分离干细胞分离需要使用特殊的试剂和设备,具体操作步骤如下:(1)准备组织样本,并进行消化处理。
(2)将消化后的组织样本过筛,去除不需要的组织碎片和异物。
(3)使用特定的抗体或其他方法对干细胞进行分离。
2.3 干细胞培养将分离出的干细胞放入培养基中进行培养。
在培养过程中应该注意以下事项:(1)保持无菌状态,避免污染。
(2)定期更换培养基,以保证营养物质的供应和废物的排出。
(3)控制培养温度、湿度和二氧化碳浓度等环境条件,以促进干细胞生长和分化。
三、干细胞鉴定为了确保分离出来的是真正的干细胞,需要进行鉴定。
常用的鉴定方法包括:3.1 免疫荧光染色法使用特异性抗体标记干细胞表面标志物,然后观察染色结果。
如果干细胞表面标志物呈阳性,说明分离出的是真正的干细胞。
3.2 流式细胞术利用流式细胞仪对干细胞进行鉴定。
流式细胞仪可以对单个细胞进行检测,并且可以同时检测多种标志物。
四、干细胞分化4.1 干细胞分化方法干细胞可以通过不同的方法进行分化,包括:(1)生长因子诱导法:通过添加特定的生长因子来促进干细胞向特定方向分化。
(2)遗传修饰法:通过基因工程技术改变干细胞内部基因表达,从而实现特定的分化方向。
胚胎干细胞的分离培养技术(最全版)PTT文档

ES细胞的特点:
➢ES细胞具有胚胎细胞的特性,在形态上表现为
体积小、核大,核仁突出,培养时呈克隆状生 长;在功能上,ES细胞具有发育的全能性,即 具有分化为成年动物体内任何一种细胞类型的 能力。
➢ES细胞具有细胞系的特征,在饲养层上能维持
未分化状态并实现自我更新。因为可无限增殖, 也可冷冻保存。
ICM PGCs i在E1F(EEnw、eSSSt功hom细 细 细根itL能ae胞胞胞a据lep上n可具在i细dpg,rim用有哺ga胞lEcee于胚乳e的nSt t6b研胎动细a分8ltai究细物胞9o化s9nt细胞个具o特doce胞的体有ny点vsh癌特发发et建selo.变性生育a立pde机,发的更adn理在育全有frdo和形规能效lme新态律性g的as药上的,)培D. 物表研即u养ro的现究具体c筛为中有-系P选体极分iet。积有化ra小价为in 、值成bla核的年st大工动oc,具物ys核;体t (仁内red突任a出何nd,一b培种la养细ck时胞pi呈类gm克型e隆的nta状能tio生力n长。) in;jected with German Land-race PGCs
嵌合体动物制作方法: 1、集合(凝集)法:在卵裂阶段使2个以上的
胚胎发生粘着和结合。 2、注入法:在临近着床的胚泡期,用显微操作
方法将另一个体的细胞注入到囊胚腔中。
研究现状:
家畜的嵌合体不但已在个体间和品种间 取得成功(绵羊、牛等),而且在异种间 也得到了活的后代,如绵山羊人工嵌合体, 该技术对遗传学研究具有重要意义,塑造 特异性状的新奇物种,从而为动物园展示 了新的前景,嵌合体也被用来研究免疫学 系统的机理。
延迟小鼠囊胚中分离出来的多能性细胞,当 时称之为EK细胞。以后称之为胚胎干细胞。
兔骨髓间充质干细胞的分离

3000rpm×30 min离心,小 心吸取中间白 膜层,DMEM 洗涤2次,接 种于含 15%FBS的低 糖完全培养基 中
二、全骨髓培养法
• 制备细胞悬液同前,将所收集的细胞悬液用200 目滤网过滤, 制备成单细胞悬液,1000rpm×5min 洗涤2 次, 弃上清液, 取沉淀重新悬浮后, 接种于含 15% FBS 的培养液中
兔骨髓间充质干细胞的分离
密度梯度离心法 全骨髓培养法
一、密度梯度离心法
超酒精棉球、保 鲜膜、打火机、手术包、percoll分离液、 培养基、培养瓶等
• 取生后21天新西兰大白兔1只(兰州大学动 物房提供),重约0.3kg
水淹法处死后, 放入75% 的酒精内浸泡15 min。无菌条件下取出双侧股骨、胫骨、肱 骨,去除附带组织,浸入生理盐水中清洗2次
无菌间内,超净台上, 将长骨从中间剪断。 此方法优点: 1.可最大量提取出干骺 端干细胞(丁香园提 示干细胞大量存在于 干骺端) 2.操作简便,只需剪开 一次
• 以10ml 注射器吸取无血清低糖DMEM 培养 液反复冲洗, 以骨头发白为准,4号针头反复 抽吸制备成单细胞悬液,装入两离心管中以 1000rpm×5min离心,去除上清, DMEM 重悬,轻铺于等量的密度1.073g/ml Percol 分离液上(5ml:5ml)
干细胞分离培养

2. 干细胞分离培养2.1胚胎干细胞诱导分化首先将类胚体消化成单细胞,贴壁培养,于不同的培养阶段添加不同种类和不同浓度的化学物质、条件培养基或细胞因子等诱导条件,直接促进ES细胞定向分化为某种特殊类型的细胞;或通过改变培养条件对某些类型的细胞分化起抑制作用,从而高效诱导目的细胞的分化。
改变细胞的培养条件使ES细胞进行定向分化的基本策略有三种:一是向培养基中添加生长因子和化学诱导剂等;二是将ES细胞与其它细胞一起进行培养;三是将细胞接种在适当的底物上,以促使细胞中某些特定基因的表达上调或下降,从而引发细胞沿着某一特定谱系进行分化。
体外诱导胚胎干细胞的物质有化学试剂诱导法、细胞因子诱导法和外源基因诱导法。
化学试剂诱导法:维甲酸(RA)、DMSO、β-磷酸甘油、维生素C(VC)、地塞米松、维生素K3(VK3)以及2,5-羟基维生素D3等化学试剂,都能诱导ES 细胞定向分化为特定类型细胞。
细胞因子诱导法:ES细胞在培养过程中对许多细胞因子具有很强的依赖性。
增加或减少一种或几种细胞因子可影响ES细胞的增殖或分化。
目前研究最深入的细胞因子主要有骨形成蛋白(BMPs)和成纤维细胞生长因子(FGF)等。
外源基因诱导法:转基因法可以弥补细胞因子法的不足。
其原理是使某个促分化基因在ES细胞中过度表达,从而调控ES细胞的分化。
应用此方法之前,首先要确定决定该细胞向不同方向分化的关键基因,其次还要确保在适宜的时间将此基因正确插入到ES细胞基因组序列上。
2.2肿瘤干细胞(CSC)分离鉴定对于CSC的分离纯化主要有根据细胞表型特征和生物学特性而建立的两大类方法:第一类:依赖于细胞表面标志的分离方法造血系统肿瘤干细胞:正常造血干细胞的表型为CD34+CD38+Thy-1-实体瘤肿瘤干细胞:A.乳腺癌:ESA+CD44+CD24-/LowLineage-的细胞是乳腺癌CSC。
B.脑肿瘤:将CD133+的肿瘤细胞命名为脑肿瘤干细胞(BTSC), 还表达Sox2、Musashi-1、bmi-1、磷酸丝氨酸磷酸化酶等神经干细胞和其它干细胞的基因特征C.结直肠癌:CD133+细胞是结直肠癌细胞的起始细胞。
造血干细胞分离培养方法

一造血干细胞分离(一)小鼠骨髓采集与单个核细胞悬液的制备1 HES(羟乙基淀粉)沉淀法抽取髓液500 m L按4∶1比例加入HES,自然沉降红细胞后,分离上清。
4℃400 g离心10 min得细胞沉淀物,以1 %白蛋白盐水液洗涤细胞2次。
2 percoll液密度梯度离心法①∶1在骨髓液中加入淋巴细胞分离液。
4℃,1 5 00 r / min,离心20 min。
取单个核细胞层,以1%白蛋白盐水液洗涤3次。
②取鼠股骨和胫骨 , 在两头关节处切开骨骼 , 反复用培养基冲洗骨髓腔 , 随后小心地逐滴将细胞悬液加在淋巴细胞分离液上 , 2 000 r / min 离心 20 min。
吸取离心后相交液面处的白色细胞层即为单个核细胞。
3 Ficoll分离法×20min,吸取白细胞层,用RPMI1640液亲清洗后离心2000r/min×10min,取白细胞层加RPMI1640液到10ml制成造血干细胞悬液样本。
方法二取无菌离心管1支,预先添加3mlFicoll(与骨髓细胞悬液体积1:1),用滴管取单细胞悬液3ml,沿离心管壁小心缓慢叠加于分离液面上,注意保持清楚的界面,室温下水平离心2000rpm×20分钟,(后续在冰上进行)用毛细吸管插到云雾层,小心吸取单个核细胞,置入另一短中管中,加入5倍以上体积的磷酸缓冲液PBS,1500rpm×10分钟,L-DMEM 洗涤细胞两次,每次以1000r/min离心10min,去上清液。
(除第一步的室温离心外,其余为低温离心)。
取骨髓细胞悬液的方法是:取出大鼠腿骨将肌肉尽可能剔除,并用PBS缓冲液冲洗干净。
在超净台中腿骨浸泡在PBS缓冲液中5min,之后在两头关节处切开骨骼 , 反复用PBS缓冲液冲洗骨髓腔,从而得到骨髓细胞悬液。
(二)Linc-- kit+造血干细胞的分离纯化。
去除 Lin+细胞( 负筛选) : 带有生物素的混合抗体标记成熟细胞 ; 抗生物素的磁珠吸附抗体标记的成熟细胞 , 包括 T , B淋巴细胞、粒细胞、巨噬细胞以及它们的定向前体细胞 ; 细胞通过磁场不被柱子吸附的包括造血干细胞和骨髓间质干细胞。
人脂肪干细胞的分离培养及鉴定

。
.
图 3 脂 肪 干 细胞 的表 型 特 征
被 称 为 A S s的 细 胞 , 具 有 一 般 干 细 DC 它 胞 的 特性 , 骨 髓 干 细 胞 相 比 , 具 有 明 与 它 显优 势 , 来 源 、 材 、 增 能 力 方 面 , 在 取 扩 都
是骨 髓 干 细 胞 所 无 法 比拟 的 , 可作 为 种 子
到第 1 4天 时 可 见 细 胞 铺 满 瓶 底 8 % 左 0
右 。 而传 代 细 胞 生 长 速 度 明 显 快 于 原 代
陶凯 等 通 过 不 同 血 清 浓 度 作 用 下 生 长 曲线 绘 制 发 现 , 血 清 浓 度 为 1% 在 5 和 2 % 时 , 最 短 时 间 内 细 胞 可 进 入 平 0 在 台期 , 到 细 胞 增 殖 高 峰 期 , 合 考 虑 性 达 综 价 因 素 , 际 应 用 中 可 将 1% 作 为 血 清 实 5 的最 适 宜 浓 度 。通 过 两代 生 长 曲线 发 现 , 第 2代 细 胞 较 原 代 细 胞 更 快 进 入 增 殖 高
摘
要 目的 : 索从 健 康 成人 脂肪 组 织 探 中分 离 、 养 并 鉴 定 脂 肪 千 细胞 。 方 法 : 培
用健 康 成 人 的 脂肪 组 织 , 除 可 见 纤 维结 剔
1 , 次 当贴 壁细 胞接 近融 合时再 次传 代。
光学 显 微 镜 下 观察 细胞 生 长 及 形 态 。 流 式 细 胞 仪检 测 相 关 抗 原 : 流式 细 胞 仪对 第 3代 脂 肪 干 细 胞 表 面 相 对 特 异 性
2 王红祥 , 李宾公 , 邵诗颖 , 人脂肪组 织分 等. 离培养基 质 干细胞 的方 法及 其 表型 鉴定 [ ] 中国临床康复,0 6,0 4 ) 1 J. 20 1 ( 1 :6—1 . 8
干细胞分离、培养和鉴定方法概述

干细胞分离、培养和鉴定方法概述关键词:干细胞淋巴细胞平滑肌细胞细胞ES 北纳创联北京标准物质网胚胎干细胞(embryonic stem cell,ES)是早期胚胎或原始性腺中分离出来的一类细胞,它是一种高度未分化的细胞,它具有无限增殖、自我更新和多向分化的特性,可在体外培养、扩增、建系,也可在适当条件下诱导分化为多种组织细胞,还可与受体胚胎嵌合,形成嵌合体。
ES细胞首先源于胚胎细胞,是胚胎细胞在特定的培养条件下分离筛选出来的,与胚胎细胞相比,ES细胞能在体外不断传代,并且相对稳定地增殖但不发生分化,能自我更新、自我复制,这是大量获得ES细胞并广泛应用的前提。
利用这一特点,可以用于医学上的药物试验。
ES细胞具有多能性,即ES细胞在解除分化抑制的条件下能参与包括生殖腺在内的各种组织的发育潜力,可为细胞的遗传操作和细胞分化研究提供丰富的实验材料。
ES细胞发育多能性的标志是ES细胞表面表达时相专一性胚胎抗原(stage specific embryorll’cant,SSEA),而且可以检查到OCT4基因的表达,这两种蛋白是发育多能性的标志。
ES细胞中AKP及端粒酶活性较高,可用于ES细胞分化与否的鉴定。
自1981年首次成功分离小鼠ES细胞,现已在仓鼠、大鼠、兔、猪、牛、绵羊、山羊、水貂、恒河猴、美洲长尾猴以及人类分离获得了ES细胞,而且已经证明小鼠ES细胞可以分化为心肌细胞、造血细胞、卵黄囊细胞、骨髓细胞、平滑肌细胞、脂肪细胞、软骨细胞、成骨细胞、内皮细胞、黑色素细胞、神经细胞、神经胶质细胞、少突胶质细胞、淋巴细胞、胰岛细胞、滋养层细胞等。
人类ES细胞也可以分化为滋养层细胞、神经细胞、神经胶质细胞、造血细胞、心肌细胞等。
ES细胞不仅可以作为体外研究细胞分化和发育调控机制的模型,而且还可以作为一种载体,将通过同源重组产生的基因组的定点突变导入个体,更重要的是,ES细胞将会给人类移植医学带来一场革命。
人骨髓造血干细胞的分离培养

人骨髓造血干细胞的分离培养是一个复杂而重要的过程,涉及到细胞生物学、分子生物学和生物工程等多个领域。
以下是对该过程的详细描述,共计800字。
一、分离骨髓造血干细胞首先,我们需要从捐献者的骨髓中分离出造血干细胞。
通常,捐献者需要接受全身麻醉,然后在医生的监督下抽取一定量的骨髓。
抽取的骨髓样本经过处理后,会分离出造血干细胞和其他类型的细胞。
这一过程通常需要使用到离心技术,如密度梯度离心法。
二、培养造血干细胞分离出的造血干细胞需要在一个适合它们生长和分化的环境中进行培养。
实验室环境通常需要具备以下几个条件:1. 合适的营养物质:造血干细胞需要特定的营养物质来维持它们的生长和分化。
这些营养物质包括氨基酸、葡萄糖、维生素、矿物质和生长因子等。
2. 适合的pH值和渗透压:造血干细胞对环境的pH值和渗透压非常敏感。
过高的pH值或渗透压可能导致细胞死亡或停止生长。
3. 适合的温度:温度是影响细胞生长和分化的重要因素。
适宜的温度可以使造血干细胞保持最佳的分裂状态。
在培养过程中,造血干细胞会逐渐分裂并形成更多的细胞,同时也会分化为不同类型的血细胞,如红细胞、白细胞和血小板等。
为了确保造血干细胞的生长和分化,通常会使用一些细胞因子,如集落刺激因子(CSF)和红细胞生成素(EPO)等。
这些细胞因子可以刺激造血干细胞增殖并抑制其分化为非造血细胞。
三、观察和记录在培养过程中,我们需要密切关注细胞的生长状况,并定期进行观察和记录。
可以通过显微镜观察细胞的形态变化,测量细胞生长的速度和数量,以及检查细胞分化的程度。
通过这些观察结果,我们可以了解细胞的生长状态,及时调整培养条件,以确保造血干细胞的最佳生长。
四、提取和分析干细胞克隆当造血干细胞在适当的条件下生长和分化时,可能会形成独立的细胞克隆。
这些克隆可以用于进一步的研究和药物开发。
可以通过克隆培养、基因敲除、基因表达分析等方法对干细胞克隆进行深入研究。
这些研究可以帮助我们更好地了解造血干细胞的生理特性,并为相关疾病的治疗提供新的思路和方法。
胎盘蜕膜间充质干细胞分离培养SOP

胎盘蜕膜间充质干细胞分离培养SOP一、样本接收1.正常足月顺产男婴,与产妇及其家属签署知情同意书后,在产房无菌条件下获取胎盘,放至无菌袋中,4℃运输至细胞中心。
2.观察运输箱的温度是否符合要求,采集瓶有无渗漏。
3.查看客户信息是否与交接表一致。
4.样本采集瓶外表面喷酒精擦拭消毒,并粘贴样本编码,填写样本接收记录,传入洁净区准备制备。
二、胎盘蜕膜间充质干细胞分离与接种1.准备耗材试剂:15cm培养皿、15ml离心管、50ml离心管、离心管架、10ml 移液管、T75培养瓶、离心管架、无尘布、封口膜、100目滤网过筛、灭菌手术刀、灭菌止血钳、灭菌镊子、灭菌剪刀、废液缸、无血清干细胞培养基(常温复温)、DPBS、双抗、75%酒精(已过滤)、Ⅰ型胶原酶。
2.仪器设备准备及预热:生物安全柜、二氧化碳培养箱、离心机、电动移液器、倒置相差显微镜、摇床(37℃150r/min)。
3.将75%酒精喷到台面,用无尘布擦拭台面,包括侧面及玻璃。
4.将生物安全柜开紫外30min通风10min,样本喷酒精擦拭,放入生物安全柜中,实验中所需要的相关试剂及耗材等喷酒精擦拭放入生物安全柜中。
5.取无菌托盘,加入含1%青链霉素的DPBS,将胎盘组织放入其中,并取适量样本保存液留样送检支原体。
并洗涤组织两三次,洗去表面的血污,直至清洗的液体无血色。
6.清洗结束后,将胎盘放入无菌托盘中,然后使用无菌剪刀分离胎盘底部靠近母体一侧的蜕膜组织,再将蜕膜组织剪碎至1-3mm3的微小组织块,加DPBS定容离心,500g 5min。
7.离心结束后,去上清。
按照蜕膜组织与消化液体积比为2:5的比例加入消化酶,在37℃150r/min的条件下震荡消化至少一个小时,再按消化酶与0.05%的胰酶体积比为1:1的比例加入0.05%的胰酶,在37℃150r/min的条件下震荡消化15min。
8.用无血清干细胞培养基终止消化,吹打悬液20-30次,打散组织,混匀细胞,将消化的组织液通过100um细胞筛网过滤出组织和胎盘蜕膜间充质干细胞两部分,组织留在滤网上,下层则是细胞悬液,加DPBS定容混匀离心。
实验项目一猪骨髓间充质干细胞的分离和培养

猪骨髓间充质干细胞的培养与分离实验准备:器材:手术刀片,手术刀柄,剪刀,镊子,弯钳,5ml灭菌注射器,7号注射针头,10ml离心管,离心机,100mm培养皿,75ml培养瓶试剂:低糖DMEM(含有10%FBS,75µg/ml青霉素,50µg/ml硫酸链霉素)1000iu/ml青链霉素的PBS(生理盐水)(装入灭菌的洗瓶中)无血清低糖DMEM。
2%台盼蓝染液材料采集:一,胎猪骨髓采集:【1】 1,无菌条件下从猪子宫内取出胎儿置入到保温瓶中,加入含有青链霉素的PBS或生理盐水中,立即送回实验室.2,在无菌操作下取下左右股骨,除净肌肉、骨膜及股骨两端软骨组织;用PBS冲洗3-4次用灭菌生理盐水冲洗干净,在超净工作台内剥离肌肉和骨膜,得到完整的股骨.立即用含有1。
0ml DMEM+3000iu/ml肝素的注射器冲骨髓腔,迅速换上5号的针头将冲出的骨髓血轻轻吹打,再加入等量培养液(DMEM+10%FBS)稀释,然后以1:4比例缓慢加入到Percoll分离液(1。
073g/ml)的表面,1000r/min 30min,小心吸取乳白色的有核细胞层。
目前用于分离MSCs的方法主要有密度梯度离心法,流式细胞仪分离法和贴壁筛选法。
密度梯度离心法目前主要包括利用percoll分离液分离MSCs和利用淋巴细胞分离液分离MSCs两种。
Percoll密度梯度离心法根据细胞密度不同将细胞分为数层,因此得到的MSCs纯度较高,但是操作繁琐,而淋巴细胞密度梯度离心法虽得到的MSCs不及percoll密度梯度离心法得到的细胞纯度高,但是操作简单,且获得的MSCs增殖活性较强.【13】来自:胎猪骨髓间充质干细胞核移植及核移植胚胎干细胞的分离取2—3月龄猪胎儿,在无菌操作下取下左右股骨,用含1000iu/ml青链霉素的PBS浸泡30min,除净肌肉、骨膜及股骨两端软骨组织;用PBS冲洗3—4遍;用吸有4ml а-MEM细胞培养液的一次性无菌5ml注射器刺入处理好的股骨的一端,冲出骨髓,然后用7号针头轻轻吹吸数次,使冲出的骨髓尽可能分散为单个细胞,100目滤沙过滤;1000rpm/min,离心5min,用а—MEM细胞培养液制成细胞悬液,计数后,调整有核细胞的密度为1-2x107/ml。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
家兔BMSC分离培养步骤
1.麻醉、备皮、消毒、铺巾:取1只4-5周龄新西兰幼兔,速眠新肌肉注
射(0.1~0.2mL/kg)麻醉。
仰卧固定于操作台上,褪毛,备皮,2%碘酒、75%酒精(或碘伏)常规消毒,铺洞巾(洞巾孔洞应控制在lcm左右,以利于减少污染)。
2. 在双侧踝关节处环形剪开皮肤,再纵行剪开皮肤至骶尾部,分离肌肉、
筋膜等软组织至见骨膜,电锯离断踝关节、膝关节及髋关节,获取家兔股骨和胫骨(桡骨),置于装有PBS液的无菌盒内。
(亦可从髂前上棘穿刺抽取骨髓)
3.用PBS液体清洗骨组织3-4遍,去除杂物、血迹后,在超净工作台上,无菌条件下剥离骨周围的肌肉软组织,用眼科剪从股骨和胫骨的干骺端打开骨髓腔,用含有适量肝素( 625 U/mL)的DMEM 液冲洗骨髓腔,收集冲洗液约 6 ~ 8 mL。
吸管反复吹打后,1 500 r/min,离心5 min,弃上清。
加入 DMEM 培养基重悬,将上述细胞重悬液按照1∶ 1 的比例缓慢滴加到密度为 1. 073 g/mL 的PercoⅡ分离液中,1 500 r / min 离心 20 min。
离心后管内容物分为 3 层,收集中间乳白色云雾状的单个核细胞层,加入 DMEM 培养液稀释混匀,1 500 r/min 离心 5 min,洗涤 2 ~ 3 次,去除多余的脂肪细胞及组织液。
用含双抗的 10% 胎牛血清的 DMEM/F12 培养基重悬细胞,以 2. 0 × 10^5个/cm2的细胞密度接种于25cm^2培养瓶中,置于37 ℃,5%、饱和湿度的孵箱中培养。
4. 48小时后首次半量换液,去除浮物及其它非贴壁细胞(如造血干细胞),后每隔3天换液一次。
5. 7-10天后,待细胞融合长满至80%以上时用0.25%胰蛋白酶消化传代。
经过第一次传代后,骨髓间充质干细胞大约能占60%左右,并且呈漩涡状生长;一般经过3次左右传代后,骨髓间充质干细胞大约能占90%左右。
