铁及其化合物化学优质课公开课
化学优质课铁及其化合物课件

Tankertanker Design
—— 黑色粉末
Fe2O3
Fe3O4
铁红
磁性氧化铁
红棕色粉末 黑色晶体
+2
+3
+2、+3
不溶 不溶
不溶
Tankertanker Design
学生活动: 这些化合物都是碱性氧化物么? 写出几种化合物与非氧化性酸盐酸的反应的离子方程式 写出几种化合物与氧化性酸稀硝酸的反应的离子方程式
Tankertanker Design
FeCl3溶液
加NaOH 溶液 生成红褐色沉淀
FeSO4溶液
生成白色絮状沉淀,迅速变为灰绿 色,最后变为红褐色沉淀
离子方 Fe3++3OH= 程式 Fe(OH)3↓
Fe2++2OH-=Fe(OH)2↓ 4Fe(OH)2+O2+2H2O=4Fe(OH)3
Tankertanker Design
*氢氧化亚铁的制备及新型装置原理的介绍
节选2018·北京卷 T12
Tankertanker Design
Fe3+和Fe2+的考点总结归纳:
Tankertanker Design
*Fe2+、Fe3+的性质?如何配制其溶液? *Fe2+、Fe3+如何检验?具体的方案如何? *Fe2+、Fe3+相互转化、及特定条件下二者如何辨析?
Tankertanker Design
铁的化合物的3CO===2Fe+3CO2
b、Fe2O3 用于制红色油漆和涂料
C、Fe3O4用于制录音磁带和电讯器材。
Tankertanker Design
高中化学铁和铁的化合物市公开课金奖市赛课一等奖课件pptx

铁的化合物种类及性质概述
氧化亚铁 氧化铁 四氧化三铁 氢氧化铁 硫酸铁 硝酸铁
铁的氧化物及其性质
定义:铁的氧化物是由铁元素和氧元素组成的化合物 分类:根据化合物的组成和结构,铁的氧化物可分为四氧化三铁、氧化亚铁和二氧化铁 性质:具有磁性、导电性、抗氧化性和催化活性等 用途:在工业、农业、医疗等领域中广泛应用
教师素质与表现: 教师的语言表达、 教态、板书等是 否规范、清晰、 有条理,是否能 够有效地引导学 生思考和学习。
感谢观看
汇报人:
巩固练习:通过 练习题的方式, 加深学生对知识 点的理解和记忆
结合目的:巩固 学生对知识的掌 握,提高学习效 果
实施方式:教师 引导学生进行归 纳总结,并安排 相应的练习题
04
教学特色
突出重点难点,详略得当
重点突出:针对重点知识进行深入讲解,确保学生掌握核心内容 难点突破:针对难点问题进行透彻剖析,帮助学生克服难关 详略得当:对重要知识点进行详细讲解,同时避免冗余,确保课程紧凑有效 实践应用:通过实验和实例,让学生更好地理解和应用化学知识
演示实验:通过实验演示铁和铁的化合物的化学反应和物理变化等
结合方式:将知识点讲解与演示实验相结合,使学生更好地理解铁和 铁的化合物的性质和用途 目的:帮助学生更好地掌握铁和铁的化合物的知识点,提高学习效 果
实验演示与理论分析相结合
通过实验演示 让学生直观地 了解化学反应
过程
结合理论知识 对实验现象进适用对象:高 中学生用途:辅助教 学,帮助学生 更好地理解铁 和铁的化合物
相关知识
特点:内容丰 富,生动形象,
具有趣味性
效果:提高学 生的学习兴趣 和效率,帮助 他们更好地掌
握知识
铁及其化合物的性质公开课优质课课件

淀 法
④Fe2+----K-M---n--O--ቤተ መጻሕፍቲ ባይዱ------Fe3+
氧化还原滴定法
总结:测定物质百分含量的基本方法 注意:操作规范、现象明显
气体法:转化为气体,测量气体的质量或体积。 沉淀法:通过反应使其转化为稳定的沉淀。 滴定法:酸碱中和滴定或氧化还原滴定法或沉淀滴定
【课堂探究二】
Fe2+、Fe3+的性质在反应原理中的应用
专题:铁及其化合物的性质
【学习目标】
1、掌握Fe2+和Fe3+的性质,根据性质对其进行检验、除杂。 2、能根据性质设计实验测定Fe2+和Fe3+百分含量。 3、根据高铁酸盐的性质及其制备方法,书写方程式。
化 合 价
+3
+2
Fe
0 单质
酸 、碱 反应
Fe2O3
Fe3+
Fe3O4
FeO
Fe2+
氧化物
2.铁元素含量的测定
过滤、洗涤、灼烧、称量
Fe2+-O--H-------Fe(OH)2---------Fe(OH)3--------Fe2O3
沉
FFeeS2+O--4-K---3-B--[--Fa--e--C--(l--C2--N------)B-6-]a--S-O--F4↓e3[Fe过(C滤N、洗)6涤]↓、干(燥、腾称氏量 蓝沉淀)
C
C
沉淀溶解平衡 盐类水解 (物质除杂问题) 电化学
FeSO4溶液
结论:物质的氧化性和还原性的强弱与反应条件有关, 氧化性和还原性的强弱并不是绝对的,
与浓度、温度、溶液的酸碱性、电压等有关
盐
高三化学铁及其化合物公开课(共14张PPT)

-
I等
Fe3+
_
SCN
Fe(SCN)3
化 亚 铁
OH _
O Cl2
H+
O2
HNO3 H2 2
(强氧化剂)
KMnO4(H+)
等
H+
OH _
显色反应
Fe(OH)2
O2+H2O
Fe(OH)3 ClO_
FeO42—
化
合
价
碱 酸碱性转酸 化
性
性
碱 转化关系
性
氧
CO /C /H2/Al
+3还 氧 Fe O Fe Fe(OH) 氧化化性 2 3+ 3 3 5.将元素化合物性质放在一定的背景下进行考核,这些背景包括海水资源的综合应用、材料领域的应用、元素化合物在自然界环境领域中的应
2013年 天津高考 第9题18分
1.单纯考查常见无机物及其应用的试题有所减弱。
②
③
Fe2+ ? Fe3+ ?
2 设计实验方案
【探究2】墨粉中Fe3O4晶体的含量是衡量墨粉质量 优劣的重要指标之一。你能设计实验,定量测定 墨粉中Fe3O4的质量分数吗? 请尝试写出你的方案。
方案1.热还原法
热还原法
【探究1】已知某品牌墨粉的成分如下: 聚丙烯酸脂-苯乙烯共聚物:占20-30% 电荷调节剂CCA:占10-20% 流动化剂SiO2等
表面改性剂聚乙烯/聚丙烯、炭粉 某一种铁的氧化物:占20-30%
提示:上述有机物不溶于水,且不与酸碱反应。
1 设计验证方案
【探究1】请设计合理方案用化学方法检验墨粉中
Fe2+、Fe3+滤液
《第一节 铁及其化合物》公开课优秀教案教学设计(高中必修第一册)
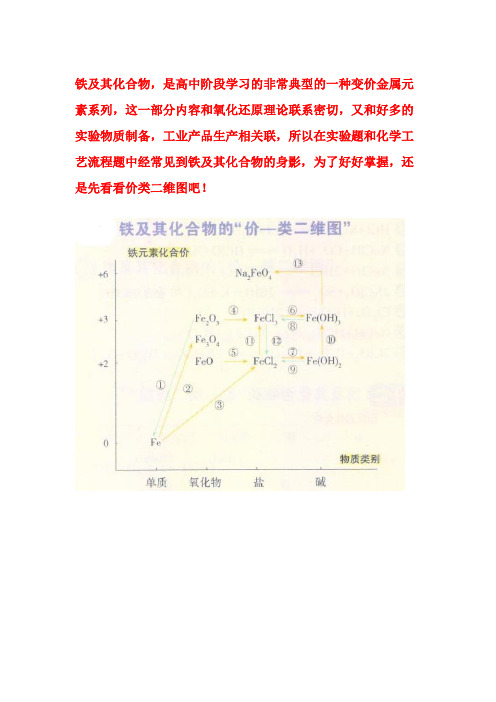
铁及其化合物,是高中阶段学习的非常典型的一种变价金属元素系列,这一部分内容和氧化还原理论联系密切,又和好多的实验物质制备,工业产品生产相关联,所以在实验题和化学工艺流程题中经常见到铁及其化合物的身影,为了好好掌握,还是先看看价类二维图吧!1、铁的误区警示常温下,铁与水不反应,只有在高温条件下,Fe才会与水蒸气反应。
1.某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管B中放入还原铁粉和石棉绒的混合物,再结合一些步骤,就可以完成高温下“Fe与水蒸气的反应实验”(已知石棉绒是耐高温材料,不与水和铁反应)。
Ⅰ.探究“铁与水蒸气”能否发生反应(1)如何检查该装置的气密性。
(2)实验中石棉绒的作用是。
(3)反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当时(填实验现象),说明“铁与水蒸气”能够进行反应,写出铁与水蒸气反应的化学方程式。
Ⅱ.探究“铁与水蒸气” 反应的产物(1)假设还原铁粉反应完全,黑色固体为某种单一成分,为研究黑色固体成分,该研究小组甲同学提出以下假设:假设一:黑色固体全部是Fe3O4假设二:黑色固体全部是Fe2O3假设三:黑色固体全部是FeO乙同学认为即使不通过实验就可以否定甲同学的一个假设,你认为乙同学否认的假设是,理由是。
(2)若假设一正确,请设计实验加以验证,完成下列表格(仪器自选)。
限选实验试剂:1 mol·L-1硫酸、2 mol·L-1NaOH溶液、新制氯水、澄清石灰水、酸性KMnO 4溶液、KSCN 溶液、品红溶液【答案加评分标准】Ⅰ.(1)将C 处导气管末端浸入水槽中,微热A 处圆底烧瓶,气管末端出现气泡,停止加热后气管末端出现一段水柱,则气密性好,否则气密性不好(2分)(2)增大铁粉与水蒸气的接触面积(1分)(3)肥皂泡破裂,有爆鸣声(2分)3Fe+4H 2O(g)Fe 3O 4+4H 2(2分)Ⅱ. (1)假设二(1分)由于Fe 2O 3为红棕色粉末,则可以根据固体颜色直接否定假设二(1分)△【解析】试题分析:Ⅰ.(1)气密性检查一般用液差法,即将C 处导气管末端浸入水槽中,微热A 处圆底烧瓶,气管末端出现气泡,停止加热后气管末端出现一段水柱,则气密性好,否则气密性不好。
新教材高中化学《铁及其化合物》PPT公开课课件1

(7)Fe2O3 不 可 与 水 反 应 得 到 Fe(OH)3 , 所 以 不 能 通 过 化 合 反 应 制 取
× Fe(OH)3( )
[重点提醒] 1.铁在潮湿的空气中生成的铁锈的主要成分是 Fe2O3,而铁在纯氧中燃 烧的产物是 Fe3O4。 2.制取 Fe(OH)2 时,所用溶液要煮沸除氧气,要将吸有 NaOH 溶液的胶 头滴管插到液面以下,或在液面上覆盖一层苯或煤油(不能用 CCl4),以防止 空气与 Fe(OH)2 接触发生反应。
按要求书写下列反应的方程式:
①Fe 与 Cl2、S 反应的化学方程式: ________2_F_e_+__3_C_l_2=_点=_=_燃=_=__2_F_eC__l3_______________________; ________F_e_+__S_=_________________。
第3讲 铁及其化合物
[考纲要求] 1.了解铁及其重要化合物的制备方法。 2.掌握铁的主要性质及应用。 3.掌握铁的重要化合物的主要性质及应用。
考点一 铁及其氧化物和氢氧化物
1.铁的性质 (1)物理性质 铁为_银__白___色固体,具有良好的导电、导热、延展性。 (2)化学性质 铁单质性质活泼,有较强的还原性,主要化合价为+2 价和+3 价。
②碱性 Fe(OH)2 属于二元弱碱,Fe(OH)3 属于三元弱碱,与非氧化性强酸反应的 离子方程式分别为 ____F_e_(_O_H__)2_+__2_H_+_=_=_=_F_e_2_+_+__2_H_2_O_;__F_e_(_O_H__)3_+__3_H_+_=_=_=_F_e_3_+_+__3_H_2_O______
铁及其化合物的课件(上课用)

黄铁)矿(FeS2
一、铁的重要化合物 1.铁元素的存在 地壳中金属元素的含量居前
两位的是 Al 、 Fe ,铁元素主 要以 +2价 和 +3价 的化合物 形式存在。
2、铁的氧化物
化学式 俗名
颜色、状态
FeO
氧化亚铁 黑色粉末
Fe2O3
氧铁化红铁 红棕色粉末
Fe3O4
磁四性氧氧化化三铁铁 黑色晶体
FeCl3
FeSO4
加入NaOH 溶液产生 的现象
产生红褐色的 沉淀
先有白色的沉淀, 迅速变成灰绿色, 最后变成红褐色。
离子 方程式
Fe2++2OH-=Fe(OH)2 ↓ Fe3++3OH-=Fe(OH)3 ↓ 4=Fe(OH)2+O2+2H2O
4Fe(OH)3
Fe(OH)ห้องสมุดไป่ตู้3的实验制备视频
Fe(OH) 的实验制 2
Fe3O4+4CO===3Fe+4CO2
我国科学家参与研制的阿尔法磁谱仪随美国 发现号航天飞机升入太空,开始了探索宇宙 中是否存在“反物质”和“暗物质”的研究工作。 根据所学的知识推测制造阿尔法磁谱仪核心 部件的材料是 ( )
A.FeO C.Fe3O4
B.Fe2O3 D.Fe
【答案】 C
*
3.铁的氢氧化物
出土的古代铜制品上往 往覆盖着一层铜绿(主 要成分是Cu2(OH)2CO3 )
误食重金属盐中毒的原因:重金属离子使蛋白质变 性,从而使蛋白质失去了生理活性。
实践活动:铝盐和铁盐的净水作用
2 min 5 min
不加试剂
加入明矾
加入硫酸铁 溶液
有明显沉降, 有明显沉降 无明显变化 溶液半透明 溶液半透明
(新)人教版《铁及其化合物》公开课课件PPT3

守恒角度进行判断,如原子守恒、电荷守恒、氧化还原反应中的电子守恒等;④从反应的条件进行判断;⑤从反应物的组成以及反应
已知硝酸能将Fe 氧化为Fe 。现对A、B、 2+ 3+ 物之间的配比进行判断(题中D项)。
由于在相同条件下,气体的密度之比是相应的化学计量数之比,所以混合气的平均相对分子质量是1.082×32=34.6。这说明氯化氢不纯
C、D作出的如下推断中,不正确的是( A ,混有空气。则氯化氢和空气的体积之比约是3︰1,所以进入容器中液体的体积是3/4L,即0.75L,答案选C。
(1)3He是高效核能原料,其原子核内中子数为_____________。 3. 进行化学实验时必须注意安全,下列说法不正确的是( )
)
A.A盐一定是FeCl3 【解析】
酸性高锰酸钾溶液
只有Fe2+ 只有Fe3+ Fe2+、Fe3+都存在
硫氰化钾溶液
不变红 双氧水
变红
酸性高锰酸钾 溶液
变红
酸性 高锰酸钾溶液
变红
无变化
紫色褪去
习题 某同学对未知物A盐的水溶液进行了
鉴定,实验过程及现象如图所示:
根据N=nNA可以知道,气体中含有原子的物质的量相等时,所含的原子数一定相等,分别根据n= = 计算出气体的物质的量,然后结合
或氧化铝均既能与酸反应,也能与碱反应,所以铝制餐具不宜长时间存放酸性、碱性和咸的食物,B正确;C.铁具有还原性,因此用
C.滤液C中一定含Fe3+ 含有铁粉的透气小袋与食品一起密封包装来防止食品氧化,C正确;D.化学药品着火,不一定能用水或泡沫灭火器来灭火,如钠的燃
烧,只能用沙土来灭,要根据化学药品的性质来分析选用灭火剂,D错误,答案选D。 B. 用四氯化碳萃取碘水中的碘时,将碘的四氯化碳溶液从分液漏斗下口放出
高中新教材化学优质课公开课课件 (13)

NaOH溶液
NaOH溶液
FeCl3溶液
FeSO4溶液
在两支试管中分别加入少量的FeCl3溶液和FeSO4溶液, 然后各滴入NaOH溶液。观察并描述发生的现象。
FeCl3溶 液中的
现象
FeSO4溶 液中的
现象
FeCl3溶液中产生了红褐色沉淀; FeSO4溶液生成的白色絮状沉淀迅速变成灰绿色,过一段时间后还会有红 褐色物质生成。
提示:铁与水会反应吗?
钢水注入干燥的模具
生活经验告诉我们,常温下,铁与水是不发生反应的。 但在高温下,铁能与水发生反应。
还原铁粉 湿棉花
可以观察到铁(如果是纯铁,为
肥皂液
白色金属)变为黑色粉末状物质 (Fe3O4)。同时生成了气体—— 氢气。
燃着的火柴
根据实验器材、实验现象书写铁在高温下和水的反应式。
的 两
氢氧化铁(Fe(OH)3)
色的Fe2O3粉末:2Fe(OH)3—△—Fe2O3+3H2O
种
氢
氧
化
氢氧化亚铁(Fe(OH)2)
白色固体,难溶于水
物
铁的氢氧化物都是不溶性碱,都能与酸发生反应。
白色的Fe(OH)2会被溶解在溶液中的氧气氧化。那么,在实 验室里,如何得到Fe(OH)2呢?
思路是如何防止Fe(OH)2被氧气氧化。 可以用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反 应制备。这样就能使Fe(OH)2的在无氧环境下生成,不会氧化成 Fe(OH)3。
还原铁粉 湿棉花
肥皂液
3Fe+4H2O高—温—Fe3O4+4H2
燃着的火柴
反应式3Fe+4H2O—高—温Fe3O4+4H2 中的气体H2为什么不加“↑” 符号呢?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题: (1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1 的溶液。在FeCl2液中需加入少量铁属,其目的是________。 (2)甲组同学取2mlFeCl2溶液.加入几滴氯水,再加入1滴 KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反 应的离子方程式为_______。 (3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2 溶液中先加入0.5ml煤油,再于液面下依次加入几滴氯水和l滴 KSCN溶液,溶液变红,煤油的作用是______。
节选2018·北京卷 T12
Tankertanker Design
Fe3+和Fe2+的考点总结归纳:
Tankertanker Design
*Fe2+、Fe3+的性质?如何配制其溶液? *Fe2+、Fe3+如何检验?具体的方案如何? *Fe2+、Fe3+相互转化、及特定条件下二者如何辨析?
Tankertanker Design
铁在地壳中的含量及存在形式
Tankertanker Design
铁的氧化物
Tankertanker Design
FeO
Fe2O3
Fe3O4
Tankertanker Design
*从元素化合价的角度认识物质,推测物质可能的性质
分子式
俗名 色、态 铁的化 合价 水溶性
氧化亚铁
氧化铁
四氧化三铁
Tankertanker Design
Fe2++2OH-=Fe(OH)2↓ 4Fe(OH)2+O2+2H2O=4Fe(OH)3
Tankertanker Design
*氢氧化亚铁的制备及新型装置原理的介绍
*氢氧化铁的制备及性质
Tankertanker Design
Tankertanker Design
化学小诗歌
胶体 负九负七数量级,乃属胶体分散系。 布朗电泳丁达尔,除杂操作称渗析。
Tankertanker Design
节选2020·全国I卷 T27 27.为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
(3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入 ________电极溶液中。 (4)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L−1。石 墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=________。 (5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为_______,铁电极 的电极反应式为_______。因此,验证了Fe2+氧化性小于________,还原 性小于________。
实验②检验的离子是_______(填离子符号);实验①和③说明:在I-过量的 情况下,溶液中仍含有_______(填离子符号),由此可以证明该氧化还原反应 为__________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl3溶液,溶液·变 成棕黄色,发生反应的离子方程式为________;一段时间后.溶液中有气泡出 现,并放热.随后有红褐色沉淀生成。产生气泡的原因是________;生成沉淀 的原因是_______(用平衡移动原理解释)。
*氢氧化铁胶体的制备 *胶体与其他分散系的本质区别 *胶体的性质、胶体胶粒区别 *有关胶体性质生活中的实例
*钢铁的腐蚀与防护
节 选 自 选 修 四 教 材
Tankertanker Design
Tankertanker Design
Tankertanker Design
*Fe2+和Fe3+的性质【含性质、转化、鉴别、检验】
拓展内容: *K2FeO4与净水 无论是酸性环境还是碱性环境都有较强的氧化性,可以广泛的用于水和废 水的氧化、消毒、杀菌。因此,高铁酸盐是备受关注的一类新型、高效、 无毒的多功能净水剂。在饮用水的处理过程中,集氧化、吸附、絮凝、沉 淀、灭菌、消毒、脱色、除臭等八大特点为一体的综合性能。
*K2FeO4的性质:
Tankertanker Design
青砖和红砖是生活中常用的两种建筑材料,你认为其中 含有什么氧化物?
2.铁的氢氧化物
Tankertanker Design
红褐色沉淀
生成白色絮状沉淀,迅速变为灰绿 色,最后变为红褐色沉淀
离子方 Fe3++3OH= 程式 Fe(OH)3↓
Tankertanker Design
(4)丙组同学取10 mL0.1 mol·L-1KI溶液,加入6mL0.1 mol·L-1FeCl3溶液混合。 分别取2mL此溶液于3 支试管中进行如下实验:
①第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色; ②第二只试 管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀;③第三支试管中加入1滴KSCN 溶液,溶液变红。
Tankertanker Design
学生活动: 这些化合物都是碱性氧化物么? 写出几种化合物与非氧化性酸盐酸的反应的离子方程式 写出几种化合物与氧化性酸稀硝酸的反应的离子方程式
Tankertanker Design
铁的化合物的用途 作为冶炼金属的原料
高温
Fe2O3+3CO===2Fe+3CO2
b、Fe2O3 用于制红色油漆和涂料
C、Fe3O4用于制录音磁带和电讯器材。
