分析化学第七讲:氧化还原滴定法(一)
分析化学课件 氧化还原滴定法

(3) n1=n2=2
K= c(Ox2) c(Red1)106 c(Red2) c(Ox1)
=1
-2
=0.059lg106 =0.18V 2
>0.4V 反应就能定量进行
7.1氧化还原反应的方向和程度
一般认为,若两电对的条件电极电势之差大于0.4V, 反应就能定量进行,就有可能用于滴定分析。
但在某些氧化还原反应中,虽然两个电对的条件电 极电势相差足够大,符合上述要求,但是由于有副 反应发生,氧化剂和还原剂之间没有一定的化学计 量关系,这样的反应还是不能用于滴定分析。
7.2 氧化还原反应的速度
一、氧化还原反应的历程
有很多氧化还原反应是分布进行的,其 中只要有一步是慢的,就影响了总的反应速 度。
二、影响氧化还原反应速度的因素
1. 反应物浓度的影响 2. 温度的影响 3. 催化剂的影响 4. 诱导反应
7.1氧化还原反应的方向和程度
(1) n1=n2=1
Kc(Ox2)c(Red1)106 c(Red2) c(Ox1)
=120 .0 1 5 9lgK 0 .3 5 V
(2) n1=1, n2=2
K
=
c(Ox2) c(Red2)
c(Red1) c(Ox1)
2
109
=1
-2
=0.059lg109 =0.27V 2
n a(Red)
(标准电位)
a(Ox)=a(Red) =1时,
0.0 n 59lg((R O e x d ))0.0 n 59lg[[R O e x d ]]
c (浓度电位)
一般可知氧化剂和还原剂的分析浓度c
若有副反应发生:
0.05l9 g2 (o)x0.05l9 g [o 2]x
(分析化学课件)第七章氧化还原滴定法

津 科 技
2MnO4- + 5C2O42- + 16H+ = 2Mn2+ + 10CO2↑+ 8H2O
大
学
②标准溶液标定时的注意“三度一点”
a.速度:该反应室温下反应速度极慢,利
用反应本身所产生的Mn2+起自身
催化作用加快反应进行。
b.温度:常将溶液加热到75~85℃。温度
高于90℃会使发生下述反应:
α为Fe的副反应系数
天 当电对的氧化态和还原态的分析浓度均 津 为1mol·L-1时,可得到:
科 技 大 学
EӨ′称为条件电势。
注意:
附录表16中列出部分氧化还原电对在不
同介质中的条件电势,均为实验测得值。
当缺乏相同条件下的条件电势时,可采用
天 条件相近的条件电势数据。
津
条件电极电势与标准电极电势差异很大。
津
科 若考虑副反应影响,则以K’代替K:
技 大 学
天 津 科 技 大 学
7.1.4 化学计量点时反应进行的程度
由化学计量点时氧化态与还原态浓度的 比值表示。
可以根据平衡常数求得。
天 津 科 技 大 学
例7.3 计算1mol/L HCl介质中,Fe3+与Sn2+ 反应的平衡常数及化学计量点时反应进行的 程度。已知 E F '3 /e F 2 e 0 .6V ,8 E S '4 n /S2 n 0 .1V 4
(3)间接碘法:利用I-的还原性。
①基本反应:
2I- - 2e → I2 I2 + 2S2O32-= S4O62-+2I-
(中性或弱酸性条件)连四硫酸根
天 津
P
H,S22IO234H2HO 2 SI2H22SH2O O 3
氧化还原滴定法(共52张PPT)

lgK(1 2)n1n2n
0.059
差值越大, 反应越完全
一般认为: º或 f 应有0.4V以上
影响 K 值的因素:
① n1 n2
② 1º~ 2º
注意:
① n1 n2 最小公倍数
② K ~ º K ~ f
五、滴定反应对平衡常数的要求
①当n1=n2=1时,两电对条件电势差大于
②当n1=n2=2时,两电对条件电势差大于 ③当n1≠n2时,
1
n [R]ed n [R] ed 酸度: H2SO4介质,控制~1mol/L
1
1
0 .0592
2
2
2
这些关于 Ep的讨论都是指对称电对
低—反应慢, 高—H2C2O4分解
邻二氮菲 - 亚铁
[O]x n [O]x n 0 .059 10 Cl- + 2 MnO4- + 16 H+ == 5 Cl2 + 2 Mn2+ + 8 H2O
O/R xe d O/R xe+d0n .0l5 ga a9 R Oexd
O/xRedO/xRed+0n .05lg9[[R Oexd]]
gg aa Ox/Red
Ox/Red
+ 0.059 lg( n
Ox Red
c Red Ox ) c Ox Red
三、条件电极电势
gg a a O /R xe d O /R xe + 0 dn .l0g5 R O (e 9 x R O d c c e R O xd e )xd
二苯胺磺酸钠
0.84V 如何选择?
另:
指示剂校正
第五节 氧化还原滴定前的预处理
目的:将被测物预先处理成便于滴定的形式
《氧化还原滴定法》课件

酚酞指示剂
在弱酸性条件下,由无色变为粉红色,常用于 测定氧化剂和还原剂的滴定。
甲基橙指示剂
在酸性条件下,由红色变为黄色,常用于测定 还原剂的滴定。
二溴酚蓝指示剂
在强酸性条件下,由黄色变为蓝色,常用于测 定氧化剂和还原剂的滴定。
邻苯二酚指示剂
在碱性条件下,由无色变为蓝色,常用于测定 氧化剂的滴定。
常用的滴定试剂及其应用
滴定的控制误差和计算结果的 处理
滴定的控制误差主要包括滴定试剂的误差、指示剂的误差和操作误差。
为了减小滴定的误差,可以使用称量精确的试剂、选用敏感的指示剂,并尽 量减小搅拌或振荡时的人为误差。
滴定法在分析化学中的应用
滴定法广泛应用于分析化学中,可用于测定无机化合物、有机化合物、电解 质和非电解质的含量和浓度。
《氧化还原滴定法》PPT 课件
本课件将介绍氧化还原滴定法的基本原理,滴定的步骤和操作要点,常见的 氧化还原指示剂,以及常用的滴定试剂及其应用。
此外,我们还会学习如何计算滴定反应的过量试剂量,控制滴定误差以及处 理计算结果,并深入探讨滴定法在分析化学中的应用。
滴定的基本原理
滴定法是一种常用的定量分析方法,通过滴定试剂与被测物质进行化学反应,确定被测物质的含量。 滴定的速反应达到滴定终点,从而确定被 测物质的浓度。
滴定法具有快速、准确、经济的特点,是定量分析的重要手段,被广泛应用 于实验室和工业生产中。
高锰酸钾溶液
碘溶液
硫代硫酸钠溶液
常用于测定还原剂的浓度和含量。 常用于测定还原剂的浓度和含量。 常用于测定氧化剂的浓度和含量。
计算滴定反应的过量试剂量
滴定反应的过量试剂量是指在滴定终点之后,滴定试剂继续滴定并加入到被滴定溶液中的体积。 计算过量试剂量的方法是基于滴定反应的立方方程式,并考虑到滴定试剂的浓度和滴定反应的摩尔比例。
分析化学第七讲:氧化还原滴定法

分析化学第七讲:氧化还原滴定法分析化学第七讲:氧化还原滴定法在化学分析领域中,氧化还原滴定法是一种常用的定量分析方法。
本篇文章将深入探讨氧化还原滴定法的原理、实验操作流程、应用领域以及优缺点,帮助读者更好地理解和掌握这一分析技术。
一、氧化还原滴定法的基本原理氧化还原滴定法是以氧化剂和还原剂之间的反应为基础,通过滴定计量氧化还原反应的进程来确定待测物质的含量。
其中,氧化剂是指能够夺取电子的物质,而还原剂则是指能够提供电子的物质。
在特定的实验条件下,氧化剂和还原剂的反应速率是恒定的,因此,通过滴定可以精确计算出反应物的量。
二、氧化还原滴定法的实验流程1、准备试样和试剂:选择合适的试样,准备相应的氧化剂、还原剂和指示剂。
2、滴定前的预处理:对试样进行适当的预处理,以便进行氧化还原反应。
3、滴定操作:将试样与氧化剂混合,观察反应进程,记录滴定开始至结束的时间。
4、数据记录与计算:根据实验数据计算出试样中待测物质的含量。
5、重复实验:为了确保实验结果的准确性,可能需要重复进行滴定操作。
三、氧化还原滴定法的应用领域氧化还原滴定法在许多领域都有广泛的应用,如环境保护、化工、食品、医药等。
例如,在环境保护中,可以运用该方法测定水体中的铁离子、锰离子等重金属离子的含量;在化工领域,可以用于测定原料、中间产物和最终产品的含量。
四、氧化还原滴定法的优缺点1、优点:(1) 适用范围广:氧化还原滴定法可用于测定多种物质,包括无机物和有机物。
(2) 精确度高:由于氧化还原反应的速率容易控制,因此该方法的测量精度较高。
(3) 可重复性好:多次实验的结果之间的一致性较好。
2、缺点:(1) 对实验条件要求较高:某些氧化还原反应需要在特定的实验条件下进行,如温度、压力、pH值等,对实验设备的要求较高。
(2) 反应速度较慢:某些氧化还原反应的速率较慢,需要较长的滴定时间。
(3) 干扰因素较多:例如,试样中的杂质可能会干扰氧化还原反应的进行,从而影响测量结果。
氧化还原滴定法

氧化还原滴定法任务一基础理论基本知识学习目标1.掌握氧化还原滴定法对化学反应的要求。
2.掌握高锰酸钾法及碘量法的原理、滴定条件和指示剂。
3.掌握氧化还原滴定法的有关计算。
4.理解氧化还原滴定法的特点。
5.理解在氧化还原滴定中提高反应速率的方法。
6.了解标准溶液的配制与标定。
7.了解氧化还原滴定法的应用。
7.1 概述7.1.1 氧化还原滴定法的特点与条件1.氧化还原滴定法的特点氧化还原滴定法是以氧化还原反应为基础的滴定分析方法。
氧化还原滴定不同于酸碱、配位、沉淀等滴定。
在这些滴定中,标准溶液与被测物质的化合价不会发生变化,因此,反应机制比较简单,反应速率比较快。
而氧化还原滴定涉及的氧化还原反应实质上是一种电子由还原剂转移到氧化剂的反应,物质的化合价会发生变化,有些反应还需要在一定的介质中进行。
因此,其反应机制一般比较复杂,反应往往分步进行,大多数反应速度较慢,且常伴有副反应发生,介质对反应也有较大的影响。
2.氧化还原滴定法必须具备的条件氧化还原滴定法与其他滴定分析方法一样,必须满足一定的条件才能滴定。
(1)滴定反应必须按化学反应式确定的计量关系定量地完成。
(2)反应速率必须足够快,不能有副反应发生。
(3)必须有适当的方法确定化学计量点。
3.提高氧化还原反应速率的方法大多数的氧化还原反应速度较慢,很难达到滴定分析对化学反应的要求。
因此,在实际滴定中,通常要采取一些措施,控制反应的外部条件,提高反应速率,使之符合滴定分析的要求。
⑴增大反应物的浓度根据质量作用定律,反应速率与反应物浓度的乘积成正比。
增加反应物浓度不仅能加快反应速率,而且可以使反应进行的更完全。
但要注意的是这里所谓的反应物的浓度通常不是指标准溶液与被测物质的浓度,而是指滴定反应中参与反应的其他反应物介质浓度。
例如,用基准物质K2Cr2O7标定Na2S2O3标准溶液浓度时,在酸性溶液中,先加入过量KI与K2Cr2O7反应,反应式为Cr2O72- + 6I+ + 14H+=2Cr3+ + 3I2 + 7H2O在此反应中,也可通过增加H+浓度的方法来加快反应速率。
分析化学-氧化还原滴定法ppt课件

II. 进一步理解影响氧化还原反应的各种因素:包 括反应方向、反应次序、反应速度等,从而选 择和创造适当的反应条件,使氧化还原反应趋 于完全;
精选PPT课件
2
分析化学
III. 掌握氧化还原滴定过程中,溶液离子浓度和 电位变化的规律,为选择适当的指示剂确定 滴定终点提供依据;
IV. 掌握几种常用的氧化还原滴定方法:高锰酸 钾法、重铬酸钾法、碘量法和溴酸盐的特点、 反应条件和应用范围;
例如: Ag+/Ag A g ++e A g (s)
E Ag/
0.799V5
Ag
A g C l ( s ) + e A g ( s ) + C l -EAg/CAlg0.22V2
A g B r ( s ) + e A g ( s ) + B r -EAgB /Arg0.07V1
精选PPT课件
9
分析化学
EE RTlnaOx nF aRed
考虑离子强度 EERT lnO[xO]x nFRde[Rd]e
精选PPT课件
15
分析化学
考虑副反应 EEn RF T lnR OdcecxO Rdxe RO dex
对于实际电对, 其氧化型、还原型的分析浓度cox,
cred是可知的, 而rOx , rRed , Ox , Red需要根据溶液
E取决于:
E:电对的性质
表示在298K,参加电对反应的有关组分的活度为 1 mol/L( 或活度比为1),气体压力为1atm (1.013×105Pa)时,某电对相对于标准氢电极的电 极电势,与电对本质及温度相关。
精选PPT课件
8
分析化学
3. 关于Nernst方程的几点说明: A. 必须明确电对的氧化型和还原型
氧化还原滴定法

通过分离方法将干扰离子从溶 液中除去,如萃取、离子交换 等。
提高测定的准确度
01
02
03
04
准确称量样品和滴定剂, 确保测量精度。
严格控制实验条件,如 温度、搅拌速度等。
进行空白实验和对照实 验,减小实验误差。
多次测量求平均值,提 高测定结果的可靠性。
05
氧化还原滴定法的注意事项
安全注意事项
01
硫酸铈滴定法
总结词
硫酸铈是一种强氧化剂,可用于滴定多 种还原性物质,如亚铁离子、硫化物等 。
VS
详细描述
硫酸铈滴定法通常在酸性环境中进行,通 过加入适量的还原剂使硫酸铈还原为铈离 子,通过滴定消耗的硫酸铈量来计算被测 物的含量。该方法具有较高的准确度和精 密度,是常用的氧化还原滴定法之一。
03
氧化还原滴定法的操作步骤
滴定前的准备
试剂和标准溶液的准备
01
根据实验要求,准确称量所需的试剂和标准溶液,确保其质量
和浓度符合要求。
仪器设备的检查
02
确保使用的滴定管、容量瓶、移液管等仪器设备干净、准确,
并进行必要的校正。
实验环境的控制
03
保持实验室内温度、湿度等环境因素稳定,以减小误差。
滴定操作
01
02
03
溶液的混合与搅拌
根据实验数据计算待测溶液的浓 度、体积等参数,并进行误差分 析。
整理实验数据和结果,撰写实验 报告,并按照要求进行结果分析。
04
氧化还原滴定法的实验技巧
选择合适的指示剂
指示剂应具有高灵敏 度,能够准确指示滴 定终点。
指示剂的变色点应与 被测离子的等当点相 近。
指示剂的颜色变化应 明显,以便观察。
氧化还原滴定法原理

四、氧化还原滴定法原理(一)氧化还原滴定指示剂常用指示剂有以下几种类型:(1).自身指示剂有些标准溶液或被滴定物质本身有颜色,而滴定产物无色或颜色很浅,则滴定时就无需另加指示剂,本身颜色变化起着指示剂的作用叫作自身指示剂。
MnO4-(紫红色)+ 5Fe2+ + 8H+ = Mn2+(肉色,近无色)+ 5Fe3+ + H2O KMnO4的浓度约为2×10-6 mol/L 时就可以看到溶液呈粉红色,KMnO4滴定无色或浅色的还原剂溶液,不须外加指示剂。
KMnO4称为自身指示剂。
(2).显色指示剂有些物质本身并没有氧化还原性,但它能与滴定剂或被测物质产生特殊的颜色,因而可指示滴定颜色。
I2 + SO2 + 2H2O = 2I- + SO42- + 4H+可溶性淀粉与碘溶液反应,生成深蓝色的化合物,可用淀粉溶液作指示剂。
在室温下,用淀粉可检出10-5mol/L 的碘溶液。
温度升高,灵敏度降低。
(3).本身发生氧化还原反应的指示剂这类指示剂的氧化态和还原态具有不同的颜色,在滴定过程中,指示剂由氧化态变为还原态,或由还原态变为氧化态,根据颜色的突变来指示终点。
作用原理:设指示剂氧化还原电对为式中In(O)和In(R)分别代表具有不同颜色的指示剂的氧化态和还原态。
随着滴定的进行,溶液电位值发生变化,指示剂的也按能斯特方程所示的关系发生变化:变色范围理论变色点指示剂选择:使落在滴定突跃范围之内。
例如Cr 2O 72-(黄色) + 6 Fe 2+ + 14 H + = 2Cr 3+(绿色)+ 6Fe 3+ + 7H 2O需外加本身发生氧化还原反应的指示剂,如二苯胺磺酸钠指示剂,紫红→无色。
指示剂变色的电势范围为: 'In In 0.059(V)E E nθ∆≤±(考虑离子强度和副反应) 氧化还原指示剂的选择:指示剂的条件电势尽量与反应的化学计量点电势一致。
(4)常用的氧化还原指示剂 ① 二苯胺磺酸钠:H + 氧化剂二苯胺磺酸钠 二苯胺磺酸 二苯联苯胺磺酸 (还原型) (无色) 氧化剂二苯联苯胺磺酸紫(紫色)(氧化型)反应的 n =2,变色电位范围:2059.085.0-~2059.085.0+ 即 0.82 ~ 0.88 (V)二苯胺磺酸钠指示剂空白值:产生原因:a.指示剂用量;b.滴定剂加入速度、被滴定剂浓度及滴定时间等因素有关消除办法:用含量与分析试样相近的标准试样或标准溶液在同样条件下标定K 2Cr 2O 7 。
氧化还原滴定法原理(分析化学课件)

三、氧化还原滴定法的指示剂
一些氧化还原指示剂的条件电极电势及颜色变化
指示剂
次甲基蓝 二苯胺 二苯胺磺酸钠 邻苯胺基苯甲酸 邻二氮杂菲—亚铁 硝基邻二氮杂菲—亚铁
θ' ln
/V
c(H+)=1
mol · L-1
0.36
0.76
0.84
0.89
1.06
1.25
颜色变化 氧化形 还原形
蓝
无色
紫
无色
红紫
无色
P323 附录F
电极电位的大小,主要 取决于物质的本性,但 同时与体系的温度、浓 度等外界条件有关。
标准电极电位: 温度:25℃ 压力:1atm 浓度:1mol/L
电对的标准电位越高,其氧化型的氧化能力就越强;反之电对的标 准电位越低,则其还原型的还原能力就越强。因此,作为一种还原 剂,它可以还原电位比它高的氧化剂。根据电对的标准电位,可以 判断氧化还原反应进行的方向、次序和反应进行的程度。
E
E
RT
a(Ox) ln
E 0.059 lg a(Ox)
n F a(Re)
n a(Re)
(25C )
E , — 标准电极电位(电势·. ),热力学常数,温度的函数。
aOx , aORe — 分别为氧化态和还原态的活度
R — 摩尔气体常数,8.314J/(mol.K)
T — 热力学温度
n — 半反应中电子的转移数
即生成Fe(Ⅲ)的硫氰酸配合物时,即为终点。
பைடு நூலகம்
氧化还原反应,除了发生主反应外。常常可能发生副反应或因条 件不同而生成不同产物。因此,要考虑创造适当的条件,使它符 合满足分析的基本要求。
一、氧化还原电对和电极电位
分析化学氧化还原滴定法PPT精选文档

16
氧化还原反应进行的程度
当 1( 2 无副或 反 1'应 2 ( ')有副反应
p2Ox1 + p1Red2
p1Ox2 + p2Red1
平衡常 K数 aaR pO p22ed1x1
lgKlgaaRpO p22ed1x1
p1
aO2x ap1
Red2
n(1 2)(无副反应
0.059
1 ' 0.n 015lg9 C C R Od 11 ex2 ' 0.n 025lg9 C C R Od 2e 2x
lgK'lgC CR p O p22d1e1xC CR p O p11d2 e2x
14
氧化还原反应平衡
H H3 AA sO 24 s [O [ HH [ H]] 3 ]K[ aH ]2K a 1 [ [H H ] ]2 3 K a 1 K a 2 K a 1 K a 2 K a 3
当 [ H ] 5 m /L o H '3 A l4s H O 2 A 0 . 6 s V O 0 I 3 /I
C ‘ 4 e C 3 e 0 .0l5 g C C C C 9 3 4 e e 1 .4 4 0 .0l5 1 g 9 3 0 1 .2V 6
CF2e 0.1
F '3 e F 2 e 0 .0l5g C C F F 9 2 3 e e 0 .6 8 0 .0l5 1 g3 9 0 0 .8V 6
26
氧化还原滴定曲线及终点确定
S时 P C F 3 e : C C 3 e , C F 2 e C C 4 e
分析化学:氧化还原滴定法
×5) C2O422e→2CO2↑ (+
2MnO4+16H++ 5C2O42 →2Mn2++10CO2↑
碱性条件则最后两边同加OH
+8H2O
二、条件电位及其影响因素
1. 条件电位 对于电极反应 aOx+ne bRed
其Nernst方程:
Ox/ Re θO d x/ R 0.e 0 nd5 lg a a 9 R b O a exd(2ο5 C )
( θO/xRed0.0 n5l9 gO O aa x xR b rbeed )d O x/R (条e件d 电位)
条件电位φ’Ox/Red随离子强度、pH、副反应系数而变。
2. 影响φ’Ox/Red因素
⑴盐效应 仅考虑此影响时:
θ
0.0n59lgRbO aexd
但γOx,γRed精确值难求,又各种副反应的影响 远大于盐效应∴常忽略盐效应,忽略后的计算式:
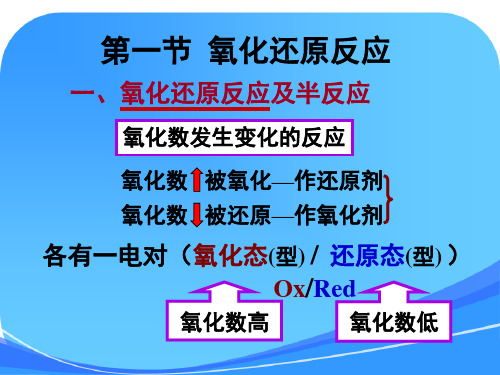
第一节 氧化还原反应
一、氧化还原反应及半反应
氧化数发生变化的反应
氧化数 被氧化—作还原剂
氧化数 被还原—作氧化剂
各有一电对(氧化态(型) / 还原态(型) )
Ox/Red
氧化数高
氧化数低
例: Ce4+ + Fe2+
Ce3+ + Fe3+
OX1 Red2
Red1 OX2
Ce4+的氧化值↓,它被还原,作氧化剂;
θ Cu2+/Cu+
=
0.16V
I2+2e 2I
φθ I2/I
=
0.54V
反应2Cu2++2I 2Cu++I2 似乎不能进行,但由于
氧化还原滴定法

氧化还原滴定法简介氧化还原滴定法是一种定量分析方法,常用于测定含氧化还原反应的物质的浓度。
在氧化还原反应中,电子会从被氧化的化合物转移到还原的化合物上,因此被称为氧化还原反应。
该方法通过滴加一种称为滴定剂的溶液来确定待测物质的浓度。
滴定剂与待测物质发生氧化还原反应,当待测物质的化合价发生改变时,滴定剂就不再反应,此时滴定完成。
原理氧化还原滴定法的原理基于以下事实:在氧化还原反应中,电子会从一个原子或分子转移到另一个原子或分子上,这样产生了电子的转移和化学计量量的变化。
因此,滴定剂可以被用来测定待测物质的化学计量量。
氧化还原反应中,电子可以从还原剂转移到氧化剂。
还原剂是一种能够给予电子的物质,它通常是一种容易氧化的物质,其化合价低于其氧化态。
氧化剂则是一种吸收电子的物质,通常是一种含氧化合物,其化合价高于其还原态。
在氧化还原滴定法中,将待测物质溶于适当的溶剂中,加入过量的还原剂,然后再滴加氧化剂,滴定至反应终点。
滴定时应注意滴定剂的选择,其氧化还原电位应当介于待测物质和还原剂之间。
当滴定剂的量与待测物质的量恰好相等时,反应终点即可确定,此时滴定完成。
操作步骤1.准备待测物质溶液,加入适当的溶剂并充分溶解;2.加入过量的还原剂;3.将寻找合适的滴定剂并确定滴定方法;4.开始滴定,滴定至反应终点(反应终点可以通过颜色变化、电位变化、气体产生等特征来确定);5.通过滴定前后的重量差或溶液浓度计算待测物质的化学计量量。
应用氧化还原滴定法广泛应用于分析化学、药学、食品工业、环境检测等领域。
例如,在药学中,可以用过氧化氢作为氧化剂来测定药物中的铁含量,氯亚铁作为还原剂来测定汞含量。
在环境检测中,可以使用铁离子和硫酸根离子来测定自然水样中的硫酸盐含量。
氧化还原滴定法是一种定量分析方法,可以通过滴加滴定剂来确定待测物质的浓度。
该方法基于化学计量量的变化,将还原剂加入待测物质溶液中,并滴加氧化剂,滴定至反应终点。
氧化还原滴定法在分析化学、药学、食品工业和环境检测等领域发挥着重要作用。
《氧化还原滴定法 》课件

滴定过程的步骤与注意事项
1
步骤一:标定滴定剂
用标准溶液对滴定剂进行标定,并计算滴定剂的浓度。
2
步骤二:准备被滴定物溶液
按照实验需求,准备含有被滴定物的溶液。
3
步骤三:滴定过程
将滴定剂逐滴滴入被滴定物溶液中,观察指示剂颜色变项
保持实验器材干净、避免误差源的引入;严格控制滴定剂的用量;仔细选择和使用适当的指 示剂。
被滴定物和滴定剂的作用机制是什么?
被滴定物是溶液中需要测定的氧化剂或还原剂,滴定剂是一种已知浓度的氧化剂或还原剂。被滴定物和滴定剂 在滴定过程中发生氧化还原反应,使溶液中氧化剂和还原剂的浓度得到测定。
确定滴定剂的选择原则
选择滴定剂时需考虑其与被滴定物反应的可逆性、滴定反应的速率和滴定终 点的明显性。滴定剂应与被滴定物发生可逆氧化还原反应,并且在滴定终点 有明显的颜色变化或称量变化。
氧化还原滴定法与其他滴定法的比较
氧化还原滴定法相对于其他滴定法具有快速、准确和灵敏度高的优点。与酸碱滴定法相比,氧化还原滴定法更 适用于测定那些没有明确定点的化学物质。
《氧化还原滴定法 》PPT 课件
本PPT课件详细介绍了氧化还原滴定法的原理、步骤、应用范围以及与其他滴 定法的比较。通过丰富的实验操作介绍和案例分析,帮助学习者深入理解氧 化还原滴定法的精确度和准确度。
什么是氧化还原滴定法?
氧化还原滴定法是一种常用的分析方法,用于测定溶液中氧化剂和还原剂的 浓度。通过滴定剂与被滴定物之间的氧化还原反应达到等量点,并利用指示 剂的颜色变化来判断滴定终点。
滴定指示剂的选用
滴定指示剂是能够在滴定过程中发生颜色变化的化合物,用于表示滴定终点的达到。选择适当的指示剂需要考 虑滴定反应的pH范围和指示剂的颜色变化范围。
氧化还原滴定法(一)

l
/
L时
' I2
I
I2
I
' Cu 2
Cu
Cu
2
Cu
0.059 lg 1 KspCuI
0.87V
I2
I
第一节 氧化还原反应平衡
12
3. 形成配合物:
与两者均形成配合物 氧化型配合物的稳定性 还原型配合物的稳定性 ' 还原型配合物的稳定性 氧化型配合物的稳定性 '
I
3
/
I
间接碘量法
直接碘量法
注:根据电对的电位高低判断氧化还原反应的方向
第二节 氧化还原反应进行的程度
16
1. 进行的程度用反应平衡常数来衡量 由标准电极电位→K 由条件电位→K’(条件平衡常数)
1 1
0.059 lg n1
aOx1 aRe d1
1
'
0.059 n1
lg
COx1 CRe d1
第一节 氧化还原反应平衡
13
例:间接碘量法测Cu2+
Cu 2
Cu
0.164V
I2
I
0.535V
Fe3
Fe2
0.771V
Fe3 氧化能力强,干扰Cu 2 测定
如加入能与Fe3形成配合物的F
'
Fe3
Fe2
0.059 lg
Fe2 ( F ) Fe3 ( F )
Fe3
Fe2
I
0.535V
Cu 2
Cu
Cu 2Cu 来自0.059lg
[Cu2 ] [Cu ]
Cu 2
Cu
0.059 lg
C Cu 2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氧化还原反应平衡
3.分析浓度表示式
[Ox] C Ox
Ox
, [Re d ]
C Re d
Ox / Re d
f Ox COx Re d 0.059 lg n f Re d C Re d Ox 0.059 f Ox Re d 0.059 COx lg lg n f Re d Ox n C Re d
Company
LOGO
第七讲:氧化还原滴定法(一)
主讲:高海涛
本讲内容
1 3 2
氧化还原反应平衡 氧化还原反应进行的程度
3
4 5 3
氧化还原反应的速度与影响因素 氧化还原滴定曲线及终点的确定
氧化还原法中的预处理
氧化还原反应平衡
一、氧化还原滴定法:以氧化还原反应为基础的滴定 分析方法 二、实质:电子的转移 三、特点: 1)机理复杂、多步反应 2)有的程度虽高但速度缓慢 3)有的伴有副反应而无明确计量关系 四、分类: 碘量法、高锰酸钾法、重铬酸钾法、 亚硝酸钠法、溴量法、铈量法 五、应用:广泛,直接或间接测定无机物、有机物
Re d
(二)标准电极电位
标准电极电位
n 半反应中的电子转移数
当a 1mol / L时 Ox / Re d
影响因素:常数,仅与电对本身性质和温度有关
氧化还原反应平衡
二、条件电极电位 (一)条件电极电位: 一定条件下,氧化型和还原型 的浓度都是1moL/L 时的实际电位
0.059 f Ox Re d 令 lg 条件电位 n f Re d Ox
'
Ox / Re d
0.059 COx lg n CRe d
'
氧化还原反应平衡
(二)影响条件电极电位的因素 与电解质溶液的浓度,及能与氧化还原电对发生 副反应的物质有关 实验条件一定,条件电位一定 1.离子强度(盐效应) 2.生成沉淀 3.形成配合物 4.酸效应
示例 已知:
Cu2+
+e
Cu+
2I-
Cu
2
Cu
0.164V
I2 + 2e
I
2
I
0.535V
理论上
实际上
Cu 2
Cu
2Cu+ + 2I2
2Cu2+ + 4I Cu 2
Cu
2Cu2+ + 4I2CuI↓ + 2I2
[Cu 2 ] 0.059 lg [Cu ]
还原型配合物的稳定性 氧化型配合物的稳定性 '
氧化还原反应平衡
例:间接碘量法测Cu2+ Cu2+ +e Cu+ 2IFe 2+
Cu
2
Cu
0.164V
I2 + 2e Fe3+ +e
I
2
I
3
氧化能力强,干扰 Cu 2测定
氧化还原反应平衡
1. 离子强度(盐效应)
离子强度改变 f 改变 '发生改变
盐效应不易计算 , 可忽略 规定f 1
0.059 Re d lg n Ox
'
2. 生成沉淀
氧化型生成沉淀 ' 还原型生成沉淀 '
氧化还原反应平衡
如加入能与Fe3形成配合物的F
Fe
'
3
Fe2
0.059 lg
Fe
2
(F ) (F )
Fe3
Fe2
1 0.059 lg 1 1[ F ] 2 [ F ]2 3[ F ]3
Fe
3
' 3 [ F ] 1mol / L Fe V 3 2 0.06 Fe 不再干扰测定 / Fe
氧化还原反应平衡
一、电极电位 Ox1 + ne Red2 Ox1 + Red2 Red1 Ox2 + ne Ox2 + Red1
电对的电极电位衡量氧化或还原能力的强弱 电对的电极电位越高,其氧化形的氧化能力越强 (还原形的还原能力越弱)——氧化剂 电对的电极电位越低,其还原形的还原能力越强 (氧化形的氧化能力越弱)——还原剂
2
I
I
2
I
Cu 2
'
Cu
Cu 2
Cu
1 0.059 lg 0.87V I 2 KspCuI
I
氧化还原反应平衡
3. 形成配合物:
与氧化型形成配合物 ' 与还原型形成配合物 '
与两者均形成配合物
' 氧化型配合物的稳定性 还原型配合物的稳定性
氧化还原反应平衡
4. 酸效应: 例:
H3AsO4 + + 2e I3- + 2 e 2H+
HAsO2 + 2H2O H3 AsO4
HAsO2
0.56V
3I-
I / I 0.545V
3
已知H 3 AsO4的pK a1 ~ pK a 3 分别为2.7, 7.0和11.5 HAsO2的pKa 9.2 2 [ H AsO ][ H ] 0 . 059 3 4 H 3 AsO4 HAsO2 lg 2 [ HAsO2 ] 2 [ H ] C H 3 AsO4 0.059 HAsO2 lg( ) 2 H 3 AsO4 C HAsO2 2 0.059 HAsO2 [ H ] ' lg 2 H 3 ASO4
Cu 2
Cu
0.059 lg
CCu 2 Cu 2 K SP(CuI ) [ I ]
氧化还原反应平衡
Cu 2 1 CCu 2 [Cu 2 ]
又已知KspCuI 1.1 10 12,令[ I ] 1mol / L时 I '
氧化还原反应平衡
(一)电极电位的NERNST表示式
1. 活度表示式
Ox / Re d
Ox / Re d
aOx 2.303 RT ln nF a Re d
0.059 aOx lg n a Re d
(25 0 C )
2. 浓度表示式
aOx f Ox [Ox] , aRe d f Re d [Re d ]
