环己醇制备己二酸二酯
环己醇生成己二酸的原理

环己醇生成己二酸的原理
环己醇生成己二酸的原理分为两个步骤:1.环己醇氧化为己醛;2.己醛再氧化为己二酸。
首先,我们来看第一步。
环己醇氧化为己醛的反应通常使用氧气作为氧化剂,并在适当的温度和催化剂存在下进行。
反应的化学方程式如下所示:
环己醇+ [O] →己醛+ H2O
在这个反应中,环己醇失去一个氢原子并与氧气中的一个氧原子结合,生成己醛和水。
这个反应是一个氧化反应,可以将环己醇中的醇基(-OH)氧化成醛基(-CHO)。
接下来,我们来看第二步。
己醛再氧化为己二酸的反应也是一个氧化反应。
通常,这个反应也需要氧气作为氧化剂,并在适当的条件下进行。
反应的化学方程式如下所示:
己醛+ [O] →己二酸
在这个反应中,己醛中的羰基(C=O)被进一步氧化,生成己二酸。
与第一步相比,己醛中的羰基更容易被氧气氧化,因此只需单纯地加氧即可得到己二酸。
综上所述,环己醇生成己二酸的原理是通过两个氧化反应实现的。
首先,环己醇被氧气氧化为己醛,然后己醛再被氧气氧化为己二酸。
这两个反应均是氧化反应,并且需要适当的条件和催化剂才能进行。
这个反应在化工工业中有着广泛的应用,己二酸是一种重要的化工原料,用于生产尼龙、涂料、塑料等产品。
环己醇硝酸制备己二酸的方程式

环己醇硝酸制备己二酸的方程式下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor.I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!环己醇硝酸法制备己二酸的化学反应过程在化学工业中,己二酸是一种重要的有机化合物,广泛应用于合成聚氨酯、尼龙66等高分子材料。
己二酸的制备实验报告
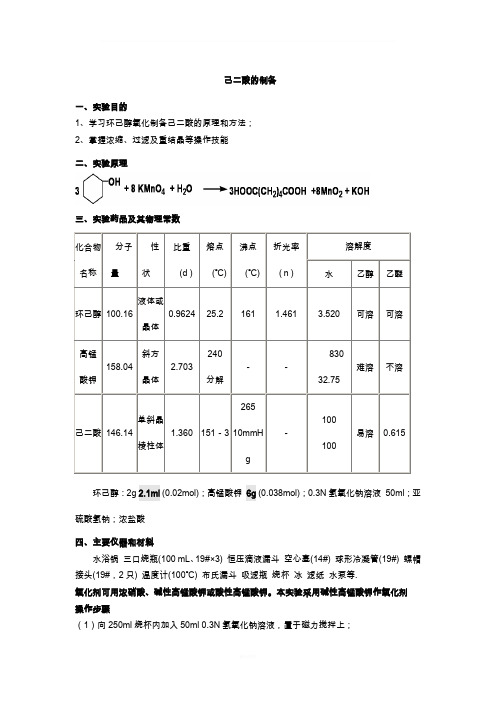
己二酸的制备一、实验目的1、学习环己醇氧化制备己二酸的原理和方法;2、掌握浓缩、过滤及重结晶等操作技能二、实验原理三、实验药品及其物理常数环己醇:2g 2.1ml (0.02mol);高锰酸钾6g (0.038mol);0.3N氢氧化钠溶液50ml;亚硫酸氢钠;浓盐酸四、主要仪器和材料水浴锅三口烧瓶(100 mL、19#×3) 恒压滴液漏斗空心塞(14#) 球形冷凝管(19#) 螺帽接头(19#,2只) 温度计(100℃) 布氏漏斗吸滤瓶烧杯冰滤纸水泵等.氧化剂可用浓硝酸、碱性高锰酸钾或酸性高锰酸钾。
本实验采用碱性高锰酸钾作氧化剂操作步骤(1)向250ml烧杯内加入50ml 0.3N氢氧化钠溶液,置于磁力搅拌上;(2)边搅拌边将6g 高锰酸钾溶解到氢氧化钠溶液中;(3)用滴管滴加2.1ml 环己醇到上述溶液中,维持反应物温度为43~47 ℃。
(4)当醇滴加完毕且反应混合物温度降低至43 ℃左右时,沸水浴将混合物加热,使二氧化锰凝聚。
(5)在一张平整的滤纸上点一小滴混合物以试验反应是否完成,如果观察到试液的紫色存在,那么可以用少量固体亚硫酸氢钠来除掉过量的高锰酸钾。
(6)趁热抽滤,滤渣二氧化锰用少量热水洗涤3次(每次2 mL),每次尽量挤压掉滤渣中的水分;(7)合并滤液和洗涤液,用4ml浓盐酸酸化至pH2.0;(8)小心地加热蒸发使溶液的体积减少到10ml左右,冷却,分离析出的己二酸。
(9)抽滤、洗涤、烘干、称重、计算产率。
(10)测量产品的熔点和红外光谱,并与标准光谱比较。
【操作要点及注意事项】1.KMnO4要研细,以利于KMnO4充分反应。
2. 滴加:本实验为强烈放热反应,所以滴加环己醇的速度不宜过快(1-2滴/秒),否则,因反应强烈放热,使温度急剧升高而引起爆炸。
3.严格控制反应温度,稳定在43~47℃之间。
4.反应终点的判断:(1)反应温度降至43℃以下。
(2)用玻璃棒蘸一滴混合物点在平铺的滤纸上,若无紫色存在表明已没有KMnO4。
1.高锰酸钾氧化环己醇制备己二酸

1.高锰酸钾氧化环己醇制备己二酸己二酸是一种重要的有机化学品,广泛应用于聚酯树脂、塑料、涂料、医药等领域。
传统的制备方法采用氧化己烷或环己烯,但其存在烷基侧链或双键结构,对于制备高品质的聚酯树脂有一定的限制。
近年来,高锰酸钾氧化环己醇制备己二酸的方法逐渐得到重视。
1. 原理高锰酸钾是一种强氧化剂,具有高效、无毒、易得等特点。
环己醇是一种稳定的脂肪醇,易于用高锰酸钾进行选择性氧化。
高锰酸钾氧化环己醇生成的环己酮在酸催化下进行环氧化反应,得到环己酮酸。
环己酮酸与高锰酸钾反应,可生成己二酸。
2. 实验过程实验器材:高锰酸钾、环己醇、硫酸、烧瓶、漏斗、冷却器、隔水加热器等。
实验步骤:1)首先,将高锰酸钾5克与500毫升蒸馏水混合,搅拌至高锰酸钾完全溶解,得到高锰酸钾溶液;2)在烧瓶中加入环己醇25克,加入适量的高锰酸钾溶液,不断搅拌,使反应进行均匀。
此时,环己醇呈淡黄色,高锰酸钾悬浮在其上;3)经过数小时的反应,环己醇溶液变成深黄色,反应完全;4)将反应液倒入分液漏斗,加入稀硫酸,混合均匀,并用蒸馏水洗净;5)将溶液倒入隔水加热器中加温,提取己二酸。
3. 结果分析用高锰酸钾氧化环己醇制备己二酸的反应是一个多步反应,其中环己醇选择性氧化生成环己酮是关键步骤。
反应时间、温度、环己醇和高锰酸钾的摩尔比等均对反应产率有影响。
实验表明,在高锰酸钾氧化环己醇制备己二酸的反应中,最适宜的反应条件是高锰酸钾用量相对于环己醇为0.08,反应时间为5小时,反应温度为70℃。
4. 结论高锰酸钾氧化环己醇制备己二酸具有简单、无毒、高产率等优点,适用于工业化生产。
研究表明,在特定的反应条件下,利用高锰酸钾氧化环己醇制备己二酸是一种高效的方法,并有望应用于聚酯树脂、涂料、医药等领域。
由环己醇制备己二酸二酯

有机化学实验八由环己醇制备己二酸二酯实验项目性质:综合性实验实验所涉及课程:无机化学、分析化学、无机及分析化学实验计划学时:4学时一、实验目的1、综合训练有机化合物的制备、分离和提纯的操作技能。
2、通过本实验过程,使学生进一步了解消去反应、氧化反应和酯化反应的原理和特点。
3、通过实验,使学生了解科学研究的初步知识,训练学生按科技论文进行写实验报告,为毕业设计和就业奠定一定的科研基础。
二、预习与参考1、实验前查阅资料,了解消去反应、氧化反应和酯化反应的特点;2、充分预习实验内容,安排好实验次序,设计好实验原始数据的记录表;3、实验结束后按要求完成实验报告。
4、参考资料:[1] 高占先主编,《有机化学实验》,高等教育出版社,2004年6月第四版。
[2] 李兆陇阴金香等编写,《有机化学实验》,清华大学出版社,2000年。
[3] 谷亨杰编写,《有机化学实验》,高等教育出版社,2002年。
[4] 文瑞明等,硫酸氢钠催化合成己二酸二乙酯,应用化工,2001,30(4),21-22三、设计指标1、确定实验方法、实验过程,设计实验数据采集表格;2、设计产率的计算公式,以质量分数表示。
四、实验要求在掌握制备原理的基础上,做好以下工作:1、配平有关的反应方程式;2、按使用20g 环己醇为起始物进行设计;3、查阅有关反应物和产物及使用的其他物质的物理常数;4、分析资料,提出设计方案;5、列出使用的仪器设备,并画出仪器装置图;6、提出各步反应的后处理方案;7、提出产物的分析测试方法和打算使用的仪器。
实验部分:1、指导教师审查学生的设计方案;2、学生独立完成实验操作,如果失败,必须进行重做;3、鼓励学生按自己的合成思路,对不同的实验条件进行反复探索,总结经验。
4、提倡对所做实验的深入研究,不刻意追求完成实验的多寡;5、对所得产物都要进行测试分析;以分析测试手段来表征合成的结果;6、做好实验记录,教师签字确认。
附:实验步骤第一步:己二酸的制备一:1.如图一组装实验仪器2.分别量取25ml浓HNO3(在量取过程中要注意戴橡胶手套,并小心不要溅到衣服上)与25ml蒸馏水,在图中烧瓶中混合。
环己醇制备己二酸

方法一:环己醇制备己二酸(高锰酸钾)一、实验目的1.学习环己醇氧化制备已二酸的原理和了解由醇氧化制备羧酸的常用方法。
2.熟悉电动搅拌,抽滤等实验技术。
3.熟练掌握熔点的测定技术。
二、实验原理 己二酸(ADA ),又称肥酸。
常温下为白色晶体, 熔点152 ℃,沸点337.5 ℃。
主要用途:有机合成中间体,主要用于合成纤维 (尼龙-66,大约占己二酸总量的70%)其 它的 (30%) 在制备聚氨酯:PA-46,PA-66,PA-610,合成树脂,合成革,聚酯泡沫塑料, 塑料增塑剂,润滑剂,食品添加剂, 粘合剂, 杀虫剂,染料, 香料, 医药等领域得以广泛应用。
产量情况 1902年首次合成。
目前世界产量大约2.60 Mt/a ,并以3.36% 年增长率增长。
其中世界上最大的5 家企业是: Dupont (1.09 Mt/a)、Rhodia (417 kt/a)、Solutia (385 kt/a)、 BASF (240 kt/a) 和旭化成 (112 kt/a)。
2002年我国年生产能力12万t/a (巴陵石化,辽阳石化,太原化学,上海燎原化工,神马集团),市场消费量约为19.5万t/a 。
预计2010年全球ADA 生产能力有望达到3.32 Mt/a 。
制备羧酸最常用的方法是烯、醇、醛等的氧化法。
常用的氧化剂有硝酸、重铬酸钾(钠) 的硫酸溶液、高锰酸钾、过氧化氢及过氧乙酸等。
但其中用硝酸为氧化剂反应非常剧烈,伴有大量二氧化氮毒气放出,既危险又污染环境。
因而本实验采用环己醇在高锰酸钾的碱性条件发生氧化反应,然后酸化得到已二酸。
反应式H[O O ]O[]HOC O(CH 2)4OHOC环己醇 环己酮 己二酸OH MnO 338H 2+KMnO 4+HO 2C(CH 2)4CO 2H ++8KOH8三、仪器和药品抽滤装置、100℃温度计、环己醇、高锰酸钾、氢氧化钠、亚硫酸氢钠、浓盐酸、试纸。
四、实验步骤1.安装反应装置,在烧杯中加入6g 高锰酸钾和50mL0.3mol/L 氢氧化钠溶液,搅拌加热至35℃使之溶解,然后停止加热;2.在继续搅拌下用滴管滴加2.1mL环己醇,控制滴加速度,维持反应温度43~47℃,滴加完毕后若温度下降,可在50℃的水浴中继续加热,直到高锰酸钾溶液颜色褪去。
环己醇、己二酸工艺

环己醇、己二酸工艺环己醇、己二酸工艺是一种重要的化工生产过程,可以广泛应用于食品、医药、日用化学品等领域。
这种工艺利用己二酸和环己烷作为原料,经过一系列的化学反应和物理处理,最终得到环己醇和己二酸。
本文将详细介绍环己醇、己二酸工艺的原理、流程、应用和发展趋势等方面内容。
一、原理环己醇、己二酸工艺是一种典型的有机合成过程,主要利用己二酸经过酯化反应生成己二酸二酯,再与环己烷在催化剂作用下发生反应生成环己醇和己二酸。
其具体反应方程式如下所示:C6H12O4 + 2C6H12O → C12H22O4 + 2H2OC12H22O4 → C6H12(OH)COOH + HOOC(CH2)4COOH二、流程环己醇、己二酸工艺的生产过程可分为以下几个步骤:(1) 原料准备:用纯化的环己烷和己二酸作为原料,必要时添加稳定剂和抗氧化剂。
(2) 酯化反应:将己二酸和酯化剂加入反应釜内,并在合适条件下加热下进行酯化反应。
反应得到己二酸二酯。
(3) 环合反应:将己二酸二酯、环己烷和催化剂加入反应釜内,进行环合反应,最终得到目标产物环己醇和己二酸。
(4) 分离、净化与精制:将反应混合物通过酸化、萃取、蒸馏和结晶等方式进行分离、净化和精制,得到产品的纯化物。
三、应用环己醇、己二酸是重要的有机化学原料,广泛应用于食品、医药、化妆品、染料、塑料等领域。
其中一些常见的应用如下:(1) 食品:己二酸可用作食品保鲜剂和食品添加剂,环己醇可用作调味剂和香精。
(2) 医药:己二酸和环己醇可用于制备口服药物和外用药物的原料,还可以用于合成防腐剂和解热镇痛药等。
(3) 化妆品:己二酸和环己醇可用于制备洗发水、肥皂、香水和化妆品等。
(4) 染料:己二酸和环己醇可用于合成染料和颜料,具有良好的染色性能。
(5) 塑料:己二酸和环己醇可用于制备聚酯树脂和聚酯纤维,作为塑料的主要原料。
四、发展趋势随着人们对健康、环保、安全等方面要求的提高,环己醇、己二酸工艺的发展也呈现出一些新趋势:(1) 优化工艺:通过改进生产工艺和技术手段,提高反应效率和产物质量,减少废物和能源消耗,降低生产成本,提高市场竞争力。
己二酸的制备
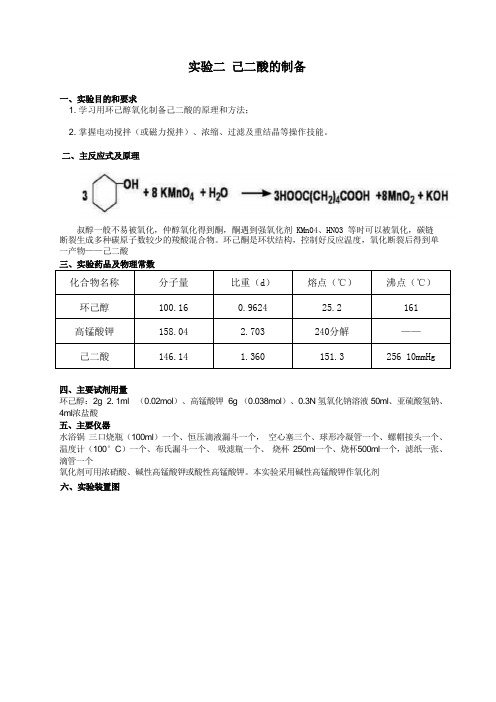
实验二己二酸的制备
一、实验目的和要求
1. 学习用环己醇氧化制备己二酸的原理和方法;
2. 掌握电动搅拌(或磁力搅拌)、浓缩、过滤及重结晶等操作技能。
二、主反应式及原理
叔醇一般不易被氧化,仲醇氧化得到酮,酮遇到强氧化剂 KMn04、HN03 等时可以被氧化,碳链
断裂生成多种碳原子数较少的羧酸混合物。
环己酮是环状结构,控制好反应温度,氧化断裂后得到单一产物——己二酸
四、主要试剂用量
环己醇:2g 2. 1ml (0.02mol)、高锰酸钾 6g (0.038mol)、0.3N 氢氧化钠溶液 50ml、亚硫酸氢钠、4ml浓盐酸
五、主要仪器
水浴锅三口烧瓶(100ml)一个、恒压滴液漏斗一个,空心塞三个、球形冷凝管一个、螺帽接头一个、温度计(100°C)一个、布氏漏斗一个、吸滤瓶一个、烧杯250ml一个、烧杯500ml一个,滤纸一张、滴管一个
氧化剂可用浓硝酸、碱性高锰酸钾或酸性高锰酸钾。
本实验采用碱性高锰酸钾作氧化剂
六、实验装置图
图1 反应装置图2 抽滤装置
七、粗产品纯化过程及原理
八、产率计算
m 理=n ·M=0.02molX146g/mol=2.92g 理论产量:2.92g
产率=实际产量理论产量×100%。
己二酸的制备

己二酸的制备一、【实验目的】1.了解用环己醇氧化制备己二酸的基本原理和方法。
2.掌握电动搅拌器的使用方法及浓缩、过滤、重结晶等基本操作。
二、【实验仪器及药品】仪器:烧杯(250 ml、800 ml 各1个);温度计(1支);吸滤瓶(1个);布氏漏斗(1个)。
药品:环己醇 2 g 2.1 ml (0.02 mol);高锰酸钾 6 g (0.038 mol);0.3 mol.L-1 NaOH;亚硫酸氢钠、浓硫酸。
三、【仪器安装要点】在安装电动搅拌装臵时应做到:1.搅拌器的轴与搅拌棒在同一直线上。
2.先用手试验搅拌棒转动是否灵活,再以低转速开动搅拌器,试验运转情况。
3.搅拌棒下端位于液面以下,以离烧杯底部3~5 mm为宜。
4.温度计应与搅拌棒平行且伸入液面以下。
四、【操作要点】1.KMnO4要研细,以利于KMnO4充分反应。
2.环己醇要逐滴加入,滴加速度不可太快。
否则,因反应强烈放热,使温度急剧升高而难以控制。
3.严格控制反应温度,稳定在43~47℃之间。
4.反应终点的判断:(1)反应温度降至43℃以下。
(2)用玻璃棒蘸一滴混合物点在平铺的滤纸上,若无紫色存在表明已没有KMnO4。
5.用热水洗涤MnO2滤饼时,每次加水量约5~10 ml,不可太多。
6.用浓硫酸酸化时,要漫漫滴加,酸化至pH=1~3。
7.浓缩蒸发时,加热不要过猛,以防液体外溅。
浓缩至10 ml左右后停止加热,让其自然冷却、结晶。
五、【本实验的成败关键】环己醇的滴加速度和反应温度的控制。
六、【问题及讨论】1、为什么反应必须严格控制环己醇的滴加速度,为什么在反应过程中要保持反应物处于沸腾状态?控制环己醇的滴加速度是制备己二酸实验的关键。
因为此反应是一个强放热的反应,所以必须等先加入反应瓶中的少量环己醇作用完全后才能继续滴加。
若滴加太快,反应过于剧烈,无法控制,会使反应液冲出烧瓶造成事故。
滴加太慢,反应进行的缓慢,需要的时间太长。
所以操作时应控制滴加环己醇的速度,维持反应液处于微沸状态。
己二酸二甲酯的制备(多步有机合成及尾气处理)

己二酸二甲酯的制备[实验目的]1.通过设计由环己醇经己二酸制备己二酸二甲酯的实验方案,训练学生综合实验的技能;2.通过查阅资料,调研工业上、实验室中实现相关反应的具体方法;[实验原理][思考题]由己二酸制备己二酸二甲酯的实验中,甲醇的用量为什么大大过量?(一)己二酸的制备(也可参照有机化学实验课本P107的方法,就不需要使用偏钒酸铵了。
)[实验仪器]250mL三颈烧瓶,温度计(0~100℃),滴液漏斗,球形冷凝管,量筒(50mL,10mL),三角漏斗,抽滤瓶,布氏漏斗,酒精灯,小烧杯。
[实验药品]12mL 50%HNO3,4mL环己醇,偏钒酸铵,稀NaOH溶液。
[实验步骤]1.用50mL量筒量取12mL 50%HNO3加入到250mL三颈烧瓶中,再加入少许偏钒酸铵,1~2粒沸石,按图装好装置;2.用10mL量筒量取4mL环己醇加入到滴液漏斗中,量过环己醇的量筒用少许水洗涤再倒入滴液漏斗中;3.用酒精灯预热至50℃左右,然后移去酒精灯。
先滴加5~6滴环己醇,同时摇动,然后慢慢滴加剩下的环己醇(m.p.=21~24℃)。
加完后用1.5mL水洗涤量过环己醇的量筒再加入到滴液漏斗中,并保持温度在60~65℃之间,使反应液处于微沸状态。
当温度过高时,用冷水冷却;过低时,用酒精灯加热;4.加完后继续振摇,用酒精灯加热,使温度慢慢上升到80~90℃,约需10min,直至无红棕色气体(NO2)生成为止;5.趁热将反应液倒入100mL烧杯中,冷却后抽滤,用15mL冰水洗涤,干燥后,称重,计算产率。
6. 纯己二酸为无色单斜晶体,熔点为153℃,应进行熔点测试以及红外光谱鉴定(有机化学实验课本P108有标准样的红外光谱图)。
[注意事项]1.本装置严禁漏气,用碱液吸收尾气(NO2,NO),最好在通风橱中进行;2.环己醇与浓HNO3切勿用同一量筒量取,因二者相遇发生剧烈反应,甚至发生意外;3.环己醇熔点为24℃,熔融时为粘稠状液体,为了减少转移时的损失,可用少量水冲洗量筒,并入滴液漏斗中,同时还可降低其熔点,以免堵住漏斗。
环己醇制取己二酸己二酯的合成路线方程式

环己醇制取己二酸己二酯的合成路线方程式己二酸己二酯(adipate esters)是一种重要的化工原料,广泛应用于塑料、涂料、染料等行业。
其制备方法有多种,其中一种常用的合成路线是通过环己醇制取己二酸己二酯。
合成路线方程式如下:环己醇 + 己二酸酐→ 己二酸己二酯 + 水在这个合成过程中,环己醇和己二酸酐反应生成己二酸己二酯和水。
这个反应属于酯化反应,通过酸催化可以促进反应的进行。
下面对这个合成路线进行详细解释:需要准备好反应所需的原料环己醇和己二酸酐。
环己醇是一种有机化合物,化学式为C6H12O,可通过氢氧化钠催化下的环己烷氧化反应获得。
己二酸酐是一种有机化合物,化学式为C6H10O4,可通过己二酸与酐化剂(如乙酸酐)反应得到。
将环己醇和己二酸酐按照一定的摩尔比例混合,在反应釜中加入催化剂(如硫酸)进行酯化反应。
酸催化可以加速反应速率,使反应更加高效。
酯化反应是一种酸催化的酯化反应。
在反应过程中,酸催化剂起到了催化剂的作用,使得反应速率加快。
具体反应机制为:首先,酸催化剂负责将己二酸酐中的羧基质子化,生成亲电性较强的酰氧离子;然后,环己醇中的氢氧根离子被酰氧离子攻击,生成中间产物环己醇己二酸酐;最后,环己醇己二酸酐中的醇基与环己醇中的羟基发生酯化反应,生成己二酸己二酯。
反应进行一定的时间后,通过蒸馏等方法将产物己二酸己二酯从反应混合物中分离出来。
同时,反应混合物中生成的水也会被蒸馏去除。
整个合成过程中,需要注意控制反应的温度、时间和催化剂用量等条件,以保证反应的高效进行和产物的纯度。
另外,还需要对产物进行后续的处理,如过滤、洗涤和干燥等步骤,以得到纯净的己二酸己二酯。
总结起来,环己醇制取己二酸己二酯的合成路线是通过环己醇和己二酸酐进行酯化反应,生成己二酸己二酯和水。
这个合成路线是一种常用的制备己二酸己二酯的方法,具有简单、高效和可控性的特点,广泛应用于工业生产中。
通过对合成路线的理解和掌握,可以实现对己二酸己二酯的高效制备,满足不同行业对该化合物的需求。
己二酸的制备

己二酸的制备一、实验目的1、学习环己醇氧化制备己二酸的原理和方法;2、掌握浓缩、过滤及重结晶等操作技能二、实验原理KMnO4在酸性、中性及碱性条件下都能将环己醇氧化为己二酸,在酸性条件下KMnO4的氧化能力最强,会造成过度氧化使己二酸质量下降,且锰盐难以回收。
在中性或弱碱性条件下KMnO4均能被还原为MnO2,且在碱性条件下KMnO4氧化有机物的速度比在酸性条件下更快,故KMnO4作为氧化剂氧化环己醇时在碱性条件下比较合适。
使用NaOH溶液提供碱性条件,这样KMnO4被还原为MnO2,易于回收并经洗涤烘干后利用。
尤其是在碱性条件下高锰酸钾反应选择性好,生成的己二酸盐易于分离,操作简便,反应平稳,反应速度快。
三、实验仪器及药品仪器:三颈烧瓶、烧杯、温度计、恒压滴液漏斗、球形冷凝管、锥形瓶、酒精灯、石棉网、布氏漏斗、吸滤瓶等药品:0.3mol/LNaOH溶液(50ml)、KMnO4固体(6g)、环己醇(2.1ml)、亚硫酸氢钠、浓盐酸等四、实验步骤向250ml烧杯内加入50ml0.3mol/LNaOH溶液,置于磁力搅拌上,边搅拌边将6g KMnO4溶解到NaOH溶液中。
将搅拌后的溶液转移到三颈烧瓶内,按如图所示安装实验仪器。
在恒压滴液漏斗中加入2.1ml 环己醇,待实验时使用。
安装好实验装置后进行实验,用滴管滴加2.1ml 环己醇到上述溶液中,维持反应物温度为43~47 ℃。
当醇滴加完毕且反应混合物温度降低至43 ℃左右时,沸水浴将混合物加热,使二氧化锰凝聚。
在一张平整的滤纸上点一小滴混合物以试验反应是否完成,若无紫色存在表明已没有KMnO4。
如果观察到试液的紫色存在,那么可以用少量固体亚硫酸氢钠来除掉过量的高锰酸钾。
使三颈烧瓶内的液体趁热抽滤,滤渣二氧化锰用少量热水洗涤3次(每次2 mL),每次尽量挤压掉滤渣中的水分。
合并滤液和洗涤液,用4ml浓盐酸酸化至pH2.0。
将液体转移到小烧杯中,小心地加热蒸发使溶液浓缩至10 ml左右后停止加热,让其自然冷却、结晶、分离析出的己二酸。
己二酸二甲酯的制备

己二酸二甲酯的制备设计实验方案姓名: 班级: 学号:(一)己二酸的制备:实验目的:1、通过设计由环己醇经二酸制备己二酸二甲酯的方案,训练学生综合实验能力。
2、巩固回流、蒸馏、洗涤等操作。
实验原理:O H+8H N O 3C O O H C O O H3+8N O +7H 2OO 28N O 2实验仪器:250ml 三颈烧瓶、温度计、滴液漏斗、球形冷凝管、布氏漏斗、抽滤瓶、量筒(10ml 、100ml )、玻璃漏斗、烧杯实验药品:HNO 3,NH 4VO 3,环己醇,稀NaOH 吸收液实验装置图:实验步骤:1、 用100ml 量筒量取 16mL HNO 3加入到250ml 三颈烧瓶中,再加入少许偏钒酸铵,1~2粒沸石,按图示搭好实验装置;2、 用10ml 量筒量取5.4 ml 环己醇加入到滴液漏斗中,并用1.5ml 水洗涤量筒的水一并倒入漏斗中;3、 水浴加热三颈烧瓶至50℃~60℃左右,然后移去,先滴加5~6d 环己醇,同时摇动,然后慢慢滴加剩下的环己醇。
加完后用少许水洗涤滴液漏斗,并保持温度在60~65℃之间,使反应处于微沸,当温度过高时,冷水冷却,过低时,用水浴加热;4、 加完后继续振摇,并用电热套加热,使温度上升到80~90℃,加热约10min,直至无红棕色气体(NO 2)生成为止;5、 趁热将反应液倒入100ml 烧杯中,冷却后抽滤,用少许水洗涤,干燥后称重,计算产率。
实验数据记录与处理:理论产量:7.4g实际产量 :产率=参考文献:1、徐明波; 高耀初; 两种己二酸制备方法的改进[J]. 湖北师范学院学报(自然科学版) 2003年04期2、黄宇芳; 谢建刚; 张建州; 己二酸的合成[J]. 化学教育 2005年03期3、张红; 李阳; 制备己二酸的几种方法的比较[J]. 中国科技信息 2008年11期4、张晶晶,黄武,易清风等,环己醇电解氧化制备己二酸[J].期刊论文(应用化学)2008 年10期5、杨秀英等;己二酸制备方法的改进[J]. 山东师范大学学报(自然科学版) 2003年02期(二)己二酸二甲酯的制备:实验目的;1、学习酯化反应的原理和己二酸二甲酯的制备方法2、巩固蒸馏、洗涤等操作技术实验原理:HOOC(CH2)4COOH+2CH3O H→CH3OOC(CH2)4COOCH3+2H2O实验仪器:100ml圆底烧瓶、球形冷凝管、干燥管、蒸馏头、直形冷凝管、接液管、锥形瓶、温度计、分液漏斗、烧杯、量筒(10ml、100ml),电热套实验药品:5g己二酸、23ml甲醇、浓硫酸4ml、碎冰、乙醚、饱和Na2CO3溶液、饱和NaCl 溶液、无水MgSO4实验装置图:实验步骤:1、称取5.0g己二酸加入到圆底烧瓶中,用量筒量取23ml甲醇倒入烧瓶中。
化学本科毕业论文-锡钒催化硝酸氧化环己醇制备己二酸

摘要
以硝酸锡和硝酸钒为催化剂,浓硝酸作为氧化剂,由环己醇制备己二酸。探讨了催化剂用量、反应原料、反应时间、反应温度以及反应物物质的量的比对己二酸产率的影响。在优化条件下,即以0.25%锡离子,0.03%钒离子作为催化剂,以环己醇为原料,硝酸: 环己醇的物质的量比为3.31:1时,反应产率可达91%。反应时间和反应温度的影响不大。
图1.1 DEHA 结构图
Figure1.1:ChartofDEHA
1.
(1)己二酸(Adipic Acid)是有机酸之一,在自然界,甜萝卜甜菜等植物就含有它。日本于1983年8月27日批准为食品添加剂[3]。我国食品卫生标准( GB2760 - 96)中允许其添加于固体饮料粉、果冻粉中[4],并规定了最大使用量分别为0.101g/kg和0.115g/ kg。其主要作用为酸味剂、pH调节剂。国外还将其用于醇饮料、速溶饮料等的增香剂[3,5]。因为己二酸的不潮解特性,可用于食品添加剂,有利食品的储存,同时己二酸也是食品和饮料行业的酸化剂。
美国NICOLET公司
koller熔点仪
WS70-1
上海浦东物理光学仪器厂
2.3己二酸的合成原理
2.4己二酸制备实验的步骤
1、装带有吸收装置的回流装置(用100mL的NaOH碱液吸收)
2、投料:
3、加热至反应开始(63℃),瓶内有红棕色放出。
4、停止加热,不断振荡下慢慢滴加剩余的环己醇(注意温度的变化,温度升高,用冰水冷却,温度降低用热水加热),约需10min。
1.3.3生物催化法
生产己二酸的传统原料苯、环己烷及丁二烯都来自于石油,石油是不可再生的资源,利用可再生的生物资源代替石油是化工生产可持续发展的方向,例如可利用D一葡萄糖生物催化合成己二酸。1990’s ,DuPont公司开发了生物催化工艺。利用大肠杆菌将D2葡萄糖转化为顺,顺2己二烯酸,然后加氢生成己二酸。后来该公司又开发了新的生物工艺法,用从好氧脱硝菌株中分离出来的一种基因蔟对酶进行编码,从而得到环己醇转化制己二酸的合成酶[15]。该合成酶的变种主细胞在合适的生长条件下可将环己醇选择性地转化成己二酸。此方法采用可循环使用,并在空气中自然降解的物质为原料,因此实现了绿色生产,但不足之处是过程费用昂贵,不适合大规模工业化生产。
杂多酸催化环己醇氧化制备己二酸

杂多酸催化环己醇氧化制备己二酸孟庆朝, 董玉环, 秦宝玉, 周长山(唐山师范学院化学系,河北唐山063000)摘 要:以磷钨酸为催化剂,用过氧化氢氧化环己醇的方法合成了己二酸。
探讨了物料配比、催化剂用量、反应温度、反应时间对己二酸产率的影响。
在环己醇用量10.5m L ,30%过氧化氢溶液用量60m L ,催化剂用量0.5mm ol ,反应温度80°C ,反应时间8h 的条件下,己二酸产率达70.6%。
实验结果表明,这是一种合成己二酸的切实可行的绿色化学工艺。
关键词:己二酸;环己醇;过氧化氢;磷钨酸中图分类号:O 643 文献标识码:A 文章编号:036726358(2005)042226202Oxidation of Cyclohexanol to Adipic Acid Catalyzed by Heteropoly AcidME NG Qing 2zhao , DONG Y u 2huan , QI N Bao 2yu , ZH OU Chang 2shan(Department o f Chemistry ,Tangshan Teachers College ,H ebei Tangshan 063000,China )Abstract :Adipic acid is synthesized by oxidation of cyclohexanol using hydrogen peroxide as oxidant over phosphotungstic acid catalyst.The effect of material ratio ,catalyst am ount ,reaction tem perature and time on the yield of adipic acid is studied.The yield of adipic acid reaches 70.6%under the conditions that the am ount of cyclohexanol ,30percent hydrogen peroxide and catalyst are 10.5m L ,60m L and 0.5mm ol ,respectively ,the reaction tem perature is 80°C ,and the reaction time is 8h.It is shown that this is a feasible and green chemical process to synthesize adipic acid.K ey w ords :adipic acid ;cyclohexanol ;hydrogen peroxide ;phosphotungstic acid收稿日期:2004203226;修回日期:2004204219作者简介:孟庆朝(1974~),男,硕士,讲师.主要从事精细化学品开发等工作. 己二酸是工业上最重要的二元羧酸,是合成尼龙66等的主要原料。
环己醇绿色合成己二酸

3171 实验部分(1)反应过程。
反应装置是一个具有回流冷凝管的50毫升圆底烧瓶,在反应的过程中,先加入一定量的催化剂,也就是硅藻土负载磷钨酸,接着将30%的过氧化氢溶液加入其中,通过磁力搅拌器,进行15分钟时间的搅拌,接着将环己醇加入其中,并且进行相应的加热,持续加热之后,温度会处于回流温度范围内,这个时候进行三小时到六小时的恒温反应反应,完成之后,进行过滤和分离工作将催化剂分离出来,并且,在后期进行循环使用,在反应的过程中,反应冷却到室温之后再将其放入到冰箱当中,进行12小时左右的冷藏,这时候就会析出大量白色结晶,对其进行抽滤,接着通过冰水进行两次到三次左右的洗涤,进行干燥,这样就可以获得己二酸晶体,对其产率进行计算。
(2)结构特征。
在载玻片上放入少量样品,并且将载玻片盖好,通过熔点仪来对产品的熔点进行测试,通过查阅文献可以发现,乙二酸的熔点在152℃。
对其产物进行干燥之后,通过kbr压片,对红外光谱吸收进行测定,使用二甲基亚砜作为相应的溶剂,通过核磁共振技术对其进行分析。
图2 由环己醇合成己二酸的IR光谱图(3)纯度分析。
样品通过酸碱滴定法来对其纯度进行测定。
2 结果与讨论(1)己二酸的红外光谱分析。
进行环已醇氧化之后获得的产物通过红外光谱分析所得的IR谱图,如下图所示,可以清晰的发现在波处于3000cm-1到2500cm-1之间的时候,出现了-OH的特征吸收峰,而在1710cm-1处有C=O特征吸收峰出现。
在1266cm-1到1205cm-1的地方出现了C-O吸收峰。
通过标准图库和红外光谱图进行比对,可以发现其结果吻合,这就说明其产物主要是己二酸。
(2)硅藻土与磷钨酸比例对产率的影响。
磷钨酸和硅藻土的比例与催化性能。
催化剂的稳定性以及重复使用息息相关,会严重影响己二酸的产率。
在测试的过程中可以制备各种质量比例不同的硅藻土岭钨酸催化剂,对己二酸的产品纯度和产率的影响进行重点分析,在此过程中,控制双氧水的含量为30毫升。
己二酸的制备

己二酸的制备一、实验目的1.掌握用环己醇氧化制备己二酸的基本原理和方法。
2.掌握电动搅拌器的安装及使用方法3.巩固浓缩、过滤、重结晶等基本操作。
二、实验原理制备羧酸最常用的方法是烯、醇、醛等的氧化法。
常用的氧化剂有硝酸、重铬酸钾(钠)的硫酸溶液、高锰酸钾、过氧化氢及过氧乙酸等。
本实验采用环己醇在高锰酸钾的酸性条件发生氧化反应,然后酸化得到已二酸。
三、实验仪器及药品仪器:三口烧瓶(250ml)烧杯(1000ml)、温度计(0-150℃)、电动搅拌器、球形冷凝管、抽滤瓶、布氏漏斗、循环水多用真空泵、滴管、滤纸等。
药品:环己醇、高锰酸钾、NaOH;亚硫酸氢钠、浓盐酸、活性炭等。
四、实验步骤1. 在250mL三口烧瓶上安装电动搅拌器。
在安装电动搅拌装置时应做到:①.搅拌器的轴与搅拌棒在同一直线上。
②.先用手试验搅拌棒转动是否灵活,再以低转速开动搅拌器,试验运转情况。
③.搅拌棒下端位于液面以下,以离烧杯底部3~5mm为宜。
④.温度计应与搅拌棒平行且伸入液面以下。
2. 往三口烧瓶中加入1.0gNaOH和50mL水。
搅拌下加入6.0g高锰酸钾。
搅拌加热至35℃使之溶解,然后停止加热;3. 用滴管慢慢加入3mL的环己醇,控制滴加速度,维持温度在45℃左右。
4. 滴加完毕后若温度下降至43℃以下。
,可在50℃的水浴中继续加热,直到高锰酸钾溶液颜色褪去。
在沸水浴中将混合物加热5分钟,使氧化反应完全,可观察到有大量二氧化锰的沉淀凝结。
5. 用玻璃棒蘸一滴反应物到滤纸上做点滴实验。
如有高锰酸盐存在,则在棕色二氧化锰点的周围出现紫色的环,可加入少量固体亚硫酸氢钠直到点滴试验呈阴性为止。
6. 趁热抽滤混合物,用少量热水洗涤滤渣3次。
7. 将洗涤液与滤液合并置于烧杯中,加少量活性炭脱色,趁热抽滤。
8. 将滤液转移至干净烧杯中,并在石棉网上加热浓缩至8ml左右,放置,冷却,冷却后再用浓盐酸酸化至pH值为2~4止。
结晶,抽滤,干燥。
环己醇制备己二酸反应方程式

环己醇制备己二酸的反应方程式
嘿,各位化学小伙伴们,今天咱们来聊聊一个既有趣又实用的化学反应——环己醇制备己二酸。
这事儿听起来高大上,其实啊,就像是厨房里变魔术,只不过咱们用的不是调料,而是试管和试剂。
想象一下,你手里拿着一瓶环己醇,就像拿着一瓶神秘的魔法药水。
接着,你又拿出了酸性高锰酸钾,这东西就像是魔法里的催化剂,能让反应变得神奇起来。
好啦,咱们开始表演吧!
当你把环己醇和酸性高锰酸钾混在一起,它们就像是遇到了老朋友的两个人,立马就开始了一场热闹的聚会。
这场聚会的第一步,就是生成环己酮。
这环己酮就像是聚会中的小丑,活蹦乱跳的,特别活跃。
但是,聚会还没结束呢!环己酮继续和酸性高锰酸钾玩耍,这次它们玩得更high了,结果羰基和α-C之间的键“啪”地一声就断了,就像是气球被戳破了一样。
而这一断,就生成了我们今天要找的己二酸。
这个反应啊,说起来简单,其实过程挺复杂的。
反应式是:5C6H11OH+8KMnO4+12H2SO4→5HOOC(CH2)4COOH+8MnSO4 +4K2SO4+13H2O。
看起来是不是像一串神秘的密码?但其实,这就是化学的魅力所在,每一个字母、每一个数字,都代表着一种物质,一种变化。
而且啊,这个实验还有一个小窍门。
那就是反应完成后,要趁热把反应液倒出来。
你要是等它凉了,己二酸就会像害羞的小姑娘一样,躲起来不出来,那你就亏大了。
好了,说了这么多,是不是觉得化学也没那么枯燥了?其实啊,化学就像是一个大大的魔法世界,只要你愿意去探索,就会发现里面充满了惊喜和乐趣。
下次有机会,咱们再一起聊聊其他的化学反应吧!。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
环己醇制备己二酸乙二酯
一、实验目的
1、综合训练有机化合物的制备、分离和提纯的操作技能。
2、通过本实验过程,使学生进一步了解消去反应、氧化反应和酯化反应的原理和特点。
二、实验原理
已二酸与乙醇1:1反应,则不完全酯化
HOOCCH2CH2CH2CH2COOH+C2H5OH→HOOCCH2CH2CH2CH2COOC2H5+H2O 已二酸与乙醇1:2反应,则完全酯化
HOOCCH2CH2CH2CH2COOH+2C2H5OH→C2H5OOCCH2CH2CH2CH2COOC2H5+2H2O
、实验仪器设备和试剂
1、实验仪器设备:
加热套;三颈烧瓶(250ml );真空泵;布氏漏斗;抽滤瓶;量筒(10ml );圆底烧瓶(100ml )铁架台;温度计(100℃与200℃各一个);胶头滴管;烧瓶250ml ;滤纸;天平;纸槽;滴液漏斗;冷凝管;分液漏斗。
等辅助工具。
2、实验所用试剂:
环己醇;50%的硝酸;硫酸氢钠;无水乙醇;饱和碳酸钠溶液
、实验步骤
第一步:己二酸的制备
一:1.如图一组装实验仪器
2.分别量取25ml 浓HNO3(在量取过程中要注意戴橡胶手套,并小心不要溅到衣服上)与25ml 蒸馏水,在图中烧瓶中混合。
3.量取10ml 环己醇,倒入小烧杯中备用。
4.用加热套对HNO3加热到80℃停止加热,取出加热套,在烧瓶底下放250ml 的装有冷水的烧杯。
5.用滴管向烧瓶中“逐滴”滴加环己醇,保持反应温度在80-90℃,此反应会放出大量的热,如果超出反应温度用冷水降温。
6.滴加完毕,重新放入加热套中加热,保持反应温度在80-90℃,持续3分钟,使反应完全。
OH 3+ 8HNO 33HO 2C(CH 2)4CO 2H + 8NO + 7H 2O 8NO + 4O 2 8NO 2
.待反应液稍冷后,将烧瓶放入冰水中冷却,使晶体析出。
2.将析出的晶体在布氏漏斗中进行抽滤。
用抽滤液洗出烧瓶中剩余的晶体。
用3ml冰水洗涤己二酸晶体,抽滤。
再用3ml冰水洗涤一次,再抽滤。
3.等晶体变为雪白色且完全干燥时停止抽滤,取出滤纸,称量计算产率。
第二步:己二酸二乙酯的合成
1.将以上获得的己二酸晶体用纸槽小心地转移到三颈烧瓶中。
再添加半药匙NaHSO4作催化剂。
2 .向滴液漏斗中添加15ml无水乙醇,如图二组装仪器。
3 .用加热套给三颈烧瓶加热,当量程为200℃的温度计升高到120℃时,打开滴液漏斗阀门,逐滴滴加无水乙醇,使反应温度控制在120-125℃之间。
4.反应40min左右(从开始滴加乙醇算)取出加热套,让反应物自然冷却。
此时反应物已成为无色液体,NaHSO4晶体颗粒聚集在一起成为块状。
将产物从三颈烧瓶中倒出。
用饱和Na2CO3洗涤分液,除去其中的己二酸氢乙酯和NaHSO4.所得产物即为己二酸二乙酯,用量筒测己二酸二乙酯的体积根据密度计算产率。
注意事项:1.上述反应会产生NO2,应在通风橱中进行。
2.此反应放热较多,一定要逐滴加入,以免温度上升太高使反应失控.但也不要使
温度降到80℃以下,以至反应太慢使未反应的环己醇积聚起来影响产率。
3.在冷却的过程中要不停的转动烧瓶(不是晃动),避免洗出的晶体粘在烧瓶壁
上。
如果仍有晶体粘在壁上可稍微加热使其脱落再重新冷却一次。
