第五章 卤代烃
第五章卤代烃

CN->OH->>NO3-
(3) 试剂和烃基的综合影响:
当试剂的亲核能力较强时,卤代甲烷和伯卤代烷 按SN2反应历程进行反应;叔卤代烷按SN1的历程 发生反应;仲卤代烷则既可按SN1历程,又可按 SN2历程进行,但两种历程的反应速度都较慢,因 此卤代烷的碱性水解反应速度顺序是叔>伯>仲 当试剂亲核能力很弱时,无论是哪一种卤代烷, 都只能按SN1历程发生反应。因此卤代烷与硝酸银 的醇溶液反应速度顺序是叔>仲>伯
叔氯代烷在室温下立即出现氯化银沉淀;仲氯代 烷在室温下只能缓慢地起反应,只有在加热的条 件下才能迅速反应;伯氯代烷则需要较长时间加 热才能反应。所以可以用硝酸银的酒精溶液鉴别 伯、仲、叔三种卤代烷烃。
2. 消除反应:有机物分子脱去小分子形成重 键的反应
β α C2H5OH + CH2 CH +KOH CH2 CH2 -N(CH 3)3 H X HX CH2 CH2 CH3 CH2X
H H C X H R H C X H 有利于SN1 有利于SN2
R
R C H X R
R C R X
影响SN1因素:①C—X键断裂 的难易程度; ②中间过渡态碳正离子的稳定性
影响SN2因素:① α-碳原子的正电荷密度; ②空间效应
(2) 反应试剂的影响:
SN1反应一般不受试剂亲核能力的影响。 试剂的亲核能力越强,对SN2反应越有利,反之, 弱亲核试剂则不利于进行SN2反应。 常见的亲核试剂其亲核能力顺序为:
第五章
卤代烃
一、卤代烃概述 二、卤代烷烃的化学性质 三、亲核取代反应历程
四、卤代烯烃和卤代芳烃
一、 卤代烃概述
烃类分子中一个或多个氢原子被卤原子取 代而生成的衍生物称为卤代烃,卤原子是 卤代烃的官能团。
第五章 卤代烃
CH3CH2CH Br 2-溴丁烷 CH3 CH3CH2CCH3 Br
CH3
KOH/乙醇
CH3CH
CHCH3 + CH3CH2CH
CH2
2-丁烯(81%)
1-丁烯(19%)
NaOC2H5 C2H5OH
CH3CH
C(CH3)2 + CH3CH2C CH3
CH2
2-甲基-2-溴丁烷
2-甲基-2-丁烯(70%) 2-甲基-1-丁烯(30%)
共轭效应
共轭体系: 单双键交替出现的体系。
C=C–C=C–C=C - 共轭 C=C–C p - 共轭 + C=C–C
定义:在共轭体系中,由于原子间的一种相互影响而使体系 内的电 子( 或p电子)分布发生变化的一种电子效应。 给电子共轭效应用+C表示
X C C C C
吸电子共轭效应用-C表示
C2H5O C2H5OH
C H3 C H3 C C H C H3 C H3O C2H5
(S N2)
(SN1)
C2H 5O C2H5OH
C H3 C H3 C C H C H3 重排 C H3
+
CH3 CH3 C CH CH3 CH3
+
C2H5O C H3
C2H5O C2H5OH
C H3 C C H C H3 C H3
第五章
卤代烃
1、 碳卤键的特点
成键轨道
Csp3
等性杂化
Xsp 3
极性共价键, 成键电子对偏 向X.
不等性杂化
2、键长
C—H 110 C—F C—C 139 154 C—Cl 176 C—Br C— I 194 214 (pm)
第五章.卤代烃

(6个σ-π)
(2个σ-π)
CH3 CH3CH2-C-CH3
OH-/ 醇
CH3 CH3-CH=C-CH3 +
CH3 CH3CH2-C =CH2
Br
71% (9个σ-π)
29% (5个σ-π)
经验规律:消除结果为生成的双键碳上连有的烃基
最多的产物为主——扎依采夫规则
卤代烷的消除反应,多数情况下常常与取代反应同时进行
HO + H3C Br H2O CH3OH + Br
H HO + H C Br
H
HH
δ-
δ-
HO C Br
H
H
H HO C + Br
H
反应速率:υ = k [CH3-Br] [OH-] 二级反应
大风中的雨伞
构型反转
H3C
Cl
H3C
H
H
H + OH
H
+ Cl OH
图 5-3 双分子亲核取代反应机理
亲核试剂的进攻与离去基团的离去同时发生
LiAlH4 + 4H2O
LiOH + Al(OH)3 + 4H2
硼氢化钠可以在水溶液中使用,也可用于还原卤代烷。
NaBH4
RX
RH
氢碘酸作还原剂也可将卤代烷还原为烷烃。
HI
RX
RH
5.1.3 亲核取代反应历程
δR δX + Nu 反应物 亲核试剂
R Nu + X 产 物 离去基团
亲核取代反应机理 SN1(单分子亲核取代 ) SN2(双分子亲核取代)
影响亲核取代反应活性的因素
1)、反应物烃基的结构
有机化学 第五章 卤代烃

O
O
O
两种机理的比较: a.中间状态: SN2-过渡态,构型翻转;
SN1-碳正离子,外消旋化。 b.卤代烃的反响活性顺序:
c. 离去基碱性越强,越难离去: -OH, -OR, -NH2一般不 直接离去,而以共轭酸的形式离去〔H2O, ROH, NH3〕。
3. 亲核取代反响的实例
(1) 被-OH取代:卤代烃与 NaOH 或 KOH 的水溶液共 热,X被-OH 取代,产物为醇。这个反响也叫水解。
(苄基碳正离子)
HH
Nu H
C
H
H
Br H
CH2=CHCH2Br SN2 过 渡 态
* 乙烯型卤化物与芳香型卤化物很难发生亲核取代反响。
以下每一对化合物,哪一个更易进行SN1反响?
CH3
a. CH3CH2CH2CHCH3 CH3CH2CCH3
(B)
(A) Br
Br (B)
b.
CH
Br (A)
CH2Br
(A)
(B)
以下每一对化合物,哪一个更易进行SN2反响?
Cl
a. CH3CH2CH2CCH3
CH3 CH3 (A)
CH3CH2CH2CHCH3 Cl
(B)
(B)
b. CH3CCHCH3 CH3CH2CHCHCH3
(B)
H3C I
(A)
H3C I (B)
2〕离去基团——卤原子的影响
* X-离去倾向:I- > Br- > Cl- > F-
一、 亲核取代反响
中心碳原子
RCH2–A + Nu:
RCH2–Nu + A:
底物 〔进入基团〕
产物 离去基团
第五章 卤代烃

按卤素连 接的碳原 子分类
(CH3)2CHCH2Cl
CH3CH2CHCH3
(CH3)3C-I
伯卤代烃 一级卤代烃
仲卤代烃 二级卤代烃
叔卤代烃 三级卤代烃
2
按烃基的 结构分类
CH3CH2X
饱和卤代烃
CH2=CHCH2X
不饱和卤代烃
X
CH2X
芳香卤代烃
其它分类方法: (一)乙烯型卤代烃 卤素连在双键碳上
4. 毒性
R-X无色,有不愉快的气味,蒸气有毒。
含偶数碳原子的一氟代烷有剧毒。
8
§5―3卤代烷的化学性质 一、亲核取代反应
Nu: C X C Nu + X
C X
+ -
亲核取代反应:有机化合物分子中的原子或原子团被亲核试 剂取代的反应。 离去基团
R–X + Nu:(Nu-)
底物
R–Nu + X产物
亲核试剂
Nu:亲核试剂,富有电子,包括负离子和有未成对电子的中性分子
9
亲核试剂:H2O/HO—,ROH,RC=CNa,NaCN/醇,RCOOM,
NaNO3,NaSH,KI/丙酮,NH3,NH2R,NHR2,NR3,R-M,NaSCN 常见亲核基团Nu∶HO-,RO-,RC=C—,CN—,RCOO—,NO3— HS—,I — ,- NH2,-NHR,-NR2, R—,SCN—
C H3(C H2)2C H2Li
+ LiBr
与Grignard试剂相似,且更为活泼,易于被空气氧化, 遇水、酸、醇、氨等含活泼氢的化合物则分解,因此在制 备和使用时,通常用N2或H2保护。
30
3. 二烃基铜锂
2 RLi + CuX
大学有机化学第五章卤代烃PPT课件

思考题
思考题3:卤代烃的应用 举例说明卤代烃在日常生活和工业生产中的应用。
THANKS
感谢观看
02
卤代烃的结构与性质
结构
卤素取代烃基
卤代烃是烃分子中的氢原子被卤素取 代后的化合物,一般用R-X表示,其 中R是烃基,X是卤素原子。
碳卤键
碳卤键是卤代烃分子中碳原子和卤素 原子之间的共价键,键能较高,稳定 性好。
物理性质
状态
随着分子中碳原子数的增加,卤代烃由气态逐渐变为液态,最后变为固态。
溶解性
氧化还原反应
卤代烃可被氧化成酮、醇或醛,也可被还原成烃或醚。
04
卤代烃的应用与实例பைடு நூலகம்
应用领域
药物合成
卤代烃在药物合成中常作为重要的中间 体,用于合成多种药物,如抗生素、抗
癌药物等。
工业溶剂
卤代烃如四氯化碳、氯仿等常作为工 业溶剂,用于清洗、稀释和萃取等。
农业化学品
卤代烃在农业中用作杀虫剂、除草剂 和植物生长调节剂等,如2,4-D等。
分为饱和卤代烃、不饱和卤代烃和芳 香族卤代烃。
卤代烃的命名
选择主链
选择最长的碳链作为主链,并标明其碳原子 数。
编号
从靠近卤素原子的碳原子开始编号,并标明 其他取代基的位置。
取代基
按照次序规则,列出其他取代基的名称和位 置。
系统命名法
采用国际通用的IUPAC系统命名法,遵循“ 取代基在前,数字在后”的原则。
大学有机化学第五章卤代 烃ppt课件
• 卤代烃的分类与命名 • 卤代烃的结构与性质 • 卤代烃的合成与反应机理 • 卤代烃的应用与实例 • 习题与思考题
01
卤代烃的分类与命名
卤代烃的分类
《有机化学》05 卤代烃

2RLi + CuI 无水乙醚 R2CuLi + Li I
二烷基铜锂
用途:制备复杂结构的烷烃(科里豪斯反应)
R2CuLi + R′X
R R′+ RCu + LiX
R可是1°、2°、3 ° R′X最好是1° 也可是不活泼的卤代烃如 RCH=CHX
§1.4 亲核取代反应历程
1.单分子反应历程(SN1)— 叔卤代烷水解
外消旋体
OH
+ H2O OH- (SN1历 程)
+
CH3
CH3
CH3 OH
2.双分子反应历程(SN2)— 伯卤代烷水解
一步完成(新键的形成和旧键的断裂同步进行), 无中间体生成,经过一个不稳定的“过渡态”。
RCH2Br + OH -
H
HO + H C B r H
RCH2OH + Br-
H
δ
δ
HO…C …B r
两步反应(SN1反应是分两步完成) 第一步:
第二步:
反应的第一步是卤代烃电离生成活性中间体碳正离 子,碳正离子再与碱进行第二步反应生成产物。故 SN1反应中有活性中间体——碳正离子生成。
水也可作为亲核试剂作用
水解反应速率取决于第一步,仅与反应物卤代烷 的浓度有关,而与亲核试剂的浓度无关,所以称为 单分子亲核取代反应(SN1反应)。
Nu C + L -
如:
CH3
Cl + H2O
OH- (SN2历 程)
CH3 OH
3. SN1与 SN2反应的竞争
小
SN1
大
CH3X RCH2X R2CHX R3CX
大
小
第五章 卤代烃

R
CH CH2 + NaX + H2O
不同卤代烷烃脱卤化氢的难易次序:三级卤代烷>二级卤代烷> 一级卤代烷 当消除反应能向两个方向进行可以得到两种不同产物时,主要 产物是双键碳上连接烃基最多的烯烃,即遵循Zaitsev rule.
C H3C H2C HC H 3 Br
KOH/乙醇
C H3C H=C HC H + C H3C H2C H=C H 2 3 19% 81%
上述取代反应广泛用于有机合成。
RX + NaOH
RX + NaCN
H2O
醇
ROH + NaX
RCN + NaX
CH2CN
AlCl3
CH2Br + NaC N
+ NaC N
+ (C H )2CHBr 3
CH(CH3)2
+ HBr
CH 3
C
CNa + (CH 3)2CHCH 2I CH 3 C C CH 2CH(CH 3)2
若使用硼氢化钠或硼氢化钾,也可以使一卤代烷还原成烷烃。 但还原能力比氢化铝锂小,能在水或醇溶液中使用。
CH3(CH2)6CH2X +NaBH4
X = Cl Br I
二甘醇二甲醚
CH3(CH2)6CH3
25% 77% 100%
250C 24h 450C 1h 450C 1h
Zn +HCl RX + Na + NH3(l)
H2 Pd
RH RH RH
5.4亲核取代反应的机理
5.4.1双分子亲核取代反应机理(SN2)
O H + CH3Br
有机化学课件--第五章 卤代烃

第一部分
一.
卤代烷(本章重点)
卤代烷类型和命名
R X ( X = F, Cl, Br, I)
1. 卤代烷通式:
R Cl , R Br ,
R
I
R F
性质接近 通常总称卤代烷
性质特殊 氟代烷
2. 卤代烷的类型
一卤代
二卤代
R
多卤代
R RCH2 X R CH X R
C R
X
伯(一级)卤代烷
仲(二级)卤代烷
H3CH2C
C H
H3CH2C
HC H
CH2
1, 2H 迁移
迁移动力:生成更稳定的正碳离子
其它形式的碳正离子的重排
CH3 H3CH2C C H CH2
~H
H3CH2C
CH3 C CH2 H
1, 2H 迁移
CH3 H3 C C CH3 CHCH3
~ CH3
CH3 H3 C C CHCH3 CH3
CH3 H3C Br
o
空间位阻效应 电子效应
R OH + Br
CH3
>
H3C
CH2
Br
>
H3C
CH Br
>
H3C
C CH3
Br
相对 速率 100
7.99
0.22
~0
Acetone(丙酮) R Br + NaI
SN1 机理:单分子取代,二步机理 反应速率 = k[RX] 手性底物反应发生消旋化
5. 碳正离子(Carbocation, Carbonium ion)
碳正离子:一类碳上只带有六个电子的活泼中间体
第5章-卤代烃幻灯片课件

三、不同类型卤代烃的鉴别
2.乙烯型卤代烯烃(不活泼)
氯原子 不活泼
0.172nm 0.177nm
0.138nm 0.134nm
氯原子的未共用电子 对所处的p轨道与双键 中的π轨道相互交盖, 形成p-π共轭体系。氯 原子上的电子云往碳 原子方向偏转,发生 了键长的平均化
Br Cl
3-甲基-1-氯丁烷
2-氯-3-溴丁烷
二、命名
(二)系统命名法
2.不饱和卤烃
(1)包含不饱和键和卤原子在内的最长碳链 为主链。
(2)编号:使不饱和键的位号最小。
CH2=CH-CH2-Cl
3-氯-1-丙烯
CH2=CH-CH2-CH2
Br
4-溴-1-丁烯
二、命名
(二)系统命名法
3.芳香卤烃
性质。 3.熟悉卤代烃的分类。 4.熟悉不饱和卤代烃的取代反应活性。 5.了解卤代烃的亲核取代反应机理和消
除反应机理。
第一节 卤代烃的分类和命名
一、分类
(一)一卤代烃、二卤代烃和多卤代烃 (二)脂肪卤代烃和芳香卤代烃 (三)伯卤代烃、仲卤代烃和叔卤代烃
二、命名
(一)普通命名 (二)系统命名
(溴甲烷的碱性水解)
离去基团
Sp2杂 化
Sp3杂 化
Sp3杂 化
亲核试剂在离 去基和碳原子 间价健的背面
进攻
过渡态
二、化学性质
双分子亲核取代反应特点:
(1)反应速率与卤代烷及亲核试 剂的浓度有关;
(2)原共价键的断裂与新共价键 的形成同时进行,反应一步完成。
(3)决定反应速率的一步没有活 性中间体碳正离子。
三、不同类型卤代烃的鉴别
第五章卤代烃

三、亲核取代反应的立体化学与重排 1.SN1反应:
a
H3C H3C Br H3C CH3 CH CH3 BrOH-
a
HO C
CH3 CH3
构型转化
CH3
-
H3C
b b
H3C H3C C OH
构型保持
sp杂化,同一平面
2
H3C
2.SN2反应
H H Br + H H H H
OH
慢
δ OH … C … Br δ
二、双分子历程SN2 1.双分子历程示例 例如:
RX
+
Nu
¨
慢
δ Nu … R … X δ
-
-
快
RNu
+
X-
2.特点:新键的形成与旧键的断裂同时进行,反应速率与反应底物和亲核 试剂均有关。 上述反应历程中,反应速率与反应底物和亲核试剂均有关,这种双分子的 反应历程称为双分子亲核取代。
H H Br + H H H H
甲基 乙基 正丙基 异丙基 正丁基
-24.2 12.3 46.6 35.7 78.5
0.916 0.898 0.891 0.862 0.886
3.5 38.4 71.0 59.4 101.6
1.676 1.460 1.354 1.314 1.276
42.4 72.3 102.5 89.5 130.5
OH
慢
δ OH … C … Br δ
H
-
-
H
快
HO C H
+
Br
-
3.结构对SN2的影响 卤代烃中与卤素相连的碳上,电子密度越小,越利于亲核试剂的进攻,故反 应活性为: 1°>2°> 3° ⑵相同烷基不同卤原子的反应活性为:R—I > R—Br > R—Cl ,原因为原子 半径越大,易极化,容易离去。
有机化学 05 第五章 卤代烃

四 亲核取代反应的历程及影响因素
两种反应历程 SN1和SN2
1.双分子亲核取代反应(SN2):简单的 伯卤代烷和仲卤代烷
反应动力学
• 二级反应,反应速率与亲核 试剂和底物的浓度都相关。 • 双分子参与,一步反应。 • 存在过渡态:新键的形成和 旧键的断裂同步进行。
立体化学
• b.p. : RI > RBr > RCl > RF>支链
• 比重: RF、RCl < 1; RBr、RI、Ar-X > 1
• 可极化性:RI > RBr > RCl > RF
• 溶解性:不溶于水(虽有极性,但不与水形成H-键)
易溶于有机溶剂。
Organic Chem
三 卤代烃的化学性质:
偶极矩:键极性的一种度量标准, 反映了键的极性大小。由于化学 键两端原子电负性不同引起,比如C-X键,X电负性比碳大。
(进入基团) 亲核试剂
离去基团
一般是负离子或带孤对 电子的中性分子 Organic Chem
常见的亲核取代反应: 1 底物 + 亲核试剂
中性 负离子
Organic Chem
2. 底物 + 亲核试剂
中性分子
NH3 RX + H2O HOR'
中性分子
R NH3X RO H2 RO R' H
+ + + -
Organic Chem
宜在低温,稀醚液中进行
• 应用----合成端烯:
MgBr + H2C CHCH2 Br CH2CH CH2
• 注意:
X C C X
与Mg反应活性低, 常用溴化物或碘化物 高沸点溶剂( )
5第五章 卤代烃(Halohydrocarbons)

:B
-
CH
3
CH3 C6H5 H
C6H5
C 6H 5
C 6H 5 H Br CH H C 6H 5
H CH3
3
C 6H 5
H
H CH3 CH3
Br CH3
H
Br
H CH3 H Cl
+
H
CH(CH3)2
CH3
CH(CH3)2
(主)
CH
3
CH(CH
3)2
(次)
(5)消除反应和取代反应的竞争 结构因素:
H H C Br
H2O,EtOH
H CH3
+
CH3
OH
C
CH3
C
OH
CH3(CH2)5
CH3(CH2)5
CH3(CH2)5
(R)-(-)-2-溴辛烷
(S)-(+)-2-辛醇 (83%)
(R)-(-)-2-辛醇 (17%)
不同类型卤代烷进行SN1反应的活性:
叔卤代烷 >仲卤代烷 > 伯卤代烷 > CH3X
H C (CH2)5CH3 CH3 (R)-(-)-2-辛醇
说明构型发生了变化
R I* R' R'' C I I* C R' R'' R I
说明亲核试剂从背面进攻
过渡态
能量
△E
O H + C H 3B r
△ H
C H 3 O H + B r-
反应进程
反应不分阶段一步完成,即旧键断裂和新键形成同时进行;
活性依次减弱 活性主要取决于碳正离子的稳定性
Br
AgNO
《有机化学(第二版)》第5章:卤代烃

19:46
四、卤代烃的化学性质
卤代烃的化学反应主要发生在官能团卤 原子以及受卤原子影响而比较活泼的β 原子以及受卤原子影响而比较活泼的β-氢原 子上:
R
CH H
δ+ CH 2 δX
取代反应 消去反应
19:46
(一)亲核取代反应(nucleophilic substitution)
Nu+ C
底物
X
19:46
2、系统命名法 、
• ⑴.选择含有卤原子的最长碳链为主链,把支链和卤素 选择含有卤原子的最长碳链为主链, 看作取代基, 按照主链中所含碳原子数目称作“ 看作取代基 , 按照主链中所含碳原子数目称作 “ 某 烷”。 • ⑵.主链上碳原子的编号从靠近支链一端开始,使卤素 主链上碳原子的编号从靠近支链一端开始, 及其它取代基具有最低位次, 及其它取代基具有最低位次,位号之和最小 ; • ⑶.当卤素与烷基具有相同编号时,优先考虑官能团 当卤素与烷基具有相同编号时, (卤素原子),使卤素原子位号最小;然后按次序规则, 卤素原子) 使卤素原子位号最小;然后按次序规则, 小基团优先列出,写出取代基名称、个数、位次。 小基团优先列出,写出取代基名称、个数、位次。
19:46
一、卤代烃的分类 卤代烃的分类
• 分类依据: 分类依据: 1、按烃基的结构分类 、 2、按卤素连接的碳原子分类 、 3、按卤素数目分类 、 4、按卤素原子的种类 、
19:46
按烃基的结构分类
•
• 脂肪卤代烃 • • 卤代烃 • 芳香卤代烃
饱和卤代烃 CH3CH2Cl 不饱和卤代烃 CH2=CHCl
卤代烃 二卤代烃 CH2I2
多卤代烃 CHI3
19:46
二、卤代烃的命名
第五章卤代烃(Halohydrocarbons).pdf

第五章 卤代烃(Halohydrocarbons )授课对象:临床医学、口腔专业学时安排:4h教 材:<<医科大学化学>> 下册 陈启元 梁逸曾 主编 2004年1月教学目的与要求:1. 掌握伯、仲、叔卤代烷的结构,卤代烷、烯的命名,卤原子作为取代基的英文名称。
2. 掌握亲核取代反应(被-OH ,-CN ,-NH 2,-OR 等取代)的反应机制以及影响因素。
3. 掌握消除反应以及Saytzeff 规则,消除反应机制。
4. 熟悉乙烯型、烯丙型、孤立型卤代烯的取代活性及鉴别方法。
5. 熟悉格氏试剂的生成及其与CO 2的加成。
6. 了解消除与取代的竞争;卤代烷亲核取代的立体化学,卤代烷与环境保护。
教学重点:1. 伯、仲、叔卤代烷的结构,卤代烷、烯的英文命名。
2. 亲核取代反应,反应机制及影响因素。
3. 消除反应和Saytzeff 规则。
消除反应机制,消除与取代的竞争。
4. 乙烯型、烯丙型、孤立型卤代烯的取代活性及鉴别方法。
5. 格氏试剂的生成及其与CO 2的加成。
教学难点:1. 卤代烷、烯的英文命名。
2. 亲核取代反应机制(S N 1、S N 2的特点)及其影响因素。
3. 消除与取代的竞争及其影响因素。
教具:电脑、投影仪、多媒体课件。
教学方法:讲授法。
为突出重点,突破难点,应注意如下几点:1. 卤素的英文名称先写在黑板上,便于记笔记,并举例说明。
2. 运用球棍模型及多媒体课件的演示,帮助学生理解S N 1、S N 2反应历程 的立体化学。
湖南省高校数字教学资源中心58.20.50.2203. 尽量结合实验数据来分析结构、试剂、溶剂对取代和消除反应的影响。
教学过程及时间分配:引言:从已学过的内容,如烯烃的亲电取代,芳环的亲电取代、芳环侧链的游离基取代等可引入卤素的反应,引出课题。
完成下列反应:以上两个反应均可将卤原子引入分子中。
卤代烃(RX ):烃分子中的一个或几个氢原子被卤素取代后的化合物。
大学有机化学第五章 卤代烃

5 由醇制备 醇分子中的羟基用卤原子置换可得到相应的卤代烃 醇分子中的羟基用卤原子置换可得到相应的卤代烃,常用的卤化剂 卤代烃, HX, 有HX,PX3,PX5,SOCl2等。
广东药学院 詹海莺 12
二、卤代烃的物理性质
1. 形态:bp、mp比相应的烷烃高 。 形态: 、 比相应的烷烃高 2. 溶解性:不溶于水,能与烃混溶,并能溶解 溶解性:不溶于水,能与烃混溶, 许多非极性及弱极性有机物。 许多非极性及弱极性有机物。 3. 密度: R-Cl < R-Br < R-I。多氯代烃、溴代 密度: 。多氯代烃、 烃和碘代烃比重大于1。 烃和碘代烃比重大于 。 4. 许多卤代烃有强烈气味。 卤代烃蒸气有毒。 许多卤代烃有强烈气味 卤代烃蒸气有毒。 气味。 5. 焰色反应:卤代烃在铜丝上灼烧时,产生绿 焰色反应:卤代烃在铜丝上灼烧时, 色火焰,这是鉴定含卤素有机物的简便方法。 色火焰,这是鉴定含卤素有机物的简便方法。
高级炔
or C C R'
R
X
NaOR' or HOR' NaSH or NaSR'
R
OR' 醚
R'COONa
R
O O C R' 酯
NHR'2(H)
R R NH2 R NHR' 仲胺
詹海莺
SH R SR' 硫醇(硫醚)
R
NR'2 叔胺
伯胺
广东药学院
R-X为重要有机中间体(intermediates) - 为重要有机中间体 为重要有机中间体( )
R—X
伯卤代烃: CH3—X 伯卤代烃 仲卤代烃:(CH CH— 仲卤代烃 (CH3)2CH—X 叔卤代烃: 叔卤代烃 (CH3)3C—X
第五章 卤代烃

卤代烃反应活性:
烯丙基卤>叔卤代烃>仲~>伯~
亲核取代反应:
由亲核试剂首先进攻电子云密度较低的中心碳 正原子而引起的取代反应,用SN表示。
亲核试剂:(带负电荷试剂或含有共用电子对试剂)
OH- 、CN- 、OR- 、NH3、ONO2 产物 ROH RCN ROR RNH 2 RONO 2
醇 腈 醚 胺 硝酸酯
β CH3
CH3CH2C=CH2 CH3
次要产物 29%
CH3CH CCH3 CH3
主要产物 71%
1、消除反应的取向
主要产物即消除的氢主要来自含H较少的β-碳 原子上,生成双键上连有最多取代基的烯烃, 称为查依采夫(Saytzeff)规则。 查依采夫规则可归纳为:越是稳定的烯烃越易 生成。
CH2-CH-CH 2CH3 Cl
Grignard试剂。
R X + Mg 无 水乙 醚 R MgX
烷基卤化镁 格氏试剂
结构分析:
R C MgX
格氏试剂的结构中有C-Mg键,这是 一个极性很强的共价键,电子云富集在 碳原子一方,即Cδ --Mgδ +,所以,它可 起碳负离子的作用,具有很强的亲核性, 可与带正电的碳原子反应。
δ-
δ+
5.熔沸点: 较同分子量的烃类高。
另: 卤代烃在铜丝上灼烧时,生成绿色火焰,是 初步鉴别卤代烃的方法
一、结构
C
C H3
X
H δδ C H H δ C H
极性共价键
δ Cl
由于成键原子的电负性不同,使成键电子对 偏向一方发生极化的现象,称为诱导效应。
极化性强弱:C-I > C-Br > C-Cl 化学性质活泼性:R-I > R-Br > R-Cl
有机化学课件-第五章 卤代烃

• C-X键的键能也比较小: C-I 217.6 kJ/mol;
C-Br 284.5 kJ/mol ;
C-Cl 338.9 kJ/mol • 因此,卤烷的化学性质比较活泼,反应都发生在C-X键 上。所以,卤素是卤烃分子中的官能团。
5.1.4 卤烷的化学性质
• 官能团: 卤素
• 卤原子的电负性大于碳原子,因此C-X键是极性共价键:
+ -
C—X
• 实验测得的卤烷偶极矩也证明了这一点:
卤烷 CH3CH2Cl CH3CH2Br
偶极矩 2.05D
2.03D
CH3CH2I
1.91D
• 可见,随着卤素电负性的增加, C-X键的极性也增大.
3C2H5I + P(OH)3
产率90%左右
• 伯醇与三氯化磷作用,因副反应而生成亚磷酸酯, 氯烷产率不高,一般不超过50%。
• 伯醇制氯烷, 3 ROH + PCl3 一般用PCl5 ROH + PCl5
P(OR)3 + 3HX RCl + POCl3 + HCl
(C) 醇与亚硫酰氯(SOCl2,又名氯化亚砜)作用
2-甲基-4-氯戊烷
3-甲基-1-碘戊烷
4-甲基-3-溴庚烷 (4)当有两个或多个相同卤素时,在卤素前冠以二、 三、…...
2-甲基-3,3,5-三氯己烷
(5)当有两个或多个不相同的卤素时,卤原子之间的 次序是:氟、氯、溴、碘
2-甲基-3-氟-4-溴-1-碘丁烷
(6)在多卤烷的命名中,常用“对称”和“不对称”、 “偏”等字来命名:
例1:
CH3-CH2-CH-CH3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
攻的机率相等,因此产物外消旋化。但是,在多数
SN1反应中,构型转化产物的比例往往大于构型保持 产物的比例,即生成的取代产物部分外消旋化。
例如:(R)-(-)-2-溴辛烷在含水的乙醇中 进行水解反应
H CH3
C
Br + H2O C2H5OH HO
H
H
CH3
CH3
C
+
C
OH
CH3(CH2)5
CH3(CH2)5 CH3(CH2)5
消除反应的取向
伯卤代烃的消除反应只有一种方式, 而仲、叔卤代烷可能有多种方式。
例如:
CH3—CH2—C| H—CH3
KOH 乙醇
Br
2-溴丁烷
CH3CH—CHCH3 + CH3CH2CH—CH2
2-丁烯
1-丁烯
(81%)
(19%)
C| H3 CH3CH2—C| —CH3
KOH 乙醇
Br
2-甲基-2-溴丁烷
例如:Grignard试剂与二氧化碳加成可以 得到比原来卤代烃多一个碳原子的羧酸:
RMgX + CO2 低温 RCOOMgX H2O/H+ RCOOH + Mg(OH)X
第四节 不同类型卤代烯烃的活泼性
烃基中含有双键的卤代烃发生亲核取代反 应的活泼性取决于卤素与双键的相对位置。
✓根据卤素与双键的相对位置分为以下三类:
1、决定反应速度的步骤为单分子反应; 2、反应是分步进行的; 3、有活泼中间体碳正离子生成 ; 4、取代产物部分外消旋化 。
(2)双分子亲核取代反应(SN2)
H2O
CH3Br + NaOH
CH3OH + NaBr
它的反应速率表示为:
V=k[CH3Br][OH-]
反应过程:
H
OH-
H
+
C
慢
Br
H H
CH3—C|H—CH3 + C2H5ONa
C2H5OH 50℃
CH3CH—CH2 + (CH3)2CHOC2H5
Br
(79%)
(21%)
✓ 实验证明:一级卤代烷易发生亲核取代反应,不 易发生消除反应,而二级,三级卤代烷易发生消除反 应。对结构相同的卤代烷,以水为溶剂时,有利于取 代反应,以醇为溶剂时,则有利于消除反应。
CH3(CH2)5 H
OH- +
C Br
CH3
(S)-(+)-2 - 溴辛烷
H
(CH2)5CH3
HO C
+ Br-
CH3
(R)-(-)-2 -辛醇
要产特物征外。消旋化是SN1机制在立体化学方面的重
R1
Nu-
Nu
C
R2
R3 SP2
R1
+
C
R3 R2
R1
Nu-
C
Nu
R2
R3
叔碳正离子
从碳正离子中间体的平面结构看,亲核试剂从两侧进
✓碳正离子稳定性顺序: 30正碳离子>20~ >10 ~> +CH3
✓不同卤代烷进行SN1的相对速度: 叔卤代烷 > 仲~>伯~ >CH3X
SN2反应的难易取决于卤代烷的 空间位阻的大小:
✓ 空间位阻大小的顺序: CH3X < 伯卤代烷 < 仲~ < 叔~
✓ 不同卤代烷SN2反应的相对速度: CH3X > 伯卤代烷 > 仲~ > 叔~
例如:苄基氯的水解,以水为溶剂时,反应 按SN1机制进行;若用丙酮为溶剂, 则按SN2机制进行。
✓一般来说,CH3X、RCH2X按SN2机理反应, R3CX、Ar2CHX、Ar3CX按SN1机理反应。 R2CHX、ArCH2X、H2C=CHCH2X根据不同的 反应条件,既可发生SN2反应,也可发生SN1反 应。若试剂亲核性强,浓度大,一般发生SN2反 应;若试剂浓度小,亲核性弱,则发生SN1反应。
NaOR'
ROR'(醚类) + NaX
R-X
NaCN/醇 △
RCN(腈类) + NaX H3O+ RCOOH(羧酸)
NH3 RNH2(胺类) + HX
AgNO3/醇 △
RONO2(硝酸酯) + AgX↓
2.亲核取代反应的反应机理
(1)单分子亲核取代反应(SN1) (2)双分子亲核取代反应(SN2)
(1)单分子亲核取代反应(SN1)
(CH3)3C-Br + OH-
H2O △
(CH3)3C-OH + Br-
它的反应速率表示为:
v=k[ (CH3)3C Br ]
反应分两步进行:
第一步:
(CH3) 3C
慢
Br
δ+ δ[(CH3)3C Br]
第一过渡态
_
(CH3)3C+ + Br
叔碳正离子
第二步:
CH3
CH3 重排 CH3 CH3C CH2 CH3C CH2 CH3
CH3
练习题:卤代烷与氢氧化钠在水-乙醇溶液中进
行反应,从下列现象判断哪些属于SN2历程,哪些 属于SN1历程?
SN2(1)产物的构型完全转变 SN2(2)增加氢氧化钠浓度,反应速率明显加快 SN1(3)叔卤代烷反应速度明显大于伯卤代烷 SN2(4)反应不分阶段一步完成 SN1(5)有重排产物
中心碳原子
δ+
δ-
Nu- + R CH2 X
亲核试剂 底物
RCH2Nu + X-
产物
离去 基团
反应类型:
1、被羟基(-OH)取代( 水解反应) 2、被烷氧基(-OR)取代 3、被氰基(-CN)取代 4、被氨基(-NH2)取代 5、被硝酸根(-ONO2)取代
NaOH/H2O △
ROH(醇类) + NaX
SN2反应增加
CH3X RCH 2X R2CHX R3CX SN1反应增加
卤代甲烷和伯卤代烷最容易发生 SN2反应;仲卤代烷既可进行SN1反应, 也可进行SN2反应;叔卤代烷最容易 发生SN1反应。
(2)离去基团的影响
无 论 是 进 行 SN1 反 应 还 是 进 行 SN2反应,卤原子做为离去基团, 它的离去倾向越大,则反应越易进 行。C-X键的可极化度大小顺序是 C-I>C-Br>C-Cl>C-F,卤 负离子离去倾向的大小顺序为:I>Br- >Cl- >F-。
(3)亲核试剂的影响
亲核试剂对SN1历程影响不大,这是由于SN1历程的反 应速率只与卤代烃的浓度有关。在SN2反应中,亲核试剂 的亲核性越强(电负性小,给电子能力强),体积越小 (空间阻碍小)则SN2反应速率越快。
(4)溶剂的影响
通常来说,极性溶剂会加快SN1反应的速率 ,非极性溶剂 有利于SN2反应。
三、与金属镁的反应
卤代烃能与Li、Na、K、Mg等金属反应,生成金
属直接与碳相连的有机金属化合物。其中与镁在无水
乙醚中反应生成有机金属化合物——烃基卤化镁,又
称Grignard试剂,是有机合成中很常用的试剂。
无水乙醚
R X + Mg
R MgX
烃基卤化镁
δ- δ+ δ-
R C MgX
强亲核试剂
Grignard试剂遇活泼氢类化合物(水、 醇、氨等)立即分解生成烷烃:
4. 影响亲核取代反应机制的因素
在一个亲核取代反应中,SN1和SN2两 种反应机制往往是互相竞争的。某一具体 的反应究竟是按SN1方式进行,还是按SN2 方式进行,这与卤代烷的结构、亲核试剂 的亲核性、溶剂的极性大小以及离去基团 的种类等多种因素有关。
(1)烃基结构的影响
SN1反应的难易取决于碳正离子的 稳定性:
5 43 21
CH3CHCH=CHCH3
|
Br
CH3Biblioteka Br4-溴-2-戊烯对溴甲苯
(或4-溴甲苯)
俗名
CHCl3(三氯甲烷)称为氯仿 CHI3 (三碘甲烷)称为碘仿
第三节 卤代烃的化学性质
卤代烃的化学性质是由于卤原子的存 在所引起的。
δ++
δ+
R β CH α CH2
H Xδ-
亲核取代反应 消除反应
5
4
3
2
1
CH3—C| H—CH2—C| H —CH3
Cl
CH3
2-甲基-4-氯戊烷
1
23
CH2=C CH2Cl
CH3
2-甲基-3-氯丙烯
1 2 34 5
CH3C| HC|HCH2CH3
Cl
6 5 4| 3 2 1 CH3C| HC| CH2CH(CH3)2
Cl CH3
Cl Cl
3-甲基-2-氯戊烷 2-甲基-4,4,5-三氯己烷
RMgX + HOH
RMgX + R'OH RMgX + HNH2
RH + Mg X OH
X RH + Mg
OR'
RH + Mg X NH2
由于Grignard试剂遇水分解,故需要在无水乙 醚等非质子性溶剂中制备和使用。
作 为 强 的 亲 核 试 剂 , Grignard 试 剂 可 以和醛、酮(见第八章醛、酮、醌)及二 氧化碳等多种化合物发生加成反应。
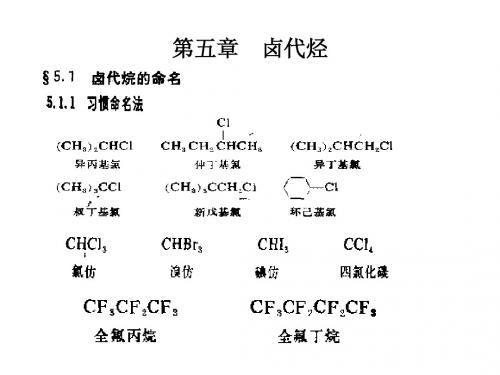
(代)某烃”或称为“某基卤”。
例如:
CHCl3
三氯甲烷
CH2=CHCl 氯乙烯
Br 溴苯
CH3CH2CH2CH2Cl (CH3)3CBr
正丁基氯 叔丁基溴
CH2=CHCH2Br 烯丙基溴
