专题03 离子反应原卷版
新高考专用2020_2022三年高考化学真题分项汇编专题03离子反应

【解析】A.碳酸钙难溶于水,在离子方程式中应以化学式保留,石灰石与醋酸反应的离子方程式为CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑,A错误;
B.银作阳极,阳极的电极反应式为Ag-e-=Ag+,铜片作阴极,阴极的电极反应式为Ag++e-=Ag,总反应为Ag(阳极) Ag(阴极),B正确;
B. 的 溶液, 与 生成 不能大量共存,B不符合题意;
C. 的 溶液,H+、 、 共同作用发生氧化还原反应,不能大量共存,C不符合题意;
D. 的 溶液, 、 、 、 、 、 能大量共存,D符合题意;
故选D。
12.(2021湖北)对于下列实验,不能正确描述其反应的离子方程式是
A. 向氢氧化钡溶液中加入盐酸:H++OH-=H2O
C.Cu与稀硝酸反应生成Cu(NO3)2、NO和水,反应的离子方程式为3Cu+8H++2 =3Cu2++2NO↑+4H2O,C正确;
D.明矾溶液中加入少量Ba(OH)2溶液,参与反应的Ba2+与OH-物质的量之比为1:2,生成的Al(OH)3与BaSO4沉淀物质的量之比为2:3,反应的离子方程式为2Al3++3 +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓,D正确;
B.氯气通入NaOH溶液中可以生成氯化钠和次氯酸钠两种盐,其离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故B正确;
C.钠的过氧化物为Na2O2,可以和水反应生成氢氧化钠,但在离子方程式里Na2O2不能拆成离子,故C错误;
专题03 章末测试卷(基础)(原卷版)

专题03章末测试卷一、单选题1.(2018·山东淄博市·七年级期中)在ABC ∆中,15AB =,13AC =,高12AD =,则三角形的周长是( )A .42B .32C .42或32D .37或33 2.(2019·全国)直角三角形的一条直角边长是另一条直角边长的13,斜边长为10,则它的面积为( )A .10B .15C .20D .30 3.(2020·广西防城港市·八年级期中)已知一个直角三角形的两边长分别为3和5,则第三边长是( )A .5B .4CD .44.(2018·安徽九年级专题练习)如图,在△ABC 中,AB=AC=5,BC=6,点M 为BC 的中点,MN ⊥AC 于点N ,则MN 等于( )A .125B .95C .65D .165 5.(2020·浙江杭州市·八年级期中)如图,在ABC ∆中,90C ∠=︒,2AC =,点D 在BC 上,AD =ADC 2B ∠=∠,则BC 的长为( )A 1B 1C 1D 16.(2020·山东德州市·八年级月考)已知a、b、c是三角形的三边长,若满足2a c--=,则这个三角形的形状是()(6)|10|0A.等腰三角形B.等边三角形C.锐角三角形D.直角三角形7.(2018·安徽全国·八年级单元测试)如图是一个十字路口,O是两条公路的交点,点A,B,C,D表示的是公路上的四辆车.若OC=8m,AC=17m,AB=5m,BD=m,则C,D两辆车之间的距离为()A.5m B.4m C.3m D.2m 8.(2020·河南许昌市·八年级期中)如图,点P是平面坐标系中一点,则点P到原点的距离是()A.3B C D 9.(2018·安徽全国·八年级单元测试)如图,已知AB⊥CD,△ABD,△BCE都是等腰直角三角形.如果CD,7,BE,3,那么AC的长为(,A.8B.5C.3D.410.(2019·全国八年级单元测试)在如图所示的网格中,每个小正方形的边长都为1,△ABC的顶点都在格点上,三边长分别为a、b、c,则a、b、c的大小关系是( )A.a<c<b B.a<b<c C.c<a<b D.c<b<a二、填空题11.(2020·全国九年级课时练习)如图,在△ABC中,∠B=90°,∠A=60°,BC=5,将△ABC沿直角边BC所在的直线向右平移2个单位长度,到达△DEF,AC与DE 交于点G,则EG的长为__.12.(2020·郑州市第六十三中学八年级月考)如图所示,李明从家出发向正北方向走了1200米,接着向正东方向走到离家2000米远的地方,这时,李明向正东方向走了____米.13.(2020·高台县南华初级中学八年级月考)如图,已知在Rt△ABC中,∠ACB=90°,AB=4,分别以AC,BC为直径作半圆,面积分别记为S1,S2,则S1+S2等_________.14.(2020·辽宁葫芦岛市·八年级期末)如图,一根旗杆在离地面5 m处断裂,旗杆顶部落在离旗杆底部12 m处,旗杆断裂之前的高为____.三、解答题15.(2020·山东济南市·八年级月考)如图,已知在四边形ABCD中,∠A=90°,AB=2cm,AD,CD=5cm,BC=4cm,求四边形ABCD的面积.16.(2020·西安市曲江第一中学八年级月考)在杭州西湖风景游船处,如图,在离水面高度为5m的岸上,有人用绳子拉船靠岸,开始时绳子BC的长为13m,此人以0.5m/s 的速度收绳.10s后船移动到点D的位置,问船向岸边移动了多少m?(假设绳子是直的,结果保留根号)17.(2020·江阴市敔山湾实验学校八年级月考)如图,公路PQ和公路MN交于点P,且∠NPQ=45°,公路PQ上有一所学校A,AP=米,现有一拖拉机在公路MN 上以10米∕秒的速度行驶,拖拉机行驶时周围100米以内会受到噪声的影响,请判断拖拉机在行驶过程中是否对学校会造成影响,并说明理由,如果造成影响,求出造成影响的时间.18.(2020·牡丹江市田家炳实验中学)如图,OABC是一张放在平面直角坐标系中的矩形纸片,O为原点,点A在x轴的正半轴上,点C在y轴的正半轴上,OA=10,OC=8.在OC边上取一点D,将纸片沿AD翻折,使点O落在BC边上的点E处,求D,E两点的坐标.19.(2019·郁南县蔡朝焜纪念中学八年级月考)如图,已知∠ABD=∠C=90°,AD=12,AC=BC,∠DAB=30°.求BC的长.20.(2020·上海市静安区实验中学九年级课时练习)如图,一张长8cm,宽6cm的矩形纸片,将它沿某直线折叠使得A、C重合,求折痕EF的长.21.(2020·宁夏吴忠市·八年级期末)一种盛饮料的圆柱形杯,测得内部底面半径为2.5㎝,高为12㎝,吸管放进杯里,杯口外面至少要露出4.6㎝,问吸管要做多长?22.(2020·山东济宁市·八年级期末)已知:如图,一块R t△ABC的绿地,量得两直角边AC=8cm,BC=6cm.现在要将这块绿地扩充成等腰△ABD,且扩充部分(△ADC)是以8cm为直角边长的直角三角形,求扩充等腰△ABD的周长.(1)在图1中,当AB=AD=10cm时,△ABD的周长为.(2)在图2中,当BA=BD=10cm时,△ABD的周长为.(3)在图3中,当DA=DB时,求△ABD的周长.23.(2020·全国八年级课时练习)到三角形三条边距离相等的点,叫做此三角形的内心,由此我们引入如下定义:到三角形的两条边距离相等的点,叫做此三角形的准内心.举例:如图,若AD平分∠CAB,则AD上的点E为△ABC的准内心.应用:(1)如图AD为等边三角形ABC的高,准内心P在高AD上,且PD=12AB,则∠BPC的度数为度.(2)如图已知直角△ABC中斜边AB=5,BC=3,准内心P在BC边上,求CP的长.。
2021-2022年高考化学真题分项解析 专题03《离子反应》

2021年高考化学真题分项解析专题03《离子反应》1.【xx天津理综化学】下列关于物质或离子检验的叙述正确的是()A.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+B.气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气C.灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2【答案】B【解析】A项Fe3+遇KSCN会使溶液呈现红色,Fe2+遇KSCN不反应无现象,如果该溶液既含Fe3+,又含Fe2+,滴加KSCN 溶液,溶液呈红色,则证明存在Fe3+但并不能证明无Fe2+,故A项错误;B项气体通过无水硫酸铜,粉末变蓝,则发生反应:CuSO4+5H2O═CuSO4·5H2O,CuSO4·5H2O为蓝色,故可证明原气体中含有水蒸气,B 项正确;C项灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,Na+颜色反应为黄色,但并不能证明无K+,因为黄光可遮住紫光,故K+颜色反应需透过蓝色的钴玻璃滤去黄光后观察,故C项错误;D项能使澄清石灰水变浑浊的气体有CO2、SO2等,故将气体通入澄清石灰水,溶液变浑浊,则原气体比一定是CO2,D项错误;本题选B。
【考点定位】本题主要考查了常见物质、离子的检验,设计铁离子、水、钠离子、钾离子、二氧化碳气体。
【名师点睛】Fe3+与KSCN溶液的反应、Fe2+的检验、二者同时存在的检验,CuSO4固体与CuSO4▪5H2O的颜色区别、水的检验,钠离子、钾离子的焰色反应的应用、检验时操作的异同,二氧化碳的检验、二氧化碳与澄清石灰水的化学方程式、现象的判断,注意在进行物质或离子的检验或鉴别时,现象与结论的对应关系的描述,不同操作的关键点,使学生着重记忆物质的性质的本质区别,学会利用物质的性质分析检验的方案及现象。
【注】本题分类与专题3、52.【xx四川理综化学】下列有关CuSO4溶液的叙述正确的是()A.该溶液中Na+、NH4+、NO3-、Mg2+可以大量共存B.通入CO2气体产生蓝色沉淀C.与H2S反应的离子方程式:Cu2++ S2-=CuS↓D.与过量浓氨水反应的离子方程式:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+【答案】A3.【xx山东理综化学】下列表示对应化学反应的离子方程式正确的是()A.向稀HNO3中滴加Na2SO3溶液:SO32—+2H+=SO2↑+H2OB.向Na2SiO3溶液中通入过量SO2:SiO32—+ SO2+ H2O=H2SiO3↓+SO32—C.向Al2(SO4)3溶液中加入过量的NH3·H2O:Al3 ++4 NH3·H2O=[Al(OH)4]—+4NH4+D.向CuSO4溶液中加入Na2O2:2 Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑【答案】D【解析】A、稀硝酸与Na2SO3发生氧化还原反应,生成SO42‾、NO和H2O,错误;B、过量的SO2与Na2SiO3溶液反应生成HSO3‾,错误;C、Al(OH)3不与弱碱反应,所以Al2(SO4)3与过量氨水反应生成Al(OH)3,错误;D、Na2O2与H2O反应生成NaOH和O2,NaOH与CuSO4反应生成Cu(OH)2和Na2SO4,两个方程式加和可得离子方程式,正确。
高三化学高考备考一轮复习课件:专题三 离子反应

色气体为Cl2,根据氧化还原反应基本原理可知,应还有Co2+生成,据此写出
其离子方程式。
2-2.(2020江苏卷节选)吸收工厂烟气中的SO2,能有效减少SO2对空气的污
染。氨水、ZnO水悬浊液吸收烟气中SO2后经O2催化氧化,可得到硫酸盐。
沧海可填山可移,男儿志气当如斯。
志之所趋,无远勿届,穷山复海不能限也;志之所向,无坚不摧。
母鸡的理想不过是一把糠。
莫为一身之谋,而有天下之志。
志高山峰矮,路从脚下伸。
志正则众邪不生。
才自清明志自高。
(
)
2A.用碳酸钠溶液处理水垢中的硫酸钙:CO3 +CaSO4
-
B.过量铁粉加入稀硝酸中:Fe+4H++NO3
Cu(NO3)2、NO和水,反应的离子方程式为3Cu+8H++2N O-3
==3Cu2++2NO↑+4H2O,C正确;D项,明矾溶液中加入少量Ba(OH)2溶液,参与
反应的Ba2+与OH-的物质的量之比为1∶2,生成的Al(OH)3与BaSO4沉淀的
2++6OH物质的量之比为2∶3,反应的离子方程式为2Al3++3S O2+3Ba
Fe、Co、Ni能与Cl2反应,其中Co和Ni均生成二氯化物,由此推断FeCl3、
CoCl3和Cl2的氧化性由强到弱的顺序为
盐酸反应有黄绿色气体生成,写出反应的离子方程式:
,Co(OH)3与
。
答案 CoCl3>Cl2>FeCl3
2Co(OH)3+6H++2Cl-==2Co2++Cl2↑+6H2O
专题03-离子反应

B.含有0.1 mol· -1 Fe3&#;、I-、NO3-
C.含有0.1 mol· -1Ca2+溶液在中: L
Na+、K+、CO32-、ClD.室温下,pH=1的溶液中: Na+、Fe3+、NO3-、SO42-
【例16】今有一混合物的水溶液,只可能含有以下离子 中的若干种:K+、NH4+ 、Cl-、Mg2+、Ba2+、SO32-、 SO42-,现取三份100 mL溶液进行如下实验: (1)第一份加入AgNO3溶液有沉淀产生 (2)第二份加足量NaOH溶液加热后,收集到气体0.04 mol (3)第三份加足量BaCl2溶液后,得干燥沉淀6.27 g, 经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述 实验,以下推测正确的是 ( ) A.K+一定存在 B.100 mL溶液中含0.01 mol CO32C.Cl-可能存在 D.Ba2+一定不存在,Mg2+可能存在
10)在溶液中能大量共存的 【例14】(09年安徽理综·
一组离子或分子是( )
A.NH4+、H+、NO3-、HCO3B.K+ 、Al3+、SO42- 、NH3· 2O H C.Na+、K+、SO32-、Cl2 D.Na+ 、CH3COO-、CO32-、OH-
7)在下列各溶液中,离子一 【例15】(09年江苏化学· 定能大量共存的是( ) A.强碱性溶液中:K+、Al3+、Cl-、SO42-
A.漂白粉溶液在空气中失效:
ClO-+CO2+H2O=HClO+HCO3B.用浓盐酸与MnO2反应制取少量氯气: MnO2+2H++2Cl-Mn2++Cl2↑+2H2O C.向NaAlO2溶液中通入过量CO2制Al(OH)3: AlO2-+CO2+2H2O=Al(OH)3↓+HCO3D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4
【备战2013】高考化学 考前30天冲刺押题系列 第二部分 专题03 离子反应与氧化还原反应

【备战2013】高考化学考前30天冲刺押题系列第二部分专题03 离子反应与氧化还原反应1.判断指定条件下离子方程式的正误及判断限定条件下的离子共存问题。
2.理解离子反应的实质与计算。
3.以生产、生活、社会中的实际问题考查氧化还原反应的基本概念,分析物质的氧化性、还原性强弱和电子转移过程。
4.结合物质的推断及离子反应考查氧化还原反应的配平。
5.电子守恒法在氧化还原反应计算中的应用。
考点一氧化还原反应的概念辨析及规律应用通过近三年的高考试题看出,氧化还原反应的考查主要集中在氧化剂、还原剂、氧化产物、还原产物等概念的辨析以及氧化还原反应规律的应用。
【例1】(2012·上海,20)火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2===Cu2S +2FeS+SO2,下列说法正确的是( )。
A.SO2既是氧化产物又是还原产物B.CuFeS2仅作还原剂,硫元素被氧化C.每生成1 mol Cu2S,有4 mol硫被氧化D.每转移1.2 mol电子,有0.2 mol硫被氧化【变式】已知二氯化二硫(S2Cl2)的结构式为Cl—S—S—Cl,它易与水反应:2S2Cl2+2H2O===4HCl+SO2↑+3S↓。
对该反应的说法正确的是( )。
A.S2Cl2既作氧化剂又作还原剂B.H2O作还原剂C.每生成1 mol SO2转移4 mol电子D .氧化产物与还原产物物质的量比为3∶1【特别提醒】正确理解氧化还原反应中的几个“不一定”(1)含最高价态元素的化合物不一定有强氧化性,如H 3PO 4、Na +;而含低价态元素的化合物也可能有强氧化性,如氧化性HClO >HClO 3。
(2)在氧化还原反应中,一种元素被氧化,不一定有另一种元素被还原,如Cl 2+H 2O HCl+HClO 。
(3)得电子难的物质不一定易失电子,如ⅣA 族的碳(C)和稀有气体。
(4)元素由化合态变为游离态不一定被氧化,也可能被还原。
苏教版高中化学选择性必修1化学反应原理课后习题 专题3 水溶液中的离子反应 盐类水解的应用

03分层作业19 盐类水解的应用A级必备知识基础练1.下列做法与盐类水解知识无关的是( )A.实验室盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不能用玻璃塞B.施肥时,草木灰(有效成分为K2CO3)不能与碳酸氢铵混合使用C.Al2S3不能用复分解反应的方法在溶液中制取,而只能用干法制备D.配制FeCl2溶液时常常要在溶液中加入少量铁粉2.(陕西汉中检测)某温度下,0.1 mol·L-1 Na2S溶液的pH约为13。
下列关于该溶液的说法正确的是( )A.c(Na+)>c(HS-)>c(OH-)B.c(H+)+2c(H2S)+c(HS-)=c(OH-)C.c(Na+)=c(S2-)+c(HS-)+c(H2S)D.c(Na+)+c(H+)=2c(S2-)+c(HS-)3.下列现象不能用盐类水解知识解释的是( )A.明矾能用于净水B.纯碱可以去油污C.铜绿的生成D.铵态氮肥不能与草木灰混合使用4.有等物质的量浓度、等体积的下列溶液(1)H2CO3(2)Na2CO3(3)NaHCO3(4)NH4HCO3(5)(NH4)2CO3。
下列关系或者说法正确的是( )A.c(HC O3-)的大小关系:(4)>(3)>(5)>(2)>(1)B.c(C O32-)的大小关系:(1)<(4)<(3)<(5)<(2)C.将溶液蒸干并灼烧后只有(1)不能得到对应的固体物质D.(2)(3)(4)(5)既能与盐酸反应,又能与NaOH溶液反应5.下列说法正确且与盐的水解有关的是( )①NH4Cl与ZnCl2溶液可作焊接金属时的除锈剂②NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂的材料③草木灰与铵态氮肥不能混合施用④实验室中盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞⑤加热蒸干CuCl2溶液并灼烧,可得到Cu(OH)2固体⑥要除去FeCl3溶液中混有的Fe2+,可先通入氧化剂Cl2,再调节溶液的pHA.①③⑥B.②③④C.①④⑤D.①②③④6.下列物质的溶液在蒸发皿中加热蒸干并灼烧,可以得到该物质本身的是( )①Fe2(SO4)3②NaHCO3③NH4Cl ④MgCl2⑤Na2SO3⑥CuSO4A.①③B.④⑤C.①⑥D.②⑥7.25 ℃时,下列溶液中微粒浓度关系一定正确的是( )A.氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(N H4+)B.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+)C.0.1 mol·L-1的硫酸铵溶液中:c(N H4+)>c(S O42-)>c(H+)D.0.1 mol·L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)8.某温度时,向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1的NaOH溶液的过程中[忽略溶液体积和温度的变化,该温度下K a(CH3COOH)=1.6×10-5]。
高考化学 考点总动员 离子共存

冠夺市安全阳光实验学校专题03 离子共存(含解析)【母题再现】 题型介绍:离子共存为高考常考题型,涉及复分解反应、氧化还原反应、双水解反应等情况下离子之间的相互反应的判断。
在近几年高考中此题型有如下变化趋势:①隐含条件越来越隐蔽;②从离子过程到粒子共存的转变,扩大了考试范围;③从无机物之间的共存到涉及有机物。
高考选题:【高考江苏卷第3题】25℃时,下列各组离子在指定溶液中一定能大量共存的是A .pH =1的溶液中:Na +、K +、MnO 4-、CO 32-B .c(H +)=1×10-13mol/L 的溶液中:Mg 2+、Cu 2+、SO 42-、NO 3-C .0.1mol/LNH 4HCO 3溶液中:K +、Na +、NO 3-、Cl-D .0.1mol/LFeCl 3溶液中:Fe 2+、NH 4+、SCN -、SO 42-解题技巧:解决此类问题,除了要考虑粒子之间能否发生反应以外,还要考虑附加条件的应用和隐含条件的深度挖掘,充分考虑溶液中离子之间是否遵循电荷守恒以及反应的先后顺序。
1、多种离子能否大量共存于同一溶液中,归纳起来就是一句话:一色、二性、三特殊、四反应。
一色:即溶液颜色。
若限定无色溶液,则Cu 2+、Fe 3+、Fe 2+、MnO -4、Co 2+、Cr 2O 2-7 、CrO 2-4、Cr 3+等有色离子不能存在。
二性:即溶液的酸性和碱性。
在强酸性溶液电,OH -及弱酸根阴离子(CO 2-3、SO 2-3、S 2-、CH 3COO -等)均不能大量存;在强碱性溶液中,H +及弱碱阳离子(如NH +4 、Mg 2+、Al 3+、Fe 3+等)均不能大量存在;酸式弱酸根离子(如HCO -3 、HSO -3 、HS -、H 2PO -4 等)在强酸性或强碱性溶液中均不可能大量存在。
三特殊:指三种特妹情况:①HCO -3 与AlO -2不能大量共存(发生双水解反应);②H +与NO -3组合具有强氧化性,能与S 2-、Fe 2+、I - 等发生反应,而这一种组合常常较为隐蔽,不易被察觉;③NH +4 与CH 3COO -、CO 2-3 ,Mg 2+与HCO -3等组合中,虽然两种离子都能水解且水解相互促进,但总的水解程度仍很小,它们在溶液中能大量共存(加热就不同了)。
高三二轮复习 专题03 离子反应方程式和离子共存(练)解析版

专题03 离子反应方程式和离子共存1.(2021·四川省成都市第一次诊断)对下列实验,一定能正确描述其反应过程的离子方程式是( ) A .向稀硝酸中加入过量铁粉:Fe +4H ++ NO -3 =Fe 3++NO↑+2H 2OB .向饱和Na 2CO 3溶液中滴入几滴稀AlCl 3溶液:2A13++3CO 2-3+3H 2O=2Al(OH)3↓+3CO 2↑C .乙酸乙酯与稀NaOH 溶液共热:CH 3COOC 2H 5+OH -→ CH 3COO -+C 2H 5OHD .向长期露置于空气的酸性KI 溶液先后滴入几滴FeCl 3溶液和淀粉溶液,立即出现蓝色2Fe 3++2I -=2Fe 2++I 2【答案】C【解析】铁粉过量生成Fe 2+,离子方程式为+-2+323Fe +8H + 2NO =3Fe +2NO +4H O ↑,故A 错误;AlCl 3少量2-3CO 过量,只发生第一步水解生成-3HCO ,离子方程式为()3+2--3233A1+3CO +3H O=Al OH +3HCO ↓,故B 错误;乙酸乙酯在碱性条件下水解生成CH 3COO -和C 2H 5OH ,故C 正确;长期露置于空气的KI 被氧气氧化,生成I 2,遇到淀粉立即出现变蓝,离子方程式为+-222O +4I =+4H +I 2H 2O ,故D 错误;故选C 。
2.(2021·云南省红河州统一检测)常温下,下列各组离子在有关限定条件下一定能大量共存的是( ) A .酸性溶液中:K +、Na +、Fe 2+、NO 3-、Cl -B .中性溶液中:K +、Fe 3+ 、Cl -、CO 23-、HCO 3-C .常温下,C(H +)/C(OH -)=1×10-12的溶液:K +、AlO 2-、CO 23-、Na +、Cl -D .pH =13的溶液中:AlO 2-、Cl -、HCO 3-、SO 24-【答案】C【解析】酸性溶液中:H +、Fe 2+、NO 3-能发生氧化还原反应,不能大量共存,A 与题意不符;中性溶液中:Fe 3+和CO 23-或HCO 3-发生双水解反应,不能大量共存,B 与题意不符;常温下,C(H +)/C(OH -)=1×10-12的溶液呈碱性,K +、AlO 2-、CO 23-、Na +、Cl -、OH -之间不反应,能大量共存,C 符合题意;pH =13的溶液呈碱性, HCO 3-、OH -反应生成碳酸根离子和水,不能大量共存,D 与题意不符;答案为C 。
专题03 重点句子及专练(原卷版及解析版)

重点句子及专练(原卷版一1.Mom, ________ ________ my teacher.妈妈,这是我的老师。
2.________ ________ you do?你好吗?3.________ you ________.给你。
4.Where ________ you ________?你来自哪里?5.________ your name, please?请问你的名字叫什么?6.________ your telephone number?你的电话号码是多少?7.—________ ________ very much.非常感谢你。
—That's OK.不客气。
8.________ ________ are you?你多大了?9.________ ________ are you in?你在哪个班?10.Excuse me, ________ ________ in English?请问,这用英语怎么说?11.________ ________ you ________ it?怎么拼写呢?12.________ me ________ you.让我来帮助你。
13.—What are these?这些是什么?—________ ________ books.这是一些书。
14.Michael, ________ is your favorite actor?迈克尔,谁是你最喜欢的演员?15.—________ ________ ________ a big knife?你有一把大的刀子吗?—Yes, I do.我有。
16.—________ ________ she ________ ________?她长什么样?—She is tall and she has short brown hair.她很高,并且有一头棕色短发。
17.Mom, I ________ ________ ________ a T-shirt, a cap and a pair of shoes.妈妈,我想买一件T恤、一个帽子和一双鞋。
高考化学二轮复习 专题03 离子反应学案 鲁科版-鲁科版高三全册化学学案

专题三离子反应学习目标:1、了解离子反应的概念、离子反应发生的条件。
2、掌握离子方程式的书写。
3、能正确判断离子是否大量共存。
4、了解常见离子的检验方法。
学习重难点:离子方程式的书写、离子共存、离子检验自主学习一、电解质及其电离【知识回顾】1.电离电解质在水溶液中或熔融状态下产生自由移动离子的过程。
2.电解质和非电解质(1)电解质是在水溶液中或熔融状态下能够导电的化合物。
(2)非电解质是在水溶液中和熔融状态下都不能导电的化合物。
3.强电解质和弱电解质在水溶液中完全电离的电解质叫强电解质。
在水溶液中部分电离的电解质叫弱电解质。
4.依据元素周期表,记忆常见强弱电解质ⅠA:除LiOH外其余都是强碱。
ⅡA:除Mg(OH)2、Be(OH)2外其余都是强碱。
ⅢA:Al(OH)3是两性氢氧化物。
ⅣA:H2CO3、H2SiO3均为弱酸。
ⅤA:强酸:HNO3中强(或弱)酸:HNO2、H3PO4。
ⅥA:强酸:H2SO4弱酸:H2SO3、H2S。
ⅦA:强酸:HCl、HBr、HI、HClO4等弱酸:HF、HClO等。
过渡元素中常见的弱碱:Fe(OH)3、Fe(OH)2、Cu(OH)2、Zn(OH)2等。
注意盐不论难溶、易溶,绝大多数都是强电解质。
二、离子反应1.离子反应(1)概念:有离子参加或有离子生成的反应统称为离子反应。
(2)离子反应的条件①生成难溶的物质;②生成难电离的物质;③生成易挥发的物质;④发生氧化还原反应。
(3)离子反应的本质离子反应的本质是溶液中某些物质的物质的量的减少。
2.离子方程式(1)离子方程式:用实际参加反应的离子符号来表示反应的式子。
(2)离子方程式的意义离子方程式不仅可以表示某一个具体的化学反应,还可以表示同一类型的离子反应。
正误辨析正误判断,正确的打“√”,错误的打“×”(1)银和食盐水都能导电,都属于电解质( )(2)AgCl、BaSO4等不溶于水,都属于弱电解质( )(3)HClO是弱酸,但NaClO是强电解质( )(4)在溶于水或熔融状态下能够自身发生电离的化合物一定是电解质( )(5)Na2O固体与水反应:O2-+H2O===2OH-( )(6)醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+===Ca2++H2O+CO2↑()(7)Fe(OH)3和稀硫酸的反应:OH-+H+===H2O( )(8)硫酸铜溶液跟氢氧化钡溶液反应:Ba2++SO2-4===BaSO4↓()答案(1)×(2)×(3)√(4)√(5)×(6)×(7)×(8)×【题组集训】题组一准确判断概念1.下列说法正确的是( )A.金属能导电,所以金属是电解质B.Cl2的水溶液能导电,所以Cl2是电解质C.硫酸在水溶液中能完全电离,所以硫酸是强电解质D.SO2、NH3的水溶液能导电,所以SO2、NH3均是电解质答案 C2.下列说法正确的是( )A.BaSO4的水溶液导电性很弱,故它是弱电解质B.强电解质溶液的导电性比弱电解质溶液的导电性强C.弱电解质溶液中存在多种共价化合物分子D.强电解质都是离子化合物,弱电解质都是共价化合物答案 C题组二电离方程式的书写——理解离子反应的基石3.写出下列典型物质在溶液中的电离方程式(注:如无特别说明,均指在水溶液中的电离)。
专题03化学反应条件的控制(解析版)

专题03化学反应条件的控制(解析版)03.化学反应条件的控制可能⽤到的相对原⼦质量:H-1 C-12 N-14 O-16 Na-23 Al-27 S-32 Cl-35.5 K-39 Mn-55 Fe-56 Co-59 Cu-64 Br-80 Ag-108 I-127第Ⅰ卷(选择题共40分)⼀、选择题(本题共20⼩题,每⼩题2分,共40分。
在每⼩题给出的四个选项中,只有⼀项是符合题⽬求的)1.已知CoCl2·6H2O(粉红⾊)CoCl2(蓝⾊),要使⼆氯化钴⽔合物的颜⾊由粉红⾊变成蓝⾊,可采取的措施是( )A.降低温度B.增⼤湿度C.研磨D.加⼊吸⽔剂【答案】D【解析】要使⼆氯化钴⽔合物的颜⾊由粉红⾊变成蓝⾊,说明平衡正向移动,即失⽔,故可加⼊吸⽔剂。
2.关于实验室制备⼄烯的实验,下列说法正确的是( )A.反应物是⼄醇和过量的3mol/L硫酸的混合液B.温度计插⼊反应液⾯以下,以便控制温度在140℃C.反应容器(烧瓶)中应加⼊少许碎瓷⽚D.反应完毕先熄灭酒精灯再从⽔中取出导管【答案】C【解析】A项,实验室制备⼄烯所⽤的原料为⼄醇和浓硫酸的混合物,3mol/L为稀硫酸,故A错误;B项,温度计要插⼊反应液的液⾯下,以控制温度在170℃时⽣成⼄烯,故B错误;C项,为防暴沸,需加⼊沸瓷⽚,故C正确;D项,为防倒吸,应先把导管从⽔中取出再熄灭酒精灯,故D错误。
故选C。
3.下列说法正确的是( )A.为测定新制氯⽔的pH,⽤玻璃棒蘸取液体滴在pH试纸上,与标准⽐⾊卡对照即可B.做蒸馏实验时,在蒸馏烧瓶中应加⼊沸⽯,以防暴沸。
如果在沸腾前发现忘记加沸⽯,应⽴即停⽌加热,冷却后补加C.在未知溶液中滴加BaCl2溶液出现⽩⾊沉淀,加稀硝酸,沉淀不溶解,说明该未知溶液中存在SO42-或SO32-D.提纯混有少量硝酸钾的氯化钠,应采⽤在较⾼温度下制得浓溶液再冷却结晶、过滤、⼲燥的⽅法【答案】B【解析】A项,氯⽔中的次氯酸能漂⽩pH试纸,不能⽤pH试纸测定新制氯⽔的pH值,故A错误;B项,液体加热要加沸⽯或碎瓷⽚,引⼊汽化中⼼,可防⽌溶液暴沸,如果加热⼀段时间后发现忘记加碎瓷⽚,应该采取停⽌加热,待溶液冷却后重新添加碎瓷⽚,故B正确;C项,硫酸钡和AgCl均为不溶于酸的⽩⾊沉淀,则向某溶液中加⼊BaCl2溶液⽣成⽩⾊沉淀,继续加稀硝酸沉淀不消失,溶液中可能含Ag+,故C错误;D项,氯化钠的溶解度受温度影响⼩,氯化钠中混有少量的硝酸钾,氯化钠是⼤量的,制得的饱和溶液中硝酸钾量较少,不能采取降温结晶的⽅法,故D错误;故选B。
专题03 阅读理解(原卷版)三年(20192021)中考英语真题(北京专用)

A.Cold.B.Lazy.C.Noisy.D.Slow.
25.In order to get through to Shelley, the writer ________.
A.wrote her a bookB.made her a toyC.drew her a pictureD.told her a story
26.Shelley changed a lot because she realized that ________.
A.her teachers loved herB.her classmates were kind
C.the writer understood herD.she had to study even harder
Shelley looked at the coloring book and then looked up at me, and finally looked away. By that, I didn’t know how I was going to get through to the little girl, but I knew I wouldn’t give up on her.
三年(2019-2021)中考英语真题分项汇编(北京专用)
专题03阅读理解
一、2021年北 Heroes for the Planet
Nowadays, people around the world are working to help our planet. Check out how the four young adults made a difference.
(2017-2019)高考化学真题分类汇编专题03离子反应(学生版)
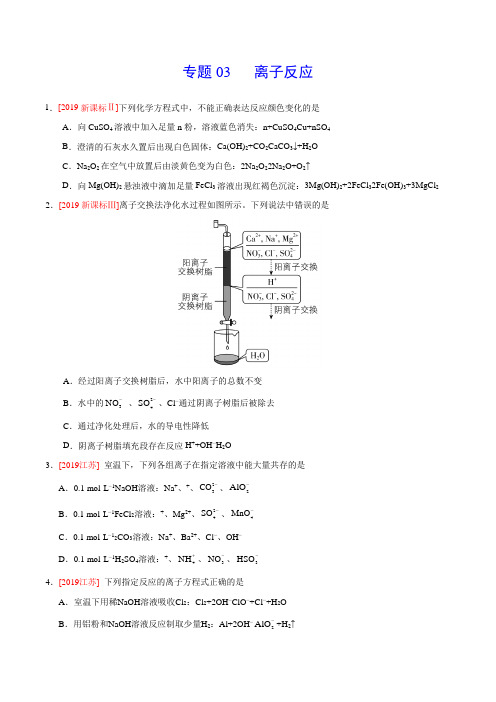
专题03 离子反应1.[2019新课标Ⅱ]下列化学方程式中,不能正确表达反应颜色变化的是A .向CuSO 4溶液中加入足量n 粉,溶液蓝色消失:n+CuSO 4Cu+nSO 4B .澄清的石灰水久置后出现白色固体:Ca(OH)2+CO 2CaCO 3↓+H 2OC .Na 2O 2在空气中放置后由淡黄色变为白色:2Na 2O 22Na 2O+O 2↑D .向Mg(OH)2悬浊液中滴加足量FeCl 3溶液出现红褐色沉淀:3Mg(OH)2+2FeCl 32Fe(OH)3+3MgCl 2 2.[2019新课标Ⅲ]离子交换法净化水过程如图所示。
下列说法中错误的是A .经过阳离子交换树脂后,水中阳离子的总数不变B .水中的3NO - 、24SO -、Cl −通过阴离子树脂后被除去 C .通过净化处理后,水的导电性降低 D .阴离子树脂填充段存在反应H ++OH −H 2O3.[2019江苏] 室温下,下列各组离子在指定溶液中能大量共存的是 A .0.1 mol·L −1NaOH 溶液:Na +、+、23CO -、2AlO -B .0.1 mol·L −1FeCl 2溶液:+、Mg 2+、24SO -、4MnO -C .0.1 mol·L −12CO 3溶液:Na +、Ba 2+、Cl −、OH −D .0.1 mol·L −1H 2SO 4溶液:+、4NH +、3NO -、3HSO -4.[2019江苏] 下列指定反应的离子方程式正确的是A .室温下用稀NaOH 溶液吸收Cl 2:Cl 2+2OH −ClO −+Cl −+H 2OB .用铝粉和NaOH 溶液反应制取少量H 2:Al+2OH −2AlO -+H 2↑C .室温下用稀HNO 3溶解铜:Cu+23NO -+2H +Cu 2++2NO 2↑+H 2O D .向Na 2SiO 3溶液中滴加稀盐酸:Na 2SiO 3+2H +H 2SiO 3↓+2Na + 5.[2019天津] 下列离子方程式能用解释相应实验现象的是实验现象离子方程式A向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解()24322Mg OH 2NH Mg 2NH H O ++++⋅B向沸水中滴加饱和氯化铁溶液得到红褐色液体 ()323Fe 3H OFe OH 3H +++↓+C二氧化硫使酸性高锰酸钾溶液褪色2224423SO 2MnO 4H 3SO 2Mn 2H O -+-+++++D 氧化亚铁溶于稀硝酸22FeO 2H Fe H O ++++6..A .二氧化硫与酸性高锰酸钾溶液反应:5SO 2+2H 2O +2MnO 4-2Mn 2++5SO +4H +B .酸性碘化钾溶液中滴加适量双氧水:2I −+2H ++H 2O 2I 2+2H 2OC .硅酸钠溶液和盐酸反应:SiO 32-+2H +H 2SiO 3↓D .硫酸铜溶液中加少量的铁粉:3Cu 2++2Fe2Fe 3++3Cu7.[2018·北京]下列化学用语对事实的表述不正确的是 A .硬脂酸与乙醇的酯化反应:C 17H 35COOH+C 2H 518OH C 17H 35COOC 2H 5+H 218OB .常温时,0.1 mol·L -1氨水的pH=11.1:NH 3·H 2O +4NH +OH −C .由Na 和C1形成离子键的过程:D .电解精炼铜的阴极反应:Cu 2+ +2e −Cu8.[2018江苏]室温下,下列各组离子在指定溶液中能大量共存的是 A .0.1 mol·L −1 I 溶液:Na +、+、ClO − 、OH −B .0.1 mol·L −1 Fe 2(SO 4)3溶液:Cu 2+、NH 4+ 、NO 3−、SO 42−C .0.1 mol·L −1 HCl 溶液:Ba 2+、+、CH 3COO −、NO 3−D .0.1 mol·L −1 NaOH 溶液:Mg 2+、Na +、SO 42−、HCO 3− 9.[2018江苏]下列指定反应的离子方程式正确的是A .饱和Na 2CO 3溶液与CaSO 4固体反应:CO 32−+CaSO 4CaCO 3+SO 42−B .酸化NaIO 3和NaI 的混合溶液:I − +IO 3−+6H +I 2+3H 2OC .ClO 碱性溶液与Fe(OH)3反应:3ClO −+2Fe(OH)32FeO 42−+3Cl −+4H ++H 2OD .电解饱和食盐水:2Cl −+2H +Cl 2↑+ H 2↑10.[2017江苏]下列指定反应的离子方程式正确的是 A .钠与水反应:Na +2H 2ONa ++2OH – + H 2↑ B .电解饱和食盐水获取烧碱和氯气:2Cl –+2H 2OH 2↑+Cl 2↑+2OH –C .向氢氧化钡溶液中加入稀硫酸:Ba 2++OH – + H + + 24SO -BaSO 4↓+H 2OD .向碳酸氢铵溶液中加入足量石灰水:Ca 2++3HCO -+OH –CaCO 3↓+H 2O 11.[2017海南]能正确表达下列反应的离子方程式为 A .用醋酸除去水垢:2H ++CaCO 3=Ca 2++CO 2↑+H 2O B .硫化亚铁与浓硫酸混合加热:2H ++FeS=H 2S↑+ Fe 2+ C .向硫酸铝溶液中滴加碳酸钠溶液:2Al 3++3CO 32−=Al 2(CO 3)3↓D .用氢氧化钠溶液吸收工业废气中的NO 2:2NO 2+2OH −=NO 3−+NO 2−+ H 2O 12.[2017江苏]常温下,下列各组离子在指定溶液中能大量共存的是 A .无色透明的溶液中:Fe 3+、Mg 2+、SCN –、Cl – B .()()–H OH c c +=1×10 −12的溶液中:+、Na +、23CO -、3NO -C .c (Fe 2+) =1 mol·L −1的溶液中:+、+4NH 、4MnO -、24SO -D .能使甲基橙变红的溶液中:Na +、+4NH 、24SO -、3HCO -13.[2017·11月浙江选考]下列离子方程式不正确的是A .氢氧化钠溶液与二氧化硅反应 SiO 2 + 2OH -=SiO 32- + H 2OB .碳酸钠溶液与氢氧化钡溶液反应 CO 32-+ Ba(OH)2=BaCO 3↓+2OH -C .酸性硫酸亚铁溶液在空气中被氧化 4Fe 2++O 2+4H +=4Fe 3++2H 2OD .氯气与氢氧化钠溶液反应 Cl 2+ 2OH -=ClO - +Cl -+H 2O 14.[2017·11月浙江选考]取某固体样品,进行如下实验①取一定量的样品,加足量水充分溶解,过滤得到滤液和滤渣; ②取少量滤液,加入BaCl 2溶液,有白色沉淀产生;③取少量滤渣,加入稀盐酸,滤渣全部溶解,同时有气体产生。
专题03 -备战高考化学-离子反应方程式

【解析】
【详解】过量铁粉与稀硝酸反应,生成硝酸亚铁、一氧化氮和水,该离子反应不符合事实,故答案为:错误。
15.氯化钙溶液中通入CO2气体:Ca2++H2O+CO2= CaCO3↓+2H+。(_______)
【答案】错误
【解析】
【详解】由于酸性:HCl>H2CO3,所以根据复分解反应的规律,溶液中CaCl2与CO2气体不能发生反应,因此溶液中不发生题干离子方程式,题目书写出该离子方程式是错误的。
5.用食醋来除水壶中的水垢(主要成分CaCO3):CaCO3+2H+=Ca2++CO2↑+H2O。(_______)
【答案】错误
【解析】
【详解】食醋的主要成分醋酸是一元弱酸,主要以电解质分子存在,应该写化学式,离子方程式应该为:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O,故题目已知的离子方程式是错误的。
【解析】
【详解】石墨作阳极则是惰性电极电解CuSO4溶液,电解材料不参与反应,阳极是H2O失去电子,阴极是Cu2+得到电子,总反应为2Cu2++2H2O 2Cu+4H+++O2↑,正确。
11.BaCl2溶液通入少】
【详解】由于酸性:HCl>H2CO3,所以向BaCl2溶液通入少量CO2,二者不能反应产生BaCO3沉淀,题目已知离子方程式是不存在的,这种说法是错误的。
16.SO2通入BaCl2溶液中:Ba2++SO2+H2O=BaSO4↓+2H+。(_______)
【答案】错误
【解析】
【详解】盐酸是强酸,亚硫酸是弱酸,弱酸不能制取强酸,SO2通入BaCl2溶液中不反应,所以Ba2++SO2+H2O=BaSO4↓+2H+错误。
专题03解题技巧专训解一元二次方程期中期末真题重组卷(50题)(原卷版)

专题03 解题技巧专训:解一元二次方程期中期末真题重组卷(50题)专项训练信息:本卷试题共 50 道大题,重组各地区期中、期末真题;本卷试题针对性较高,覆盖面广,选题有深度,涵盖了解一元二次方程的所有情况!一、解答题 1.(2023秋·新疆乌鲁木齐·九年级统考期末)解方程:(1)245x x +=;(2)()()2323x x x -=-.2.(2023春·安徽马鞍山·八年级安徽省马鞍山市第七中学校考期中)解方程:(1)2280x -=;(2)2310x x --=;3.(2023秋·辽宁大连·九年级统考期末)解方程:(1)22450x x +-=;(2)3(21)42-=-x x x .4.(2023秋·甘肃平凉·九年级校联考期末)用恰当的方法解方程.(1)2340x x -++=;(2)()32142x x x -=-.5.(2023秋·江苏镇江·九年级统考期末)解方程:(2)22350x x --=(公式法)11.(2023秋·山东临沂·九年级统考期末)解方程:(1)2120x x +-=;(2)()()215160x x ----=.12.(2023春·浙江·八年级期中)用适当的方法解下列解方程(1)26180x x --=(2)()22239x x -=-13.(2023秋·四川德阳·九年级统考期末)用适当的方法解下列方程:(1)()22240x --=.(2)()()2323x x x -=-.14.(2023秋·贵州黔东南·九年级统考期末)解方程:(1)2450x x --=(2)()()22213x x -=-15.(2023秋·辽宁朝阳·九年级统考期末)解下列方程(1)2810x x -+=(2)()3122x x x -=-16.(2023秋·河北保定·九年级统考期末)用适当的方法解下列一元二次方程:(1)2810x x -+=;(2)()3122x x x -=-17.(2023春·江苏无锡·九年级校联考期末)解方程:(1)2650x x ++=;(2)2410x x --=.18.(2023秋·河南信阳·九年级统考期末)解方程:(1)2640x x +-=(配方法)(2)()()231231x x -=-(分解因式法)19.(2023春·浙江杭州·八年级校考期中)解一元二次方程:(1)2241x x -=-;(2)()()23230x x x -+-=20.(2023秋·江苏南京·九年级南京外国语学校仙林分校校考期末)解方程:(1)2450x x --=;(2)()2422x x x -=-.21.(2023秋·河北承德·九年级统考期末)解下列方程:(1)()311x x x -=-.(2)22730x x -+=.22.(2023秋·黑龙江绥化·九年级校考期末)解方程(1)22240x x --=(2)()()2333x x x -=-23.(2023秋·重庆九龙坡·九年级统考期末)解方程:(1)267x x +=(因式分解法)(2)2232x x -=(配方法)24.(2023秋·甘肃平凉·九年级校考期中)解下列方程:(1) 2430x x -+= (配方法)(2) 2340x x --= (公式法)25.(2023秋·湖北荆门·九年级校考期末)按要求解方程.(1)()2231y y y -=- (公式法);(2)()()22132120x x ---+= (因式分解法).26.(2023秋·甘肃平凉·九年级校考期中)解下列方程:(1)()24236x -=(2)()()2311x x +=+27.(2023秋·河北保定·九年级统考期末)用适当的方法解下列方程.(1)250x x +=;(2)22150x x +-=.28.(2023秋·河北沧州·九年级校考期末)用因式分解法解下列方程.(1)()()222320x x ---=;(2)()2211t t -+=.29.(2023秋·江苏南通·九年级统考期末)用适当的方法解下列方程:(1)2244121x x x x -+=++;(2)210x x --=.30.(2023秋·云南昆明·九年级统考期末)解方程:(1)2430x x --=;(2)()()3220x x x ---=.31.(2023秋·江苏扬州·九年级校考期末)用适当的方法解一元二次方程:(1)228=0x x --;(2)()()3222x x x -=-.32.(2023秋·河南平顶山·九年级统考期末)用恰当的方法解下列方程:(2)()()3454x x x -=-38.(2023秋·重庆忠县·九年级统考期末)解方程:(1)2426x x +-=-;(2)22210x x +-=.39.(2023秋·江苏扬州·九年级统考期末)解方程:(1)2440x x --=(2)(4)3(4)x x x +=-+40.(2023秋·山西阳泉·九年级统考期末)解方程(1)2610x x --=(2)()()23230x x -+-=41.(2023秋·云南曲靖·九年级统考期末)用适当的方法解下列方程.(1)()33x x x -=-(2)2310x x +-=42.(2023秋·河南开封·九年级统考期末)解下列方程:(1)()()3121x x x -=-(2)2210x x --=43.(2023春·浙江宁波·八年级校联考期中)用适当的方法解下列方程.(1)()()232x x x -=-(2)22410x x -+=44.(2023秋·江苏扬州·九年级统考期末)解下列方程:(1)()()21321x x x +=-+(2)()2325x x +=+45.(2023秋·四川南充·九年级统考期末)解下列方程:(1)(2)(3)6x x --=;(2)2(2)2(2)3x x +-+=.46.(2023秋·山东聊城·九年级统考期末)解一元二次方程(1)24410x x -+=;(2)22410x x --=;(3)3(1)22x x x -=-47.(2023秋·江苏无锡·九年级统考期末)解方程:(1)²250x x --=; (2)()()2424x x +=+;(3)()2190x --=;(4)()56x x +=.。
2023年高考化学二轮复习教案(全国通用)专题03 离子反应含解析

专题03 离子反应考点热度★★★★★【化学素养要求】【考纲导向】1.了解离子反应的概念,了解离子反应发生的条件,并会判断离子在溶液中能否大量共存。
2.了解电解质的概念,了解强电解质与弱电解质的概念。
3.理解电解质在水中的电离以及电解质溶液的导电性。
4.能正确书写离子方程式,或结合具体反应对所给离子方程式进行正误判断。
【命题分析】离子方程式的书写及正误判断、溶液中的离子共存是每年高考的热点,高考再现率为100%。
在高考试题中,大多以选择题形式呈现,但增加了限制条件和隐含条件,基本每一个选项都会有干扰,并且加大氧化还原反应的考察。
选择题常以离子方程式正误判断的形式呈现,非选择题常与氧化还原反应理论、化学工艺流程、实验滴定(沉淀滴定、氧化还原滴定)相结合,书写相关反应的离子方程式。
氧化还原型离子方程式的书写是近几年全国卷命题的热点内容。
离子共存类选择题主要为限定条件下离子能否大量共存的判断。
离子推断类试题Ⅰ卷、Ⅱ卷均有考查,主要利用离子的特征反应,通过定性、定量分析,确定离子存在情况,进而推断物质。
核心考点一离子方程式的书写与正误判断离子方程式中物质的拆分原则(1)强酸、强碱和可溶性盐写成离子形式。
(2)弱酸、弱碱、难溶盐、单质、氧化物、气体用化学式表示。
(3)多元弱酸的酸式盐的酸根离子(如HCO-3、HSO-3等)在离子方程式中不能拆开写,多元强酸的酸式盐的酸根离子(如HSO-4)在离子方程式中拆开写。
(4)微溶物的处理情况:①当反应物是微溶物的澄清稀溶液时(如澄清石灰水),微溶物应写成离子形式。
②当反应物是微溶物的浊液或固态时(如石灰乳),微溶物应写化学式。
③生成物中的微溶物按难溶物处理,应写化学式。
(5)固体之间的反应(如消石灰与NH 4Cl),固体与特定溶液(如Cu 与浓硫酸)的反应不能用离子方程式表示。
离子方程式正误判断要注意4个两【核心考法】考法 离子方程式的书写与正误判断(题型预测:选择题)1.(2022·全国)能正确表示下列反应的离子方程式为 A .硫化钠溶液和硝酸混合:S 2-+2H +=H 2S↑B .明矾溶液与过量氨水混合:Al 3++4NH 3+2H 2O=AlO 2-+4NH 4+C .硅酸钠溶液中通入二氧化碳:SiO 23-+CO 2+H 2O=HSiO 3-+HCO 3-D .将等物质的量浓度的Ba(OH)2和NH 4HSO 4溶液以体积比1∶2混合:Ba 2++2OH -+2H ++SO 24-=BaSO 4↓+2H 2O【答案】D【解析】A .硝酸具有强氧化性,可以将S 2-氧化为S 单质,自身根据其浓度大小还原为NO 或NO 2,反应的离子方程式为4H ++2NO 3-+S 2-=S↓+2NO 2↑+2H 2O(浓)或8H ++2NO 3-+3S 2-=3S↓+2NO↑+4H 2O(稀),A 错误;B .明矾在水中可以电离出Al 3+,可以与氨水电离出的OH -发生反应生成Al(OH)3,但由于氨水的碱性较弱,生成的Al(OH)3不能继续与弱碱发生反应,故反应的离子方程式为Al 3++3NH 3·H 2O=Al(OH)3↓+3NH 4+,B 错误;C .硅酸的酸性小于碳酸,向硅酸钠溶液中通入二氧化碳时,生成硅酸沉淀,二氧化碳则根C .苯酚钠溶液中通入2CO ,出现白色浑浊:D .乙醇、乙酸和浓硫酸混合加热,产生有香味的油状液体:Δ3CH COOCH 浓硫酸.碳酸氢钠受热之后分解生成碳酸钠、水和二氧化碳,.过量的铁粉与稀硝酸反应,应该生成.苯酚钠溶液中通入二氧化碳利用强酸制取弱酸生成苯酚和碳酸氢钠,乙醇和乙酸在浓硫酸混合加热的条件下发生酯化反应产生有香味的油状液体乙酸乙酯和为2-+323SiO +2H =H SiO ↓,A 正确;B .亚硫酸的酸性强于碳酸,因此,23Na CO 溶液中通入过量2SO 发生离子反应生成亚硫酸氢钠和二氧化碳,该反应的离子方程式为2--32232CO +2SO +H O =2HSO +CO ,B 正确;C .乙醇与227K Cr O 酸性溶液反应发生反应,乙醇被氧化为乙酸,2-27Cr O 被还原为3+Cr ,该反应的离子方程式为2-+3+3227323CH CH OH+2Cr O +16H 3CH COOH+4Cr +11H O −−→,C 正确; D .类比氯气与碱反应可知,溴与冷的NaOH 溶液反应生成溴化钠、次溴酸钠和水,该反应的离子方程式为---22Br +2OH =Br +BrO +H O ,D 不正确。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题03 离子反应
1.[2020新课标Ⅱ]某白色固体混合物由NaCl 、KCl 、MgSO 4、CaCO 3中的两种组成,进行如下实验:① 混合物溶于水,得到澄清透明溶液;② 做焰色反应,通过钴玻璃可观察到紫色;③ 向溶液中加碱,产生白色沉淀。
根据实验现象可判断其组成为 A .KCl 、NaCl
B .KCl 、MgSO 4
C .KCl 、CaCO 3
D .MgSO 4、NaCl
2.[2020新课标Ⅲ]对于下列实验,能正确描述其反应的离子方程式是 A .用Na 2SO 3溶液吸收少量Cl 2:32-3SO +Cl 2+H 2O = 2-3HSO +2-Cl +2-4SO B .向CaCl 2溶液中通入CO 2:Ca 2++H 2O+CO 2=CaCO 3↓+2H +
C .向H 2O 2溶液中滴加少量FeCl 3:2Fe 3++H 2O 2=O 2↑+2H ++2Fe 2+
D .同浓度同体积NH 4HSO 4溶液与NaOH 溶液混合:+4NH +OH -=NH 3·H 2O 3.[2020浙江7月选考]能正确表示下列反应的离子方程式是( )
A .()()4422NH Fe SO 溶液与少量2Ba(OH)溶液反应:2-244SO Ba BaSO ++=↓
B .电解2MgCl 水溶液:2222Cl 2H O
2OH Cl H --++↑+↑通电
C .乙酸乙酯与NaOH 溶液共热:Δ323332CH COOCH CH OH CH COO CH CH OH --−−→++
D .4CuSO 溶液中滴加稀氨水:22Cu 2OH Cu(OH)+-+=↓
4.[2020天津卷]下列离子方程式书写正确的是
A .CaCO 3与稀硝酸反应:2-+322CO +2H =H O+CO ↑
B .FeSO 4溶液与溴水反应:2+3+-22Fe +Br =2Fe +2Br
C .NaOH 溶液与过量H 2C 2O 4溶液反应:-2-224242H C O +2OH =C O +2H O
D .C 6H 5ONa 溶液中通入少量CO 2: -2-65226532C H O +CO +H O=2C H OH+CO
5.[2020江苏卷]常温下,下列各组离子在指定溶液中能大量共存的是 A .10.1mol L -⋅氨水溶液:Na +、K +、OH -、NO -
3
B .10.1mol L -⋅盐酸溶液:Na +、K +、SO 2-4、SiO 2-3
C .10.1mol L -⋅KMnO 4溶液:NH +4、Na +、NO -3、I -
D .10.1mol L -⋅AgNO 3溶液:NH +4、Mg 2+、Cl -、SO 2-4 6.[2020江苏卷]下列指定反应的离子方程式正确的是 A .Cl 2通入水中制氯水:22Cl H O
2H Cl ClO +--+++ B .NO 2通入水中制硝酸:2232NO H O 2H NO NO +-+=++ C .10.1mol L -⋅NaAlO 2溶液中通入过量CO 2:
22233AlO CO 2H O Al(OH)HCO -
-++=↓+
D .10.1mol L -⋅AgNO 3溶液中加入过量浓氨水:324Ag NH H O AgOH NH ++++=↓+。
