有机化学课件第三章烯烃和二烯烃
第三章-烯烃、炔烃、二烯烃

以反式加成产物为主
Br
Br
CH2 CH2 + Br2 NaCl水溶液 CH2 CH2 + CH2 CH2
Br
Cl
亲电试剂:试剂带有正电荷,或者电子云密度较低,在
反应中进攻反应物上带部分负电荷的位置,这种试剂叫
做亲电试剂,例如X+(卤素)、R+、H +等。详见课本 P54-56。
亲电加成反应:由亲电试剂进攻而引起的加成反应。
1埃 = 0.1纳米(nm) = 10-10米(m)
1
键的特点: 1.成键原子不能绕两核连线自由旋转。
2.键比键易断裂。
3.电子云易极化。
PS:极化(polarization),指事物在一定条件下发生两极 分化,使其性质相对于原来状态有所偏离的现象
烯烃的同分异构
构造异构:碳链异构;官能团位置异构 构型异构:顺反异构 (几何异构or立体异构)
链终止 CH3CH· CH2Br +Br· CH3CHBrCH2Br
注:过氧化物只对HBr有影响,不影响HCl和HI。
诱导效应:受分子中电负性不同的原子或基团的影响,整个分 子中成键的电子云向着一个方向偏移,分子发生极化的效应。
δ+ δ- δ+ δH3C CH CH2 + HBr
CH3CHCH2 Br
电负性差别:O:3.5 Cl:3.1 O> Cl
由于次氯酸不稳定,反应中常用氯气和水代替次氯酸
Cl2 + H2O HOCl + HCl
H2C CH2 + Cl2 + H2O
CH2 CH2 OH Cl
(2) 臭氧化反应
O
CH3CH CH2 O3 CH3HC O
有机化学 第三章 烯烃、炔烃和二烯烃

第三章烯烃、炔烃和二烯烃第一节烯烃和炔烃单烯烃是指分子中含有一个C=C的不饱和开链烃,简称烯烃.通式为C n H2n。
炔烃是含有(triple bond) 的不饱和开链烃。
炔烃比碳原子数目相同的单烯烃少两个氢原子,通式CnH2n-2。
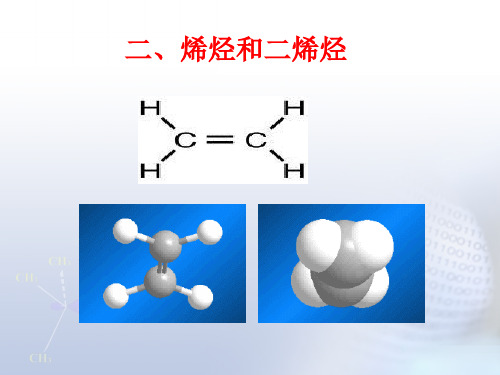
一、烯烃和炔烃的结构乙烯是最简单的烯烃, 乙炔是最简单的炔烃,现已乙烯和乙炔为例来讨论烯烃和炔烃的结构。
(一)乙烯的结构分子式为C2H4,构造式H2C=CH2,含有一个双键C=C,是由一个σ 键和一个π 键构成。
现代物理方法证明,乙烯分子的所有原子都在同一平面上,每个碳原子只和三个原子相连.杂化轨道理论根据这些事实,设想碳原子成键时,由一个s轨道和两个p轨道进行杂化,组成三个等同的sp2杂化轨道,sp2轨道对称轴在同一平面上, 彼此成1200角.此外,还剩下一个2p轨道,它的对称轴垂直于sp2轨道所在的平面。
乙烯:C-C σ键4C-H σ键在乙烯分子中,两个碳原子各以一个sp2轨道重叠形成一个C-Cσ键,又各以两个sp2轨道和四个氢原子的1s轨道重叠,形成四个C-Hσ键,五个σ键都在同一平面上。
每个碳原子剩下的一个py轨道,它们平行地侧面重叠,便组成新的分子轨道,称为π轨道。
其它烯烃的双键也都是由一个σ键和一个π键组成的。
双键一般用两条短线来表示,如:C=C,但两条短线含义不同,一条代表σ键,另一条代表π 键。
π键重叠程度比σ键小,不如σ键稳定,比较容易破裂。
(二)乙炔的结构乙炔的分子式是C2H2,构造式H-C≡C-C,碳原子为sp 杂化。
两个sp杂化轨道向碳原子核的两边伸展,它们的对称轴在一条直线上,互成180°。
在乙炔分子中,两个碳原子各以一个sp轨道互相重叠,形成一个C-Cσ键,每个碳原子又各以一个sp轨道分别与一个氢原子的1s轨道重叠形成C-Hσ键。
此外,每个碳原子还有两个互相垂直的未杂化的p轨道(px,py),它们与另一碳的两个p轨道两两相互侧面重叠形成两个互相垂直的π键。
3烯烃、炔烃、二烯烃

沸点:
3.7°C
0.88°C -105.6°C
熔点: -138.9°C
三、烯烃、炔烃的化学性质
双键的结构与性质分析
C C C C
键能: 键 ~347 kJ / mol 键 ~263 kJ / mol 键活性比 键大 不饱和,可加成至饱和
电子受原子核吸引较弱, 是电子供体,易受 亲电试剂进攻参与反应。 与亲电试剂结合 与氧化剂反应
乙烯分子中的σ键
乙烯分子中的π键
H H
·
·
H
C = C
C
C H
{
sp2-sp2 σ键 2p-2p π键
π键
σ键和π键比较
存在的情况 键的形成情 况 电子云的分 布情况
键
键
1、可以单独存在。 2、存在于任何共价键中。
1、必须与键共存。 2、仅存在于不饱和键中。
成键轨道沿轴向在直线上相 成键轨道对称轴平行,从侧 互重叠。 面重叠。 1、 电子云集中于两原子 核的连线上,呈圆柱形分布 2、 键有一个对称轴,轴 上电子云密度最大。 1、键能较大。 2、键的旋转:以 键连接 的两原子可相对的自由旋转 3、键的可极化度:较小。 1、 电子云分布在 键所 在平面的上下两方,呈块状
第三章
烯烃、炔烃、二烯烃
本章重点
不饱和烃的类型、结构和命名
烯烃构型的表示方式(顺式和反式,E型和Z型)
不饱和烃的亲电加成反应 Markovnilkov加成规则及理论解释 诱导效应及共轭效应 共轭二烯烃的1,4加成
第三章
烯烃、炔烃、二烯烃
本章难点 不饱和烃的亲电加成反应
Markovnilkov加成规则及理论解释
(3)命名:根据主链上的碳数和双、叁键的位次 编号m、n,称为m-某烯-n-炔
《有机化学》第三章 不饱和烃

吸电子基团: +NR3>NO2>CN>COOH>F>Cl>Br>I>COOR>OR>
COR>SH>OH> C CR>C6H5>CH=CH2>H
诱导效应的特点:
(1)诱导效应的强弱取决于原了或基团的电负性的大小
的两原子可相对的自由旋转。 能相对自由旋转。Βιβλιοθήκη c.键的可极化度:较小。 较大
1.2 单烯烃的异构现象
1.2.1 结构异构
CH3 CH2 CH CH2 CH3 CH CH CH3
1-丁 烯
2-丁 烯
官能团碳碳双键 位置异构
CH3 C CH2 2-甲 基 丁 烯 CH3
碳链异构
结构异构是由于分子中各原子的结合顺序不同而引起的, 位置异构和碳链异构均属于结构异构。
(2) 与卤化氢的加成
CH3CH CHCH3 + HCl CH3CH2CHCH3
2–丁烯
HBr CH3CH2CH CH2
Markovnikov规则
Cl
2–氯丁烷
Br
CH3CHCH CH3
80 %
CH3CHCH2 CH2Br 20 %
当不对称的烯烃与卤化氢等极性试剂加成时,氢原总
是加到含氢较多的双键碳原子上,卤原子(或其子或
上相互重叠。
从侧面重叠。
电子云的分布情况 a. 电子云集中于两原子 电子云分布在 键所
核的连线上,呈圆柱形分布。 在平面的上下两方,呈块
状分布。
第三章 烯烃和二烯烃

(四) 烯烃的化学性质
(1) 加氢
在催化剂作用下,烯烃或炔烃与氢加成生成烷烃:
CH2=CH 2 + H 2
催化剂
(甲) 催化加氢
CH3-CH 3
Cat.:Pt、Pd、Rh、Ni等。 Raney Ni,又叫活性Ni、骨架Ni。特点是具有很大的表面 积,反应按下列机理进行:
H2
吸附 解吸
H
H
C2H4
(RCH2CH2)2BH
二烷基硼
(RCH2CH2)3B
三烷基硼
H2O2,OH-
RCH2CH2OH + B(OH)3
一级醇
H2O2的NaOH水溶液
19
烯烃硼氢化反应得醇,炔烃的硼氢化得醛. 其特点:反马、顺加、不重排!
例:
CH3(CH 2)7CH=CH 2
① B2H6 ,醚 ② H2O2/OH
-
CH3(CH 2)7CH2CH2OH
1 2 O2
。 250 C
Ag
CH2-CH 2 O
23
(5) 聚合反应
高压聚乙烯的制备属于自由基聚合反应:
n CH 2=CH 2
自由基引发剂
>100 C,>1000MPa
。
[ CH2 CH 2 ]n
高压聚乙烯
乙烯、丙烯等可在齐格勒-纳塔(1963年Nobel化学奖得主) 催化剂存在和低压条件下,经离子型定向聚合得到聚烯烃:
(Ⅰ)
Br -
CH3-CH-CH 3(主要产物) Br CH3CH2CH2Br(次要产物)
1°C+
CH3CH2CH2+
(Ⅱ)
Br -
14
结论:C的稳定性决定了烯烃加成主要产物的结构。 C的稳定性:
烯烃和二烯烃
CnH2n-2(n≧4)
烯烃的结构、同分异构体和命名
(一)、乙烯的结构
1.平面构型
118° 121°
说明:乙烯分子中的两个碳原子和四个氢原子都在同一
个平面上。它们彼此间的夹角约为120°,双键的键长比 单键的短,键能比单键的两倍小。所以化学性质活泼。
同系物:结构相似:都含有一个碳碳双键的链烃;
组成上相差一个或若干个“CH2”原子团。 如:丙烯,1-丁烯,1-己烯等等
C
3
C H 2
CH3
1
CH2 CH3
③
②
4-甲基-3-乙基-2-戊烯
【例题1】用系统命名法命名下列化合物
CH2 CH H3C H2C CH CH2 CH2 CH3 CH3CH2CH
C
CHCH3
CH3 CH3
3-乙基-1-己烯 3,4-二甲基-2-己烯
CH3 H3C H C CH3 C H C H C CH2 CH3
写出丙烯的分子式、电子式和结构简式
它们的化学性质与乙烯的相似;物理性质一般地 也随着碳原子数目的增加而递变,与烷烃类似。
(二)、烯烃的同分异构现象
1、碳链异构
2、双键位置异构
如:写出C4H8 属于烯烃的同分异构体
H2C CHCH2CH3
H2C C CH3 CH3
H3CHC CHCH3
烯烃同分异构体的推导方法:
加成反应、加聚反应、氧化反应
加成反应 1 ) 1,4-加成反应
H2C
①
H2C Br
②
C H
③
C H
④
CH2 Br
①
C H ②
C H ③
CH2
+ Br2
有机化学二烯烃课件

利用Wittig反应,以甲基三苯基溴化膦和丁酮为原料,合成1,3-丁二烯。
2,5-二甲基-2,5-己二烯的合成
通过McMurry反应,以2,5-二甲基-3,6-二氧代庚烷为原料,合成2,5-二甲基-2,5-己二烯。
04
反应机理与动力学研究
反应类型及机理概述
亲电加成反应
01
二烯烃在亲电试剂作用下发生的加成反应,遵循马氏规
THANK YOU
感谢聆听
100%
学术研究价值
二烯烃作为一类具有独特结构和性 质的有机化合物,对于研究有机反 应机理、分子结构等具有重要的学 术价值。
80%
推动有机化学发展
对二烯烃的深入研究有助于推动有 机化学理论的发展和完善,为其他 有机化合物的研究提供借鉴和参考。
课程内容与结构安排
01
02
03
04
课程目标
课程内容
课程结构
则。
自由基加成反应
02
二烯烃在自由基引发剂作用下发生的加成反应,自由基
进攻双键形成新的自由基中间体。
狄尔斯-阿尔德反应
03
共轭二烯烃与烯烃或炔烃在加热或光照条件下发生的
[4+2]环加成反应。
动力学参数测定方法
速率常数测定
通过测定反应速率与浓度的关系, 求得速率常数k。
活化能测定
利用阿累尼乌斯方程,通过测定不 同温度下的速率常数,求得活化能 Ea。
共轭效应
共轭体系中的π电子离域作用使得二烯烃分子具有特殊的稳定性, 称为共轭效应。
稳定性比较
一般来说,共轭效应越强,二烯烃分子的稳定性越高。例如,1,3丁二烯比1,2-丁二烯更稳定,因为前者的共轭效应更强。
有机化学课件 - 第二、三章烷烯炔二烯
Cl. + H:CH3 ─ → HCl + CH3. CH3. + Cl:Cl ─ → CH3Cl + Cl. ③链终止 Cl. + Cl. ─ → Cl2 Cl. + CH3.
②链增长
─ → CH3Cl
CH3. + CH3. ─ → CH3CH3
CH3
CH3 H H CH3 H H
H H H
CH3 H
丁烷分子的位能曲线图
五、烷烃的命名(nomenclature)
(一)普通命名法 1、直链烷烃 1~10个碳原子的直链烷烃
CH4 甲烷(methane) C3H8 丙烷(propane)
C5H12 戊烷(pentane ) C7H16 庚烷(heptane) C9H20 壬烷(nonane)
CH2=CHCH2CH2CH3 CH3CH=CHCH2CH3
H C CH3 C CH2CH3 H
1-戊烯 2-戊烯
H C C H CH2CH3
CH3
顺-2-戊烯 Z-2-戊烯
反-2-戊烯 E-2-戊烯
CH3 CH2 = CCH2CH3
CH3 CH2 = CHCHCH3
mp.270℃
延胡索酸
H C C H
COOH
CH3 COCl 140℃
O H C C H C C O
O
O + H2O
COOH
H C C HOOC
COOH
异构化 270℃
- H2O
H H
C C
C O C O
H
H3 C Cl
H3 C
Cl
有机化学第三章烯烃和二烯烃资料

【次序规则】 ①Br > Cl > S > P > O > N > C > H ②(CH3)3C->(CH3)2CH->CH3CH2->CH3-
【原则】 两个次序高的基团在双键同侧——Z 式 两个次序高的基团在双键异侧——E 式
下一页
第三章 烯烃和 二烯烃
例如:
第一节 烯烃的结构、异构 和命名
H
C H3C 2
第二节 烯烃的性质
二、烯烃的化学性质
C=C双键是烯烃的官能团
与官能团直接相连的碳原子叫做α-碳原子 α-碳原子上的氢原子叫做α-氢原子
烯烃的化学反应主要发生在官能团C=C双键以及受
C=C双键影响较大的α-C-H键上。
例如:
H H H α-碳原子
↙
CCCH
↑
官能团
H ← α-氢原子
下一页
第三章 烯烃和 二烯烃
下一页
同学们再见!
同学们好! 欢迎学习《有机化学》课
程
下一页
有 机 化 学 第三章 烯烃和二烯
【复习旧课】
烃
1.烯烃双键的组成
2.π键的特点
随分子中碳原子数目↑而↑ 1.烯基: 烯烃分子中去掉一个氢原子后剩下的基团
【导入新课】 选主链:含双键、最长、取代基最多
熟悉烯烃的分类和异构现象,掌握其命名法; 【产生原因】双键不能自由旋转 (两个双键连在同一个碳原子上)
H CH2CH3
下一页
第三章 烯烃和 二烯烃
• 【本课小结】
第一节 烯烃的结构、异构 和命名
1.烯烃的结构
乙烯的结构:平面型分子,键角120°
C原子杂化方式:SP2杂化
双键的组成:一个σ键和一个π键
构造异构 2.烯烃的同分异构
第三章烯烃和二烯烃

第三章烯烃和二烯烃第一节烯烃一、烯烃的同分异构现象烯烃的通式: CnH2n。
烯烃的官能团:C=C1.构造异构2.顺反异构(a)反-2-丁烯(b) 顺-2-丁烯二、烯烃的结构1.碳的sp2杂化及乙烯的结构碳原子的sp2杂化过程如下:每一个sp2杂化轨道含有1/3s成分和2/3p成分,其形状也是一头大,一头小的葫芦形。
三个sp2杂化轨道以平面三角形对称地排布在碳原子周围,它们的对称轴之间的夹角为120°,未参与杂化的2p轨道垂直于三个sp2杂化轨道组成的平面。
如图3-1所示。
(a)三个sp2杂化轨道(b) 三个sp2杂化轨道与一个p轨道图3-2碳原子的sp2杂化轨道乙烯分子形成时,两个碳原子各以一个sp2杂化轨道沿键轴方向重叠形成一个C—Cσ键,并以剩余的两个sp2杂化轨道分别与两个氢原子的1s轨道沿键轴方向重叠形成四个等同的C—Hσ键,五个σ键都在同一平面内,因此乙烯为平面构型。
此外,每个碳原子上还有一个未参与杂化的p轨道,两个碳原子的p轨道相互平行,于是侧面重叠成键。
这种成键原子的p轨道侧面重叠形成的共价键叫做π键。
乙烯分子中的σ键和π键如图3-2所示。
图3-2 乙烯分子的结构2.σ键和π键的比较σ键和π键的特点比较如下:其他烯烃的结构与乙烯相似,双键碳原子也是sp2杂化,与双键碳原子相连的各个原子在同一平面上,碳碳双键都是由一个σ键和一个π键组成的。
三、烯烃的命名1.构造异构体的命名烯烃分子去掉一个氢原子剩下的部分,叫做烯基;常见的烯基有:CH2=CH—CH3—CH=CH—CH2=CH—CH2—乙烯基丙烯基烯丙基(二)烯烃的命名(1)习惯命名法烯烃和二烯烃的个别化合物常采用习惯命名法命名。
例如:正丁烯异丁烯异戊二烯(2)系统命名法命名方法与烷烃基本相似,原则如下:①选择含有官能团的最长碳链作为母体,母体命名原则同直链烯化合物。
若有多条最长链可供选择时,选择原则与烷烃相同。
②靠近官能团一端编号,即使官能团的位次符合“最低系列”。
烯烃、二烯烃的性质与结构-高中化学同步课件(苏教版2019选择性必修3)

烯烃能使酸性高锰酸钾和溴水褪色
烯烃的不对称加成反应
【提问】试写出CH2=CH-CH3与HBr的反应。
CH2=CH-CH3 + HBr
CH2-CH-CH3
|
|
Br
H
CH2-CH-CH3
|
|
主要产物
H
Br
当不对称烯烃与含氢化合物(HBr、H2O等)加成时,H原子主要
加到连有较多H原子的C原子上(马氏规则)
CH3
[ CH2
CH3
C]
n
CH3
二、加聚反应的类型
②共轭烯烃型加聚反应 双键要打开,单键变双键
n CH2=CH—CH=CH2 催化剂
[ CH2—CH=CH—CH2 ]n
【练一练】试右侧物质的加聚反应?
不变 ,氢原子质量分数 不变 。
数
环烷烃:CnH2n (n≥3)
单烯烃与同碳原子数的环烷烃是同分异构体
3.烯烃的结构:
含有碳碳双键,乙烯所有原子 能 共平面,键角约为 120° 。
3和sp2
sp
烯烃中含有键和 键,碳原子的杂化方式为
。碳原子
数不同的单烯烃之间关系是 同系物
。
二、烯烃的立体异构
1.顺反异构产生的原因:由于与双键相连接的两个碳原子不能旋转,导致原子
现象:若发生取代反应则生成HBr,则有淡黄色沉淀或加石蕊会变红;
若发生加成反应,则无此现象。
四、烯烃的化学性质
3.氧化反应:
①在氧气中燃烧
现象:在空气中燃烧,火焰明亮且伴有黑烟
反应方程式:
四、烯烃的化学性质
3.氧化反应:
②与酸性高锰酸钾溶液反应
现象:酸性高锰酸钾溶液褪色
第三章 烯烃炔烃二烯烃

Br
Br
+
CH2=CH2
CH2
+
CH2
CH2
+
CH2 Br
+
Br
-
Br Br
• 第二步:
Br CH2
+
CH2 Br
+
Br
-
CH2 Br
CH2
• 与HX、H2SO4、H2O等的反应则有碳正 离子中间体产生。例如:
• 第一步:
CH2 CH2
+
H Cl
+
-
+
CH2
CH3
+
Cl
-
• 第二步:
+
CH2
CH3
“顺序规则”(sequence rule)
• 比较原子序数,首先是比较与双键碳直接相连原
• • •
•
子的原子序数。 1. 原子序数大的称为较优基团,对于同位素,质 量较重的优先于较轻的。例如: -I>-Br>-Cl>-SH>-OH>-NH2>-CH3>-D>H 2. 若取代基中与双键碳直接相连的原子相同时, 则采用“外推法”。 3.若有双键或三键与其它原子相连,则看成与两 个或三个该原子连接。
(一) 加成反应
• 加成反应(addition reaction):是指 反应物分子中π键断裂,试剂中原子或 原子团直接加到相邻的两个碳原子上, 形成新化合物的反应。
A C C
+
A
B
C
C B
1.催化加氢
•
催化加氢是指烯烃和炔烃等在催化剂(如 Pt、Ni)存在下,与氢气加成形成饱和化合 物的反应。
HCl
+
第三章 烯烃 二烯烃

CH2=CH-CH2烯丙基 HC C-CH2炔丙基
CH3-C=CH2 异丙烯基 -CH=CH1,2-亚乙烯基
(2) 衍生物命名法 衍生物命名法只适用于简单的烯烃和炔烃。 烯烃以乙烯为母体,将其它的烯看作乙烯的衍生物。例:
CH3-CH=CH2 甲基乙烯 CH3C CCH3 二甲基乙炔
(CH3)2CH=CH2 不对称二甲基乙烯 CH3CH2C CCH3 甲基乙基乙炔
∴
-C(CH3)3>-CH(CH3)2>-CH2CH3>-CH3 -CH2Cl>-CH2OH>-CH2NH2
③当取代基不饱和时,把双键碳或三键碳看成以单键和多个原 子相连。
(C) (C) -C CH 可看作 -C C-H (C) (C) (C) (C) -CH=CH2 可看作 -C H C-H H
C
C
次序规则
①比较与双键碳原子直接相连的原子,原子序数大者较优先,
I>Br>Cl>S>O>N>C>D>H>:
②直接相连的原子相同时,则比较其次相连的原子。 (CH3)3CC(C,C,C) 最优先 (CH3)2CHC(C,C,H) 次优先 CH3CH2C(C,H,H) 再次优先 CH3C(H,H,H) 最不优先
CF3CH 2 CH CH 2 + HBr CF3CH 2CH 2CH 2Br
(6) 过氧化物效应
一般情况下: CH3-CH=CH2
+ HBr
CH3-CH-CH3 Br (主)
CH3CH2CH2Br (反马)
但有过氧化物存在时:
CH3-CH=CH2 + HBr
hor 过氧化物
只能是HBr (HCl、HI都不反马)
有机化学第三章烯烃

沸点: 3.7℃ 熔点: -138.9℃
0.88℃ -105.6℃
顺、反异构体之间差别最大的物理性质是偶极矩,反 式异构体的偶极矩较顺式小,或等于零,由于反式异 构体中两个基团和双键碳相结合的键,方向相反可以 抵消,而顺式中则不能。
在顺、反异构体中,顺式异构体因为极性较大,沸点通 常较反式高。它们的对称性较低,较难填入晶格,故熔 点较低。
I > Br > Cl > S > P > F > O > N > C > D > H
Cl C
H
CH3 C
Br
对于左式,因为Cl>H, Br>C, 两个“较优”基 团(Cl和Br)位于双键 的异侧,所以为E式。
次序规则
(2)如果与双键碳原子直接相连的原子的 原子序数相同,则用外推法看与该原子 相连的其它原子的原子序数,比较时, 按原子序数由大到小排列,先比较最大 的,如相同,再顺序比较居中的、最小 的。如仍相同,再依次外推,直至比较 出较优基团为止。
上简称烯烃,其为通式:CnH2n ,双键是烯烃的官能团。
CH2 CH2 乙烯
CH3 CH CH2 丙烯
CH3 CH2 CH CH2 CH3 C CH2 CH3 CH CH CH3
CH3
1-丁烯
异丁烯
2-丁烯
末端烯烃或α—烯烃
命名
烯基:从烯烃分子中去掉一个氢原子之后所剩下的基团。如:CH2 CH
丙烯:CH3 CH CH
第四节 烯烃的制法
烯烃中最重要的是乙烯,其次是丙烯,它们都是有机化学工业基础原料。
一、从裂解气、炼厂气中分离—工业上制备烯烃的方法
石油裂解气:乙烯、丙烯、丁烯、1,3-丁二烯等烯烃和二烯烃炼厂气:乙 烯、丙烯、丁烯 从裂解气、炼厂气中分离乙烯、丙烯等是工业上大规模生产乙烯、丙烯的 方法。
有机化学03(2)二烯烃
共轭二烯烃的稳定性也可以从它的氢化热中看出来。
1. 二烯的结构 (1)丙二烯的结构
H
1 1 8 .4 sp sp
2
C
C
CH2
H
0 .1 0 8 n m 0 .1 3 1 n m
C H H
两个键是相互垂直的
丙二烯分子是线 型非平面分子
H C C H
(2) 1,3-丁二烯的结构
C H HC H C H
双烯体
亲双烯体
改变二烯和亲二烯体的结构,可以得到多种类型的化合 物,并且许多反应在室温或在溶剂中加热即可进行,产率也 比较高,是合成含六元环化合物的重要方法。
象环加成这样只通过过渡态而不生成活性中间体 的反应称为协同反应。
3. 聚合反应与合成橡胶
1,3-丁二烯或2-甲基-1,3-丁二烯在Ziegler-Natta催 化剂作用下, 主要按1,4-加成方式进行顺式加成聚合, 这种聚合方式通称定向聚合。
第三节 二 烯 烃
• 一. 二烯烃的分类 • 二. 二烯烃的结构和命名 • 三. 二烯烃的化学性质
一. 二烯烃的分类
二烯烃是指含有两个碳碳双键的烃类化合物。二烯烃的 通式都是CnH2n-2,都含有两个不饱和度。根据分子中两个双 键的相对位置,又可以分成下面三种:
(1)累积二烯烃 是指分子中两个双键合用一个碳原 子,即含有>C=C=C<结构的二烯烃。例如:
H CH3 C H C H C C CH3 H
1
6Leabharlann 7顺,顺-2,4-己二烯 或(Z,Z)-2,4-己二烯
三. 二烯烃的化学性质
共轭二烯烃同烯烃一样,容易与卤素,卤化氢等起加 成反应,它的特点是比烯烃更容易起加成反应,并且能起1, 4-加成反应。
二烯烃-有机化学

炔烃二烯烃分子中含有碳碳双键的烃称为烯烃。
碳碳双键是烯烃的官能团。
烯烃的通式为。
乙烯是最简单的烯烃。
乙烯、丙烯、丁烯等组成了烯烃的同系列。
烯烃以游离状态存在于自然界的不多,主要以其衍生物的形态存在于自然界中。
杂化轨道理论认为:在烯烃分子中,组SP2杂化轨道城建。
轨道进行杂化,形杂化轨道,并对称地分布在碳原子周围,其对称轴在同一平1200。
所以,SP2杂化又称为平面三角杂化。
杂化碳原子各以一个SP2杂化的轨道沿着对称轴的方向相互重叠形π键,π键的电子键所在平面的上下方。
烯烃的异构体比烷烃的复杂。
除有碳链异构体外,还有因双键位置不同而产生的官能团位置异构。
例如丁烯就有以下同分C H CH3CH2C CH3CH32-甲基丁烯丁烯是官能团双键的位置不同而产生的异构,成为官能团位置异构,简称位置异构。
此外,烯烃还由于碳碳双键两侧连有不同原子或原子团而产生顺反异构。
顺反异构又称为几何异构,是立体异构的一种。
一般是由于分子中具有双键或环状结构使键的自由旋转受阻,与双键或环相连的不同原子或原子团可能存在不同的空间排布,由此而产生的立体异构现象称为顺丁烯的顺反异构。
烯反-2-丁烯IUPAC系统命名法。
它的命名原则和烷烃相似:、选择的主链必须包括碳碳双键,按主链碳原子数称为某烯。
如果主链碳原子数超过十,则称为某碳烯。
、从靠近双键的一端对主链碳原子编号,并以双键碳原子中编号较小的数字表示双键的位次,写在烯烃名称的前面。
例C H CH CCH 3CH 2CH 3CH 3CH 3CH 33,5,6,6-四甲基-3-庚烯当烯烃分子中去掉一个氢原子后剩下的C H 2C CH 3C CH 2H 烯丙基异丙烯基烯基的碳原子编号应从自由价的碳原子开始:2顺反异构体命名时,常把两个双键碳原子上所连接的两个相同或近似的基团在双键同一侧称为顺式,在双键异侧称为反式。
HC CCH3-2-丁烯以上方法虽然简明,但如果双键碳原子上连接有四个不相同的原子或原子团,就命名法。
第三章烯烃和二烯烃

46
上页 下页 首页 退出
2.氧化反应
烯烃的氧化反应较复杂,随烯烃的结构、 反应条件、氧化剂和催化剂的不同而得到 不同的产物。
⑴高锰酸钾氧化 ⑵催化氧化
47
上页 下页 首页 退出
⑴高锰酸钾氧化
A 烯烃在稀、冷高锰酸钾中性或碱性溶中氧化 被氧化成邻二醇。
3RCH CHR' + 2KMnO4 + 4H2O
CH2=CH-CH=CH2
5
上页 下页 首页 退出
2.烯烃的同分异构
烯烃由于含有官能团>C=C<,因此异 构现象比烷烃复杂。
三种异构:碳链异构 官能团位置异构 顺反异构
6
上页 下页 首页 退出
⑴碳链异构
双键的位置不变, 碳链发生了改变。
CH3 CH3-CH2-CH=CHCH2 3-C=CH2
(2)官能团位置异构 CH3-CH2-CH=CH2
44
上页 下页 首页 退出
⑹加次卤酸
CH2=CH2 + HO-Cl (Cl2+H2O)
+ - - +
CH3-CH=CH2 + HO-Cl
HO-CH2-CH2-Cl
OH-
[CH3-C+H-CCHl2]
CH3-CH-CH2 OH Cl
91%
45
上页 下页 首页 退出
马氏规则可理解为: 正性基团加到含氢较多的碳原子上,
32
上页 下页 首页 退出
四 烯烃的物理性质
(1)含2-4个碳原子的烯烃为气体,5-18个碳原子的烯烃为液 体,19个碳原子以上是固体
(2)直链烯的沸点要高于带支链的异构体,但差别不大。 (3)顺式异构体的沸点一般比反式的要高,而熔点较低. (4)烯烃的相对密度都小于1。 (5)烯烃几乎不溶于水,但可溶于非极性溶剂(戊烷、四氯化碳、
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H3PO4 / 硅藻土 O 300 C , 4MPa
烯烃与水直接反应生成醇,称为烯烃直接水合法, 是醇的制备方法之一。
6. 加次氯酸
烯烃能与次氯酸反应生成氯代醇。不对称烯烃与次卤 酸加成,符合马氏规则。例如:
B CH2 CH2 + HOCl CH2 Cl
6CC CH3CH
CH2 B OH
CH OH CH2 C Cl
③ 写名称 将取代基的位次、数目、名称及双键的位次写 在烯烃名称前。
例1: 7
6
5
4
3
2
1
CH3
CH2
CH
CH2
CH
C CH2 CH3
CH3 CH3 CH2 3,5-二甲基-2-乙基-1-庚烯
(选择含有双键的最长碳链为母体)
例2:
1
2
3
4
5
6
7
8
CH3CH2CHCH CHCHCH2CH3 CH3 C 2H 5
(1)键长平均化
(2)共平面性 (3)体系能量降低
2. 共轭体系和共轭效应 (1) π-π共轭
凡双键和单键交替排列的结构是由π键和π
键形成的共轭体系,叫做π-π共轭体系。
1,3-丁二烯以及其他的共轭二烯烃都属于
π -π 共轭体系。
⑵ p-π共轭体系
具有p轨道且与双键碳原子直接相连的原子,其p 轨道与双键π轨道平行并侧面重叠形成共轭,叫做p-π共 轭体系。如:
CH3 C=C H
CH3 H
CH3 C=C H
H CH3
顺-2-丁烯
反-2-丁烯
(2) Z–E命名法
① 根据“次序规则”确定集团的优先次序(见书P25)。 ② 两个“优先”基团在同侧,为Z构型,反之为E构型。
例:
优 CH3 优 CH Br 优 3
C C C C H H CH3 CH3
Br 优
优 CH3 优 CH CH3 3
烯烃和炔烃可以被高锰酸钾氧化,反应后高锰酸钾 溶液的紫色褪去,是鉴别碳碳双键的常用方法之一。 (1) 用稀、冷高锰酸钾(中性、碱性溶液)氧化
3RCH CHR'
+
2KMnO4
+
4H2O
3RCH CHR' OH OH
+
2MnO2
+ 2KOH
(2) 用浓高锰酸钾(或酸性)氧化
R R C C H R KMnO4 H+ R R C OH RCOOH
Ⅰ
CH3 CH CH3 CH3 CH2 CH2
+
+
X
-
CH3 CH CH2
+
H+
Ⅱ
CH3 CH CH3 X CH3 CH2 CH2 X
X
-
马氏规则解释
第一步加成的途径取决于生成碳正离子稳定性。碳
正离子的稳定性越大,也就越容易生成。
不同碳正离子的稳定性:
CH2=CHCH2 > CH3
+
C CH3 > CH3 CH3
三、共轭二烯烃的结构
(一)共轭二烯烃
1. 1,3-丁二烯的结构。
H C H
0.135nm
H C
0.148nm 122.4°
H C
C
H
119.8°
H
2.共轭体系和共轭效应
含有共轭π键的分子称为共轭分子,具有共轭π键的 体系称为共轭体系。在共轭体系中,形成共轭π键的所有 原子是一个整体,它们之间的相互影响称为共轭效应。 共轭体系具有以下特点:
2-氯乙醇
CH2 + HOCl
CH3
1-氯-2-丙醇
(二)
氧化反应
1. 催化氧化
在有机化学中,通常把加氧或脱氢的反应统称为
氧化反应。
CH
2
CH
2 +
O
2
Ag 250℃
CH
2
CH
环氧乙烷
O
2
CH
3
CH CH
2
+
O
PdCl2-CuCl2 2 90~ 120 1MPa CH3 ℃,
O C CH
丙酮
3
2.高锰酸钾氧化
引发剂 温度、压力
nCH2=CH2
CH2
CH2 n
第二节 二烯烃
一、二烯烃的分类
分子中含有两个碳碳双键的脂肪烃叫做二烯烃。
通式为CnH2n-2。
累积二烯烃
二烯烃
CH2
C
CH2 (丙二烯)
共轭二烯烃 CH2 CH CH CH2
(1,3-丁二烯)
隔离二烯烃 CH2 CH CH2 CH CH2 (1,4-戊二烯)
性质
三、烯烃的命名
1. 烯基
烯烃去掉一个H后剩余的基团,称为烯基。 CH2=CH- -CH2CH=CH2 CH3CH=CH- CH3C=CH2 乙烯基 烯丙基 (或 2–丙烯基) 丙烯基 (或 1–丙烯基) 异丙烯基
2. 系统命名法
① 选主链 选择含碳-碳双键且含支链较多的最长碳链作 主链。
② 编号 从靠近双键一端开始。
分子中含有一个(或两个)碳碳双键的不饱和烃 叫做烯(或二烯)烃。
烯烃比相应烷烃少两个氢原子,通式为CnH2n。
烯烃的同分异构现象
1. 碳链异构
2. 官能团位置异构
① CH2 CHCH2CH3 ② CH2 C CH3 CH3
其中: ①或③和②互为碳链异构体. ①和③互为位置异构体。
③ CH3CH CHCH3
3. 顺反异构
A B A C C
顺式
A B
B C C
反式
B
A
二、烯烃的结构
1. 碳原子sp2杂化
碳原子的2s轨道和两个2p轨道重新组合,形成了三个 完全相同的sp2杂化轨道,还剩余一个未参与杂化的2p轨道。
2s
2p
跃迁 2s 2p
sp2杂化 sp 杂化轨道
2
2p(未杂化)
基态
激发态
杂化态
sp2轨道模型
Br2
CCl4 1,4- 加 成
3, 4-二 溴 -1-丁 烯
CH2 Br
CH CH CH2 Br
1, 4-二 溴 -2-丁 烯
2. 双烯合成
共轭二烯烃与含C=C或C≡C的不饱和化合物发生1,
4-加成,生成环状化合物的反应叫做双烯合成反应,也
叫做Diels-Alder反应。
1 2 3 4 1 2
+
2. 乙烯的分子结构
乙烯为平面构型。 碳原子上未参与杂化的p轨道,相互平行,侧面重叠(也
称为“肩并肩”重叠)成键。这种成键原子的p轨道平行侧
面重叠形成的共价键叫做π键。
118°
H H
C
C
H H
3.σ键和π键的比较
σ键 存在 形成 分布 可以单独存在 成键轨道沿键轴重叠, 重叠程度大 电子云对称分布在键轴 周围呈圆柱形 ①键能较大,比较稳定 ②成键的两个原子可沿 键轴自由旋转 ③电子云受核的束缚大 ,不易极化 π键 不能单独存在,只能与σ键 共存 成键轨道平行侧面重叠, 重叠程度小 电子云对称分布于σ键所在 平面的上下 ①键能较小,不稳定 ②成键的两个原子不能沿 键轴自由旋转 ③电子云受核的束缚小, 容易极化
第三章 烯烃和二烯烃
学习目的与要求
1. 理解sp2 杂化的特点及π键的形成和特
征;
2. 掌握烯烃和二烯烃的命名方法;
3. 掌握烯烃和二烯烃的化学性质及在生
产中的应用;
4. 掌握烯烃的鉴别方法;
5. 理解亲电加成反应的本质。
第一节 第二节
烯烃 二烯烃
第一节
烯烃
一、烯烃的通式和同分异构
(一) 烯烃的通式
90MPa 165℃, 17h
+
3 4
(三)聚合反应
在催化剂存在下,共轭二烯烃可以聚合为高分子化合物。
CH2 n CH3 C C H CH3 CH2
聚合
CH2 C=C
CH2 H n
顺-1,4-聚异戊二烯
2. 氧化反应
烯烃的α-氢原子被氧化,丙烯在一定条件下,可被氧
化为丙烯醛。若条件不同,丙烯还可被氧化为丙烯酸。
在氨的存在下,生成丙稀腈。
磷鉬酸铋 470 C
O
CH3 CH=CH2 + O2 + NH3
CH2 =CH CN 丙烯腈
(四) 聚合反应
含有双键或叁键的化合物在合适的条件下,发生加
成或缩合等反应,使多个分子结合成一个相对分子质量 较大的化合物的反应称为聚合反应。
CH2
CH2Br
无过氧化物
CH CH3 Br
HCl,HI加成没有影响
4.加硫酸(例3-2)
烯烃可与浓硫酸反应,生成烷基硫酸。硫酸氢酯 溶于硫酸,可用于分离烷烃中少量烯烃。 也可用于制备醇,但除乙烯外,无法得到伯醇。
R CH CH2
H OSO3H
R CH CH3
H2O/
+
R CH CH2 H OSO3H
H2O /
OSO3H (主) R CH CH2
+
R CH CH2 H OHOH H(主)5.加水
在酸的催化下,烯烃和水加成生成醇。不对称烯 烃与水加成符合马氏规则。
CH2 CH2 + H2O
H3PO4 / 硅藻土 O 300 C , 7MPa
CH3 CH2 OH
CH3CHCH3 OH
CH3CH CH2 + H2O
C C C C H H Br 优 Br 优
CH3
(Z)-2-溴-2-丁烯(反-2-溴-2-丁烯) (E)-2-溴-2-丁烯(顺-2-溴-2-丁烯)
