第3章全面腐蚀与局部腐蚀s
合集下载
全面腐蚀与局部腐蚀

D点蚀程度
点蚀程度可用点蚀系数或点蚀因子来表示:
点蚀系数=最大腐蚀深度/平均腐蚀深度
点蚀因子= P/d
图3-3 最深点蚀、平均侵蚀深度及点蚀 因子的关系。
3.2.3 影响点蚀的因素及预防措施
3.2.3.1 材料因素
1)合金元素的影响 不锈钢中Cr是最有效提高耐 点蚀性能的合金元素。
随着含Cr量的增加,点蚀电位向正方向移动。 如与Mo、Ni、N等合金元素配合,效果最好。
孔内 阳极反应:Fe→Fe+2 + 2e
(3-5)
孔外 阴极反应:1/2 2H2O + 2e → 2OH- (3-6) 孔口 pH值增高,产生二次反应:
Fe+2 + 2OH- → Fe(OH)2
Fe(OH)2 + 2H2O + O2 → Fe(OH)3 ↓
(3-7) (3-8)
Fe(OH)3沉积在孔口形成多孔的蘑菇状壳层。 使孔内外物质交换因难,孔内介质相对孔外介质 呈滞流状态。
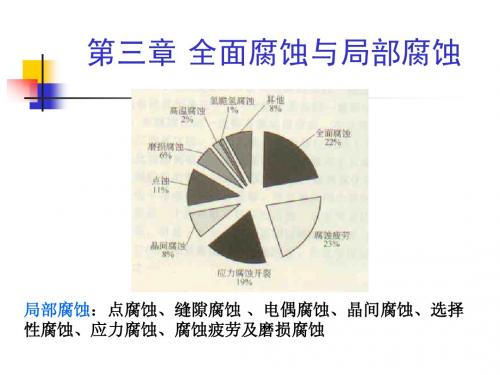
局部腐蚀类型,主要有点蚀(孔蚀)、缝隙腐蚀、 晶间腐蚀、选择腐蚀,应力腐蚀、腐蚀疲劳、湍 流腐蚀等。
3.1.1 全面腐蚀的特征
全面腐蚀是常见的一种腐蚀。全面腐蚀是指整个 金属表面均发生腐蚀,它可以是均匀的也可以是 不均匀的。
钢铁构件在大气、海水及稀的还原性介质中的腐 蚀一般属于全面腐蚀。
全面腐蚀一般属于微观电池腐蚀。通常所说的铁 生锈或钢失泽.镍的“发雾”现象以及金属的高 温氧化均属于全面腐蚀。
B点蚀发生的条件
1) 表面易生成钝化膜金属材料,如不锈钢、 铝、铅合金:或表面镀有阴极性镀层的金 属,如碳钢表面镀锡、铜、镍等。
2) 在有特殊离子的介质中易发生点蚀,如 不锈钢在有卤素离子溶液中易发生点蚀。
3全面腐蚀与局部腐蚀

十微米。其形貌各异.有蝶形浅孔,有窄深形、 有舌形等等。
B点蚀发生的条件
1) 表面易生成钝化膜金属材料,如不锈钢、 铝、铅合金:或表面镀有阴极性镀层的金 属,如碳钢表面镀锡、铜、镍等。
2) 在有特殊离子的介质中易发生点蚀,如 不锈钢在有卤素离子溶液中易发生点蚀。
3) 电位大于点蚀电位(Ebr)易发生点蚀。
3.2 点腐蚀
点腐蚀(孔蚀)是一种腐蚀集中在金属表面数十微 米范围内且向纵深发展的腐蚀形式,简点蚀。
点蚀是一种典型局部腐蚀形式,具有较大的隐患 性及破坏性。在石油、化工、海洋业中可以造成 管壁穿孔,使大量的油、气等介质泄漏,有时甚 至会造成火灾,爆炸等严重事故。
3.2.1 点蚀的形貌与特征 A点蚀的形貌 点蚀表面直径等于或小于它的深度。一般只有几
D点蚀程度
点蚀程度可用点蚀系数或点蚀因子来表示:
点蚀系数=最大腐蚀深度/平均腐蚀深度
点蚀因子= P/d
图3-3 最深点蚀、平均侵蚀深度及点蚀 因子的关系。
3.2.3 影响点蚀的因素及预防措施
3.2.3.1 材料因素
1)合金元素的影响 不锈钢中Cr是最有效提高耐 点蚀性能的合金元素。
随着含Cr量的增加,点蚀电位向正方向移动。 如与Mo、Ni、N等合金元素配合,效果最好。
(3-4)
Cl- 浓度在一定临界值以下不发生点蚀。
C点蚀坑的生长
点蚀生长机制较公认的是蚀孔内的自催化酸化机制,即 闭塞电池作用。
不锈钢在充气的含Cl-离子的中性介质中腐蚀过程。
如图3-2所示,蚀孔一旦形成,孔内金属处于活化状态 (电位较负),蚀孔外的金属表面仍处于钝态(电位较 正),于是蚀孔内外构成了膜-孔电池。孔内金属发生阳 极溶解形成Fe+2 (Cr3+、Ni2+等):
B点蚀发生的条件
1) 表面易生成钝化膜金属材料,如不锈钢、 铝、铅合金:或表面镀有阴极性镀层的金 属,如碳钢表面镀锡、铜、镍等。
2) 在有特殊离子的介质中易发生点蚀,如 不锈钢在有卤素离子溶液中易发生点蚀。
3) 电位大于点蚀电位(Ebr)易发生点蚀。
3.2 点腐蚀
点腐蚀(孔蚀)是一种腐蚀集中在金属表面数十微 米范围内且向纵深发展的腐蚀形式,简点蚀。
点蚀是一种典型局部腐蚀形式,具有较大的隐患 性及破坏性。在石油、化工、海洋业中可以造成 管壁穿孔,使大量的油、气等介质泄漏,有时甚 至会造成火灾,爆炸等严重事故。
3.2.1 点蚀的形貌与特征 A点蚀的形貌 点蚀表面直径等于或小于它的深度。一般只有几
D点蚀程度
点蚀程度可用点蚀系数或点蚀因子来表示:
点蚀系数=最大腐蚀深度/平均腐蚀深度
点蚀因子= P/d
图3-3 最深点蚀、平均侵蚀深度及点蚀 因子的关系。
3.2.3 影响点蚀的因素及预防措施
3.2.3.1 材料因素
1)合金元素的影响 不锈钢中Cr是最有效提高耐 点蚀性能的合金元素。
随着含Cr量的增加,点蚀电位向正方向移动。 如与Mo、Ni、N等合金元素配合,效果最好。
(3-4)
Cl- 浓度在一定临界值以下不发生点蚀。
C点蚀坑的生长
点蚀生长机制较公认的是蚀孔内的自催化酸化机制,即 闭塞电池作用。
不锈钢在充气的含Cl-离子的中性介质中腐蚀过程。
如图3-2所示,蚀孔一旦形成,孔内金属处于活化状态 (电位较负),蚀孔外的金属表面仍处于钝态(电位较 正),于是蚀孔内外构成了膜-孔电池。孔内金属发生阳 极溶解形成Fe+2 (Cr3+、Ni2+等):
第三章 全面腐蚀与局部腐蚀

合理选择耐蚀材料:使用含有抗小孔腐蚀最为有效 的元素如Cr、Mo、Ni等的不锈钢,在含氯离子介质中 可得到较好的抗孔蚀性能,这些元素含量愈高,抗蚀 性能愈好。应根据对耐蚀性的要求,介质的侵蚀性以 及经济性能等各方面的要求选用适当的材料。
3.3、缝隙腐蚀
1、定义 金属部件在介质中,由于金属与金属或金属与
间或有FeCl .4H O结晶
2
2
Cl- Cl-
Fecl2 Hcl HS
2
Fe2+
e 2H++2eH
2
e
Fe2++H2OFeOH++H+
FeFe2++2e
蚀孔形成后,为什么具有“深挖”动力? 孔蚀的过程是怎么样进行的? 蚀坑的深挖是从形成闭塞电池开始, “自催化酸化作用”是导致腐蚀加速的根 本原因
均匀腐蚀实例:
(一端腐蚀较重 腐蚀产物较疏松)
剖管的管内壁形貌
点蚀实例:
铝合金点蚀形貌
二、小孔腐蚀特征:
1、蚀孔小而深,具有深挖特征 2、一般蚀孔口有腐蚀产物覆盖 3、存在诱导期 4、孔蚀位置不可预测 5、在易钝化的金属上易发生
金属小孔腐蚀的特征(一)
小孔腐蚀的产生与临界电位有关,只有 金属表面局部地区的电极电位达到并高于临界 电位值时,才能形成小孔腐蚀,该电位称作 “小孔腐蚀电位”或“击穿电位”,一般用E b表示。这时阳极溶解电流显著增大,即钝化 膜被破坏,发生小孔腐蚀。
四、影响小孔腐蚀的因素:电位与pH值
Pourbaix实测了铁在10-2mol/L氯化物系统的 E—pH图,并叙述了临界电位即钝态区和孔蚀区 的界限。
实验现象:随着电极电位升高,小孔腐蚀敏 感性加剧;而随着pH值的增高,小孔腐蚀倾向反 而减小。
实验结论:小孔腐蚀与电极电位和pH值有着 密切的关系。
3.3、缝隙腐蚀
1、定义 金属部件在介质中,由于金属与金属或金属与
间或有FeCl .4H O结晶
2
2
Cl- Cl-
Fecl2 Hcl HS
2
Fe2+
e 2H++2eH
2
e
Fe2++H2OFeOH++H+
FeFe2++2e
蚀孔形成后,为什么具有“深挖”动力? 孔蚀的过程是怎么样进行的? 蚀坑的深挖是从形成闭塞电池开始, “自催化酸化作用”是导致腐蚀加速的根 本原因
均匀腐蚀实例:
(一端腐蚀较重 腐蚀产物较疏松)
剖管的管内壁形貌
点蚀实例:
铝合金点蚀形貌
二、小孔腐蚀特征:
1、蚀孔小而深,具有深挖特征 2、一般蚀孔口有腐蚀产物覆盖 3、存在诱导期 4、孔蚀位置不可预测 5、在易钝化的金属上易发生
金属小孔腐蚀的特征(一)
小孔腐蚀的产生与临界电位有关,只有 金属表面局部地区的电极电位达到并高于临界 电位值时,才能形成小孔腐蚀,该电位称作 “小孔腐蚀电位”或“击穿电位”,一般用E b表示。这时阳极溶解电流显著增大,即钝化 膜被破坏,发生小孔腐蚀。
四、影响小孔腐蚀的因素:电位与pH值
Pourbaix实测了铁在10-2mol/L氯化物系统的 E—pH图,并叙述了临界电位即钝态区和孔蚀区 的界限。
实验现象:随着电极电位升高,小孔腐蚀敏 感性加剧;而随着pH值的增高,小孔腐蚀倾向反 而减小。
实验结论:小孔腐蚀与电极电位和pH值有着 密切的关系。
第三章 全面腐蚀与局部腐蚀

(2)溶解—沉积 这种理论认为铜和锌以金属离子形式一起进入溶液,铜离子 再发生还原以纯铜的形式沉积出来(称为回镀)。
防止脱锌的措施
• 改善环境 ——脱氧或阴极保护 • 选用对脱锌不敏感的黄铜 ——红黄铜(含Zn小于15%) • 在a黄铜中加入抑制脱锌元素 ——砷、锑、磷
3.6.3 石墨化腐蚀
3.7 剥蚀
发生局部腐蚀的条件
(1)金属方面或溶液方面存在较大的电化学不均一性, 因而形成了可以明确区分的阳极区和阴极区。
(2)阳极区和阴极区的电化学条件差异在腐蚀过程中一 直保持下去,不会减弱,甚至还会不断强化,使某些 局部区域的阳极溶解速度一直保持高于其余表面。这 是局部腐蚀能够持续进行(发展)的条件。
全面腐蚀与局部腐蚀的比较
3.3.3 缝隙腐蚀特征
3.3.4 缝隙腐蚀机理
3.3.5 影响因素
3.3.6 缝隙腐蚀防护措施
孔蚀和缝隙腐蚀的比较
3.4 电偶腐蚀
3.4.1 电偶腐蚀的定义及特点
两种腐蚀电位不同的金属在介质中相互接触 而产生的一种腐蚀形态,又称接触腐蚀或双金 属腐蚀。
发生电偶腐蚀的几种情况: (1) 异金属部件 (包括导电的非金属材料,如石墨) 组合。 (2) 金属镀层。 (3) 金属表面的导电性非金属膜。 (4) 气流或液流带来的异金属沉积。
——剥蚀的控制方法
(1)改用没有层蚀的合金 (2)使用热处理方法,减小晶间腐蚀
(3)采用表面保护措施
(4)采用牺牲阳极的阴极保护方法
阴 极 性
阳 极 性
阴极反应受氧扩散控制时,有
可得到
6.5 晶间腐蚀
3.6
选择性腐蚀
3.6.1 定义和特点
3.6.2 黄铜脱锌
第三章-2全面腐蚀与局部腐蚀(共28张PPT)

量较大。若缓蚀剂用量不当,很可能会加速腐蚀。
共二十八页
晶间腐蚀的特征(tèzhēng)
❖ 晶间腐蚀是金属在适宜的腐蚀环境中沿着或紧挨着材料的晶粒 间界发生和发展的局部腐蚀破坏形态。晶间腐蚀从金属材料表面 开始,沿着晶界向内部(nèibù)发展,使晶粒间的结合力大大丧失, 使材料的结合力大大丧失。例如经受这种腐蚀的不锈钢材料, 表面光滑,但轻轻敲击即可碎成细粉。
腐蚀,其阳极活性电流急剧增加, 即高电位下相有遭受严重选择性腐蚀
的可能,这正是(zhènɡ shì)强氧
化性介质-质量分数为0.65的HNO3 能够检验出相引起晶间腐蚀的电化 学原理。
共二十八页
晶界吸附(xīfù)理论
❖在强氧化性热浓的“硝酸(xiāo suān)十重铬酸盐”介质 中,经1050℃固溶处理的超低碳18-8型奥氏体不 锈钢等也能产生晶间腐蚀,这显然既不能用晶界 沉积M23C6引起的贫铬解释,也不能用相析出现 象来说明。经过研究,将这类晶间腐蚀归于晶界 吸附溶质P等产生电化学侵蚀而造成晶界吸附性溶 解所致。
Ti,Nb的奥氏体不锈钢,应在850-900℃下进行稳定化处理,避 免快速析出(CrFe)23C6a的600-750℃的敏化温度。采用固溶处理, 以不使碳化物析出的极快速率冷却,抑制碳化物在晶界析出。
❖ (4)恰当地控制晶粒度,使晶粒合理地细化。
共二十八页
2.其他合金的晶间腐蚀控制
降低C含量,添加稳定化元素(如Ti)和晶粒细化,可以控制铁基
共二十八页
缝隙腐蚀(fǔshí)的控制因素
❖ (1)合理设计。在设计和制造工艺上应尽可能避免造成缝隙结构。 ❖ (2)合理选择耐蚀性材料。选择合适的耐缝隙腐蚀材料是控制续隙腐
蚀的有效方法之一。例如,含Cr,Mo,Ni,N量较高的不锈钢和 镍基合金,铁及铁合金,某些铝台金等具有较好的抗缝隙腐蚀 性能。选材时既要考虑耐蚀性能,同时还要注意经济因素。例 如,Ti-Pd合金具有优异的抗热浓氯化物介质缝隙腐蚀性能。 ❖ (3)采取电化学保护措施。例如,对不锈钢等钝化(dùn huà)性金 属材料,将其电位降低到保护电位以下,而高于F1ade电位 区间.这样既保证不产生点蚀,也不致引起缝隙腐蚀。 ❖ 此外,采用缓蚀剂控制缝隙腐蚀时要谨慎,通常需要采用高 浓度的缓蚀剂才能有效,因为缓蚀刑进入缝隙时常受阻,其消耗
共二十八页
晶间腐蚀的特征(tèzhēng)
❖ 晶间腐蚀是金属在适宜的腐蚀环境中沿着或紧挨着材料的晶粒 间界发生和发展的局部腐蚀破坏形态。晶间腐蚀从金属材料表面 开始,沿着晶界向内部(nèibù)发展,使晶粒间的结合力大大丧失, 使材料的结合力大大丧失。例如经受这种腐蚀的不锈钢材料, 表面光滑,但轻轻敲击即可碎成细粉。
腐蚀,其阳极活性电流急剧增加, 即高电位下相有遭受严重选择性腐蚀
的可能,这正是(zhènɡ shì)强氧
化性介质-质量分数为0.65的HNO3 能够检验出相引起晶间腐蚀的电化 学原理。
共二十八页
晶界吸附(xīfù)理论
❖在强氧化性热浓的“硝酸(xiāo suān)十重铬酸盐”介质 中,经1050℃固溶处理的超低碳18-8型奥氏体不 锈钢等也能产生晶间腐蚀,这显然既不能用晶界 沉积M23C6引起的贫铬解释,也不能用相析出现 象来说明。经过研究,将这类晶间腐蚀归于晶界 吸附溶质P等产生电化学侵蚀而造成晶界吸附性溶 解所致。
Ti,Nb的奥氏体不锈钢,应在850-900℃下进行稳定化处理,避 免快速析出(CrFe)23C6a的600-750℃的敏化温度。采用固溶处理, 以不使碳化物析出的极快速率冷却,抑制碳化物在晶界析出。
❖ (4)恰当地控制晶粒度,使晶粒合理地细化。
共二十八页
2.其他合金的晶间腐蚀控制
降低C含量,添加稳定化元素(如Ti)和晶粒细化,可以控制铁基
共二十八页
缝隙腐蚀(fǔshí)的控制因素
❖ (1)合理设计。在设计和制造工艺上应尽可能避免造成缝隙结构。 ❖ (2)合理选择耐蚀性材料。选择合适的耐缝隙腐蚀材料是控制续隙腐
蚀的有效方法之一。例如,含Cr,Mo,Ni,N量较高的不锈钢和 镍基合金,铁及铁合金,某些铝台金等具有较好的抗缝隙腐蚀 性能。选材时既要考虑耐蚀性能,同时还要注意经济因素。例 如,Ti-Pd合金具有优异的抗热浓氯化物介质缝隙腐蚀性能。 ❖ (3)采取电化学保护措施。例如,对不锈钢等钝化(dùn huà)性金 属材料,将其电位降低到保护电位以下,而高于F1ade电位 区间.这样既保证不产生点蚀,也不致引起缝隙腐蚀。 ❖ 此外,采用缓蚀剂控制缝隙腐蚀时要谨慎,通常需要采用高 浓度的缓蚀剂才能有效,因为缓蚀刑进入缝隙时常受阻,其消耗
3--全面腐蚀与局部腐蚀

蚀孔出现的特定点称为点蚀源。
形成点蚀源所需要的时间为诱导时间,称孕育期。 孕育期长短取决于介质中Cl-的浓度、pH值及金 属的纯度.一般时间较长。Engell等人认 为.孕育期的倒数与Cl-浓度呈线性关系:
1/τ = K[Cl-]
(3-4)
Cl- 浓度在一定临界值以下不发生点蚀。
C点蚀坑的生长
的点蚀孔继续长大: 2)Ebr>E>Ep,不会形成新的点蚀扎,但原有的
点蚀孔将继续扩展长大; 3) E≤Ep,原有点蚀孔全部钝化,不会形成新的
点蚀孔。 Ebr值越正耐点蚀性能越好。 Ep与Ebr值越接近,钝化膜修复能力愈强。
B 点蚀源形成的孕育期
点蚀包括点蚀核的形成到金属表面出现宏观可见 的蚀孔。
D点蚀程度
点蚀程度可用点蚀系数或点蚀因子来表示:
点蚀系数=最大腐蚀深度/平均腐蚀深度
点蚀因子= P/d
图3-3 最深点蚀、平均侵蚀深度及点蚀 因子的关系。
3.2.3 影响点蚀的因素及预防措施
3.2.3.1 材料因素
1)合金元素的影响 不锈钢中Cr是最有效提高耐 点蚀性能的合金元素。
随着含Cr量的增加,点蚀电位向正方向移动。 如与Mo、Ni、N等合金元素配合,效果最好。
在敏化温度温度范围内继续延长时间,即长 时间回火处理,将发生碳化物的聚集,晶间 腐蚀将逐渐消除,如图3-8(e)。
3.4.2.2 贫化理论
认为晶间腐蚀是由于晶界析出新相,造成晶界附 近某一成分的贫乏化。
如奥氏体不锈钢回火过程中(400-800℃)过饱 和碳部分或全部以Cr23C6形式在晶界析出。
3.1.2 全面腐蚀速度及耐蚀标准
人们关心的是腐蚀速度。知道准确的腐蚀速度, 才能选择合理的防蚀措施及为结构设计提供依据。 全腐速度也称均匀腐蚀速度,常用表示方法有重 量法和深度法。
全面腐蚀和局部腐蚀

3.3.2 缝隙旳形成
1.不同构造件之间旳连接,
• 金属和金属之间旳铆接、搭焊、螺纹连接,
•多种法兰盘之间旳衬垫等金属和非金属之间旳接触。
2.在金属表面旳沉积物、附着物、涂膜等。
•如灰尘、沙粒、沉积旳腐蚀产物。
3.3.3 缝隙腐蚀旳特征
1.可发生在全部旳金属和合金上,尤其轻易发生在
靠钝化耐蚀旳金属材料表面。
一、环境原因
1.介质类型:
一般材料易发生点蚀旳介质是特定旳
不锈钢轻易在具有卤素离子Cl-、Br-、I-旳溶液中发生点蚀
铜对SO42-则比较敏感。
FCl3 、CuCl2
高价金属离子参加阴极反应,增进点蚀形成和发展
在一定旳条件下溶液中有些阴离子具有缓蚀效果,
对不锈钢阴离子缓蚀效果旳顺序是:
OH->NO3->AC->SO42->ClO4-;
第三章全方面腐蚀与局部腐蚀
1 全方面腐蚀
2 点腐蚀
3 缝隙腐蚀
4 电偶腐蚀
5 晶间腐蚀
6 选择性腐蚀
7 应力腐蚀
8 腐蚀疲劳
金属旳腐蚀形态:全方面腐蚀 局部腐蚀
全方面腐蚀:
各部位腐蚀速率接近,金属旳表面比较均匀地减薄,金属表面
无明显旳腐蚀形态差别。同步允许具有一定程度旳不均匀性。
局部腐蚀:
阳极过程:M
Mn++ne
阴极过程:O2+H2O+ne
4OH-氧扩散困难-缺氧
阴极反应为吸氧反应,蚀孔内缺氧, 蚀孔外富氧,形成供氧浓差
电池
(2)孔内金属离子浓度不断增长.
第三章全面腐蚀和局部腐蚀

整个金属表面遭受腐蚀。
局部腐蚀
局部腐蚀种类:
点腐蚀、缝隙腐蚀、电偶腐蚀、晶间腐蚀、
选择性腐蚀、应力腐蚀、腐蚀疲劳及磨损腐蚀。
全面腐蚀与局部腐蚀的比较
全面腐蚀危害:
造成金属的大量损失,可以检测和预测腐蚀速
率,一般不会造成突然事故。根据测定和预测的
腐蚀速率,在工程设计时可预先考虑应有的腐蚀
裕量。
局部腐蚀的危害:
•缝隙
•必须宽到溶液能够流入缝隙内,
•必须窄到能维持液体在缝内停滞。
•一般发生缝隙腐蚀最敏感的缝宽约为0.025-
0.15mm。
机理
在初期阶段
缝内外的金属表面发生相同的阴、阳极反应过程。
阳极反应:M → M n + + ne
阴极反应:1 /2O 2 + H 2 O + 2e → 2OH −
后期阶段
定义: 在金属与金属及金属和非金属之间构成狭窄的缝隙内,
有电解质溶液存在,介质的迁移受到阻滞时而产生的一种局
部腐蚀形态。
特点:
•在工程结构中,一般需要将不同的结构件相互连接,缝
隙是不可避免的。
•缝隙腐蚀将减小部件的有效几何尺寸,降低吻合程度。
•缝内腐蚀产物的体积增大,形成局部应力,并使装配困
难,因此应尽量避免。
氧的竞争吸附的结果。
• 例如:在去气溶液中金属表面吸附是由水形成的稳
定氧化物离子。一旦氯的络合离子取代稳定氧化物
离子,该处吸附膜被破坏,而发生点蚀。
(3)点蚀敏感位置
➢金属材料表面组织和结构的不均匀性使表面钝化膜的
某些部位较为薄弱,从而成为点蚀容易形核的部位:
晶界、夹杂、位错和异相组织
点蚀敏感位置——晶界:
局部腐蚀
局部腐蚀种类:
点腐蚀、缝隙腐蚀、电偶腐蚀、晶间腐蚀、
选择性腐蚀、应力腐蚀、腐蚀疲劳及磨损腐蚀。
全面腐蚀与局部腐蚀的比较
全面腐蚀危害:
造成金属的大量损失,可以检测和预测腐蚀速
率,一般不会造成突然事故。根据测定和预测的
腐蚀速率,在工程设计时可预先考虑应有的腐蚀
裕量。
局部腐蚀的危害:
•缝隙
•必须宽到溶液能够流入缝隙内,
•必须窄到能维持液体在缝内停滞。
•一般发生缝隙腐蚀最敏感的缝宽约为0.025-
0.15mm。
机理
在初期阶段
缝内外的金属表面发生相同的阴、阳极反应过程。
阳极反应:M → M n + + ne
阴极反应:1 /2O 2 + H 2 O + 2e → 2OH −
后期阶段
定义: 在金属与金属及金属和非金属之间构成狭窄的缝隙内,
有电解质溶液存在,介质的迁移受到阻滞时而产生的一种局
部腐蚀形态。
特点:
•在工程结构中,一般需要将不同的结构件相互连接,缝
隙是不可避免的。
•缝隙腐蚀将减小部件的有效几何尺寸,降低吻合程度。
•缝内腐蚀产物的体积增大,形成局部应力,并使装配困
难,因此应尽量避免。
氧的竞争吸附的结果。
• 例如:在去气溶液中金属表面吸附是由水形成的稳
定氧化物离子。一旦氯的络合离子取代稳定氧化物
离子,该处吸附膜被破坏,而发生点蚀。
(3)点蚀敏感位置
➢金属材料表面组织和结构的不均匀性使表面钝化膜的
某些部位较为薄弱,从而成为点蚀容易形核的部位:
晶界、夹杂、位错和异相组织
点蚀敏感位置——晶界:
全面腐蚀与局部腐蚀

Table2:1976年日本Mitsubishi化工机械公司化工装置损坏调查
全面腐蚀与局部腐蚀的比较
比较项目
全 面 腐 蚀
局 部 腐 蚀
腐蚀形貌
腐蚀分布在整个金属表面
腐蚀破坏主要集中在一定区域
腐蚀电池
阴阳极在表面上变化,阴阳极无法辨别
阴阳极在微观上可以分析
电极面积
阴极 = 阳极
阳极 << 阴极
电 位
1
2
金属小孔腐蚀的特征(二)
小孔腐蚀发生于有特殊离子的介质中,例如在有氧化剂(空气中的氧)和同时有活性阴离子存在的溶液中。活性阴离子,例如卤素离子会破坏金属的钝性而引起小孔腐蚀,卤素离子对不锈钢引起小孔腐蚀敏感性的作用顺序为Cl->Br->I-.另外也有ClO4-和SCN等介质中产生小孔腐蚀的报道。这些特殊阴离子在合金表面的不均匀腐蚀,导致膜的不均匀破坏。所以溶液中存在活性阴离子,是发生小孔腐蚀的必要条件。
在流动介质中金属不容易发生孔蚀,而在停滞液体中容易发生,这是因为介质流动有利于消除溶液的不均匀性,所以输送海水的不锈钢泵在停运期间应将泵内海水排尽。
壹
改善介质环境:减轻介质环境的侵蚀性,包括减少或消除Cl-等卤素离子,特别是防止引起局部浓缩;避免氧化性阳离子;加入某些缓蚀性阴离子;提高pH值;降低环境温度;使溶液流动或加搅拌等都可减少孔蚀的发生。
在钝态金属表面上小孔的成核;
小孔腐蚀的过程包括:
小孔腐蚀的机理
孔蚀的引发
孔蚀的形成可分为引发和成长(发展)两个阶段。 在钝态金属表面上,蚀孔优先在一些敏感位置上形成,这些敏感位置(即腐蚀活性点)包括: 晶界(特别是有碳化物析出的晶界),晶格缺陷 。 非金属夹杂,特别是硫化物,如FeS、MnS是最为敏感的活性点。 钝化膜的薄弱点(如位错露头、划伤等)。
全面腐蚀与局部腐蚀的比较
比较项目
全 面 腐 蚀
局 部 腐 蚀
腐蚀形貌
腐蚀分布在整个金属表面
腐蚀破坏主要集中在一定区域
腐蚀电池
阴阳极在表面上变化,阴阳极无法辨别
阴阳极在微观上可以分析
电极面积
阴极 = 阳极
阳极 << 阴极
电 位
1
2
金属小孔腐蚀的特征(二)
小孔腐蚀发生于有特殊离子的介质中,例如在有氧化剂(空气中的氧)和同时有活性阴离子存在的溶液中。活性阴离子,例如卤素离子会破坏金属的钝性而引起小孔腐蚀,卤素离子对不锈钢引起小孔腐蚀敏感性的作用顺序为Cl->Br->I-.另外也有ClO4-和SCN等介质中产生小孔腐蚀的报道。这些特殊阴离子在合金表面的不均匀腐蚀,导致膜的不均匀破坏。所以溶液中存在活性阴离子,是发生小孔腐蚀的必要条件。
在流动介质中金属不容易发生孔蚀,而在停滞液体中容易发生,这是因为介质流动有利于消除溶液的不均匀性,所以输送海水的不锈钢泵在停运期间应将泵内海水排尽。
壹
改善介质环境:减轻介质环境的侵蚀性,包括减少或消除Cl-等卤素离子,特别是防止引起局部浓缩;避免氧化性阳离子;加入某些缓蚀性阴离子;提高pH值;降低环境温度;使溶液流动或加搅拌等都可减少孔蚀的发生。
在钝态金属表面上小孔的成核;
小孔腐蚀的过程包括:
小孔腐蚀的机理
孔蚀的引发
孔蚀的形成可分为引发和成长(发展)两个阶段。 在钝态金属表面上,蚀孔优先在一些敏感位置上形成,这些敏感位置(即腐蚀活性点)包括: 晶界(特别是有碳化物析出的晶界),晶格缺陷 。 非金属夹杂,特别是硫化物,如FeS、MnS是最为敏感的活性点。 钝化膜的薄弱点(如位错露头、划伤等)。
第三章全面腐蚀和局部腐蚀

3.表面处理
• 对材料表面进行钝化处理,提高其钝态稳定性。
4.阴极保护:
•使电位低于Eb,最好低于Ep,使不锈钢处于稳定钝化 区。
•这称为钝化型阴极保护
•应用时要特别注意严格控制电位。
5.缓蚀剂保护
3.3 缝隙腐蚀crevice corrosion
3.3.1 缝隙腐蚀的定义和特点
定义: 在金属与金属及金属和非金属之间构成狭窄的缝隙 内,有电解质溶液存在,介质的迁移受到阻滞时而产生的一 种局部腐蚀形态。
常数a、b值与钢种及卤素离子种类有关。
在Cl-、Br-、I-三种离子中Cl-对点蚀电位的影响最大。
3.介质温度的影响:
在相当宽的范围内,随温度的提高,不锈钢点蚀电位降低。
• 温度升高,活性点增加,参与反应的物质运动速度加 快,在蚀孔内难以引起反应物的积累, •氧的溶解度明显下降等原因造成的。 •在含氯介质中,各种不锈钢都存在临界点蚀温度(CPT) •在这一温度点蚀几率增大 •随温度升高,更易产生并趋于严重。
特点: •在工程结构中,一般需要将不同的结构件相互连接,缝 隙是不可避免的。 •缝隙腐蚀将减小部件的有效几何尺寸,降低吻合程度。 •缝内腐蚀产物的体积增大,形成局部应力,并使装配困 难,因此应尽量避免。
3.3.2 缝隙的形成
1.不同结构件之间的连接, • 金属和金属之间的铆接、搭焊、螺纹连接, •各种法兰盘之间的衬垫等金属和非金属之间的接触。 2.在金属表面的沉积物、附着物、涂膜等。 •如灰尘、沙粒、沉积的腐蚀产物。
长有很大的影响,因此蚀孔一旦形成,发展十分迅速。
• 蚀孔发展的主要理论是以“闭塞电池”的形成为基础, 并进而形成“活化-钝化腐蚀电池”的自催化理论。
1.闭塞电池的形成条件:
第三章 局部腐蚀
0C)
18 Cr) 缝隙 CPT Mo
流动状态
在流动介质中金属不容易发生孔蚀, 在流动介质中金属不容易发生孔蚀, 而在停滞液体中容易发生, 而在停滞液体中容易发生,这是因为介质 流动有利于消除溶液的不均匀性,所以输 流动有利于消除溶液的不均匀性, 送海水的不锈钢泵在停运期间应将泵内海 水排尽。 水排尽。
在钝态金属表面上,蚀孔优先在一些敏感位置 在钝态金属表面上,蚀孔优先在一些敏感位置 上形成,这些敏感位置(即腐蚀活性点)包括 包括: 上形成,这些敏感位置 即腐蚀活性点 包括: 晶界(特别是有碳化物析出的晶界 特别是有碳化物析出的晶界), 晶界 特别是有碳化物析出的晶界 ,晶格缺陷 。 特别是硫化物 硫化物,如 非金属夹杂 特别是硫化物 如FeS、MnS,是 、 , 最为敏感的活性点。 最为敏感的活性点。 钝化膜的薄弱点 如位错露头、划伤等)。 的薄弱点(如位错露头 钝化膜的薄弱点 如位错露头、划伤等 。 孕育期: 孕育期:1/τ=K[Cl-]
几
25-13-1MO-N
与 海 水 温 度 的 关 系
种 不 锈 钢 的 孔 蚀 电 位
( ( ( ( 系 ) ) ) )
蚀 1.6 电 位 (伏 1.2 ) 0.8
孔
孔蚀临界Cl 离子浓度与 孔蚀临界Cl-离子浓度与Cr 含量的关系
[H+]=iN 孔蚀临界Cl 孔蚀临界 -离 铬含量(%) 铬含量( ) 子浓度(N) 子浓度( )
缝隙形成
机器和设备上的结构缝隙 机器和设备上的结构缝隙 结构 固体沉积 泥沙 腐蚀产物等)形成的缝 固体沉积(泥沙、腐蚀产物等 形成的缝 沉积 泥沙、 隙。 金属表面的保护模 如瓷漆 清漆、 如瓷漆、 金属表面的保护模 (如瓷漆、清漆、磷 化层、金属涂层)与金属基体之间形成的 化层、金属涂层 与金属基体之间形成的 缝隙。 缝隙。
18 Cr) 缝隙 CPT Mo
流动状态
在流动介质中金属不容易发生孔蚀, 在流动介质中金属不容易发生孔蚀, 而在停滞液体中容易发生, 而在停滞液体中容易发生,这是因为介质 流动有利于消除溶液的不均匀性,所以输 流动有利于消除溶液的不均匀性, 送海水的不锈钢泵在停运期间应将泵内海 水排尽。 水排尽。
在钝态金属表面上,蚀孔优先在一些敏感位置 在钝态金属表面上,蚀孔优先在一些敏感位置 上形成,这些敏感位置(即腐蚀活性点)包括 包括: 上形成,这些敏感位置 即腐蚀活性点 包括: 晶界(特别是有碳化物析出的晶界 特别是有碳化物析出的晶界), 晶界 特别是有碳化物析出的晶界 ,晶格缺陷 。 特别是硫化物 硫化物,如 非金属夹杂 特别是硫化物 如FeS、MnS,是 、 , 最为敏感的活性点。 最为敏感的活性点。 钝化膜的薄弱点 如位错露头、划伤等)。 的薄弱点(如位错露头 钝化膜的薄弱点 如位错露头、划伤等 。 孕育期: 孕育期:1/τ=K[Cl-]
几
25-13-1MO-N
与 海 水 温 度 的 关 系
种 不 锈 钢 的 孔 蚀 电 位
( ( ( ( 系 ) ) ) )
蚀 1.6 电 位 (伏 1.2 ) 0.8
孔
孔蚀临界Cl 离子浓度与 孔蚀临界Cl-离子浓度与Cr 含量的关系
[H+]=iN 孔蚀临界Cl 孔蚀临界 -离 铬含量(%) 铬含量( ) 子浓度(N) 子浓度( )
缝隙形成
机器和设备上的结构缝隙 机器和设备上的结构缝隙 结构 固体沉积 泥沙 腐蚀产物等)形成的缝 固体沉积(泥沙、腐蚀产物等 形成的缝 沉积 泥沙、 隙。 金属表面的保护模 如瓷漆 清漆、 如瓷漆、 金属表面的保护模 (如瓷漆、清漆、磷 化层、金属涂层)与金属基体之间形成的 化层、金属涂层 与金属基体之间形成的 缝隙。 缝隙。
材料腐蚀与防护 第三章

在一定的敏化温度下,随着加热时间的增加,钢 的晶间腐蚀倾向愈严重,但是加热时间过长,晶间腐 蚀倾向又复降低,甚至完全消除。
原因是在一定敏化温度下,随加热时时间过长,
析出的碳化物颗粒逐渐聚集长大,晶界贫铬区不再连 续,而且由于Cr在晶粒和晶界上的浓度差较大,C在 晶粒和晶界上的浓度差较小,随着回火时间的延长Cr 的扩散最终将超过C的扩散。通过Cr的扩散使晶粒内 部与晶界上的铬浓度均匀,结果晶界耐蚀性又上升, 晶间腐蚀敏感性减小。
(4)点蚀的孕育期
从金属与溶液接触一直到点蚀刚刚产生,这段时间称作 孕育期,孕育期随氯离子浓度增大及电极电位升高而缩短。
二: 点腐蚀机理
点蚀可分为两个阶段,即蚀孔成核(发生)和蚀孔生长(发展).
1蚀孔成核(发生)
目前通常有二种学说,即钝化膜破坏理论和吸附理论。
钝化膜破坏理论:
这种说法认为当腐蚀性阴离子(如氯离子)在不锈钢钝化膜上 吸附后,由于氯离子半径小而穿过纯化膜,氯离子进入膜内后 “污染了氧化膜”,产生了强烈的感应离子导电,于是此膜在 一定点上变得能够维持高的电流密度,并能使阳离子杂乱移动 而活跃起来,当膜—溶液界面电场达到其一临界值时,就发生 点蚀。
如不锈钢易在含卤族元素阴离子Cl-、Br - 、I –中发生, 而铜则对SO4 2-更敏感。
当溶液中含有FeCl 3、CuCl2为代表的二价以上重金 属氯化物时,由于金属离子强烈的氧化作用,将大大促 进点蚀的形成和发展。
(2)介质浓度
以卤族离子为例,一般认为,只有当卤族离子 达到一定浓度才发生点蚀。可以把产生点蚀的最 小浓度作为评定点蚀趋势的一个参量。
这一阶段的腐蚀主要是介质状态的不均匀性引起 的。
3.3 点腐蚀 点腐蚀(孔蚀)是一种腐蚀集中于金属表面的很小范 围内,并深入到金属内部的蚀孔状腐蚀形态,一般是 直径小而深度深。
第三章1全面腐蚀与局部腐蚀

蚀孔内pH值降低(通常使pH值降低到2-3,甚至趋于0),加之Cl活化作用,促使孔内加速阳极溶解。这种由闭塞电池引起孔内 酸化加速腐蚀的作用,称为自催化酸化作用。 自催化作用可使孔内-孔外电池的电极电位差达100 mv量级, 加上重力的作用.构成了蚀孔具有深挖的能力。而孔外大片面 积处于钝化的阴极状态,同时又受到蚀孔内阳极过程所释放 的电子的阴极保护作用,因而抑制了蚀孔周围的全面腐蚀。
电化学引起的全面腐蚀的特点
? 微观电池腐蚀 腐蚀电池的阴、阳极面积都非常微小,且其位置随 时间变幻不定,由于整个金属表面在电解质溶液 中都处于 活化状态 ,表面各处随时间发生能量起 伏,某一时刻为微阳极 (高能量状态 )的点。另一 时刻则可能转变为微阴极 (低能量状态 ),从而导 致整个金属表面遭受腐蚀。
1、点蚀的萌生
? 点蚀的发生首先是在金属表面的某些敏感位置(点蚀源处) 形成点蚀核,即萌生点蚀孔。生成第一个或最初几个蚀点 所需要的时间称为点蚀萌生的诱导期(或孕育期),用?表示。
点蚀过程是由内因(金属材料的成分和组织结构、表面状态 等因素)和外因(环境介质的成分和温度等因素)共同影响的, 点蚀核的萌生实质上就是钝化膜的局部破坏过程,破坏的 原因有化学的或机械的作用,化学作用的模型目前尚无统 一的认识.较为典型的有穿透模型、吸附模型和钝化成相 膜局部破裂模型等。下面仅以纯金属为对象作简要描述.
局部腐蚀
? 局部腐蚀是由于电化学因素的不均匀性形成局部腐蚀原电 池导致的金属表面局部集中腐蚀破坏,其阳极区和阴极区 一般是截然分开的,可以用肉眼或微观检查方法加以区分 和辨别,通常阳极面积比阴极面积小得多。
? 局部腐蚀原电池可由异类金属接触电池,或由介质的浓差 电池,或由活化-钝化电池构成;也可以由金属材料本身的 组织结构或成分的不均匀性以及应力或温度状态差异所引 起。
第3章 全面腐蚀与局部腐蚀

3.2.3.2
蚀孔生长(发展)
(1)闭塞电池的形成条件 闭塞电池的形成一般需要如下条件:在 反应体系中具备阻碍液相传质过程的几何条件,如在孔口腐蚀产 物的塞积可在局部造成传质困难,缝隙及应力腐蚀的裂纹也都会 出现类似的情况;有导致局部不同于整体的环境;存在导致局部 不同于整体的电化学和化学反应。
(2)蚀孔的自催化发展过程 点蚀一旦发生,蚀孔内外就会发生一 系列变化,如图3-4所示。
图3-4 蚀孔内发生的自催化过程
3.2.4
3.2.4.1 环境因素 3.2.4.2 冶金因素
点蚀的影响因素
3-5
3M6.tif
3.2.4.1
环境因素
(1)介质类型 金属材料发生点蚀的介质是特定的,如不锈钢容易 在含有卤素离子Cl-、Br-、I-的溶液中发生点蚀,而铜对S4则比 较敏感。 (2)介质浓度 一般认为,只有当卤素离子达到一定浓度时,才发 生点蚀。 (3)介质温度的影响 在相当宽的范围内,随温度的提高,不锈钢 点蚀电位降低,如图3-5所示。 (4)溶液pH值的影响 由图3-6可见,当pH<10时,影响较小;当 pH>10后,点蚀电位上升。 (5)介质流速的影响 一般的规律是:流速增大,点蚀倾向降低。
3.3.4
缝隙腐蚀机理
缝隙腐蚀是指在金属构件缝隙处发生斑点或溃疡形的宏观蚀坑, 这是局部腐蚀的一种,常发生在垫圈、铆接、螺钉连接的接缝处, 搭接的焊接接头、阀座、堆积的金属片间等处。
图3-7 缝隙腐蚀机理图解 a)初级阶段 b)后期阶段
3.3.5
缝隙腐蚀的影响因素
3.3.5.1 缝隙的几何因素 3.3.5.2 环境因素 3.3.5.3 材料因素
3.3.2
缝隙的形成
1)不同结构件之间的连接,如金属和金属之间的铆接、搭焊、螺 纹联接,以及各种法兰盘之间的衬垫等金属和非金属之间的接触。 2)在金属表面的沉积物、附着物、涂膜等,如灰尘、沙粒、沉积 的腐蚀产物。
第三章1全面腐蚀与局部腐蚀

❖ 局部腐蚀是由于电化学因素的不均匀性形成局部腐蚀原电 池导致的金属表面局部集中腐蚀破坏,其阳极区和阴极区 一般是截然分开的,可以用肉眼或微观检查方法加以区分 和辨别,通常阳极面积比阴极面积小得多。
❖ 局部腐蚀原电池可由异类金属接触电池,或由介质的浓差 电池,或由活化-钝化电池构成;也可以由金属材料本身的 组织结构或成分的不均匀性以及应力或温度状态差异所引 起。
点蚀电位Eb对应着金属阳极极化曲线电 流迅速增大的位置,即钝化遭到破坏产 生了局部点腐蚀。正、反向极化曲线交 点对应的电位EP’称为保护电位(再钝化 电位),当金属的电位低于EP’而仍处于 钝化区时,不会生成点蚀孔;电位处于 Eb~ EP’之间时,不会形成新的点蚀孔, 而已有的点蚀孔会继续长大:当金属的 电位高于Eb时,不仅已形成的点蚀孔会 继续长大,而且将形成新的点蚀孔。点 蚀电位Eb越高,从热力学上讲金属的点 蚀倾向越小,而Eb与EP’越接近,则表明 金属钝化膜的修复能力越强。
适的缓蚀剂
(对 装 保 位 位 备 稳 阴3)于 护 降 定 极置 金E电p金 措 低 的 保采 属以化属 施 到 钝 护用 材下学设 , 保 化 电电 料,保备 将 护 区 位化 处使护、 电 电 或 区学 于设。钝 镍 的 覆 合 对 免 于 在可抗纯金于敏铝5化0以点铝的不化合处0℃理提蚀可抗锈热金左和高性以点钢处,右不能提蚀,理应表退锈;高性应,避面火钢包铝能避对免镀,
❖ 从表面上看,点蚀坑多数被腐蚀产物所覆盖,呈 闭口形式,也有开口形式。孔口直径一般等于或 小于孔的深度,大小通常在数十微米到数百微米 范围。
❖ 点蚀坑的发展通常受重力影响,多数情况是从水 平表面向下生长,少数是在垂直表面上发展,极 少数情况是从材料朝下的表面向上生长。
二、点蚀机理
❖ 局部腐蚀原电池可由异类金属接触电池,或由介质的浓差 电池,或由活化-钝化电池构成;也可以由金属材料本身的 组织结构或成分的不均匀性以及应力或温度状态差异所引 起。
点蚀电位Eb对应着金属阳极极化曲线电 流迅速增大的位置,即钝化遭到破坏产 生了局部点腐蚀。正、反向极化曲线交 点对应的电位EP’称为保护电位(再钝化 电位),当金属的电位低于EP’而仍处于 钝化区时,不会生成点蚀孔;电位处于 Eb~ EP’之间时,不会形成新的点蚀孔, 而已有的点蚀孔会继续长大:当金属的 电位高于Eb时,不仅已形成的点蚀孔会 继续长大,而且将形成新的点蚀孔。点 蚀电位Eb越高,从热力学上讲金属的点 蚀倾向越小,而Eb与EP’越接近,则表明 金属钝化膜的修复能力越强。
适的缓蚀剂
(对 装 保 位 位 备 稳 阴3)于 护 降 定 极置 金E电p金 措 低 的 保采 属以化属 施 到 钝 护用 材下学设 , 保 化 电电 料,保备 将 护 区 位化 处使护、 电 电 或 区学 于设。钝 镍 的 覆 合 对 免 于 在可抗纯金于敏铝5化0以点铝的不化合处0℃理提蚀可抗锈热金左和高性以点钢处,右不能提蚀,理应表退锈;高性应,避面火钢包铝能避对免镀,
❖ 从表面上看,点蚀坑多数被腐蚀产物所覆盖,呈 闭口形式,也有开口形式。孔口直径一般等于或 小于孔的深度,大小通常在数十微米到数百微米 范围。
❖ 点蚀坑的发展通常受重力影响,多数情况是从水 平表面向下生长,少数是在垂直表面上发展,极 少数情况是从材料朝下的表面向上生长。
二、点蚀机理
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
全面腐蚀是一种最容易见到的腐蚀形态, 其特征是腐蚀分布于金属材料的整个表 面,使金属整体减薄。可以是均匀的, 也可以是不均匀的。发生全面腐蚀的条 件是,腐蚀介质能够均匀的抵达金属表 面的各部位,而且金属的成分和组织比 较均匀。例如碳钢或锌板在稀硫酸溶液 中的溶解,以及某些材料在大气中的腐 蚀都是典型的全面腐蚀。
电化学控制:
ln
Ec 2 Ec1 ba1 ic 2 bc 2 S2 ln ln ba1 bc 2 ba1 bc 2 ic1 ba1 bc 2 S 1
• 电化学控制时,电偶的阳极电流密度正 比于M1和M2的面积比A2/A1和电位差Ec2Ec1 如海水介质中电偶腐蚀主要受氧的阴极还原控制,电偶电 流决定于Ac / Aa
(i) Ec2-Ec1 越大,Ig 越大;
(ii) ba1+ bc2 越大,Ig 越小;
(iii) ic2.S2和ic1S1越大,则Ig越大。 如果: M1阳极腐蚀电流: ig1 = Ig/S1 定义电偶效应参数: = ia1/ic1 = ig/ic1 有: 扩散控制:
ia1 S2 1 ic1 S1
§5.1电偶腐蚀
在同一介质中,异种金属相互接触,电 偶电势差异 — 电偶腐蚀
•
• 电偶腐蚀在化工/日常生活中现象很普遍
• 电偶腐蚀 — 金属电极构成宏观腐蚀电 池 • 电位较低的金属腐蚀增大,电位较高的 金属腐蚀速度减小
M1 M1n+ + ne 2H+ + 2e H2 M2 M2 n+ + ne
• pH对点蚀发生过程影响较大,而对发展过程影响较小
• 温度上升, 点腐蚀数增加,达到90℃溶解氧减少,点蚀 速度下降
• 介质流动能降低点蚀速度,氧浓度增加,钝化加强 • 改善传质可消除闭塞效应和自催化作用,减缓点蚀发展。
(2)材料因素
• • • • 不同金属耐点蚀能力显著不同,Al Fe Ni Zr Cr Ti 钝性金属对点蚀比较敏感 合金元素:Cr、Mo、Si、Cu、Ni等能有效提高耐点蚀性 C、Mn、S 可使点蚀敏感性增大
E
g
b b b .b i .S E E ln( ) b b b b b b i .S
c2 a1 a1 c1 c2 2 c1 c2 a2 c2 a1 c2 a1 c2 c1 1
• Eg 处于Ec1和 Ec2 之间,A2.ic2 越大, Eg 越正 • 反之亦然。
Ec 2 Ec1 ba1 bc 2 ln Ig ln(ic1S 1) ln(ic 2 S 2) ba1 bc 2 ba1 bc 2 ba1 bc 2
Er
Micropit & Repassivation
Ep
Development of Pitting Macropit
solution
solution
solution
solution
solution
metal
metal
metal
metal
metal
A
B
C
D
E
A conceptual model for pitting initiation and propagation for stainless steel in a chloride containing solution
第3章 金属的全面腐蚀与局部腐蚀
金属的全面腐蚀 局部腐蚀现象与特点 局部腐蚀机理和规律性 局部腐蚀影响因素 局部腐蚀控制
3.1金属的全面腐蚀
全面腐蚀(均匀腐蚀)— 阴阳极共扼反应在 金属相同位置同时发生或交替发生,阴阳极 没有时间和空间上的区别,整个表面用Ecorr 表征,在此电位下表面均匀溶解腐蚀。腐蚀 速度可测量/预测。
影响点蚀因素
• 材料因素— 金属或合金的性质、缺陷状态、表面特性等 • 环境因素— 介质性质、pH、温度、流速等
(1)环境因素
腐蚀介质类型:NaCl,CaCl2可促进溶解氧还原(阴极过 程),Cl—侵蚀性强,诱发促进点腐蚀发生/发展
卤素(侵蚀性)离子浓度影响大, 存在临界离子浓度: Ep = -0.088 lg a Cl— + 0.108 (V) Ep = -0.124 lg a Cl— - 0.0504 (V) - 不锈钢 -铝
全面腐蚀的电化学特点
腐蚀原电池的阴、阳极面积非常小,甚 至用微观方法也无法辨认,而且微阳极 和微阴极的位置变幻不定。整个金属表 面在溶液中处于活化状态,只是各点随 时间(或地点)有能量起伏,能量高时 (处)呈阳极,能量低时(处)呈阴极, 从而使整个金属表面遭受腐蚀。
全面腐蚀属于微观电池腐蚀,如铁生锈, 钢失泽,镍发雾,高温氧化等。 腐蚀速度用重量法和深度法表示。
2H+ + 2e H2
异种金属接触构成电偶腐蚀
• 电偶构成, 对应总腐 蚀电流 I c,电偶混合 电位Ecorr。
• M1,ic1 ic1’,腐 蚀速度增加。
• M2,ic2 ic2’,腐 蚀速度下降。 ic2 ic1 ic • 电偶腐蚀总电流: ic = ic1’ + ic2’ = Ig
M1 M1n+ + ne 2H+ + 2e H2 M2 M2 n+ + ne 2H+ + 2e H2
• Ig – A1/A2, Ec1-Ec2, ba1+bc2 关系
因电偶电流: Ig = i1.A1 = i2.A2 当Eg离Ec1与 Ec2较远,M1只进行阳极反应,M2只发生阴极反 应, 并由电化学控制,由Ig = i1.A1 = i2.A2代入动力学方程,有: Ig = A1 ic1 exp[( Eg- Ecl)/ ba1] = A2 ic2 exp [-( Eg-Ec2)/ bc2] 整理,求得Ig、Eg:
几何因素 — 缝隙内氧耗尽,难以扩散补充,缝内缺氧,电位负移, 相对缝外富氧区,形成腐蚀阳极区。
缝蚀腐蚀发展
• 闭塞电池(Occlude)内自催化作用 — 缝蚀发展 • 缝内阳极溶解,金属离子增多,金属离子水解反应,缝内 溶液酸化、浓缩: Mn+ + nH2O M(OH)n + nH+ • 缝内pH下降,Ef = 0.63 + 0.059pH,电位负移, 缝内、外电位差达50-600mV,钝态 活化态。形成严重 氧浓差腐蚀电池。 • 缝内阳极/缝外阴极,面积比小,缝腐蚀速度快。 • Cl-离子迁入缝内以保持缝内溶液电中性。 • 腐蚀产物堆积 — 几何形状闭塞 — 扩散传输进一步受阻。
• 氧 化 性 金 属 离 子 促 进 点 蚀 , 如 : Fe3+ 、 Cu2+ 、 Hg2+ (FeCl3,CuCl2)加速金属氧化,相当于施加阳极电位;
• 含氧阴离子抑制点蚀,如:OH—、SO2—4、NO3—,可排 斥Cl—吸附,抑制点蚀能力:OH— NO3— SO2—4 ClO4—
点腐蚀发展过程一般模型
点腐蚀发展驱动力 — 几何环境、化学微环境、 电化学差异
•自催化效应形成,点蚀可 持续发展。
Fe2+ + 2H2O + 2Cl-
Fe(OH)2 + 2HCl
点蚀程度用最大腐蚀深度比平均腐蚀深度表示。
Ecorr
Active Defects Breakdown of Passivity
§5.3 缝隙腐蚀
金属/非金属
金属
缝隙腐蚀可发生在所有金属和合金, 如法兰,锈层,铆, 焊,螺钉连接等。 缝隙处选择性腐蚀普遍 (缝隙腐蚀)任何介质/金属 (金属/金属,金属/非金属)均可能发生缝蚀,缝隙腐蚀临界尺 寸为0.025—0.1 mm,宽度/深度比值很小。
缝蚀腐蚀机理:
• 缝蚀腐蚀发生— ln(CO/CR) 驱动力 — 氧浓差电池 E = Eo + RT/ nF
正确选材,避免异种金属或电偶序差大金属接触 保持阴/阳极面积合适比例,避免大阴极、小阳极
异种金属接触时应加以绝缘;
表面处理、涂覆可使电偶效应减少; 应用缓蚀剂,可有效防止电偶腐蚀。
§5.2 点腐蚀 (孔腐蚀)
最常见的一种局部腐蚀形式 点蚀随机分布,孔径:微米-毫米 孔口有腐蚀产物覆盖或开放式
重量法用单位面积、单位时间内的增重 或失重表示: V+ = (W1-W0) / s t V- = (W0-W2) / s t
深度法用每年腐蚀的金属厚度表示: B = (W0-W2) / s tρ
3.2金属局部腐蚀
局部腐蚀 — 由于电化学不均一性(如异 种金属、表面缺陷、浓度差异、应力集 中、环境不均匀等),形成局部电池。 局部腐蚀阴、阳极可区分,阴极/阳极面 积比很大,阴、阳极共扼反应分别在不 同区域发生,局部腐蚀集中在个别位置, 急剧发生,材料快速腐蚀破坏。 表3-1对 全面腐蚀和局部腐蚀在电化学行为和腐 蚀产物等方面的差异进行了全面比较。
(a) FeOOH + H2O (b) FeOOH + Cl(c) Fe
Fe3+ +3OHFeOCl + OHFeOCl + H2O Fe3+ + Cl- + 2OH-
Fe 2+ + 2e
点蚀成长机理:
• 膜-孔电池形成后,孔外 氧去极化,腐蚀产物(Fe2+) 水解、氧化; • Cl - 迁 入 孔 内 保 持 电 中 性,氯化物水解,孔内酸化, pH降低; • 闭塞使传输困难,氧浓 差电池形成;孔内溶液浓缩, H+ 去极化加速铁溶解。
含Cl-
无Cl-
过钝化 不锈钢在NaCl介质中阳极极化曲线
