Annexin V凋亡试剂盒操作步骤
AnnexinV-FITC细胞凋亡检测说明书

凯基Annexin V-FITC细胞凋亡检测试剂盒一、原理在正常细胞中,磷脂酰丝氨酸(PS)只分布在细胞膜脂质双层的内侧,而在细胞凋亡早期,细胞膜中的磷脂酰丝氨酸(PS)由脂膜内侧翻向外侧。
Annexin V是一种分子量为35~36kD的Ca2+依赖性磷脂结合蛋白,与磷脂酰丝氨酸有高度亲和力,故可通过细胞外侧暴露的磷脂酰丝氨酸与凋亡早期细胞的胞膜结合。
因此Annexin V被作为检测细胞早期凋亡的灵敏指标之一。
将Annexin V进行荧光素(FITC、FITC)标记,以标记了的Annexin V作为荧光探针,利用荧光显微镜或流式细胞仪可检测细胞凋亡的发生。
与FITC 的绿色荧光信号相比,FITC的绿色荧光信号具有信号强,不易淬灭,稳定性高等优点,故本试剂盒采用FITC作为荧光标记探针。
碘化丙啶(Propidium Iodide, PI)是一种核酸染料,它不能透过完整的细胞膜,但对凋亡中晚期的细胞和死细胞,PI能够透过细胞膜而使细胞核染红。
因此将Annexin V与PI匹配使用,就可以将处于不同凋亡时期的细胞区分开来。
二、试剂盒组份三、操作步骤1.用适当的方法诱导细胞凋亡,同时设立阴性对照组,并收集细胞;2.用PBS洗涤细胞二次(离心2000rpm,5min)收集1~5×105细胞;3.吸取250μL的2×Binding Buffer和250μL灭菌去离子水(用户自备),混匀;4.用上述500μL的1×Binding Buffer悬浮细胞;5.加入1μL Annexin V-FITC混匀后加入5 μL Propidium Iodide,然后混匀;6.避光室温反应5min;根据不同的分析方法选择步骤A或B。
A.荧光显微镜观察1.滴一滴经过步骤1~6处理过的细胞悬浮液于载玻片,并用盖玻片盖上细胞;2.对于贴壁细胞来说,也可直接用盖玻片来培养细胞并诱导细胞凋亡;(1)将细胞于盖玻片上生长,用适当的凋亡诱导剂诱导细胞凋亡,并设立阴性对照组;(2)用PBS洗涤细胞两次;(3)吸取250μL 的2×Binding Buffer和250μL灭菌去离子水(用户自备),混匀;(4)加入1μL Annexin V-FITC混匀后加入5 μL Propidium Iodide,然后混匀;(5)将(4)步骤的溶液滴加于盖玻片表面,使长有细胞的盖玻片表面均匀覆盖;(6)避光室温反应5 min。
凋亡、周期操作步骤

凋亡操作步骤Annexin V-FITC/PI法检测细胞凋亡1.将细胞收集到离心管中,1000rpm离心10min,除去上清,用4℃预冷的PBS重悬细胞,1000rpm离心10min,再重复一次,最后除去上清;2.在冰浴上,加入500μl的上样缓冲液到离心管中,用吸管吹打使细胞重悬,然后转移到1.5ml EP管中;3.先加入5μl AnnexinV-FITC,振荡均匀后4℃避光孵育15min,然后再加入5μlPI,同样孵育5min;4.孵育后立即上流式细胞仪分析。
注意:●需制备三个质控样本来设定流式细胞仪的荧光补偿和设置十字门的范围:a.没有染色的细胞;b.经过处理,仅用AnnexinV-FITC染色的细胞;c.经过处理,仅用PI染色的细胞。
●理想样品浓度调至105-106 cells/ml,一般实验只需0.5 ml的样品。
周期操作步骤1.细胞培养●药物作用后,将细胞胰酶消化,轻轻吹打下细胞至15ml离心管。
●1000 rpm×5 min离心,弃上清。
2.细胞固定●加入3ml 预冷PBS重悬细胞,1000 rpm×5 min离心,弃上清。
●加入500ul PBS,轻轻重悬细胞,使细胞分离为单个,在V ertex上低速涡旋震荡(1档),逐滴加入到1.5 ml 100%乙醇(4℃),使其终浓度为75% ,4℃放置过夜固定。
(注意:这里是细胞悬液逐滴加入到100%乙醇中)3.细胞标记●取出固定的样品,1000 rpm×5 min离心,弃上清。
●加入3 ml预冷PBS重悬细胞,1000 rpm×5 min离心,弃上清,收细胞。
●加入150 μl RNaseA(250 μg/ml PBS稀释)重悬细胞,37℃消化30分钟。
●加入150 μl PI(100 μg/ml ,PBS溶解),4℃避光染色30分钟。
●转至流式检测管,分析细胞DNA含量的变化及细胞周期。
Annexin V-FITC细胞凋亡检测详细步骤及说明

Annexin V-FITC细胞凋亡检测详细步骤及说明1. 对于悬浮细胞:a. 在进行完细胞凋亡刺激后,1000g离心5分钟,弃上清,收集细胞,用PBS 轻轻重悬细胞并计数。
注意:PBS重悬不能省略,PBS重悬的过程同时也起到了洗涤细胞的作用,可以保证后续Annexin V-FITC的结合。
b. 取5-10万重悬的细胞,1000g离心5分钟,弃上清,加入195µl Annexin V-FITC结合液轻轻重悬细胞。
c. 加入5µl Annexin V-FITC,轻轻混匀。
d. 加入10µl碘化丙啶染色液,轻轻混匀。
e. 室温(20-25ºC)避光孵育10-20分钟,随后置于冰浴中。
可以使用铝箔进行避光。
孵育过程中可以重悬细胞2-3次以改善染色效果。
f. 如果用于流式细胞仪检测,可立即上机检测,Annexin V-FITC为绿色荧光,碘化丙啶(PI)为红色荧光,流式检测细胞凋亡的效果及其验证请参考图1和图2。
初次进行流式细胞仪检测时,建议选择一组适当的细胞参考图2设置未染色、PI单染和Annexin V-FITC单染这3个对照。
如果用于荧光显微镜检测,1000g 离心5分钟,收集细胞,用50-100µl Annexin V-FITC结合液轻轻重悬细胞,涂片后,荧光显微镜下观察。
注意:细胞在染色后须尽快完成检测,通常宜在1小时之内完成检测。
用于流式细胞仪检测时,如果发现Annexin V-FITC单独染色时出现了过多的PI假阳性细胞,并且通过调整相关设置和参数也无法改善,可以用PBS将Annexin V-FITC稀释3-10倍后再进行检测。
2. 对于贴壁细胞的消化后检测:a. 把细胞培养液吸出至一合适离心管内,PBS洗涤贴壁细胞一次,加入适量胰酶细胞消化液(可含有EDTA)消化细胞。
室温孵育至轻轻吹打可以使贴壁细胞吹打下来时,吸除胰酶细胞消化液。
需避免胰酶的过度消化。
Annexin V-FITC 凋亡检测试剂盒操作方法及步骤说明书

Annexin V-FITC凋亡检测试剂盒说明:细胞凋亡是细胞的基本特征之一,它在机体的胚胎发育、组织修复、内环境的稳定等方面起着十分重要的作用。
Annexin Ⅴ是一种分子量为35-36kD的Ca2+依赖性磷脂结合蛋白,能与细胞凋亡过程中翻转到膜外的磷脂酰丝氨酸(Phosphatidylserine,PS)高亲和力特异性结合。
以标记了FITC的Annexin Ⅴ作为荧光探针,利用流式细胞仪或荧光显微镜可检测细胞凋亡的发生。
Propidium iodide(PI)是一种核酸染料,它不能透过完整的细胞膜,但在凋亡中晚期的细胞和死细胞,PI能够透过细胞膜而使细胞核红染。
将Annexin Ⅴ与PI匹配使用,可以将凋亡早期的细胞和晚期的细胞以及死细胞区分开来。
产品组成(50/25次反应):· Annexin V-FITC 500ul/250ul(20ug /ml)· Binding Buffer 40ml/20 ml· Propidium Iodide (PI) 250ul/125ul(50ug /ml)保存条件: 2-8℃储存,有效期一年。
注意事项:1.为保证得到理想的实验结果,在使用此试剂盒之前请认真阅读该注意事项;2.试剂(尤其是小瓶装的试剂)在开盖前请短暂离心,将盖内壁上的液体甩至管底,避免开盖时液体洒落;3.Propidium iodide(PI)能通过皮肤吸收,对眼睛有刺激作用;4.此试剂盒仅供科研使用,不宜用于临床诊断;5.本试剂盒中提供的PBS为随试剂赠送,并非试剂盒的真正组成成分;细胞的洗涤同常规方法。
操作注意要点:1.整个操作过程动作要尽量轻柔,勿用力吹打细胞,尽量在4℃下操作;2.反应完毕后请尽快检测,因为细胞凋亡是一个动态的过程,反应1小时后荧光强度就开始衰变;3.Annexin V-FITC和Propidium iodide是光敏物质,在操作时请注意避光;4.成功的检测凋亡受以下几种因素的影响,如细胞类型、细胞膜上PS的密度、发生凋亡时PS翻转的比例、诱导细胞凋亡的方法、所用试剂、诱导凋亡的时间等,把这些影响因素进行优化对实验成功是非常必要的;5.在细胞洗涤的最后一步,请尽量将上清弃净,以免PBS残留,有可能会影响实验结果;6.PI染色时间过长有可能造成检测的凋亡率偏高,建议首先进行Annexin V-FITC染色,上机前5分钟再加入PI染色。
ANNEXIN V-FITC PI 凋亡检测试剂盒说明书

第1页,共3页ANNEXINV-FITC/PI 凋亡检测试剂盒说明书注意:本产品试剂浓度发生变化,使用前请仔细阅读说明书。
货号:CA1020规格:20T/50T /100T保存:2-8°C ,避光保存,有效期1年。
产品说明:细胞凋亡早期改变发生在细胞膜表面,这些细胞膜表面的改变之一是磷脂酰丝氨酸(PS)从细胞膜内转移到细胞膜外,使PS 暴露在细胞膜外表面。
PS 是一种带负电荷的磷脂,正常主要存在于细胞膜的内面,在细胞发生凋亡时细胞膜上的这种磷脂分布的不对称性被破坏而使PS 暴露在细胞膜外。
Annexin V 具有易于结合到磷脂类如PS 的特性,对PS 有高度的亲和性。
因此,该蛋白可充当一敏感的探针检测暴露在细胞膜表面的PS 。
PS 转移到细胞膜外不是凋亡所独特的,也可发生在细胞坏死中。
两种细胞死亡方式间的差别是在凋亡的初始阶段细胞膜是完好的,而细胞坏死在其早期阶段细胞膜的完整性就破坏了。
因此,可以采用Annexin V 与PI 双染的方法,通过流式检测细胞早期凋亡。
操作步骤:1.细胞样品的准备:a)对于贴壁细胞:小心收集细胞培养液到一离心管内备用。
用不含EDTA 的胰酶消化细胞,至细胞可以被轻轻用移液管或枪头吹打下来时,加入前面收集的细胞培养液,吹打下所有的贴壁细胞,并轻轻吹散细胞。
再次收集到离心管内。
1000rpm 左右离心5min ,沉淀细胞。
对于特定的细胞,如果细胞无法完全离心至离心管底,可以适当延长离心时间或稍稍加大离心力。
小心吸除上清,可以残留约50µl 左右的培养液,以避免吸走细胞。
加入约1ml 4℃预冷的PBS ,重悬细胞,再次离心沉淀细胞,小心吸除上清。
b)对于悬浮细胞:1000rpm 左右离心5min ,沉淀细胞。
对于特定的细胞,如果细胞无法完全离心至离心管底,可以适当延长离心时间或稍稍加大离心力。
小心吸除上清,可以残留约50µl 左右的培养液,以避免吸走细胞。
PH0536 Annexin V-PE细胞凋亡检测试剂盒操作手册
PH0536|Annexin V-PE细胞凋亡检测试剂盒(Annexin V-PE apoptosis detection kit)货号:PH0536规格:PH0536-20|20T存储:4℃保存,半年有效。
AnnexinV-PE需避光保存。
◆产品组分试剂组成规格保存Annexin V-PE100uL4℃Annexin V-PE结合液12mL4℃,避光说明书1份/◆产品简介Annexin V-PE细胞凋亡检测试剂盒(Annexin V-PE Apoptosis Detection Kit)是用PE(Phycoerythrin)标记的重组人Annexin V来检测细胞凋亡时出现在细胞膜表面的磷酯酰丝氨酸的一种细胞凋亡检测试剂盒。
可以使用流式细胞仪、荧光显微镜或其它荧光检测设备进行检测。
本试剂盒检测的是红色荧光,因此在待检测的细胞已经表达GFP等绿色荧光蛋白的情况下,特别适合使用本试剂盒检测细胞凋亡。
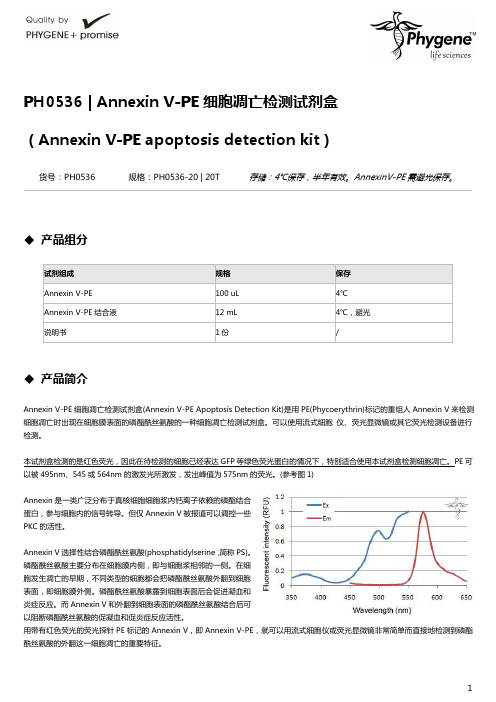
PE可以被495nm、545或564nm的激发光所激发,发出峰值为575nm的荧光。
(参考图1)Annexin是一类广泛分布于真核细胞细胞浆内钙离子依赖的磷酯结合蛋白,参与细胞内的信号转导。
但仅Annexin V被报道可以调控一些PKC的活性。
Annexin V选择性结合磷酯酰丝氨酸(phosphatidylserine,简称PS)。
磷酯酰丝氨酸主要分布在细胞膜内侧,即与细胞浆相邻的一侧。
在细胞发生凋亡的早期,不同类型的细胞都会把磷酯酰丝氨酸外翻到细胞表面,即细胞膜外侧。
磷酯酰丝氨酸暴露到细胞表面后会促进凝血和炎症反应。
而Annexin V和外翻到细胞表面的磷酯酰丝氨酸结合后可以阻断磷酯酰丝氨酸的促凝血和促炎症反应活性。
用带有红色荧光的荧光探针PE标记的Annexin V,即Annexin V-PE,就可以用流式细胞仪或荧光显微镜非常简单而直接地检测到磷酯酰丝氨酸的外翻这一细胞凋亡的重要特征。
正常细胞不会被Annexin V-PE所染色,凋亡细胞和坏死细胞都会被Annexin V-PE所染色。
艾美捷Annexin V-FITC PI双染法细胞凋亡检测试剂盒操作说明

艾美捷Annexin V-FITC/PI双染法细胞凋亡检测试剂盒操作说明细胞凋亡是细胞的基本特征之一,它在机体的胚胎发育、组织修复、内环境的稳定等方面起着十分重要的作用。
在细胞凋亡过程中,细胞内膜的磷酯酰丝氨酸外翻到细胞外膜,而Annexin V(膜联蛋白V)对其有天然的高亲和能力,故可以用FITC标记(绿色荧光)的Annexin V来检测细胞凋亡,但本方法的缺点是不能区分早期和晚期的凋亡细胞。
早期和晚期的凋亡细胞的一个重要区别在于细胞膜的完整性(凋亡早期细胞没有丧失膜的完整性),故可以用碘化丙啶(PropidiumIodide,PI)来染色加以区分。
图源:网络艾美捷Annexin V-FITC/PI双染法细胞凋亡检测试剂盒特点:1. 即开即用,不需要专门花时间准备各种成分。
2. 整合了Annexin V-FITC和PI检测法的优点,提高了凋亡细胞检测的灵敏度和特异性,本方法是目前极为灵敏的细胞凋亡检测方法。
3. 跟流式细胞仪、荧光显微镜或其它荧光检测兼容。
艾美捷Annexin V-FITC/PI双染法细胞凋亡检测试剂盒操作步骤:(一)获得目的基因1、通过PCR方法:以含目的基因的克隆质粒为模板,按基因序列设计一对引物(在上游和下游引物分别引入不同的酶切位点),PCR循环获得所需基因片段。
2、通过RT-PCR方法:用TRIzol法从细胞或组织中提取总RNA,以mRNA为模板,逆转录形成cDNA第一链,以逆转录产物为模板进行PCR循环获得产物。
(二)构建重组表达载体1、Annexin V-FITC/PI双染法细胞凋亡检测试剂盒载体酶切:将表达质粒用限制性内切酶(同引物的酶切位点)进行双酶切,酶切产物行琼脂糖电泳后,用胶回收Kit或冻融法回收载体大片段。
2、PCR产物双酶切后回收,在T4DNA连接酶作用下连接入载体。
(三) 获得含重组表达质粒的表达菌种1、将连接产物转化大肠杆菌DH5α,根据重组载体的标志(抗Amp或蓝白斑)作筛选,挑取单斑,碱裂解法小量抽提质粒,双酶切初步鉴定。
PH0539-Annexin V-FITCPI 凋亡检测试剂盒使用手册

PH0539|Annexin V-FITC/PI凋亡检测试剂盒(Annexin V-FITC/PI Apoptosis Assay Kit)货号:PH0539规格:PH0539-50|50T存储:Store at4℃,一年有效。
◆产品组分>>Annexin V-FITC--------------------250ul>>10×Binding Buffer-----------------2*13ml>>Propidium Iodide(PI)--------------500ul◆产品简介细胞凋亡(Apoptosis)是一种由基因控制的细胞自主死亡方式。
它与组织器官的发育,机体正常生理功能的维持,某些疾病的发生发展以及细胞癌变过程均有着密切的关系。
细胞凋亡已成为生命学科极为活跃的研究领域之一。
此外,介绍几种常用的细胞凋亡检测方式。
在细胞凋亡的早期,细胞膜表面的磷脂酰丝氨酸(Phosphatidylserine,PS)将会从细胞膜内侧转移到细胞膜外侧,使PS充分暴露在细胞膜外表面。
Annexin V是一种磷脂结合蛋白,对PS有高度的亲和力。
因此,Annexin V作为一个敏感的探针可以有效地检测暴露在细胞膜表面的PS。
目前普遍使用的检测方法是将荧光标记后的Annexin V-FITC作为探针,利用流式细胞仪来检测细胞凋亡。
值得注意的是,在细胞坏死的过程中也会发生PS的暴露。
但两者的差别在于细胞凋亡的初始阶段细胞膜结构是完好的,只有PS转移,而细胞坏死则在早期阶段细胞膜的完整性就破坏了,从而暴漏出PS。
因此,检测细胞凋亡时,通常会使用颜料碘化丙啶(Propidium Iodide,PI)以确立细胞膜的完整性。
PI是一种核酸染料,它可以染色死细胞,但不能进入完整的活细胞,从而将凋亡性细胞和坏死性细胞区分开来。
◆使用说明1、细胞收集与Annexin V-FITC结合(1)在完成细胞凋亡诱导处理后,1500rpm,5分钟离心后弃上清,收集细胞。
Annexin V-FITC 凋亡检测试剂盒操作方法及步骤说明书

Annexin V-FITC凋亡检测试剂盒说明:细胞凋亡是细胞的基本特征之一,它在机体的胚胎发育、组织修复、内环境的稳定等方面起着十分重要的作用。
Annexin Ⅴ是一种分子量为35-36kD的Ca2+依赖性磷脂结合蛋白,能与细胞凋亡过程中翻转到膜外的磷脂酰丝氨酸(Phosphatidylserine,PS)高亲和力特异性结合。
以标记了FITC的Annexin Ⅴ作为荧光探针,利用流式细胞仪或荧光显微镜可检测细胞凋亡的发生。
Propidium iodide(PI)是一种核酸染料,它不能透过完整的细胞膜,但在凋亡中晚期的细胞和死细胞,PI能够透过细胞膜而使细胞核红染。
将Annexin Ⅴ与PI匹配使用,可以将凋亡早期的细胞和晚期的细胞以及死细胞区分开来。
产品组成(50/25次反应):· Annexin V-FITC 500ul/250ul(20ug /ml)· Binding Buffer 40ml/20 ml· Propidium Iodide (PI) 250ul/125ul(50ug /ml)保存条件: 2-8℃储存,有效期一年。
注意事项:1.为保证得到理想的实验结果,在使用此试剂盒之前请认真阅读该注意事项;2.试剂(尤其是小瓶装的试剂)在开盖前请短暂离心,将盖内壁上的液体甩至管底,避免开盖时液体洒落;3.Propidium iodide(PI)能通过皮肤吸收,对眼睛有刺激作用;4.此试剂盒仅供科研使用,不宜用于临床诊断;5.本试剂盒中提供的PBS为随试剂赠送,并非试剂盒的真正组成成分;细胞的洗涤同常规方法。
操作注意要点:1.整个操作过程动作要尽量轻柔,勿用力吹打细胞,尽量在4℃下操作;2.反应完毕后请尽快检测,因为细胞凋亡是一个动态的过程,反应1小时后荧光强度就开始衰变;3.Annexin V-FITC和Propidium iodide是光敏物质,在操作时请注意避光;4.成功的检测凋亡受以下几种因素的影响,如细胞类型、细胞膜上PS的密度、发生凋亡时PS翻转的比例、诱导细胞凋亡的方法、所用试剂、诱导凋亡的时间等,把这些影响因素进行优化对实验成功是非常必要的;5.在细胞洗涤的最后一步,请尽量将上清弃净,以免PBS残留,有可能会影响实验结果;6.PI染色时间过长有可能造成检测的凋亡率偏高,建议首先进行Annexin V-FITC染色,上机前5分钟再加入PI染色。
流式细胞仪检测细胞凋亡操作流程

流式检测细胞凋亡A n n e x i n V检测细胞凋亡 (2)实验原理 (2)实验用品 (2)操作步骤 (3)Annexin V Blocking (5)凋亡细胞的D N A断裂片段分析 (7)实验原理 (7)实验用品 (8)操作步骤 (9)B r d U F l o w K i t s检测细胞增殖 (12)实验原理 (12)BrdU Flow Kits 试剂盒 (12)结果分析 (17)流式仪器设置指南 (18)线粒体膜电位变化检测细胞凋亡 (22)实验原理 (22)实验用品 (22)样本制备 (23)结果分析 (24)注意事项 (24)A c t i v e C a s p a s e-3检测细胞凋亡 (26)实验原理 (26)实验步骤 (27)结果分析 (28)A n n e x i n V检测细胞凋亡实验原理Annexin V 是检测细胞凋亡的灵敏指标之一。
它是一种磷脂结合蛋白,可以与早期凋亡细胞的胞膜结合,而细胞质膜的改变是细胞发生凋亡时最早的改变之一。
在细胞发生凋亡时,膜磷脂酰丝氨酸(PS) 由质膜内侧翻向外侧。
Annexin V 与磷脂酰丝氨酸有高度亲和力,因而与细胞外侧暴露的磷脂酰丝氨酸结合。
由于在发生凋亡时,磷脂酰丝氨酸外翻的发生早于细胞核的改变,因此,与DNA 碎片检测比较,使用Annexin V 可以更早地检测到凋亡细胞。
因为细胞坏死时也会发生磷脂酰丝氨酸外翻,所以Annexin V 常与鉴定细胞死活的核酸染料(如PI 或7-AAD)合并使用,来区分凋亡细胞(Annexin V+/核酸染料-) 与死亡细胞(Annexin V+/核酸染料+)。
实验用品1. 一次性12⨯75mm Falcon试管。
2. PBS缓冲液:含0.1%NaN3,过滤后2-8︒C保存。
3. 微量加样器和加样头。
4. Annexin V Binding Buffer缓冲液(Cat. No. 66121E):浓度为10⨯,使用时,用稀释为1⨯浓度的应用液。
BD556547凋亡试剂盒使用方法

BD556547凋亡试剂盒使⽤⽅法⼀、概述在正常细胞中,磷脂酰丝氨酸只分布在细胞膜脂质双层的内侧,细胞发⽣凋亡早期,膜磷脂酰丝氨酸(PS)由脂膜内侧翻向外侧,这⼀变化早于细胞皱缩、染⾊质浓缩、DNA⽚断化和细胞膜的通透性增加等凋亡现象。
AnnexinV是⼀种磷脂结合蛋⽩,与磷脂酰丝氨酸有⾼度亲和⼒,故可通过细胞外侧暴露的磷脂酰丝氨酸与凋亡早期细胞的胞膜结合。
因此AnnexinV被作为检测细胞早期凋亡的灵敏指标之⼀。
碘化丙啶(Propidium Iodide,PI)是⼀种核酸染料,它不能透过完整的细胞膜,但凋亡中晚期的细胞和死细胞由于细胞膜通透性的增加,PI能够透过细胞膜⽽使细胞核染红。
因此将Annexin V与PI匹配使⽤,就可以将处于不同凋亡时期的细胞区分开来。
⼆、BD 556547 AnnexinV-FITC/PI细胞凋亡双染试剂盒的组份:556547a Annexin V Binding Buffer, 10X conc (51-66121E)556547b Annexin V-FITC (51-65874X)556547c Propidium Iodide Staining Solution(51-66211E)三、BD 556547 AnnexinV-FITC/PI细胞凋亡双染试剂盒的操作步骤:贴壁细胞需⽤0.25%的胰酶消化。
注意过度消化可损伤细胞。
在消化时可加2%的BSA可防⽌消化过度。
如果⽤含EDTA的胰酶消化时,注意必须清除EDTA:在标记前⽤1×PBS或1×bindingbuffer洗涤,清除EDTA,以免残余的EDTA与Ca2+螯合,影响Annexin V的结合。
(1)⽤去离⼦⽔将10×Binding Buffer稀释成1×Binding Buffer;(2)细胞收集。
悬浮细胞收集:离⼼5分钟;贴壁细胞:⽤不含EDTA的胰酶消化收集后(注:胰酶消化时间不宜过长,否则会影响细胞膜上磷脂酰丝氨酸与Annexin V-FITC的结合),于室温2000rpm离⼼5~10分钟,收集细胞)(3)细胞洗涤:⽤预冷1×PBS(4℃)重悬细胞⼀次,2000rpm离⼼5~10分钟,洗涤细胞;(4)加⼊300µL 的1×Binding Buffer 悬浮细胞;(5)Annexin V-FITC标记:加⼊5µL的Annexin V-FITC混匀后,避光,室温孵育15分钟;(6)PI标记:上机前5分钟再加⼊5µL的PI染⾊。
细胞凋亡试剂盒使用说明书 - 专业提供基因,重组蛋白,抗体

细胞凋亡试剂盒使用说明书目录号:CSB-AP11921h本试剂盒仅供研究使用概述细胞凋亡是细胞的基本特征之一,在机体的胚胎发育、组织修复、内环境的稳定等方面都起到十分重要的作用。
在正常细胞中磷脂酰丝氨酸(PS)分布在细胞膜脂质双层的内侧,而在细胞凋亡早期,细胞膜中的磷脂酰丝氨酸(PS)由脂膜内侧翻向外侧。
此磷脂酰丝氨酸可与Annexin V, 一种分子量为35~36kD的Ca2+依赖性磷脂结合蛋白以高度亲和力相结合。
凋亡后期死亡的细胞与其它因素死亡的细胞,虽都可与A nnexin V结合,但死亡的细胞其细胞膜通透,也可被碘化丙啶(Propidium Iodide, PI),一种核酸染料染成红色。
如将Annexin V标以荧光素(RPE、FITC等)作为荧光探针,结合PI, 利用荧光显微镜或流式细胞仪检测,就可以将处于不同凋亡时期的细胞区分开来。
试剂盒组成及试剂配制1.Annexin V-FITC:保存在Tris-HCl (20mM), NaCl(50mM) 缓冲液中,含1mg/ml BSA和0.09% NaN3。
2.Binding Buffer:Hepes(10 mM) /NaOH (pH 7.4), NaCl (140 mM),CaCl2(2.5 mM). 经0.2μm孔径过滤器除菌。
2–8℃保存。
3.Propidium Iodida(PI):50 ug/ml 溶于PBS (pH7.4)中。
操作步骤实验开始前,请提前配置好所有试剂,试剂或样品稀释时,均需混匀,混匀时尽量避免起泡。
1.悬浮细胞离心(350g, 3 min)收集;贴壁细胞用不含EDTA的胰酶消化收集(胰酶消化时间不易过长,以防引起假阳性);2.用PBS洗涤细胞二次(350g, 3 min),计数细胞,每样0.1ml 含1~5×105细胞;3.用400μL Binding Buffer悬浮细胞;4.加入5μL Annexin V-FITC, 混匀,加入5 μL Propidium Iodide,混匀;5.室温避光反应10 min;6.荧光显微镜下观察或用流式细胞仪检测。
Annexin V 凋亡检测试剂盒说明书_PF032

Annexin V-FITC Apoptosis Detection Kit目录货号PF032包装包装::1 试剂盒组分组分::100次检测形式形式::流式细胞仪或荧光显微镜检测方法检测方法::荧光测定种属特异性种属特异性::可适用于许多种属储存储存::Annexin V-FITC 试剂盒组分用干冰运输,4°C 储存。
为了防止由于沾在管盖上造成的试剂损失,移除管盖前需要轻轻旋转使沾在管盖上的液体落入管内。
请参考注意事项和操作建议。
适用范围适用范围::Calbiochem® Annexin V-FITC Apoptosis Detection 试剂盒是一种非同位素检测方法,可以检测伴随着细胞死亡发生的细胞膜的变化。
检测手段包括流式细胞仪或荧光显微镜。
背景背景::凋亡是细胞死亡的一种基本形式,它在胚胎发育,组织分化和一些疾病发生过程中起着重要的调控作用。
在正常细胞中,磷脂酰丝氨酸(PS )位于细胞膜内侧,一旦发生细胞凋亡,可以从细胞膜的内侧迅速翻转到细胞膜外侧,使得PS 暴露在细胞膜表面。
在体内,巨噬细胞可以识别翻转到细胞膜表面的PS 从而将这些程序性死亡的细胞清除,因此凋亡过程中并不伴随局部的炎症反应,而在细胞坏死的过程中则常常伴随着炎症反应。
在体外可以用PS 与抗凝血剂annexin V 的相互作用检测外翻的PS 。
在Ca2+存在的情况下,annexin V 与PS 有很高的亲和力,可以与之迅速结合。
PS 外翻发生在细胞核破裂,DNA 片段化以及凋亡相关蛋白出现之前,这使得annexin V 与PS 的结合成为凋亡早期的一种重要检测标志事件。
检测原理检测原理::在该方法中,基于流式细胞仪和荧光显微镜,FITC 标记的annexin V 可以用来检测细胞凋亡。
由于细胞坏死的过程中也会发生细胞膜通透性增强,坏死的细胞同样也会结合annexin V-FITC 。
因此,propidium iodide (PI )被用来区分存活的早期细胞和坏死或晚期凋亡细胞。
bd annexin凋亡实验步骤

bd annexin凋亡实验步骤
进行bd annexin凋亡实验的步骤通常包括以下几个主要环节:
1. 细胞处理,首先,需要处理细胞样本。
这可能涉及到细胞培养、细胞分离、冻存细胞等步骤,具体操作会根据实验的具体要求
和样本类型而有所不同。
2. 细胞处理,将处理后的细胞进行处理,包括用PBS洗涤细胞、用缓冲液悬浮细胞等操作。
3. 细胞标记,接下来,需要使用BD Annexin V染色试剂盒对
细胞进行染色标记。
这通常涉及到使用BD Annexin V染色液和PI (荧光素)染色液,根据厂家提供的操作手册进行染色操作。
4. 流式细胞术,将标记后的细胞进行流式细胞术分析。
这包括
使用流式细胞仪进行数据采集和分析,根据细胞标记的不同,可以
区分出不同的细胞亚群,如存活细胞、凋亡细胞等。
5. 数据分析,最后,需要对流式细胞术得到的数据进行分析,
包括细胞凋亡率的计算和数据的统计学处理。
需要注意的是,在进行实验前,需要仔细阅读BD Annexin V染色试剂盒的操作手册,严格按照操作要求进行操作。
此外,实验过程中需要注意细胞的处理和操作要在无菌条件下进行,以确保实验结果的准确性和可靠性。
同时,实验过程中也需要注意个人防护,避免对染色试剂和细胞样本造成污染。
希望这些信息能够对你有所帮助。
AnnexinV凋亡试剂盒一般染色检测方法1.把将被染色分析的细胞用冷PBS...

Annexin V凋亡试剂盒一般染色检测方法1.把将被染色分析的细胞用冷PBS洗涤二次并在恰当的染色缓冲液(binding buffer)中以1 x 106 细胞/mL的浓度重悬。
(染色缓冲液,binding buffer,中必须含有钙离子)2.吸取100ul的细胞(1 x 105)至试管中。
(必须在室温下进行)3.加入适量的荧光标记的annexin V试剂和PI。
(必须在室温下进行)4.混匀后避光室温下孵育15分钟。
(必须在室温下进行)5. 孵育后加入400ul染色缓冲液,立即上流式细胞仪分析。
(实验必须在一小时内完成,否则无意义!)我们推荐另外制备三个质控样本来设定流式细胞仪的荧光补偿和设置十字门的范围:a) 没有染色的细胞;b) 仅用荧光标记的annexin V染色的细胞;c) 仅用PI染色的细胞.annexin V和PI双阳性可以说明细胞群体中含有死亡细胞。
我们推荐可以使用一个细胞系来制备以上三个对照管来作为annexin V和PI阳性染色对照。
可以使用在RPMI +10% FCS + 2-4 ng/mL的TNF-a孵育2-3小时的人U-937细胞,或在培养液中孵育1-2小时鼠淋巴细胞作为对照细胞。
请依据以下建议来正确设置仪器补偿。
以下方案可以根据不同的细胞类型稍加修改。
在流式细胞仪上分析经染色的细胞:使用流式细胞仪正确分析annexin V-FITC和PI双标的细胞要求仪器的荧光补偿来去除两种染料激发光之间的叠加。
因为荧光补偿设置与PMT的电压直接相关,所以不同仪器之间的补偿不同。
我们建议在实验开始阶段分析单染的细胞来调整荧光补偿去除光谱重叠。
1. 上样未经染色的细胞,在线性FS-SS点图上显示细胞并设门圈出目标细胞群体。
注意:细胞在经培养后光散射信号会发生变化。
要注意使用侧向散射光设门来识别出这些已改变的细胞。
2.建立LogFL1-LogFL2双参数点图并分析以上光散射图中设门的细胞;保证>98%的细胞处于在X、Y轴Log 1为边界的左下象限中心区域。
流式细胞仪检测细胞凋亡Annexin VPI双染色法

流式细胞仪检测细胞凋亡——Annexin V/PI双染色法
实验步骤
1. 细胞收集:悬浮细胞直接收集到10ml的离心管中,每样本细胞数为(1~5)×106,/mL 500~1000r/min离心5min,弃去培养液。
2. 用孵育缓冲液洗涤1次,500~1000r/min离心5min。
3. 用100ul的标记溶液重悬细胞,室温下避光孵育10~15min。
4. 500~1000r/min离心5min沉淀细胞孵育缓冲液洗1次。
5. 加入荧光(SA-FLOUS)溶液4℃下孵育20min,避光并不时振动。
6. 流式细胞仪分析:流式细胞仪激发光波长用488nm,用一波长为515nm 的通带滤器检测FITC荧光,另一波长大于560nm的滤器检测PI。
7. 结果判断:凋亡细胞对所有用于细胞活性鉴定的染料如PI有抗染性,坏死细胞则不能。
细胞膜有损伤的细胞的DNA可被PI着染产生红色荧光,而细胞膜保持完好的细胞则不会有红色荧光产生。
因此,在细胞凋亡的早期PI不会着染而没有红色荧光信号。
正常活细胞与此相似。
在双变量流式细胞仪的散点图上,左下象限显示活细胞,为(FITC-/PI-);右上象限是非活细胞,即坏死细胞,为(FITC+/PI+);而右下象限为凋亡细胞,显现(FITC+/PI-)。
MA0429 Annexin V-PE 7-AAD细胞凋亡检测试剂盒使用说明书

Annexin V-PE/7-AAD Apoptosis detection Kit Annexin V-PE/7-AAD细胞凋亡检测试剂盒产品编号:MA0429 规格:50T/ 100T产品内容产品组成MA0429-50T MA0429-100TAnnexin V-PE 250μl500μl7-AAD 500μl1mlBinding Buffer(10×) 25ml 50ml说明书 1 份 1 份产品简介本试剂盒用于检测细胞凋亡早期的发生,其中Annexin V为胞内蛋白膜联蛋白家族成员,以钙离子依赖的方式选择性与磷脂酰丝氨酸(PS)结合。
PS 正常分布在细胞膜内侧,即与细胞浆相邻的一侧。
在细胞发生凋亡的早期,不同类型的细胞都会把PS外翻到细胞膜外侧。
用带有PE标记的Annexin V,即Annexin V-PE,就可以通过流式细胞仪或荧光显微镜检测到PS 外翻这一细胞凋亡的重要特征。
7-氨基放线菌素D(7-AAD)是一种非浸入性染料,可以用来检测无活性的细胞。
它不能通过正常质膜,随着细胞凋亡、细胞死亡过程,质膜对7-AAD的通透性逐渐增加。
染料一旦进入细胞,它将结合到细胞内DNA分子上,在合适波长激发光的激发下发出明亮的红色荧光。
7-AAD同PI有着相似的荧光特性,但其发射波谱较PI窄,对其他检测通道的干扰更小,在多色荧光分析中是PI的最佳替代品,可与Annexin V-FITC/PE联合使用。
将Annexin V-PE与7-AAD联合使用时,7-AAD被排除在活细胞(Annexin V-/7-AAD-)和早期凋亡细胞(Annexin V+/7-AAD-)外,而晚期凋亡细胞和坏死细胞同时被PE和7-AAD 结合染色呈现双阳性(Annexin V+/7-AAD+)。
PE最大吸收波长为565nm,发射波长为575nm。
7-AAD可被488 nm氩离子激光激发,发射波长为647nm。
保存条件2-8℃避光保存,一年有效。
Annexin V-PE 7-AAD 荧光双染细胞凋亡检测试剂盒说明书

Annexin V-PE / 7-AAD 荧光双染细胞凋亡检测试剂盒货号:P-CA-206规格: 20Assays / 50Assays / 100Assays / 200Assays产品编号成分20Assays50Assays100Assays200Assays StorageP-CA-105Annexin V-PE 染色液100 μL250 μL500 μL 1 mL 2~8℃.避光P-CA-151Annexin V Binding Buffer(10×) 1.4 mL×2 5.5 mL 11 mL 11 mL×2 2~8°CP-CA-1627-AAD染色液100 μL250 μL500 μL 1 mL -5~-20℃, 避光说明书一份保存条件7-AAD染色液适当分装后-5~-20℃可保存1年,其他试剂2~8℃可保存1年。
Annexin V-PE禁止冷冻保存。
实验原理Annexin V-PE / 7-AAD荧光双染细胞凋亡检测试剂盒,可用于检测悬浮细胞和贴壁细胞的凋亡。
Annexin V是一种钙离子依赖性磷脂结合蛋白,与磷脂酰丝氨酸(PS) 有高度亲和力。
当细胞发生凋亡时,膜内侧的磷脂酰丝氨酸(PS) 外翻到膜表面,而被荧光染料PE标记的Annexin V结合,可通过流式细胞仪或荧光显微镜进行检测。
由于凋亡晚期或坏死细胞膜丧失完整性,而7-氨基放线菌素D(7-Amino Actinomycin D, 7-AAD)可与双链DNA特异性结合并产生强烈的荧光,与Annexin V搭配使用,可区分处于不同凋亡时期的细胞。
本试剂盒检测喜树碱诱导的Jurkat细胞凋亡效果如下图所示:Jurkat细胞用 5 μM喜树碱(Camptothecin)(左) 或未加药(右) 处理4 h,本试剂盒染色后流式检测。
Annexin V-PE单阳细胞为早期凋亡细胞,AnnexinV-PE和7-AAD双阳细胞为坏死或晚期凋亡细胞,7-AAD单阳细胞为裸核细胞。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
请在使用前仔细阅读说明书
Annexin V,FITC 凋亡检测试剂盒(100次)
产品名称货号规格储存条件运输条件
Annexin V,FITC结合物AD01-10 100次×1 0-5℃,避光(切勿冻存) 室温
PI Solution AD02-05 50次×2 0-5℃,避光(切勿冻存) 室温
10×Annexin V Binding Buffer AD03-05 50次×2 0-5℃,避光(切勿冻存) 室温
*注:规格中的每“次”是以细胞浓度1×106 cells/ml计算
产品描述
细胞凋亡是指为维持有机体内环境稳定,由基因控制的细胞自主的有序的死亡。
正常情况下任何细胞在形成过程中发生的异常都会通过凋亡消除。
例如体内的癌细胞增长为肿瘤的过程会受细胞凋亡的引导而被抑制。
然而在抑癌基因p53出现问题时,凋亡就不会诱导发生,从而导致癌细胞的不断增长。
细胞凋亡可以通过细胞形态的变化或生物化学的变化来检测。
目前常用的指标有caspase活性变化、DNA碎片、磷脂酰丝氨酸的外翻等。
Annexin V染色的细胞可以用于检测细胞凋亡早期的细胞膜变化。
在细胞凋亡早期,膜磷脂酰丝氨酸由脂膜内侧翻向外侧。
Annexin V 是一种分子量为35~36kD的Ca2+依赖性磷脂结合蛋白,与磷脂酰丝氨酸有高度亲和力,可通过细胞外侧暴露的磷脂酰丝氨酸与凋亡早期细胞的胞膜特异性结合,因此Annexin V 被作为检测细胞早期凋亡的灵敏指标之一。
用绿色荧光FITC标记的Annexin V 通过流式细胞仪或荧光显微镜可以检测到细胞凋亡的发生。
碘化丙啶(Propidium Iodide, PI)是一种核酸染料,PI只能透过凋亡晚期和死细胞的细胞膜,因此Annexin V和PI结合使用,可以区分凋亡早晚期的细胞及死细胞。
所需的设备和材料
-合适量程的移液枪-样品和诱导剂
-细胞培养用6,12,24,96孔板-PBS、去离子水
-流式细胞仪或荧光显微镜。
*最大激发/发射波长Annexin V,FITC:494 nm/518 nm; PI:535 nm/617 nm
溶液制备
1×Annexin V Binding solution
-将10×Annexin V Binding Buffer用蒸馏水稀释10倍。
稳定性
试剂盒在0-5°下可以保存6个月,请避光保存Annexin V,FITC结合物。
操作流程
Ⅰ.悬浮细胞的操作流程
(Ⅰ)诱导凋亡的操作步骤
1.制备细胞(Jurkat cell)悬液(1×106 cells/ml)
2.加入终浓度为1 μg/ml的凋亡诱导剂(Staurosuporine)
3.在37℃下培养3.5 h。
* Staurosuporine用于诱导Jurkat cell凋亡。
最佳诱导条件请根据实验的细胞类型与诱导剂调整。
(Ⅱ)Annexin V染色操作步骤
1.将细胞悬液转移到离心管中,1,000 rpm离心3 min,取出上清液。
2.加入PBS,1,000 rpm离心3 min,去除上清液。
再重复本步操作一次。
3.用之前准备好的1×Annexin V Binding Solution制备细胞终浓度为1×106 cells/ml的细胞悬液。
* 细胞悬液体积根据实验目的自行调整,一般推荐不少于500 μl细胞悬液。
4.取100 μl步骤3中制备的细胞悬液,加入到一个新的tube中。
5.向细胞悬液中加入5 μl Annexin V,FITC结合物,再加入5 μl PI Solution。
6.室温下避光培养15 min。
7.加入400 μl 1×Annexin V Binding Solution,请在在1小时内检测。
Ⅱ. 贴壁细胞的操作流程
(Ⅰ)诱导凋亡的操作步骤
1.制备细胞(Caco-2)悬液(1×106 cells/ml)
将细胞悬液接种到培养皿或者培养板中。
2.在5% CO2培养箱中37℃预培养。
3.加入终浓度为25 μmol/ml的凋亡诱导剂(Cisplatin)
4.37℃培养4 days。
*Cisplatin用于诱导Caco-2 cell凋亡。
最佳的诱导条件请根据实验的细胞类型与诱导剂调整。
(Ⅱ)Annexin V染色操作步骤
1.弃去培养皿或培养板中的上清液。
2.用PBS洗细胞2次。
3.用胰蛋白酶消化细胞。
4.用适量的培养基或PBS将细胞悬液转移至离心管中。
5.1,000 rpm离心3 min,弃上清。
6.加入PBS后1,000 rpm离心3 min,弃上清。
重复本步操作一遍。
7.加入预先配好的1×Annexin V Binding Solution,制成终浓度为1×106 cells/ml的细胞悬液。
* 细胞悬液体积根据实验目的自行调整,一般推荐不少于500 μl细胞悬液。
8.取100 μl步骤7中的细胞悬液,加入到新的tube中。
9.向细胞悬液中加入5 μl Annexin V,FITC结合物,再加入5 μl的PI Solution。
10.室温下避光培养15 min。
11.加入400 μl 1×Annexin V Binding Solution,请在1小时内检测。
Ⅲ. 设定的对照
1.未染色细胞。
2. Annexin V-FITC染色细胞(没有PI)。
3.PI染色细胞(没有Annexin V-FITC)。
Ⅳ. 流式细胞仪检测
加样到流式细胞仪检测,激发波长E x=488 nm; 发射波长E m=530 nm。
Annexin V-FITC的绿色荧光通过FITC通道(FL1)检测;PI的红色荧光通过PI 通道(FL2 或FL3)检测(建议使用FL3)。
Ⅴ. 荧光显微镜检测
将细胞悬液滴到玻片上,置于显微镜上使用合适的滤光片检测。
*由于EDTA会对细胞膜的特定部位有损伤,建议使用不含EDTA的胰酶消化贴壁细胞。
注意事项
1.PI有潜在的致癌性,操作时请特别注意并采取必要的防护措施。
2.Annexin V,FITC和PI均对光敏感。
所有染色过程和培养过程均需避光。
3.若细胞收集过程中使用胰酶,需设法去除残留的胰酶,这些胰酶会消化并降解Annexin V-FITC,最终导致染色失败。
实验实例
a.staurosporine诱导凋亡的图像
b.对照组(无staurosporine处理)
图1. staurosporine诱导Jurkat细胞凋亡的图像
a.参照(无Staurosporine处理)
b. Staurosporine诱导的凋亡
图2. Staurosporine诱导凋亡后的活细胞数量(FITC/PI 二维点阵图;细胞:Jurkat)
a.参照(无paclitaxel处理)
b.Paclitaxel诱导的凋亡。
图3.paclitaxel诱导凋亡后的活细胞数量(FITC/PI 二维点阵图;细胞:MDA-MB-231)图2、3中诱导凋亡组(b)显示早期细胞凋亡区域(Q4)比无凋亡组该区域(a)的细胞数量更多。
处于凋亡晚期的细胞数量也可以被观察到(Q2),几乎所有细胞的凋亡情况都可以观测到。
