(完整版)化学物质与蛋白质的相互作用总结,推荐文档
蛋白质相互作用的研究

蛋白质相互作用的研究蛋白质是大分子生物化学中的重要组成部分。
它们主要由氨基酸组成,并且在生物体系中发挥着重要的功能。
在细胞内部,蛋白质相互作用是维持细胞生命周期稳定性的关键因素。
因此,蛋白质相互作用的研究,在生物化学、生物物理学和分子生物学等多个领域中都是一个重要的研究方向。
本文将从蛋白质相互作用的定义开始,逐步探讨蛋白质相互作用的分类、特点以及相关的实验技术和研究方法,以期为读者提供系统而又全面的知识储备。
一、蛋白质相互作用的定义蛋白质相互作用是指两个或多个蛋白质之间在生物体系中的结合和相互作用过程。
这种相互作用可以使两个蛋白质之间形成复合体,从而发挥一定的生物功能。
相互作用的结果可能是稳定性增加、功能的调节或协同作用,也可能是抵消性和竞争性作用等不同结果。
二、蛋白质相互作用的分类按参与蛋白质数量,蛋白质相互作用可分为二元、三元、多元相互作用。
其中二元相互作用是指两个蛋白质共同形成复合体,三元相互作用是指三个蛋白质之间形成复合体,而多元相互作用则指多个蛋白质一起结合形成复合体的过程。
按作用原理和机制的不同,蛋白质相互作用可分为静态相互作用和动态相互作用。
静态相互作用的结构相对稳定,很难被破坏或改变,并且其功能一般比较固定。
而动态相互作用则是动态的,随着生理条件的不同呈现出多样的结构和功能特征。
例如,蛋白酶的底物结合就属于动态相互作用的范畴。
三、蛋白质相互作用的特点蛋白质相互作用具有多种特征,最为突出的是其特殊的结构、不确定性和多样性。
其一,蛋白质相互作用形式多样,可以是氢键、离子键、范德华力、疏水作用等多种作用方式。
例如,氢键是通过氢原子与质子和δ-带有部位的非氢原子之间的相互作用而形成的共价化学键,是一种常见的相互作用方式。
其二,蛋白质相互作用具有不确定性。
与单独的蛋白质分子相比,蛋白质相互作用更加难以准确预测。
因为它不仅取决于相互作用双方的结构和性质,还取决于周围环境的作用和影响。
波动的温度、离子浓度和pH值等环境因素都会对蛋白质相互作用的过程和结构产生较大影响。
蛋白质相互作用

蛋白质相互作用与代谢性疾病
蛋白质相互作用在心血管疾病中发挥重要作用,如动脉粥样硬化的发生和发展。
心血管疾病
蛋白质相互作用也与自身免疫性疾病的发病有关,如类风湿性关节炎和系统性红斑狼疮中的免疫细胞信号转导。
自身免疫性疾病
蛋白质相互作用与其他疾病
蛋白质相互作用的干预策略
06
基于小分子的干预策略
总结词:通过小分子调节蛋白质相互作用,改变蛋白质复合物的组成或活性,从而调控细胞功能。
蛋白质相互作用与神经退行性疾病
肥胖症
蛋白质相互作用也与肥胖症的发生有关,如脂肪细胞分化、脂肪代谢等过程中的蛋白质相互作用。
非酒精性脂肪肝
蛋白质相互作用还涉及非酒精性脂肪肝的发病机制,如脂肪酸氧化和甘油三酯的积累。
糖尿病
蛋白质相互作用在糖尿病的发生发展中起到重要作用,如胰岛素与其受体之间的相互作用和信号转导。
蛋白质磷酸化修饰对相互作用的调控
去乙酰化酶抑制剂可以抑制去乙酰化酶的活性,从而增强乙酰化修饰的作用,促进蛋白质相互作用。这些抑制剂在癌症治疗和其他疾病治疗中具有潜在的应用价值。
乙酰化是一种通过将乙酰基团添加到蛋白质的特定氨基酸残基上,如赖氨酸和精氨酸,来调节蛋白质活性和功能的过程。这种修饰通常由乙酰化酶和去乙酰化酶催化。
结构生物学方法
VS
通过计算机模拟蛋白质的动态行为,预测蛋白质相互作用的模式和稳定性。
序列比对和进化分析
通过比较不同物种间同源蛋白质的序列差异,推断相互作用的可能性和进化关系。
分子动力学模拟
计算生物学方法
蛋白质相互作用网络
03Biblioteka 通过将两个蛋白质分别与两个转录激活因子融合,在酵母细胞中检测它们之间的相互作用。
生物学中的蛋白质相互作用

生物学中的蛋白质相互作用生物学是一门研究生命现象的科学,其中最基本的单位是细胞。
而蛋白质是细胞内的基本分子,它们在细胞内担负着各种各样的功能,甚至可以说是生命的基础。
在细胞内,蛋白质与蛋白质之间相互作用,进而调节和控制着细胞的生命现象。
而这些相互作用的本质,就是蛋白质相互作用。
蛋白质相互作用可以分为许多种类,最常见的就是酶-底物互作用、配体-受体互作用、蛋白质-蛋白质互作用等。
这些互作用通常涉及到蛋白质的空间结构和化学性质,其中最为关键的就是氨基酸残基之间的相互作用。
氨基酸残基是构成蛋白质的基本单位,它们通过不同的键和相互作用连接在一起,形成了蛋白质的空间结构。
蛋白质的功能往往取决于其空间结构,而氨基酸残基之间的相互作用则是维持蛋白质空间结构的重要原因之一。
常见的氨基酸残基相互作用包括疏水作用、离子键、氢键、范德华力等。
其中,疏水作用是最为普遍的一种相互作用,它可以使得氨基酸残基在水中更倾向于聚集在一起,从而促进蛋白质的折叠和稳定性。
而离子键、氢键等相互作用则可以提供更多的交错和穿插方式,进而使得蛋白质的空间结构更加多样化和灵活。
除了氨基酸残基之间的相互作用外,蛋白质之间的相互作用也是生物学中不可或缺的一部分。
例如,许多酶就是由多个蛋白质组成的复合体,它们之间的互作用可以调节酶的活性和催化效率。
同样,许多细胞信号途径也是由多个蛋白质组成的复合物,它们之间的相互作用可以促进信号传递和细胞功能的调节。
在研究生物学中的蛋白质相互作用时,科学家通常会利用许多实验手段进行研究。
例如,X-射线晶体学可以用来测定蛋白质的空间结构,核磁共振技术则可以用来研究蛋白质之间的相互作用。
此外,还可以利用生物芯片技术、蛋白质亲和层析技术等工具来探究蛋白质之间的互作性质和生物学功能。
最近几年,人工智能技术的发展也为研究蛋白质相互作用带来了新的突破。
例如,深度学习、机器学习等技术可以用来预测蛋白质之间的相互作用,并探究它们的生物学功能。
蛋白质与蛋白质的相互作用

蛋白质与蛋白质的相互作用蛋白质是生命体中最重要的一类分子,它们在生物体内起着结构支持、信号传导、催化反应、运输、抗体等重要功能。
蛋白质的功能需要依赖它们的三维形态以及与其他分子的相互作用。
蛋白质与蛋白质之间的相互作用是实现这些功能的关键,它们可以是弱的非共价相互作用,也可以是强的共价键结。
蛋白质与蛋白质之间的非共价相互作用主要包括氢键、范德华力、疏水作用和离子相互作用。
其中氢键是蛋白质对结构和稳定性具有重要影响的相互作用方式之一、氢键是指氢原子与电负性原子的其中一个电子对形成的相互作用。
在蛋白质中,常见的氢键形式包括酸氨基(COOH)与氨基(NH2)之间的氢键,以及酰胺中相邻相对的氨基之间的氢键。
这种氢键的形成不仅可以使蛋白质维持稳定的空间结构,还可以在蛋白质的功能过程中提供靶向性的相互作用。
范德华力是非共价相互作用中的一种力量,它是由于分子中电子的运动而产生的瞬时电偶极矩引起的相互作用。
这种相互作用力量与分子之间的距离的6次方成反比,因此只在分子接近时才能发挥作用。
在蛋白质与蛋白质的相互作用中,范德华力可以通过蛋白质的表面和周围溶液中的蛋白质相互作用,从而促进蛋白质的合并和组装。
疏水作用是一种特殊的非共价相互作用,它是由于蛋白质内部的疏水性氨基酸和周围水分子之间的相互作用引起的。
疏水作用主要是通过疏水氨基酸的亲水性残基聚集在一起形成疏水芯与周围的水分子隔离。
这种疏水芯可以在蛋白质的折叠过程中起到关键的结构稳定作用,并且在蛋白质的功能过程中也起到起到重要的作用。
离子相互作用是通过带电的氨基酸残基之间的静电相互作用产生的。
酸性氨基酸残基(如谷氨酸和天冬酰胺酸)具有负电荷,而碱性氨基酸残基(如赖氨酸和精氨酸)具有正电荷。
这些正负电荷之间的相互作用可以使蛋白质形成稳定的空间结构。
此外,离子相互作用还可以通过电荷相互吸引来实现蛋白质与其他分子的结合。
除了以上所述的非共价相互作用,蛋白质之间还可以通过共价键结进行相互作用。
第六章化学物质与蛋白质的相互作用讲解

2、氧化剂
各种氧化剂能够氧化芳香族侧链的氨基酸以及甲硫氨 酸、半胱氨酸和胱氨酸残基。其中酪氨酸侧链的酚羟 基可以被氧化成醌,后者可以与蛋白质表面的巯基、 氨基发生迈克尔加成反应形成交联产物。在碱性条件 下,半胱氨酸可以被Cu2+氧化成次磺酸或亚磺酸或磺 酸半胱氨酸。
分子氧、H2O2以及过氧化物(如过氧甲酸)、氧自由 基等是最常见的氧化剂,在生物体内,蛋白质的氧化 失活主要是通过活性氧(羟基自由基、超氧离子、过 氧化氢、过氧化物)来完成的。这些氧化剂的杀菌作 用主要也是造成蛋白质失活。
固定化:将酶或蛋白质多点连接于载体上(无机载 体、高分子载体);
添加剂:保护蛋白质(酶)不受氧化剂氧化、不受 变性剂变性等
化学修饰:共价交联,使蛋白质构象固化。
பைடு நூலகம்溶剂
稳定剂
抗氧化剂 底物、辅酶 金属离子 化学交联剂
糖类,醇 半胱氨酸, 氨基酸及 2-巯基乙醇 其衍生物 还原谷胱甘 无机盐, 肽,二巯基 甘油,聚 赤藓醇等巯 乙二醇等 基试剂可防 常用1-4M 止巯基氧化 浓度共溶 植物抗氧化 剂来稳定 剂如儿茶酚 蛋白质和 黄酮等也具 细胞器。 有保护作用
三、化学物质对蛋白质的稳定作用
蛋白质的稳定性是指蛋白质抵抗各种因素的影响,保持其 生物活性的能力。根据生物体内蛋白质等存在的状态,可 以利用化学物质或化学方法使蛋白质稳定化,以有利于蛋 白质在体外的应用。
通过研究蛋白质的变性及稳定性,可以了解蛋白质的结构 功能与稳定性的关系等。
在蛋白质(酶)分离、纯化、储藏和应用中,可以 通过化学方法使蛋白质稳定。其中常用的方法有以 下几种:
化学物质对蛋白质的稳定作用
一、蛋白质不可逆失活的化学因素
强酸和强碱 氧化剂 表面活性剂 变性剂 重金属离子
化学物质与蛋白质的相互作用共54页

ቤተ መጻሕፍቲ ባይዱ
化学物质与蛋白质的相互作用
16、自己选择的路、跪着也要把它走 完。 17、一般情况下)不想三年以后的事, 只想现 在的事 。现在 有成就 ,以后 才能更 辉煌。
18、敢于向黑暗宣战的人,心里必须 充满光 明。 19、学习的关键--重复。
20、懦弱的人只会裹足不前,莽撞的 人只能 引为烧 身,只 有真正 勇敢的 人才能 所向披 靡。
6、最大的骄傲于最大的自卑都表示心灵的最软弱无力。——斯宾诺莎 7、自知之明是最难得的知识。——西班牙 8、勇气通往天堂,怯懦通往地狱。——塞内加 9、有时候读书是一种巧妙地避开思考的方法。——赫尔普斯 10、阅读一切好书如同和过去最杰出的人谈话。——笛卡儿
第六章 化学物质与蛋白质的相互作用..

金属离子沉淀法的优点是它们在稀溶液中对蛋白质
有效强的沉淀能力。处理后残余的金属离子可用离 子交换树脂或螯合剂除去。
Ba2+和Mn2+,而Cu2+,Fe2+,Pb2+,Hg2+等较 少应用,因为它们会使产品损失和引起污染。如 Zn 2+ 可用于沉淀杆菌肽 ( 作用于第 4 个组氨酸残基 上)和胰岛素;Ca2+(CaCO 3)用于分离乳酸,血清 清蛋白等。
在蛋白质的内部也存在极少量的亲水残基,在蛋白质分子的表面也常 见到一些疏水的残基。这些“异常”分布的残基,致使肽链的局部结 构发生“扭曲”,一些键的张角与一般正常的值有所偏离,蛋白质中 这些局部的构象具有相对偏高的能量,相对地处于较不稳定的状态, 在外界很小的扰动作用下,就能发生变化。 原则上,一些相对规则的-螺旋和-折叠分布在球状蛋白的内部,而 且压积得很紧密,致使球状蛋白成为致密的结构;那些连接 -螺旋和 - 折叠叠的规整性相对差一些的二级结构,转角和环状以及特定的 “无规”卷曲,则更多地是分布在球状蛋白的外周。
硫氧还蛋白的结构
紧密结合水
亲水性残基
疏水性残基
第一节 化学物质对蛋白质的沉淀作用
由于蛋白质的分子量很大,它在水中能够形成胶体溶 液。蛋白质溶液具有胶体溶液的典型性质,如丁达尔 现象、布郎运动等。由于胶体溶液中的蛋白质不能通 过半透膜,因此可以应用透析法将非蛋白的小分子杂 质除去。 根据蛋白质的亲水胶体性质,当其环境发生改变时, 蛋白质会发生沉淀作用。 蛋白质胶体溶液的稳定性与它的分子量大小、所带的 电荷和水化作用有关。改变溶液的条件,将影响蛋白 质的溶解性质。在适当的条件下,蛋白质能够从溶液 中沉淀出来。
蛋白质的相互作用

蛋白质的相互作用蛋白质是生命体内重要的生物大分子,具有多种生物学功能,包括催化化学反应、传递信号和提供结构支持等。
为了完成这些功能,蛋白质必须与其他分子相互作用。
蛋白质的相互作用可以分为四类:蛋白质与蛋白质的相互作用、蛋白质与核酸的相互作用、蛋白质与小分子的相互作用以及蛋白质与膜的相互作用。
在这些相互作用中,蛋白质通常与其他分子发生非共价作用,如氢键、离子键和疏水相互作用等。
蛋白质与蛋白质的相互作用是细胞中最常见的相互作用类型之一、蛋白质与蛋白质之间的相互作用可以形成复合物,这些复合物在调节和执行细胞内的生物学功能中起着关键作用。
例如,酶与底物的结合形成酶底物复合物,从而催化化学反应。
蛋白质与蛋白质还可以发生互相激活或抑制,这在细胞信号转导过程中尤为重要。
蛋白质与核酸的相互作用也是生物体内常见的一种相互作用类型。
DNA与蛋白质之间的相互作用在基因转录和DNA复制过程中起着关键作用。
这些相互作用可以通过蛋白质与DNA的顺序特异性识别实现。
同样,RNA与蛋白质之间的相互作用在RNA的转录、剪接和翻译等过程中也起到重要作用。
这些相互作用可以通过互补配对和其他非共价作用实现。
蛋白质与小分子的相互作用是细胞内许多生物活性分子的机制。
蛋白质可以通过与小分子结合而改变其构象和功能。
举例来说,抗生素与靶标蛋白质的相互作用是通过结合并抑制细菌的生长和繁殖。
蛋白质与小分子的相互作用还广泛存在于细胞信号途径中,这种相互作用可以改变蛋白质的构象,从而影响信号传递的过程。
蛋白质与膜的相互作用是细胞内一种重要的相互作用类型。
细胞膜是由脂质双层组成的,蛋白质与膜之间的相互作用决定了细胞膜的功能。
蛋白质可以通过其跨膜区域与膜相互作用,从而在细胞内传递信号或形成通道。
蛋白质还可以通过与细胞膜的外层相互作用来参与细胞黏附和信号转导等过程。
总的来说,蛋白质的相互作用对于细胞的生理过程至关重要。
蛋白质可以通过与其他分子的相互作用来实现其功能,从而使细胞可以生长、分裂和完成各种生物学过程。
蛋白质 相互作用

蛋白质相互作用
蛋白质相互作用是指两种或以上的蛋白质结合的过程。
这种结合通常是为了执行其特定的生化功能,如DNA复制、信号传递等。
在细胞中,大量的蛋白质元件组成分子机器,通过蛋白质相互作用来执行细胞内多数重要的分子过程。
蛋白质复合体是蛋白质通过长时间交互作用形成的,它们负责携带另一个蛋白质,例如从细胞质至细胞核,或反之。
此外,短暂的交互作用可以修饰另一个蛋白质,例如蛋白激酶将磷酸盐转移到目标蛋白上。
蛋白质相互作用广泛参与了生物化学、量子化学、分子动力学、讯息传递等代谢或遗传学/表观遗传学过程。
它是所有活体细胞中整个交互作用组学系
统的核心,主宰了活体细胞内几乎所有的生化反应。
蛋白质相互作用的基础是它们表面的原子尺度特征,这些特征能够与其他物质的原子尺度特征产生吸引或排斥。
如果两种蛋白质的表面特征能够精确匹配并相互吸引,它们就可以结合在一起。
这种结合需要单个原子尺度上的空间位置能匹配,比钟表齿轮的啮合还要精密得多。
以上内容仅供参考,如需更多专业信息,建议查阅相关文献或咨询生物学家。
化学物质与蛋白质的相互作用总结
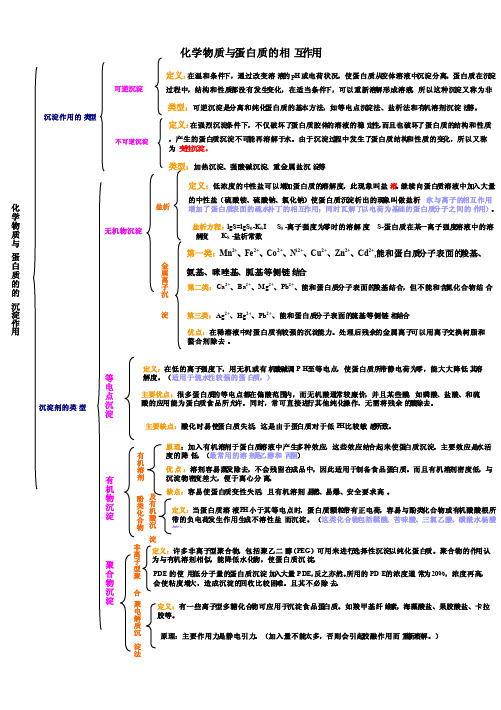
化学物质与蛋白质的相互作用化学物质与蛋白质的的沉淀作用 沉淀作用的类型 可逆沉淀 定义:在温和条件下,通过改变溶液的pH 或电荷状况,使蛋白质从胶体溶液中沉淀分离。
蛋白质在沉淀过程中,结构和性质都没有发生变化,在适当条件下,可以重新溶解形成溶液,所以这种沉淀又称为非变性沉淀。
类型:可逆沉淀是分离和纯化蛋白质的基本方法,如等电点沉淀法、盐析法和有机溶剂沉淀法等。
不可逆沉淀 定义:在强烈沉淀条件下,不仅破坏了蛋白质胶体的溶液的稳定性,而且也破坏了蛋白质的结构和性质,产生的蛋白质沉淀不可能再溶解于水。
由于沉淀过程中发生了蛋白质结构和性质的变化,所以又称为变性沉淀。
类型:加热沉淀、强酸碱沉淀、重金属盐沉淀等 沉淀剂的类型无机物沉淀 盐析 定义:低浓度的中性盐可以增加蛋白质的溶解度,此现象叫盐溶。
继续向蛋白质溶液中加入大量的中性盐(硫酸铵、硫酸钠、氯化钠)使蛋白质沉淀析出的现象叫做盐析(水与离子的相互作用增加了蛋白质表面的疏水补丁的相互作用;同时瓦解了以电荷为基础的蛋白质分子之间的作用)。
盐析方程:lgS=lgS 0-K S I S 0 -离子强度为零时的溶解度 S-蛋白质在某一离子强度溶液中的溶解度 K S -盐析常数 第一类:Mn 2+、Fe 2+、Co 2+、N i2+、Cu 2+、Zn 2+、Cd 2+,能和蛋白质分子表面的羧基、氨基、咪唑基、胍基等侧链结合 金属离子沉淀法第二类:Ca 2+、Ba 2+、Mg 2+、Pb 2+、能和蛋白质分子表面的羧基结合,但不能和含氮化合物结合 第三类:Ag 2+、Hg 2+、Pb 2+、能和蛋白质分子表面的巯基等侧链相结合 优点:在稀溶液中对蛋白质有较强的沉淀能力。
处理后残余的金属离子可以用离子交换树脂和螯合剂除去。
质谱分析蛋白质的相互作用

蛋白质间的相互作用存在于生物体每个细胞的生命活动过程中,互交叉形成网络,成细胞中一系列重要生理活动的基础。
其中,多数蛋白质是通过与配体分子结合或者是作为1个大的生物复合体的一部分,与细胞完整性维持、遗传物质复制、基因表达调控、信号转导、免疫应答等一系列生命过程。
研究蛋白质间相互作用的方式和程度,将有助于蛋白质功能的分析、疾病致病机理的阐明和治疗和新型药物的开发等众多难题的解决。
因此,确定蛋白质间相互作用关系、绘制相互作用图谱已成为蛋白质组学研究的热点。
近年来有许多方法被用于蛋白质相互作用的研究,酵母双杂交技术,免疫共沉淀技术,串联亲和纯化技术,化学交联技术,蛋白质芯片技术,荧光共振能量转移技术,噬菌体展示技术等。
酵母双杂交技术Fields和song等首先在研究真核基因转录调控中建立起来的,是在真核细胞中检测蛋白质与蛋白质之间的相互作用的方法。
该系统是通过两个分别称之为“诱饵蛋白”和“捕获蛋白”的融合蛋白形成一个完整的转录激活因子,从而激活报告基因的表达,通过在营养缺陷型培养基上生长或呈现显色反应来检测系统的功能。
酵母双杂交系统可在全基因组规模上进行蛋白质一蛋白质相互作用高通量的研究。
免疫共沉淀技术免疫共沉淀是利用抗原和抗体的特异性结合以及细菌的Protein A或G特异性地结合到免疫球蛋白的Fc片段的现象开发出来的方法。
其基本原理是,在细胞裂解液中加入抗兴趣蛋白的抗体,孵育后再加入与抗体特异结合的结合于Agarose珠上的Protein A或G,若细胞中有与兴趣蛋白结合的目的蛋白,就可以形成这样一种复合物:“目的蛋白—兴趣蛋白—抗兴趣蛋白抗体—Protein A或G”,经变性聚丙烯酰胺凝胶电泳,复合物又被分开。
然后经免疫印迹或质谱检测目的蛋白。
这种方法得到的目的蛋白是在细胞内与兴趣蛋白天然结合的,符合体内实际情况,得到的结果可信度高。
这种方法常用于测定两种目标蛋白质是否在体内结合;也可用于确定一种特定蛋白质的新的作用搭档。
化学物质与蛋白质的相互作用总结
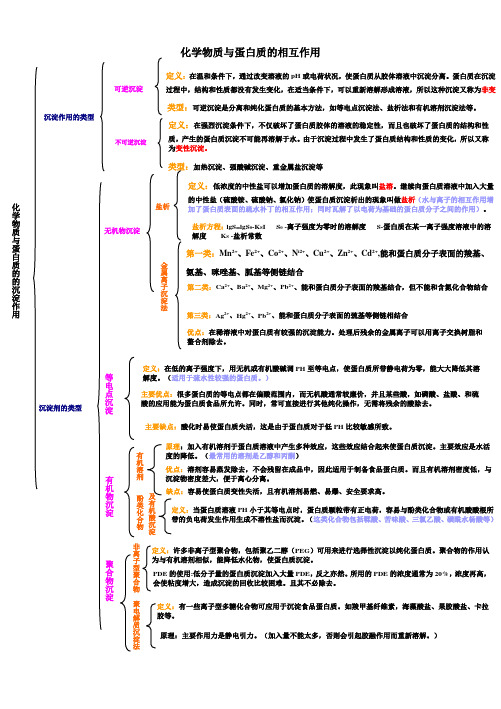
化学物质与蛋白质的相互作用化学物质与蛋白质的的沉淀作用 沉淀作用的类型 可逆沉淀 定义:在温和条件下,通过改变溶液的pH 或电荷状况,使蛋白质从胶体溶液中沉淀分离。
蛋白质在沉淀过程中,结构和性质都没有发生变化,在适当条件下,可以重新溶解形成溶液,所以这种沉淀又称为非变性沉淀。
类型:可逆沉淀是分离和纯化蛋白质的基本方法,如等电点沉淀法、盐析法和有机溶剂沉淀法等。
不可逆沉淀 定义:在强烈沉淀条件下,不仅破坏了蛋白质胶体的溶液的稳定性,而且也破坏了蛋白质的结构和性质,产生的蛋白质沉淀不可能再溶解于水。
由于沉淀过程中发生了蛋白质结构和性质的变化,所以又称为变性沉淀。
类型:加热沉淀、强酸碱沉淀、重金属盐沉淀等 沉淀剂的类型无机物沉淀 盐析 定义:低浓度的中性盐可以增加蛋白质的溶解度,此现象叫盐溶。
继续向蛋白质溶液中加入大量的中性盐(硫酸铵、硫酸钠、氯化钠)使蛋白质沉淀析出的现象叫做盐析(水与离子的相互作用增加了蛋白质表面的疏水补丁的相互作用;同时瓦解了以电荷为基础的蛋白质分子之间的作用)。
盐析方程:lgS=lgS 0-K S I S 0 -离子强度为零时的溶解度 S-蛋白质在某一离子强度溶液中的溶解度 K S -盐析常数第一类:Mn 2+、Fe 2+、Co 2+、N i2+、Cu 2+、Zn 2+、Cd 2+,能和蛋白质分子表面的羧基、氨基、咪唑基、胍基等侧链结合 金属离子沉淀法 第二类:Ca 2+、Ba 2+、Mg 2+、Pb 2+、能和蛋白质分子表面的羧基结合,但不能和含氮化合物结合 第三类:Ag 2+、Hg 2+、Pb 2+、能和蛋白质分子表面的巯基等侧链相结合 优点:在稀溶液中对蛋白质有较强的沉淀能力。
处理后残余的金属离子可以用离子交换树脂和螯合剂除去。
等电点沉淀 定义:在低的离子强度下,用无机或有机酸碱调PH 至等电点,使蛋白质所带静电荷为零,能大大降低其溶解度。
(适用于巯水性较强的蛋白质。
化合物蛋白质相互作用mse

化合物蛋白质相互作用mse
蛋白质与化合物之间的相互作用是生物化学领域的重要研究课题。
蛋白质是生物体内最重要的功能分子之一,而化合物可以是药物、激素、营养物质等。
蛋白质和化合物之间的相互作用可以影响
药物的疗效、毒性以及生物体内的代谢过程。
首先,蛋白质与化合物之间的相互作用可以发生在蛋白质的活
性位点上。
一些化合物可以与蛋白质的活性位点结合,从而影响蛋
白质的功能。
这种相互作用可以是竞争性的,也可以是非竞争性的,对于药物研发和设计具有重要意义。
其次,蛋白质与化合物之间的相互作用也可以通过蛋白质的构
象变化来实现。
一些化合物可以与蛋白质结合后改变其构象,从而
影响其功能。
这种相互作用对于理解蛋白质的结构与功能关系具有
重要意义。
此外,蛋白质与化合物之间的相互作用还可以影响信号传导通路、代谢途径等生物学过程。
一些化合物可以通过与特定蛋白质相
互作用来调节细胞内的信号传导通路,从而影响细胞的生理功能。
总的来说,蛋白质与化合物之间的相互作用是一个复杂而重要的研究领域,涉及药物研发、生物化学、分子生物学等多个学科领域。
深入研究这种相互作用对于理解生物体内的生物化学过程,发现新药物以及改善药物疗效具有重要意义。
化学物质与蛋白质的相互作用54页PPT

6、最大的骄傲于最大的自卑都表示心灵的最软弱无力。——斯宾诺莎 7、自知之明是最难得的知识。——西班牙 8、勇气通往天堂,怯懦通往地狱。——塞内加 9、有时候读书是一种巧妙地避开思考的方法。——赫尔普斯 10、阅读一切好书如同和过的相互作用
51、没有哪个社会可以制订一部永远 适用的 宪法, 甚至一 条永远 适用的 法律。 ——杰 斐逊 52、法律源于人的自卫本能。——英 格索尔
53、人们通常会发现,法律就是这样 一种的 网,触 犯法律 的人, 小的可 以穿网 而过, 大的可 以破网 而出, 只有中 等的才 会坠入 网中。 ——申 斯通 54、法律就是法律它是一座雄伟的大 夏,庇 护着我 们大家 ;它的 每一块 砖石都 垒在另 一块砖 石上。 ——高 尔斯华 绥 55、今天的法律未必明天仍是法律。 ——罗·伯顿
第六章化学物质与蛋白质的相互作用.

2、氧化剂
各种氧化剂能够氧化芳香族侧链的氨基酸以及甲硫氨
酸、半胱氨酸和胱氨酸残基。其中酪氨酸侧链的酚羟 基可以被氧化成醌,后者可以与蛋白质表面的巯基、 氨基发生迈克尔加成反应形成交联产物。在碱性条件 下,半胱氨酸可以被Cu2+氧化成次磺酸或亚磺酸或磺 酸半胱氨酸。 分子氧、H2O2以及过氧化物(如过氧甲酸)、氧自由 基等是最常见的氧化剂,在生物体内,蛋白质的氧化 失活主要是通过活性氧(羟基自由基、超氧离子、过 氧化氢、过氧化物)来完成的。这些氧化剂的杀菌作 用主要也是造成蛋白质失活。
(3)螯合剂
结合金属离子的试剂,如 EDTA 等可以使金属酶、金属蛋白
失活,这是因为EDTA与金属离子形成配位复合物,从而使 酶失去金属辅助因子造成的。
失去金属辅助因子的酶或蛋白质可以引起蛋白质构象发生较
大改变,导致蛋白质活力不,使那些不 需要金属离子的蛋白质稳定。
3、去污剂和表面活性剂
去污剂一般分为离子型和非离子型两大类,都具有
长链疏水尾和亲水的极性头。当少量的阴离子去污 剂(如十二烷基硫酸钠,SDS )单体加入到蛋白质 溶液中时,去污剂与蛋白质表面的疏水区域结合, 随着加入量增加,与蛋白质的结合位点达到饱和, 这时去污剂则以协同方式结合于蛋白质其它位点, 导致蛋白质伸展,分子内部的疏水性氨基酸残基暴 露,并进一步与去污剂结合,直到达到饱和为止, 从而使蛋白质发生不可逆变性。
4、变性剂
(1)脲和盐酸胍
高浓度脲(8-10mol/L)和盐酸胍(6
mol/L)常常用于蛋白质变性和 复性研究,由于脲或盐酸胍与蛋白质多肽链作用,破坏了蛋白质分子内 维持其二级结构和高级结构的氢键,引起蛋白质不可逆失活。
(2)有机溶剂
水互溶有机溶剂可以使酶、蛋白质失去活性,是
第六章 化学物质与蛋白质的相互作用3-4节

6、胍基的化学修饰
• 丁二酮和1,2-环己酮与胍基反应可逆地形成精氨酸-丁二酮复 合物,该产物可以与硼酸结合而稳定下来。 • 苯乙二醛是最早用来对精氨酸残基进行修饰的,通常是两个 分子的苯乙二醛与1个精氨酸残基不可逆地结合,该试剂与 α-氨基也有一定反应性。 • 4-羟基-3-硝基苯乙二醛在温和条件下修饰精氨酸残基,具有 光吸收性质,可使被修饰的精氨酸残基在405nm处具有光吸 收效应。 • 对硝基苯乙二醛修饰精氨酸残基可以得到唯一的产物
瑞利散射的实验支持
• 如右图所示,将强光源S所发出的光束入射到装满水的玻 璃容器上,水内加上几滴牛奶使之成为浑浊物质,光通过 这类物质后发生散射,从正侧方向(垂直于入射光的传播 方向,如Z方向)观察时,散射光带青蓝色,即此入射光 含有较多的短波;从面对入射光的方向(X方向)看,则 通过容器的光显得比较红。
• 溴苯是一种重要的肝脏毒物,进入体内后经细胞色素 P450作用形成溴苯-3,4-环氧化物,可与蛋白质、DNA等 共价结合。
4、与血红蛋白的共价结合
• 外源化合物进入血液后,可与红细胞膜结合而进入红细胞 内与血红蛋白发生共价结合。其中血红蛋白氨基酸中的氨 基、巯基易与外源化合物发生共价结合。 • 烷基化试剂可与血红蛋白末端氨基酸的氨基、半胱氨酸的 巯基以及组氨酸咪唑环上N1或N3共价结合。 • 环氧乙烷、环氧丙烷可与血红蛋白中组氨酸、末端氨基酸 残基共价结合; • 4-氨基联苯、苯胺经体内代谢氧化后可与半胱氨酸的巯基 结合。
三、亲和性标记
• 亲和标记试剂,这些化合物是具有化合反应性的蛋白质分 子的底物或配体的类似物。由于结构的相似性,它们对底 物或配体的结合部位具有一定的亲和性,因而能够选择性 地结合在蛋白质分子共价结合。 • 这类试剂具有饱和性,与底物或天然配体竞争蛋白质分子 的结合位点。 • 亲和性标记试剂中最重要的是光亲和标记和自杀性抑制剂 (见第七章)
