课题1、生活中常见的盐
课题1 生活中常见的盐1

其它盐类水下沉。
这些物质间
5、H2SO4 + BaCl2-------6、Ba(OH)2+ KCl -------7、CuSO4 + NH4NO3----8、HNO3 + NaOH -------
能否反应
【思考】
1、AgNO3 + HCl -------2、 K2CO3+ Ca(OH)2--3、Na2CO3+ CaCl2 ----4、Na2SO4 + HCl ------5、H2SO4 + BaCl2------6、Ba(OH)2+ KCl -----7、CuSO4 + NH4NO3--8、HNO3 + NaOH -----
附录 1 部分酸、碱和盐的溶解性表(20摄氏度) P111
盐类溶水性顺口溜: 【思考】1、AgNO3 + HCl ----------
钾钠硝铵盐溶水快,
2、 K2CO3+ Ca(OH)2-----
硫酸盐除了钡银钙,
3、Na2CO3+ CaCl2 --------
氯化物只有氯化银,
4、Na2SO4 + HCl ----------
课题 1 生活中常见的盐 课题2 化学肥料
食盐
常见的盐
食盐 明矾晶体
五水硫酸铜晶体
用钡餐观察 肠内情况
石盐标本
一、氯化钠
氯化钠日常生活用于调味和腌菜、肉,医 药上的生理盐水0.9%的氯化钠溶液,工业上是 化工原料,制取氯气、盐酸、纯碱。
我国食盐产地
我国食盐的产地分布很广,出产着种类繁多的 盐:海盐、井盐、岩盐、池盐等。其中辽宁、 山东、两淮、长芦各盐场盛产海盐,自古闻名。 井盐则以四川自贡市的自流井最为有名,岩盐 产于四川、云南、等地。在青海、新疆、内蒙 古等地有很多咸水湖,盛产池盐,其中最大的 是柴达木盆地的察尔汗盐池,据统计,仅这一 盐池开采出来的池盐,足够我国十二亿人口食 用四千多年。
课题1、生活中常见的盐

课题1 生活中常见的盐一、氯化钠(NaCl)1、俗名:食盐2、存在:海水、盐湖、盐井、盐矿3、制取:晾晒——海水煮——盐井、盐湖水开采——盐矿4、用途(1)调味、腌渍食品(2)生理盐水(3)化工原料5、粗盐提纯(1)称量(2)溶解(3)过滤(4)蒸发二、碳酸钠(Na2CO3)、碳酸氢钠(NaHCO3)、碳酸钙(CaCO3)(一)碳酸钠(Na2CO3)1、俗名:纯碱,苏打2、性质:白色粉末,易溶于水,水溶液显碱性3、用途:生产玻璃,造纸,纺织,洗涤剂等。
(二)碳酸氢钠(NaHCO3)1、俗名:小苏打2、性质:白色粉末,易溶于水,水溶液显碱性3、用途:食品添加剂、制药品等。
(三)碳酸钙(CaCO3)——大理石、石灰石的主要成分1、性质:白色固体,难溶于水。
2、用途:(1)建筑材料(2)补钙剂3、CO32-的鉴别(1)取样品滴加稀盐酸,(2)将产生的气体通入澄清石灰水,(3)澄清石灰水变浑浊,则含有CO32-例:Na2CO3 +2HCl= 2NaCl + H2O + CO2↑CaCO3 + 2HCl = CaCl2 + H2O + CO2↑CO2 + Ca(OH)2 = CaCO3↓+ H2O三、盐溶液相似的化学性质1、盐+金属→另一种金属+另一种盐条件:在金属活动顺序中,只有排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来。
Fe + CuSO4 = FeSO4 + Cu硫酸铜硫酸亚铁Cu + Hg(NO3)2 = Cu(NO3)2 + Hg 硝酸汞硝酸铜2、盐+酸→另一种盐+另一种酸HCl + AgNO3 = AgCl ↓+ HNO3硝酸银氯化银2HCl + BaCO3 = BaCl2 + H2O + CO2↑碳酸钡氯化钡H2SO4 + BaCl2 = BaSO4↓+ 2HCl3、盐+碱→另一种盐+另一种碱2NaOH + CuSO4 = Cu(OH)2 ↓+ Na2SO4硫酸铜氢氧化铜硫酸钠Ca(OH)2 + Na2CO3 = 2NaOH + CaCO3↓3NaOH + FeCl3 = Fe(OH)3 ↓+ 3NaCl氯化铁氢氧化铁4、盐+盐→另外两种盐AgNO3 + NaCl = AgCl↓+ NaNO3硝酸银氯化银硝酸钠BaCl2 + Na2SO4 = BaSO4 ↓+ 2NaCl氯化钡硫酸钠硫酸钡四、复分解反应1、复分解反应——由两种化合物互相交换成分,生成两种新的化合物的反应。
课题1 生活中常见的盐

四、复分解反应
2.条件/原因/理由 ①酸+碱/盐/金属氧化物:生成物中有沉淀或者气体或者 水;HCl + NaOH ;HCl + Na2CO3 ;HCl + Fe2O3 能反应 的原因; ②碱+盐、盐+盐:生成物中有沉淀或者气体或者水且反应 物都能溶于水;Na2CO3 + Ca(OH)2 ;NaCl + AgNO3 能反 应的原因;
Fe + CuSO4 = Cu + FeSO4 ②Cu和AgNO3溶液的反应:
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
三、盐的化学性质
2.盐 + 酸 → 新盐 + 新酸 (复分解反应 ) ①实验室制取CO2:
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ ②小苏打用于治疗胃酸过多:
②请找出生成KCl的方法; ③请找出生成NaOH的方法:
四、复分解反应
3.书写:相交换,价不变。
根据下列反应物写出生成物
HCl + NaOH ; Fe2O3 + HCl ; NaCl + AgNO3 ;
HCl + Na2CO3 ; Na2CO3 + Ca(OH)2 ;
四、复分解反应
4.复分解反应中生成物的特点 ①AB + CD → AD + CB;
生成物中阳离子来自于一种物质,阴离子来自于另一种 物质;
一、常见的盐
3.碳酸氢钠(NaHCO3) 俗称:小苏打; 用途:制糕点所用的发酵粉;治疗胃酸过多;
单元课题生活中常见的盐

称取粗 剩余粗 溶解粗 盐/g 盐/g 盐/g
5.0Leabharlann 1.73.3产率的计算
溶解的粗盐/g 精盐/g
精盐产率/ %
3.3
2.2
2.2 g ×100% 3.3g ≈66.7﹪
二、Na2C03、NaHC03、CaC03
Na2C03工业原料(玻璃、造纸、纺织和洗涤剂) NaHC03焙制糕点的发酵剂、治疗胃酸过多等 CaC03建筑材料(大理石、石灰石)
Na2C03+Ca(0H)2=CaC03↓+2Na0H
工业上:石灰(水)—纯碱法制烧碱 若现在只有石灰石、纯碱如何制得烧碱? 试着写出该过程有关的化学方程式。
Na2C03溶液能与下列物质共存吗?
×稀盐酸 澄清石灰水×
×稀硫酸 Ba(0H)2 ×
√ √ Na0H NaCl
Cu(0H)√2
•什么叫做盐?
•日常生活中所说的盐与化 学中的盐相同吗?
•你能举例说明吗?
第十一单元 盐 化肥
课题1 生活中常见的盐
1、认识几种常见的盐:NaCl Na2C03 NaHC03 CaC03 的性质及其用途 2、如何把粗盐提纯?
条件 3、什么叫复分解反应?你知道复分解反应在什么
下才能发生 ?
一、氯化钠(NaCl)
白色晶体 易溶于水 有咸味
{日常生活必需品
氯化钠的用途 重要的化工原料
假盐 亚硝酸钠(NaN02) 是一种工业用盐,有咸味,外形与食盐相似, 有毒。
粗盐中含有哪些杂质?
①含有不溶性杂质(泥沙等)
②含有较多的可溶性杂质 (MgCl2、CaCl2等)
过滤
粗盐的提纯步骤 ⑴溶解
⑵过滤
⑶蒸发
请思考:在整个实验过程中,玻璃棒使用 几次?作用相同吗?
课题1 生活中常见的盐

课题1 生活中常见的盐一、盐1.定义:含有金属离子(或铵根离子NH4+)与酸根离子的化合物叫做盐。
2.2极容易混淆,但它有毒性和碱性。
这些与氯化钠不同,要注意区分,防止误食引起中毒事件。
二、氯化钠3. 海水制盐:海水―(蒸发)→粗盐―(过滤)→精盐―(提纯)→纯净盐4.粗盐提纯操作:蒸发海水生产出的粗盐,含有泥沙等难溶性杂质及可溶性钙镁化合物(CaCl2、MgCl2等)。
难溶性的泥沙可以通过过滤除去,从而得到较纯的精盐。
但精盐仍含有一些可溶性的钙镁化合物。
步骤:溶解、过滤、蒸发结晶、计算产率。
①溶解——用玻璃棒搅动使粗盐溶解完全;②过滤——除去难溶性杂质泥沙。
注意过滤装置的“一贴、两低、三靠”要求(玻璃棒);③蒸发——除去水得到食盐。
蒸发中出现较多晶体时就停止加热,利用蒸发皿的余热使滤液蒸干,防止食盐晶体飞溅。
(玻璃棒:不断搅动,防止液体受热不均匀而飞溅)④计算产率——用玻璃棒将蒸发后所得的食盐晶体转移到滤纸上,然后放到托盘天平上进行称量。
(玻璃棒:将晶体转移)三、碳酸钠、碳酸氢钠和碳酸钙1. 碳酸钠(Na2CO3)俗名:纯碱、苏打;性质:白色固体,易溶于水;①水溶液呈碱性,能与酸溶液反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑②能与碱溶液(石灰水)反应:Na2CO3 + Ca(OH)2 == CaCO3↓+ 2NaOH③能与某些盐溶液反应:Na2CO3 + CaCl2 == CaCO3↓+ 2NaCl用途:用于造纸、玻璃、纺织和生产洗涤剂。
2. 碳酸氢钠(NaHCO3)俗名:小苏打性质:白色固体,易溶于水;①水溶液呈碱性,能与酸溶液反应: NaHCO3 + HCl == NaCl + H2O + CO2↑用途:焙制糕点时用于作发酵粉;在医疗上用于治疗胃酸过多。
3.碳酸钙(CaCO3)俗名:大理石、石灰石的主要成分性质:白色固体,难溶于水;能与酸溶液反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑用途:作建筑材料和装饰材料;可用于作补钙剂。
课题1-1 生活中常见的盐

一、氯化钠(NaCl)
①主要用途:调味品、腌渍食品、消毒,化工原 料。 ②制法:蒸发海水、盐湖水,井盐水。
二、碳酸钠、碳酸氢钠和碳酸钙
(1)Na2CO3:白色粉末,俗名:苏打、纯碱 (纯碱不是碱,它是盐) (2)NaHCO3:白色粉末, 俗名:小苏打。 (3)CaCO3:白色固体,石灰石、大理石主要成 分。 主要用途: (1)Na2CO3:玻璃、造纸、纺织和洗涤剂等。 (2)NaHCO3:糕点发酵粉,治疗胃酸过多等。 (3)CaCO3:建筑材料,补钙剂等。
第十一元 盐
化肥
课题1 生活中常见的盐
提到盐,同学们可能马上会想到食盐,其实,在化 学中,盐是指的一类化合物,即组成里含有金属离 子和酸根离子的化合物。如氯化钠、硫酸铜、碳酸 钠等。我国曾发生多次将工业用盐如亚硝酸钠误作 食盐用于烹饪而引起的中毒事件。原因就是混淆了 盐和食盐的概念。除食盐外,生活中常见的碳酸钠、 碳酸氢钠、高锰酸钾、大理石等都属于盐。
含有碳酸根离子或碳酸氢根离子的盐都能与盐酸反 应,生成二氧化碳气体。
未知物,加入少量稀盐酸,看能否 生成使澄清石灰水变浑浊的气体。
滴加 盐酸 通入澄清 石灰水中
未知物
产生气体
看澄清石 灰水是否 变浑浊
一、盐的分类
1.按盐中是否含有氧元素划分 无氧酸盐:NaCl、CaCl2 、MgCl2、 KCl 、Na2S 由后往前读作:“某”化“某” 含氧酸盐:Na2SO4 、KNO 3 、CaCO3、 K2SO4、 K3PO4 根据中心元素读作:“某”酸 “某” 2.另外根据盐的组成里所含阴、阳离子的特点, 可将盐分类并称为某盐
课题1_生活中常见的盐
H2SO4 Ba(NO3)
2
NaOH
H2SO4
Ba(NO3 √)2
NaOH √
K2CO3 √
白色沉淀 无现象 生成气体
无现象 √ 白色沉淀
无现象
K2CO3
我来归纳 盐的化学性质
(1) 盐 + 金属 = 新盐 + 新金属 置换反应
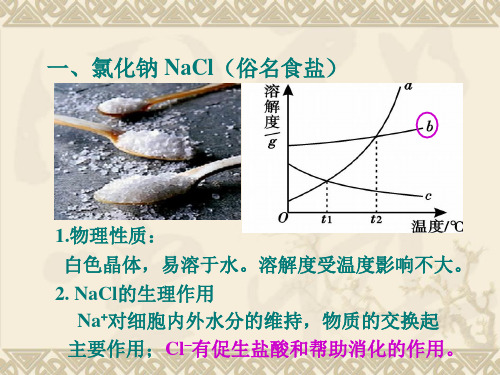
一、氯化钠 NaCl(俗名食盐)
1.物理性质: 白色晶体,易溶于水。溶解度受温度影响不大。 2. NaCl的生理作用
Na+对细胞内外水分的维持,物质的交换起 主要作用;Cl–有促生盐酸和帮助消化的作用。
氯化钠的用途
3. NaCl的用途
调味、腌制食品
配制生理盐水
选种
化工原料
消除积雪
4. 氯化钠的分布
(1)蒸发滤液析出的食盐未完全干燥即进行称量 (2)过滤后液体尚浑浊时,就进行蒸发水份 (3)称量或计算错误。
2、导致粗盐提纯后产率偏低的原因有哪些?
(1)粗盐没有完全溶解就进行过滤操作 (2)在过滤、蒸发过程中没有用玻璃棒引流或 搅拌不当造成液体溅失 (3)在蒸发皿、玻璃棒等处留有食盐等。
二、碳酸钠、碳酸氢钠和碳酸钙
Na2CO3能否与盐酸反应生成CO2?
Na2CO3++22HHCCl l==22NNaaCCl+l H+ 2HC2OO3 +CO2 ↑
⑶ 与澄清石灰水反应
CO2↑+H2O
现
产生白色沉淀
象 碳酸钠与氢氧化钙反应生成碳酸钙
Na分析2CO3+Ca(OH)2= CaCO3 +2NaOH
初中化学第十一单元课题1 课题1生活中常见的盐

是复分解反应,都有气体产生
复分解反应发生的条件
酸、碱、盐之间并不是 都能发生复分解反应。只有 当两种化合物互相交换成分, 生成物中有沉淀或有气体或 有水生成时,复分解反应才 可能发生。
酸、碱、盐之间的反应是复分解反应, 酸跟一些金属氧化物的反应也是复分解反应。
CuO + H2SO4 = CuSO4 + H2O CuO + 2HCl = CuCl2 + H2O Na2O + H2SO4 = Na2SO4 + H2O Na2O + 2HCl = 2NaCl + H2O Fe2O3 + 6 HCl =2 FeCl3 + 3 H2O Fe2O3 + 3 H2SO4 = Fe2(SO4)3 + 3 H2O
除食盐外,生活中你们还见过哪些盐?
碳酸钠(Na2CO3,俗称纯碱、苏打)
高锰酸钾(KMnO4)
虽然叫纯碱,溶液显
碱性,但不是碱是盐
碳酸氢钠(NaHCO3,又叫小苏打)
石灰石和大理石的主 要成分(CaCO3)
一、氯化钠( NaCl) 食盐的用途
调味品
医疗上的生理盐水是用 氯化钠配制的(100mL 生理盐水中含有0.9g医用 氯化钠)。
说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水, “挥”表示挥发性,“—”表示那种物质不存在或者遇到水就分解了。
一些不溶性碱的制取
2NaOH+MgCl2 =Mg(OH)2↓+2NaCl 3NaOH+AlCl3=Al(OH)3↓+3NaCl 2NaOH+FeSO4=Fe(OH)2↓+Na2SO4
碳酸氢钠是焙制糕点所用 的发酵粉的主要成分之一
课题1 生活中常见的盐

NaHCO3+HCl=NaCl+ CO2 ↑ +H2O
实验11-2
实验11-2 碳酸钠溶液+澄清石灰水 现象 出现白色沉淀 二者发生反应,生成一种难溶物
分析
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
Na2CO3+Ca(OH)2=CaCO3 ↓ +2NaOH Na2CO3+2HCl=2NaCl+ CO2↑ +H2O
讨论
迄今为止,在初中化学中,我们已经学习 了关于空气、氧气、水、碳、二氧化碳、氧化 铜、铁、铝、硫酸、氢氧化钠和氯化钠等一系 列物质的知识。为方便记忆和进一步学习,可 按组成和性质对学过的物质进行整理和分类, 例如: 1.根据物质组成是否单一,可以把物质分 成几类? 两类。混合物和纯净物。 2.在纯净物中,根据组成元素的异同,可 以把它们分成几类? 两类。单质和化合物。
金属 氧化物
①
酸
②
一 般 ①金属氧化物+酸→盐+水 不 需 ②酸+碱→盐+水(中和反应) 判 断
③酸+盐→新酸+新盐 需 要 判 断
碱
④
③
④碱+盐→新碱+新盐
盐
⑤
⑤盐+盐→两种新盐
课堂练习
1.判断下列反应能否发生,能发生反应的完 成化学方程式。
(1)氧化铜和盐酸 CuO+2HCl=CuCl2+H2O (2)氢氧化铜和硫酸Cu(OH)2+H2SO4=CuSO4+2H2O (3)盐酸和碳酸钙CaCO3+2HCl=CaCl2+H2O+CO2↑ (4)盐酸和硫酸钠 (5)硫酸和碳酸钾K2CO3+H2SO4=K2SO4+H2O+CO2↑ (6)硝酸钙和盐酸
生活中常见的盐完整版

25
Ba(NO3)2+H2SO4=BaSO4↓+2HNO3
BaSO4是一种白色沉淀,不溶于稀硝酸!
BaCl2 + Na2SO4=BaSO4↓+2NaCl
AgNO3 +HCl=AgCl↓+HNO3
AgCl是一种白色沉淀,不溶于稀硝酸!
AgNO3+NaCl=AgCl↓+NaNO3
AgCl、BaSO4不仅不溶于水,而且还不溶于稀 硝酸!其他沉淀一般都可溶于酸,例如CaCO3、 Cu(OH)2、Fe(OH)3等都可以溶于酸
FeCl3溶液+NaOH溶液
有红褐色沉淀生成
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
Fe(精O选Hp)pt3是一种红褐色沉淀 24
CuSO4溶液+BaCl2溶液 有白色沉淀生成
CuSO4+BaCl2=CuCl2+BaSO4 ↓
(3)盐溶液+盐溶液→新盐+新盐 (一般有沉淀生成)
精选ppt
精选ppt
12
2.过滤(过滤应注意:“一贴二低三靠”)
(1)叠好的滤纸放入漏斗后,应紧贴漏斗壁,中间不要 有气泡。否则过滤速度过慢。
(2)滤纸的边缘要比漏斗口稍低;倾倒液体时,使液体 沿着玻璃棒流下,液面要低于滤纸的边缘。
(3)盛有待过滤液的烧杯口紧靠玻璃棒中部; 玻璃棒下端紧靠三层滤纸一边,防止滤纸 破损,滤液浑浊;漏斗下端紧靠烧杯内壁, 防止液滴飞溅。
如果反应物中有酸参与,那么其他物质的水溶性可 不考虑,反应时可以是沉淀,也可以是溶液。
AgNO3 +HCl=AgCl↓+HNO3
Na2CO3+2HCl=2NaCl+H2O+CO2↑
高一化学生活中常见的盐
3、仪器不干净等
过滤操作要点:
一贴:将滤纸折叠成圆锥形,用水湿 润使其紧贴在漏斗内壁上,中间不要 留有气泡。 二低:滤纸要低于漏斗的边缘、漏斗 里的液面应低于滤纸的边缘。 三靠:过滤时玻璃棒的末端要轻轻靠 在三层滤纸的一边;盛过滤液的烧杯 口要紧靠在玻璃棒的中上端,漏斗的 最下端要紧贴在烧杯内壁上,以免滤 液飞溅。
NaHCO3 白色固体
溶解度 较大(易溶)
较小(易溶)
用途 去油污、玻璃工业 制发酵粉、治 疗胃酸过多
固体与同 量、同浓 度盐酸反 应
溶液与盐 酸反应现 象与滴加 顺序的关 系
碳酸钠
快,产生大量气 泡,产生的气体 使澄清石灰水 变浑浊
碳酸钠溶液中 逐滴滴加盐酸 时,先没有明显 现象,随着盐酸 的加入,慢慢出 现大量气泡
思考:在溶解、过滤、蒸发和转移 氯化钠中,四次用到玻璃棒,各起 什么作用?
答:溶解粗盐时用玻璃棒,其作用是
_加_快__溶__解__速__度_;
过滤粗盐水溶液时用玻璃棒,其作用
是_引__流__;
用蒸发皿蒸发滤液时用玻璃棒,其作
用_以__免_ 滤液浓缩时因局部过热; 而使液滴飞溅
第四次_转__移__固__体__
碳酸氢钠
更快,产生更多气 泡,产生的气体使 澄清石灰水变浑 浊
首先就有大量的 气泡,随着盐酸 的加入,产生的 气泡越来越少。
a.碳酸钠、碳酸氢钠遇酸产生 二氧化碳
Na2CO3+2HCl=2NaCl+H2O+CO2↑ NaHCO3+HCl=NaCl+H2O+CO2 ↑
b.碳酸钠溶液显碱性。 在碳酸钠溶液中滴加酚酞试液。 试液变红色.
课题1 生活中常见的盐

第四单元 盐 化肥 课题1 生活中常见的盐(第一课时)
课题1 生活中常见的盐 (第一课时)
创设情境:
同学们在家有没有做过饭 烧过菜?烧菜过程中应加那些调 味品?
生活中的盐常指的是哪种物质? 食盐(主要成分是NaCl)
知识拓展
同学们,我们化学中的盐是指组成里含有 金属离子和酸根离子的一类化合物,不仅仅指 食盐,而且有些盐是有毒的,如我国曾发生过 多起因误将工业用盐亚硝酸钠(NaNO2)当 作食盐用于烹调而引起的中毒事件。
碳酸钠(或碳酸氢钠)与盐
分 析
酸反应生成了CO2气体
〈设问〉 上面列出这些反应跟我们前面所学
的化合反应、分解反应、置换反应有那 些不同点?再比较这节课中所出现的几 个方程式,具有那些共同特征
归纳概念
1、复分解反应 由两种化合物互相交换成分,生成另外两种化 合物的反应。
〈讨论〉
1.酸和碱作用生成盐和水的反应是否也属于 复分解反应?为什么?
过渡
粗盐中含有较多的可溶性杂质和 不溶性杂质(如泥沙等),可以通过 什么方法除去泥沙等不溶性的杂质呢?
〈引导讨论〉
①粗盐初步提纯需要那些步骤? ②过滤器的准备需要那些仪器?
滤纸如何使用? 过滤操作时应注意那些问题? ③整个操作过程中玻璃棒的作用有那些?
消除疑虑
1.过滤后的液体仍浑浊的原因: •操作过程中液面可能高出滤纸的边缘 ②滤纸被玻璃棒捅破
2.产率偏低的原因: •溶解时未充分搅拌。 •蒸发时液体可能被溅出。
转移时固体可能洒落等。
课题1 生活中常见的盐 (第二课时)
创设情境:
〈提问〉 同学们看了这么多的图片, 知道它们是用什么材料做成的吗?
二、碳酸钠、碳酸氢钠和碳酸钙
课题1 生活中常见的盐

二、碳酸钠、碳酸氢钠和碳酸钙
1.碳酸钠(Na2CO3)
(1)俗名:纯碱、苏打 (2)纯碱不是碱,是盐(水溶液显碱性) (3)用途:玻璃、造纸、纺织和洗涤剂的生产等
2.碳酸氢钠(NaHCO3) (1)俗名:小苏打 (2)用途:焙制糕点、治疗胃酸过多
2NaHCO3====Na2CO3+H2O+CO2
氢氧化钙微溶,其余均为沉淀 (3)盐:钾盐、钠盐、铵盐、硝酸盐都可溶;
氯化物除AgCl难溶外,其余多数均可溶; 硫酸盐除BaSO4难溶,Ag2SO4、CaSO4微溶外,其余 多数可溶; 碳酸盐除碳酸钾、碳酸钠、碳酸铵可溶,其余都难溶。 注:BaSO4、AgCl 不溶于水,也不溶于酸 【钾钠铵硝溶,盐酸盐除银盐,硫酸盐除钡盐,碳酸盐溶钾钠铵】
【食盐的实用价值 】 (1)是化学工业的重要原料 (2)是人类生活中的重要调味品 (3)每天用淡盐开水漱口,可以预防各种口腔病。 (4)洗浴时,在水中加少量食盐,可使皮肤强健。 (5)豆腐易变质,如将食盐化在开水中,冷却后将豆腐 浸入,可保存数月。 (6)鲜花插入稀盐水里,可数日不谢。 (7)洗有颜色的衣服,先用5%盐水浸泡10分钟,然后 再洗,则不易掉色。 (8)洗有汗渍的白衣服,先在5%的盐水中揉一揉,再用 肥皂洗净,不易变黄。 (9)将胡萝卜砸碎拌上盐,可擦去衣服上的血迹。 (10)铜器生锈或出现黑点,用盐可以擦掉。
Na2CO3+2HCl====2NaCl+ CO2 ↑ +H2O NaHCO3+HCl====NaCl+ CO2 ↑ +H2O
2.与碱反应:
碳酸钠溶液+澄清石灰水
现象
出现白色沉淀
分析
二者发生反应,生成一种难溶物
