路易斯酸碱理论2014
路易斯酸

属于路易斯酸,但实际上路易斯酸这个名词多指那些不属于布朗斯特-劳里酸的路易斯酸。
路易斯酸的化学反应活性可以用软硬酸碱理论来判断。
科学家仍没有知道路易斯酸“强度”的通用定义,这是因为路易斯酸的强度与其特有的路易斯碱的反应特性有关。
一个模型曾以气态路易斯酸对氟离子的亲合能来预测路易斯酸的强度,从而得出在常见可分离出的路易斯酸中,以SbF5(五氟化锑)的路易斯酸酸性最强。
氟离子是“硬”的路易斯碱,氯离子及一些较“软”的路易斯碱,以及溶液中的路易斯酸性,都受到计算复杂的限制而较难研究。
酸根型配合物酸根型配合物(Ate complex)是指路易斯酸与特定的碱生成的中心原子价升高的盐。
英文有机化学命名法中,ate这个字是一个后辍,用在被描述的原子上。
例如,硼化合物的酸根型配合物被叫作borate硼酸盐。
因此,三甲基硼烷可和甲基锂反应生成酸根型配合物Me4B-Li+。
这个概念是由格奥尔格·维蒂希在1958年引入的。
相似地,路易斯碱可以生成鎓盐。
氯化铝是一种较强的路易斯酸,可以接受来自羟基、羰基等基团的孤对电子的配位,起酸催化作用,例如傅克反应、醇的分子内脱水等氯化铝氯化铝(aluminium chloride),化学式AlCl3,式量133.34,无色透明晶体或白色而微带浅黄色的结晶性粉末。
密度2.44g/cm³,熔点190℃(2.5大气压),沸点182.7℃,在177.8℃升华,氯化铝的蒸气或溶于非极性溶剂中或处于熔融状态时,都以共价的二聚分子Al2Cl6形式存在。
可溶于许多有机溶剂。
在空气中极易吸收水分并部分水解放出氯化氢而形成酸雾。
易溶于水并强烈水解,水溶液呈酸性。
溶于水,并生成六水物AlCl3·6H2O,密度2.398克/厘米3。
也溶于乙醇和乙醚,同时放出大量的热。
100℃时分解。
物质简介中文名称:氯化铝中文发音:lǜ huà lǚ英文别名:Aluminum chloride crystal,Aluminum chloride hexahydrate,Aluminum trichloride crystal化学式:AlCl3氯化铝(二聚体)的结构(也写做Al2Cl6)相对分子质量:133.34CAS登记号:7446-70-0管制信息:无水氯化铝,本品根据《危险化学品安全管理条例》受公安部门管性状:白色或微带浅黄色的结晶或粉末。
路易斯酸碱理论电子论

CH
C + H +338.9kJ mol-1
甲烷分子中C—H键的键能则为上述四个C—H键离解能 的平均值(415.3kJ•mol-1)。
(四)键的极性和极化性
► 非极性键:两个相同的原子形成的共价键,由于成键 电子云对称地分布在两个原子核之间,正电荷中心和 负电荷中心重合,这样的共价键没有极性,称为~
(七)碳原子的三种杂化
杂化轨道:由于原子间的相互影响,同一个原 子中参与成键的几个能量相近的原子轨道可 以重新组合,重新分配能量和空间方向,组 成数目相等的,成键能力更强的新的原子轨 道。
2Px 2Py 2Pz
2Px 2Py 2Pz
2S
激发 2S
杂化
基态
激发态
SP3 杂化态
2Pz SP2
2Py 2Pz SP
►(4)能量相近的原子轨道可以杂化,杂化轨 道的方向性更强,成键能力增大。
►(六)分子轨道理论
目前应用最广泛的是原子轨道线性组合法, 简称LCAO法。要点如下:
(1)以分子整体出发,认为分子中的电子围 绕整个分子在多核体系内运动,成键电子是 非定域的即离域的。
(2)分子轨道是原子轨道的线性组合,多少 个原子轨道组合成多少个分子轨道。
三、结构概念和结构理论
► (一)碳原子的四面体结构 荷兰化学家范霍夫和法国化学家勒贝尔分别独立提 出。现用X射线衍射法验证。
甲 烷 正 四 面 体 结 构
►(二)共价键
在原子间通过共用一对电子而形成的化学键 称为~
►配位键是一种特殊的共价键,其特点是形成 共价键的一对电子由一个原子提供。
►离子键
常以δ-表示,电负性较小的原子则带部分正电荷,以δ+ 表示。这样正负电荷中心不重合,构成一个偶极,有 一定的偶极矩。
lewis acid酸碱文献

lewis acid酸碱文献路易斯酸碱理论:理解化学相互作用的基础路易斯酸碱理论是化学中一个基本概念,它描述了电子对的转移或共享如何导致化学键的形成。
由吉尔伯特·N·路易斯于 1916 年提出,该理论为化学家提供了一个强大的框架来理解和预测化学反应。
路易斯酸:电子对受体路易斯酸被定义为能够接受电子对的物种。
它们通常具有空轨道或未成对电子,可以容纳来自另一个分子的电子。
典型的路易斯酸包括质子 (H+)、金属离子(例如 Fe3+)和硼烷 (BH3)。
路易斯碱:电子对给体路易斯碱是能够提供电子对的物种。
它们通常具有孤对电子,可以与路易斯酸共享。
常见的路易斯碱包括氢氧化物离子 (OH-)、氨 (NH3) 和水 (H2O)。
酸碱反应:电子对转移当路易斯酸和路易斯碱相遇时,它们可以发生酸碱反应,其中电子对从碱转移到酸。
这种转移导致形成一个新的化学键,称为酸碱键。
酸碱强度的量化路易斯酸和碱的强度可以通过它们电离或解离的程度来量化。
强酸完全电离,而强碱完全解离。
弱酸和弱碱则部分电离或解离。
酸碱反应的例子质子 (H+) 与氢氧化物离子 (OH-) 反应形成水 (H2O)。
二氧化碳 (CO2) 与水反应形成碳酸 (H2CO3)。
氨 (NH3) 与盐酸 (HCl) 反应形成氯化铵 (NH4Cl)。
路易斯酸碱理论的重要性路易斯酸碱理论在化学中至关重要,因为它为理解各种化学现象提供了基础,包括:化学键的形成和断裂酸碱平衡配位化学生物分子中的分子间相互作用该理论还用于预测化学反应的产物和平衡常数。
拓展应用:硬酸软碱理论硬酸软碱理论是路易斯酸碱理论的一种拓展,它考虑了反应物种的极化性。
硬酸是极性较大的酸,而软酸是极性较小的酸。
硬碱是极性较大的碱,而软碱是极性较小的碱。
硬酸和软碱倾向于相互反应,而硬酸和硬碱以及软酸和软碱也倾向于相互反应。
结论路易斯酸碱理论是化学中一个基本概念,它描述了电子对的转移或共享如何导致化学键的形成。
路易斯酸碱

路易斯酸碱路易斯酸碱概念的范围非常广泛。
常见的路易斯酸为有空轨道的分子或正离子,如AlCl3,BF3,FeCl3,ZnCl2,Ag+.,R,Br,NO2等。
路易斯碱为具有未共用时的分子或负离子,如NH3,ROH,X,OH,RO等。
路易斯酸具有接受电子对的能力,具有亲电性,因而它是亲电试剂。
路易斯碱具有给出电子对的能力,具有亲核性,是亲核试剂。
路易斯酸碱的强弱,即是试剂亲电性或亲核性的强弱。
因此,路易斯酸碱概念以及亲电、亲核概念,是学习有机反应机理必须掌握的基础概念。
有机化学中也常用路易斯所提出的概念来理解酸和碱,即凡是能接受外来电子对的都叫做酸,凡是能给予电子对的都叫做碱。
按此定义,路易斯碱就是布朗斯特定义的碱。
例如(5)式中的NH3,它可以接受质子,所以是布伦斯特定义的碱;但它在和H结合时,是它的氮原子给予一对电子而和H成键,所以它又是路易斯碱。
路易斯酸则和布朗斯特酸略有不同。
例如质子H,按布朗斯特定义它不是酸,按路易斯定义它能接受外来电子对所以是酸。
又例如,按布朗斯特定义,HCl、H2SO4等都是酸,但按路易斯定义,它们本身不能成为酸,它们所给出的质子才是酸。
反之,有些化合物按布朗斯特定义不是酸。
但按路易斯定义却是酸。
例如,在有机化学中常见的试剂氟化硼和三氯化铝在一般的有机化学资料中,一般泛称的酸碱,都是指按布朗斯特定义的酸碱。
当需要涉及路易斯酸碱概念时,则都专门指出它们是路易斯酸碱.1830年,阿伦尼乌斯从他自己的电离理论出发,提出酸和碱的定义,这就是现行初中课本教给我们的酸碱定义——“在水溶液中,电离时生成的阳离子全部是氢离子的化合物叫酸。
电离时生成的阴离子全部是氢氧根离子的化合物叫碱”。
到了高中,课本又告诉我们,在水溶液中,电离过程是“在水分子的作用下”发生的,所以,酸和碱的定义又变为——“在水溶液中,能电离出“水合氢离子”(H3O+)的化合物叫酸,能电离出“水合氢氧根离子”的化合物叫碱”。
酸碱理论简介

酸碱理论简介酸碱理论的研究,已经有两百多年的历史,最初,人们把有酸味,能使蓝色石蕊变红的物质叫酸;有涩味,使红色石蕊变蓝的叫碱。
1887年,提出了酸碱电离理论:凡是在水溶液中能够电离产生的物质叫作酸,能电离产生的物质叫作碱。
酸碱电离理论从物质的化学组成上揭示了酸碱的本质,并应用化学平衡原理找到了衡量酸碱强弱的定量标度,是人们对酸碱认识由现象到本质的一次质的飞跃,对化学的发展起了很大作用,而且至今仍然普遍应用。
但这个理论也有缺陷的,实际上并不是只有含的物质才具有碱性,如氨的水溶液也显碱性,可作为碱来中和酸。
酸碱电离理论另一个缺陷是将酸碱概念局限于水溶液体系,由于科学的进步和生产的发展,越来越多的反应在非水溶液中进行,对于非水体系的酸碱性,酸碱电离理论就无能为力了。
1923年,丹麦化学家布朗斯特(Bronsted)和英国化学家劳莱(Lowrey)进一步发展了酸碱理论,提出了酸碱质子理论(也叫质子理论)来理解酸碱的本质:凡是能给出质子的分子或离子称为酸,凡是能接受质子的分子或离子称为碱。
根据酸碱质子理论,酸和碱不是孤立的:酸=质子+碱这种对应情况属酸碱的共轭关系,左边的酸是右边碱的共轭酸,而右边碱是左边酸的共轭碱。
有的离子在某个共轭酸碱对中是酸,但在另一个共轭酸碱对中可能又变成碱。
酸碱质子理论不仅扩大了酸和碱的范围,还可以把电离理论中的电离作用、中和作用、水解作用、同离子效应等均看成是质子传递的酸碱中和作用。
但是,质子理论只限于质子的放出和接受,所以必须含有氢,不能解释不含氢的一类化合物的反应。
质子酸碱反应的实例质子理论拓展了酸碱概念。
它包括了所有显示碱性的物质,但是对于酸仍然限制在含氢的物质上,故酸碱反应也就只能局限于包含质子转移的反应。
1923年美国物理化学家路易斯(Lewis)又提出了另一种酸碱概念:"凡是能给出电子对的分子、离子或原子团都叫作碱,凡是能接受电子对的分子、离子或原子团都叫作酸"。
路易斯酸碱效应

路易斯酸碱效应一、引言路易斯酸碱效应是化学领域中的一个重要概念,它描述了酸和碱之间电子的转移过程。
这一概念由美国化学家吉尔伯特·劳伦斯·路易斯在1923年提出,相对于传统的布朗斯特酸碱理论,路易斯酸碱效应更为广泛适用。
本文将对路易斯酸碱效应进行全面、详细、完整且深入地探讨。
二、路易斯酸碱定义2.1 基本定义根据路易斯酸碱效应的定义,路易斯酸是指能够接受电子对的化合物或离子,而路易斯碱是指能够提供电子对的化合物或离子。
与传统的布朗斯特酸碱理论不同,路易斯酸碱不要求必须存在质子的转移。
2.2 酸和碱的例子常见的路易斯酸包括金属离子、阳离子以及具有不完全原子键的化合物,例如氯化铝(AlCl3)、硼三氯化物(BCl3)等。
而常见的路易斯碱包括孤对电子的氧、氮、硫等原子,例如水(H2O)、氨气(NH3)等。
三、路易斯酸碱反应路易斯酸碱反应是指路易斯酸和碱之间发生电子转移的化学反应。
在路易斯酸碱反应中,路易斯酸接受路易斯碱提供的电子对,从而形成酸碱加合物,也称为路易斯盐。
在这个过程中,路易斯酸和碱的物质性质发生了改变。
3.1 路易斯酸碱反应的例子一个经典的路易斯酸碱反应就是钙离子和氨气之间的反应:Ca2+ + 8NH3 → [Ca(NH3)8]2+在这个反应中,钙离子作为路易斯酸接受了氨气分子提供的两对电子,形成了配位数为8的路易斯酸碱加合物,也即[Ca(NH3)8]2+。
四、路易斯酸碱理论与布朗斯特酸碱理论的关系4.1 对比分析路易斯酸碱理论与布朗斯特酸碱理论有一些相似之处,都描述了酸和碱之间的相互作用。
然而,两者之间还存在一些关键的区别。
4.1.1 酸碱定义布朗斯特酸碱理论以质子的转移为基础,酸是能够提供质子的物质,碱是能够接受质子的物质。
而路易斯酸碱理论则更广泛,不要求存在质子的转移。
路易斯酸是能够接受电子对的物质,路易斯碱是能够提供电子对的物质。
4.1.2 范围的差异布朗斯特酸碱理论主要适用于溶液中的化学反应,而路易斯酸碱理论不仅适用于溶液中的反应,还适用于许多其他体系中的反应,如气相反应、固相反应等。
02-2 路易斯酸碱理论及应用

有机化学有机化学路易斯酸碱电子理论及其应用1酸碱的概念发展回顾路易斯酸碱理论在反应中的应用332路易斯酸碱电子理论主要内容一、酸碱的概念发展回顾1663年(英)Boyle R.酸具有酸味,能使蓝色石蕊变红;碱具有苦涩味,能使红色石蕊变蓝。
1781年(法)Lavoisier A L.酸是一类含氧化合物,氧——酸素。
19世纪初,HCl,HI等被发现;19世纪后期近代酸碱理论形成。
一、酸碱的概念发展回顾 19世纪后期近代酸碱理论形成A、1889年Arrhenius S A 水-离子论;20世纪B、Franklin FC. 溶剂论;C、Brönsted JN-Lowry TM. 质子论;D、Lewis GN. 电子论;E、Pearson RG.软硬酸碱理论。
一、酸碱的概念发展回顾阿伦乌尼斯Arrihenius离子论在水溶液中能电离出氢离子的物质称为酸; 能电离出氢氧根离子的物质称为碱。
局限性:不能解释非水体系和非溶剂体系的问题;一、酸碱的概念发展回顾二、路易斯酸碱电子理论Lewis GN二、路易斯酸碱电子理论Lewis GN 路易斯酸举例路易斯酸如:三氟化硼、三氯化铝(常用做催化剂);阳离子(氢质子、铵根离子、金属离子);过渡金属(铁、钴镍、釕、铑、钯)(做催化剂)等。
二、路易斯酸碱电子理论Lewis GN 路易斯碱举例路易斯碱如:分子(氨分子、有机胺、醇等含有孤对电子的原子或原子团);阴离子(卤素负离子、酸根离子)等。
二、路易斯酸碱电子理论Lewis GN三、路易斯酸碱理论在反应中的应用路易斯酸??路易斯碱?三、路易斯酸碱理论在反应中的应用AlCl3H小结3、路易斯碱 电子对供体路易斯酸碱;质子酸碱。
1、酸碱概念2、路易斯酸 电子对受体;常用做催化剂。
有机反应多为电子对(n,π)授受关系!谢谢!。
路易斯酸碱理论及化学反应速率
例1,指出下列反应中各物质的路易斯酸碱属性, 并标明反应类型。
Ni + 4CO = Ni(CO)4 CO2 + 2H2O = HCO3- + H30+ Ag(NH3)2+ + 2S2O32- = Ag(S2O3)23- + 2NH3 H2O + HF + BF3 = H3O+ + BF4CaSO4 + Na2CO3 = Na2SO4 + CaCO3
于 1 mol?dm-3 时的速率。
ki 与浓度无关,只与温度相关。(问题:与压力是否有关?)
化学反应级数
aA + bB
gG + hH
速率方程 ? i = ki [ c(A)]m [ c(B)]n
那么m 与 n 之和,为该反应的 反应级数。
该反应是(m + n)级反应,或者说对反应物 A 是 m 级反 应,对反应物 B 是 n 级反应。
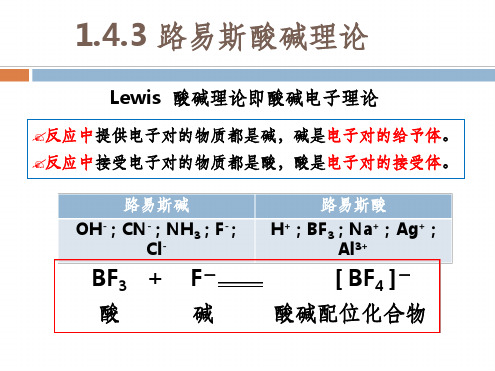
Al3+
[ BF4 ]- 酸碱配位化合物
路易斯酸碱反应的类型:
种类 酸碱加合反应
酸取代反应 取代反应 碱取代反应
双取代反应
定义 a b c
d
举例
H+ + OH- = H2O [Cu(NH3)4]2+ + 4H+ =4NH4+ Cu2+ [Cu(NH3)4]2+ + 2OH- = Cu(OH)2 +
过度态理论:反应并不是由简单的碰撞来完成的。分子发生碰 撞首先形成一种过度态的络合物,形成的过度态络合物既可能 形成新的化学键生成产物,也可能逆向转化为反应物。
过度态理论认为:活化络合物的浓度、活化络合物分解成产物的 概率、活化络合物分解成产物的速率均将影响化学反应的速率。
Lewis酸碱理论

Lewis酸碱理论理论发展布朗斯特酸碱理论概念的核心系于分子或离子间的质子转移,显然无法对不涉及质子转移,但却具有酸碱特征的反应做解释.这一不足在布朗斯特概念提出的同年由美国化学家路易斯提出的酸碱电子理论(the electronic theory of acid and alkali),也称广义酸碱理论、路易斯(lewis)酸碱理论,是1923年美国物理化学家吉尔伯特·牛顿·路易斯(Lewis G N)提出的一种酸碱理论,它认为:凡是可以接受外来电子对的分子、基团或离子为酸;凡可以提供电子对的分子、离子或原子团为碱。
这种理论包含的酸碱范围很广,但是,它对确定酸碱的相对强弱来说,没有统一的标度,对酸碱的反应方向难以判断。
后来,皮尔逊提出的软硬酸碱理论弥补了这种理论的缺陷。
电子酸碱该理论认为:凡是能够接受外来电子对的分子、离子或原子团称为路易斯酸(Lewis acid),即电子对接受体,简称受体;凡是能够给出电子对的分子、离子或原子团称为路易斯碱(Lewis base),即电子对给予体,简称给体。
或者说:路易斯酸(Lewis acid)是指能作为电子对接受体(Electron pair acceptor)的原子,分子,离子或原子团;路易斯碱(Lewis base)则指能作为电子对给予体(Electron pair donor)的原子,分子,离子或原子团;酸碱反应是电子对接受体与电子对给予体之间形成配位共价键的反应.路易斯酸的分类1、配位化合物中的金属阳离子,例如[Fe(H2O)6]3+和[Cu(NH3)4]2+中的Fe3+离子和Cu2+离子.2、有些分子和离子的中心原子尽管满足了8电子结构,仍可扩大其配位层以接纳更多的电子对.如 SiF4 是个路易斯酸,可结合2个F–的电子对形成[SiF6]2–.3、另一些分子和离子的中心原子也满足8电子结构,但可通过价层电子重排接纳更多的电子对.再如CO2能接受OH–离子中O 原子上的孤对电子4、某些闭合壳层分子可通过其反键分子轨道容纳外来电子对.碘的丙酮溶液呈现特有的棕色,是因为I2分子反键轨道接纳丙酮中氧原子的孤对电子形成配合物(CH3)2COI2.再如四氰基乙烯(TCNE)的π*轨道能接受一对孤对电子。
酸碱理论

酸碱理论阐明酸、碱本身以及酸碱反应的本质的各种理论。
在历史上曾有多种酸碱理论,其中重要的包括:阿伦尼乌斯酸碱理论——酸碱电离理论布朗斯特-劳里酸碱理论——酸碱质子理论路易斯酸碱理论——酸碱电子理论酸碱溶剂理论软硬酸碱理论最早提出酸、碱概念的是英国R.玻意耳。
为酸和碱下了更科学的定义:―所有的酸都是氢的化合物,但其中的氢必须是能够很容易地被金属所置换的。
碱则是能够中和酸并产生盐的物质。
‖但他不能解释为什么有的酸强,有的酸弱。
这一问题为瑞典S.A.阿伦尼乌斯解决。
阿伦尼乌斯电离理论阿伦尼乌斯酸碱理论在阿伦尼乌斯电离理论的基础上提出的酸碱理论是:―酸、碱是一种电解质,它们在水溶液中会离解,能离解出氢离子的物质是酸;能离解出氢氧根离子的物质是碱。
‖由于水溶液中的氢离子和氢氧根离子的浓度是可以测量的,所以这一理论第一次从定量的角度来描写酸碱的性质和它们在化学反应中的行为,指出各种酸碱的电离度可以大不相同,有的达到90%以上,有的只有1%,于是就有强酸和弱酸;强碱和弱碱之分。
强酸和强碱在水溶液中完全电离;弱酸和弱碱则部分电离。
阿伦尼乌斯还指出,多元酸和多元碱在水溶液中分步离解,能电离出多个氢离子的酸是多元酸;能电离出多个氢氧根离子的碱是多元碱,它们在电离时都是分几步进行的。
这一理论还认为酸碱中和反应乃是酸电离出来的氢离子和碱电离出来的氢氧根离子之间的反应:H++OH- ===H2O阿伦尼乌斯酸碱理论也遇到一些难题,如:①在没有水存在时,也能发生酸碱反应,例如氯化氢气体和氨气发生反应生成氯化铵,但这些物质都未电离。
②将氯化铵溶于液氨中,溶液即具有酸的特性,能与金属发生反应产生氢气,能使指示剂变色,但氯化铵在液氨这种非水溶剂中并未电离出氢离子。
③碳酸钠在水溶液中并不电离出氢氧根离子,但它却是一种碱。
要解决这些问题,必须使酸碱概念脱离溶剂(包括水和其他非水溶剂)而独立存在。
其次酸碱概念不能脱离化学反应而孤立存在,酸和碱是相互依存的,而且都具有相对性。
酸碱理论

酸碱理论阐明酸、碱本身以及酸碱反应的本质的各种理论。
在历史上曾有多种酸碱理论,其中重要的包括:阿伦尼乌斯酸碱理论——酸碱电离理论,布朗斯特-劳里酸碱理论——酸碱质子理论,路易斯酸碱理论——酸碱电子理论,酸碱溶剂理论,软硬酸碱理论。
最早提出酸、碱概念的是英国R.玻意耳。
法国A.L.拉瓦锡又提出氧是所有酸中普遍存在的和必不可少的元素,英国H.戴维以盐酸中不含氧的实验事实证明拉瓦锡的看法是错误的,戴维认为:“判断一种物质是不是酸,要看它是否含有氢。
”这个概念带有片面性,因为很多有机化合物和氨都含有氢,但并不是酸。
德国J.von李比希弥补了戴维的不足,为酸和碱下了更科学的定义:“所有的酸都是氢的化合物,但其中的氢必须是能够很容易地被金属所置换的。
碱则是能够中和酸并产生盐的物质。
”但他不能解释为什么有的酸强,有的酸弱。
这一问题为瑞典S.A.阿伦尼乌斯解决。
一、阿伦尼乌斯酸碱理论在阿伦尼乌斯电离理论的基础上提出的酸碱理论是:“酸、碱是一种电解质,它们在水溶液中会离解,能离解出氢离子的物质是酸;能离解出氢氧根离子的物质是碱。
”由于水溶液中的氢离子和氢氧根离子的浓度是可以测量的,所以这一理论第一次从定量的角度来描写酸碱的性质和它们在化学反应中的行为,指出各种酸碱的电离度可以大不相同,有的达到90%以上,有的只有1%,于是就有强酸和弱酸;强碱和弱碱之分。
强酸和强碱在水溶液中完全电离;弱酸和弱碱则部分电离。
阿伦尼乌斯还指出,多元酸和多元碱在水溶液中分步离解,能电离出多个氢离子的酸是多元酸;能电离出多个氢氧根离子的碱是多元碱,它们在电离时都是分几步进行的。
这一理论还认为酸碱中和反应乃是酸电离出来的氢离子和碱电离出来的氢氧根离子之间的反应:H++OH- ===H2O阿伦尼乌斯酸碱理论也遇到一些难题,如:①在没有水存在时,也能发生酸碱反应,例如氯化氢气体和氨气发生反应生成氯化铵,但这些物质都未电离。
②将氯化铵溶于液氨中,溶液即具有酸的特性,能与金属发生反应产生氢气,能使指示剂变色,但氯化铵在液氨这种非水溶剂中并未电离出氢离子。
路易斯酸碱

路易斯酸碱路易斯酸碱概念的范围非常广泛。
常见的路易斯酸为有空轨道的分子或正离子,如AlCl3,BF3,FeCl3,ZnCl2,Ag+.,R,Br,NO2等。
路易斯碱为具有未共用时的分子或负离子,如NH3,ROH,X,OH,RO等。
路易斯酸具有接受电子对的能力,具有亲电性,因而它是亲电试剂。
路易斯碱具有给出电子对的能力,具有亲核性,是亲核试剂。
路易斯酸碱的强弱,即是试剂亲电性或亲核性的强弱。
因此,路易斯酸碱概念以及亲电、亲核概念,是学习有机反应机理必须掌握的基础概念。
有机化学中也常用路易斯所提出的概念来理解酸和碱,即凡是能接受外来电子对的都叫做酸,凡是能给予电子对的都叫做碱。
按此定义,路易斯碱就是布朗斯特定义的碱。
例如(5)式中的NH3,它可以接受质子,所以是布伦斯特定义的碱;但它在和H结合时,是它的氮原子给予一对电子而和H成键,所以它又是路易斯碱。
路易斯酸则和布朗斯特酸略有不同。
例如质子H,按布朗斯特定义它不是酸,按路易斯定义它能接受外来电子对所以是酸。
又例如,按布朗斯特定义,HCl、H2SO4等都是酸,但按路易斯定义,它们本身不能成为酸,它们所给出的质子才是酸。
反之,有些化合物按布朗斯特定义不是酸。
但按路易斯定义却是酸。
例如,在有机化学中常见的试剂氟化硼和三氯化铝在一般的有机化学资料中,一般泛称的酸碱,都是指按布朗斯特定义的酸碱。
当需要涉及路易斯酸碱概念时,则都专门指出它们是路易斯酸碱.1830年,阿伦尼乌斯从他自己的电离理论出发,提出酸和碱的定义,这就是现行初中课本教给我们的酸碱定义——“在水溶液中,电离时生成的阳离子全部是氢离子的化合物叫酸。
电离时生成的阴离子全部是氢氧根离子的化合物叫碱”。
到了高中,课本又告诉我们,在水溶液中,电离过程是“在水分子的作用下”发生的,所以,酸和碱的定义又变为——“在水溶液中,能电离出“水合氢离子”(H3O+)的化合物叫酸,能电离出“水合氢氧根离子”的化合物叫碱”。
高中化学竞赛 中级无机化学 路易斯酸碱与硬软酸碱原理 硬软酸碱理论(HSAB)

sp3d2
可利用外层空d 轨道
路易斯碱: ①阴离子,X-、OH- 、CN -等
②具有孤对电子的中性分子
如
:NH3、H2O:、 :CO、CH3OH
③含键的物种
C=C、 、 ……
酸碱反应:
酸碱反应: A + : B A : B
酸 碱 酸碱加合物
配位键 实质是电子对的转移。
BF3
+ : NH3 F3B : NH3
② 判断溶解度大小
LiF在水中是难溶解的,而其余LiX在水中的溶解度较大,且随 着卤离子的半径增大而增大,与此相比,AgX却有相反的性质, 对上述现象,请给出合理的解释。 F-为硬碱 水 Ag+为软酸 I-为软碱
Li+为硬酸
② 键合异构现象
1/2 Au+ 1/6 Fe3+
[AuI (SCN)2] -
Li+为硬酸
③键合异构现象
1/2 Au+ 1/6 Fe3+
[AuI (SCN)2] -
SCN-
[FeIII(NCS)6]3-
④自然现象 Mg2+、Al3+、Ca2+等 多以氧化物、氟化物等形式存在。
Zn2+、Hg2+、Ag+等
以硫化物如ZnS、HgS、Ag2S等形式存在。
⑤科研问题
Chen, L.; Liu, Y.; Hou, G.; Song, H.; Zi, G. Inorg. Chem. Commun. 2013, 29, 141-144.
1. 软硬酸碱
软硬 酸碱
软酸 软碱 交界酸 交界碱 硬酸 硬碱 Lewis酸
理论
半径小、正电荷高
路易斯酸碱理论66页PPT

1、纪律是管理关系的形式。——阿法 纳西耶 夫 2、改革如果不讲纪律,就难以成功。
3、道德行为训练,不是通过语言影响 ,而是 让儿童 练习良 好道德 行为, 克服懒 惰、轻 率、不 守纪律 、颓废 等不良 行为。 4、学校没有纪律便如磨房里没有水。 ——夸 美纽斯
5、教导儿童服从真理、服从集体,养 成儿童 自觉的 纪律性 ,这是 儿童道 德教育 最重要 的部分 。—— 陈鹤琴
▪
26、要使整个人生都过得舒适、愉快,这是不可能的,因为人类必须具备一种能应付逆境的态度。——卢梭
▪
27、只有把抱怨环境的心情,化为上进的力量,才成功的保证。——罗曼·罗兰
▪
28、知之者不如好之者,好之者不如乐之者。——孔子
▪
29、勇猛、大胆和坚定的决心能够抵得上武器的精良。——达·芬奇
▪
30、意志是一个强壮的盲人,倚靠在明眼的跛子肩上。——叔本华
谢谢!
66
路易斯酸碱络合物

路易斯酸碱络合物
路易斯酸碱络合物是一种化学化合物,由一种路易斯酸和一种路易斯碱组成的。
路易斯酸通常是一个离子、离子对、分子或离子对,而路易斯碱通常是一个孤对电子、阴离子或中性配体。
路易斯酸碱络合物可以是单分子复合物,双分子复合物或多分子复合物。
路易斯酸和碱可以通过配位作用结合在一起形成络合物。
在络合物中,碱中的孤对电子形成氧化钙,给酸提供电子受体。
酸和碱之间的相互作用产生了新的化学性质,并增强了原有的性质。
路易斯酸碱络合物具有广泛的应用,包括工业、生物学、药学、材料学和环境科学等领域。
由于路易斯酸碱络合物的复杂性,许多学者研究并尝试确定它们的结构和性质。
已有多种方法用于描述络合物的结构,如3D结构、亚结构和团簇结构等。
并且,发展了许多计算方法用以预测络合物的性质和结构。
在生物学领域,路易斯酸碱络合物是研究重要的一部分。
生命体内的大多数均涉及到络合物的形成和解体,如转运蛋白、生物催化剂等。
药物设计中也经常使用路易斯酸碱络合物,以提高药物的效果、稳定性和生物可利用性。
在环境科学中,络合物的形成在污染物的传输和生物整合中具有重要意义。
其利用可以有效减少环境中有害物质的毒性和降解速率。
因此,路易斯酸碱络合物作为化学学科中的重要研究领域之一,将会在更多的领域得到广泛的应用和发展。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
model 2 路易斯酸碱
The Lewis acid-base model
上页 下页 目录 返回
阿仑尼乌斯“电离说”
Arrhenius acid-base concept
★ 酸指在水中电离出的阳离子全部为H H2SO4 = HSO4 + H+ ★ 碱指在水中电离出的阴离子全部为OH-
NaOH = Na+ + OH★ 中和反应的实质 H+ + OH- = H2O
H+
H 3O (aq)
H+
NH 3 (aq)
NH 4 (aq)
H 2 O( l )
HAc(aq)
OH (aq) H 2O(l) Ac (aq )
● 盐的水解
H+
H 2O(l) Ac (aq) HAc(aq) H+
NH 4 (aq) H 2O(l) H 3O (aq)
+ NH4
酸给出质子的趋势越强,生成的共轭碱越弱,反之 亦然;碱接受质子的趋势越强,生成的共轭酸越弱, 反 之亦然。
上页 下页 目录 返回
共轭酸碱对
Conjugate acid-base pair
任何布朗斯特酸碱反应都涉及两个共轭酸碱对。 一种物质是酸是碱, 取决于它参与的反应;既可为 酸又可为碱的物质叫两性物质(Amphoteric substance)。
(a) 前者, 中心离子电荷高, 对O的极化能力大, H+易解离;
(b) 前者, 中心离子半径小, 对O的极化能力大, H+易解离;
(c) 前者, 中心离子半径小, 对O的极化能力大, H+易解离; (d) 、 (e)、 (f) 均为后者,非羟基氧原子多。
上页 下页 目录 返回
1. 酸碱反应的实质
Solution
(1) 在水中,O2-的碱性太强以致无法用实验研究;
和 (2) 在水中, ClO 4 NO 3 的碱性太弱以致无法用实验 研究; CO 2 (3) 在水中, 3 可直接测定其强度。
上页 下页 目录 返回
非水溶剂的分辨窗
Discrimination windows
知识 介绍
+ HF(aq) + NH3(aq) → NH4 (aq) + F– (aq)
+ H2O(l) + NH3(aq) →OH –(aq) + NH4 (aq)
H2S(aq) + H2O (l) →H 3O+ (aq) + HS-(aq)
上页 下页 目录 返回
1.2 共轭酸碱对
半反应(Half reaction)的概念
E—O—H + OH–
( E—O)– + H2O
这类氧化物叫酸性氧化物(acidic oxide)或酸酐
(acid anhydride) 。
上页 下页 目录 返回
某些常见酸在水中的电离常数(298K)
上页 下页 目录 返回
Acid ionization constant
电离常数表使用说明
1.
θ 值小于1的 (Strong acid), Ka θ值越大,酸性越强。 Ka θ值 大 于 1 的 酸 叫 强 酸 Ka
酸叫弱酸(Weak acid)。 θ 值跨越24个数量级,常 2. 表中的 K a
4. 对二元和三元酸而言,还有第二步和第三步质子转移 反应的相应常数:
HCO 3 (aq) + H2O(l)
2 HPO 4 (aq)+ H2O(l)
θ Ka (H 2CO3 ) 4.8 1011 2 3 PO 4 (aq) + H3O+(aq)
2 CO 3 (aq) + H3O+(aq)
1. 二元氢化物的酸性
★ 化合物显示的酸性源自失去质子的能力,可以预期
酸的强弱与H—B键的强弱有关,H—B键越强 ,相
应的酸越弱。
HI
键长/pm 键的解离能/ kJ· mol-1
θ Ka
HBr
368 109 < >
HCl
HF
160.9 > 141.4 > 127.4 > 91.7 297 < 1011 > 431 < 569 107 > 3.5×10-3
θ 不同温度下水的 pK a
θ pK a
θ 叫作质子自递常数 Ka
(Autoprotolysis constant) , 是由 于质子转移发生在两个相同分
T/K 273 283 291 295 298 313 333
子之间. 该常数又叫水的离子
积(Ion product of water), 符号
θ , 相应的对数表达式为 为 Ka
溶剂对酸碱强度的分辨范围就是它们各自的质子自递 常数。 p K w =14 意味着水的分辨区跨越 14 个单位。分辨区 的宽度表征了
最大限度的强 酸(即溶剂的 共轭酸)和最 大限度的强碱 (即溶剂的共 轭碱)之间的 反应。
上页 下页 目录 返回
1.4 酸碱性强弱与分子结构的关系
切相关。
如果了解了化合物的酸碱性与其分子结构的关系, 就会发现,化合物的酸碱性与元素在周期表中的位置密
2. 酸性、碱性和两性氧化物
通式为ExOy的氧化物与H2O反应形成含有EOH基 团的化合物 : ExOy+ H2O E O H
酸性氧化物 若 E 是高电负性的非金属原子 ,
它会将 O—H键的键电子吸向自己, 减弱O—H键的强度并导致 E—O—H基团按酸的方式电离。若有强碱存在, 产物为 该元素的氧阴离子和H2O。
2014竞赛
酸、碱和 酸碱反应
本章教学要求
1. 了解酸碱概念的变迁;
2. 理解布朗斯特酸碱理论的意义和要点; 3. 理解路易斯酸碱理论的意义和要点;
4. 了解软硬酸碱的内容和应用;
5. 了解几种有代表性的路易斯酸。
上页 下页 目录 返回
1
布朗斯特酸碱
The Brfnsted-Lowry acid-base
HI HClO 4 HCl H 2SO 4 HNO 3
同样,酸越强,其共轭碱越弱;碱越强, 其共轭酸越弱。
上页 下页 目录 返回
Question 3
用拉平效应概念讨论水溶液中的碱 , 2- , 2 , O ClO CO 3 4 NO 3 (1) 哪些碱性太强以致无法用实验研究? (2) 哪些碱性太弱以致无法用实验研究? (3) 哪些可直接测定其强度?
H2 O(l) NH3 (aq) OH (aq) NH 4 (aq)
它的一个半反应是作为酸的H2O分子给出质子生成它的 共轭碱(Conjugate base)OH–: H2O H+ + OH–
另一个半反应是作为碱的NH3分子接受质子生成它的共 轭酸(Conjugate acid) : NH3 + H+
θ 该反应的标准平衡常数 K a 叫酸性常数(Acidity
constant), 也叫酸的电离常数(Acid ionization constant):
θ Ka
{c(B ) / mol dm 3 }{c(H 3O ) / mol dm 3 } {c(HB) / mol dm 3 }
θ Ka (H 3 PO4 ) 2.2 1013 3
上页 下页 目录 返回
电离常数表使用说明
5. 对反应 H2O(l) + H2O(l) OH-(aq) + H3O+(aq) (酸 ) (碱 ) (共轭碱) (共轭酸) θ={c(H O+)/mol· -3}· –)/mol· – 3} dm { c (OH dm Ka 3
θ θ p KW lg K w
0.13×10-14 0.36×10-14 0.74×10-14 1.00×10-14 1.27×10-14 3.80×10-14 12.60×10-14
上页 下页 目录 返回
水合氢离子
hydronium ion 由于质子对负离子和极性共价分子负端极强的吸引
力,因而在任何溶剂中都不可能以“裸质子”形式存在 。水合高氯酸HClO4· H2O晶体结构测定结果证实 , 其中 的 H+以 H3O+ 形式存在。 H3O+是 NH3 的等电子体。另一 个被确定了结构的物种是固体水合物 HBr· 4H2O 中的 H9O4+。普遍的看法是 , 水溶液中水合氢离子的形式随 116 条件变化而不同。
质子理论中无盐的概念,电离理论中的盐,在质子 理论中都是离子酸或离子碱。
上页 下页 目录 返回
上页 下页 目录 返回
Question 1
Solution
下列各对中哪一个酸性较强? (a) [Fe(H2O)6]3+和[Fe(H2O)6]2+ (b) [Al(H2O)6]3+和[Ga(H2O)6]3+ (c) Si(OH)4和Ge(OH)4 (d) HClO3和HClO4 (e) H2CrO4和HMnO4 (f) H3PO4和H2SO4
上页 下页 目录 返回
1.1 定义
酸: 反应中能给出质子的分子或离子, 即质子给予体 碱: 反应中能接受质子的分子或离子, 即质子接受体
Brfnsted J N 丹麦物理化学家
酸碱反应指质子由给予体向接受体的转移过程 气相中 溶剂中
水 是 两 性
HF(g) + H2O(l) →H3O+(aq) + F–(aq)
★ 水溶液中电解质部分电离
已电离的溶质粒子数 100 % 原有溶质的粒子数
上页 下页 目录 返回
Svante August Arrhenius 瑞典化学家
