各种动物或人淋巴细胞分离液操作说明和使用保存中的注意事项:
淋巴细胞的保存和活力测定

淋巴细胞的保存和活力测定一、分离细胞的保存在某些情况下,分离所得细胞需要加以保存,否则活力迅速下降,甚至死亡。
(一)短期保存技术将分离到的细胞用适量含10%~20%灭活小牛血清的Hanks、Tc-1 99、RPMI1640或其他培养液稀释重悬。
所用培养液要求等渗,具缓冲作用,并对细胞无毒性。
通常置4℃保存较好,可减低细胞代谢活动。
要注意不要迅速改变细胞所处的温度,以免造成细胞“温度”休克。
(二)长期冷冻保存技术利用液氮深低温(-196℃)环境保存细胞,是当前世界上通用的细胞长期保存技术。
其原理在于深低温环境可中断细胞的代谢,但在降温过程由于冰晶的形成和渗透压的改变均可导致细胞的损伤和部分死亡,所以在冷冻过程中一定要加用冷冻保护剂,常用的保护剂为二甲亚砜(dimethylsulfoxide,DMSO)。
冷冻时的降温速度和细胞解冻时的升温速度对细胞活力的保存有很大影响。
条件合适时,冻存细胞一旦复苏,恢复37℃培养,其形态和代谢活动均可恢复正常。
操作的原则是先对需冻存的细胞作活细胞计数,低速离心后,取沉积细胞用含10%二甲亚砜的小牛血清配制成适当浓度的细胞悬液,分装于冻存管内,速即放入降温过渡站中,避免二甲亚砜对细胞的损伤。
继而进行降温冷冻,目前常用两步降温法,即迅速降温至一选择好的临界温作为过渡站,如-80℃低温冰箱过夜,或在液氮罐液面以上的一层空间放置片刻,然后再放入液氮中。
如需复苏细胞,则需迅速解冻以恢复细胞的活力,要求在20s以内完全融化。
将冻存管自液氮中取出,立即放入40℃温水中,融化后即从水中取出,吸出细胞悬液,加入10倍的培养液中混匀,继而低速离心,尽快洗去保护剂,再悬于新培养液中,计数并检查细胞活力,然后置37℃培养箱内培养。
二、细胞活力测定细胞活力常用百分比表示,活力的大小对试验结果有很大影响。
细胞活力的测定有许多方法,最简便常用的方法是台盼蓝(trypanblu e)染色法。
台盼蓝又称锥蓝,是一种阴离子型染料,这种染料不能透过活细胞正常完整的细胞膜,故活细胞不着色,但死亡细胞的细胞膜通透性增加,可使染料通过细胞膜进入细胞内,使死细胞着色呈蓝色。
提取淋巴细胞流程

一、采集血样,室温保存。
使用一次性的抗凝的真空抽血管进行采血。
一般使用EDTA或肝素抗凝均可;血量一般为2-5ml;一般地,1ml外周血中含有大约1-2*10^6个单个核细胞(PBMC,即淋巴细胞核单核细胞)。
二、提取淋巴细胞。
在无菌的塑料离心管中加入2ml淋巴细胞分离液,在装有2ml血样的真空管中加入2mlPBS(磷酸盐缓冲液),1:1混匀。
然后缓慢把混匀的血样PBS混合液加入到有淋巴细胞分离液的离心管中,注意要缓慢,使血样尽量位于提取液上层,不能太用力让血细胞扩散到下层,就没办法离心分层了。
(这一步的操作应该尽量快速的完成,因为时间长了,红细胞就会在重力作用下沉降,混入到提取液中,对后面的离心造成影响)然后离心。
1500rpm,15min,20摄氏度。
说明:1、从采集血样到开始实验的时间最好不超过4小时。
实验过程中一直保持室温条件,一般20摄氏度比较适中,因为细胞的最适温度是体温37摄氏度,但是温度降低又可以降低细胞的代谢,两者有些矛盾,所以取中间温度比较理想。
2、关于淋巴细胞分离液的注意事项:启封后应置4℃保存避免微生物的污染;分离液从冰箱取出后,不可立即使用,需待溶液温度升至室温时,摇匀后使用;整个分离过程中,温度应控制在18-28℃且在无菌环境下,避免微生物的污染,否则会影响分离质量;未启封前在18-25℃避光保存,启封后置4℃保存,本品为真空包装,未启封前置于10℃以下易出现白色结晶,影响分离效果。
(各种淋巴细胞分离液的保存温度不完全一致)淋巴细胞分离液是一种根据细胞密度差异,借助离心产生的重力加速度,进行细胞的分离纯化的常用试剂,为带有乳光或微乳光的灭菌水溶液,主要成分是葡聚糖与泛影酸葡甲胺。
适用于人淋巴细胞和大多数哺乳动物细胞的分离纯化,能除去红细胞和死细胞碎片,所获得的PBMC可进一步用于原代培养或流式细胞分析。
最常用的细胞分离液有Ficoll和Percoll。
3、PBS溶液是一种平衡盐溶液,还可以用Hank’s液或生理盐水代替PBS溶液,但最常用的还是PBS溶液。
淋巴细胞分离液说明书

Lonza Walkersville, Inc.biotechserv@Tech Service: 800-521-0390Document # INST-17-829-1 06/07Walkersville, MD 21793-0127 USA© 2007 Lonza Walkersville, Inc.Lymphocyte Separation MediumInstruction For Use17-829EIntroductionLymphocyte Separation Medium (LSM) is a mixture of Ficoll® and sodium diatrizoate (Hypaque) with density adjusted to 1.077 g/ml. This sterile filtered product is intended for laboratory/manufacturing use, and is not for in vitro diagnostic use. It is commonly used to isolate lymphocytes from human blood. One protocol to accomplish this is presented here.Protocol1. Anticoagulated blood (citrated or heparinized)should be used.Note: Always treat human and other primatesource material as potentially infectious and take safety precautions.2. Dilute blood 1:1 with calcium-magnesium-freePBS and layer 9 ml onto 6 ml LSM. Use a clearplastic centrifuge tube with a cap. For largevolumes use a similar ratio of diluted blood toLSM.3. Centrifuge at 400xg for 15 minutes.4. Remove plasma-PBS without disturbing theinterface.5. Collect the interface with a cannula and dilute to20 ml in serum-free medium, such as RPMI1640.6. Centrifuge at 70xg for 10 minutes.7. Discard supernatant fluid and resuspend pelletin 2-3 ml serum-free medium.8. Count nucleated cells on a hemocytometer orelectronic counting device.9. Lymphocytes will be concentrated at theinterface, along with some platelets andmonocytes. Granulocytes will be found mostly in the Lymphocyte Separation Medium anderythrocytes will pellet at the bottom of the tube.References1. Boyum, A. 1968. Isolation of mononuclear cellsand granulocytes from human blood. Isolation of mononuclear cells by one centrifugation, and ofgranulocytes by combining centrifugation andsedimentation at 1 g. Scand. J. Clin. Lab. Invest.Suppl. 97:77-89.2. Boyum, A. 1976. Isolation of lymphocytes,granulocytes and macrophages. Scand. J. Clin.Lab. Invest. Suppl. 5:9-15.3. Boyum, A. 1977. Separation of lymphocytes,lymphocyte subgroups and monocytes: areview. Lymphology. 10-2:71-6.4. Boyum, A. 1984. Separation of lymphocytes,granulocytes and monocytes from human blood using iodinated density gradient media. Methods Enzymol. 108:88-102.5. Boyum, A. et al. 2002. Separation of HumanLymphocytes from Citrated Blood by DensityGradient (NycoPrep) Centrifugation: MonocyteDepletion Depending upon Activation ofMembrane Potassium Channels. Scand. J.Immunol. 56-1:76-84.6. Koistinen, P. 1987. Human peripheral blood andbone marrow cell separation using densitygradient centrifugation on Lymphoprep andPercoll in haematological diseases. Scand. J.Clin. Lab. Invest. 47-7:709-14.7. Rola-Pleszczynski, M. and W.H. Churchill. 1978.Purification of human monocytes by continuous gradient sedimentation in ficoll. J. Immunol.Methods. 20:255-62.Product Use StatementTHESE PRODUCTS ARE FOR RESEARCH USE ONLY. Not approved for human or veterinary use, for application to humans or animals, or for use in clinical or in vitro procedures.INST-17-829-1 06/07Ficoll is a trademark of GE Healthcare. All other trademarksherein are marks of Lonza Group or its subsidiaries.1。
淋巴细胞分离液的原理

淋巴细胞分离液的原理
淋巴细胞分离液是一种用于分离淋巴细胞的溶液。
它的原理是利用淋巴细胞和其他细胞在密度上的差异来进行分离。
淋巴细胞分离液通常是由密度梯度离心法制备而成的。
首先,一种或多种高密度物质(如Ficoll、Percoll等)被溶解在无菌
生理盐水或缓冲液中,形成密度梯度溶液。
然后,这个溶液被注入到离心管中。
接下来,待分离的淋巴细胞样品被加入到离心管中的密度梯度溶液上方。
离心管被放置在离心机中进行离心操作。
离心的过程中,样品中的细胞会向下沉降,并在密度梯度中找到自己的位置。
由于淋巴细胞在密度上相对较轻,它们通常会沉降到密度梯度溶液的较低密度区域。
而其他细胞(如红细胞、血小板等)普遍比淋巴细胞密度高,它们会沉降到密度梯度溶液的较高密度区域。
当离心结束后,离心管中的密度梯度溶液会形成不同的层次,每个层次含有不同种类的细胞。
淋巴细胞分离液将淋巴细胞与其他细胞有效地分离开来。
最后,通过使用适当的技术,如离心、吸引、冲洗等,从密度梯度中提取和收集分离的淋巴细胞。
这种方法能够获得高纯度、高活力的淋巴细胞样品,用于进一步的实验研究。
淋巴细胞分离实验

外周血单个核细胞的分离
外周血单个核细胞的分离 原理 试剂和仪器 实验步骤 注意事项
原理
外周血各种血细胞的密度不尽相同, 利用淋巴细胞分层液(Ficoll)作 密度梯度离心,使一定比重的细胞 群按相应密度梯度分布,从而将各 种血细胞加以分离。
原理
红细胞
1.093 1.092
实验步骤
5、计算:将结果代入下式,得出细胞密度 细胞数/毫升原液 =(4大格细胞数之和/4)×104
注意事项
1.取样计数前,应充分混匀细胞悬液 2.加样量不要溢出盖玻片,也不要过少或带 气泡 3.细胞压中线时,数上不数下,数左不数右 4.本法要求细胞密度不低于104细胞/ml 5.镜下计数时,细胞数过少或过多,说明稀 释不当,需重新制备细胞悬液、计数
淋巴细胞 单核细胞
外周血
粒细胞
单个核细胞 (PBMC) 血小板
1.075~1.090 1.030~1.035
Ficoll:1.077±0.001
稀 释 外 周 血
稀释的血浆、 血小板
1500rpm, 20℃ , 30min
PBMC
Ficoll
Ficoll
红细胞 粒细胞
实验步骤
1.采血,稀释 (外周血:稀释液=1:2) 2.在离心管中加入Ficoll,沿倾斜的 管壁缓缓加入稀释的外周血 (Ficoll:稀释血=1:2)
实验步骤
3.20℃,1500r/min,离心30min
4.沿管壁周缘轻轻吸取PBMC层移入 另一试管中
实验步骤
5.加足量稀释液充分洗涤,1800 r/min 离心10min ,弃上清 6.重复洗涤一次,1400r/min离心10min, 弃上清 7.适量的培养基重悬细胞 ,计数
达科为生物技术 人淋巴细胞分离管说明书

1/32/33/3表一:产品基本参数使用方法1.检查。
如图一(A )所示。
取出分离管,观察半固体材料之上是否有游离的分离液。
如果有,请用离心机2000g ,20℃,离心1min 。
2.倒入血液。
血液样品必须为抗凝全血,无需稀释。
分离液呈半固体形态,不会与血液混合。
每支分离管可以分血分离管组成密度介质医用级别半固体组织分离液密度 1.077±0.001g/mL (20ºC)渗透压290±15mOsm 内毒素含量≤0.25EU/mL 保存条件室温避光保存保质期12个月图一:淋巴细胞分离管分离血液的过程注意事项:�分离管室温避光保存。
�最佳分离温度在18-25℃,超出该温度范围分离效果将受一定影响。
�血液在室温采集、在抗凝容器中室温存放(保存时间不要超过4hr )、室温分离,勿放到4℃冰箱。
�全血无需稀释,可直接分离。
但稀释后不影响分离效果。
�如果全血不足3mL ,建议不要使用分离管,稀释到3mL 对分离效果没有改善。
因为不论稀释与否,红细胞的数量是恒定的,置换出的游离分离液也是恒定的,经离心后细胞聚集带仍然距离半固体组织很近,吸取操作会有一定难度。
�取走血浆的血细胞可以用生理盐水稀释一倍之后倒入分离管,以分离PBMC 。
但前提是有足够数量的红细胞(至少有相当于3mL 全血所含的红细胞)。
1046-10496.刘义,等.[J]生殖与避孕,2007,27(11):691-6947.张慧,等.[J]江苏大学学报医学版,2007,13(2):97-1018.王晓莲,等.[J]实用老年医学,2007,21(4):240-2429.丁隆,等.[J]第三军医大学学报,2007,29(11):1072-107510.夏婷,等.[J]中国实验血液学杂志,2006,14(4):745-74811.陈华华,等.[J]微循环学杂志,2005,15(4):6-812.陈敏,重庆医科大学博士学位论文2007制造商:深圳市达科为生物技术有限公司地址:深圳市南山区南油登良路天安工业区5栋3B (518054)Toll free :800-8304366Tel :+8675586235352Fax :+8675526869149E-mail :*************http ://(100413)。
人淋巴细胞分离液说明书(3篇)

第1篇一、产品概述本产品为一种生物医学试剂,主要用于从人血液中分离纯化淋巴细胞。
淋巴细胞是人体免疫系统的重要组成部分,广泛用于免疫学研究和临床诊断。
本产品采用特殊的分离技术,能够高效、快速地从人外周血中分离出高纯度的淋巴细胞,为后续的免疫学研究提供高质量的实验材料。
二、产品规格| 产品规格 | 批号 | 有效期 || :-------: | :---: | :----: || 100ml/瓶 | ABC123 | 2025年12月 |三、产品特性1. 高效分离:本产品采用独特的分离介质,能够高效地将淋巴细胞与其他血细胞分离,分离效率高,纯度好。
2. 操作简便:本产品使用方法简单,无需特殊设备,适合实验室常规操作。
3. 稳定性好:本产品在规定的储存条件下,稳定性良好,保质期内质量稳定。
4. 无污染:本产品在生产过程中严格遵循无菌操作规程,产品无细菌、病毒等生物污染。
四、产品用途1. 免疫学研究:用于分离淋巴细胞,进行细胞因子检测、细胞培养、细胞因子基因表达等研究。
2. 临床诊断:用于检测血液中的淋巴细胞,辅助诊断某些疾病,如自身免疫性疾病、肿瘤等。
3. 药物研发:用于药物筛选、药效评价等。
五、使用方法1. 准备工作:- 将分离液室温下平衡至室温。
- 准备无菌试管、移液器、吸头等实验器材。
- 准备适量抗凝剂(如EDTA-K2)。
2. 操作步骤:- 将抗凝全血加入分离管中,轻轻混匀。
- 将分离液加入另一支无菌试管中,加入量约为全血量的2倍。
- 将全血和分离液轻轻混合,避免产生气泡。
- 将混合后的样品垂直静置1-2小时,直至形成清晰的三层界面。
- 小心吸取淋巴细胞层,避免混入其他细胞层。
- 将淋巴细胞转移至新的无菌试管中,加入适量磷酸盐缓冲盐水(PBS)洗涤,重复洗涤2-3次,以去除残留的分离液和杂质。
- 最后,将洗涤后的淋巴细胞悬浮于适量的PBS中,即可进行后续实验。
六、注意事项1. 操作过程中应严格遵守无菌操作规程,防止污染。
淋巴细胞提取
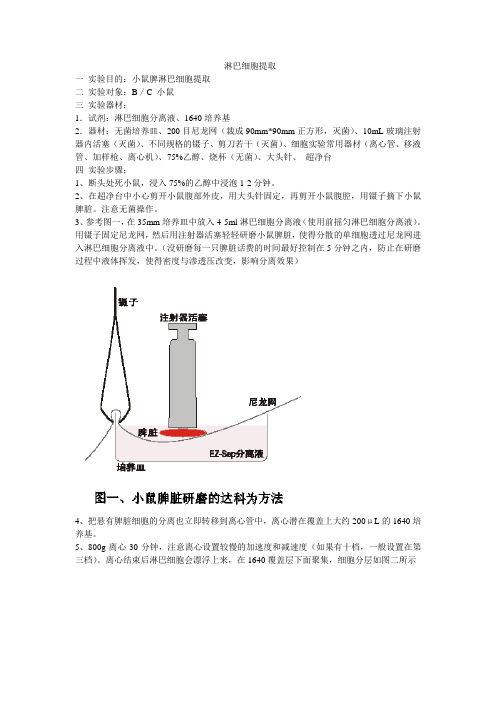
淋巴细胞提取一实验目的:小鼠脾淋巴细胞提取二实验对象:B/C 小鼠三实验器材:1.试剂:淋巴细胞分离液、1640培养基2.器材:无菌培养皿、200目尼龙网(裁成90mm*90mm正方形,灭菌)、10mL玻璃注射器内活塞(灭菌)、不同规格的镊子、剪刀若干(灭菌)、细胞实验常用器材(离心管、移液管、加样枪、离心机)、75%乙醇、烧杯(无菌)、大头针、超净台四实验步骤:1、断头处死小鼠,浸入75%的乙醇中浸泡1-2分钟。
2、在超净台中小心剪开小鼠腹部外皮,用大头针固定,再剪开小鼠腹腔,用镊子摘下小鼠脾脏。
注意无菌操作。
3、参考图一,在35mm培养皿中放入4-5ml淋巴细胞分离液(使用前摇匀淋巴细胞分离液)。
用镊子固定尼龙网,然后用注射器活塞轻轻研磨小鼠脾脏,使得分散的单细胞透过尼龙网进入淋巴细胞分离液中。
(没研磨每一只脾脏话费的时间最好控制在5分钟之内,防止在研磨过程中液体挥发,使得密度与渗透压改变,影响分离效果)4、把悬有脾脏细胞的分离也立即转移到离心管中,离心潜在覆盖上大约200μL的1640培养基。
5、800g离心30分钟,注意离心设置较慢的加速度和减速度(如果有十档,一般设置在第三档)。
离心结束后淋巴细胞会漂浮上来,在1640覆盖层下面聚集,细胞分层如图二所示6、析出淋巴细胞层,再加入10mL1640培养基,250g离心10分钟。
倾倒上清液,加入3-5mL Lympho-SpotTM无血清培养基重悬,细胞计数。
五、注意事项:①离心前在细胞悬液上面加盖一层1640培养基,既有利于漂浮上来的淋巴细胞的聚集,又有利于下一步的吸取操作。
覆盖层不必太厚,2Μl足矣。
②如果实验者一次实验要处理很多只小鼠,需要注意两点:其一,每研磨一只小鼠,立即把脾细胞悬液从培养皿转入离心管中,注意盖严管盖,切不可敞口放在超净台中。
否则,液体挥发,密度与渗透压都会改变,严重影响分离效果。
其二,在所有的小鼠脾脏处理完后,统一再加1640覆盖层。
MD PACIFIC 淋巴细胞分离液说明书

MD PACIFIC 淋巴细胞分离液说明书主要用途:淋巴细胞分离试剂是一种旨在通过葡聚糖和泛影酸钠混合液,达到特定比重,然后离心分层以获得纯化完整的单核细胞/淋巴细胞的权威而经典的技术方法。
可以被用于动物(大鼠、小鼠等)单核细胞/淋巴细胞的分离、鉴定、染色、标记、培养、DNA萃取、线粒体分离、细胞因子测定和细胞流式仪分析等研究。
产品严格无菌,即到即用,操作简易,分离出色,性能稳定,细胞活性保证。
技术背景:全血溶液含有血清、各种蛋白因子、无核血红细胞、血小板、多核白细胞和单核白细胞等。
为了获得纯化完整的单核白细胞/淋巴细胞,采用Boyum(1968)的离心技术,可以方便快速地从全血和骨髓中分离。
产品内容:淋巴细胞分离液(200)毫升产品说明书1份产品特点:-密度变化率依照Ficoll400泛影酸和氢氧化钠。
-最佳分离溶液的密度为参照具体产品的标签-生理学参数-在低粘度时高密度-无菌-即用型-溶液产品规格检测标准:热源检测结果:<0.5EU∕ml无菌检测结果:已检测应用人外周血中分离出淋巴细胞的最佳试剂。
这种分离液同样可被用作从其它途径分离人的淋巴细胞,包括骨髓血细胞、脐带血细胞及组织匀浆。
实验步骤实验开始前,室温预热淋巴细胞分离液。
然后进行下列操作。
(注:上述方法适用于从外周血中分离淋巴细胞。
如从骨髓、脐带及组织匀浆中分离,需要先去除红细胞后再进行上述步骤分离淋巴细胞。
1.准备无菌的锥形离心管2.加入淋巴细胞分离液3. 用hank’s 液或用户自备的PBS缓冲液1:1比例(如果全血样本粘稠,可适当增大比例)稀释抗凝过的全血样品。
3.小心沿着管壁,接近分离液层面,非常缓慢地加入新鲜的稀释过的全血样品在淋巴分离液上面。
(注意:切记不要搅浑淋巴细胞分离液)4.小心放进台式离心机离心30分钟,速度为400g5.小心取出离心管,切记不要震动6.可见,最上层为淡红色透明血浆,其次为薄薄的致密白色环状层,然后为离心液层,最后为红色沉淀在管底的红细胞层。
大鼠外周血淋巴细胞分离液
大鼠外周血淋巴细胞分离液说明书修订日期说明书修订日期::2015.10.21Cat number :KGA832Store at 4 for 12 months ℃For Research Use Only (科研专用)一、试剂盒组份名称 规格 A各种动物外周血淋巴细胞分离液 200ml B全血及组织稀释液(赠品) 200ml C 细胞洗涤液(赠品) 200ml注:本试剂内容中各单品可根据货号单独购买,客户可根据试剂使用情况自行选择购买。
适用于从动物抗凝血液中分离淋巴细胞,无菌条件下所分离的淋巴细胞可用于细胞培养等。
本品仅供科研使用。
二、试剂盒原理本分离液为FICOLL 、羟乙基淀粉550与泛影酸葡甲胺的混合液。
抗凝外周血可在分离液中分层。
离心时,在FICOLL 、羟乙基淀粉的作用下红细胞与粒细胞聚集并迅速沉降;此时,淋巴细胞及其他单个核细胞仍处于分离液上层,红细胞污染可忽略不计。
大部分血小板可在细胞清洗低速离心过程中去除。
其他人及动物多重比重细胞分离液,因不同种属不同比重分离液的细胞离散系数及细胞带电不同,用户在制定分离液时应提供所需分离液的比重、动物种属及被分离细胞的名称。
三、试剂盒以外自备仪器和试剂可提供400g 离心力的水平转子离心机、15ml 玻璃离心管、吸管等。
四、试剂盒试剂盒使用注意事项使用注意事项1. 使用前,本分离液需复温至18-22℃。
为获得最佳的实验结果,最好在取血后2小时内进行试验,血液提取后存放时间越长细胞活性越低。
2. 实验过程中,如需稀释血液或洗涤细胞,不可使用Ca 、Mg 离子的缓冲液及培养液,其成分会导致血细胞凝集大大降低细胞得率及纯度。
本公司生产的全血及组织稀释液和细胞洗涤液不含Ca、Mg离子、低内毒素水平且含细胞和保护成分,推荐使用。
3. 最优抗凝剂选择:EDTA、枸橼酸、肝素,其他抗凝剂也可使用,但会影响细胞活性。
应注意在血液稀释过程中去除抗凝剂体积。
4. 当血液样本粘度过高或血样样本大于等于3ml时,最优稀释方法:将血液于18-22℃以250g离心10分钟,弃去血浆,补充添加全血及组织稀释液,添加量为所弃去血浆体积的1.5-2倍,混匀备用。
实验二:淋巴细胞分离实验

4.沿管壁周缘轻轻吸取淋巴细胞层移 入另一试管中
精选2021版课件
8
实验步骤
5.加足量稀释液充分洗涤,1000 r/min 离心5min ,弃上清
6. 适量的培养基重悬细胞 ,计数
精选2021版课件
9
注意事项
1.在Ficoll上加入稀释外周血时,应缓慢 加,以免冲散界面
2. 吸取单个核细胞层时,应避免吸出过 多的上清液或分层液而导致血小板污染
精选2021版课件
12
精选2021版课件
13
实验步骤
5、计算:将结果代入下式,得出细胞密度 细胞数/毫升原液 =(4大格细胞数之和/4)×104
精选2021版课件
14
注意事项
1.取样计数前,应充分混匀细胞悬液 2.加样量不要溢出盖玻片,也不要过少或带
气泡 3.细胞压中线时,数上不数下,数左不数右 4.本法要求细胞密度不低于104细胞/ml 5.镜下计数时,细胞数过少或过多,说明稀
精选2021版课件
10
细胞计数
实验步骤 注意事项
精选2021版课件
11
实验步骤
1、准备计数板: 2、制备细胞悬液:收集细胞,制成单个细胞
悬液 3、加样:用吸管轻轻吹打细胞悬液,取少许
细胞悬液,在计数板上盖玻片的一侧加微量细 胞悬液, 4、计数:在显微镜下,用10×物镜观察计数 板四角大方格中的细胞数
实验二
小鼠脾脏淋巴细胞的分离
小鼠脾脏淋巴细胞的分离
目的 原理 实验步骤 注意事项
精选2021版课件2 Nhomakorabea 目的熟悉淋巴细胞和外周血单个核细胞 (PBMC)的分离方法
精选2021版课件
3
原理
脾脏各种血细胞的密度不尽相同, 利用淋巴细胞分层液(Ficoll)作 密度梯度离心,使一定比重的细胞 群按相应密度梯度分布,从而将各 种血细胞加以分离。
提取淋巴细胞流程

提取淋巴细胞流程一、采集血样,室温保存。
使用一次性的抗凝的真空抽血管进行采血。
一般使用EDTA或肝素抗凝均可;血量一般为2-5ml;一般地,1ml外周血中含有大约1-2*10^6个单个核细胞(PBMC,即淋巴细胞核单核细胞)。
二、提取淋巴细胞。
在无菌的塑料离心管中加入2ml淋巴细胞分离液,在装有2ml血样的真空管中加入2mlPBS(磷酸盐缓冲液),1:1混匀。
然后缓慢把混匀的血样PBS混合液加入到有淋巴细胞分离液的离心管中,注意要缓慢,使血样尽量位于提取液上层,不能太用力让血细胞扩散到下层,就没办法离心分层了。
(这一步的操作应该尽量快速的完成,因为时间长了,红细胞就会在重力作用下沉降,混入到提取液中,对后面的离心造成影响)然后离心。
1500rpm,15min,20摄氏度。
说明:1、从采集血样到开始实验的时间最好不超过4小时。
实验过程中一直保持室温条件,一般20摄氏度比较适中,因为细胞的最适温度是体温37摄氏度,但是温度降低又可以降低细胞的代谢,两者有些矛盾,所以取中间温度比较理想。
2、关于淋巴细胞分离液的注意事项:启封后应置4℃保存避免微生物的污染;分离液从冰箱取出后,不可立即使用,需待溶液温度升至室温时,摇匀后使用;整个分离过程中,温度应控制在18-28℃且在无菌环境下,避免微生物的污染,否则会影响分离质量;未启封前在18-25℃避光保存,启封后置4℃保存,本品为真空包装,未启封前置于10℃以下易出现白色结晶,影响分离效果。
(各种淋巴细胞分离液的保存温度不完全一致)淋巴细胞分离液是一种根据细胞密度差异,借助离心产生的重力加速度,进行细胞的分离纯化的常用试剂,为带有乳光或微乳光的灭菌水溶液,主要成分是葡聚糖与泛影酸葡甲胺。
适用于人淋巴细胞和大多数哺乳动物细胞的分离纯化,能除去红细胞和死细胞碎片,所获得的PBMC可进一步用于原代培养或流式细胞分析。
最常用的细胞分离液有Ficoll和Percoll。
人淋巴细胞分离液

人淋巴细胞分离液说明书修订日期:2018.12.10 Cat number:KGA830Store at 2-8℃ for 12 monthsFor Research Use Only一、试剂盒说明人淋巴细胞分离液将人血液中的淋巴细胞分离出来,是由于各种机体的血细胞比重不同制备出不同比重的分离液,它是一种体外应用的生化试剂,本品为带有乳光或微乳光的注射水溶液,主要组成成份是羟乙基淀粉(6%)与泛影酸钠9%,适用于从血液或组织匀浆中中分离所需细胞。
单个核细胞包括淋巴细胞和单核细胞等细胞,其体积、形态和密度与其他细胞不同,红细胞和白细胞等细胞密度较大,为1.090 g/ml 左右,而淋巴细胞和单核细胞密度为1.075~1.090 g/ml,血小板为1.030~1.035 g/ml。
经过密度梯度离心使一定密度的细胞按相应密度梯度分布,从而将各种血细胞加以分离。
二、试剂盒组份组份Cat: KGA830 保存条件人淋巴细胞分离液200ml 2-8℃,12months三、试剂盒以外自备仪器和试剂注射用生理盐水、离心机四、使用注意事项1. 启封后应置4℃保存,有效期6个月。
2. 细胞分离液从冰箱取出后,不可立即使用,需待溶液温度升至室温时,混匀后使用。
3. 整个分离过程中,温度应控制在18-28℃,否则会影响分离质量。
五、操作方法本分离液要求血液为新鲜的抗凝血,血液收集时应无菌操作且在储存、处理和运输过程中避免冷冻和冷藏。
1. 取新鲜抗凝血1ml,与注射用生理盐水1:1混匀后,小心加于2ml的细胞分离液之液面上,以400-800×g离心(半径15cm水平转子)20-30分钟,此时离心管中由上至下细胞分四层(第一层为血浆层(含血小板),第二层为环状乳白色淋巴细胞或单核细胞,第三层为透明分离液层,第四层为红细胞层(含大量中性粒细胞),红细胞层表面有悬起的部分白细胞层,收集此界面上的细胞)2. 用吸管小心收集第二层淋巴细胞,放入含4-5毫升注射用生理盐水的试管中,充分混匀后,以500×g离心20分钟,弃上清,沉淀经反复洗2次即得所需细胞。
小鼠外周血淋巴细胞分离液

小鼠外周血淋巴细胞分离液说明书修订日期:2016.03.31 Cat number:KGA831Storage RT for2yearsFor Research Use Only(科研专用)一、试剂盒说明小鼠淋巴细胞分离液将人血液中的淋巴细胞分离出来,是由于各种机体的血细胞比重不同制备出不同比重的分离液,它是一种体外应用的生化试剂,主要成分聚蔗糖(Ficoll)或葡聚糖与泛影酸葡甲胺或泛影酸钠,适用于从血液及组织匀浆中分离所需细胞。
二、试剂盒组份组份Cat:KGA831保存条件小鼠淋巴细胞分离液200ml室温,有效期两年。
样本稀释液(赠品)200ml清洗液(赠品)200ml三、试剂盒以外自备仪器和试剂离心机(最大离心力要求达到1200g)四、操作方法首先取抗凝血按体积比1:1的比例与样本稀释液混匀,根据稀释后的样本量大小,分以下两种情况:情况A:稀释后的血液样本量小于5ml时,实验方法如下:1.取一支15ml离心管,先加入与稀释后样本等量的分离液(注:分离液最少不得少于3ml)。
2.用吸管小心吸取稀释后的血液样本加于分离液液面上,400-500g,离心20-30min(注:根据血液样本量确定离心条件,血液样本量越多,离心力越大,离心时间越长,具体离心条件需客户自行摸索,以达到最佳分离效果)。
3.离心后,此时离心管中由上至下分为四层。
第一层为血浆层。
第二层为环状乳白色淋巴细胞层。
第三层为透明分离液层。
第四层为红细胞层。
4.用吸管小心吸取第二层环状乳白色淋巴细胞层到另一15ml离心管中,往所得离心管中加入10ml清洗液,混匀细胞。
5.250g,离心10min。
6.弃上清。
7.用吸管以5ml清洗液重悬所得细胞。
8.250g,离心10min。
9.重复6、7、8,弃上清后以0.5ml后续实验所需相应液体重悬细胞。
情况B:稀释后的血液样本量大于等于5ml时,实验方法如下:1.取一支适当的离心管,先加入与稀释后样本等量的分离液。
淋巴细胞分离计数实验报告

淋巴细胞分离计数实验报告一、实验目的本实验旨在通过淋巴细胞分离计数实验,了解淋巴细胞的分离过程和计数方法,并掌握相关技能。
二、实验原理1. 淋巴细胞的分离:通过梯度离心法将淋巴细胞与其他血液成分进行分离。
2. 细胞计数:使用显微镜和特殊计数板对淋巴细胞进行计数。
三、实验材料和设备1. 血液样品2. Ficoll-Paque液(用于梯度离心)3. 生理盐水4. 无菌注射器、针头5. 显微镜、计数板四、实验步骤1. 取适量血液样品加入无菌注射器中。
2. 将Ficoll-Paque液加入另一无菌注射器中。
3. 在针头上滴上生理盐水,避免空气进入。
4. 缓慢注入Ficoll-Paque液至血液样品上方。
注意不要将两种液体混合。
5. 离心20分钟,速度为400g。
此时,白色细胞会沉积到Ficoll-Paque层,红细胞会沉积到底部。
6. 用无菌注射器吸取上层白色细胞,转移到新的离心管中。
7. 加入适量生理盐水,混合均匀。
8. 离心10分钟,速度为200g。
此时,淋巴细胞会沉积到底部。
9. 弃去上层液体,用生理盐水洗涤淋巴细胞。
10. 在计数板上吸取适量淋巴细胞进行计数。
五、实验结果分析1. 淋巴细胞的分离效果:根据显微镜下观察到的细胞形态和数量来判断分离效果是否良好。
2. 细胞计数:根据计数板上的规则进行计数,并结合显微镜下观察到的图像来确定结果。
六、实验注意事项1. 操作过程要严格无菌,避免污染样品。
2. 离心过程中要注意速度和时间,以避免对样品产生影响。
3. 计数板要保持干燥和清洁。
七、实验结论通过本次淋巴细胞分离计数实验,我们成功地将淋巴细胞与其他血液成分进行了分离,并通过计数板对淋巴细胞进行了计数。
这些实验结果为我们进一步了解淋巴细胞的生物学特性和相关疾病提供了基础数据。
淋巴细胞分离液说明书

Lonza Walkersville, Inc.biotechserv@Tech Service: 800-521-0390Document # INST-17-829-1 06/07Walkersville, MD 21793-0127 USA© 2007 Lonza Walkersville, Inc.Lymphocyte Separation MediumInstruction For Use17-829EIntroductionLymphocyte Separation Medium (LSM) is a mixture of Ficoll® and sodium diatrizoate (Hypaque) with density adjusted to 1.077 g/ml. This sterile filtered product is intended for laboratory/manufacturing use, and is not for in vitro diagnostic use. It is commonly used to isolate lymphocytes from human blood. One protocol to accomplish this is presented here.Protocol1. Anticoagulated blood (citrated or heparinized)should be used.Note: Always treat human and other primatesource material as potentially infectious and take safety precautions.2. Dilute blood 1:1 with calcium-magnesium-freePBS and layer 9 ml onto 6 ml LSM. Use a clearplastic centrifuge tube with a cap. For largevolumes use a similar ratio of diluted blood toLSM.3. Centrifuge at 400xg for 15 minutes.4. Remove plasma-PBS without disturbing theinterface.5. Collect the interface with a cannula and dilute to20 ml in serum-free medium, such as RPMI1640.6. Centrifuge at 70xg for 10 minutes.7. Discard supernatant fluid and resuspend pelletin 2-3 ml serum-free medium.8. Count nucleated cells on a hemocytometer orelectronic counting device.9. Lymphocytes will be concentrated at theinterface, along with some platelets andmonocytes. Granulocytes will be found mostly in the Lymphocyte Separation Medium anderythrocytes will pellet at the bottom of the tube.References1. Boyum, A. 1968. Isolation of mononuclear cellsand granulocytes from human blood. Isolation of mononuclear cells by one centrifugation, and ofgranulocytes by combining centrifugation andsedimentation at 1 g. Scand. J. Clin. Lab. Invest.Suppl. 97:77-89.2. Boyum, A. 1976. Isolation of lymphocytes,granulocytes and macrophages. Scand. J. Clin.Lab. Invest. Suppl. 5:9-15.3. Boyum, A. 1977. Separation of lymphocytes,lymphocyte subgroups and monocytes: areview. Lymphology. 10-2:71-6.4. Boyum, A. 1984. Separation of lymphocytes,granulocytes and monocytes from human blood using iodinated density gradient media. Methods Enzymol. 108:88-102.5. Boyum, A. et al. 2002. Separation of HumanLymphocytes from Citrated Blood by DensityGradient (NycoPrep) Centrifugation: MonocyteDepletion Depending upon Activation ofMembrane Potassium Channels. Scand. J.Immunol. 56-1:76-84.6. Koistinen, P. 1987. Human peripheral blood andbone marrow cell separation using densitygradient centrifugation on Lymphoprep andPercoll in haematological diseases. Scand. J.Clin. Lab. Invest. 47-7:709-14.7. Rola-Pleszczynski, M. and W.H. Churchill. 1978.Purification of human monocytes by continuous gradient sedimentation in ficoll. J. Immunol.Methods. 20:255-62.Product Use StatementTHESE PRODUCTS ARE FOR RESEARCH USE ONLY. Not approved for human or veterinary use, for application to humans or animals, or for use in clinical or in vitro procedures.INST-17-829-1 06/07Ficoll is a trademark of GE Healthcare. All other trademarksherein are marks of Lonza Group or its subsidiaries.1。
分离牛脏器组织淋巴细胞的方法

分离牛脏器组织淋巴细胞的心得体会一、分离方法说明及图例A.取组织匀浆单细胞悬液(细胞浓度为2×108-1×109个/ml,具体制备方法参照“二、组织单细胞悬液的制备”)2ml,小心加于2ml细胞分离液(这次实验使用的是天津灏洋的分离液)之液面上;B.以400g(约1500转/分)离心15分钟(半径15cm水平转子);第二层细胞放入含4-5ml细胞洗涤液(Cat#:2010X1118)的试管中,充分混匀后,以500g(约1800转/分)离心20分钟,弃去上清留沉淀细胞重新悬起。
重复洗涤2次即得所需细胞。
注:提取率大于90%。
B. 全过程及所需试剂要求无菌环境。
二、组织单细胞悬液的制备注:A.本说明只提供机械匀浆制备单细胞悬液的方法,酶消化法由于各实验室选取的消化酶种类各不相同,请各实验室自行选择进行试验。
B. 全过程及所需试剂要求无菌环境。
剪碎法:将组织块放入平皿后,加入少量组织匀浆液及20%胎牛血清;用眼科剪将组织剪至匀浆状,加入5ml组织匀浆液及20%胎牛血清;用吸管吸取组织匀浆,用100目不锈钢滤网(另购)过滤到试管内;离心沉淀1500转/分×3min,再用细胞洗涤液清洗3次,每次以500rpm短时低速离心除去细胞碎片,以200目不锈钢滤网(另购)过滤去细胞团块。
作细胞计数并调整细胞浓度为(2~5)×107个/ml。
常温下放置,待测细胞的活力。
分离前用20%胎牛血清或全血及组织稀释液悬起细胞浓度为2×108-1×109个/ml的单细胞悬液备用。
匀浆器法:用眼科剪将组织剪成小块;放入70ml组织研磨器内,加入2ml组织匀浆液及20%胎牛血清;缓慢转动研棒,研磨至匀浆;用5ml组织匀浆液及20%胎牛血清冲洗研器;收集细胞悬液,经200目不锈钢滤网(另购)过滤;离心沉淀800rpm×2min,再用细胞洗涤液洗3次,离心沉淀。
作细胞计数并调整细胞浓度为(2~5)×107个/ml。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
各种动物或人淋巴细胞分离液操作说明和使用保存中的注
意事项:
各种动物或人淋巴细胞分离液操作说明和使用保存中的注意事项: 本品为带有乳光或微乳光的灭菌水溶液。
主要成分是Ficoll 400与泛影酸葡甲胺。
适用于从血液及组织匀浆中(小牛血清或人血清悬起匀浆的细胞 1X107/ml)分离所需细胞,在医疗和医学生
物中广泛应用。
其他人及动物多种比重细胞分离液。
注:因不同种属不同比重分离液的细胞离散系数及细胞带电不同,所以用户在定制分离液时应提供所需分离液的比重、动物的种属及被分离细胞的名称。
使用方法
例:取新鲜抗凝血1ml,与全血及组织匀浆稀释液(LOT#:2010C1119)液1:1 混匀后,小心加
于2ml的细胞分离液之液面上,以1500-2000转/分离心(半径15cm水平转子)15分钟,此时离心
管中由上至下细胞分四层。
第一层;为血浆或组织匀浆液层。
第二层;为环状乳白色淋巴细胞。
第三层;为透明分离液层。
第四层;为红细胞层,收集第二层细胞放入含细胞洗涤液 (LOT#:2010X1118)4-5毫升的试管中,充分混匀后,以1500-2000转/分离心10-30分钟。
沉
淀经反复洗2次即得所需细胞。
(此方法效果较好,推荐使用)
注意事项
1. 启封后应置4?保存避免微生物的污染。
2. 细胞分离液从冰箱取出后,不可立即使用,需待
溶液温度升至室温时,摇匀后使用。
3. 整个分离过程中,温度应控制在18-28?且在无菌环境
下,避免微生物的污染,否则会影响分离质量。
应用
-从动物血液及组织中分离所需细胞
特点
-密度变化率依照Ficoll 400,泛影酸和氢氧化钠. -最佳分离溶液的密度为参照具体产品的标签
-生理学参数 -在低粘度时高密度 -无菌-即用型-溶液
产品规格
溶液水
PH 7.0-7.5
渗透压 280-340mOsmol/kg 内毒素 <5EU/ml 无菌已检测
保存期限 2年
贮藏 +18?-+25?
注意
TBD实验室的细胞分离培养基是敏光型的。
这种培养基在运输和贮藏过程中应避光保温。
由于
各品牌离心机的性能不同,国内南北地区温度环境和四季的差异,可能影响分离效果,用户可以
调节离心转数,调节离心的时间,摸索最佳的分离条件(具体分离条件各实验室自定)。
组织,血液,细胞要求新鲜,避免冷冻和冷藏。
贮藏
18-25?避光保存。
启封后置4?保存。
本品为真空包装,未启封前置于10? 以下易出现白色结晶,影响分离效果。
取新鲜抗凝血1ml,与全血及组织匀浆稀释液(LOT#:2010C1119)液1:1 混匀后,小心加于2ml的细胞分离液之液面上
血液和分离液比例 1:2。
