络合滴定指示剂.
edta络合滴定法

edta络合滴定法介绍edta络合滴定法是一种常用的化学分析方法,用于测定金属离子的浓度和种类。
edta(乙二胺四乙酸)是一种强螯合剂,可以与金属离子形成稳定的络合物。
在滴定过程中,通过滴加已知浓度的edta溶液,可以确定待测溶液中金属离子的浓度。
仪器和试剂•滴定仪:包括滴定管、滴定架等。
•edta溶液:已知浓度的edta溶液。
•指示剂:常用的指示剂有eriochrome黑T(Eri-T)和印度洋粉(xylenol orange)。
操作步骤1.准备样品:将待测溶液准确地取出一定体积,转移到滴定瓶中。
2.加入指示剂:根据待测金属离子的性质选择合适的指示剂,加入到滴定瓶中。
指示剂会与金属离子形成有色络合物,当溶液中金属离子被edta络合完全时,指示剂的颜色会发生明显变化。
3.滴定:使用滴定管滴加已知浓度的edta溶液到滴定瓶中,直到指示剂颜色发生变化。
记录下滴定所需的edta溶液体积。
4.计算结果:根据滴定所需的edta溶液体积和其浓度,可以计算出待测溶液中金属离子的浓度。
影响滴定结果的因素1.pH值:edta络合滴定法对溶液的pH值比较敏感,一般要求在特定的pH范围内进行滴定。
pH值的变化会影响金属离子和edta络合的平衡,从而影响滴定结果的准确性。
2.温度:温度的变化也会对滴定结果产生影响。
一般情况下,滴定过程应在恒定的温度下进行,以保证结果的准确性。
3.指示剂的选择:不同的金属离子需要选择不同的指示剂,以保证滴定的准确性和灵敏度。
优点和应用•优点:edta络合滴定法具有操作简便、结果准确、灵敏度高等优点,广泛应用于环境监测、食品检测、药物分析等领域。
•应用:edta络合滴定法常用于测定水中金属离子的浓度,例如测定自来水中的钙、镁离子浓度,或者测定土壤中重金属离子(如铅、镉等)的含量。
注意事项•滴定过程中要注意滴定管的使用,确保滴定液滴加均匀。
•选择合适的滴定指示剂,以确保滴定结果的准确性。
•仪器和试剂要保持干净,避免杂质的干扰。
edta络合滴定法

edta络合滴定法EDTA络合滴定法是一种常用的分析化学方法,它广泛应用于金属离子的定量分析以及环境、食品、医药等多个领域。
该方法基于金属离子和EDTA(乙二胺四乙酸)之间的络合反应,通过滴定过程中络合物的形成与断裂,确定金属离子的含量。
本文将介绍EDTA络合滴定方法的原理、步骤、影响因素以及其应用。
1. 原理EDTA是一种能与金属离子形成稳定络合物的配体,它的酸碱性介于中性范围,独特的配位骨架使得它能与多种金属离子形成络合物。
在络合滴定过程中,首先将含有待测金属离子的溶液加入容器中,然后加入EDTA溶液作为滴定剂,滴定剂的浓度和体积是已知的。
加入滴定剂后,金属离子和EDTA之间发生络合反应,形成可溶的络合物,这个过程称为络合滴定反应。
2. 步骤(1)制备标准溶液:测量一定量的含有待测金属离子的溶液,加入稳定剂,稀释到一定体积。
这个溶液被称为标准溶液,用于滴定分析。
(2)准备滴定溶液:称取适量的EDTA盐固体,溶解在适量的盐酸中,并经过稀释得到EDTA滴定溶液。
(3)滴定:使用滴定管取一定量的标准溶液,加入适量的pH 缓冲液和指示剂,使其达到最适的pH条件。
然后滴定EDTA溶液,直到金属离子与EDTA发生定量的络合反应。
进一步加入指示剂,根据指示剂的颜色变化来确定终点。
(4)计算:根据滴定剂的浓度和体积,以及标准溶液的体积,计算出待测溶液中金属离子的浓度。
3. 影响因素EDTA络合滴定法的准确性和精确度受到多种因素的影响,包括pH值、温度、金属离子的选择、络合剂和指示剂的选择等。
确保滴定过程中的pH值恒定可以提高滴定的准确性。
温度的控制可以提高滴定反应的速率和反应的稳定性。
选择合适的金属离子、络合剂和指示剂可以使络合反应达到最佳效果,提高分析结果的准确性。
4. 应用EDTA络合滴定法广泛应用于金属离子的定量分析和质量控制。
它可以用于分析环境样品中的重金属含量,例如水中的铜、铁和锌。
在食品行业,EDTA络合滴定法可以用于测定食品样品中的钙、镁和锰等元素的含量。
第六章络合滴定法缓冲溶液指示剂滴定原理

若按该比例配制缓冲溶液,其缓冲容量太小,没有 应用价值,因此只能考虑改换络合剂。若选HEDTA 为络合剂,lgK (CaX) =8.0 pH=7.5时lgax(H) = 2.3
[X`] lg 6.0 8.0 2.3 0.3 [CaX]
[X`] 2 :1 [CaX]
配制HEDTA与Ca2+的物质的量之比为3:1,并调节 PH为7.5即可。
M
+
In
=
MIn
红色(络合态)
蓝色(游离态)
MIn + Y = MY + In
终点时: 红色 蓝色 注意:以上举例是金属离子无色情况,如果金属离子有 颜色,则溶液颜色是混合颜色
3.指示剂应具备的条件 P189 ① 显色络合物(MIn)与指示剂(In)的颜色应有明显差 别。金属指示剂多是有机酸,颜色随pH而变化。因此必须 控制合适的pH范围。 ② 显色络合物(MIn)的稳定性要适当 a KMIN > KMY KMY 得不到滴定终点, 终点拖后。 终点提前。
NB VB VM
主要内容:
提问:络合滴定是不是可以看成广义的酸碱反应 Y H6Y、MY解离可得到Y,因此可以将Y看成弱碱。 M在水中可以和OH -络合,可以将M看成强酸。因此络合滴 定可以看成广义的弱碱滴定强酸,注意酸碱滴定中没有这一 种情况。
㈠ 络合滴定曲线的绘制
Y→M 相当于
弱碱A →强酸H+
lg K MIn lg In(H)
说明:ep时[MIn]=[In`];[MIn] 10 显示[MIn]颜色;
[In`]
[MIn] 10 显示[In]颜色,络合滴定变色范围计算并不多。 [In`]
② 如M有副反应
络合滴定钙指示剂的选择_尹立君

络合滴定钙指示剂的选择尹立君(黑龙江省煤炭质量监督检验一站,鸡西158100) 络合滴定钙的指示剂中,以钙黄绿素灵敏度较高,但此指示剂色变欠佳。
为了增加终点变色对比度,文献[1]提出加入百里酚酞为衬色指示剂。
百里酚酞在强碱性溶液中为纯蓝色,使络合滴定钙终点呈现红紫色,终点指示不太理想。
另外,百里酚酞加入量对终点变化影响很大:量少,钙黄绿素萤光不易消失;量大,又使终点蓝色太深,变化不明显。
为使络合滴淀钙指示剂达到最佳组合,滴淀终点变色敏锐,使分析结果准确可靠,进行了络合滴定钙指示剂的选择试验。
1 指示剂对比 用E D T A在强碱性溶液中络合滴定钙,几种与钙黄绿素混合的双色或三色指示剂对比结果列于表1。
表1 指示剂对比指示剂1)终点变色终点判断情况a黄色—橙色有残余萤光a—b绿色—紫红色较明显a—b—酚酞绿色—红色过渡色带宽酚醛色消退a—b—刚果红绿色—红色明显、刚果红色渐退a—b—甲基蓝绿色—红色明显、甲基蓝色渐退a—b—亚销基R盐绿色—橙色较好a—b—中性红绿色—黄色不好a—b—茜素绿色—红色明显a—茜素绿色—橙色明显 注:1)a为钙黄绿素;b为百里酚酞。
2 试验结果 用茜素作为钙黄绿素的衬色指示剂,无论加与不加百里酚酞都能得到非常明显的终点变化,以不加百里酚酞为更佳。
茜素试剂在碱性溶液中呈玫瑰红色,它与钙黄绿素指示剂混合后,终点以绿色萤光消失转至明显红色,比其它三色指示剂终点指示明显,而且茜素在强碱中不退色,也不被氢氧化镁吸附。
因此,茜素是较为合适的络合滴定钙用的衬色指示剂。
3 指示剂配比 按样品分析测定方法分析国家标准物质白云石中的钙,标准值为30.50%,以钙黄绿素与茜素的比例1∶1至2∶1平行测定7次的结果为:30.51%、30.49%、30.50%、30.49%、30.50%、30.49%、30.50%;当钙黄绿素与茜素的比例小于1∶1时,平行测定7次的结果为:30.10%、30.08%、30.11%、30.09%、30.07%、30.08%、30.06%;当钙黄绿素与茜素的比例大于2∶1平行测定7次的结果为: 30.82%、30.90%、30.85%、30.88%、30.89%、30.88%、30.91%。
六亚甲基四胺在络合滴定中的作用

六亚甲基四胺在络合滴定中的作用
六亚甲基四胺是一种广泛应用于分析化学领域的络合剂,其在络合滴定中起着重要作用。
络合滴定是一种定量化学分析方法,其中一个化合物(称为指示剂)与被测试的化合
物反应,形成掩蔽剂-指示剂络合物。
这个络合物的形成和消失可以通过滴定时加入的控
制试剂来检测,从而可以准确地测量被测试化合物存在的浓度。
另外,六亚甲基四胺可以与一些金属离子形成络合物。
这些络合物可以改变被测试化
合物的性质,例如使其更易与控制试剂反应或改变其在水中的溶解度。
这些化学效应通常
被用来检测或分离特定种类的金属离子。
在一些滴定方法中,六亚甲基四胺还可以作为指示剂。
由于六亚甲基四胺与许多金属
离子形成的络合物的颜色发生变化,因此它可以用来指示滴定过程何时已达到终点。
例如,在铁离子滴定中,六亚甲基四胺与Fe(II)形成的络合物呈天蓝色,而与Fe(III)形成的络
合物为黄色。
当滴定剂完全转化Fe(II)为Fe(III)时,颜色从天蓝变为黄色,这表明已经
达到了终点。
络合滴定的条件

络合滴定的条件“络合滴定的条件之一是要有合适的指示剂哦,这就像在黑暗中为你指引方向的明灯!”比如说,在一次化学实验课上,我们要测定一种金属离子的浓度。
老师就强调了指示剂的重要性。
当时我们用的是EDTA滴定金属离子,选择了一种合适的指示剂,它在滴定过程中颜色变化非常明显。
当溶液的颜色从一种颜色逐渐变成另一种颜色的时候,就像一个信号告诉我们滴定达到了终点。
如果没有选对指示剂,或者指示剂的变色不灵敏,那我们就很难准确判断滴定的终点,实验结果也就不准确啦。
所以啊,合适的指示剂可是络合滴定的关键条件之一呢。
“稳定的反应体系也很重要哦,它就像一个坚固的城堡,为滴定反应提供安全的环境。
”我有个同学在做实验的时候,一开始没有注意反应体系的稳定性。
溶液的酸碱度没有调节好,结果在滴定过程中,出现了一些副反应,导致滴定结果偏差很大。
后来他重新调整了溶液的酸碱度,让反应体系变得稳定,再次进行滴定,就得到了比较准确的结果。
这就好比你要在一个平静的湖面上划船才能顺利到达目的地,如果湖面波涛汹涌,那船就很容易翻掉。
所以,在进行络合滴定时,一定要确保反应体系稳定,这样才能保证滴定反应顺利进行,得到可靠的结果。
“准确控制滴定速度也是个要点哦,它就像开车时控制油门一样,要恰到好处。
”有一次我和小组同学一起做络合滴定实验,其中一个同学滴定速度太快了,结果反应还没完全进行,就加入了过多的滴定剂,导致实验结果偏高。
后来我们重新做实验,这次大家都很注意滴定速度,慢慢地滴加滴定剂,让反应充分进行。
就像你在给花浇水的时候,不能一股脑儿地把水全倒下去,要慢慢地浇,让水充分渗透到土壤里。
这样才能保证络合滴定反应平稳进行,得到准确的结果。
所以,控制好滴定速度可不能马虎哦。
“溶液的酸碱度要合适哦,这就像给植物提供适宜的土壤酸碱度一样,关乎着反应的成败。
”比如说在测定某一种金属离子的含量时,我们需要根据金属离子和络合剂的性质,调节溶液到合适的酸碱度。
如果酸碱度不合适,金属离子可能会和其他物质发生反应,或者络合剂的络合能力会受到影响。
《络合滴定指示剂》课件

THANKS。
随着分析化学和材料科学的进步,新型络合 滴定指示剂不断涌现,如荧光络合滴定指示 剂、纳米络合滴定指示剂等。
络合滴定指示剂的应用拓展
络合滴定指示剂不仅在化学分析领域有广泛应用, 还逐渐拓展到生物医学、环境监测、食品安全等领 域。
络合滴定指示剂的灵敏度 与选择性提升
提高络合滴定指示剂的灵敏度和选择性是当 前研究的重要方向,有助于实现痕量元素的 分析。
在大气分析中的应用
要点一
检测大气中的有害气体
络合滴定指示剂可以用于检测大气中的有害气体,如二氧 化硫、氮氧化物等,通过与这些有害气体发生反应,指示 剂的颜色变化可以用来判断有害气体的浓度。
要点二
检测大气中的可吸入颗粒物
络合滴定指示剂还可以用于检测大气中的可吸入颗粒物, 如PM2.5、PM10等,通过与这些颗粒物发生反应,指示 剂的颜色变化可以用来判断颗粒物的含量。
特性
络合滴定指示剂应具有灵敏度高、选 择性好、稳定性好等特性,以便准确 指示滴定终点和反应进程。
指示剂在络合滴定中的作用
指示滴定终点
络合滴定指示剂可以指示滴定反应的 终点,即当滴定剂与被滴定物质完全 络合时,指示剂的颜色发生变化,从 而确定滴定终点。
指示反应进程
络合滴定指示剂可以指示络合反应的 进程,通过观察指示剂颜色的变化, 可以判断络合反应是否进行完全以及 反应进行的程度。
在石油化工行业中的应用
石油化工行业是另一个重要的应用领域。在石油和化工产品的生产和加工过程中 ,络合滴定指示剂可用于监测和控制各种化学反应的进行,以确保产品的质量和 安全性。
例如,在石油的提炼过程中,络合滴定指示剂可用于监测油品的酸度和碱度,以 确保油品的质量和稳定性。此外,在化学反应过程中,络合滴定指示剂也可用于 检测反应产物的成分和纯度。
5.2 络合滴定法

尽量使: pM’ep=pMsp
三、金属指示剂在使用中存在的问题
(一)指示剂的封闭现象
有时某些指示剂能与某些金属离子生成极 为稳定的络合物,但这些络合物较对应的 MY 络合物更稳定,以致到达计量点时滴入 过量EDTA,也不能夺取指示剂络合物(MIn) 中的金属离子,指示剂不能释放出来,看不 到颜色的变化,这种现象叫指示剂的封闭现 象。
目前,合成金属指示剂达300种以上,经 常有新的金属指示剂问世。
(一)铬黑T
铬 黑 T 属 O,O’- 二 羟 基 偶 氮 类 染 料 , 简 称 EBT 或 BT ,其化学名称是: 1-(1- 羟基 -2- 萘偶 氮)-6-硝基-2-萘酚-4-磺酸钠。
铬黑 T 的钠盐为黑褐色粉末,带有金属光泽, 使用时最适宜的 pH范围是9—11,在此条件下, 可用EDTA直接滴定Mg2+、Zn2+、Cd2+、Pb2+、 Hg2+ 等 离 子 。 对 Ca2+ 不 够 灵 敏 , 必 须 有 MgEDTA 或 Zn-EDTA 存在时,才能改善滴定终点。 一般滴定Ca2+和Mg2+的总量时常用铬黑T作指示 剂。
金属指示剂大多数是具有许多双
键的有色化合物易被日光氧化、空气
和氧化剂所分解。有些指示剂在水溶 液中不稳定,日久会变质。
举
例
如铬黑T、钙指示剂的水溶液均易氧化变质,所
以常配成固体混合物或用具有还原性的溶液来配
制溶液。
分解变质的速度与试剂的纯度也有关。一般纯度
较高时,保存时间长一些。
四、常用金属指示剂简介
(2) 酸度减小,对滴定有利,但酸度 太小,金属离子可能水解,影响滴 定,所以要控制溶液酸度。
edta的标定实验报告

edta的标定实验报告EDTA 的标定实验报告一、实验目的1、掌握 EDTA 标准溶液的配制和标定方法。
2、学会用络合滴定法测定金属离子的含量。
3、熟悉络合滴定中指示剂的选择和使用。
二、实验原理EDTA(乙二胺四乙酸)是一种很强的络合剂,能与许多金属离子形成稳定的 1:1 络合物。
本实验以 Zn²⁺为基准物质,在 pH 约为 10 的条件下,以铬黑 T 为指示剂,用 EDTA 标准溶液滴定至溶液由酒红色变为纯蓝色,即为终点。
反应式为:Zn²⁺+ H₂Y²⁻⇌ ZnY²⁻+ 2H⁺三、实验仪器与试剂1、仪器电子天平、酸式滴定管(50 mL)、移液管(25 mL)、容量瓶(250 mL)、锥形瓶(250 mL)、玻璃棒、烧杯(250 mL、500 mL)、胶头滴管。
2、试剂乙二胺四乙酸二钠盐(EDTA)、基准物质 ZnO、盐酸(1:1)、氨水(1:1)、氯化铵氢氧化铵缓冲溶液(pH ≈ 10)、铬黑 T 指示剂(5 g/L)。
四、实验步骤1、 EDTA 标准溶液的配制称取约 95 g EDTA 二钠盐于 500 mL 烧杯中,加入约 200 mL 水,温热溶解后,转入聚乙烯塑料瓶中,用水稀释至 1000 mL,摇匀。
2、锌标准溶液的配制准确称取 042 g 基准物质 ZnO 于 100 mL 烧杯中,用少量水润湿,滴加 1:1 盐酸至 ZnO 完全溶解,然后定量转移至 250 mL 容量瓶中,用水稀释至刻度,摇匀。
3、 EDTA 标准溶液的标定用移液管准确移取 2500 mL 锌标准溶液于 250 mL 锥形瓶中,加入20 mL 氯化铵氢氧化铵缓冲溶液和 3 滴铬黑 T 指示剂,用 EDTA 标准溶液滴定至溶液由酒红色变为纯蓝色,即为终点。
平行标定三份,计算 EDTA 标准溶液的浓度。
五、实验数据记录与处理1、数据记录|实验序号| V(Zn²⁺)/mL | V(EDTA 初读数)/mL |V(EDTA 终读数)/mL | V(EDTA)/mL |||||||| 1 | 2500 |_____ |_____ |_____ || 2 | 2500 |_____ |_____ |_____ || 3 | 2500 |_____ |_____ |_____ |2、计算EDTA 标准溶液的浓度计算公式为:c(EDTA) = m(ZnO) /(V(Zn²⁺) × M(ZnO)) × V(EDTA)其中,m(ZnO) 为 ZnO 的质量(g),V(Zn²⁺)为移取锌标准溶液的体积(mL),M(ZnO) 为 ZnO 的摩尔质量(8139 g/mol),V(EDTA) 为滴定消耗 EDTA 标准溶液的体积(mL)。
分析化学 第五章 络合滴定法

滴定允许的最低pH值: lgKMY = lgKMY - lgα Y(H) lgα Y(H) = lgKMY - lgKMY
lgα
Y(H)
≤lgKMY - lgK MY =lgKMY-8 (3-29)
将金属离子的KMY代入式3-29,计算出lgαY(H), 再查 表3-11得对应的pH值,即滴定允许的最低pH值。 将金属离子的lgKMY 与其滴定允许的最低pH值绘成
b.碱土金属离子的lgKMY = 7~11; c.过渡金属、稀土金属离子和Al3+、Ce3+ 、Y3+等 的lgKMY=12~19; d.多数三价、四价金属离子及Hg2+、Sn2+等离子的 lgKMY>20 。
注意:表中数据为无副反应发生时的稳定常数。
实际测定时要采用条件稳定常数。
二、EDTA的离解平衡
综合考虑EDTA的酸效应和金属离子的络合效应等 副反应时,络合物的实际稳定程度要用条件稳定常 数KMY表示:
lgKMY = lgKMY-lgα Y(H)- lgα ≈lgKMY-lgα Y(H) = lgKMY
M
注意:在络合滴定中,酸效应对络合物稳定性的影 响较大,而络合效应的影响相对较小,因而条件稳定 常数可只考虑酸效应的影响,近似用KMY代替KMY。
K MY
Y(H)
[Y' ] [Y]
MY
[MY] [M][Y]
[Y ] [Y' ]
根据:
Y(H)
可得:
[MY] K MY K MY ' [M][Y' ] Y ( H )
考虑酸效应的条件稳定常数:
lgKMY = lgKMY - lgα
Y(H)
络合滴定法

络合滴定法(硬度的测定)一、络合滴定的原理络合滴定法是以络合反应为基础的滴定分析方法。
乙二胺四乙酸就是一种常用的络合剂。
简称EDTA 。
它是一种四元酸,微溶于水。
通常情况下,一个EDTA 分子,可与一个不同价态的离子络合,也就是说,EDTA 与金属离子1:1络合,生成易溶于水的络合物。
在络合滴定中,等当点的判别常用金属指示剂来显示。
金属指示剂本身也是一种络合剂,它与金属离子生成的络全物颜色与游离指示剂的颜色不同,而且要求它与金属离子形成的络合的稳定性略低于EDTA 和金属离子形成的络合物的稳定性,在理论终点时,指示剂由络合状态被EDTA 置换而成为游离的指示剂,根据指示剂颜色的变化就可以判断终点。
如用铬黑T (简写成HI n 2-)为指示剂测Ca 2+时Ca 2+ + HI n 2- = CaI n - + H +用EDTA (简称为H 2Y 2-)滴定过程中Ca 2+ + H 2Y 2- =CaY 2- + 2H +在终点时,溶液中游离Ca 2+都与H 2Y 2-反应了,由于CaY 2-的稳定性比CaI n 2-的稳定性高,再加入的EDTA 就会夺取CaI n -中的Ca 2+,发生如下反应H 2Y 2- +CaI n - = CaY 2-+HI N -+H +酒红色 蓝色溶液由酒红色转变为蓝色,显示终点的到来。
由于EDTA 是一种多元酸,溶液的pH 值决定EDTA 的存在形式,从而影响到络合物的稳定性。
在测硬度时,一般用缓冲溶液控制溶液的pH 值为10±0.1。
二、试剂1、C (1/2EDTA)为0.04mol/L配制:称取8g 乙二胺四乙酸二钠溶入1L 高纯水中,摇匀。
标定:称取0.4g(准确到0.2mg)于800℃灼烧至恒重的氧化锌,用少许蒸馏水湿润,滴加盐酸溶液(1+1)至样品溶解移入250mL 容量瓶中,稀释至刻度,摇匀。
取上述溶液20.00mL ,加80mL 除盐水,用10%氨水中和至pH 为7~8,加5mL 氨-氯化铵缓冲溶液(Ph =10),加5滴ρ=5g/L 铬黑T 指示剂,用C (1/2edta)=0.04mol/L 溶液滴定至溶液由紫色变纯蓝色,记录消耗EDTA 标准溶液的体积。
络合滴定指示剂

一、作用原理
确定络合滴定终点的方法很多,常用的是 指示剂法。
金属指示剂是一种络合剂,它能与金属离子 形成与其本身显著不同颜色的络合物而指示滴 定终点。由于它能够指示出溶液中金属离子浓 度的变化情况,故也称为金属离子指示剂,简 称金属指示剂。这些金属指示剂具有酸碱指示 剂的性质。因此,使用时要注意体系的酸度。
9
2.指示剂的僵化 例如:PAN难溶于水 原因:MIn↓+ Y ↔ MY + In
指示剂或MIn溶解度小,或MIn只稍小于 MY的稳定性,导致反应慢,终点拖长或颜色变 化很不敏锐。
动力学因素,导致置换反应缓慢
消除(1)加热--加快速度 (2)有机溶剂--相似相溶
10
3.指示剂的氧化变质等 (在水溶液中不稳定)
滴定终点时 Mg-EBT + EDTA= Mg-EDTA + EBT
(红色)
(蓝色)
3
注意:In本身就是有机弱酸或弱碱,能随pH改变而发 生颜色变化。应特别注意各种指示剂适宜的使用酸度范 围。例如,铬黑T(EBT,NaH2In)在溶液中存在如下平衡:
H2ln- = HIn2- = In3(红色) (蓝色) (橙色) pH<6 pH=8-11 pH>12
1
1.原理
终点置换反应
In显色反应
2
现以EDTA滴定Mg2+离子(在pH=10的条件下),用 铬黑T(EBT)作指示剂为例,说明金属指示剂的变色原 理。
(1)Mg2+与铬黑T反应,形成一种与铬黑T本身颜色 不同的络合物:
滴定前 Mg2+ + EBT = Mg—EBT
(蓝色) (红色)
分析化学第五版第6章 络合滴定法 滴定原理 指示剂 2
M、N有副反应:
lg K MY
M ( L)
sp CM
lg K NY
N ( L)
sp CN
5
说明:分别滴定判别式由准确滴定判别式推导得出。
2. 金属离子指示剂应具备的条件(P189) (1) MIn与In-的颜色显著不同。 (2) 反应灵敏、迅速、有良好的变色可逆性。
(3) MIn的稳定性适当。K′MIn < K′MY (4) 稳定,便于储存和使用。
3. 金属离子指示剂的选择
(1)选择依据 指示剂应在pM突跃内发生颜色变化,且 指示剂变色点的pMep应尽量与化学计量点 pMsp一致。
滴定曲线
滴定突跃
20.00 20.02 20.20 22.00 40.00
1.000 1.001 1.010 1.100 2.000
6.12 7.24 8.24 9.24 10.1
计量点的 pM′sp、 pMsp、 pY′sp、 pYsp 计算 (1)M、Y均有副反应: M + Y = MY sp 时:
解: Zn(NH3) =106.68 ∴ Zn = Zn(NH3) + Zn(OH) -1 =106.68
∴ lgK′ZnY = lgKZnY - lgZn - lgY(H) =9.37
1 sp pZn sp (lg K ZnY pC Zn ) 5.69 2
pZnep 12.2
(3)常用指示剂 : P190, 397 要求掌握:① 颜色变化,使用pH范围的确定。
② 会查指示剂在不同pH下的pMep, 会求M有副反应时的pM ′ep。
pMep lg M pM ep
3. 指示剂的封闭、僵化与变质
(1)指示剂的封闭现离子N与In形成 十分稳定的 络合物NIn ,造成颜色不变。
第五章 络合滴定法

M +2L ⇌ ML2
M + 3L ⇌ ML3
M + 4L ⇌ ML4 β4= KS1KS2KS3KS4
βn= Ks = 1/Kd
利用各级形成常数,知道了游离金属离子和 游离配位体的平衡浓度,能比较方便地计算出溶 液中各级络合物型体的平衡浓度: [ML] = β1[M][L]
[ML2] = β2[M][L]2
一、络合物的形成常数 (一)ML型络合物 M + Y ⇌ MY(省略电荷)
K MY
[MY] [M][Y]
1 Ks Kd
[M][Y] Kd [MY]
KMY↑或Kd↓络合物稳定性越高。络合反 应越完全。
某些金属离子与EDTA的形成常数
lgK Na+ 1.7 lgK Mg2+ 8.7 Ca2+ 10.7 lgK Fe2+ La3+ Al3+ Zn2+ Cd2+ Pb2+ Cu2+ 14.3 15.4 16.1 16.5 16.5 18.0 18.8 lgK Hg2+ 21.8 Th4+ 23.2 Fe3+ 25.1 Bi3+ 27.9 ZrO2+ 29.9
0.40 0.20
H 5Y
H 3Y
H 4Y
0
2
4
6
8
10
12
pH
EDTA 各型体的δ-pH曲线
H6Y2+
H++H5Y+ K a,1=1.3 ×10-1=10-0.9
H5Y+
H4Y H3YH2Y2HY3-
H++H4Y
常用滴定指示剂
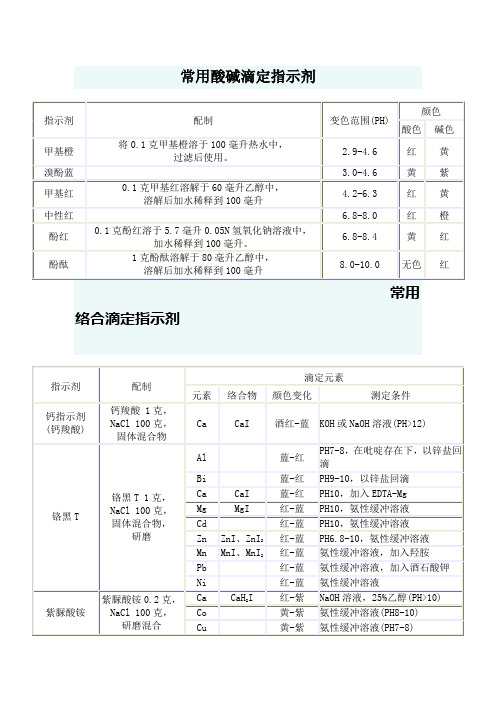
6.8-8.4
黄
红
酚酞
1克酚酞溶解于80毫升乙醇中,
溶解后加水稀释到100毫升
8.0-10.0
无色
红
常用络合滴定指示剂
指示剂
配制
滴定元素
元素
络合物
颜色变化
测定条件
钙指示剂
(钙羧酸)
钙羧酸1克,
NaCl 100克,
固体混合物
Ca
CaI
酒红-蓝
KOH或NaOH溶液(PH>12)
铬黑T
红-黄
硝酸溶液(PH 1.6-3.5)
Zr(IV)
ZrI
红-黄
1MHCl,热溶液
常用氧化还原滴定指示剂
指示剂
配制
标准电极电位(PH=0)
颜色
氧化形
还原形
苯基代邻氨基苯甲酸
将0.27克苯基代邻氨基苯甲酸溶于5毫升5%碳酸钠溶液中,用水稀释到250毫升。
红紫色
无色
铬黑T 1克,
NaCl 100克,
固体混合物,
研磨
Al
蓝-红
PH7-8,在吡啶存在下,以锌盐回滴
Bi
蓝-红
PH9-10,以锌盐回滴
Ca
CaI
蓝-红
PH10,加入EDTA-Mg
Mg
MgI
红-蓝
PH10,氨性缓冲溶液
Cd
红-蓝
PH10,氨性缓冲溶液
Zn
ZnI、ZnI2
红-蓝
PH6.8-10,氨性缓冲溶液
常用酸碱滴定指示剂
指示剂
配制
变色范围(PH)
颜色
酸色
碱色
甲基橙
将0.1克甲基橙溶于100毫升热水中,
络合滴定指示剂—金属指示剂(一)

络合滴定指示剂—金属指示剂(一)在络合滴定中,通常利用能与金属离子生成有色协作物的显色剂来指示滴定过程中金属离子浓度的变幻,这种显色剂称为金属指示剂。
(一)金属指示剂变色原理金属指示剂的变色原理是基于金属指示剂的色彩不同于与金属离子生成的协作物的色彩,例如用EDTA标准溶液滴定镁,溶液pH=10,加入指示剂铬黑T,因与镁离子生成红色协作物溶液呈红色。
反应如下:当以EDTA滴定,EDTA夺取Mgln-中的镁生成更稳定的MgY2-,反应如下:直到Mgln-彻低改变成MgY2-,同时游离出蓝色HIn2-,此时溶液由红色变为蓝色,指示尽头到达。
(二)金属指示剂应具备的条件 (1)金属指示剂本身的色彩应与金属离子和金属指示剂形成协作物的色彩有显然的区分。
惟独这样才干使尽头色彩变幻显然。
(2)指示剂与金属离子形成协作物的稳定性适当的小于EDTA与金属离子形成的协作物的稳定性。
金属离子与指示剂所形成协作物的稳定性要符合: 1gKMIn' 4 同时还要求:1gKMY'-1gKMIn'≥2 (3)指示剂不与被测金属离子产生封闭现象。
有时金属指示剂与某些金属离子形成极稳定的协作物,其稳定性超过1gKMY'以致在滴定过程中虽然滴入了过量的EDTA,也不能从金属指示剂协作物中夺取金属离子(M),因而无法确定滴定尽头。
这种现象称为指示剂的封闭现象。
(4)金属指示剂应比较稳定,以便于储存和用法。
但有些金属指示剂本身放置空气中易被氧化破坏,或发生分子聚合作用而失效。
为避开金属指示剂失效,对稳定性差的金属指示剂可用中性盐混合配成固体混合物储存备用。
也可以在金属指示剂溶液中加入防止其变质的试剂,如在铬黑T溶液中加。
(三)常用金属指示剂 (1)铬黑T (EBT)结构式如下:铬黑T 为黑褐色粉末,略带金属光泽,溶于水后,结合在磺酸根上的Na+所有电离,以阴离子形式存在于溶液中。
铬黑T是一个三元弱酸,以H2In-表示,在不同pH值时,其色彩变幻为铬黑T与无数金属离子生成显红色的协作物,为使尽头敏锐最好控制pH=8~10,这时尽头由红色变为蓝色比较敏锐。
沉淀滴定的指示剂及原理

沉淀滴定的指示剂及原理
沉淀滴定又称络合滴定或沉淀滴定法,是通过加入沉淀剂与分析物中的金属离子产生沉淀反应,然后加入指示剂,利用指示剂对于反应溶液颜色的改变,判断沉淀落下的瞬间,从而得到测量数据的一种分析方法。
沉淀滴定的常用指示剂有:
硫化钠:可以用于检测镍、铜、镉、铈等离子。
二苯卡琳:是用来检测铁、铝、锌、钡、钴等离子的指示剂。
浓缩硫酸:是检测镉、铜、铟、银及其他卤化物离子的指示剂。
十二烷基腈:用于检测钙、锌等离子。
沉淀滴定的原理是通过沉淀剂与分析物中的金属离子发生化学反应后,形成沉淀。
加入适当的指示剂,可以探测到沉淀形成的瞬间,从而得到准确的测量结果。
沉淀滴定常用的沉淀剂有氢氧化钠、氢氧化钙、硫化氢等,它们能与离子反应生成相应的沉淀。
指示剂又称滴定指示剂或指示药,它们呈现出明显的几种颜色或颜色的变化,能够指明沉淀与分析溶液混合的比例。
总的来说,沉淀滴定通过沉淀剂与分析物中的离子反应生成沉淀,然后加入指示剂,根据沉淀形成的瞬间判断溶液
比例,从而得到测量数据的一种分析方法。
指示剂的选择要根据沉淀的化学性质和反应参数进行,以获取更精确的分析结果。
络合滴定中常用的指示剂EDTA

络合滴定中常用的指示剂EDTA
刘焕梅
【期刊名称】《河北陶瓷》
【年(卷),期】2000(28)1
【总页数】2页(P35-36)
【关键词】络合滴定;指示剂;EDTA
【作者】刘焕梅
【作者单位】河北轻工业学校
【正文语种】中文
【中图分类】O655.25;TQ421.323
【相关文献】
1.发酵液乳酸含量测定法中EDTA络合滴定钙指示剂的改进 [J], 明恒磊;于颖;刘杰;王尚龙;袁宁宁;刘全兰
2.关于以PAN为指示剂EDTA络合-铜盐返滴定法测定铝的终点判别的几个问题[J], 王敏娟;刘睿;张蓓
3.EDTA络合滴定钙镁指示剂的改进 [J], 李红霞;李国江;张俊杰;唐桂芬
4.EDTA络合滴定法测定铜合金中锌的复合指示剂 [J], 张红侠;冯爱华
5.EDTA络合滴定金属离子新指示剂的研究 [J], 吴小华;陈建荣
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
三、金属指示剂在使用中存在的问题
(一)指示剂的封闭现象
有时某些指示剂能与某些金属离子生成极为 稳定的络合物,这些络合物较对应的 MY络合物更 稳定,以致到达计量点时滴入过量 EDTA,也不能 夺取指示剂络合物(MIn)中的金属离子,指示剂 不能释放出来,看不到颜色的变化,这种现象叫指 示剂的封闭现象。
一、金属离子指示剂的作用原理 金属指示剂也是一种络合剂,它能与金属离子形 成与其本身显著不同颜色的络合物而指示滴定终点。 由于它能够指示出溶液中金属离子浓度的变化情况, 故也称为金属离子指示剂,简称金属指示剂。现以 EDTA 滴定 Mg2+ 离子 ( 在 pH = 10 的条件下 ) ,用铬黑 T(EBT)作指示剂为例,说明金属指示剂的变色原理。 1 . Mg2+ 与铬黑 T 反应,形成一种与铬黑 T 本身 颜色不同的络合物 Mg2++EBT=Mg—EBT
其 水 溶 液 在 pH < 8 时 为 酒 红 色 ,pH 为 813.67 时呈蓝色 ,pH 为 12-13 间与 Ca2+ 形成酒红 色络合物 , 指示剂自身呈纯蓝色。因此 , 当 pH 值介 于12-13之间用EDTA滴定Ca2+时溶液呈蓝色。 使用此指示剂测定 Ca2+ 时,如有 Mg 存在, 则颜色变化非常明显,但不影响结果,原因和钙 镁特相同。 Fe3+、A13+、Ti3+、Cu2+、Ni2+和Co2+等 离子能封闭此指示剂。应将这些离子分离或掩蔽。 如有钛、铝和少量 Fe3+ 时,可用三乙醇胺掩蔽。 Cu2+ 、 Co2+ 、 Ni2+ 可加 KCN 掩蔽。 Mn2+ 可加三 乙醇胺用空气氧化后加KCN联合掩蔽。少量Cu2+、 Pb2+可加Na2S以消除其影响。
4 .指示剂应具有一定的选择性,即在一定条 件下,只对其一种(或某几种)离子发生显色反应。在 符合上述要求的前提下,指示剂的颜色反应最好又有 一定的广泛性,即改变了滴定条件,又能作其他离子 滴定的指示剂。这样就能在连续滴定两种 ( 或两种以 上)离子时,避免加人多种指示剂而发生颜色干扰。 此外,金属指示剂应比较稳定,便于贮存和使
用。
二、金属指示剂变色点的pM值 1、金属指示剂的选择
在酸碱滴定中,滴定突跃的统一尺度是 pH 值,一切酸碱 指示剂的变色范围都用pH表示,因而可以根据滴定曲线的突跃 范围来选择指示剂。在络合滴定中,虽然滴定过程中溶液里金 属离子浓度的变化也可绘成类似的滴定曲线,然后选择变色范 围正好落在滴定曲线突跃范围内的指示剂。这样作势必需要测 定各种指示剂对可滴定的每一种金属离子的变色范围,因此是 有一定困难的。在络合滴定中,一般用下列方法来选择指示剂。 设金属离子M与指示剂离子In生成MIn络合物: M+In=MIn, KMIn=[MIn]/[M][In] 或者 lgKMIn=pM+lg[MIn]/[In] 当 达 到 指 示 剂 的 变 色 点 时 ,[MIn] = [In] , 此 时 logKMIn=pM 当[MIn]浓度比[In]浓度约大10倍时,能明显地看出络合 物的颜色,则得: pM=logKMIn-1 当 [In] 浓度比 [MIn] 浓度约大 10 倍时,能明显地看出指 示剂的颜色,则得: pM=logKMIn+1
第五节 络合滴定指示剂
络合滴定也和其他滴定方法一样,判断终 点的方法有多种。如用电化学方法 ( 电位滴定、 安培滴定或电导滴定 ) ,光化学方法 ( 光度滴定 ) 等。最常用的还是用指示剂的方法。各种指示剂, 如酸碱指示剂、氧化还原指示剂,有时也能应用 于络合滴定,最重要的是利用金属指示剂来判断 滴定终点。近三十年来,由于金属指示剂的迅速 发展,使络合滴定法成为分析化学中最重要的滴 定分析方法之一。
2、金属离子-指示剂的条件形成常数 金属离子与指示剂的络合反应中,同样也存在 副反应,如指示剂的酸效应、金属离子的络合效应 和共存离子的影响等。如果只考虑酸效应,则有 KMIn′=[MIn]/[M][In’]=KMIn/αIn(H) lgKMIn′=pM+lg[MIn]/[In’] =lgKMIn- lgαIn(H) 当达到指示剂的变色点时 ,[MIn] = [In’] ,此 时若以此变色点来确定滴定终点,则 pMep=pMt=lgKMIn′= lgKMIn -lgαIn(H) 如果同时存在金属离子的副反应,则 pMep=pMt-lgαM
(蓝色)
(鲜红色)
2 .当滴入 EDTA 时,溶液中游离的 Mg2+ 逐 步被 EDTA 络合,当达到计量时,已与 EBT 络合的 Mg2+ 也被 EDTA 夺出,释放出指示剂 EBT ,因而就 引起溶液颜色的变化: Mg-EBT+EDTA=Mg-EDTA+EBT (鲜红色) (蓝色) 应该指出,许多金属指示剂不仅具有络合剂的 性质,而且本身常是多元弱酸或多元弱碱,能随溶 液 pH值变化而显示不同的颜色。例如铬黑 T,它是 一个三元酸,第一级离解极容易,第二级和第三级 离解则较难 (pka2 = 6.3 , pka3 = 11.6) ,在溶液中 有下列平衡: H2ln- = HIn2- = In3 (红色) (蓝色) (橙色) pH<6 pH=8-11 pH>12
2. 金属离子与指示剂所形成的有色络合物应该 足够稳定,在金属离子浓度很小时,仍能呈现明显的 颜色,如果它们的稳定性差而离解程度大,则在到达 计量点前,就会显示出指示剂本身的颜色,使终点提 前出现,颜色变化也不敏锐。 3.“M— 指示剂”络合物的稳定性 , 应小于“ M— EDTA”络合物的稳定性,二者稳定常数应相差在100 倍以上,即 logK’MY-logK’MIn>2,这样才能使EDTA 滴定到计量点时,将指示剂从“ M— 指示剂”络合物 中取代出来。
(三)指示剂的氧化变质现象 金属指示剂大多数是具有许多双键的有色 化合物易被日光氧化,空气所分解。有些指示剂 在水溶液中不稳定,日久会变质。如铬黑T、钙 指示剂的水溶液均易氧化变质,所以常配成固体 混合物或用具有还原性的溶液来配制溶液。分解 变质的速度与试剂的纯度也有关。一般纯度较高 时,保存时问长一些。另外,有些金属离子对指 示剂的氧化分解起催比作用。如铬黑T在Mn(IV) 或Ce4+存在下,仅数秒钟就分解褪色。为此,在 配制铬黑T时,应加入盐酸羟胺等还原剂。
铬黑T能与许多金属离子,如Ca2+、Mg2+、 Zn2+、Cd2+等形成红色的络合物。显然,铭黑T 在pH<6或pH>12时,游离指示剂的颜色与形 成的金属离子络合物颜色没有显著的差别。只有 在pH=8—11时进行滴定, 终点由金属离子络 合物的红色变成游离指示剂的蓝色,颜色变化才 显著。因此,使用金属指示剂,必须注意选用合 适的pH范围。 金属指示剂必须具备的条件: 1.在滴定的pH范围内,指示剂本身的颜色 与其金属离子结合物的颜色应有显著的区别。这 样,终点时的颜色变化才明显于有色络 合物的颜色变化为不可逆反应所引起。这时 MIn 有 色络合物的稳定性虽然没有 M—EDTA络合物的稳定 性 高 , 但 由 于 其 颜 色 变 化 为 不 可 逆 , 有 色 络 合物 MIn并不是很快地被EDTA所破坏因而对指示剂也产 生了封闭。如果封闭现象是被滴定离子本身所引起 的,一般可用返滴定法予以消除。如 A13+ 对二甲酚 橙有封闭作用,测定Al3+时可先加入过量的EDTA标 准溶液,于pH=3.5时煮沸,使A13+与EDTA完全络 合后,再调节溶液pH值为5—6,加入二甲酚橙,用 Zn2+或Pb2+标准溶液返摘定,即可克服A13+对二甲 酚橙的封闭现象。
(二)指示剂的僵化现象 有些金属指示剂本身与金属离子形成的络合物 的溶解度很小,使终点的颜色变化不明显;还有些金 属指示剂与金属离子所形成的络合物的稳定性只稍差 于对应EDTA络合物,因而使EDTA与MIn之间的反 应缓慢,使终点拖长,这种现象叫做指示剂的僵化。 这时,可加入适当的有机溶剂或加热,以增大其溶解 度。例如,用PAN(吡啶偶氮萘酚)作指示剂时,可 加入少量甲醇或乙醇也可以将溶液适当加热,以加快 置换速度,使指示剂的变色较明显。又如,用磺基水 杨酸作指示剂,以EDTA标准溶液滴定Fe3+时,可先 将溶液加热到50-70℃后,再进行滴定。
(三) 二甲酚橙 二甲酚橙属于三苯甲烷类显色剂,其化学名称为: 3,3’-双[N,N-二(羧甲基)-氨甲基]-邻甲酚磺酞。 常用的是二甲酚橙的四钠盐 , 为紫色结晶 ,易溶于 水 ,pH > 6.3 时呈红色 ,pH < 6.3 时呈黄色。它与金属 离子络合呈红紫色。因此,它只能在pH<6.3的酸性溶 液中使用。通常配成0.5%水溶液。 许多金属离子可用二甲酚橙作指示剂直接滴定, 如 ZrO2+(pH < 1 ) 、 Bi3+(pH=l-2) , Th4+(pH=2.5-3.5), Sc3+(pH=3-5) 、 Pb2+ 、 Zn2+ 、 Cd2+、Hg2+和Tl3+等离子和稀士元素的离子 (pH5-6) 都可以用 EDTA 直接滴定。终点时溶液由红色变为亮 黄色,很敏锐。 Fe3+ 、 A13+ 、 Ni2+ 、 Cu2+ 等离子, 也可以借加入过量EDTA后用Zn2+标准溶液返滴定。
钙镁特也是三元酸,可用 H3In 简式表示,它 的第一级离解常数很大,可以不考虑,其第二和第 三级离解如下: H2In- = HIn2- = ln3(鲜红色) (亮蓝色) (桔红色) 此指示剂在 pH=9-11时显蓝色,能与许多金 属离子生成 1:1 红色络合物。是一种灵敏的金属离 子检出剂。例如,镁离子浓度为l0-6-10-7mol/L时, 能与此试剂配合,呈鲜明的红色。 在 pH = 10 时 , 此指示剂与 Ca2+ 形成的络合物 的稳定性较与Mg2+形成的络合物小 ,所以,用此指示 剂测定 Ca2+ 变色并不灵敏。因此 , 为了能准确地滴 定 Ca2+, 应加入少量 Mg2+, 因为 Mg—EDTA 的条件形 成常数比Ca—EDTA的条件形成常数小,所以MgIn与 EDTA的作用及颜色变化只发生在 Ca—EDTA作用完 全之后。
