表面现象与分散系统一优秀课件
合集下载
物理化学第8章 表面物理化学

例如,要农药润湿带蜡的植物表面,要在农 药中加表面活性剂;
如果要制造防水材料,就要在表面涂憎水的 表面活性剂,使接触角大于90°。
2.增溶作用
定义:非极性有机物如苯在水中溶解度很小, 加入油酸钠等表面活性剂后,苯在水中的溶解度 大大增加,这称为增溶作用。
增溶作用与普通的溶解概念是不同的,增溶 的苯不是均匀分散在水中,而是分散在油酸根分 子形成的胶束中。
2、公式 (1)形式: ⊿p=2ϭ/r
(2)结论: ①凸液面: r >0,则 ⊿p > 0。
液滴越小,附加压力越大
②凹液面 : r< 0,⊿p<0。
③水平液面:r为无穷大, ⊿p= 0。
④对于液泡(如肥皂泡):
⊿p =
4ϭ r
因为肥皂泡有两个气液界面,且两个球形界面的
半径几乎相等,方向均指向液泡中心。
①液体能润湿毛细管(如水能润湿玻璃): 呈凹形曲面,且液面上升一定高度。
p'
p ''
p0
M H2O
N Hg
r g h =⊿ p = 2 ϭ
r
曲率半径 r与毛细管半径R的关系:
R´ = R
cosq
联立以上二式,可得:
2ϭcosq
h=
r gR
②液体不能能润湿毛细管(如汞不能润湿玻璃): 呈凹形曲面,且液面下降一定高度。
可见光的波长约在400~750 nm之间。
二、溶胶的力学性质
主要指: Brown 运动
扩散
沉降和沉降平衡
1、Brown运动(Brownian motion)
通过超显微镜,可以看到胶体粒子不断地 作不规则的“之”字形运动,这就叫布朗运 动。
产生原因:分散介质分子以不同大小和方向 的力对胶体粒子不断撞击而产生的。
如果要制造防水材料,就要在表面涂憎水的 表面活性剂,使接触角大于90°。
2.增溶作用
定义:非极性有机物如苯在水中溶解度很小, 加入油酸钠等表面活性剂后,苯在水中的溶解度 大大增加,这称为增溶作用。
增溶作用与普通的溶解概念是不同的,增溶 的苯不是均匀分散在水中,而是分散在油酸根分 子形成的胶束中。
2、公式 (1)形式: ⊿p=2ϭ/r
(2)结论: ①凸液面: r >0,则 ⊿p > 0。
液滴越小,附加压力越大
②凹液面 : r< 0,⊿p<0。
③水平液面:r为无穷大, ⊿p= 0。
④对于液泡(如肥皂泡):
⊿p =
4ϭ r
因为肥皂泡有两个气液界面,且两个球形界面的
半径几乎相等,方向均指向液泡中心。
①液体能润湿毛细管(如水能润湿玻璃): 呈凹形曲面,且液面上升一定高度。
p'
p ''
p0
M H2O
N Hg
r g h =⊿ p = 2 ϭ
r
曲率半径 r与毛细管半径R的关系:
R´ = R
cosq
联立以上二式,可得:
2ϭcosq
h=
r gR
②液体不能能润湿毛细管(如汞不能润湿玻璃): 呈凹形曲面,且液面下降一定高度。
可见光的波长约在400~750 nm之间。
二、溶胶的力学性质
主要指: Brown 运动
扩散
沉降和沉降平衡
1、Brown运动(Brownian motion)
通过超显微镜,可以看到胶体粒子不断地 作不规则的“之”字形运动,这就叫布朗运 动。
产生原因:分散介质分子以不同大小和方向 的力对胶体粒子不断撞击而产生的。
物理化学8 表面现象与分散系统

2、曲率对蒸气压的影响 、
弯曲液面的附加压力使小液滴比 平面液体具有更大的饱和蒸气压。
ps = p
pr = p + ∆p
在一定温度下,将1mol平面液体分散成半径为r的小液滴, 则吉布斯自由能的变化为:
∆G = µ r − µ = Vm ( pr − p ) = Vm ∆p
现假设,平面液体与小液滴的饱和蒸气压分别为:
kbp a = kθ = 1 + bp
上式即为朗格缪尔单分子层吸附等温式 讨论: ① 当气体压力很小时,bp<<1,得
a = kbp
② 当气体压力很大时,bp>>1,得
a=k
③ 若将
kbp a = kθ = 1+ bp
p 1+ bp 1 p = = + a kb kb k
以p/a对p作图应得一直线,该直线的斜率为1/k,截距为 1/kb。
σ’与σ是两个意义不同、单位不同、数值相同、 意义不同、 与 是两个意义不同 单位不同、数值相同、
量纲相同的物理量。两者相通, 量纲相同的物理量。两者相通,是同一表面性质 的物理量 的两种不同描述方式。统称表面张力, 的两种不同描述方式。统称表面张力,符号σ。
表面张力是强度性质。且随温度升高而降低。
第八章 表面现象与分散系统
1. 表面化学(界面化学):研究各种相界面的 性质,具有巨大界面积系统的特殊性质 (界面效应)。 胶体:是一类具有巨大界面积的系统。 2. 本章:实用性强,科研活跃。 3. 以前各章为什么不提出表面的特殊性。
§8.1 表面自由能与表面张力
1. 表面分子的特殊性
g 受力情况特殊:
p ' = ∆p + p
第6章表面现象ppt课件

图6-13 白口铁和可锻铸铁的G与T关系
设P0是平面(曲率半径为∞)液体的蒸气压,P是半径为r 的液滴的蒸气压,有质量为dg/M的液体从平面液体转移到 液滴中,该过程的吉布斯自由能变化为
dG1
dg M
(G0
RT
ln P / P0 )
dg M
(G0
RT
ln P0
/ P0)
dg M
RT
ln
p p0
根据热力学的最小自由能原理,表面自由能的减小有两种 可能:或减小表面积A,或减小表面张力σ;或两者同时减 小。1.减小表面积A:△G= σ △A 球状露珠
2.减小表面张力σ: △G= A△ σ 吸附作用
W’=f*△λ (环境) f=2σ*l
W’= 2 σ *l *△λ 2l *△λ= △A
W’= σ *△A 又△G=W’ △G= σ *△A σ= △G/ △A
另一方面,液滴的表面积增加dA,表面自由能变化为
dG 2 dA
dG1 dG 2
所以 dG RT ln p dA
又
M
A 4r2
p0
dA 8rdr
g 4 r3
dg 4r2dr
整理后得到 ln p 2 M p0 r RT
3 凯尔文(Kelvin)公式
从上式看出,r越小的液滴其蒸气压越大。
过饱和蒸气是温度降低到露点以下还不结晶为液体的蒸 气。
过饱和蒸气能够存在的原因是蒸气最初冷凝成液滴,是从 原有的气相产生一个新相,新相的自发形成是一个从无到有、 从小到大的过程,新形成的液滴极其微小,相对而言,微小液 滴的蒸气压大于片面液体的蒸气压,对液体饱和的蒸气压对液 滴并不饱和,如图6-11。若存在凝结中心,则可以大大降低其 过饱和程度。人工降雨、还原炼锌
设P0是平面(曲率半径为∞)液体的蒸气压,P是半径为r 的液滴的蒸气压,有质量为dg/M的液体从平面液体转移到 液滴中,该过程的吉布斯自由能变化为
dG1
dg M
(G0
RT
ln P / P0 )
dg M
(G0
RT
ln P0
/ P0)
dg M
RT
ln
p p0
根据热力学的最小自由能原理,表面自由能的减小有两种 可能:或减小表面积A,或减小表面张力σ;或两者同时减 小。1.减小表面积A:△G= σ △A 球状露珠
2.减小表面张力σ: △G= A△ σ 吸附作用
W’=f*△λ (环境) f=2σ*l
W’= 2 σ *l *△λ 2l *△λ= △A
W’= σ *△A 又△G=W’ △G= σ *△A σ= △G/ △A
另一方面,液滴的表面积增加dA,表面自由能变化为
dG 2 dA
dG1 dG 2
所以 dG RT ln p dA
又
M
A 4r2
p0
dA 8rdr
g 4 r3
dg 4r2dr
整理后得到 ln p 2 M p0 r RT
3 凯尔文(Kelvin)公式
从上式看出,r越小的液滴其蒸气压越大。
过饱和蒸气是温度降低到露点以下还不结晶为液体的蒸 气。
过饱和蒸气能够存在的原因是蒸气最初冷凝成液滴,是从 原有的气相产生一个新相,新相的自发形成是一个从无到有、 从小到大的过程,新形成的液滴极其微小,相对而言,微小液 滴的蒸气压大于片面液体的蒸气压,对液体饱和的蒸气压对液 滴并不饱和,如图6-11。若存在凝结中心,则可以大大降低其 过饱和程度。人工降雨、还原炼锌
【精品课件】胶体溶液和表面现象

胶体粒子带电的主要原因:
吸附作用 固体吸附剂优先选择吸附与它组成相关的 离子,或者能够在固体表面上形成难电离或难 溶解物质的离子。“相似相吸原理”
例如:Fe(OH)3胶体粒子很容易吸附与它结 构相似的FeO+离子,而带正电荷。 [Fe(OH)3]m·nFeO+
FeO+ FeO+ FeO+
FeO+
3、电学性质——电泳
直流电
电泳管示意图
电泳管中:
Fe(OH)3溶胶向负 极移动,说明 Fe(OH)3 溶胶中分散质粒子带 正电荷。As2S3向正极 移动, As2S3溶胶中分 散质带负电荷。
电泳: 在电场中,分散质粒子作定向移动,称为电泳。
胶粒带正电荷称为正溶胶,一般金属氢氧化物 的溶胶即为正溶胶。 胶粒带负电荷称为负溶胶,如:土壤、硫化物 、硅酸、金、银、硫等溶胶。
要掌握
三价离子>>二价离子>>一价离子
如:对于As2S3溶胶(负溶胶)的聚沉能力
AlCl3>CaCl2>NaCl
对于Fe(OH)3溶胶(正溶胶)的聚沉能力
K3[Fe(CN)6] >K2SO4>KCl
要掌握
要掌握
练习: 1. 将20ml 0.1mol / L的AgNO3与10ml
0.1mol / L的KI溶液混合。下列电解质中,对 AgI溶胶聚沉能力最强的是( )。
1、高分子化合物的分子量可达几百万,长 度可达几百纳米,但截面积只 相当于一个普 通分子大小。 2、是单个分子分散的单相体系,是真溶液, 溶解过程是自动的,也是可逆的,是热力学 的稳定体系。
3、无丁达尔效应因为高分子化合物分子中含 有大量的亲水基团(-OH, -COOH、-NH2 ), 溶剂化作用强,溶质与溶剂间无界面。
[高等教育]第八章 表面现象与分散系统
![[高等教育]第八章 表面现象与分散系统](https://img.taocdn.com/s3/m/4994621c0b4c2e3f572763b3.png)
界面张力。
10
(2)温度的影响 同一种物质,温度升高,体积膨胀,分子之间的相互 作用减弱,其表面张力减小。当达到临界温度Tc时,界面 张力趋向于零。 因为 运用全微分的 性质,可得:
S ( )T , P ,nB ( ) A, P ,nB As T
等式左方为正值,因为表面积增加,熵总是增加 的。所以 随T的增加而下降。
7
F=2γl
γ:表面张力,单位:N.m-1
表面张力γ: 为垂直作用于单位长度相界面上的力。为 物质特征,与T、p、组成及另一相有关。 纯液体γ: 液体与饱和了其本身蒸汽的空气接触时 而言。 非纯液体γ: 与组成物质的性质有关。
8
γ: 表面吉布斯函数、表面功。单位 J· m-2。 γ:界面张力, 垂直作用于单位长度表面上的力。 单位 N· m-1。 由于J=N· m,所以表面吉布斯函数、表面功与 界面张力的量纲相同。它们描述系统的同一个强度 性质,是系统的同一个热力学变量,但却不是完全 相同的一个量:①描述的角度不同,一个是能量概 念,另一个是力的概念。②单位不同。③界面张力 是矢(向)量,而表面能是标(非向)量。 γ的两种意义是等价的。一般情况下两者可以相互通用。
2
比表面(specific surface area)
比表面通常用来表示物质分散的程度,有两 种常用的表示方法:一种是单位质量的固体所具 有的表面积;另一种是单位体积固体所具有的表 面积。即:
Am A / m
或
AV A / V
Байду номын сангаас
式中,m和V分别为固体的质量和体积,A为其表 面积。目前常用的测定表面积的方法有BET法和 色谱法。
附加压力示意图
所有的点产生的总压力 为ps ,称为附加压力。凸面 上受的总压力为:po+ ps po为大气压力。
第二章 分散体系_PPT课件

定形胶状物。 过滤实验:
把各种溶液或胶体按右图实验,观察分散质是否 能透过羊皮纸。
结果:溶液的分散质(溶质)能透过羊皮纸,但 胶体的分散质不能。
第一章 溶液和胶体
第一节 分散体系 第二节 溶液的浓度 第三节 稀溶液的依数性 第四节 胶体溶液 第五节 乳状液和表面活性剂
第二节 溶液的浓度
第一节 分散体系
分散体系:一种或几种物质(分散质)分散 在另一种物质(分散剂)中所形成的体系.
按分散质粒子的大小分类,分散体系分为三类:
类型
分散质粒 子大小
主要性质
实例
分子/离子 分散体系
(溶液)
单相, 很稳定,扩散速度快
<1nm 能透过半透膜,电子显微镜
不可见
食盐水 蔗糖水
胶体分散系 1~100
一、物质的量及其单位
❖ 物质的量n——表示系统中所含基本单元的数量。SI 制基本物理量,单位为mol,称为“摩尔”。
❖ 基本单元——可以是分子、离子、原子及其他粒子, 或这些粒子的特定组合。
❖ 摩尔——是一系统的物质的量,该系统中所包含的 基本单元与0.012kg 12C的原子数目相等。1mol的任 何物质均含有6.02*1023个基本单元数。
一温度时,paq<p* 。 蒸汽压下降值:Δp = p*- p
蒸汽压下降原因:
溶质分子→溶剂化,束缚一些 高能量的溶剂分子;
溶剂表面被溶质分子占据。单位 时间内逸出液面的溶剂分子数目 便相应地减少了;
拉乌尔定律(定量计算):
一定T下,难挥发非电解质稀溶液的蒸气压p 等于纯溶剂的蒸气压p*乘以溶剂在溶液中的
(溶胶和
nm
高分子溶液)
多相/单相,较稳定,扩散速度慢,
把各种溶液或胶体按右图实验,观察分散质是否 能透过羊皮纸。
结果:溶液的分散质(溶质)能透过羊皮纸,但 胶体的分散质不能。
第一章 溶液和胶体
第一节 分散体系 第二节 溶液的浓度 第三节 稀溶液的依数性 第四节 胶体溶液 第五节 乳状液和表面活性剂
第二节 溶液的浓度
第一节 分散体系
分散体系:一种或几种物质(分散质)分散 在另一种物质(分散剂)中所形成的体系.
按分散质粒子的大小分类,分散体系分为三类:
类型
分散质粒 子大小
主要性质
实例
分子/离子 分散体系
(溶液)
单相, 很稳定,扩散速度快
<1nm 能透过半透膜,电子显微镜
不可见
食盐水 蔗糖水
胶体分散系 1~100
一、物质的量及其单位
❖ 物质的量n——表示系统中所含基本单元的数量。SI 制基本物理量,单位为mol,称为“摩尔”。
❖ 基本单元——可以是分子、离子、原子及其他粒子, 或这些粒子的特定组合。
❖ 摩尔——是一系统的物质的量,该系统中所包含的 基本单元与0.012kg 12C的原子数目相等。1mol的任 何物质均含有6.02*1023个基本单元数。
一温度时,paq<p* 。 蒸汽压下降值:Δp = p*- p
蒸汽压下降原因:
溶质分子→溶剂化,束缚一些 高能量的溶剂分子;
溶剂表面被溶质分子占据。单位 时间内逸出液面的溶剂分子数目 便相应地减少了;
拉乌尔定律(定量计算):
一定T下,难挥发非电解质稀溶液的蒸气压p 等于纯溶剂的蒸气压p*乘以溶剂在溶液中的
(溶胶和
nm
高分子溶液)
多相/单相,较稳定,扩散速度慢,
第八章表面现象与分散系统

5、掌握胶团结构和电动电势的意义及其对稳定性的影响,溶胶的聚沉。
6、了解溶胶的制备与净化方法。
教
学
重
点
1、表面自由能与表面张力。
2、弯曲表面现象。
3、溶液的表面吸附。
4、胶体分散系统的特征。
5、溶胶的电性质。
6、溶胶的聚沉。
7、溶胶的制备。
教
学
难
点
1、弯曲液面下的附加压力。
2、弯曲液面上的饱和蒸汽压。
三、大分子化合物对溶胶稳定性的影响。
1、保护作用。
2、敏化作用。
3、絮凝作用。
§8.10溶胶的制备与净化
一、溶胶的制备。
1、分散法。
2、凝聚法。
二、溶胶的净化。
教
学
进
度
及
课
时
分
配
节次
内容
学时
第八章
表面现象及分散系统
8学时
第一节
表面自由能与表面张力
1
第二节
纯液体的表面现象
1
第三节
气体在固体表面上的吸附
1、胶束的形成及特征。
2、临界胶束浓度。
三、表面活性剂的作用。
1、润湿作用。
2、增溶作用。
3、乳化作用。
§8.6分散系统的分类
一、分散系统的定义。
二、分散系统的分类。
1、按分散程度的高低及分散粒子的大小分。
2、按分散相与分散介质的聚集状态分。
§8.7溶胶的光学及力学性质
一、丁达尔现象。
1、丁达尔现象。
一、溶液表面的吸附现象。
1、表面吸附现象及正、负吸附。
2、产生原因。
二、吉布斯吸附公式。
1、吸附公式。
2、吸附量的意义。
6、了解溶胶的制备与净化方法。
教
学
重
点
1、表面自由能与表面张力。
2、弯曲表面现象。
3、溶液的表面吸附。
4、胶体分散系统的特征。
5、溶胶的电性质。
6、溶胶的聚沉。
7、溶胶的制备。
教
学
难
点
1、弯曲液面下的附加压力。
2、弯曲液面上的饱和蒸汽压。
三、大分子化合物对溶胶稳定性的影响。
1、保护作用。
2、敏化作用。
3、絮凝作用。
§8.10溶胶的制备与净化
一、溶胶的制备。
1、分散法。
2、凝聚法。
二、溶胶的净化。
教
学
进
度
及
课
时
分
配
节次
内容
学时
第八章
表面现象及分散系统
8学时
第一节
表面自由能与表面张力
1
第二节
纯液体的表面现象
1
第三节
气体在固体表面上的吸附
1、胶束的形成及特征。
2、临界胶束浓度。
三、表面活性剂的作用。
1、润湿作用。
2、增溶作用。
3、乳化作用。
§8.6分散系统的分类
一、分散系统的定义。
二、分散系统的分类。
1、按分散程度的高低及分散粒子的大小分。
2、按分散相与分散介质的聚集状态分。
§8.7溶胶的光学及力学性质
一、丁达尔现象。
1、丁达尔现象。
一、溶液表面的吸附现象。
1、表面吸附现象及正、负吸附。
2、产生原因。
二、吉布斯吸附公式。
1、吸附公式。
2、吸附量的意义。
物理化学课件-第8章 表面现象与分散系统

分散系统
Байду номын сангаас
溶胶分类
光、力学性质
电性质
溶胶聚沉和絮凝
13
表面现象
表面张力
纯液体表面现象
气固吸附
溶液表面吸附
表面活性剂
Kelvin eq.
RT ln p Vm (l )P(l )
p
pr
pr 2 RT ln Vm (l ) p r
2M pr Vm (l )2 ln RTr p RTr
分散系统
溶胶分类 光、力学性质 电性质 溶胶聚沉和絮凝 16
表面现象
表面张力
纯液体表面现象
气固吸附
溶液表面吸附
表面活性剂
三、液体的润湿与铺展 wetting and spreading
(l-g)
(s-g) O
O
(s-l)
分散系统
溶胶分类
光、力学性质
电性质
溶胶聚沉和絮凝
17
表面现象
表面张力
:单位表面积上的分子比相同数量的内部分子超额 的吉布斯自由能。
分散系统
溶胶分类
光、力学性质
电性质
溶胶聚沉和絮凝
4
表面现象
表面张力
纯液体表面现象
气固吸附
溶液表面吸附
表面活性剂
二、表面张力
单位:Nm-1 物理意义:表面紧缩力。 定义:在相表面的切面上,垂直作用于表面任意 单位长度上的紧缩力。 例如:表面为一平面:肥皂水膜 表面为一曲面:
纯液体表面现象
气固吸附
溶液表面吸附
表面活性剂
§8.1 表面自由能与表面张力
Surface free energy and surface tension 单组分密闭系统: dG = -SdT + Vdp +wr’ 在等温等压条件下:
大学化学表面活性剂化学PPT课件

因为粒子小,比表面大,表面自由能高,是热力学不稳
定体系,有自发降低表面自由能的趋势,即小粒子会自动
聚结成大粒子。
第4页/共25页
胶粒的结构
+ → + 例2:AgNO3 KI KNO3 AgI↓
过量的 AgNO3 作稳定剂
胶团的结构表达式:
[(AgI)m n Ag+ (n-x)NO3–]x+ x NO3–
分散体系分类 按分散相粒子的大小分类:
•分子分散体系 <10-9 m 白酒 •胶体分散体系 1 ~100 nm 溶胶 •粗分散体系 >100 nm 黄河水
第2页/共25页
1.分子分散体系
分散相与分散介质以分子或离子形式彼此混溶,没有界面,是均匀的单相,分 子半径大小在10-9 m以下 。通常把这种体系称为真溶液,如CuSO4溶液。
胶粒与扩散层中的反号离子,形成一个电中性的胶团。
第7页/共25页
胶粒的聚沉和保护 聚沉:加入电解质
两种带异号电荷的胶粒混合 加热
保护:
第8页/共25页
表面活性剂
从广义上讲,能使体系表面张力降低的溶质均 可称为表面活性物质;但习惯上只将显著降低表面 张力的这类化合物称为表面活性剂。
表面活性剂是一类具有双亲性结构的有机化合物。
洗涤作用是湿润、渗透、乳化、分散、增溶等多种作用的综合作用。一种去污 效果好的表面活性剂,并不表明各种性能都好,只是各种性能综合配合的好。
第21页/共25页
2、表面活性剂的应 用
(1) 金属清洗剂
金属清洗剂一般由多种表面活性剂和助剂组成,不仅能清除油污,而且还兼 有缓蚀、防锈功能,pH值一般控制在8~10范围,活性剂含量在40%~80%范围,助 剂1%~2%。表面活性剂大多是非离子型和阴离子型,常混合使用。
7表面现象与分散系统

◆过热液体 液体在正常沸腾温度不沸腾,要温度超过正常沸腾温度 才沸腾。
原因:液体表面气化,液体内部的极微小气泡 (新相)不能长大逸出(气泡内为凹液面)。 p大气 小气泡受到的压力为: p = p大气+ ps+ p静 p静=ρgh h ps = 2σ/r ◆ 过饱和溶液 ps 超过正常溶解度仍不结晶的溶液。 原因:微小物质的溶解度大。解决方法:加晶种
Δ GT,p,浸湿 = ΔGs,浸湿 =σs/l -σs/g
Δ GT,p,铺展= ΔGs,铺展=σs/l -σs/g+σl/g
σs/g ≥ 平衡 σs/l -σl/g 最低条件:σs/g =σs/l -σl/g
自动
σs/g ≥ σs/l
平衡
σs/g ≥ σs/l +σl/g 最低条件: σs/g =σs/l +σl/g
,熔融时,
B B(l)
则:
r,B> B(l)
微物熔融应满足:
r,B B(l)
只有降低熔点,才能使 r, B 减小,故有: Tf(微小)< Tf(大块)
▲ 微小物质化学活性大 微小物质化学势高,所以化学活性大 ▲ 亚稳状态与新相难成 易蒸发,易升华,易融化,易溶解,其逆过程 难冷凝,难凝华,难凝固,难结晶。 共同特征:从原体系中形成新的相态,初成的 新相颗粒是极微小的,则μi大,微粒很快蒸发 (升华,融化,溶解)。形成亚稳体系
2. 界面现象和表面现象:在相的界面上发生的行为 如: 露珠为球形 微小液滴易蒸发 水在毛细管中会自动上升 3. 比表面A0
A A0 V
例如:有边长为 l 的立方体,
l 分割成边长为 的小立方体, 10
6l 6 A0 3 l l 60 A0 ' 10 A0 l
第八章 表面现象与分散系统 物理化学教学课件
解:以 对c作图。
在c 1.5g / kg水处作切线, 求得曲线在该点的斜为率:
d (7050)103
dc
4.00.0
5.0103Nm1g1kg水
cd 1 .5 5 .0 1 3 0 3 .1 1 6 m 0m o 2 l Rd Tc 8 .3 1 24 .5 94
(b)归纳溶液表面张力与浓度的解析关系式,然后求微商。
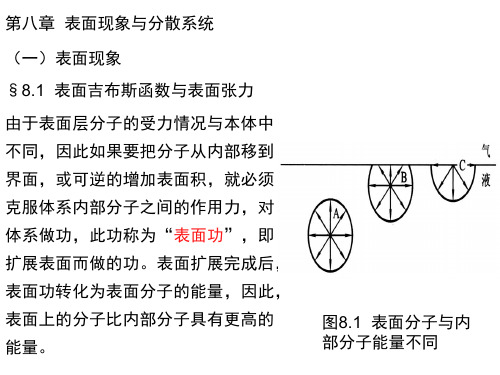
图8.1 表面分子与内 部分子能量不同
p' pp即 pp'p
p'dVpdVpdV
pdVdA 即 pdA
dV
A4r2即dA8rdr V 4r3即dV4r2dr
3
p 8rdr 2 4r2dr r
(拉普拉斯公式 )
图 8.2 附加压力与曲 率半径的关系
空气中(的 凸液 液 ): 滴 面 p' pp 液体中(的 凹气 液 ): 泡 面 p' pp
(3) 吸附曲线
在a,T,P三个因素中固定其一而反映另外两者关系的曲线称为 吸附曲线。 (i)吸附等压线 吸附质平衡分压一定时,反映吸附温度与吸附量之间关系的曲线。 (ii)吸附等量线 吸附量一定时,反映吸附温度与吸附质平衡分压之间关系的曲线。
(lT np)a R a dH T s2m
例1 教材294页例1
( s g ) ( s l) ( l g ) co 0s
cos(sg()l g)(sl)
若接触角小于90°,液体能润湿固体,如水在洁净的玻璃表面。
若接触角大于90°,液体不能润湿固体,如汞在玻璃表面;
若θ=0°完全润湿;θ=180°完全不润湿
若(sg)(sl)(lg)0, 则液体在固体 展表 开面 (完 完全 全润 时湿 取 ) 0 ,
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
WWWWWWWWWWWW 222222222222
表面张力
在两相(特别是气-液)界面上,处处存在着一种 张力,这种力垂直与表面的边界,指向液体方向并 与表面相切。
把作用于单位边界线上的这种力称为表面张
力,用 或 表示。
表面张力的单位是: N m1
表面张力
表面张力也可以这样来理解:
温度、压力和组成恒定时,可逆使表面积增加dA 所需要对系统作的非体积功,称为表面功。用公式表
表面现象与分散系 统一
第八章 表面现象
§8.1 表面张力及表面Gibbs自由能 §8.2 纯液体的表面现象 §8.3 液-液界面的性质 §8.4 溶液的表面吸附 §8.5 液-固界面-润湿作用 §8.6 表面活性剂及其作用 §8.7 固体表面的吸附
表面和界面 (surface and interface)
示为:
W ' dAs
式中 为比例系数,它在数值上等于当T,p 及
组成恒定的条件下,增加单位表面积时所必须对系
统做的可逆非膨胀功。
测定表面张力方法很多,如毛细管上升法、滴重法、
吊环法、最大压力气泡法、吊片法和静液法等
表面张力
纯物质的表面张力与分子的性质有关,通常是
(金属键)> (离子键)> (极性共价键)> (非极性共价键)
水因为有氢键,所以表面张力也比较大
Antonoff 发现,两种液体之间的界面张力是两 种液体互相饱和时的表面张力之差,即
1,2 1 2
这个经验规律称为 Antonoff 规则
表面热力学的基本公式
根据多组分热力学的基本公式
dU TdS pdV BdnB U U S,V , nB B 对需要考虑表面层的系统,由于多了一个表
界面是指两相接触的约几个分子厚度的过渡区, 若其中一相为气体,这种界面通常称为表面。
严格讲表面应是液体和固体与其饱和蒸气之间 的界面,但习惯上把液体或固体与空气的界面称为 液体或固体的表面。
常见的界面有:气-液界面,气-固界面,液-液 界面,液-固界面,固-固界面。
1.气-液界面
空气
CuSO 4 溶液
如果在活动边框上挂一重物,
使重物质量W2与边框质量W1所产 生的重力F与总的表面张力大小相 等方向相反,则金属丝不再滑动。
这时
F 2l
l 是滑动边的长度,因膜有两个
面,所以边界总长度为2l, 就是作
用于单位边界上的表面张力。
F=(W1W2)g
= 2 l 22222222222 lllllllllllW 1
气-液 界面
2.气-固界面
气-固界面
3.液-液界面
H 2O
Hg
液-液 界面
4.液-固界面
Hg
液-固界面
H 2O
玻璃板
5.固-固界面
Cr镀层 铁管
固-固界面
界面现象的本质
表面层分子与内部分子相比所处的环境不同 体相内部分子所受四周邻近相同分子的作用力
是对称的,各个方向的力彼此抵销; 但是处在界面层的分子,一方面受到体相内相
)T
, P , nB
狭义的表面自由能定义:
(
G As
)T
, P , nB
又可称为表面Gibbs自由能
表面自由能的单位: J m2
表面张力与温度的关系
温度升高,表面张力下降,当达到临界温度Tc时, 表面张力趋向于零。这可用热力学公式说明:
因为dG SdT VdP dA BdnB B
运用全微分的性质,可得:
表面张力(surface tension)
液体表面的最基本的特性是趋向于收缩 由于表面层分子的受力不均衡,液滴趋向于 呈球形,水银珠和荷叶上的水珠也收缩为球形。 从液膜自动收缩的实验,可以更好地认识这 一现象 将一含有一个活动边框的金属线框架放在 肥皂液中,然后取出悬挂,活动边在下面。
由于金属框上的肥皂膜的表面张力作用, 可滑动的边会被向上拉,直至顶部。
例如,把边长为1 cm的立方体1 cm3 ,逐渐分 割成小立方体时,比表面将以几何级数增长。
分散程度越高,比表面越大,表面能也越高
可见达到nm级的超细微粒,具有巨大的比表面 积,因而具有许多独特的表面效应,成为新材料和 多相催化方面的研究热点。
§8.1 表面张Βιβλιοθήκη 及表面Gibbs自由能表面张力 表面热力学的基本公式 界面张力与温度的关系 溶液的表面张力与溶液浓度的关系
同物质分子的作用,另一方面受到性质不同的另一 相中物质分子的作用,其作用力未必能相互抵销, 因此,界面层会显示出一些独特的性质。
对于单组分系统,这种特性主要来自于同一物质 在不同相中的密度不同;对于多组分系统,则特性来 自于界面层的组成与任一相的组成均不相同。
最简单的例子是液体及其蒸气组成的表面。
液体内部分子所受的力可 以彼此抵销,但表面分子受到 体相分子的拉力大,受到气相 分子的拉力小(因为气相密度 低),所以表面分子受到被拉 入体相的作用力。
这种作用力使表面有自动收缩到最小的趋势,并 使表面层显示出一些独特性质,如表面张力、表面吸 附、毛细现象、过饱和状态等。
界面现象的本质
比表面(specific surface area)
比表面通常用来表示物质分散的程度,有两
种常用的表示方法:一种是单位质量的固体所具
有的表面积;另一种是单位体积固体所具有的表
面积。即:
A0
As m
或
A0
As V
式中,m 和 V 分别为固体的质量和体积,As为其 表面积。目前常用的测定表面积的方法有BET法
和色谱法。
分散度与比表面
把物质分散成细小微粒的程度称为分散度。 把一定大小的物质分割得越小,则分散度越高, 比表面也越大。
面相,在体积功之外,还要增加表面功,则基本 公式为
dU TdS pdV dAs BdnB B U U S,V , As, nB
表面自由能 (surface free energy)
广义的表面自由能定义:
(
U As
)S
,V
,nB
(
H As
)S
, P , nB
(
A As
)T
,V
,nB
(
G As
S As T,V,nB
T As,V,nB
S As T,p,nB
T As,p,nB
等式左方为正值,因为表面积增加,熵总是增加
的。所以 随T的增加而下降。
溶液的表面张力与溶液浓度的关系
水的表面张力因加入溶质形成溶液而改变。 非表面活性物质
能使水的表面张力明显升高的溶质称为非表 面活性物质。如无机盐和不挥发的酸、碱等。
表面张力
在两相(特别是气-液)界面上,处处存在着一种 张力,这种力垂直与表面的边界,指向液体方向并 与表面相切。
把作用于单位边界线上的这种力称为表面张
力,用 或 表示。
表面张力的单位是: N m1
表面张力
表面张力也可以这样来理解:
温度、压力和组成恒定时,可逆使表面积增加dA 所需要对系统作的非体积功,称为表面功。用公式表
表面现象与分散系 统一
第八章 表面现象
§8.1 表面张力及表面Gibbs自由能 §8.2 纯液体的表面现象 §8.3 液-液界面的性质 §8.4 溶液的表面吸附 §8.5 液-固界面-润湿作用 §8.6 表面活性剂及其作用 §8.7 固体表面的吸附
表面和界面 (surface and interface)
示为:
W ' dAs
式中 为比例系数,它在数值上等于当T,p 及
组成恒定的条件下,增加单位表面积时所必须对系
统做的可逆非膨胀功。
测定表面张力方法很多,如毛细管上升法、滴重法、
吊环法、最大压力气泡法、吊片法和静液法等
表面张力
纯物质的表面张力与分子的性质有关,通常是
(金属键)> (离子键)> (极性共价键)> (非极性共价键)
水因为有氢键,所以表面张力也比较大
Antonoff 发现,两种液体之间的界面张力是两 种液体互相饱和时的表面张力之差,即
1,2 1 2
这个经验规律称为 Antonoff 规则
表面热力学的基本公式
根据多组分热力学的基本公式
dU TdS pdV BdnB U U S,V , nB B 对需要考虑表面层的系统,由于多了一个表
界面是指两相接触的约几个分子厚度的过渡区, 若其中一相为气体,这种界面通常称为表面。
严格讲表面应是液体和固体与其饱和蒸气之间 的界面,但习惯上把液体或固体与空气的界面称为 液体或固体的表面。
常见的界面有:气-液界面,气-固界面,液-液 界面,液-固界面,固-固界面。
1.气-液界面
空气
CuSO 4 溶液
如果在活动边框上挂一重物,
使重物质量W2与边框质量W1所产 生的重力F与总的表面张力大小相 等方向相反,则金属丝不再滑动。
这时
F 2l
l 是滑动边的长度,因膜有两个
面,所以边界总长度为2l, 就是作
用于单位边界上的表面张力。
F=(W1W2)g
= 2 l 22222222222 lllllllllllW 1
气-液 界面
2.气-固界面
气-固界面
3.液-液界面
H 2O
Hg
液-液 界面
4.液-固界面
Hg
液-固界面
H 2O
玻璃板
5.固-固界面
Cr镀层 铁管
固-固界面
界面现象的本质
表面层分子与内部分子相比所处的环境不同 体相内部分子所受四周邻近相同分子的作用力
是对称的,各个方向的力彼此抵销; 但是处在界面层的分子,一方面受到体相内相
)T
, P , nB
狭义的表面自由能定义:
(
G As
)T
, P , nB
又可称为表面Gibbs自由能
表面自由能的单位: J m2
表面张力与温度的关系
温度升高,表面张力下降,当达到临界温度Tc时, 表面张力趋向于零。这可用热力学公式说明:
因为dG SdT VdP dA BdnB B
运用全微分的性质,可得:
表面张力(surface tension)
液体表面的最基本的特性是趋向于收缩 由于表面层分子的受力不均衡,液滴趋向于 呈球形,水银珠和荷叶上的水珠也收缩为球形。 从液膜自动收缩的实验,可以更好地认识这 一现象 将一含有一个活动边框的金属线框架放在 肥皂液中,然后取出悬挂,活动边在下面。
由于金属框上的肥皂膜的表面张力作用, 可滑动的边会被向上拉,直至顶部。
例如,把边长为1 cm的立方体1 cm3 ,逐渐分 割成小立方体时,比表面将以几何级数增长。
分散程度越高,比表面越大,表面能也越高
可见达到nm级的超细微粒,具有巨大的比表面 积,因而具有许多独特的表面效应,成为新材料和 多相催化方面的研究热点。
§8.1 表面张Βιβλιοθήκη 及表面Gibbs自由能表面张力 表面热力学的基本公式 界面张力与温度的关系 溶液的表面张力与溶液浓度的关系
同物质分子的作用,另一方面受到性质不同的另一 相中物质分子的作用,其作用力未必能相互抵销, 因此,界面层会显示出一些独特的性质。
对于单组分系统,这种特性主要来自于同一物质 在不同相中的密度不同;对于多组分系统,则特性来 自于界面层的组成与任一相的组成均不相同。
最简单的例子是液体及其蒸气组成的表面。
液体内部分子所受的力可 以彼此抵销,但表面分子受到 体相分子的拉力大,受到气相 分子的拉力小(因为气相密度 低),所以表面分子受到被拉 入体相的作用力。
这种作用力使表面有自动收缩到最小的趋势,并 使表面层显示出一些独特性质,如表面张力、表面吸 附、毛细现象、过饱和状态等。
界面现象的本质
比表面(specific surface area)
比表面通常用来表示物质分散的程度,有两
种常用的表示方法:一种是单位质量的固体所具
有的表面积;另一种是单位体积固体所具有的表
面积。即:
A0
As m
或
A0
As V
式中,m 和 V 分别为固体的质量和体积,As为其 表面积。目前常用的测定表面积的方法有BET法
和色谱法。
分散度与比表面
把物质分散成细小微粒的程度称为分散度。 把一定大小的物质分割得越小,则分散度越高, 比表面也越大。
面相,在体积功之外,还要增加表面功,则基本 公式为
dU TdS pdV dAs BdnB B U U S,V , As, nB
表面自由能 (surface free energy)
广义的表面自由能定义:
(
U As
)S
,V
,nB
(
H As
)S
, P , nB
(
A As
)T
,V
,nB
(
G As
S As T,V,nB
T As,V,nB
S As T,p,nB
T As,p,nB
等式左方为正值,因为表面积增加,熵总是增加
的。所以 随T的增加而下降。
溶液的表面张力与溶液浓度的关系
水的表面张力因加入溶质形成溶液而改变。 非表面活性物质
能使水的表面张力明显升高的溶质称为非表 面活性物质。如无机盐和不挥发的酸、碱等。
