琼脂稀释法测定抗菌药物最低抑菌浓度MIC精编WORD版
琼脂稀释法测定抗菌药物最低抑菌浓度(MIC)资料解读

琼脂稀释法测定抗菌药物最低抑菌浓度(MIC)|琼脂稀释法琼脂稀释法是将不同剂量的抗菌药物,加入融化并冷至50℃左右的定量MH琼脂中,制成含不同递减浓度抗菌药物的平板,接种受试菌,孵育后观察细菌生长情况,以抑制细菌生长的琼脂平板所含最低药物浓度为MIC。
本法优点是可在一个平板上同时作多株菌MIC测定,结果可靠,易发现污染菌;缺点是制备含药琼脂平板费时费力。
1.培养基制备使用MH琼脂,按商品说明书进行配制,pH7.2~7.4。
淋病奈瑟菌使用GC琼脂基础加1%添加剂;其它链球菌使用含5%(V/V)绵羊血的MH琼脂(当试验磺胺药时,使用溶解的马血)。
2.含药琼脂平板制备根据实验设计,将已倍比稀释的不同浓度的抗菌药物分别加入已加热溶解,并在45~50℃水浴中平衡的MH琼脂中,充分混匀倾倒灭菌平皿,琼脂厚度3~4mm。
通常按1∶9比例配制药物琼脂平板,根据需要来选择药物浓度范围。
配制好的含药琼脂平板应装入密封塑料袋中,置2~8℃冰箱可贮存5天。
3.接种物制备与接种制备浓度相当于0.5麦氏标准比浊管的菌悬液,再1∶10稀释,以多点接种器吸取制备好菌液(约1~2μl)接种于琼脂平板表面,每点菌数约为104CFU,形成直径为5~8mm的菌斑。
接种好后置35℃孵育16~20h(甲氧西林耐药葡萄球菌、万古霉素耐药肠球菌孵育时间应满24h),观察结果。
奈瑟菌属、链球菌属细菌置5%二氧化碳、幽门螺杆菌置微需氧环境中孵育。
4.结果判断将平板置于暗色、无反光物体表面上判断试验终点,以抑制细菌生长的最低药物浓度为MIC。
在含甲氧苄胺嘧啶或磺胺琼脂平板上可见轻微细菌生长,与生长对照比较抑制80%以上细菌生长的最低药物浓度作为终点浓度。
如果出现有2个以上菌落生长于含药浓度高于终点水平的琼脂平板上,或低浓度药物琼脂平板上不长而高浓度药物琼脂平板上生长现象,则应检查培养物纯度或重复试验。
读书的好处1、行万里路,读万卷书。
2、书山有路勤为径,学海无涯苦作舟。
测定抗菌药物最低抑菌浓度(MIC)方法

测定抗菌药物最低抑菌浓度(MIC)方法测定抗菌药物最低抑菌浓度(MIC)方法1.1.常量肉汤稀释法1.1.1.抗菌药物贮存液制备抗菌药物贮存液浓度不应低于1000μg/ml(如1280μg/ml)或10倍于最高测定浓度。
溶解度低的抗菌药物可稍低于上述浓度。
抗菌药物直接购自厂商或相关机构。
所需抗菌药物溶液量或粉剂量可公式进行计算。
例如:需配制100 ml浓度为1280μg/ml的抗生素贮存液,所用抗生素为粉剂,其药物的有效力为750μg/mg。
用分析天平精确称取抗生素粉剂的量为182.6 mg。
根据公式计算所需稀释剂用量为:(182.6 mg×750μg/ml)/1280μg/ml=107.0ml,然后将182.6 mg 抗生素粉剂溶解于107.0ml稀释剂中。
制备抗菌药物贮存液所用的溶剂和稀释剂见表5。
配制好的抗菌药物贮存液应贮存于-60℃以下环境,保存期不超过6个月。
1.1.2.药敏试验用抗菌药物浓度范围根据NCCLS抗菌药物敏感性试验操作标准,药物浓度范围应包含耐药、中介和敏感分界点值,特殊情况例外。
1.1.3.培养基NCCLS推荐使用Mueller-Hinton(MH)肉汤,pH7.2~7.4。
需氧菌及兼性厌氧菌在此培养基中生长良好。
在测试葡萄球菌对苯唑西林的敏感性时,应在肉汤中加入2%(W/V)氯化钠,按制造厂家的要求配制需要量的MH肉汤。
嗜血杆菌属菌使用HTM肉汤,肺炎链球菌和其它链球菌使用含2%~5%溶解马血的MH肉汤。
1.1.4.接种物的制备有2种方法配制接种物,一是细菌生长方法,用接种环挑取形态相似待检菌落3-5个,接种于4-5ml的水解酪蛋白(MH)肉汤中,35℃孵育2-6h。
增菌后的对数生长期菌液用生理盐水或MH 肉汤校正浓度至0.5麦氏比浊标准,约含1~2×108CFU/ml。
二是直接菌落悬液配制法,对某些苛养菌,如流感嗜血杆菌、淋病奈瑟菌和链球菌及甲氧西林耐药的葡萄球菌等菌株,推荐直接取培养18~24h 的菌落调配成0.5麦氏比浊标准的菌悬液。
测定抗菌药物最低抑菌浓度(MIC)方法

测定抗菌药物最低抑菌浓度(MIC)方法1.1.常量肉汤稀释法1.1.1.抗菌药物贮存液制备抗菌药物贮存液浓度不应低于1000μg/ml(如1280μg/ml)或10倍于最高测定浓度。
溶解度低的抗菌药物可稍低于上述浓度。
抗菌药物直接购自厂商或相关机构。
所需抗菌药物溶液量或粉剂量可公式进行计算。
例如:需配制100 ml浓度为1280μg/ml的抗生素贮存液,所用抗生素为粉剂,其药物的有效力为750μg/mg。
用分析天平精确称取抗生素粉剂的量为182.6 mg。
根据公式计算所需稀释剂用量为:(182.6 mg×750μg/ml)/1280μg/ml=107.0ml,然后将182.6 mg抗生素粉剂溶解于107.0ml稀释剂中。
制备抗菌药物贮存液所用的溶剂和稀释剂见表5。
配制好的抗菌药物贮存液应贮存于-60℃以下环境,保存期不超过6个月。
1.1.2.药敏试验用抗菌药物浓度范围根据NCCLS抗菌药物敏感性试验操作标准,药物浓度范围应包含耐药、中介和敏感分界点值,特殊情况例外。
1.1.3.培养基NCCLS推荐使用Mueller-Hinton(MH)肉汤,pH7.2~7.4。
需氧菌及兼性厌氧菌在此培养基中生长良好。
在测试葡萄球菌对苯唑西林的敏感性时,应在肉汤中加入2%(W/V)氯化钠,按制造厂家的要求配制需要量的MH肉汤。
嗜血杆菌属菌使用HTM肉汤,肺炎链球菌和其它链球菌使用含2%~5%溶解马血的MH肉汤。
1.1.4.接种物的制备有2种方法配制接种物,一是细菌生长方法,用接种环挑取形态相似待检菌落3-5个,接种于4-5ml的水解酪蛋白(MH)肉汤中,35℃孵育2-6h。
增菌后的对数生长期菌液用生理盐水或MH肉汤校正浓度至0.5麦氏比浊标准,约含1~2×108CFU/ml。
二是直接菌落悬液配制法,对某些苛养菌,如流感嗜血杆菌、淋病奈瑟菌和链球菌及甲氧西林耐药的葡萄球菌等菌株,推荐直接取培养18~24h的菌落调配成0.5麦氏比浊标准的菌悬液。
几种测定抗菌药物最低抑菌浓度(MIC)方法

几种测定抗菌药物最低抑菌浓度(MIC)方法近年来,随着抗生素的广泛使用以及细菌耐药性的增加,抗菌药物的最低抑菌浓度(MIC)的测定变得日益重要。
MIC是指抗菌药物能够抑制细菌生长的最低浓度,是评估抗菌药物对细菌耐药性的一种重要方法。
下面介绍几种测定抗菌药物MIC的方法。
1. 琼脂扩散法琼脂扩散法是一种经典的MIC测定方法。
该方法基于抗生素与菌株相互作用抑制菌株生长的原理。
实验中将不同浓度的抗生素溶液加入琼脂平板中,并在琼脂表面均匀涂布细菌悬液。
待菌株在琼脂表面生长形成克隆后,观察克隆周围清晰的无菌区域大小,根据无菌区域所对应的抗生素浓度计算MIC值。
该方法简单易行,但由于该方法目测判断,因此存在主观性差异和读片误差的问题。
2. 荧光素二磷酸盐3-(4,5-二苯基噻唑)(Alamar blue)法荧光素二磷酸盐3-(4,5-二苯基噻唑)法是一种高通量及准确性较高的MIC测定方法。
该方法基于菌株呼吸代谢消耗的荧光素二磷酸盐3-(4,5-二苯基噻唑)的发光信号变化来评估抗生素的MIC值。
实验中将不同浓度的抗生素溶液加入微孔板中,并添加细菌悬液及荧光素二磷酸盐3-(4,5-二苯基噻唑),经过一定时间后读取板上的荧光信号,测算MIC 值。
该方法准确性高,可用于筛选大量样本的抗菌药物敏感性,但需要特殊设备和耗费较多经费。
3. 壳聚糖纳米粒子微滴法壳聚糖纳米粒子微滴法是一种新兴的MIC测定方法。
该方法基于壳聚糖纳米粒子本身具有抑菌作用及微滴原理,实验中将不同浓度的抗生素与含菌液的溶液制成微滴,并添加壳聚糖纳米粒子,待微滴凝胶后进行观察,根据微滴内的细菌生长情况评估折射率值,进而计算MIC值。
这种方法具有较高的准确性和可靠性,但需要特殊仪器和技术支持。
4. 测序MIC法随着测序技术的发展,现已出现测序MIC法。
该方法基于高通量测序技术,对菌株进行全基因组测序,确定细菌株中抗生素耐药基因的编码序列,并进行序列比对和分析,确定抗生素的MIC值。
抗生素最低抑菌浓度(MIC)和半数抑菌浓度(MIC)测定方法

抗生素最低抑菌浓度(MIC)和半数抑菌浓度(MIC)测定方法抗生素最低抑菌浓度(MIC)和半数抑菌浓度(MIC)测定方法常量肉汤稀释法1.1抗菌药物贮存液制备抗菌药物贮存液浓度不应低于1000μg/ml(如1280μg/ml)或10倍于最高测定浓度。
溶解度低的抗菌药物可稍低于上述浓度。
抗菌药物直接购自厂商或相关机构。
所需抗菌药物溶液量或粉剂量可公式进行计算。
例如:需配制100 ml浓度为1280μg/ml的抗生素贮存液,所用抗生素为粉剂,其药物的有效力为750μg/mg。
用分析天平精确称取抗生素粉剂的量为182.6 mg。
根据公式计算所需稀释剂用量为:(182.6mg×750μg/ml)/1280μg/ml=107.0ml,然后将182.6 mg抗生素粉剂溶解于107.0ml稀释剂中。
制备抗菌药物贮存液所用的溶剂和稀释剂见表5。
配制好的抗菌药物贮存液应贮存于-60℃以下环境,保存期不超过6个月。
1.2.药敏试验用抗菌药物浓度范围根据NCCLS抗菌药物敏感性试验操作标准,药物浓度范围应包含耐药、中介和敏感分界点值,特殊情况例外。
1.3.培养基NCCLS推荐使用Mueller-Hinton(MH)肉汤,pH7.2~7.4。
需氧菌及兼性厌氧菌在此培养基中生长良好。
在测试葡萄球菌对苯唑西林的敏感性时,应在肉汤中加入2%(W/V)氯化钠,按制造厂家的要求配制需要量的MH肉汤。
嗜血杆菌属菌使用HTM肉汤,肺炎链球菌和其它链球菌使用含2%~5%溶解马血的MH肉汤。
1.4.接种物的制备有2种方法配制接种物,一是细菌生长方法,用接种环挑取形态相似待检菌落3-5个,接种于4-5ml的水解酪蛋白(MH)肉汤中,35℃孵育2-6h。
增菌后的对数生长期菌液用生理盐水或MH肉汤校正浓度至0.5麦氏比浊标准,约含1~2×108CFU/ml。
二是直接菌落悬液配制法,对某些苛养菌,如流感嗜血杆菌、淋病奈瑟菌和链球菌及甲氧西林耐药的葡萄球菌等菌株,推荐直接取培养18~24h的菌落调配成0.5xx比浊标准的菌悬液。
抗菌药物最小抑菌浓度的测定

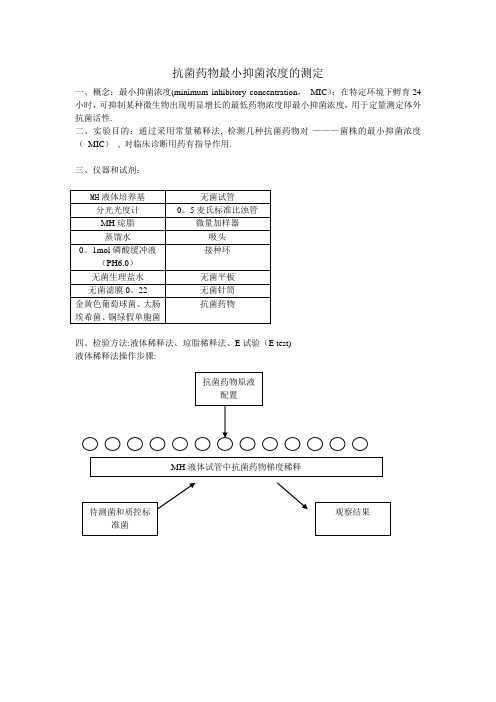
抗菌药物最小抑菌浓度的测定之公保含烟创作一、概念:最小抑菌浓度(minimum inhibitory concentration, MIC):在特定环境下孵育24小时,可抑制某种微生物呈现明显增长的最低药物浓度即最小抑菌浓度,用于定量测定体外抗菌活性.二、实验目的:通过采用常量稀释法, 检测几种抗菌药物对----菌株的最小抑菌浓度( MIC) , 对临床诊断用药有指导作用.三、仪器和试剂:MH液体培养基无菌试管分光光度计MH琼脂微量加样器蒸馏水吸头0.1mol磷酸缓冲液接种环(PH6.0)无菌生理盐水无菌平板无菌针筒抗菌药物金黄色葡萄球菌、年夜肠埃希菌、铜绿假单胞菌四、检验办法:液体稀释法、琼脂稀释法、E试验(E test)液体稀释法把持步伐:1..抗菌药物原液制备抗菌药物贮存液浓度不应低于1000μg/ml(如1280μg/ml)或10倍于最高测定浓度.溶解度低的抗菌药物可稍低于上述浓度.所需抗菌药物溶液量或粉剂量可公式停止计算.例如:需配制100 ml 浓度为1280μg/ml 的抗生素贮存液,所用抗生素为粉剂,其药物的有效力为750μg/mg.用剖析天平准确称取抗生素粉剂的量为182.6 mg.依据公式计算所需稀释剂用量为:(182.6 mg ×750μg/ml )/1280μg/ml=107.0ml ,然后将182.6 mg 抗生素粉剂溶解于107.0ml 稀释剂中.制备抗菌药物贮存液所用的溶剂和稀释剂见表1.配制好的抗菌药物贮存液应贮存于-20℃环境,并注意抗菌药物的保管期限.表1 稀释法中常常使用的抗菌药物容积稀释法2.药敏试验用抗菌药物浓度范围依据NCCLS抗菌药物敏理性试验把持标准,药物浓度范围应包括耐药、中介和敏感分界点值,特殊情况例外.3.培养基NCCLS推荐使用Mueller-Hinton(MH)肉汤,pH7.2~7.4.需氧菌及兼性厌氧菌在此培养基中生长良好.在测试葡萄球菌对苯唑西林的敏理性时,应在肉汤中参加2%(W/V)氯化钠,按制造厂家的要求配制需要量的MH肉汤.嗜血杆菌属菌使用HTM肉汤,肺炎链球菌和其它链球菌使用含2%~5%溶解马血的MH肉汤.4.接种物的制备有2种办法配制接种物,一是细菌生长办法,用接种环挑取形态相似待检菌落3-5个,接种于4-5ml的水解酪卵白(MH)肉汤中,35℃孵育2-6h.增菌后的对数生临时菌液用生理盐水或MH肉汤校正浓度至0.5麦氏比浊标准,约含1~2×108CFU/ml.二是直接菌落悬液配制法,对某些苛养菌,如流感嗜血杆菌、淋病奈瑟菌和链球菌及甲氧西林耐药的葡萄球菌等菌株,推荐直接取培养18~24h的菌落分配成0.5麦氏比浊标准的菌悬液.用MH肉汤将上述菌悬液停止1∶100稀释后备用.注意应在15分钟内接种完配制好的接种物,并取一份接种物在非选择性琼脂平板上传代培养,以反省接种物纯度.5.稀释抗菌药物的制备及菌液接种取无菌试管(13×100mm)13支,排成一排,除第1管参加1.6mlMH肉汤外,其余每管参加MH肉汤1ml,在第1管参加抗菌药物原液(如1280μμg/ml.然后在每管内参加上述制备好的接种物各1ml,使每管最终菌液浓度约为5×μg/ml.另外设对照3支,别为肉汤对照、质控菌对照和待测菌生长对照.6.孵育将接种好的稀释管塞好塞子,置35℃普通空气孵箱中孵育16~20h;嗜血杆菌和链球菌在普通空气孵箱中孵育20~24h;对能够的耐甲氧西林葡萄球菌和耐万古霉素肠球菌应继续孵育满24h.7.后果判断与解释在读取和陈说所测试菌株的MIC前,应反省生长对照管的细菌生长情况是否良好,同时还应反省接种物的传代培养情况以确定其是否污染,质控菌株的MIC值是否处于质控范围.以肉眼察看,药物最低浓度管无细菌生长者,即为受试菌的MIC.甲氧苄胺嘧啶或磺胺药物的肉汤稀释法终点判断,与阳性生长对照管比拟抑制80%细菌生长管药物浓度为受试菌MIC.【MIC参考范围】表2稀释法质控标准菌株MIC预期值范围(ug/ml)常常使用抗菌药物稀释和配制办法药物溶媒配制办法青霉素一次氨苄西林一次氨苄西林氟氯西林一次氨苄西林舒巴坦一次阿莫西林氟氯西林一次阿莫西林舒巴坦一次阿莫西林克拉维酸一次奈夫西林一次阿洛西林二次,每g先用10ml注射用水溶解美洛西林一次美洛西林舒巴坦二次,先用适量注射用水或生理盐水溶解羧苄西林一次替卡西林克拉维酸二次,先用10ml注射用水溶解哌拉西林无一次哌拉西林他唑巴坦5%G.S,NS 一次哌拉西林舒巴坦5%G.S,NS 一次苯唑西林一次头孢唑啉二次,先用注射用水溶解五水头孢唑啉二次,先用注射用水溶解头孢硫脒一次头孢噻吩二次.先4g用20ml注射用水溶解头孢呋辛无一次头孢美唑一次头孢替安一次头孢替唑一次头孢尼西一次头孢西丁一次头孢孟多一次头孢他定一次头孢曲松头孢哌酮一次,终浓度为5-25mg/ml头孢哌酮舒巴坦二次,1g—水溶后总量4ml,再用同一溶媒溶解. 头孢哌酮他唑巴坦二次.先用注射用水、N.S 5-10ml溶解拉氧头孢一次头孢米诺一次头孢唑肟一次头孢地嗪一次头孢甲肟一次头孢匹胺一次头孢吡肟一次头孢匹罗一次亚胺培南西司他汀一次美罗培南二次,可先用适宜液体配制氨曲南二次,1g先用至少3ml注射用水溶解,终浓度不超越2%阿奇霉素二次.先用注射用水稀释成0.1mg/ml,再稀释成终浓度为1-2mg/ml依替米星一次多西环素克林霉素无一次万古霉素二次.先用10ml注射用水溶解,再参加至少200ml溶液中.滴注>1小时.去甲万古霉素二次.先用注射用水溶解,再用至少200ml液体慢滴.替考拉宁二次.先用注射用水溶解,双手滚动小瓶至药粉全部溶解.如果呈现泡沫,静置15分钟.培氟沙星一次氟罗沙星一次洛美沙星二次,先用5ml注射用水溶解左氧氟沙星一次加替沙星一次,终浓度为2mg/ml依诺沙星一次帕珠沙星一次利福霉素一次氟康唑无一次两性霉素B 5%G.S(用NS有沉淀)二次.5ml注射用水溶解25mg药物,终浓度<0.1mg/ml,避光慢滴6h以上阿昔洛韦二次.每0.1g用10ml注射用水溶解成50g/l.再用年夜瓶稀释成至少100ml.终浓度不超越7g/l.慢滴.注意水化更昔洛韦先用N.S或注射用水溶解,再用年夜瓶稀释成100ml.浓度不超越10mg/ml,一次最少量6mg/kg聚安洛韦一次膦甲酸钠无一次.注意水化(2.5L/d),可适当用利尿剂,慢滴阿糖腺苷无一次.日剂量<10mg/kg病毒唑一次.1mg/ml,慢滴磷霉素先用注射用水溶解.慢滴1-2小时.总结:1. N.S溶解:青霉素、氨苄西林类、阿莫西林类、奈夫西林、头孢硫脒、帕珠沙星(阿青安怕牛来)2. G.S溶解:培氟沙星、氟罗沙星、曲伐沙星、依诺沙星、两性霉素B/利福霉素(两粒)3. 需二次配制的:青霉素类:阿洛西林、美洛西林舒巴坦、替卡西林克拉维酸(阿美卡拉);头孢类:唑啉、噻吩、曲松、哌酮舒巴坦(他唑巴坦);两粒霉素B、磷霉素、多西环素、阿奇霉素、洛美沙星(20多哈罗)、万古霉素、去甲万古霉素、替考拉宁;阿昔洛韦、更昔洛韦、氨曲南、美罗培南。
抗菌药物最小抑菌浓度的测定

抗菌药物最小抑菌浓度的测定一、概念:最小抑菌浓度(minimum inhibitory concentration, MIC):在特定环境下孵冇24 小时,可抑制某种微生物出现明显增长的最低药物浓度即最小抑菌浓度,用于泄量测立体外抗菌活性。
二、实验目的:通过采用常量稀释法,检测几种抗菌药物对--菌株的最小抑菌浓度(MIC), 对临床诊断用药有指导作用。
MH液体培养基无菌试管分光光度计0.5麦氏标准比浊管MH琼脂微量加样器蒸饰水吸头接种环0.1 mol磷酸缓冲液(PH6.0)无菌生理盐水无菌平板无菌滤膜0.22无菌针筒抗菌药物金黄色匍萄球菌、大肠埃希菌、铜绿假单胞菌四、检验方法:液体稀释法、琼脂稀释法、E试验(Etcst)液体稀释法操作步骤:抗菌药物原液配置0000000000000MH液体试管中抗菌药物梯度稀释观察结果1..抗菌药物原液制备抗菌药物贮存液浓度不应低于1000ug/ml(如1280ug/ml)或10倍于最高测左浓度。
溶解度低的抗菌药物可稍低于上述浓度。
所需抗菌药物溶液量或粉剂量可公式进行计算。
例如:需配制100 ml浓度为1280ug/ml的抗生素贮存液,所用抗生素为粉剂,其药物的有效力为750ixg/mgo用分析天平精确称取抗生素粉剂的量为182.6 mg.根据公式讣算所需稀释剂用量为:(182.6 mgX75O u g/ml)/1280 ug/ml= 107.0ml,然后将182.6 mg抗生素粉剂溶解于107.0ml稀释剂中。
制备抗菌药物贮存液所用的溶剂和稀释剂见表1。
配制好的抗菌药物贮存液应贮存于-20°C环境,并注意抗菌药物的保存期限。
表1稀释法中常用的抗菌药物容积稀释法2.药敏试验用抗菌药物浓度范带|根据NCCLS抗菌药物敏感性试验操作标准,药物浓度范国应包含耐药、中介和敏感分界点值,特殊情况例外。
3.培养基NCCLS推荐使用Mueller-Hinton (MH)肉汤,pH7.2~7.4。
最小抑菌浓度(MIC)及抑菌率的测定

最小抑菌浓度(MIC)及抑菌率的测定提纯蛋白质后,需要测定其最小抑菌浓度(MIC),有文献提到根据MIC测得的结果计算抑菌率:抑菌率(%)= (阳性对照OD值—试验OD值) / (阳性对照OD值—阴性对照OD值)X100样品的MIC与同性质药物和一些常用药物的MIC进行比较才有意义,不能单纯通过自己样品的结果就判断出高低,并且不能只用一种细菌。
要考虑用不同种类的细菌进行实验,还要做质控。
根据抑菌率大小可以判断是否具有抑菌能力。
可参考以下药敏介绍:诸多药敏试验方法中,肉汤稀释法是标准方法,琼脂稀释法也可认为属于标准方法。
其他任何方法必须与标准方法比较,才能确定可靠性。
其他方法之间相互比较没有太大价值。
比较须平行测定耐药菌株和敏感菌株。
耐药菌株,被评价方法与标准方法的误差称极重要误差,不得大于3%;敏感菌株,被评价方法的误差称重要误差,不大于7%。
不同的药敏试验方法,针对不同药物,可靠性不一样。
如测MRSA须高盐条件,有的试剂盒中不加盐,结果不准确,但这不影响肠球菌的测定结果。
所以,评价一种方法,应该是有针对性地验证一种细菌对一种药物测定结果的可靠性。
质量控制及其校准作用1、纸片法药敏试验用敏感菌株做质量控制。
此外,ATCC25923,ATCC25922,ATCC27853三个菌株还具备校准作用,此点往往被忽视。
在NCCLS有关文件中,质量控制一节的第一部分就是讲方法的校准。
由于培养基和操作的原因,国内大部分实验室的药敏试验没有经过校准,试验的准确度差异很大。
校准过程中,须注意用适合的参考菌株校准相应菌类的药敏试验。
如葡萄球菌药敏试验用ATCC25923校准;肠杆菌药敏试验用ATCC25922校准。
2、筛选法药敏试验必须用耐药菌株做质量控制,最好是低水平耐药菌株。
MRS筛选试验以ATCC43300控制。
万古霉素筛选试验,以ATCC51299控制。
3、稀释法药敏试验对质量控制要求较高,特别是微量稀释法,必须做质量控制,否则会出现较大误差。
琼脂稀释法测定抗菌药物最低抑菌浓度

琼脂稀释法是将不同剂量的抗菌药物,加入融化并冷至50C左右的定量MH琼脂中,制成含不同递减浓度抗菌药物的平板,接种受试菌,孵育后观察细菌生长情况,以抑制细菌生长的琼脂平板所含最低药物浓度为MIC。
本法优点是可在一个平板上同时作多株菌MIC测定,结果可靠,易发现污染菌;缺点是制备含药琼脂平板费时费力。
1. 培养基制备使用MH琼脂,按商品说明书进行配制,pH7.2~7.4。
淋病奈瑟菌使用GC琼脂基础加1%添加剂;其它链球菌使用含5%(V/V )绵羊血的MH琼脂(当试验磺胺药时,使用溶解的马血)。
2. 含药琼脂平板制备根据实验设计,将已倍比稀释的不同浓度的抗菌药物分别加入已加热溶解,并在45~50 C水浴中平衡的MH琼脂中,充分混匀倾倒灭菌平皿,琼脂厚度3~4mm。
通常按1 : 9比例配制药物琼脂平板,根据需要来选择药物浓度范围。
配制好的含药琼脂平板应装入密封塑料袋中,置2~8 C冰箱可贮存5天。
3. 接种物制备与接种制备浓度相当于0.5麦氏标准比浊管的菌悬液,再 1 : 10稀释,以多点接种器吸取制备好菌液(约1~2卩I)接种于琼脂平板表面,每点菌数约为104CFU,形成直径为5~8mm的菌斑。
接种好后置35C孵育16~20h (甲氧西林耐药葡萄球菌、万古霉素耐药肠球菌孵育时间应满24h),观察结果。
奈瑟菌属、链球菌属细菌置5%二氧化碳、幽门螺杆菌置微需氧环境中孵育。
4. 结果判断将平板置于暗色、无反光物体表面上判断试验终点,以抑制细菌生长的最低药物浓度为MIC。
在含甲氧苄胺嘧啶或磺胺琼脂平板上可见轻微细菌生长,与生长对照比较抑制80%以上细菌生长的最低药物浓度作为终点浓度。
如果出现有2个以上菌落生长于含药浓度高于终点水平的琼脂平板上,或低浓度药物琼脂平板上不长而高浓度药物琼脂平板上生长现象,则应检查培养物纯度或重复试验。
原理:将抗菌药物配制到琼脂培养基中成:128 u g/ml * 64 u g/ml . 32 u g/ml .............................. 0. 06 ug/ml对倍稀释的浓度系列多点接种器将制备好的细菌菌悬液迅速点种到琼脂表面,经35C16-20小时培养肉眼观察细菌生长,以未见细菌生长平板的最低药物浓度为最低抑菌浓度(MIC)抗菌药物保存液的准备1估算抗菌药物最小称量琼脂稀释法最高药物浓度为128 u g/ml 药物和培养基的体积比1: 14,即药物浓度將成15倍稀释,因此保存液为128ug/mlX15 = 1920 u g/ml 如果1次用量为10ml ,则:抗菌药物最小称量二1920ug/ml*10ml抗菌药物的效价抗菌药物保存液的准备2抗菌药物稀释选择合适的抗菌药物稀释液进行药物稀释, 稀释液需要量见下列公式:抗菌药物实际称量*效价稀释液体积二保存液浓度(1920iig/ml)抗菌药物保存液的准备3实际操作:先计算完成一批试验需几次完成,每次用量多少,然后可一起称量,一起稀释亍然后按每次需要量分装在试管中,贴上标签,注明药物名称,浓度,体积数及配制日期,置与<-20D C保存,备用。
几种测定抗菌药物最低抑菌浓度(MIC)方法

几种测定抗菌药物最低抑菌浓度(MIC)方法1.1.常量肉汤稀释法1.1.1.抗菌药物贮存液制备抗菌药物贮存液浓度不应低于1000μg/ml(如1280μg/ml)或10倍于最高测定浓度。
溶解度低的抗菌药物可稍低于上述浓度。
抗菌药物直接购自厂商或相关机构。
所需抗菌药物溶液量或粉剂量可公式进行计算。
例如:需配制100 ml浓度为1280μg/ml的抗生素贮存液,所用抗生素为粉剂,其药物的有效力为750μg/mg。
用分析天平精确称取抗生素粉剂的量为182.6 mg。
根据公式计算所需稀释剂用量为:(182.6 mg×750μg/ml)/1280μg/ml=107.0ml,然后将182.6 mg抗生素粉剂溶解于107.0ml稀释剂中。
制备抗菌药物贮存液所用的溶剂和稀释剂见表5。
配制好的抗菌药物贮存液应贮存于-60℃以下环境,保存期不超过6个月。
1.1.2.药敏试验用抗菌药物浓度范围根据NCCLS抗菌药物敏感性试验操作标准,药物浓度范围应包含耐药、中介和敏感分界点值,特殊情况例外。
1.1.3. 培养基NCCLS推荐使用Mueller-Hinton(MH)肉汤,pH7.2~7.4。
需氧菌及兼性厌氧菌在此培养基中生长良好。
在测试葡萄球菌对苯唑西林的敏感性时,应在肉汤中加入2%(W/V)氯化钠,按制造厂家的要求配制需要量的MH肉汤。
嗜血杆菌属菌使用HTM 肉汤,肺炎链球菌和其它链球菌使用含2%~5%溶解马血的MH肉汤。
1.1.4.接种物的制备有2种方法配制接种物,一是细菌生长方法,用接种环挑取形态相似待检菌落3-5个,接种于4-5ml的水解酪蛋白(MH)肉汤中,35℃孵育2-6h。
增菌后的对数生长期菌液用生理盐水或MH肉汤校正浓度至0.5麦氏比浊标准,约含1~2×108CFU/ml。
二是直接菌落悬液配制法,对某些苛养菌,如流感嗜血杆菌、淋病奈瑟菌和链球菌及甲氧西林耐药的葡萄球菌等菌株,推荐直接取培养18~24h的菌落调配成0.5麦氏比浊标准的菌悬液。
抗菌药物最小抑菌浓度的测定

抗菌药物最小抑菌浓度的测定之答禄夫天创作一、概念:最小抑菌浓度(minimum inhibitory concentration, MIC):在特定环境下孵育24小时,可抑制某种微生物出现明显增长的最低药物浓度即最小抑菌浓度,用于定量测定体外抗菌活性。
二、实验目的:通过采取常量稀释法, 检测几种抗菌药物对----菌株的最小抑菌浓度( MIC) , 对临床诊断用药有指导作用。
三、仪器和试剂:MH液体培养基无菌试管分光光度计MH琼脂微量加样器蒸馏水吸头0.1mol磷酸缓冲液接种环(PH6.0)无菌生理盐水无菌平板无菌针筒抗菌药物金黄色葡萄球菌、大肠埃希菌、铜绿假单胞菌四、检验方法:液体稀释法、琼脂稀释法、E试验(E test)液体稀释法操纵步调:1..抗菌药物原液制备抗菌药物贮存液浓度不该低于1000μg/ml(如1280μg/ml)或10倍于最高测定浓度。
溶解度低的抗菌药物可稍低于上述浓度。
所需抗菌药物溶液量或粉剂量可公式进行计算。
例如:需配制100 ml 浓度为1280μg/ml 的抗生素贮存液,所用抗生素为粉剂,其药物的有效力为750μg/mg 。
用分析天平精确称取抗生素粉剂的量为182.6 mg 。
根据公式计算所需稀释剂用量为:(182.6 mg ×750μg/ml )/1280μg/ml=107.0ml ,然后将182.6 mg 抗生素粉剂溶解于107.0ml 稀释剂中。
制备抗菌药物贮存液所用的溶剂和稀释剂见表1。
配制好的抗菌药物贮存液应贮存于-20℃环境,并注意抗菌药物的保管期限。
表1 稀释法中经常使用的抗菌药物容积稀释法2.药敏试验用抗菌药物浓度范围根据NCCLS抗菌药物敏感性试验操纵尺度,药物浓度范围应包含耐药、中介和敏感分界点值,特殊情况例外。
3.培养基NCCLS推荐使用Mueller-Hinton(MH)肉汤,pH7.2~7.4。
需氧菌及兼性厌氧菌在此培养基中生长良好。
琼脂稀释法测定抗菌药物最低抑菌浓度MIC

琼脂稀释法测定抗菌药物最低抑菌浓度(MIC)|琼脂稀释法琼脂稀释法是将不同剂量的抗菌药物,加入融化并冷至50℃左右的定量MH琼脂中,制成含不同递减浓度抗菌药物的平板,接种受试菌,孵育后观察细菌生长情况,以抑制细菌生长的琼脂平板所含最低药物浓度为MIC。
本法优点是可在一个平板上同时作多株菌MIC测定,结果可靠,易发现污染菌;缺点是制备含药琼脂平板费时费力。
1.培养基制备使用MH琼脂,按商品说明书进行配制,pH7.2~7.4。
淋病奈瑟菌使用GC琼脂基础加1%添加剂;其它链球菌使用含5%(V/V)绵羊血的MH琼脂(当试验磺胺药时,使用溶解的马血)。
2.含药琼脂平板制备根据实验设计,将已倍比稀释的不同浓度的抗菌药物分别加入已加热溶解,并在45~50℃水浴中平衡的MH琼脂中,充分混匀倾倒灭菌平皿,琼脂厚度3~4mm。
通常按1∶9比例配制药物琼脂平板,根据需要来选择药物浓度范围。
配制好的含药琼脂平板应装入密封塑料袋中,置2~8℃冰箱可贮存5天。
3.接种物制备与接种制备浓度相当于0.5麦氏标准比浊管的菌悬液,再1∶10稀释,以多点接种器吸取制备好菌液(约1~2μl)接种于琼脂平板表面,每点菌数约为104CFU,形成直径为5~8mm的菌斑。
接种好后置35℃孵育16~20h(甲氧西林耐药葡萄球菌、万古霉素耐药肠球菌孵育时间应满24h),观察结果。
奈瑟菌属、链球菌属细菌置5%二氧化碳、幽门螺杆菌置微需氧环境中孵育。
4.结果判断将平板置于暗色、无反光物体表面上判断试验终点,以抑制细菌生长的最低药物浓度为MIC。
在含甲氧苄胺嘧啶或磺胺琼脂平板上可见轻微细菌生长,与生长对照比较抑制80%以上细菌生长的最低药物浓度作为终点浓度。
如果出现有2个以上菌落生长于含药浓度高于终点水平的琼脂平板上,或低浓度药物琼脂平板上不长而高浓度药物琼脂平板上生长现象,则应检查培养物纯度或重复试验。
抗菌药物最小抑菌浓度的测定
抗菌药物最小抑菌浓度的测定一、概念:最小抑菌浓度(minimum inhibitory concentration,MIC):在特定环境下孵育24小时,可抑制某种微生物出现明显增长的最低药物浓度即最小抑菌浓度,用于定量测定体外抗菌活性.二、实验目的:通过采用常量稀释法, 检测几种抗菌药物对-———菌株的最小抑菌浓度(MIC), 对临床诊断用药有指导作用.三、仪器和试剂:四、检验方法:液体稀释法、琼脂稀释法、E试验(E test) 液体稀释法操作步骤:1.。
抗菌药物原液制备抗菌药物贮存液浓度不应低于1000μg/ml(如1280μg/ml)或10倍于最高测定浓度。
溶解度低的抗菌药物可稍低于上述浓度.所需抗菌药物溶液量或粉剂量可公式进行计算。
例如:需配制100 ml浓度为1280μg/ml的抗生素贮存液,所用抗生素为粉剂,其药物的有效力为750μg/mg。
用分析天平精确称取抗生素粉剂的量为182。
6 mg.根据公式计算所需稀释剂用量为:(182。
6 mg×750μg/ml)/1280μg/ml=107。
0ml,然后将182。
6 mg抗生素粉剂溶解于107。
0ml稀释剂中.制备抗菌药物贮存液所用的溶剂和稀释剂见表1.配制好的抗菌药物贮存液应贮存于-20℃环境,并注意抗菌药物的保存期限。
表1 稀释法中常用的抗菌药物容积稀释法2.药敏试验用抗菌药物浓度范围根据NCCLS抗菌药物敏感性试验操作标准,药物浓度范围应包含耐药、中介和敏感分界点值,特殊情况例外.3.培养基NCCLS推荐使用Mueller—Hinton(MH)肉汤,pH7.2~7.4。
需氧菌及兼性厌氧菌在此培养基中生长良好.在测试葡萄球菌对苯唑西林的敏感性时,应在肉汤中加入2%(W/V)氯化钠,按制造厂家的要求配制需要量的MH肉汤。
嗜血杆菌属菌使用HTM肉汤,肺炎链球菌和其它链球菌使用含2%~5%溶解马血的MH肉汤。
4.接种物的制备有2种方法配制接种物,一是细菌生长方法,用接种环挑取形态相似待检菌落3—5个,接种于4—5ml的水解酪蛋白(MH)肉汤中,35℃孵育2-6h.增菌后的对数生长期菌液用生理盐水或MH肉汤校正浓度至0.5麦氏比浊标准,约含1~2×108CFU/ml。
抗生素最低抑菌浓度

抗生素最低抑菌浓度(MIC)和半数抑菌浓度(MIC)测定方法2008年05月07日星期三 02:19几种测定抗菌药物最低抑菌浓度(MIC)方法:1.1.常量肉汤稀释法1.1.1.抗菌药物贮存液制备抗菌药物贮存液浓度不应低于1000μg/ml(如1280μg/ml)或10倍于最高测定浓度。
溶解度低的抗菌药物可稍低于上述浓度。
抗菌药物直接购自厂商或相关机构。
所需抗菌药物溶液量或粉剂量可公式进行计算。
例如:需配制100 ml浓度为1280μg/ml的抗生素贮存液,所用抗生素为粉剂,其药物的有效力为750μg/mg。
用分析天平精确称取抗生素粉剂的量为182.6 mg。
根据公式计算所需稀释剂用量为:(182.6 mg×750μg/ml)/1280μg/ml=107.0ml,然后将182.6 mg抗生素粉剂溶解于107.0ml稀释剂中。
制备抗菌药物贮存液所用的溶剂和稀释剂见表5。
配制好的抗菌药物贮存液应贮存于-60℃以下环境,保存期不超过6个月。
1.1.2.药敏试验用抗菌药物浓度范围根据NCCLS抗菌药物敏感性试验操作标准,药物浓度范围应包含耐药、中介和敏感分界点值,特殊情况例外。
1.1.3. 培养基 NCCLS推荐使用Mueller-Hinton(MH)肉汤,pH7.2~7.4。
需氧菌及兼性厌氧菌在此培养基中生长良好。
在测试葡萄球菌对苯唑西林的敏感性时,应在肉汤中加入2%(W/V)氯化钠,按制造厂家的要求配制需要量的MH肉汤。
嗜血杆菌属菌使用HTM肉汤,肺炎链球菌和其它链球菌使用含2%~5%溶解马血的MH肉汤。
1.1.4.接种物的制备有2种方法配制接种物,一是细菌生长方法,用接种环挑取形态相似待检菌落3-5个,接种于4-5ml的水解酪蛋白(MH)肉汤中,35℃孵育2-6h。
增菌后的对数生长期菌液用生理盐水或MH肉汤校正浓度至0.5麦氏比浊标准,约含1~2×108CFU/ml。
二是直接菌落悬液配制法,对某些苛养菌,如流感嗜血杆菌、淋病奈瑟菌和链球菌及甲氧西林耐药的葡萄球菌等菌株,推荐直接取培养18~24h的菌落调配成0.5麦氏比浊标准的菌悬液。
最小抑菌浓度的测定

几种测定抗菌药物最低抑菌浓度(MIC)方法1.1.常量肉汤稀释法1.1.1.抗菌药物贮存液制备抗菌药物贮存液浓度不应低于1000μg/ml(如1280μg/ml)或10倍于最高测定浓度。
溶解度低的抗菌药物可稍低于上述浓度。
抗菌药物直接购自厂商或相关机构。
所需抗菌药物溶液量或粉剂量可公式进行计算。
例如:需配制100 ml浓度为1280μg/ml的抗生素贮存液,所用抗生素为粉剂,其药物的有效力为750μg/mg。
用分析天平精确称取抗生素粉剂的量为182.6 mg。
根据公式计算所需稀释剂用量为:(182.6 mg×750μg/ml)/1280μg/ml=107.0ml,然后将182.6 mg抗生素粉剂溶解于107.0ml稀释剂中。
制备抗菌药物贮存液所用的溶剂和稀释剂见表5。
配制好的抗菌药物贮存液应贮存于-60℃以下环境,保存期不超过6个月。
1.1.2.药敏试验用抗菌药物浓度范围根据NCCLS抗菌药物敏感性试验操作标准,药物浓度范围应包含耐药、中介和敏感分界点值,特殊情况例外。
1.1.3. 培养基 NCCLS推荐使用Mueller-Hinton(MH)肉汤,pH7.2~7.4。
需氧菌及兼性厌氧菌在此培养基中生长良好。
在测试葡萄球菌对苯唑西林的敏感性时,应在肉汤中加入2%(W/V)氯化钠,按制造厂家的要求配制需要量的MH肉汤。
嗜血杆菌属菌使用HTM肉汤,肺炎链球菌和其它链球菌使用含2%~5%溶解马血的MH肉汤。
1.1.4.接种物的制备有2种方法配制接种物,一是细菌生长方法,用接种环挑取形态相似待检菌落3-5个,接种于4-5ml的水解酪蛋白(MH)肉汤中,35℃孵育2-6h。
增菌后的对数生长期菌液用生理盐水或MH肉汤校正浓度至0.5麦氏比浊标准,约含1~2×108CFU/ml。
二是直接菌落悬液配制法,对某些苛养菌,如流感嗜血杆菌、淋病奈瑟菌和链球菌及甲氧西林耐药的葡萄球菌等菌株,推荐直接取培养18~24h的菌落调配成0.5麦氏比浊标准的菌悬液。
抗菌药物最小抑菌浓度的测定

抗菌药物最小抑菌浓度的测定(一)一、概念:最小抑菌浓度(minimum inhibitory concentration, MIC ):在特定环境下孵育24小时,可抑制某种微生物出现明显增长的最低药物浓度即最小抑菌浓度,用于定量测定体外抗菌活性。
二、实验目的:通过采用常量稀释法, 检测几种抗菌药物对----菌株的最小抑菌浓度( MIC) ,对临床诊断用药有指导作用。
三、仪器和试剂:MH 液体培养基 无菌试管分光光度计 0.5麦氏比浊管MH 琼脂 微量加样器蒸馏水 吸头0.1mol 磷酸缓冲液(PH6.0)接种环无菌生理盐水 无菌平板无菌滤膜0.22 无菌针筒金黄色葡萄球菌、大肠埃希菌、铜绿假单胞菌抗菌药物四、检验方法:液体稀释法、琼脂稀释法、E 试验(E test )液体稀释法操作步骤:1..抗菌药物原液制备抗菌药物贮存液浓度不应低于1000μg/ml(如1280μg/ml)或10倍于最高测定浓度。
溶解度低的抗菌药物可稍低于上述浓度。
所需抗菌药物溶液量或粉剂量可公式进行计算。
例如:需配制100 ml 浓度为1280μg/ml 的抗生素贮存液,所用抗生素为粉剂,其药物的有效力为750μg/mg 。
用分析天平精确称取抗生素粉剂的量为182.6 mg 。
根据公式计算所需稀释剂用量为:(182.6 mg ×750μg/ml )/1280μg/ml=107.0ml ,然后将182.6 mg 抗生素粉剂溶解于107.0ml 稀释剂中。
制备抗菌药物贮存液所用的溶剂和稀释剂见表1。
配制好的抗菌药物贮存液应贮存于-20℃环境,并注意抗菌药物的保存期限。
表1 稀释法中常用的抗菌药物容积稀释法2.药敏试验用抗菌药物浓度范围根据NCCLS抗菌药物敏感性试验操作,药物浓度范围应包含耐药、中介和敏感分界点值,特殊情况例外。
3.培养基NCCLS推荐使用Mueller-Hinton(MH)肉汤,pH7.2~7.4。
需氧菌及兼性厌氧菌在此培养基中生长良好。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
琼脂稀释法测定抗菌药
物最低抑菌浓度M I C
精编W O R D版
IBM system office room 【A0816H-A0912AAAHH-GX8Q8-GNTHHJ8】
琼脂稀释法测定抗菌药物最低抑菌浓度(MIC)|琼脂稀释法
琼脂稀释法是将不同剂量的抗菌药物,加入融化并冷至50℃左右的定量MH琼脂中,制成含不同递减浓度抗菌药物的平板,接种受试菌,孵育后观察细菌生长情况,以抑制细菌生长的琼脂平板所含最低药物浓度为MIC。
本法优点是可在一个平板上同时作多株菌MIC 测定,结果可靠,易发现污染菌;缺点是制备含药琼脂平板费时费力。
1.培养基制备
使用MH琼脂,按商品说明书进行配制,pH7.2~7.4。
淋病奈瑟菌使用GC琼脂基础加1%添加剂;其它链球菌使用含5%(V/V)绵羊血的MH琼脂(当试验磺胺药时,使用溶解的马血)。
2.含药琼脂平板制备
根据实验设计,将已倍比稀释的不同浓度的抗菌药物分别加入已加热溶解,并在45~50℃水浴中平衡的MH琼脂中,充分混匀倾倒灭菌平皿,琼脂厚度3~4mm。
通常按1∶9比例配制药物琼脂平板,根据需要来选择药物浓度范围。
配制好的含药琼脂平板应装入密封塑料袋中,置2~8℃冰箱可贮存5天。
3.接种物制备与接种
制备浓度相当于0.5麦氏标准比浊管的菌悬液,再1∶10稀释,以多点接种器吸取制备好菌液(约1~2μl)接种于琼脂平板表面,每点菌数约为104CFU,形成直径为5~8mm的菌斑。
接种好后置35℃孵育16~20h(甲氧西林耐药葡萄球菌、万古霉素耐药肠球菌孵育时
间应满24h),观察结果。
奈瑟菌属、链球菌属细菌置5%二氧化碳、幽门螺杆菌置微需氧环境中孵育。
4.结果判断
将平板置于暗色、无反光物体表面上判断试验终点,以抑制细菌生长的最低药物浓度为MIC。
在含甲氧苄胺嘧啶或磺胺琼脂平板上可见轻微细菌生长,与生长对照比较抑制80%以上细菌生长的最低药物浓度作为终点浓度。
如果出现有2个以上菌落生长于含药浓度高于终点水平的琼脂平板上,或低浓度药物琼脂平板上不长而高浓度药物琼脂平板上生长现象,则应检查培养物纯度或重复试验。
