第三章第二讲 氮的循环 专题
第三章 第二讲 氮的循环 Word版含解析

氮及其化合物一、选择题1. 解析 硝酸是一种具有强氧化性的强酸,并且浓度越大,氧化性越强。
浓硝酸可使蓝色石蕊试纸先变红后退色,故选项A 错;硝酸是一种氧化性酸,可氧化很多还原性物质,所以硝酸与Na 2S 反应不能生成H 2S ,与Na 2CO 3反应能生成CO 2,所以选项B 、C 错;选项D 准确。
2.答案 C 解析 A 项,NO 在空气中不能稳定存有,易被O 2氧化为NO 2;B 项,n (NO)=1 mol ×23=23mol ,N (NO)=23N A ;C 项,pH =1时,NO -3氧化Fe 2+;D 项,溶液变黄,Fe 被HNO 3氧化为Fe 3+。
3. 解析 1个NH 4+中含有10个电子,A 错;NH 4+中N 元素的化合价为-3价,化合价最低在氧化还原反应中常作还原剂;B 错误;0.1 L 3 mol·L -1的NH 4NO 3溶液中的氮原子数为0.6 N A ;C 准确;铵根离子中,氮与氢原子之间为共价键,D 错。
答案 C4.解析 3体积的NO 2通过饱和NaHCO 3溶液,发生的反应有3NO 2+2NaHCO 3===2NaNO 3+H 2O +NO +2CO 2,剩余气体通过浓硫酸后除去H 2O ,通过Na 2O 2时发生反应2Na 2O 2+2CO 2===2Na 2CO 3+O 2,此时剩余气体为1体积O 2和1体积NO ,排水法收集气体时发生反应4NO +3O 2+2H 2O===4HNO 3,显然O 2过量,剩余14体积O 2。
答案 C 5. 答案 B 解析 蛋白质遇浓硝酸显黄色,此反应常用于检验蛋白质,A 准确。
NH 4Cl分解生成的HCl 和NH 3遇冷又生成NH 4Cl(在试管中凝结),B 错。
NO 2不溶于CCl 4,Br 2易溶于CCl 4,根据CCl 4层的颜色区分红棕色气体是NO 2或是Br 2,C 准确。
在常温下,稀硝酸能氧化铜,而浓硫酸不能氧化铜,由此可推出稀硝酸的氧化性强于浓硫酸,D 准确。
高中化学 第三章第二节氮的循环(1)讲学稿

第三章第二节氮的循环(1)一、氮气及氮的氧化物1.氮气占空气体积的。
在放电条伴下跟氧气化合生成NO直接跟化合生成化学方程式:N2分子的结构很,N2化学性质。
2.N2的化学性质N2 + H2→N2 + O2→N2+Mg→氮的固定是指的方法,氮的固定主要有自然固氮和人工固氮。
自然固氮的途径主要有两种:和,人工固氮包括和练习1、起氮的固定作用的化学反应是()A .NH3经催化氧化生成NOB .NO与O2反应生成NO2C .N2与H2在一定条件下反应生成NH3 D. NH3与NO2作用生成N23.NO的性质无色有毒、不溶于水的气体,能与血红蛋白作用。
NO + O2→不与碱作用生成盐,为不成盐氧化物。
4.NO2的性质(1)______色有毒、有_______气味的气体。
(2)二氧化氮与水反应:练习2、将盛有氮气和二氧化氮混合气体的试管倒立于水中,经过足够时间后,试管内气体体积缩小为原体积的一半,则原混合气体中氮气和二氧化氮的体积比是。
[思考]1.在新疆与青海交界处有一山谷,人称“魔鬼谷”。
经常电闪雷鸣,狂风暴雨,把人畜击毙。
然而谷内却是牧草茂盛,四季常青。
这是为什么?2. Murad等三位教授最早提出NO分子在人体内有独特功能,近年来此领域研究有很大发展,因此这三位教授荣获1998年诺贝尔医学及生理学奖。
关于NO的下列叙述不正确的是()A.NO可以是某些含低价N物质的氧化产物B.NO不是亚硝酸酸酐C.NO可以是某些高价N物质的还原的产物D.NO是红棕色气体[思考]3.NO2是否时硝酸的酸酐?说明理由。
填表:二、31、物理性质:色有气味的气体,密度比空气,溶于水且能快速溶解,常温常压下1体积水能溶解约体积氨气。
(1)练习3会看到烧瓶中的液体呈喷泉状喷出,最终几乎充满整个烧瓶。
则a和b不可能是()A、HCl和水B、O2和水C、NH3和水D、CO2和NaOH2、氨的化学性质(1)NH3与水的反应。
NH3·H2O很不稳定,受热会分解。
高一化学课件氮的循环2

6.1、将40 mLNO与___mLO2混合,与水反应无气体剩余; 6.1、 mLNO与 30 混合,与水反应无气体剩余; 6.2、将40 mL NO与 21 mL O2混合,与水反应后 6.2、 NO与 混合, 余_____气体_____mL; _____气体_____mL; NO 气体 12 40 或 22.5 6.3、 将40 mL NO 与_______________mLO2混合, 混合, 6.3、 应后余气10mL. 与水反 应后余气10mL.
6 mL NO
生成溶液的物质的量浓度为多少? 生成溶液的物质的量浓度为多少? 1/22.4 mol L-1
例2、标准状况下,将10 mL NO 和 NO2混合气体 标准状况下, 缓慢通入倒立于水槽中的盛满水的试管中, 缓慢通入倒立于水槽中的盛满水的试管中, 充分反应后, mL剩余气体 剩余气体, 充分反应后,有 6 mL剩余气体,求 : 的体积比; (1)原混合气体 NO 和 NO2 的体积比; (2)所得溶液是什么溶液,其物质的量浓 所得溶液是什么溶液, 度为多少? 度为多少?
2、氨的化学性质
(1)氨跟水反应
NH3+H2O NH3H2O
NH3H2O NH4 ++OH-
溶质为NH 一水合氨是弱电解质。 溶质为 3,一水合氨是弱电解质。
, 氨水的成分: 氨水的成分: NH3, H2O, NH3H2O, NH4+,OH-,H+(少量) 少量)
NH3H2O
NH3↑+ H2O
(2)氨跟酸的反应
对环境的污染: (4)NO、NO2对环境的污染: NO、 危害 光化学烟雾 酸雨 石油产品和煤燃烧的产物 汽车尾气 制硝酸的工厂
污染源
NO+NO2+2NaOH = 2NaNO2+H2O 2NO2+2NaOH =NaNO3+NaNO2+H2O
第二节 氮的循环(共53张PPT)

2NO+O2 3NO2+H2O
2NO2 2HNO3+NO
(二)、铵态氮肥(铵 盐)
种类
铵 态 氮 肥
化学式
NH4HCO3 NH4Cl NH4NO3 (NH4)2SO4
含氮量
17.7% 26.2% 35% 21.2% 46.7%
性
状
白色结晶,吸湿性很 强,易潮解,溶于水,弱碱性 白色或淡黄色结晶,有吸湿性, 溶于水,酸性. 白色结晶,易潮解,溶于水, 微酸性, 白色粒状结晶,吸湿性不大, 不易结块 白色或浅黄色针状结晶或小颗 粒,溶于水,中性
3、若试管中为一氧化氮气体,通入的氧气与 一氧化氮的体积比要为多少可使试管中无气体 剩余?
4NO+ 2H2O +3O2 = 4HNO3 O2:NO的体积比为 3:4
练习巩固: 1、起固氮作用的反应是( A ) A、N2和H2在一定条件下合成NH3
B、NO与O2反应生成NO2 C、NH3催化氧化生成NO D、由NH3造硝酸铵
【联想· 质疑】
氨中氮元素的化合价是 -3 ,请从 化合价的角度分析,氨还可能具有什 么性质?它能与哪些物质发生反应?
(3) 氨跟氧气的反应(氨的催化氧化)
高温 4NH3+5O2 催化剂
还原剂 氧化剂
4NO+6H2O
工业制硝酸的基础
请写出以氨为原料制取硝酸的化学方程式?
4NH3+5O2
高温 4NO+6H2O 催化剂
2、下列过程属于人工固氮的是( C ) A、分离液态空气制氮气 B、闪电时N2转化为NO C、工业合成氨 D、豆科植物根瘤菌固氮
3、有一句谚语叫“雷雨发庄稼” , 请写出有关化学方程式 N2+O2
高中化学第3章自然界中的元素第2节氮的循环第1课时自然界中氮的循环鲁科版必修

3.下列过程中属于人工固氮的途径有( ) A.豆科植物根部的根瘤菌,把氮气转变为硝酸盐等含氮化合物 B.在放电条件下,氮气与氧气化合生成氮的氧化物,并随降水进入土壤和 水体 C.工业上通过化学方法把空气中的氮气转化为氨,再进一步转化为其他含 氮化合物 D.化石燃料燃烧所产生的氮氧化物通过大气进入陆地和海洋
化学方程式
试管中的红棕色气体逐渐变成无色 3NO2
+
气体,同时水进入试管,最后试管内 H2O===2HNO3
液面上升到整个试管容积的 2/3 处 +NO
2NO
+
无色气体变成红棕色,水进入试管并 O2===2NO2
最终充满试管,然后液面下降,试管 3NO2
+
中充满无色气体
H2O===2HNO3
+NO
(1)氮气与氢气反应:N2+3H2高温催、化高剂压2NH3,该反应是工业合成氨的原 理。
(2)氮气与氧气反应:N2+O2=放==电==2NO。 (3)氮气与镁反应:3Mg+N2=点==燃==Mg3N2。
3.工业制法 空气中含有大量的氮气,空气是工业制氮气的主要来源,生产方法主要是 分离液态空气,并制得液态氧。
【解析】 氮气是由两个氮原子通过共用三对电子形成的双原子分子,使 得氮分子很稳定,在通常情况下,氮气的化学性质很不活泼,但在一定条件下, 氮气能与氢气、氧气、镁等物质反应;纯净的氮气是不溶于水的无色无味无毒 气体,比空气略轻;一定条件下 N2 与 H2 化合生成 NH3 时,氮元素得到电子, 表现氧化性;因氮气的化学性质很不活泼,故常用作焊接金属的保护气。
(2)相互转化 ①NO→NO2: 2NO+O2===2NO2 。
②NO2→NO: 3NO2+H2O===2HNO3+NO 。
实验室收集 NO 和 NO2 时,分别使用什么方法? 【提示】 用排水法收集 NO,用向上排空气法收集 NO2。
第三章第二节氮的循环精品PPT教学课件

2020/12/6
5
Hale Waihona Puke B、与氢气反应❖ 合成氨:
高温高压
❖N2+3H2 催化剂 2NH3
❖ 讨论:反应条件是高温高压催化剂,说明了 什么?该反应是不是氧化还原反应?体现了 氮气的什么性质?
❖ 什么是可逆反应?相同条件、同时进行
2020/12/6
6
氮气的用途:
❖ 1、工业原料:造氨气、硝酸、化肥 ❖ 2、保护气 ❖ 3、致冷剂 ❖ 4、冷藏食品
密度比空略小。 ❖ 分子结构:
❖ 分子式:N2
❖ ❖
××× ×××
电 讨子论式::氮:的N性质为N什:么不活泼?
❖ 1、氮气与氮的固定
2020/12/6
4
化学性质:
❖ A、与氧气反应(完成下列方程式)
❖ N2
NO
NO2
HNO3
放电
❖N2+O2=2
NO(无色、难溶于气体)
❖2NO+O2=2NO2(红棕色有毒气体) ❖3NO2+H2O=2HNO3+NO↑
2020/12/6
10
2、起固氮作用的反应是()
❖ A、N2和H2在一定条件下合成NH3
❖ B、NO与O2反应生成NO2 ❖ C、NH3催化氧化生成NO ❖ D、由NH3造硝酸铵 3、在体积为VL的密闭容器中,通入amolNO、
bmolO2 反应后容器内氮原子和氧原子的个数 比是()
A、a/b
B、a/2b
第三章 第二节 氮的循环
2020/12/6
1
2020/12/6
2
一 、氮在自然界中的循环
❖
NH3
N2N2 NO
❖ ❖
第三章第二节氮的循环第一课时PPT课件

广州
洛杉矶光化学烟雾
巩固提高
1、下列过程属于人工固氮的是( C ) A、分离液态空气制氮气 B、闪电时N2转化为NO C、工业合成氨 D、豆科植物根瘤菌固氮
2、在新疆和青海两省交界处,有一狭长
山谷,有时牧民和牲畜进入后,风和日丽的
晴天顷刻间会电闪雷鸣,狂风大作,人畜常 遇雷击而倒毙,被当地牧民称为“魔鬼谷”。
You Know, The More Powerful You Will Be
Thank You
在别人的演说中思考,在自己的故事里成长
Thinking In Other People‘S Speeches,Growing Up In Your Own Story
讲师:XXXXXX XX年XX月XX日
奇怪的是这里草木茂盛,你知道其中的
Hale Waihona Puke 原因吗?放电N2+O2 2NO
2NO+O2 2NO2
3NO2+H2O 2HNO3+NO
写在最后
经常不断地学习,你就什么都知道。你知道得越多,你就越有力量 Study Constantly, And You Will Know Everything. The More
第2节 氮的循环
第1课时
联想•质疑
➢雷电交加时,空气中的氮气和有关的
《氮的循环改》PPT课件

泼
B.1 mol N2可与3 mol H2完全反应生成2 mol NH3 C.电闪雷鸣的雨天,雨水中会含有一定量的硝酸,其中发
生的反应之一是N2+2O2 =放==电= 2NO2
D.NO、NO2在一定条件下可相互转化,且二者都是引起光化 学烟雾的大气污染物
【易错选项】B
精选课件ppt
20
联想·质疑
1.闪电时空气中会发 生哪些化学反应?
地面
天空
N2
NO NO2
NH3 硝酸盐等
HNO3
地底
—
NH3 、NH4+、 NO3
精选课件ppt
8
二、氮循环中的重要物质
1、氮气
(1)氮气的物理性质
纯净的氮气通常是无色无味无毒的气体.
密度比空气略小
氮气在水中的溶解度很小,通常状况下,1 体积水中只能溶解0.02体积的氮气.
—即难溶于水
(2)氮气的化学性质
1.氮气
(1)氮气的物理性质
(2)氮气的化学性质
A.氮气和氧气反应
B.氮气和氢气合成氨
2、氮的氧化物
N2O、NO、N2O3、NO2、N2O4、N2O5
精选课件ppt
17
NO 和 NO2
NO
物理 无色气体 性质 难溶于水,剧毒!
NO2
红棕色有刺激性气味 气体,易溶于水,剧毒!
化学
性质
2NO+O2=2NO2
0
0
-3 +1
在反应中氧化剂为 N2 ,还原剂 为 H2 ;体现了氮气 具有 氧化
性
精选课件ppt
15
高温、高压
N2+3H2
催化剂 2NH3
可逆反应:相同条件下,能同时向正反两 个方向进行的反应
《自然界中氮的循环氮气及氮的氧化物》教学设计
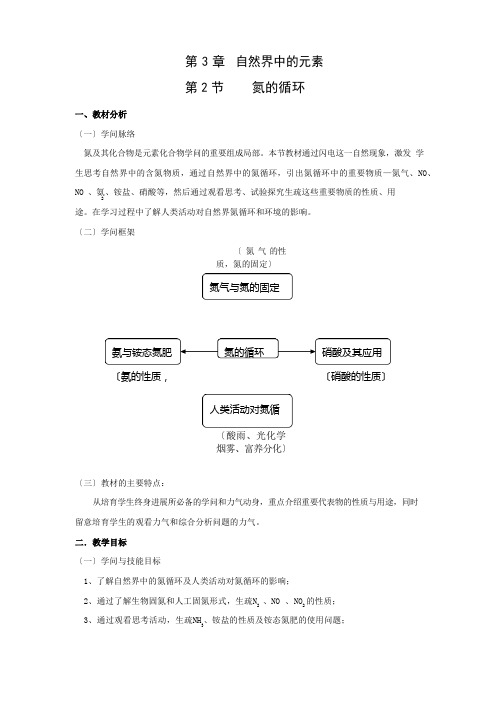
氮气与氮的固定氨与铵态氮肥氮的循环 硝酸及其应用人类活动对氮循第 3 章 自然界中的元素第 2 节氮的循环一、教材分析〔一〕学问脉络氮及其化合物是元素化合物学问的重要组成局部。
本节教材通过闪电这一自然现象,激发 学生思考自然界中的含氮物质,通过自然界中的氮循环,引出氮循环中的重要物质—氮气、NO 、NO 、氨、铵盐、硝酸等,然后通过观看思考、试验探究生疏这些重要物质的性质、用 2途。
在学习过程中了解人类活动对自然界氮循环和环境的影响。
〔二〕学问框架〔 氮 气 的性质,氮的固定〕〔氨的性质,〔硝酸的性质〕〔酸雨、光化学烟雾、富养分化〕〔三〕教材的主要特点:从培育学生终身进展所必备的学问和力气动身,重点介绍重要代表物的性质与用途,同时留意培育学生的观看力气和综合分析问题的力气。
二.教学目标〔一〕学问与技能目标1、了解自然界中的氮循环及人类活动对氮循环的影响;2、通过了解生物固氮和人工固氮形式,生疏N 2 、NO 、NO 2 的性质;3、通过观看思考活动,生疏NH 3、铵盐的性质及铵态氮肥的使用问题;4、通过观看思考活动,生疏 HNO 的性质。
3〔二〕过程与方法目标1、培育学生通过观看试验现象,总结分析物质性质的力气;2、初步体会物质的浓度对化学反响产物的影响,进一步生疏试验中变量把握的思想。
〔三〕情感态度与价值观目标1、通过介绍合成氨进展的艰辛历程,体会从试验室争论到工业生产的过程,渗透化学与技术关系的教育;2、通过介绍酸雨,光化学烟雾和富养分化等环境问题,了解人类活动对氮循环的影响,树立保护环境的意识。
三、重点、难点〔一〕学问上重点、难点重点:氮气、氨、铵盐和硝酸的性质。
难点:硝酸的氧化性。
〔二〕方法上重点、难点培育学生通过观看试验现象总结分析物质性质的力气,并使学生初步体会物质的浓度对化学反响产物的影响,进一步生疏试验中变量把握的重要性。
四、教学预备〔一〕学生预备1、预习其次节-氮的循环2、查找氮循环的资料,小组合作画出氮循环图示,写出短文。
鲁科版高中化学必修一第三章第二节氮的循环第1课时自然界中氮的循环、氮气及其氧化物公开课教学课件共21

思考:什么方法收集NO和NO2 ?
3.一氧化氮和二氧化氮
1.将一支收集满N02气体的试管倒立于水 槽中,可以看到什么现象?
试管中的红棕色逐渐褪去,液面上升 至试管的三分之二处。 2.如果想使试管中的液面继续上升,可 采取什么措施?
往试管中通入氧气
3.一氧化氮和二氧化氮
信使分子—NO 在1998年三位美国药理学家发 现“NO是心血管系统的信号分子”, 而获得诺贝尔医学奖。三位科学家发 现NO在人体血管内具有传递信号的 功能,使血管处于持续的舒张状态, 血压降低,NO可抑制VSMC和心肌 细胞增殖,维持其正常的有丝分裂。
学习目标
3.情感、态度和价值观: 认识氮元素固定的意义,从中体会
化学对社会生活的重要意义,同时提高 环保意识。
在新疆与青海交界处有一山谷,人称魔 鬼谷,经常电闪雷鸣,狂风暴雨,把人畜 击毙。然而谷内却是牧草茂盛,四季常青。 这是为什么呢?
一、氮在自然界中的循环
一、氮在自然界中的循环
1.自然循环
灯泡填充气
氮气
化学性质
从元素化合价的角度考虑, 氮气具有什么性质?
氮元素的最低价态是-3价,最高价态是+5价, 氮气的0价处于中间价态,既有氧化性,又 有还原性。
氮气
化学性质
N2+O2==放=电==2NO 氮气的还原性
氮气
化学性质
N2+3H2
高温、高压 催化剂
2NH3 氮气的氧化性
阅读课本P75 化学与技术:氨的合成, 谈谈你的体会。
用图示表示含氮物质的转化关系
还原性 N+2 O
+4
NO2
保护气N N N0 2
氧化性
+5
氮的循环课件

7、干燥:用碱石灰或生石灰。 、干燥:用碱石灰或生石灰。 思考:能否用浓H 干燥? 思考:能否用浓 2SO4干燥? 能否用CaCl2干燥? 干燥? 能否用 拓展:快速制氨气法: 拓展:快速制氨气法:
NH3·H2O (可 逆 过 程)
NH4++OH-
NH3+H2O
NH3·H2O
NH4++OH-
NH3是中学化学中唯一一种碱性气体,可以使湿 是中学化学中唯一一种碱性气体, 润的红色石蕊试纸变蓝,常用于检验NH3的存在。 的存在。 润的红色石蕊试纸变蓝,常用于检验
氨水成分: 氨水成分:
分子: 分子:H2O、NH3、NH3·H2O 、 离子: 离子:H+、OH-、NH4+
2.将充满 2和N2共45mL的试管,倒立于水槽中, 将充满NO 的试管, 将充满 的试管 倒立于水槽中, 过一段时间气体的体积变为35mL,则原混合气体 过一段时间气体的体积变为 , 中N2和NO2的体积比为 ( ) D A、7:2 B、2:7 C、1:2 D、2:1 、 : 、 : 、 : 、 :
第三课时
三、氨和铵盐
(一)、氨 NH3: )、氨 1、物理性质: 物理性质: 无色;有刺激性气味的气体;比空气轻; 无色;有刺激性气味的气体;比空气轻; 极易溶于水(1:700)。 极易溶于水( : )。 2、化学性质: 化学性质: (1)、与水反应:喷泉实验 )、与水反应: 与水反应
NH3+H2O
3、装置:固+固 、装置: 固
气 (类例制 2) 类例制O
高中化学第3章自然界中的元素3.2.1氮气及其氧化物课件

C.工业上将氨转化成硝酸及其他氮的化合物
D.从空气中分离出氮气
3.下列反应,氮元素只被还原的是( D )
A.N2+O2
2NO
B.2NO2
N2O4
C.3NO2+H2O
2HNO3+NO
D.N2+3H2
2NH3
探究一 自然界中氮的循环 1.存在及应用 (1)氮元素在自然界中的存在形式:游___离__态__和___化___合_。态
(3)氮气不燃烧、不支持燃烧,可以灭火,是否任何物质都不能在氮气中燃 烧?
可逆反应:在相同条件下能同时向正反两个方向进行的反应。
②__N_2_+_O_2 ______2_N_O 。(表现了还原性)
(2)与金属反应
点燃
镁条可以在N2中燃烧,化学方程式:__3_Mg_+_N_2_=_=_=__=M_g_3_N_2 _。(表现了氧化
性)
2.氮的固定 (1)定义:使游离氮转化为_含__氮__化__合__物__的过程。 (2)分类:
第2节氮的循环 第1课时氮气及其氧化物
一、自然界中氮的循环 氮气以_游__离__态存在于大气中,以_化__合__态存在于动植物体 内、土壤中和水体中。
二、氮循环中的重要物质及转化 (一)氮气 1.氮气的物理性质
2.氮气的化学性质 氮气的化学性质__不_活__泼__(填“活泼”或“不活泼”)。
(1)N2与O2反应:__N_2+_O_2 _____2_NO___。 (2)N2与H2反应(工业合成氨的反应): ___N_2+_3_H2_________2N_H_3 ___。 可逆反应:在__相__同_条__件__下,能同时向___正_反__两_个__方_向___进行的反
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氮及其化合物化学辅导第九周资料辅导老师__________辅导学生___________________________________________________一、选择题1.下列有关硝酸化学性质的叙述中,正确的是 ( )。
A .浓、稀硝酸都能使蓝色石蕊试纸最终变为红色B .硝酸能与Na 2CO 3反应,但不生成CO 2C .硝酸可与Na 2S 反应制得H 2S 气体D .浓硝酸因分解放出的NO 2又溶解于硝酸而呈黄色2.下列说法正确的是( )。
A .CO 、NO 、NO 2都是大气污染气体,在空气中都能稳定存在B .1 mol Cu 和足量稀HNO 3反应产生N A 个NO 分子(N A 为阿伏加德罗常数)C .pH =1的溶液中,Fe 2+、NO -3、SO 2-4、Na +不能大量共存D .铁溶于稀HNO 3,溶液变黄,发生离子反应为3Fe +8H ++2NO -3===3Fe 2++2NO↑+4H 2O 3.铵盐是一类重要的氮的化合物,设N A 表示阿伏加德罗常数的值,下列叙述正确的是( )。
A .1 mol NH 4+含有的电子数为11N AB .NH 4+中N 元素的化合价为-3,在氧化还原反应中常作氧化剂C .0.1 L 3 mol·L -1的NH 4NO 3溶液中氮原子数等于0.6N AD .硫酸铵中既含有离子键,又含有共价键,而氯化铵中只含有离子键4.把3体积NO 2气体依次通过①饱和NaHCO 3溶液;①浓硫酸;①Na 2O 2后(假设每一步的反应都是充分的),再用排水法收集残留气体,则收集到的气体是( )。
A .1体积NOB .1体积NO 2和12体积O 2 C.14体积O 2 D.13体积NO 5.氮的多样性主要体现在含氮化合物及其性质的多样性上,下列说法不正确的是( )。
A.用浓硝酸与蛋白质的颜色反应鉴别部分蛋白质B.实验室可采用如图所示装置制取NH3C.实验室可用CCl4检验NO2和溴蒸气D.在常温下,稀硝酸的氧化性强于浓硫酸的6.已知常温常压下在1 L水中可溶解40 L NO2,NO2能与NaOH溶液发生反应:2NaOH+2NO2===NaNO3+NaNO2+H2O。
以下各种尾气吸收装置中,不适合吸收NO2气体的是()二、非选择题7.某兴趣小组用如图装置探究氨的催化氧化。
(1)氨催化氧化的化学方程式为______________________________________________。
(2)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是________反应(填“吸热”或“放热”)。
(3)为保证在装置4中观察到红棕色气体,装置3应装入________;若取消3,在4中仅观察到大量白烟,原因是_________________________________________________________。
(4)为实现氨的催化氧化,也可用装置5替换装置________(填装置代号);化合物X为________(只写一种),Na2O2的作用是____________________________。
8.某化学活动小组想通过如图所示装置(夹持装置已略去)进行实验,探究Na2O2与NO反应的产物。
实验前,他们查阅有关资料得到如下信息:①2NaNO 3=====①2NaNO 2+O 2↑;①NaNO 2为白色粉末状固体,既有氧化性又有还原性;①NaNO 2溶液显弱碱性(原因:强碱弱酸盐的水解)。
实验开始时,先在A 装置中加入适量的碳酸钙和足量稀硝酸,待不再有气体产生时,将铜丝插入稀硝酸中。
请回答下列问题:(1)A 装置中放入碳酸钙的目的是_____________________________________。
(2)装置B 、C 中的试剂分别是:B________、C________,E 的作用是______________________________________________________________。
(3)如何检验反应中是否有氧气生成? _______________________________。
(4)假如Na 2O 2已反应完全,为确定D 中固体产物的成分,甲同学将固体溶于水后,经测定发现溶液显强碱性,再向溶液中加入酸性高锰酸钾溶液,紫色退去。
由此现象推断固体产物中可能含有的物质是________(填化学式)。
(5)乙同学取适量固体于试管中密闭加热,发现白色固体部分变为淡黄色。
此现象说明固体中还可能含有的成分是________(填化学式)。
根据以上推测,请写出Na 2O 2与NO 反应的化学方程式_________________________________。
氮及其化合物一、选择题1. 解析 硝酸是一种具有强氧化性的强酸,并且浓度越大,氧化性越强。
浓硝酸可使蓝色石蕊试纸先变红后退色,故选项A 错;硝酸是一种氧化性酸,可氧化许多还原性物质,因此硝酸与Na 2S 反应不能生成H 2S ,与Na 2CO 3反应能生成CO 2,所以选项B 、C 错;选项D 正确。
2.答案 C 解析 A 项,NO 在空气中不能稳定存在,易被O 2氧化为NO 2;B 项,n (NO)=1 mol×23=23mol ,N (NO)=23N A ;C 项,pH =1时,NO -3氧化Fe 2+;D 项,溶液变黄,Fe 被HNO 3氧化为Fe 3+。
3. 解析 1个NH 4+中含有10个电子,A 错;NH 4+中N 元素的化合价为-3价,化合价最低在氧化还原反应中常作还原剂;B 错误;0.1 L 3 mol·L -1的NH 4NO 3溶液中的氮原子数为0.6 N A ;C 正确;铵根离子中,氮与氢原子之间为共价键,D 错。
答案 C4.解析 3体积的NO 2通过饱和NaHCO 3溶液,发生的反应有3NO 2+2NaHCO 3===2NaNO 3+H 2O +NO +2CO 2,剩余气体通过浓硫酸后除去H 2O ,通过Na 2O 2时发生反应2Na 2O 2+2CO 2===2Na 2CO 3+O 2,此时剩余气体为1体积O 2和1体积NO ,排水法收集气体时发生反应4NO +3O 2+2H 2O===4HNO 3,显然O 2过量,剩余14体积O 2。
答案 C 5. 答案 B 解析 蛋白质遇浓硝酸显黄色,此反应常用于检验蛋白质,A 正确。
NH 4Cl分解生成的HCl 和NH 3遇冷又生成NH 4Cl(在试管中凝结),B 错。
NO 2不溶于CCl 4,Br 2易溶于CCl 4,根据CCl 4层的颜色区分红棕色气体是NO 2或是Br 2,C 正确。
在常温下,稀硝酸能氧化铜,而浓硫酸不能氧化铜,由此可推出稀硝酸的氧化性强于浓硫酸,D 正确。
6.解析 由于常温常压下在1 L 水中NO 2可溶解40 L ,即易溶于水,所以在吸收装置中需要防止倒吸,只有B 中不能防止倒吸。
答案 B二、非选择题7. 答案 (1)4NH 3+5O 2=====催化剂①4NO +6H 2O(2)放热(3)浓硫酸 生成的NO 与O 2反应生成NO 2,NO 2与水反应生成HNO 3,NH 3与HNO 3反应生成了NH 4NO 3(4)1 NH 4Cl 与HCl 反应生成氧气(合理答案即可)解析 氨的催化氧化,首先要制备NH 3和O 2,可得出装置1的作用:制备NH 3和O 2。
在装置2中NH 3和O 2在催化剂、加热条件下,反应生成NO 和H 2O 。
(3)利用装置3除去H 2O 及未反应的NH 3,在装置4中NO 被氧化为NO 2。
若取消装置3,在装置4中生成的NO 与O 2反应生成NO 2,NO 2与水反应生成HNO 3,NH 3与HNO 3反应生成了NH 4NO 3。
(5)装置5是制备NH 3和O 2。
8. 解析 本题探究NO 与过氧化钠的反应,实验设计必须考虑如下因素:①产生NO 时,要除尽装置中的空气;①装置必须干燥,防止水与过氧化钠反应;①排尽装置中的二氧化碳,防止二氧化碳与过氧化钠反应;①采取措施,防止空气进入装置。
新信息挖掘:反应①暗示如果产物中有硝酸钠,受热会产生氧气;信息①暗示若D 中固体呈黄色,一定有硝酸钠、亚硝酸钠以外的物质生成;亚硝酸钠具有还原性,加入强氧化剂如酸性高锰酸钾溶液,会发生反应,高锰酸钾溶液由红色变成无色。
信息①暗示亚硝酸钠溶液呈弱碱性,若产物溶于水呈强碱性,说明有强碱生成。
若显中性,说明没有亚硝酸钠生成。
由以上分析,若Na 2O 2已反应完全,D 中固体产物溶于水,溶液显强碱性说明含有Na 2O ,向溶液中加入酸性KMnO 4溶液,紫色退去,说明存在还原性物质,即可能有NaNO 2,D中白色固体产物密闭加热部分变为淡黄色,说明其中还有NaNO 3,2NaNO 3=====①2NaNO 2+O 2↑、生成的O 2再次把Na 2O 氧化为Na 2O 2而显淡黄色,由此可知Na 2O 2与NO 反应的产物有NaNO 3、NaNO 2和Na 2O ,其反应的化学方程式为:2Na 2O 2+2NO===NaNO 3+NaNO 2+Na 2O答案 (1)使碳酸钙与稀硝酸反应生成CO 2,排除装置中的空气(2)NaOH 溶液 浓硫酸 防止空气中的CO 2、水蒸气进入装置D 中,干扰产物的判断 (3)将带火星的木条放在E 装置的气体出口处,观察木条是否复燃,若复燃,则说明有氧气生成;若不复燃,说明无氧气产生(4)Na 2O 、NaNO 2(5)NaNO 3 2Na 2O 2+2NO===NaNO 3+NaNO 2+Na 2O。
