食品生产企业飞检共性缺陷项汇总
食品生产企业飞行检查中的问题及对策

飞行检查企 业行业分布情况
向和预防为主 的原则 ,积极化解风险 ;
共抽查 1 2 1家食 品生 产企 业。 其 食品 加工企 业食 品安 全 管理制 度 的落
有 效打 击食 品安 全违 法行 为 ,震 慑食 中 ,食用植物油脂 企业 1 6家 ,婴幼儿 实情况 品生 产企 业相关 责任 人 增 强企 业 安 乳粉 企 业 3家 ,槟 榔企 业 7家 ,饮 料
l 2 1家食 品 生 产 企 业 飞 行 检 查 中 发 现 果 企 业 7家 ,糕 点 企 业 1 2家 ,冷 冻 饮 项、检验记录不齐全不真实 、未按要求 的主要问题进行分析研究。
品企 业 5家 ,粮食 加 工 品企 业 3家 ,
进行批批成品留样与留样设 施不齐全。
( 2)采 购 进 货 查 验 落 实 和 投 配 记
( 1)生 产 场 所 及 设 备 设 施 不 符
货记录制度和记录保存情况不 完整 。
( 3) 生 产 过 程 控 制 及 食 品 安 全 管
飞行检查的对象
合 要 求 ,共 8 3家 (占检 查 企 业 数 的 理 制度落实 不到位 ,共 3 3家 ( 占检 查
飞 行 检 查 的 对 象 主 要 是 有 可 能 引 6 8 . 6 %) 。 主 要 问题 是 :厂 区 环 境 清 洁 企 业数 4 4 . 6 名)。主要 问题是 .采购进
国家 专项 抽检 、省级 专 项抽 检 以及 专 变或脱落 、 随意堆放杂物 、 敞开式生产 、 理 制度 欠缺 ;作 业 指导 书不 规 范 ,关
1 0食 品 安 全 导 刊2 0 1 7 年 3 月
食 品 安 全 管 理l
键控 制点 记 录不 完整 ;不合 格 品处理 造 生产过程控 Ni E录的 , 应不 予通过 。
食品飞行检查常被发现的主要问题

食品飞行检查常被发现的主要问题
生产企业质量体系的存在问题较多的7 个环节,主要问题的表现归纳如下。
一、设施设备方面仓储设施管理不善,成品与半成品混杂存放,库房存放清洁剂、消毒剂;个人卫生设施管理不善,车间更衣柜中存有私人物品;生产设备保养维修不及时,缺少温湿度计等必要的环境监控措施,排水设施管理不规范,清洁作业区更衣室缺少连锁装置,难以避免交叉污染。
二、卫生管理方面厂房设施损坏后未及时修补;虫害控制设施不足,不能有效阻碍虫害进入;生产设备清洁不足,有食物残留和污垢;没有根据产品的特点建立关键控制环节,还存在加工人员未持健康证上岗的情况。
三、产品检验方面检验水平较低,检验人员能力不足、流失严重,检验设备设施不全、出厂检验原始记录和报告中的检验项目不全、仪器的检定或校准不及时。
产品留样记录不全,样品难以溯源。
四、厂房及车间方面厂房设计与布局不合理,缺少必要的有效防护措施,存在清洁区受污染的风险;人流物流通道有交叉;车间人流通道与生活、办公区未有效分隔。
五、记录及文件管理方面原料采购记录和进货查验记录不完整;生产记录内容不全,缺少环境监测和工艺参数记录;出入库记录不完整。
六、食品原料、食品添加剂和食品相关产品方面未索要供货方的许可证和产品合格证,原料验收项目不全。
不合格的原料未及时退货、换货。
七、生产过程安全控制方面未按照制度要求在生产结束后进行清洁消毒,未对清洁消毒效果进行验证。
除上述问题外,检查组还发现个别企业注销生产许可证后,重新申请新许可证,聘用原来员工在原厂继续生产同类产品;企业管理层的质量管理意识淡薄,存在实际操作与制度不匹配情况。
食品生产企业飞行检查问题汇总

二、洗瓶间内的洗涤剂、消毒剂未分隔放置且存放电线等杂物;
三、外包间与洗瓶间存在人员由高清洁作业区进入一般作业区现象。
霍尔果斯想念远航食品有限公司
一、原料库内存放的原料无标识;
二、废弃物存放桶非密闭式;
三、包装车间缺少安全标识行检查问题汇总
企业名称
缺陷和问题描述
新疆天露饮品有限公司
一、灌装车间存放修理工具;
二、制水车间管道有漏水现象,地面有积水;
三、包装车间地面有积水;
四、大桶水外检车间存放饮水机,未设置废弃物标识;
五、包装暂存间存放的标签无标识;
六、成品库存放的原料、包材、成品无标识。
伊犁伊阳蜂业有限公司
GMP飞检缺陷

GMP飞检缺陷六安华源制药有限公司一般缺陷10项:1、产品工艺规程中未列入原辅料、包装材料的生产厂家信息。
2、现场检查时玻瓶车间制水岗位人员检测pH值操作不规范;输液类产品批生产指令中缺少指令日期、物料批号和生产厂家等信息;A线灌装百级层流有半扇档风板门已坏未及时修理安装;配液补料缺少称量记录。
3、起泡点试验标准操作规程(SOP-03-218-06)规定0.22μm的滤芯每天生产前和结束后各做一次起泡点试验,但企业每天生产多个批次产品时,规程未对生产结束后起泡点试验不合格所生产产品的风险评估及处理作出规定。
4、塑瓶车间制塑料瓶未实行批号管理,企业未制定先生产先灌装,且在5日内用完的管理程序。
5、成品阴凉库面积偏小,使需要阴凉保存的成品存放在普通库。
6、质检中心培养室生化培养箱(Spx-250B-Z型)为企业自校,但未按时间定期校准,且企业未制定生化培养箱自校操作规程。
7、盐酸氨溴索(检品编号:JCz15007)检验报告书原始记录吸收系数测定只称取一份样品,未做平行样测定。
8、葡萄糖氯化钠注射液(检品编号:SY50070)检验报告书原始记录中重金属检查项未记录甲、乙、丙三管的制备操作。
9、替硝唑(检品编号:JCz150006)检验报告书原始记录炽灼残渣项未记录炽灼温度和时间。
10、乳酸左氧氟沙星氯化钠注射液(检品编号:SY150088)检验报告书原始记录有关物质项下供试品溶液量取体积数记录被涂改。
同路生物制药有限公司1、注射用水系统部分使用点通过热交换器降温致部分管路回水温度短时间内低于70℃,企业未对水系统的此种运行情况进行风险评估。
2、部分灯检不合格品未按不合格品管理程序和偏差管理程序处理,如狂犬病人免疫球蛋白(批号20130712)、乙型肝炎人免疫球蛋白(批号20140901)、人血白蛋白(批号20150517)、破伤风人免疫球蛋白(批号20141203)、静注人免疫球蛋白(批号20150407)等存放在3﹟待检冷库内,无台账。
食品生产企业飞行检查问题汇总

企业名称
缺陷和问题描述
新疆小巴依牧业有限公司乌鲁木齐分公司
一、化验室药品柜内存放杂物;
二、生产车间内废弃物存放桶未设置标识;
三、排酸库未分区,温度记录表未及时填写;
四、冷藏库半成品未离墙且未设置标识;
五、冷冻库未分区,存放的成品未离墙且未设置标
识,生产日期未在外包装指明的区域标注;
六、前处理车间未设置挡鼠板;
七、2018年9月17日、18日生产的成品未进行出
厂检验。
乌鲁木齐花果山网络科技有限公司
一、核桃生产工艺与炒货食品及坚果制品细则中的
工艺流程不一致;
二、检验室内分析天平未单独摆放;
三、生产车间内废弃物存放桶未设置标识;
四、“若羌灰枣”成品标签上印刷的标准代号有误。
飞检中常见不合格项

GSP飞检中常见不合格项1、仓库温湿度自动监测系统未设置远程报警功能;2、冷藏车、保温箱等运输设备验证项目不全,未对其经营品种的储存温度区间进行验证,如前列地尔注射液;3、企业使用的千方百剂医药管理系统操作日志可删除,无法保证数据真实、准确和可追溯;4、企业购进个别品种未对首营企业进行认真审核;5、企业温湿度超标后未及时采取措施;6、质量管理部门未对财务的账户、票据、资金流向的规范管理进行督促;7、企业发电机不能满足仓库控制温度的用电需求。
8、企业温湿度自动监测系统未按日备份以保证数据安全、完整;9、药品到货时,收货人员未严格按照要求核实运输温度并记录,未对照随货同行单和采购记录做到票账货相符;10、现场检查抽取品种的部分供货单位随货同行单样式与档案留存样式不一致,如山西同达药业有限公司;11、企业温湿度超标后未及时采取措施。
12、部分配送交接手续不完整,无销售客户收货签字或盖章。
13、个别冷链品种交接单记录不完整,如无日期、车牌号等内容。
14、少数品种未按批号堆放;15、培训档案不全;16部分首营企业审批滞后;17、销售员授权委托书未及时登记,有重号现象。
18、中药材库出现储存化学药品现象。
19、2号冷库6月22日温度超标约1小时,设备维护记录为当天进行冷库验证,但验证报告和各项记录中,未见温度超标期间是否储存冷链药品。
20、该企业计算机系统中显示培力(南宁)中药配方颗粒(骨碎补等几十个品种)2016年有销售出库,配送方式不符合省食品药品监督管理局的有关规定。
21、不合格区的药品:复方右旋糖苷40注射液(A141012-2,数量443瓶),未及时在计算机系统中按规定进行处理。
22、供货方质保协议对方只盖章未签字。
23、计算机系统质量负责人权限设置不正确,计算机系统运行数据未按日备份24、对供货企业资质审核不到位,部分企业质量保证协议签订不规范。
25、计算机系统无法及时调取数据;26、7-8月份温湿度记录无法调取;27、阴凉库超温时无法触发短信报警;28、向药品零售企业销售药品未做到发票随货同行;29、部分药品未严格按照制度要求验收。
食品检验中常见不合格项目的危害总结

食品检验中常见不合格项目的危害总结1、大肠菌群、菌落总数大肠菌群、菌落总数是生物污染性的重要指标。
多数食物中毒是由生物污染引起的,严格控制生物污染的发生,对食品安全非常重要。
微生物指标(如大肠菌群、菌落总数)超标,表明企业产品存在严重的卫生质量缺陷,被致性微生物污染的概率增大。
消费者食用大肠菌群、菌落总数超标的食品,可能引起急性中毒、呕吐、腹泻等症状。
2、金黄色葡萄球菌金黄色葡萄球菌的产肠毒素菌株污染食品可产生肠毒素,引起食物中毒。
金黄色葡萄球菌致病是由其产生的多种毒素和酶,如肠毒素、血浆凝固酶、耐热核酸酶,还有表皮剥脱毒素、毒性休克综合毒素Ⅱ等,可引起感染化脓性疾病、内脏化脓性疾病、败血症、脓毒血症及毒素性疾病。
金黄色葡萄球菌肠毒素十分耐热,100℃加热数小时也不能破坏,能在极短的时间内导致食物中毒。
因此,金黄色葡萄球菌污染的食品若加热杀灭细菌后,该菌产生的肠毒素仍能导致食物中毒素,是引起食物中毒素的重要原因。
监测食品中金黄色葡萄球菌肠毒有十分重要的意义。
3、霉菌和酵母霉菌和酵母可造成食物的腐败变质,并可能使食品表面失去色、香、味。
有些霉菌能够合成有毒代谢产物-霉菌毒素;酵母在新鲜的和加工的食品中繁殖,可使食品发生难闻的异味,它还可以使液体发生混浊,产生气泡,形成薄膜,改变颜色及散发不正常的气味等。
4、二氧化硫残留量二氧化硫对食品有漂白和防腐作用,是食品加工中常用的漂白剂和防腐剂。
人如果食用了二氧化硫超标的食物,易出现头晕、呕吐、恶心、腹泻、全身乏力、胃黏膜损伤等,严重时会伤害肝、肾等脏器,引起急性中毒。
5、亚硝酸盐亚硝酸盐有很强的毒性,中毒剂量为0.2g-0.5g,剂量过大可中毒致死。
亚硝酸盐进入人体后,可使血中低铁血红蛋白失去运氧的功能,致使组织缺氧,出现青紫而中毒,出现口唇、舌尖、指尖青紫,重者眼结膜、面部及全身皮肤青紫,恶心、呕吐、绞痛、腹泻,严重者昏迷、惊厥、大小便失禁,可因呼吸衰竭而死亡。
飞检违规频繁项目都有哪些

飞检违规频繁项目都有哪些?!看这里......
60 *1、未提供物料合规性评价清单
36%
2、未定期进行物料合规性评价
3、氨基苯酚等物料合规性评价不符合化妆
品安全技术规范(2015版)
631、未对进口原料进行索证索票的要求36%
721、部分产品标签标识不符合相关规定36%
违规最频繁的项目:
1、检验员对有效物、泡沫、微生物等项目不熟悉;
2、检验员对环境监控、护发素、膏霜类产品的检测能力有待提高。
105条检查项目:
检验人员应具备相应的资质或经相应的专业技术培训,考核合格后上岗。
评价方法:
检查检验人员档案,微生物检验人员的资格证或培训证明,其他检验人员的专业技术培训记录,检查是否经过考核,并通过观察访谈形式核对开展工作的能力。
文章来源化妆品行业传媒网。
食品生产企业“飞行检查”项目和不符合项目分析
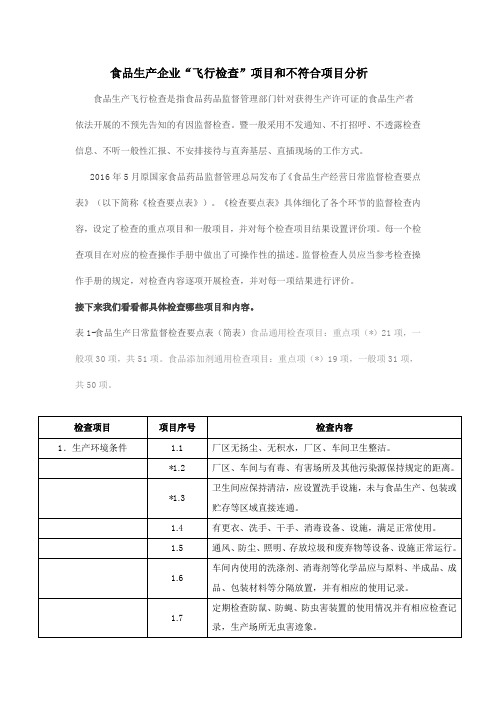
食品生产企业“飞行检查”项目和不符合项目分析食品生产飞行检查是指食品药品监督管理部门针对获得生产许可证的食品生产者依法开展的不预先告知的有因监督检查。
暨一般采用不发通知、不打招呼、不透露检查信息、不听一般性汇报、不安排接待与直奔基层、直插现场的工作方式。
2016年5月原国家食品药品监督管理总局发布了《食品生产经营日常监督检查要点表》(以下简称《检查要点表》)。
《检查要点表》具体细化了各个环节的监督检查内容,设定了检查的重点项目和一般项目,并对每个检查项目结果设置评价项。
每一个检查项目在对应的检查操作手册中做出了可操作性的描述。
监督检查人员应当参考检查操作手册的规定,对检查内容逐项开展检查,并对每一项结果进行评价。
接下来我们看看都具体检查哪些项目和内容。
表1-食品生产日常监督检查要点表(简表)食品通用检查项目:重点项(*)21项,一般项30项,共51项。
食品添加剂通用检查项目:重点项(*)19项,一般项31项,共50项。
说明:1.上表中打*号的为重点项,其他为一般项。
2.每次检查抽查重点项不少于10个,总检查项目不少于20个。
3.上表中除1.7、3.4、3.5、3.6项以及2.1项中关于“食品相关产品”的检查部分,其他项目均适用于食品添加剂生产者。
4.对食品添加剂生产者每次检查,还需检查第9项,对食品生产者的检查不需检查第9项。
5.如果检查项目存在合理缺项,该项无需勾选“是或否”,并在备注中说明,不计入不符合项数。
以上由原国家食品药品监督管理总局发布的《检查要点表》)虽然只包含了9大项检查内容,但是各地可根据当地实际对该表进行完善、调整和细化。
因此其他省市飞行检查的项目也有所不同,接下来再看看广东省食品药品监督管理局发布《关于印发广东省食品生产日常监督检查有关表格的通知》中的检查项目。
表2-广东省日常监督检查要点表(简表)说明:1. 上表中打*号的为重点项,其他为一般项。
2. 每次检查抽查重点项不少于10个,总检查项目不少于20个。
GMP飞检实验室缺陷汇总

一、实验数据真实性缺陷1、查看6批五维他口服溶液含量测定高效液相图谱,检测前未进行色谱条件与系统适用性实验,检测时对照品和样品配制1份、进2针。
2、物料部分检测项目委托鄂州市食品药品检验检测中心检验,但现场不能提供相关检测报告。
3、QC实验室检验台账、取样台账,QA变更台账、偏差台账均为Word 格式的电子版本,储存上述台账的电脑无权限管理设置。
经现场核对,中药材检验台账中部分批次检验结果项目为空白,检验台账中部分中药材批次信息与原辅料台账中的相应信息不一致。
4、检查发现,企业用于申报生产的9个批次的人血白蛋白长期稳定性考察3个月、6个月、加速试验6个月大部分铝离子实际检测结果高于药典规定的不得高于200µg/L的标准,与注册申报数据不符。
5、上市后持续稳定性数据可靠性问题。
检查人血白蛋白上市后持续稳定性考察数据发现:铝离子检测数据与报告数据不一致,实际检测数据不符合标准,企业存在修改样品名、删除检测记录重新检测等问题,比如20130503批,实际检测结果为408µg/L,报告为143µg/L。
激肽释放酶原激活剂(PKA)含量实际值与记录值不一致,实际值不符合药典规定(≦35IU/ml)。
6、显微鉴别原始记录只有文字表述,无照片、影像或描图数据,现场未发现水合氯醛,企业亦提供不出配制记录,未配备检验样品对应的显微图谱,实验人员未开展显微鉴别培训,现场询问实验人员不能回答实验操作要求,企业无法证明实际开展了显微鉴别实验。
中检院穿心莲对照药材现批号为121082-201505,而企业批号为121082-200302。
7、未能提供检验原始记录。
未能提供160201批女宝胶囊部分原药材检验原始记录;未能提供150601批白芍(用于保胎灵生产)和140401批白芍(用于保胎灵、女宝胶囊生产)的检验原始记录;未能提供140401批和150701批阿胶(用于保胎灵、女宝胶囊生产)的检验原始记录;未能提供131101批穿山龙(用于接骨续筋片生产)和150901批焦槟榔委托检验报告和委托检验合同。
飞行检查不合格项汇总

飞行检直不合格项汇总(1)生产间隙期洁净区的地漏未水封;(2)除菌过滤药液的滤心在使用后未做滤心完整试验;(3)企业未建立防止筛网断裂的措施(该筛网用于待分装的注射用阿魏酸钠过筛);(5)粉针剂车间操作人员2006年未进行皮肤病检查(5601);(6)验证过程中的数据收集不全,分析内容不完整;列管式纯蒸汽发生器的验证未收集每小时蒸汽发生量、不同时间段蒸汽的质量(6001);(7)批生产记录内容不全,如:胶塞清洗的最后一次注射用水清洗的可见异物检查记录未归入批生产记录;(8)精制工序中过筛后的阿魏酸钠(注射用)废粉、母液未制定处理程序;(9)胶塞灭菌柜、脉动真空灭菌柜、热风循还烘箱的自动打印设备不能实施自动打印,使用过程中采取手工记录;(10)一万级洁净区地面自流坪破损处未及时修复;(1101)(11)部分设备维修保养记录内容不全;(3701)(12)个别洁净生产操作间的废弃物未及时处理;(5001)(13)水系统再验证过程中的部分数据收集不全;(6001)(14)个别批生产记录数据收集不完整。
(6801)(15)洁净区使用的拖帕和抹布未存放在规定地点(1103);(16)小容量注射剂空调净化系统初效过滤器未按规定及时清洗(1504);(17)洁净区工作鞋无清洗记录(5203);(18)从事灯检的人员未进行色盲检查(5601);(19)胶塞漂洗间无生产状态标识(7009);(20)质量管理部门未严格履行对检验用仪器、试剂管理办法的职责(7503);(21)从事药品生产的人员经相应的专业技术培训不够(0601);(22)固体原辅料库房中存有液体原料药维生素E和三氯叔丁醇(4302);(23)个别设备清洁状态标示未规定有效期,仅有已清洁的标示,个别设备未挂清洁状态标示(4902);(24)不同洁净级别工作服(一万级与十万级)均为蓝色,仅有微小的花纹差别,不易区分(5201);(25)十万级洁净区内,洁净服上的自编号与清洗、消毒、灭菌记录中登记的号码不符,无发放记录;(5204)(26)部分文件制订的内容不完整。
国家局飞检不合格项汇总

十万级洁净生产车间内的组装间天花板有漏水和维补痕迹,有锈迹。
12
《空调净化系统清洁维修保养管理制度》(文件编号:Q/SYS/SB/ZD-2008-124)规定初效每个月清洗一次,中效三个月清洗一次,高效过滤器每年监测完整性,但企业实际对初、中效每年更换,实际也未监测高效过滤器的完整性;企业生产体外诊断试剂产品具有不连续性,空气净化系统停机时间较长,企业尚未对不同停机时间后再次开启空气净化系统所需采取的措施进行相应的验证和规定。
39
现场检查洁净区内镜片分拣、内包间时正值下班时间,工人已离开,剩余半成品无防护措施,企业未按规定清场。
40
查实验室现场,阳性对照间为正压设置。
41
检验室一更换鞋处放置一标识有“待洗无菌服”字样的塑料桶,桶内装满未经防护处理的工作服。企业洁净服管理规定,万级无菌服应在万级洗衣机清洗,十万级应在十万级洗衣间清洗。查该公司实验室无菌服清洗记录,确认实验室无菌服在十万级生产车间内的洗衣间进行清洗,未执行有关规定。
65
空气压缩系统(YEP000020)压力表(PO21、P022)未校准。
66
微生物限度室内的微粒测试仪所使用的纯化水,从周一(4月10日)放置进微生物限度室,存放至今。
67
复合膜袋技术规格书未规定初始污染菌、细菌内毒素等要求,且未针对采购物品去除细菌内毒素处理制定相关作业指导书。
61
待检产品未按规定放置在待验区,无标识,无请检单、出库单等单据。成品库台帐不能反映入、出库情况,仅能反映库存数量。
62
空调系统标准操作程序规定压差不超过初始压差2倍,实际执行初中效压差10~150,中高效压差30~250。
63
注射用水点存在死水段,且未明确规定取水时如何避免死水的措施。
【生产】2020年上半年食药总局飞行检查发现问题汇总

【关键字】生产
食品生产企业飞行检查
是检查组采取不发通知、不打招呼、不听汇报、不陪同接待,直奔现场的方式,通过看现场、查资料、验数据、问情况等方式,及时掌握和查找解决食品生产加工环节安全问题。
现为方便食品企业自我核查了解,保证企业持续合规,对2017年上半年食药监局组织实施的飞行检查中食品企业存在的共性缺陷项进行汇总,主要涉及到以下9个方面:
采购进货查验管理、生产过程控制、生产场所及设施设备、产品检验及留样管理、产品追溯及担心全食品召回、仓储管理、从业人员管理、贮存及交付控制方面、食品安全管理及培训制度。
说明:正文中《管理控制要求》未标明条款来源的,均为GB 14881对应条款内容。
一、采购进货查验管理
二、仓储管理
三、生产过程控制
四、产品检验及留样管理
五、产品追溯及担心全食品召回
六、生产场所及设施设备
七、从业人员管理
八、贮存及交付控制方面
文档从网络中收集,已重新整理排版.word 版本可编辑.欢迎下载支持.
11word 版本可编辑.欢迎下载支持.
九、食品安全管理及培训制度
12
培训
13 管理制度和人员
此文档是由网络收集并进行重新排版整理.word 可编辑版本!。
安徽飞行检查--药企存在问题汇总

回音必集团安徽制药有限公司一般缺陷7项:1、麻醉药品专库内未设监控探头,且未于110报警装置联网,库内卫生状况较差;2、黄连上清片多个批次(如批号15020401等)未及时进行内包装;颗粒包装机在生产过程中未固定;糖浆灌装间地面出现脱痕;沸腾干燥床制好的颗粒未封口转运,且人工转运不利于控制粉尘;3、未对2014年纯化水质量监测进行质量回顾分析;4、易患味、毒性药材、化验室易制毒化学品库等库不通风;新建的综合库未设置成品阴凉库;5、益母草(批号为14041102)等原药材包装上无标签;6、销售退回批号为15012802、14122101强力枇杷露、批号15020301、15020302板蓝根颗粒为未严格执行《产品退货管理制度》(SMP-QMS-017)的取样、送检程序;7、黄连上清片工艺规程(文件编码:SMP-PMP-003)中“原辅料、包装材料用量一览表”中荆芥穗用量表述错误,错误表述为“18KG/批”,应为“72KG/批”,部分药材用量填写错误。
安徽贝克生物制药有限公司一般缺陷7项:1、纯化水系统停机后恢复制水前未对该系统进行消毒。
2、进口交联聚维酮英文标签标识的生产企业与进口药品注册证上标识的生产企业不一致,销售商加贴的中文标签未标注进口药品注册证号的信息。
3、《原辅料接收贮存管理规程》(SOP-MA-007),规定物料入库时管理员核实来料数量与入库单相符情况,其中“核实数量大于入库单数量的按入库单数量办理入库”的规定会引起账物不符的情况。
4、企业生产所领物料未使用完的有时放生产车间(车间结余),有时退回仓库,未以文件形式对何种情况下放在生产车间还是退回仓库作出具体规定。
5、齐多拉米双夫定片(规格:每片含齐多夫定300mg和拉米夫定150mg,批号:1408024)批生产记录压片工序出现偏差时未记录,未附偏差调查报告。
6、空调净化系统操作岗位实际上岗人(张罗锋)与运行记录人(张国凯)不一致。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
食品生产企业飞行检查共性缺陷项汇总
食品生产企业飞行检查是检查组采取不发通知、不打招呼、不听汇报、不陪同接待,直奔现场的方式,通过看现场、查资料、验数据、问情况等方式,及时掌握和查找解决食品生产加工环节安全问题。
为方便食品企业自我核查了解,现对2017年上半年食药监总局组织实施的飞行检查中食品企业存在的共性缺陷项进行汇总,主要涉及到以下9个方面:采购进货查验管理、生产过程控制、生产场所及设施设备、产品检验及留样管理、产品追溯及不安全食品召回、仓储管理、从业人员管理、贮存及交付控制方面、食品安全管理及培训制度。
说明:正文中《管理控制要求》未标明条款来源的,均为GB 14881对应条款内容。
一、采购进货查验管理
二、仓储管理
三、生产过程控制
四、产品检验及留样管理
五、产品追溯及不安全食品召回
六、生产场所及设施设备
七、从业人员管理
八、贮存及交付控制方面
九、食品安全管理及培训制度
12 培训。
