变性与非变性聚丙烯酰胺的区别
变性与非变性电泳对牛羊乳蛋白质差异比较研究

第31卷 第6期 陕西科技大学学报 Vol.31No.6 2013年12月 JournalofShaanxiUniversityofScience&Technology Dec.2013倡 文章编号:1000‐5811(2013)06‐0109‐05变性与非变性电泳对牛羊乳蛋白质差异比较研究宋宏新,刘 静,张 歌,李红心(陕西科技大学生命科学与工程学院,陕西西安 710021)摘 要:主要采用十二烷基硫酸钠聚丙烯酰胺凝胶电泳法(SDS‐PAGE)和非变性聚丙烯酰胺凝胶电泳法(Native‐PAGE)对新鲜牛羊乳及其酪蛋白清蛋白的区别进行分析检测,对比研究两种电泳方法测定结果的差异,并用两种方法分别检测了掺入不同浓度牛乳的羊乳样品.结果显示SDS‐PAGE法对牛羊乳酪白质的分离效果好,该条件下牛羊乳的区别主要是酪蛋白αs2‐CN和αs1‐CN,而native‐PAGE法则是对清蛋白分离效果较好,该条件下的主要区别是牛乳较羊乳多两条β‐乳球蛋白.两种电泳方法对掺入不同浓度的羊乳样品的检测阈值均为5%,但native‐PAGE效果更明显.关键词:SDS‐PAGE;Native‐PAGE;乳蛋白质;羊乳牛乳蛋白质差别中图法分类号:TS252.4 文献标识码:AThestudyofthedifferencesbetweencowandgoatmilkproteinsbySDS‐PAGEandnative‐PAGESONGHong‐xin,LIUJing,ZHANGGe,LIHong‐xin(CollegeofLifeScienceandEngineering,ShaanxiUniversityofScience&Technology,Xi′an710021,China)Abstract:Thisexperimentanalysisanddetectionfreshcowandgoatmilkandcaseinprotein,albuminproteinbysodiumdodecylsulphatepolyacrylamidegelelectrophoresis(SDS‐PAGE)andnativepolyacrylamidegelelectrophoresis(native‐PAGE),comparativetheresultsdiffer‐encesoftwoelectrophoresismethods.Andweredetectedthegoatmilksamplesdopedwithdifferentconcentrationsofcowmilkbybothmethods.TheresultsshowedthatbySDS‐PAGEcaseinproteinareseparatedbetter,andthemaindifferencesareαs2‐CNandαs1‐CN,whilenative‐PAGEseparatealbuminproteinbetter,andthemaindifferenceisthatcowmilkhastwoβ‐lactoglobulin,butgoatmilkhasn′t.Andthedetectionthresholdofthosetwokindsofelectrophoresismethodsofdetectedthegoatmilksamplesdopedwithdifferentconcentra‐tionsofcowmilkis5%.Butthenative‐PAGEismoreeffective.Keywords:SDS‐PAGE;Native‐PAGE;milkprotein;differencesbetweencowandgoatmilkprotein倡收稿日期:2013‐10‐14基金项目:陕西省教育厅科研计划项目(2013JC03)作者简介::宋宏新(1959-),男,陕西咸阳人,教授,研究方向:生物化学与分子生物学陕西科技大学学报第31卷0 引言乳与乳制品含有丰富的蛋白质、脂肪、乳糖、矿物质及多种维生素[1],是一类营养丰富的理想食品,牛乳和羊乳是两类重要的乳品工业原料.羊乳的营养物质易于吸收、风味独特[2],但羊乳资源相对匮缺,致使其市场价高量少,在利益驱动下不法商贩将牛乳掺入羊乳中降低成本,这种掺假不仅存在于羊乳及其制品中,更多地会出现在原料乳的收购过程.国际贸易对羊乳制品纯度要求高(大于95%),羊乳制品企业在生产经营过程对原料及产品的保真性检验是一个急待解决的问题,基于牛羊乳成分的差异比较研究是解决羊乳中掺入牛乳成分的技术关键.羊乳与牛乳的外观和主要化学成分相似,其差别主要是在脂肪酸、蛋白质种类等微观组成上.乳蛋白质是乳制品的重要营养质量指标之一,乳蛋白质主要包括酪蛋白和乳清蛋白两大类[3],乳脂肪球膜蛋白的含量相对较少.蛋白质的电荷和分子质量特性的聚丙烯酰胺凝胶电泳(PAGE)是蛋白质分离分析的良好方法,PAGE分为变性聚丙烯酰胺凝胶电泳(SDS‐PAGE)和非变性聚丙烯酰胺凝胶电泳(native‐PAGE),两种电泳系统的主要差别是SDS‐PAGE添加SDS和疏基乙醇变性剂,并在加热条件下将聚合蛋白质充分变性为亚基进行分离,而native‐PAGE不含变性剂,多在低温条件下对天然构象的蛋白质(寡聚或单体)进行分离.SDS‐PAGE是乳品蛋白质研究应用最广泛的方法[4],native‐PAGE的研究报道较少,本实验通过对牛羊乳在变性及非变性条件下的电泳分析,建立分析牛羊乳蛋白质的方法,通过比较牛羊乳的蛋白质差异为羊乳中掺入牛乳成分的分析检验提供依据.1 材料与方法1.1 实验仪器分析天平(万分之一克),北京赛多利斯仪器系统公司;T‐1000型电子天平,江苏常熟双杰测试仪器厂;HC‐3018R高速冷冻离心机;WH‐3微型旋涡混合仪,上海泸西分析仪器厂;移液枪,德国艾尔德股份有限公司;101‐2A型电热鼓风干燥箱,天津市泰斯特仪器有限公司;PB‐10型酸度计,北京赛多利斯仪器系统公司;恒温水浴锅,国华电器有限公司;TS‐2型脱色摇床、恒温器,海门市其林贝尔仪器制造有限公司;HoeferminiVE型电泳槽,美国GE公司;BG‐Power600型电泳仪,北京百晶生物技术有限公司;JD‐801型捷达图像分析系统,江苏省捷达软件工程有限公司.1.2 实验药品及材料主要试剂:丙烯酰胺、N,N‐甲叉双丙烯酰胺,优级纯,美国Amersco公司;十二烷基硫酸钠(SDS),优级纯,美国USB公司;过硫酸铵,分析纯,北京化学试剂厂;四甲基乙二胺(TEMED),优级纯,北京化学试剂厂;α‐乳白蛋白、β‐乳球蛋白:美国Sigma公司;分子量标准蛋白Maker,科昊生物工程有限责任公司;硫酸铜、硫酸钾、Tris‐Base、巯基乙醇、考马斯亮兰R‐250、甘油、溴酚蓝、盐酸、甲醇、冰乙酸等其它常用试剂为分析纯级.1.3 样品及处理牛乳:西安未央区韩家湾奶牛场当天产的鲜乳.奶牛健康状况良好,无乳房炎、消化道疾病等.羊乳:西安市北郊夏家堡某农户家关中奶山羊当天产的鲜乳.脱脂牛、羊乳:取新鲜牛、羊乳在4℃5000r/min下离心30min,弃去上层脂肪即得.牛、羊乳酪蛋白:酪蛋白的制备方法采用的是等电点沉淀法[5],脱脂乳加热37℃,用0.1mol/LHCl调pH(牛乳调至pH4.6,羊乳调至pH4.1),40℃保温30min沉淀酪蛋白,5000r/min离心10min,下层沉淀干燥即为酪蛋白.保留上清液用于清蛋白制备.牛、羊乳清蛋白:上步保留的离心上清过滤除去残留酪蛋白颗粒即为清蛋白液.羊乳中掺入不同比例牛乳样品的制备:分别取脱脂乳按脱脂羊乳和脱脂牛乳体积比(V∶V)95∶5、90∶10、80∶20、70∶30、60∶40、50∶50分别混匀,即制得掺入5%、10%、20%、30%、40%、50%脱脂牛乳的脱脂羊乳样品.α‐乳白蛋白:准确称量0.01gα‐乳白蛋白标准品溶于1mL纯净水中.β‐乳球蛋白:准确称量0.01gβ‐乳球蛋白标准品溶于1mL纯净水中.1.4 电泳方法1.4.1 SDS‐PAGE(1)样品处理:2×变性样品缓冲液(pH8.0:0.125mol/LTris‐HCl,2%SDS,10%甘油,0.1%溴酚蓝,5%巯基乙醇,调完pH后再加巯基乙醇).·011·第6期宋宏新等:变性与非变性电泳对牛羊乳蛋白质差异比较研究脱脂乳用蒸馏水稀释5倍,取一定量与等体积2×变性样品缓冲液混合.乳酪蛋白样品用0.05mol/L氢氧化钠溶液溶解成乳酪蛋白浓度6mg/mL,取一定量与等体积的2×变性样品缓冲液混合.乳清蛋白样品直接与等体积的2×变性样品缓冲液混合.α‐乳白蛋白和‐β‐乳球蛋白标准液与等体积的2×变性样品缓冲液混合.掺入不同比例脱脂牛乳的脱脂羊乳样品与等体积的2×变性样品缓冲液混合.所有样品电泳前用混合仪混匀,煮沸5~10min,10μL进样.(2)电泳及分析[6]:分离胶质量浓度为12.5%,浓缩胶质量浓度为3%[7],凝胶厚度为1mm的垂直不连续SDS‐PAGE,缓冲系统中含0.1%SDS,预电泳电流为15mA,样品进入分离胶后调到30mA.电泳结束后用考马斯亮蓝R‐250染色,甲醇、冰醋酸溶液脱色,用捷达图像分析系统对电泳图片进行扫描.以SDS‐PAGE分子量标准制作蛋白质(亚基)分子量对数与电泳迁移率的标准曲线,该曲线方程为logMW=-1.379x+2.134(MW—蛋白质分子量;x—电泳迁移率),R2=0.969,计算各蛋白组分的分子量大小.1.4.2 native‐PAGE(1)样品处理:2×非变性样品缓冲液不含SDS和巯基乙醇(1.25mLpH6.8,0.5mol/LTris‐HCl,3.0mL甘油,0.2mL0.5%溴酚蓝,5.5mL水.)乳酪蛋白固体样品的溶解,其它乳品样的稀释,液体样品与2×非样品缓冲液等体积混合与SDS‐PAGE样品处理相同,不同的是样品仅需用混匀仪充分混合不加热,10μL进样.(2)电泳及分析[8]:分离胶质量浓度为8%,浓缩胶质量浓度为5%[9],凝胶厚度为1mm的垂直不连续native‐PAGE,缓冲系统不含SDS,预电泳电流为15mA,样品进入分离胶后调到20mA.为防止蛋白质在电泳过程中变性,电泳在0~4℃进行.电泳结束后染色脱色等程序同SDS‐PAGE.2 实验结果与分析2.1 SDS‐PAGE对脱脂牛羊乳及其清蛋白酪蛋白样品进行SDS‐PAGE电泳结果见图1(左).M.分子量标准蛋白质;1.脱脂羊乳;2.脱脂牛乳;3.羊乳酪蛋白;4.牛乳酪蛋白;5.羊乳清蛋白;6.牛乳清蛋白;7.α‐乳白蛋白;8.β‐乳球蛋白图1 脱脂牛羊乳及清蛋白酪蛋白的SDS‐PAGEE(左)和native‐PAGE(右)图谱 SDS‐PAGE电泳可以将蛋白质变性为亚基,按其分子量大小进行分离,图1(左)显示从电泳的负极(上)到正极(下)可以显示乳中蛋白质(亚基)含量较大的组分有8种,依据分子量标准及两种牛乳α‐乳白蛋白和‐β‐乳球蛋白标注蛋白质,将其分为上(高分子量)、中(中分子量)和下(低分子量)3组,对其分子量和蛋白质种类进行以下讨论:上端的高分子量区域主要为血清白蛋白(72.1KD)和免疫球蛋白(IgG),SDS‐PAGE看到的IgG只是由于巯基乙醇和SDS变性裂解的IgG的重链[10],羊乳IgG重链的分子量(56.9KD)较牛乳(57.8KD)小.下端的小分子量组主要为β‐乳球蛋白(12.0KD)及α‐乳白蛋白(10.4KD),仅从分子量看,在此区间牛羊乳的差别不大.由图可见羊乳·111·陕西科技大学学报第31卷(泳道5)和牛乳(泳道6)清蛋白主要分布在高分子量和低分子量区.中间的中分子量区主要为羊乳和牛乳酪蛋白(泳道3和泳道4):αs1‐CN、αs2‐CN、β‐CN和κ‐CN4种,牛羊乳的差别明显,羊乳αs2‐CN分子量(35.9KD)大于牛乳αs2‐CN分子量(34.2KD),牛乳α‐CN含量比较多,羊乳β‐CN含量(条带更深)比较多.可见SDS‐PAGE对两种乳品蛋白质的分离较好,电泳条带多而清晰,并且有较好的重复性,两种乳品酪蛋白的区分最好.2.2 native‐PAGE对脱脂牛羊乳及其清蛋白酪蛋白样品进行native‐PAGE电泳结果见图1(右).native‐PAGE分离羊乳及牛乳蛋白质的电泳图谱条带明显比SDS‐PAGE条带少,中间区域的酪蛋白仅有两条,且条带拖尾不清晰,虽然也能显示两种乳品(泳道3和泳道4,泳道1和泳道2)的差别,但是信息量较少,推测是由于多种酪蛋白以胶束状态在native‐PAGE时泳动的特点.在下端的低分子区域可以看出乳清蛋白分离效果良好.羊乳与牛乳清蛋白的差别明显:羊乳清蛋白(泳道5)仅为一条带,表明羊乳非变性条件下羊乳的乳白蛋白和乳球蛋白聚合成一个较大的羊乳清蛋白(寡聚蛋白)而存在;牛乳清蛋白(泳道6)可分为三条,一条为牛α‐乳白蛋白(泳道7),最下端的两条为牛β‐乳球蛋白(泳道8),显示牛β‐乳球蛋白有两种不同聚合形式存在.比较两种牛标准清蛋白的native‐PAGE和SDS‐PAGE图谱发现:图1(左)中牛α‐乳白蛋白亚基是分子量最小的一条带(图1左泳道7),图1(右)则显示牛α‐乳白蛋白(图1右泳道7)分子量较牛β‐乳球蛋白大;图1(左)显示牛α‐乳白蛋白亚基仅一条带,图1(右)则为两条,此现象的合理解释是两种乳清蛋白的天然(非变性)状态都是由相同亚基(图1左为一条带)的多个亚基聚合而成的寡聚蛋白.native‐PAGE分离乳蛋白质的条带虽然较少,但是对清蛋白的分离效果良好,明显的差别是最下端的牛乳较羊乳体多两条β‐乳球蛋白条带,可以作为区别牛羊乳的良好标志.2.3 两种电泳方法检测羊乳中掺入牛乳结果及分析羊乳中掺入不同比例牛乳样品的两种电泳分析结果见图2.1.脱脂牛乳;2.脱脂羊乳;3‐8.分别为掺入5%、10%、20%、30%、40%、50%脱脂牛乳的脱脂羊乳图2 羊乳中掺入牛乳的SDS‐PAGE(左)和native‐PAGE(右)图谱 比较SDS‐PAGE(图2左)和native‐PAGE(图2右)图谱可以看出,前者分离乳蛋白质的条带多而清晰,能够比较全面的表征乳蛋白质的组成.SDS‐PAGE图谱显示牛乳IgG-H分子量比羊乳大,含量较羊乳少,最明显的差别是酪蛋白αs2‐CN的分子量和αs1‐CN含量,牛乳αs1‐CN含量较羊乳多(条带颜色较深),当向羊乳中掺入5%含量的牛乳时(图2左,泳道3)就可以看出条带的差异.图2(右图,泳道1和泳道2)显示native‐PAGE对酪蛋白及高分子量清蛋白分离不好,但是最前端小分子乳清蛋白差别明显,牛乳较羊乳多出两条β‐乳球蛋白条带,羊乳随着掺入脱脂牛乳比例·211·第6期宋宏新等:变性与非变性电泳对牛羊乳蛋白质差异比较研究的变化,β‐乳球蛋白条带(泳道2‐8)从无到有并逐渐加深,两条β‐乳球蛋白条带可以作为羊乳中掺入牛乳的特征蛋白,实验显示的检测阈值为5%.比较羊乳和牛乳蛋白质差异,SDS‐PAGE显示的αs2‐CN和αs1‐CN在较多的蛋白质条带中较难区分,而native‐PAGE显示的两条β‐乳球蛋白条带从无到有更易观察识别,以其差别为基础建立的羊乳中掺入牛乳成分更可取.3 结论对牛乳和羊乳及由其制得的酪蛋白清蛋白进行两种电泳方法分析比较发现以下特点:SDS‐PAGE法由于变性可以将聚合蛋白变性成单体蛋白质或亚基,该条件下的电泳分离效果好,可以显示更多的电泳条带(8~10条),在该条件下牛羊乳最主要的差别是酪蛋白,羊乳αs2‐CN分子量(35.9KD)大于牛乳αs2‐CN分子量(34.2KD),羊乳αs2‐CN含量较高,而牛乳αs1‐CN含量较高(条带更深);native‐PAGE法乳品中蛋白质是以天然(非变性)的完整聚合蛋白质进行分离,酪蛋白变条带少(几种酪蛋白聚合成酪蛋白胶束)且分离效果较差;小分子量的乳清蛋白分离好,羊乳有一条较大的羊乳清蛋白(羊乳的乳白蛋白和乳球蛋白聚合成一个蛋白质),而牛乳清蛋白分有一条牛α‐乳白蛋白,最下端有两条牛β‐乳球蛋白,这也是native‐PAGE显示羊乳和牛乳蛋白质最明显的差别,可以作为羊乳中掺入牛乳的检测特征目标蛋白.比较而言,n‐ative‐PAGE更能明显区分牛羊乳,当羊乳中掺入5%牛乳时,在native‐PAGE电泳图谱中就可以看出明显差异.从电泳操作方法比较,SDS‐PAGE比较成熟,结构较稳定,反映的酪蛋白种类信息更多,native‐PAGE试剂少不变性,要求在较低温度下进行,蛋白质的溶解性对分析影响较大,更适应于乳清蛋白分析,可以作为羊乳中掺入牛乳的有效检测方法之一.进一步比较两种电泳清蛋白电泳结果,天然状态的羊乳清蛋白与牛乳清蛋白的差别显著,然而,有关羊乳清蛋白质中的乳白蛋白和乳球蛋白是如何聚集和其蛋白质结构特点的细节,还有待更深入的蛋白质结构解析研究,羊乳清蛋白质与牛乳清蛋白质的不同,究竟是如何影响羊乳的加工和营养消化特性也有待研究.native‐PAGE可以作为羊乳中掺入牛乳成分的有效检测方法.参考文献[1]唐 萍,田 晶,佘振宝.奶制品中蛋白质测定的毛细管电泳法研究[J].分析科学学报,2006,22(1):5‐8.[2]程潄兰,姚 莉,崔惠玲,等.WTO背景下的中国奶业发展前景[J].农业经济问题,2002,23(3):12‐14.[3]宋宏新,刘立新,柏红梅,等.牛乳中蛋白质的电泳分析技术研究[J].食品与机械,2010,26(6):51‐53.[4]陈丹华.蛋白质凝胶电泳及其分析应用[J].分析科学学报,1995,11(3):75‐86.[5]汪家政,范 明.蛋白质技术手册[M].北京:科学出版社,2000:67.[6]韩奕奕,黄菲菲,王建军,等.凝胶电泳法(SDS‐PAGE)测定乳与乳制品中β‐乳球蛋白的含量[J].乳业科学与技术,2009,32(2):74‐77.[7]宋宏新,李敏康.现代生物化学实验技术教程[M].陕西:陕西人民出版社,2000:160‐162.[8]HamesB.D.,D.Rickwoodeds.Gelelectrophoresisofpro‐teins:Apracticalapproach[M].London:IRLPress.,1981.[9]希尔德布兰特F,伊格莱西P.分子医学技术[M].林建银,译.北京:北京科学出版社,2001:54‐56.[10]KinghornNM,NorrisCS,PatersonGR.Comparisonofcapillaryelectrophoresiswithtraditionalmethodstoana‐lysebovinewheyproteins[J].JChromatogrA,1995,700:111‐123.·311·变性与非变性电泳对牛羊乳蛋白质差异比较研究作者:宋宏新, 刘静, 张歌, 李红心, SONG Hongxin, LIU Jing, ZHANG Ge, LIHongxin作者单位:陕西科技大学生命科学与工程学院,陕西西安,710021刊名:陕西科技大学学报(自然科学版)英文刊名:Journal of Shaanxi University of Science and Technology (Natural ScienceEdition)年,卷(期):2013(6)1.唐 萍;田 晶;佘振宝奶制品中蛋白质测定的毛细管电泳法研究[期刊论文]-分析科学学报 2006(01)2.程潄兰;姚 莉;崔惠玲W T O 背景下的中国奶业发展前景 2002(03)3.宋宏新;刘立新;柏红梅牛乳中蛋白质的电泳分析技术研究[期刊论文]-食品与机械 2010(06)4.陈丹华蛋白质凝胶电泳及其分析应用 1995(03)5.汪家政;范 明蛋白质技术手册 20006.韩奕奕;黄菲菲;王建军凝胶电泳法(SDS-PAGE)测定乳与乳制品中 β-乳球蛋白的含量[期刊论文]-乳业科学与技术 2009(02)7.宋宏新;李敏康现代生物化学实验技术教程 20008.Hames B.D;D.Rickwood Gel electrophoresis of pro-teins:A practical approach 19819.希尔德布兰特F;伊格莱西P;林建银分子医学技术 200110.Kinghorn N M;Norris C S;Paterson G R Comparison of capillary electrophoresis with traditional methods to ana-lyse bovine w hey proteins 1995本文链接:/Periodical_xbqgyxyxb201306024.aspx。
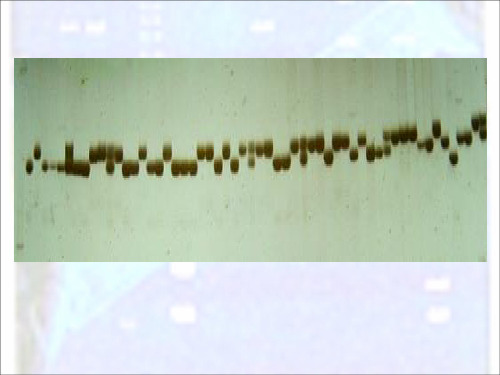
微卫星产物变性与非变性PAGE-银染方法比较

性 遗传 , 定 性好 , 比性 强 等优 点 , 稳 可 目前 已广 泛应
用 于 动植 物 的遗 传 连锁 分 析 [ 1 因定 2、 ,基 3 多领 域 。 聚丙烯酰胺 凝胶 电泳 (A E银染法 由于对 D A PG) N 】遗传 、
PAGE—S l e — a ni e ho s iv r St i ng M t d
Z HANG h n 1i , ONG a g x a g , C u . T e0 Gu n . in 2 KUANG u y Z Yo — i HANG a , N i .h n 2 , Ch o , YI Ja s e g ( . ol eo A i l c n e n e h oo y Yu n nA r ut e i ri , u mig6 0 0 , hn ; 1 C l g f nma S i c dT c n lg , n a gi l r v s y K n n 5 2 1 C ia e e a c u Un e t
c f b n s r d c du i g o e g l nt e o t r ,h c e r a g t a d c u db d t ce a i sn e a u i gg 1 ii a d p o u e sn n v l e, h c n r y t e la l r e b c o a yt n s o l e ee tde sl i gd n t r yu n e.
Ke r s: c o ae l e; AGE ; i e -ti i g y wo d mir s tl t P i s v rsan n l
微 卫 星 序 列 ( coae i N M )L 简 单 mi stlt D A, S 3 称 r le
Native-PAGE实验方法

Native-PAGE实验方法非变性聚丙烯酰胺凝胶和变性sds-page电泳在操作上基本上是相同的,只是非变性聚丙烯酰胺凝胶的配制和电泳缓冲液中不能含有变性剂如SDS等。
一般蛋白进行非变性凝胶电泳要先分清是碱性还是酸性蛋白。
分离碱性蛋白时候,要利用低pH凝胶系统,分离酸性蛋白时候,要利用高pH凝胶系统。
酸性蛋白通常在非变性凝胶电泳中采用的pH是的缓冲系统,蛋白会带负电荷,蛋白会相阳极移动;而碱性蛋白通常电泳是在微酸性环境下进行,蛋白带正电荷,这时候需要将阴极和阳极倒置才可以电泳。
分离酸性蛋白工作液配制1. 40%胶贮液(Acr:Bis=29:1);2. 4×分离胶Buf M Tris-HCl,pH : g Trisbase 溶于80ml 水,用浓HCl调pH ,加水定容到10 0ml,4℃贮存;3. 4×堆积胶Buf M Tris-HCl,pH :6 g Trisbase 溶于80ml 水,用浓HCl调pH ,加水定容到1 00ml,4℃贮存;4. 10×电泳Buf( Tris-Gly): g Trisbase, 144 g 甘氨酸,加水定容到1l ,4℃贮存;5. 2×溴酚蓝上样Buf: , Tris-Cl,甘油, % 溴酚蓝, dH2O; -20℃贮存;6. 10%APS;7. %考马斯亮蓝染色液:Coomassie red R-250 ,甲醇450ml,HAc 100ml, dH2O 450ml;8. 考马斯亮蓝脱色液: 100ml甲醇,100冰醋酸,800ml dH2O电泳胶的配制及电泳条件(上槽电极为负,下槽电极为正)1. 碱性非变性胶 17%分离胶(10 ml) 4%堆积胶(5 ml)2. 40%胶贮液(40%T,%C)3. 4×分离胶Buf M Tris-HCl,pH4. 4×堆积胶Buf M Tris-HCl,pH5. 水6. 10%APS 35 μl7. TEMED 15 μl8. 10×电泳Buf( Tris-Gly):100ml稀释到1L电泳条件 :100V恒压约20min,指示剂进入浓缩胶;改换160V恒压,当指示剂移动到胶板底部时,停止电泳,整个过程约80min。
聚丙烯酰胺凝胶电泳实验结果

聚丙烯酰胺凝胶电泳实验结果聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)是一种用于分离不同分子量的蛋白质的实验方法。
在PAGE实验中,蛋白质在电场的作用下,会根据其分子量大小在聚丙烯酰胺凝胶中进行迁移。
分子量越大的蛋白质,其迁移率越慢。
PAGE实验结果的分析主要根据以下几个方面:•蛋白质条带的数量:表示样品中存在的蛋白质种类。
•蛋白质条带的大小:表示蛋白质的分子量。
•蛋白质条带的形状:表示蛋白质的完整性。
以下是PAGE实验结果的常见分析方法:•标准品对照:使用已知分子量的蛋白质标准品作为对照,可以用来确定样品中蛋白质的分子量。
•SDS-PAGE:SDS-PAGE是一种常用的PAGE方法,在该方法中,蛋白质会被SDS(十二烷基硫酸钠)和还原剂处理,使其变性并失去其原有的结构。
因此,SDS-PAGE实验结果主要根据蛋白质条带的大小来判断分子量。
•非变性PAGE:非变性PAGE是一种不使用SDS和还原剂的PAGE方法,在该方法中,蛋白质可以保持其原有的结构。
因此,非变性PAGE实验结果主要根据蛋白质条带的形状来判断分子量。
以下是PAGE实验结果的常见示例:•单一蛋白质:如果样品中只有一种蛋白质,那么凝胶中将会出现一个单一的条带。
•多种蛋白质:如果样品中存在多种蛋白质,那么凝胶中将会出现多个条带。
•蛋白质变性:如果蛋白质在样品制备过程中发生变性,那么凝胶中可能会出现多个条带,或者条带的形状会发生变化。
PAGE实验结果可以用于以下目的:•蛋白质纯度分析:通过比较样品中蛋白质条带的数量和大小,可以判断样品的纯度。
•蛋白质分子量测定:通过对比样品中蛋白质条带的大小和标准品条带的大小,可以测定样品中蛋白质的分子量。
•蛋白质鉴定:通过对比样品中蛋白质条带的大小和形状,可以进行蛋白质鉴定。
实验结果实验材料•样品:肌肉组织蛋白•标准品:蛋白质分子量标准品•凝胶:10% SDS-PAGE凝胶•染色剂:溴酚蓝实验步骤1. 将样品和标准品制备成均匀的溶液。
sds-page

聚丙烯酰胺凝胶电泳(英语:polyacrylamide gel electrophoresis,简称PAGE),是以聚丙烯酰胺凝胶作为支持介质的一种常用电泳技术,用于分离蛋白质和寡核苷酸。
作用原理:聚丙烯酰胺凝胶是具有分子筛作用的网络结构。
它有两种形式:非变性聚丙烯酰胺凝胶电泳(Native-PAGE)和变性聚丙烯酰胺凝胶。
在蛋白质的非变性聚丙烯酰胺凝胶电泳中,蛋白质可以保持完整的状态,并根据蛋白质的分子量,蛋白质的形状和附着的电荷量逐渐彼此分离。
在DNA的非变性聚丙烯酰胺凝胶电泳中,DNA以双链状态游动,其迁移率受碱基组成和序列的影响。
在变性聚丙烯酰胺凝胶电泳中,变性剂通常为SDS(SDS-PAGE),变性剂通常为尿素和甲酰胺。
蛋白质的SDS-PAGE技术由Shapiro于1967年首次建立。
他们发现,蛋白质亚基的电泳迁移率主要取决于亚基的分子量(电荷因子可忽略不计),加入离子去污剂和强还原剂(SDS,十二烷基样品介质和丙烯酰胺凝胶。
SDS是一种阴离子洗涤剂。
作为变性剂和增溶剂,SDS可以破坏分子之间的氢键,展开分子并破坏蛋白质分子的二级和三级结构。
诸如巯基乙醇和二硫苏糖醇之类的强还原剂可以破坏半胱氨酸残基之间的二硫键。
将还原剂和SDS加入样品和凝胶后,分子解聚成多肽链。
解聚的氨基酸侧链与SDS结合形成蛋白质SDS胶束。
聚合物的负电荷远高于蛋白质的原始电荷,因此消除了不同分子之间的电荷和结构差异。
通常,不连续缓冲系统用于SDS-PAGE,其分辨率高于连续缓冲系统。
浓缩胶的作用是积聚,凝胶小,孔径大,将较薄的样品加入到增稠胶中,通过大孔胶的迁移作用将其浓缩到狭窄区域。
当选择Tris / HCl缓冲溶液作为样品溶液和浓缩凝胶时,选择Tris /甘氨酸作为电极溶液。
电泳开始时,HCl分解为氯离子,甘氨酸分解为甘氨酸离子。
蛋白质带负电荷,因此它们一起移动到正电极。
氯离子最快,甘氨酸离子最慢,蛋白质在中间。
非变性凝胶电泳技术

Native-PAGE原理非变性聚丙烯酰胺凝胶电泳(Native-PAGE)是在不加入SDS 疏基乙醇等变性剂的条件下,对保持活性的蛋白质进行聚丙烯酰胺凝胶电泳,常用于同工酶的鉴定和提纯。
未加SDS的天然聚丙烯酰胺凝胶电泳可以使生物大分子在电泳过程中保持其天然的形状和电荷,它们的分离是依据其电泳迁移率的不同和凝胶的分子筛作用,因而可以得到较高的分辨率,尤其是在电泳分离后仍能保持蛋白质和酶等生物大分子的生物活性,对于生物大分子的鉴定有重要意义,其方法是在凝胶上进行两份相同样品的电泳,电泳后将凝胶切成两半,一半用于活性染色,对某个特定的生物大分子进行鉴定,另一半用于所有样品的染色,以分析样品中各种生物大分子的种类和含量。
实验方法非变性聚丙烯酰胺凝胶和变性sds-page电泳在操作上基本上是相同的,只是非变性聚丙烯酰胺凝胶的配制和电泳缓冲液中不能含有变性剂如SDS等。
一般蛋白进行非变性凝胶电泳要先分清是碱性还是酸性蛋白。
分离碱性蛋白时候,要利用低pH凝胶系统,分离酸性蛋白时候,要利用高pH凝胶系统。
酸性蛋白通常在非变性凝胶电泳中采用的pH是8.8的缓冲系统,蛋白会带负电荷,蛋白会相阳极移动;而碱性蛋白通常电泳是在微酸性环境下进行,蛋白带正电荷,这时候需要将阴极和阳极倒置才可以电泳分离酸性蛋白。
工作液配制1.40%胶贮液(Acr:Bis=29:1);2.4×分离胶Buf(1.5 M Tris-HCl,pH 8.8):18.2 g Trisbase 溶于ml 水,用浓HCl调pH 8.8,加水定容到100ml,4℃贮存;3. 4×堆积胶Buf(0.5 M Tris-HCl,pH 6.8):6g Trisbase 溶于80ml 水,用浓HCl调pH 6.8,加水定容到100ml,4℃贮存;4.10×电泳Buf(pH8.8 Tris-Gly):30.3 g Trisbase,144g 甘氨酸,加水定容到L,4℃贮存;5.2×溴酚蓝上样Buf:1.25ml pH6.8, 0.5M Tris-Cl,3.0ml甘油,.2ml 0.5% 溴酚蓝,5.5ml dH2O;-20℃贮存;6. 10%APS;7. 0.25%考马斯亮蓝染色液:Coomassie blue R-250 2.5g,甲醇ml,HAc 100ml, dH2O 450ml;8.考马斯亮蓝脱色液:100ml甲醇,100冰醋酸,800ml dH2O电泳胶的配制及电泳条件(上槽电极为负,下槽电极为正)1. 碱性非变性胶17%分离胶(10 ml) 4%堆积胶(5 ml)2. 40%胶贮液(40%T,3.3%C)4.25ml 0.5ml3. 4×分离胶Buf(1.5 M Tris-HCl,pH 8.8)2.5ml4. 4×堆积胶Buf(0.5 M Tris-HCl,pH 6.8) 1.25ml5. 水3.2ml6. 10%APS 35ul7. TEMED 15 ul8. 10×电泳Buf(pH8.8 Tris-Gly):100ml稀释到L电泳条件:100V恒压约20min,指示剂进入浓缩胶;改换160V恒压,当指示剂移动到胶板底部时,停止电泳,整个过程约80min。
sds-page

SDS-PAGE聚丙烯酰胺凝胶电泳(英语:polyacrylamide gel electrophoresis,简称PAGE),是以聚丙烯酰胺凝胶作为支持介质的一种常用电泳技术,用于分离蛋白质和寡核苷酸。
作用原理聚丙烯酰胺凝胶为网状结构,具有分子筛效应。
它有两种形式:非变性聚丙烯酰胺凝胶电泳(Native-PAGE)和变性聚丙烯酰胺凝胶。
在蛋白质的非变性聚丙烯酰胺凝胶电泳中,蛋白质能够保持完整状态,并依据蛋白质的分子量大小、蛋白质的形状及其所附带的电荷量而逐渐呈梯度分开;在DNA的非变性聚丙烯酰胺凝胶电泳中,DNA呈双链状态泳动,其迁移率会受碱基组成和序列的影响。
在变性聚丙烯酰胺凝胶电泳中,由于加入了变性剂——蛋白质变性剂常为SDS(SDS-PAGE),核酸变性剂常为尿素、甲酰胺等,故其分离仅依据于分子量大小。
蛋白质的SDS-PAGE技术最初由Shapiro于1967年建立,他们发现在样品介质和丙烯酰胺凝胶中加入离子去污剂和强还原剂(SDS即十二烷基硫酸钠)后,蛋白质亚基的电泳迁移率主要取决于亚基分子量的大小(可以忽略电荷因素)。
作用SDS是阴离子去污剂,作为变性剂和助溶试剂,它能断裂分子内和分子间的氢键,使分子去折叠,破坏蛋白分子的二、三级结构。
而强还原剂如巯基乙醇,二硫苏糖醇能使半胱氨酸残基间的二硫键断裂。
在样品和凝胶中加入还原剂和SDS后,分子被解聚成多肽链,解聚后的氨基酸侧链和SDS结合成蛋白- SDS胶束,所带的负电荷大大超过了蛋白原有的电荷量,这样就消除了不同分子间的电荷差异和结构差异。
SDS-PAGE一般采用的是不连续缓冲系统,与连续缓冲系统相比,能够有较高的分辨率。
浓缩胶的作用是有堆积作用,凝胶浓度较小,孔径较大,把较稀的样品加在浓缩胶上,经过大孔径凝胶的迁移作用而被浓缩至一个狭窄的区带。
当样品液和浓缩胶选TRIS/HCl缓冲液,电极液选TRIS/甘氨酸。
电泳开始后,HCl解离成氯离子,甘氨酸解离出少量的甘氨酸根离子。
聚丙烯酰胺凝胶电泳

聚丙烯酰胺凝胶电泳分为变性胶与非变性胶两种,区别在于前者中含有一定浓度的变性剂(尿素、甲酰胺或两者合用)。
其基本原理是单体丙烯酰胺在过硫酸铵与TEMED(N,N,N’N’-四甲基乙二胺)的催化与诱导下聚合成长链,当有N,N’-亚甲双丙烯酰胺参与聚合反应时,长链与长链之间就交联成凝胶,其孔径由链长与交联度决定,当DNA分子进入凝胶,在电场下进行泳动时,可根据各自迁移率的不同而得以分离。
非变性胶可用于双链DNA分子的分离与纯化,变性胶可用于单链DNA分子的分离与纯化。
由于变性聚丙烯酰胺凝胶电泳可消除DNA分子不同构象对迁移率的影响,常用于进行遗传病家系的单体型分析。
1、试剂:1)30%丙烯酰胺:丙烯酰胺29gN,N’-亚甲双丙烯酰胺1g加去离子水至100ml 室温避光保存2)10%过硫酰铵(APS):过硫酰铵1g加去离子水至10ml 4℃避光保存3)TEMED(N,N,N’,N’-四甲基乙二胺)4℃避光保存4)10×TBE:Tris碱108g硼酸55g0.5M EDTA(pH8.0) 40ml加去离子水至1000ml 高压蒸气灭菌,室温保存5)8%丙烯酰胺(含50%尿素):丙烯酰胺38gN,N’-亚甲双丙烯酰胺2g10×TBE 25ml尿素250g加去离子水至500ml室温避光保存6)PBR322/MSPI DNA分子量标准:622bp /527bp/404bp/309bp/242bp/238bp/217bp/201bp/190bp/180bp/160bp/147bp/123bp/110bp/97bp/76bp/67bp/34bp7)6×非变性载样缓冲液:二甲苯青FF 0.025g溴酚蓝0.025g0.5M EDTA(pH8.0) 300μl蔗糖4g加去离子水至10ml 4℃保存2×变性载样缓冲液:二甲苯青FF 0.0083g溴酚蓝0.0083g0.5M EDTA(pH8.0) 100μl加去离子甲酰胺至10ml 4℃保存8)固定液:无水乙醇50ml冰醋酸 2.5ml加一蒸水至500ml染色液:AgNO31g加一蒸水至500ml显色液:NaOH 3.75g甲醛(30%) 2.7ml加一蒸水至500ml2、操作步骤:1)选择合适的垂直电泳槽与大小相配的两块玻璃板(其中一块为U形),及两玻璃板间的间隔片和点样梳。
变性与非变性电泳对牛羊乳蛋白质差异比较研究

变性与非变性电泳对牛羊乳蛋白质差异比较研究宋宏新;刘静;张歌;李红心【期刊名称】《陕西科技大学学报(自然科学版)》【年(卷),期】2013(000)006【摘要】主要采用十二烷基硫酸钠聚丙烯酰胺凝胶电泳法(SDS-PAGE)和非变性聚丙烯酰胺凝胶电泳法(Native-PAGE)对新鲜牛羊乳及其酪蛋白清蛋白的区别进行分析检测,对比研究两种电泳方法测定结果的差异,并用两种方法分别检测了掺入不同浓度牛乳的羊乳样品。
结果显示SDS-PAGE法对牛羊乳酪白质的分离效果好,该条件下牛羊乳的区别主要是酪蛋白αs2-CN和αs1-CN ,而native-PAGE法则是对清蛋白分离效果较好,该条件下的主要区别是牛乳较羊乳多两条β-乳球蛋白。
两种电泳方法对掺入不同浓度的羊乳样品的检测阈值均为5%,但native-PAGE效果更明显。
%This experiment analysis and detection fresh cow and goat milk and casein protein , albumin protein by sodium dodecyl sulphate polyacrylamide gel electrophoresis (SDS-PAGE) and native polyacrylamide gel electrophoresis (native-PAGE) ,comparative the results differ-ences of two electrophoresis methods .And were detected the goat milk samples doped with different concentrations of cow milk by both methods .The results showed that by SDS-PAGE casein protein are separated better ,and th e main differences are αs2-CN and αs1-CN , while native-PAGE separate albumin protein better ,and the main difference is that cow milk has two β-lactoglobulin ,but goat milk hasn′t .And the detection threshold of those two kinds of electrophoresis methods ofdetected the goat milk samples doped with different concentra-tions of cow milk is 5% .But the native-PAGE is more effective .【总页数】5页(P109-113)【作者】宋宏新;刘静;张歌;李红心【作者单位】陕西科技大学生命科学与工程学院,陕西西安 710021;陕西科技大学生命科学与工程学院,陕西西安 710021;陕西科技大学生命科学与工程学院,陕西西安 710021;陕西科技大学生命科学与工程学院,陕西西安 710021【正文语种】中文【中图分类】TS252.4【相关文献】1.玉米品种SSR标记毛细管电泳荧光检测法与变性PAGE银染检测法的比较研究[J], 易红梅;王凤格;赵久然;王璐;郭景伦;原亚萍2.变性与非变性PAGE在检测家蚕微卫星PCR产物中差异 [J], 连伟;翁宏飚3.棉花品种SSR标记变性与非变性PAGE检测法的比较研究 [J], 刘国栋;王芙蓉;张传云;陈煜;张景霞;杜召海;张军4.非变性聚丙烯酰胺凝胶电泳中与杂合子相伴产生的非目的条带的鉴定 [J], 王晓通;连林生;赵春江;邓学梅;吴常信5.基于非变性聚丙烯酰胺凝胶电泳的菜心SCoT分析 [J], 史卫东; 罗海玲; 康红卫; 琚茜茜; 张力因版权原因,仅展示原文概要,查看原文内容请购买。
蛋白非变性胶详解

Native-PAGE原理非变性聚丙烯酰胺凝胶电泳(Native-PAGE)是在不加入S DS 疏基乙醇等变性剂的条件下,对保持活性的蛋白质进行聚丙烯酰胺凝胶电泳,常用于同工酶的鉴定和提纯。
未加SDS的天然聚丙烯酰胺凝胶电泳可以使生物大分子在电泳过程中保持其天然的形状和电荷,它们的分离是依据其电泳迁移率的不同和凝胶的分子筛作用,因而可以得到较高的分辨率,尤其是在电泳分离后仍能保持蛋白质和酶等生物大分子的生物活性,对于生物大分子的鉴定有重要意义,其方法是在凝胶上进行两份相同样品的电泳,电泳后将凝胶切成两半,一半用于活性染色,对某个特定的生物大分子进行鉴定,另一半用于所有样品的染色,以分析样品中各种生物大分子的种类和含量。
实验方法非变性聚丙烯酰胺凝胶和变性sds-page电泳在操作上基本上是相同的,只是非变性聚丙烯酰胺凝胶的配制和电泳缓冲液中不能含有变性剂如S DS等。
一般蛋白进行非变性凝胶电泳要先分清是碱性还是酸性蛋白。
分离碱性蛋白时候,要利用低pH凝胶系统,分离酸性蛋白时候,要利用高pH凝胶系统。
酸性蛋白通常在非变性凝胶电泳中采用的p H是8.8的缓冲系统,蛋白会带负电荷,蛋白会相阳极移动;而碱性蛋白通常电泳是在微酸性环境下进行,蛋白带正电荷,这时候需要将阴极和阳极倒置才可以电泳分离酸性蛋白。
工作液配制1.40%胶贮液(Acr:Bis=29:1);2.4×分离胶Buf(1.5 M Tris-HCl,pH 8.8):18.2 g Trisba se 溶于ml 水,用浓HCl调pH 8.8,加水定容到100ml,4℃贮存;3. 4×堆积胶Buf(0.5 M Tris-HCl,pH 6.8):6g Trisba se 溶于80ml水,用浓HCl调pH 6.8,加水定容到100ml,4℃贮存;4.10×电泳Buf(pH8.8 Tris-Gly):30.3 g Trisba se,144g 甘氨酸,加水定容到L,4℃贮存;5.2×溴酚蓝上样B uf:1.25ml pH6.8, 0.5M Tris-Cl,3.0ml甘油,.2ml 0.5% 溴酚蓝,5.5ml dH2O;-20℃贮存;6. 10%APS;7. 0.25%考马斯亮蓝染色液:Coomas sie blue R-250 2.5g,甲醇ml,HAc 100ml, dH2O 450ml;8.考马斯亮蓝脱色液:100ml甲醇,100冰醋酸,800mldH2O电泳胶的配制及电泳条件(上槽电极为负,下槽电极为正)1. 碱性非变性胶17%分离胶(10 ml) 4%堆积胶(5 ml)2. 40%胶贮液(40%T,3.3%C)4.25ml 0.5ml3. 4×分离胶Buf(1.5 M Tris-HCl,pH 8.8)2.5ml4. 4×堆积胶Buf(0.5 M Tris-HCl,pH 6.8) 1.25ml5. 水3.2ml6. 10%APS 35ul7. TEMED15 ul8. 10×电泳Buf(pH8.8 Tris-Gly):100ml稀释到L电泳条件:100V恒压约20mi n,指示剂进入浓缩胶;改换160V恒压,当指示剂移动到胶板底部时,停止电泳,整个过程约80min。
DNA电泳技术
(丙烯酰胺) CH2=CH-CO-NH-CH2-NH-COCH=CH2 (N,N`-亚甲双丙烯酰胺)
聚丙烯酰胺凝胶电泳
• 适宜分离鉴定低分子量蛋白质、小于1Kb的 DNA片段和DNA序列分析
• 其装载的样品量大,回收DNA纯度高,长 度仅相差0.2%(即500bp中的1bp)的核苷 酸分子即能分离
一 毛细管电泳仪系统
电泳仪
进样系统 分离系统
检测系统
数据处理系统
Come on
二 毛细管电泳的分离模式
• 区带电泳 capillary zone electrophoresis, CZE • 毛细管凝胶电泳 capillary gel electrophoresis, CGE • 等速电泳 capillary isota- chophoresis, CITP • 等电聚焦 capillary isoelectric focus, CIEF
原理简图
・Electrophoresis: ABI310 Genetic Analyzer (Applied Biosystems) ・Analysis: GeneScanTM Analysis Software Ver.3.7(Applied Biosystems)
优点
• • • • 1. 2. 3. 4. 分辨率高 灵敏度高 高效性 自动化: 灌胶、进样、数据收集
09:37:50
四 分离原理
电场作用下,毛细 管柱中出现:电泳现 象和电渗流现象。 带电粒子的迁移速度=电泳+电渗流;两种速度的矢量和。 正离子:两种效应的运动方向一致,在负极最先流出; 中性粒子无电泳现象,受电渗流影响,在阳离子后流出; 阴离子:两种效应的运动方向相反。ν 电渗流 >ν 电泳 时,阴离 子在负极最后流出,在这种情况下,不但可以按类分离,除中性 粒子外,同种类离子由于受到的电场力大小不一样也同时被相 互分离。
聚丙烯酰胺的分类

聚丙烯酰胺的分类聚丙烯酰胺(Polyacrylamide,简称PAM)是一种重要的高分子化合物,具有广泛的应用领域。
根据其化学结构和功能特点,可以将聚丙烯酰胺分为以下几个分类。
一、非离子型聚丙烯酰胺非离子型聚丙烯酰胺是指在水溶液中不带电荷的聚丙烯酰胺。
它具有优异的增稠性能和流变性能,常用于石油开采、纸浆造纸、漂白剂和沉淀剂等工业领域。
在石油开采过程中,非离子型聚丙烯酰胺可以改变水的黏度,提高水的流动性,从而增加油井的产量。
在纸浆造纸过程中,非离子型聚丙烯酰胺可以增加纸浆的粘度,提高纸张的强度和光泽。
二、阳离子型聚丙烯酰胺阳离子型聚丙烯酰胺是指在水溶液中带正电荷的聚丙烯酰胺。
它具有良好的吸附性能和沉淀性能,广泛应用于水处理、纺织印染和生物医药等领域。
在水处理过程中,阳离子型聚丙烯酰胺可以吸附并沉淀悬浮物、有机物和重金属离子,从而提高水质。
在纺织印染过程中,阳离子型聚丙烯酰胺可以与纤维表面形成吸附层,改善染料的吸附性能和牢度。
在生物医药领域,阳离子型聚丙烯酰胺可以作为药物控释系统的载体,延长药物的释放时间。
三、阴离子型聚丙烯酰胺阴离子型聚丙烯酰胺是指在水溶液中带负电荷的聚丙烯酰胺。
它具有良好的分散性和稳定性,常用于纺织助剂、矿山浮选和油田注水等领域。
在纺织助剂中,阴离子型聚丙烯酰胺可以改善纤维的分散性,提高染料的上染率和均匀度。
在矿山浮选过程中,阴离子型聚丙烯酰胺可以促进矿石颗粒与气泡的接触和附着,提高浮选效果。
在油田注水过程中,阴离子型聚丙烯酰胺可以改善水的渗透能力,增加原油的采收率。
四、复合型聚丙烯酰胺复合型聚丙烯酰胺是指由非离子型、阳离子型和/或阴离子型聚丙烯酰胺组成的混合物。
它综合了各种聚丙烯酰胺的特点,具有更广泛的应用范围。
复合型聚丙烯酰胺可以用于纸浆造纸、水处理、矿山浮选、油田注水和生物医药等领域。
其中,复合型聚丙烯酰胺在纸浆造纸过程中可以起到增稠、增强和改善纸张性能的作用;在水处理过程中可以同时起到吸附、沉淀和分散的作用;在矿山浮选过程中可以提高矿石的浮选效果;在油田注水过程中可以提高原油的采收率;在生物医药领域可以作为药物控释系统的载体。
Native-PAGE

Native-PAGE原理非变性聚丙烯酰胺凝胶电泳(Native-PAGE)是在不加入SDS 疏基乙醇等变性剂的条件下,对保持活性的蛋白质进行聚丙烯酰胺凝胶电泳,常用于同工酶的鉴定和提纯。
未加SDS的天然聚丙烯酰胺凝胶电泳可以使生物大分子在电泳过程中保持其天然的形状和电荷,它们的分离是依据其电泳迁移率的不同和凝胶的分子筛作用,因而可以得到较高的分辨率,尤其是在电泳分离后仍能保持蛋白质和酶等生物大分子的生物活性,对于生物大分子的鉴定有重要意义,其方法是在凝胶上进行两份相同样品的电泳,电泳后将凝胶切成两半,一半用于活性染色,对某个特定的生物大分子进行鉴定,另一半用于所有样品的染色,以分析样品中各种生物大分子的种类和含量。
Native-PAGE实验方法非变性聚丙烯酰胺凝胶和变性sds-page电泳在操作上基本上是相同的,只是非变性聚丙烯酰胺凝胶的配制和电泳缓冲液中不能含有变性剂如SDS等。
一般蛋白进行非变性凝胶电泳要先分清是碱性还是酸性蛋白。
分离碱性蛋白时候,要利用低pH凝胶系统,分离酸性蛋白时候,要利用高pH凝胶系统。
酸性蛋白通常在非变性凝胶电泳中采用的pH是8.8的缓冲系统,蛋白会带负电荷,蛋白会相阳极移动;而碱性蛋白通常电泳是在微酸性环境下进行,蛋白带正电荷,这时候需要将阴极和阳极倒置才可以电泳分离酸性蛋白工作液配制1. 30%胶贮液(Acr:Bis=29:1);2. 4×分离胶Buf(1.5 M Tris-HCl,pH 8.8):18.2 g Trisbase溶于80ml 水,用浓HCl调pH 8.8,加水定容到100ml,4℃贮存;3. 4×堆积胶Buf(0.5 M Tris-HCl,pH 6.8):6 g Trisbase溶于80ml 水,用浓HCl调pH 6.8,加水定容到100ml,4℃贮存;4. 10×电泳Buf(pH8.8 Tris-Gly):??30.3 g Trisbase,144 g 甘氨酸,加水定容到1L,4℃贮存;5. 2×溴酚蓝上样Buf:1.25ml pH6.8, 0.5M Tris-Cl,3.0ml甘油,0.2ml 0.5% 溴酚蓝,5.5ml dH2O;-20℃贮存;6. 10%APS;7. 0.25%考马斯亮蓝染色液:Coomassie blue R-250 2.5g,甲醇450ml,HAc 100ml, dH2O 450ml;8. 考马斯亮蓝脱色液: 100ml甲醇,100冰醋酸,800ml dH2O电泳胶的配制及电泳条件(上槽电极为负,下槽电极为正)1. 碱性非变性胶17%分离胶(10 ml) 4%堆积胶(5 ml)2. 40%胶贮液(40%T,3.3%C)4.25ml 0.5ml3. 4×分离胶Buf(1.5 M Tris-HCl,pH 8.8) 2.5ml4. 4×堆积胶Buf(0.5 M Tris-HCl,pH 6.8) 1.25ml5. 水3.2ml6. 10%APS ??35 μl7. TEMED 15 μl8. 10×电泳Buf(pH8.8 Tris-Gly):100ml稀释到1L电泳条件:100V恒压约20min,指示剂进入浓缩胶;改换160V恒压,当指示剂移动到胶板底部时,停止电泳,整个过程约80min。
变性与非变性聚丙烯酰胺的区别

非变性和变性聚丙烯酰胺凝胶的区别?“变性”体现在哪里?作者: 墨池(站内联系TA)收录: 2011-07-31 发布: 2011-07-211 非变性和变性聚丙烯酰胺凝胶的区别?“变性”体现在哪里?2 SRAP标记用6%聚丙烯酰胺凝胶电泳,是变性还是非变性?配方是什么?配胶时,过硫酸铵是不是要最后加入?谢谢(*^__^*) 嘻嘻收、蛋白质分子量测定会使用变性PAGE,而DNA跑PAGE通常是采用非变性PAGE,另外回收活性蛋白也有用非变性PAGE的。
2. SRAP(貌似叫什么...相关序列扩增多态性)标记这个应该是非变性PAGE,6%的PAGE胶配方就不用发了吧,google一下一大堆。
TEMED和过硫酸铵都是最Originally posted by holyala at 2011-07-21 2121:1. 变性胶加尿素或者其他变性剂,非变性胶是不加的。
一般做RNA分离或回收、蛋白质分子量测定会使用变性PAGE,而DNA跑PAGE通常是采用非变性PAGE,另外回收活性蛋白也有用非变性PAGE的。
2. SRAP(貌似叫什么...相 ...Originally posted by 墨池 at 2011-07-21 2138:TEMED和过硫酸铵的先后呢?Originally posted by 墨池 at 2011-07-21 2019:1 非变性和变性聚丙烯酰胺凝胶的区别?“变性”体现在哪里?2 SRAP标记用6%聚丙烯酰胺凝胶电泳,是变性还是非变性?配方是什么?配胶时,过硫酸铵是不是要最后加入?谢谢(*^__^*) 嘻嘻1. “变性”体现在聚丙烯酰胺凝胶中加入尿素(一般跑DNA)或SDS(一般跑蛋白),另外,如果样品也要变性(DNA的loanding buffer也与普通的琼脂糖电泳所用的不同,同理所用Marker也不同;蛋白也要变性)。
2.SRAP一般用变性的聚丙烯酰胺,毕竟片段还是比较小。
Native-PAGE实验方法

Native-PAGE实验方法非变性聚丙烯酰胺凝胶和变性sds-page电泳在操作上基本上是相同的,只是非变性聚丙烯酰胺凝胶的配制和电泳缓冲液中不能含有变性剂如SDS等。
一般蛋白进行非变性凝胶电泳要先分清是碱性还是酸性蛋白。
分离碱性蛋白时候,要利用低pH凝胶系统,分离酸性蛋白时候,要利用高pH凝胶系统。
酸性蛋白通常在非变性凝胶电泳中采用的pH是8.8的缓冲系统,蛋白会带负电荷,蛋白会相阳极移动;而碱性蛋白通常电泳是在微酸性环境下进行,蛋白带正电荷,这时候需要将阴极和阳极倒置才可以电泳。
分离酸性蛋白工作液配制1. 40%胶贮液(Acr:Bis=29:1);2. 4×分离胶Buf(1.5 M Tris-HCl,pH 8.8):18.2 g Trisbase 溶于80ml 水,用浓HCl调pH 8.8,加水定容到100ml,4℃贮存;3. 4×堆积胶Buf(0.5 M Tris-HCl,pH 6.8):6 g Trisbase 溶于80ml 水,用浓HCl调pH 6.8,加水定容到100ml,4℃贮存;4. 10×电泳Buf(pH8.8 Tris-Gly):30.3 g Trisbase,144 g 甘氨酸,加水定容到1l ,4℃贮存;5. 2×溴酚蓝上样Buf:1.25ml pH6.8, 0.5M Tris-Cl,3.0ml甘油,0.2ml 0.5% 溴酚蓝,5.5ml dH2 O;-20℃贮存;6. 10%APS;7. 0.25%考马斯亮蓝染色液:Coomassie red R-250 2.5g,甲醇450ml,HAc 100ml, dH2O 450ml;8. 考马斯亮蓝脱色液: 100ml甲醇,100冰醋酸,800ml dH2O电泳胶的配制及电泳条件(上槽电极为负,下槽电极为正)1. 碱性非变性胶17%分离胶(10 ml) 4%堆积胶(5 ml)2. 40%胶贮液(40%T,3.3%C)4.25ml 0.5ml3. 4×分离胶Buf(1.5 M Tris-HCl,pH 8.8) 2.5ml4. 4×堆积胶Buf(0.5 M Tris-HCl,pH 6.8) 1.25ml5. 水 3.2ml6. 10%APS 35 μl7. TEMED 15 μl8. 10×电泳Buf(pH8.8 Tris-Gly):100ml稀释到1L电泳条件:100V恒压约20min,指示剂进入浓缩胶;改换160V恒压,当指示剂移动到胶板底部时,停止电泳,整个过程约80min。
生化分析知识点总结

一.氨基酸1 八种必须氨基酸的英文命名及缩写。
赖氨酸Lysine Lys K甲硫氨酸Methionine Met M缬氨酸valine Val V异亮氨酸isoleucine Ile I苯丙氨酸phenylaninePhe F亮氨酸leucine Leu L色氨酸tryptophan Try W苏氨酸threonine thr T2 俩种氨基酸组成多肽时,有几种?成二肽,有四种成三肽时,有八种(仅供参考,不一定正确,有不同意见请指出来)。
二酶分析1酶活性的定义,国际常用的单位:酶活性(enzyme activity)也称为酶活力,指酶促反应速率,即规定条件下在单位时间内产物的生成量或底物的减少量。
酶活性单位:表示酶的相对含量,指在一定条件下,单位时间内生成一定量的产物或消耗一定量的底物所催化的酶量。
a.国际单位IU(µmol/min)定义:在规定条件下(25℃及其他最适条件),每分钟催化1µmol 底物转变为产物的酶量,为1IU或1U。
1IU=1µmol/min。
B.Katal单位(mol/s)定义:1Katal是在规定条件下,每秒钟催化1mol底物转变为产物的酶量。
1Katal=1mol/s。
IU与Katal单位的关系:1katal = 60×106IU,1IU = 16.67nkatal3 酶促反应酶促反应的历程:延滞期,线性期,非线性期a.酶促反应式:B.米氏方程C .Km 的含义与意义.Km 的含义:当Km=[S]时,可见Km 值等于反应速率达到最大反应速率Vmax 一半时的底物浓度。
Km 的意义:Km 是酶的一个特征性常数(其他如等电点),Km 的大小只与酶的性质有关反映酶对底物亲和力的大小选择酶的最适底物或天然底物计算不同底物浓度时的反应程度鉴别酶的种类判断可逆反应的速率判断酶偶联反应的限速反应计算工具酶的用量3.两种测定酶活性的方法:a .定时法原理:定时法是固定时间法的简称,是指测定反应开始后一段时间(t1~t2)产物的增加量或底物的减少量以测定酶活性的方法。
SDS聚丙烯酰胺凝胶电泳原理

聚丙烯酰氨凝胶电泳作用原理聚丙烯酰胺凝胶电泳是网状结构,具有分子筛效应,它有两种形式,一种是非变性聚丙烯酰胺凝胶,蛋白质在电泳中保持完整的状态,蛋白在其中依三种因素分开:蛋白大小,形状和电荷。
而SDS-PAGE仅根据蛋白分子量亚基的不同而分离蛋白。
这个技术首先是1967年由shapiro建立,他们发现在样品介质和丙烯酰胺凝胶中加入离子去污剂和强还原剂后,蛋白质亚基的电泳迁移率主要取决于亚基分子量的大小,电荷因素可以忽视。
SDS是阴离子去污剂,作为变性剂和助溶试剂,它能断裂分子内和分子间的氢键,使分子去折叠,破坏蛋白分子的二、三级结构。
而强还原剂如巯基乙醇,二硫苏糖醇能使半胱氨酸残基间的二硫键断裂。
在样品和凝胶中加入还原剂和SDS后,分子被解聚成多肽链,解聚后的氨基酸侧链和SDS结合成蛋白- SDS胶束,所带的负电荷大大超过了蛋白原有的蛋白量,这样就消除了不同分子间的电荷差异和结构差异。
SDS-PAGE一般采用的是不连续缓冲系统,于连续缓冲系统相比,能够有较高的分辨率。
浓缩胶的作用是有堆积作用,凝胶浓度较小,孔径较大,把较稀的样品加在浓缩胶上,经过大孔径凝胶的迁移作用而被浓缩至一个狭窄的区带。
当样品液和浓缩胶选TRIS/HCL缓冲液,电极液选TRIS/甘氨酸。
电泳开始后,HCL解离成氯离子,甘氨酸解离出少量的甘氨酸根离子。
蛋白质带负电荷,因此一起向正极移动,其中氯离子最快,甘氨酸根离子最慢,蛋白居中。
电泳开始时氯离子泳动率最大,超过蛋白,因此在后面形成低电导区,而电场强度与低电导区成反比,因而产生较高的电场强度,使蛋白和甘氨酸根离子迅速移动,形成以稳定的界面,使蛋白聚集在移动界面附近,浓缩成一中间层。
SDS聚丙烯酰胺凝胶电泳原理采用十二烷基硫酸钠-聚丙稀酰胺凝胶电泳(SDS-PAGE,polyacrylamide gel electrophoresis)方法可对蛋白质的组分进行分离,并可精确测得蛋白质的分子量。
聚丙烯酰胺凝胶电泳

电泳体系中所用的缓冲液 成分、 、 成分、pH、凝胶浓度相同
电荷效应 连续电泳 分子筛效应
PAGE
电荷效应 不连续电泳 分子筛效应 浓缩效应: 浓缩效应:不连续性所致
不连续SDS-PAGE 不连续
原理
凝胶的不连续性 缓冲离子的不连续性 pH的不连续性 的不连续性 电位梯度的不连续性
凝胶的不连续性: ① 凝胶的不连续性: 浓缩胶:大孔径。样品在其中浓缩, 浓缩胶:大孔径。样品在其中浓缩,并按迁 移率递减的顺序逐渐在其与分离胶的界面上积 聚成薄层。 聚成薄层。 分离胶:小孔径。 分离胶:小孔径。蛋白质分子在大孔胶中受 到的阻力小,移动速度快, 到的阻力小,移动速度快,进入小孔胶时遇到 的阻力大,迁移速度减慢。 的阻力大,迁移速度减慢。由于凝胶的不连续 在大孔胶和小孔胶界面处就会使样品浓缩, 性,在大孔胶和小孔胶界面处就会使样品浓缩, 取带变窄。 取带变窄。 ② 缓冲离子的不连续性 ③ pH的不连续性 的不连续性 ④ 电位梯度的不连续性
非变性聚丙烯酰胺凝胶电泳( 非变性聚丙烯酰胺凝胶电泳(native-PAGE) )
(根据蛋白质的分子量、形状、电荷来分离蛋白质) 根据蛋白质的分子量、形状、电荷来分离蛋白质)
变性聚丙烯酰胺凝胶电泳( 变性聚丙烯酰胺凝胶电泳(SDS-PAGE) )
(根据亚基分子量分离蛋白质) 根据亚基分子量分离蛋白质)
聚丙烯酰胺凝胶由丙烯酰胺单体( 聚丙烯酰胺凝胶由丙烯酰胺单体(Acrylamide, , Acr)和交联剂 甲叉双丙烯酰胺( )和交联剂N,N’-甲叉双丙烯酰胺(Bis)在 甲叉双丙烯酰胺 ) 催化剂作用下合成。 催化剂作用下合成。 聚合后的聚丙烯酰胺凝胶形成网状结构, 聚合后的聚丙烯酰胺凝胶形成网状结构,具有 电荷效应、分子筛效应。 电荷效应、分子筛效应。 电荷效应(电泳物所带电荷的差异性) 电荷效应(电泳物所带电荷的差异性) 分子筛效应( 分子筛效应(凝胶的网状结构及电泳物 大小形状不同所致) 的 大小形状不同所致)
非变性聚丙烯酰胺凝胶电泳

非变性聚丙烯酰胺凝胶电泳非变性聚丙烯酰胺凝胶电泳是一种常用的蛋白质分离技术。
它利用聚丙烯酰胺凝胶作为分离介质,将蛋白质按照其分子量大小隔离出来。
与变性聚丙烯酰胺凝胶电泳不同,非变性聚丙烯酰胺凝胶电泳在分离过程中保持蛋白质的天然构象和电荷状态,因此适用于研究酶的活性以及蛋白质与其他分子的相互作用等。
非变性聚丙烯酰胺凝胶电泳的原理是基于蛋白质在凝胶中的迁移速率与其分子量成反比的关系。
通过将样品加入凝胶孔中,并通过电泳使蛋白质随电场迁移,可以将分子量较大的蛋白质沿着凝胶向电极缓慢迁移,而分子量较小的蛋白质则快速迁移。
最终,蛋白质会在凝胶中形成带状图案,从而实现它们的分离。
非变性聚丙烯酰胺凝胶电泳需要准备一定数目的设备以及试剂。
其中最主要的试剂是聚丙烯酰胺凝胶,其通过自由基聚合反应形成一种网络结构,可将蛋白质分子固定在凝胶中,防止其沿着电场离开凝胶。
另外还需要一些缓冲液来调节电泳过程中的pH值和离子浓度,以防止蛋白质发生聚集现象。
此外,还需要电泳槽、电源、电极、样品载体等设备。
在进行非变性聚丙烯酰胺凝胶电泳之前,需要对这些设备进行清洗和消毒,以保证实验结果的准确性和可靠性。
在非变性聚丙烯酰胺凝胶电泳中,蛋白质的分离主要依赖于凝胶的孔径大小和电荷性质。
凝胶的孔径大小决定了蛋白质进入凝胶的速率,同时也影响了蛋白质与凝胶网络之间的相互作用,从而影响蛋白质的迁移速率。
电荷性质主要指凝胶中的离子种类和浓度,以及pH值等因素,这些因素会影响蛋白质的电荷状态,从而影响其在凝胶中的迁移速率。
如果这些因素不合适,就可能导致蛋白质无法有效地分离。
总之,非变性聚丙烯酰胺凝胶电泳是一种常用的蛋白质分离技术。
通过调节凝胶孔径大小和电荷性质,可以实现对不同分子量蛋白质的有效分离。
在研究酶活性和蛋白质相互作用等方面有着广泛的应用前景。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
非变性和变性聚丙烯酰胺凝胶的区别?“变性”体
现在哪里?
作者: 墨池(站内联系TA)收录: 2011-07-31 发布: 2011-07-21
1 非变性和变性聚丙烯酰胺凝胶的区别?“变性”体现在哪里?
2 SRAP标记用6%聚丙烯酰胺凝胶电泳,是变性还是非变性?配方是什么?配胶时,过硫酸铵是不是要最后加入?
谢谢(*^__^*) 嘻嘻
收、蛋白质分子量测定会使用变性PAGE,而DNA跑PAGE通常是采用非变性PAGE,另外回收活性蛋白也有用非变性PAGE的。
2. SRAP(貌似叫什么...相关序列扩增多态性)标记这个应该是非变性PAGE,6%的PAGE胶配方就不用发了吧,google一下一大堆。
TEMED和过硫酸铵都是最
Originally posted by holyala at 2011-07-21 2121:
1. 变性胶加尿素或者其他变性剂,非变性胶是不加的。
一般做RNA分离或回收、蛋白质分子量测定会使用变性PAGE,而DNA跑PAGE通常是采用非变性PAGE,另外回收活性蛋白也有用非变性PAGE的。
2. SRAP(貌似叫什么...相 ...
Originally posted by 墨池 at 2011-07-21 2138:
TEMED和过硫酸铵的先后呢?
Originally posted by 墨池 at 2011-07-21 2019:
1 非变性和变性聚丙烯酰胺凝胶的区别?“变性”体现在哪里?
2 SRAP标记用6%聚丙烯酰胺凝胶电泳,是变性还是非变性?配方是什么?配胶时,过硫酸铵是不是要最后加入?
谢谢(*^__^*) 嘻嘻
1. “变性”体现在聚丙烯酰胺凝胶中加入尿素(一般跑DNA)或SDS(一般跑蛋白),另外,如果样品也要变性(DNA的loanding buffer也与普通的琼脂糖电泳所用的不同,同理所用Marker也不同;蛋白也要变性)。
2.SRAP一般用变性的聚丙烯酰胺,毕竟片段还是比较小。
3.配胶时不用加入过硫酸铵,灌胶前同时加入过硫酸铵(注意有毒!低温保存)和TEMED(也有毒,特臭)。
另外,这些问题貌似分子克隆那本书非常详细,只不过SRAP标记较新而已,没
Originally posted by changes at 2011-07-21 2107:
1. “变性”体现在聚丙烯酰胺凝胶中加入尿素(一般跑DNA)或SDS(一般跑蛋白),另外,如果样品也要变性(DNA的loanding buffer也与普通的琼脂糖电泳所用的不同,同理所用Marker也不同;蛋白也要变性)。
2.SRAP一般 ...
Originally posted by 墨池 at 2011-07-21 2104:
你说SRAP是变性的,我看师姐的配胶过程没有一点体现变性的物质。
非变性胶也可以,但是分辨率会低些。
另外,你是用SRAP标记做什么的,多态
Originally posted by 冼亮淀粉酶 at 2011-07-22 0727:
APS和TEMED虽然不好,但也比不上丙烯酰胺有神经毒性,可随皮肤渗入人体,所以我是什么东西都加完之后最后加丙烯酰胺。
...额~~话说我们一般都是把丙烯酰胺和甲叉丙烯酰胺配成40%的母液,用的时候根据所需要的浓度加一定量的母液即可。
要是每次都搞丙烯酰胺来配,那谁
Originally posted by changes at 2011-07-21 2107:
1. “变性”体现在聚丙烯酰胺凝胶中加入尿素(一般跑DNA)或SDS(一般跑蛋
白),另外,如果样品也要变性(DNA的loanding buffer也与普通的琼脂糖电
泳所用的不同,同理所用Marker也不同;蛋白也要变性)。
2.SRAP一般 ...
这个我有点问题...跑DNA的PAGE电泳要用变性胶么?根据我的经验,双链DNA跑尿素PAGE的时候由于变性导致双链打开,电泳图会非常难看,原本的单一条带会变成非常接近的两个条带。
嗯,不过我这种情况是DNA片段较大(>50bp)的时候,不知道十几个bp的DNA会怎样。
so...我只用过尿素PAGE分离
为单链
Originally posted by changes at 2011-07-21 2202:
非变性胶也可以,但是分辨率会低些。
另外,你是用SRAP标记做什么的,多态
性还是标记目的基因或遗传图谱构建?
Originally posted by holyala at 2011-07-22 1055:
...额~~话说我们一般都是把丙烯酰胺和甲叉丙烯酰胺配成40%的母液,用的时
候根据所需要的浓度加一定量的母液即可。
要是每次都搞丙烯酰胺来配,那谁
受得了啊。
Originally posted by 墨池 at 2011-07-22 1320:
你理解有误,我们说的就是指母液,不知道你怎么理解成这样了
不知道是哪里的问题啊...如果我理解不对的话,那么冼亮淀粉酶大大说的:“APS和TEMED虽然不好,但也比不上丙烯酰胺有神经毒性,可随皮肤渗入人体,所以我是什么东西都加完之后最后加丙烯酰胺。
” 意思难道是所有东西都
Originally posted by 墨池 at 2011-07-22 1313:
多态性。
一种观赏花卉50个品种的遗传多样性分析
多态性的话建议使用变性胶检测,使用大板、长板,那样跑出来相当漂亮,也方便统计条带。
另外,材料的亲缘关系最好也明确,对于最终结果的分析有帮助。
Originally posted by holyala at 2011-07-22 1454:
不知道是哪里的问题啊...如果我理解不对的话,那么冼亮淀粉酶大大说的:“APS和TEMED虽然不好,但也比不上丙烯酰胺有神经毒性,可随皮肤渗入人体,所以我是什么东西都加完之后最后加丙烯酰胺。
” 意思难道是所 ...
Originally posted by changes at 2011-07-22 1422:
多态性的话建议使用变性胶检测,使用大板、长板,那样跑出来相当漂亮,也方便统计条带。
另外,材料的亲缘关系最好也明确,对于最终结果的分析有帮助。
:P
变性胶的配方有么?可否参考一下下(*^__^*) 嘻嘻……。
