低密度脂蛋白胆固醇测定试剂盒技术审评规范
低密度脂蛋白胆固醇测定试剂盒(直接法-表面活性剂清除法)标准化操作规程LDLC-SOP

低密度脂蛋白胆固醇测定试剂盒(直接法-表面活性剂清除法)标准化操作规程1 目的规范实验室操作,保证检验工作顺利有效进行特制定此规程。
2 授权操作人经培训且考核通过的临床检验人员。
3 适用范围本试剂用于体外定量检测血清中低密度脂蛋白胆固醇的浓度。
4 检验方法本试剂采用直接测试法测定低密度脂蛋白胆固醇的浓度。
5 检验原理样本中的低密度脂蛋白胆固醇在试剂中表面活性剂的作用下被胆固醇脂酶选择性地催化水解为胆固醇和游离脂肪酸,生成的胆固醇经胆固醇氧化酶氧化生成胆甾-4-烯-3-酮和过氧化氢,过氧化氢在过氧化物酶的催化下与苯胺类色原物质和4-氨基安替比林作用产生水和醌亚胺色素,醌亚胺色素的生成量与样本中低密度脂蛋白胆固醇的含量成正比,通过测定特定波长处反应最终生成的色素量,可以计算出样本中低密度脂蛋白胆固醇的浓度。
低密度脂蛋白胆固醇脂+ H2O −−−−→−酶酯胆固胆固醇+游离脂肪酸胆固醇 + O2−−−−−−→−胆固醇氧化酶胆甾-4-烯-3-酮+ H2O2H 2O2+ 4-氨基安替比林 + 苯胺类色原物质−−−−−→−过氧化物酶醌亚胺色素 + 水6 标本要求6.1 样本为血清,不得使用溶血、脂血或被污染的样本。
6.2 样本在2℃~8℃可稳定7天,-20℃可稳定1个月。
避免样本反复冻融。
7 试剂及配套品7.1试剂来源长春迪瑞医疗科技股份有限公司低密度脂蛋白胆固醇试剂盒(直接测试法)7.27.3试剂的稳定性与贮存:7.3.1试剂在2℃~8℃条件下,干燥、避光、密封贮存,有效期为12个月。
7.3.2试剂开封后在2℃~8℃条件下可稳定30天。
7.3.3 请勿于0℃以下保存试剂。
8 实验仪器及性能指标8.1 实验仪器迪瑞CS系列全自动生化分析仪8.2试剂性能指标8.2.1 试剂空白吸光度:A<0.05。
8.2.2 分析灵敏度:测试1.00mmol/L的样本时,吸光度变化△A>0.03。
8.2.3 线性范围:试剂线性在[0.20,11.60] 区间内;线性回归系数r≥0.9950;[0.20,2.00] mmol/L范围内,线性绝对偏差应不超过±0.30mmol/L;(2.00,11.60] mmol/L范围内,线性相对偏差不超过±10%。
小而密低密度脂蛋白胆固醇(sdLDL-C)测定试剂盒(过氧化物酶法)产品技术要求百奥泰康

小而密低密度脂蛋白胆固醇(sdLDL-C)测定试剂盒(过氧化物酶法)产品技术要求百奥泰康预览说明:预览图片所展示的格式为文档的源格式展示,下载源文件没有水印,内容可编辑和复制小而密低密度脂蛋白胆固醇(sd LDL-C)测定试剂盒(过氧化物酶法) 适用范围:该产品用于体外定量测定人血清或血浆中小而密低密度脂蛋白胆固醇的含量。
1.1 产品规格1.2 组成成分1.2.1 试剂组成试剂1:Tris 缓冲液 100mmol/L胆固醇酯酶(CHE) 1600U/L胆固醇氧化酶(CHO) 600U/L磷脂酶 2700U/L过氧化氢酶 1200U/L2-羟基-3-间甲苯胺丙磺酸钠 2mmol/L试剂2:Tris 缓冲液 100mmol/L过氧化物酶(POD) 5000U/L4-氨基安替比林4mmol/L1.2.2校准品的组成校准品为冻干品,校准品组成是在磷酸盐缓冲液中加入含一定浓度的小而密低密度脂蛋白胆固醇纯品,稳定剂<5%。
1个水平校准品目标浓度为1.1 mmol/L(42.5 mg/dL),浓度有批特异性,具体定值详见瓶签。
1.2.3质控品的组成两水平冻干质控品,在20g/L牛血清中加入小而密低密度脂蛋白胆固醇纯品,稳定剂<5%。
靶值范围分别为:0.259 ~ 1.036 mmol/L (10.0~40.0 mg/dL)、1.036 ~2.072 mmol/L(40.0~80.0 mg/dL)。
2.1 外观试剂1 为无色到淡褐色液体,目测不得有任何沉淀及絮状悬浮物;试剂2 为淡黄色到黄色液体,目测不得有任何沉淀及絮状悬浮物;校准品为白色或淡黄色粉末状物质,复溶后为无色或淡黄色液体,目测不得有任何沉淀及絮状悬浮物;质控品为白色或淡黄色粉末状物质,复溶后为无色或淡黄色液体,目测不得有任何沉淀及絮状悬浮物。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 空白吸光度试剂空白吸光度应≤0.1。
2.4 分析灵敏度浓度为2.59 mmol/L(100.0 mg/dL)时,吸光度变化应≥0.05。
低密度脂蛋白胆固醇测定试剂盒产品技术审评规范版

低密度脂蛋白胆固醇测定试剂盒产品技术审评规范版标准化工作室编码[XX968T-XX89628-XJ668-XT689N]附件4低密度脂蛋白胆固醇测定试剂(盒)产品技术审评规范(2017版)本规范旨在指导注册申请人对低密度脂蛋白胆固醇测定试剂(盒)注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本审评规范是对低密度脂蛋白胆固醇测定试剂(盒)的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据产品特性确定其中的具体内容是否适用。
本规范是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本规范。
本规范是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本规范相关内容也将进行适时调整。
一、适用范围低密度脂蛋白胆固醇测定试剂(盒)用于体外定量测定人血清和/或血浆中的低密度脂蛋白胆固醇的含量。
从方法学考虑,本规范主要指基于分光光度法原理,利用全自动、半自动生化分析仪或分光光度计,在医学实验室进行低密度脂蛋白胆固醇定量检验所使用的临床化学体外诊断试剂。
本规范不适用于干式低密度脂蛋白胆固醇测定试剂(盒),但适用处可参照执行。
依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号,以下简称《办法》)、《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管[2013]242号)低密度脂蛋白胆固醇测定试剂盒管理类别为Ⅱ类,分类代号为6840。
二、注册申报资料要求(一)综述资料综述资料主要包括产品预期用途、临床意义、产品描述、有关生物安全性方面说明、研究结果的总结评价以及同类产品上市情况介绍等内容,应符合《体外诊断试剂注册管理办法》和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局〔2014〕第44号公告)相关要求。
低密度脂蛋白胆固醇测定试剂盒产品技术审评规范版完整版

低密度脂蛋白胆固醇测定试剂盒产品技术审评规范版HEN system office room 【HEN16H-HENS2AHENS8Q8-HENH1688】附件4低密度脂蛋白胆固醇测定试剂(盒)产品技术审评规范(2017版)本规范旨在指导注册申请人对低密度脂蛋白胆固醇测定试剂(盒)注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本审评规范是对低密度脂蛋白胆固醇测定试剂(盒)的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据产品特性确定其中的具体内容是否适用。
本规范是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本规范。
本规范是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本规范相关内容也将进行适时调整。
一、适用范围低密度脂蛋白胆固醇测定试剂(盒)用于体外定量测定人血清和/或血浆中的低密度脂蛋白胆固醇的含量。
从方法学考虑,本规范主要指基于分光光度法原理,利用全自动、半自动生化分析仪或分光光度计,在医学实验室进行低密度脂蛋白胆固醇定量检验所使用的临床化学体外诊断试剂。
本规范不适用于干式低密度脂蛋白胆固醇测定试剂(盒),但适用处可参照执行。
依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号,以下简称《办法》)、《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管[2013]242号)低密度脂蛋白胆固醇测定试剂盒管理类别为Ⅱ类,分类代号为6840。
二、注册申报资料要求(一)综述资料综述资料主要包括产品预期用途、临床意义、产品描述、有关生物安全性方面说明、研究结果的总结评价以及同类产品上市情况介绍等内容,应符合《体外诊断试剂注册管理办法》和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局〔2014〕第44号公告)相关要求。
低密度脂蛋白胆固醇测定试剂盒(终点法)产品技术要求beijian

低密度脂蛋白胆固醇测定试剂盒(终点法)
适用范围:本产品用于体外定量测定人血清中低密度脂蛋白胆固醇的含量。
1.1规格
具体产品规格见下表:
1.2组成成分
磷钨酸 10mmol/L
2.1 外观
2.1.1 外包装完整无破损;
2.1.2 试剂:无色澄清透明无杂质液体。
2.2 净含量
净含量不低于标示值。
2.3 试剂空白吸光度
在波长600~630nm、37℃条件下,试剂空白吸光度小于0.6。
2.4 线性
2.4.1 线性范围
[1.30,5.20]mmol/L,相关系数r>0.990。
2.4.2 线性偏差
(2.00,5.20]mmol/L线性范围内,相对偏差不超过±10%;
[1.30,2.00]mmol/L线性范围内,绝对偏差不超过±0.50mmol/L。
2.5 分析灵敏度
检测浓度为3.11mmol/L的样本时,吸光度变化不小于0.08。
2.6 重复性
测试高、低浓度的新鲜人血清或质控品,重复测试10次,低值:CV≤10%;高值:CV≤5%。
2.7 批间差
用三个不同批号的试剂测试同一样本,重复测试3次,相对极差R≤10%。
2.8 准确度
相关系数r>0.990;相对偏差不超过±10%。
2.9 稳定性
原包装试剂2~8℃避光储存,有效期12个月。
效期后1个月内产品应符合2.3、2.4和2.8的要求。
低密度脂蛋白胆固醇(LDL—C)测定试剂盒(直接法) 产品技术要求性能指标yp

医疗器械产品技术要求编号:
低密度脂蛋白胆固醇(LDL-C)测定试剂盒(直接法)
1.性能指标
1.1外观
1.1.1试剂盒各组分应齐全,内外包装均应完整,液体组分应无渗漏,包装标签文字符
号应清晰。
1.1.2R1应为淡黄色澄清均一液体;R2应为无色透明均一液体。
1.2装量
各组分的液体装量应不少于标示值。
1.3试剂空白吸光度
试剂以生理盐水为空白在37℃±1℃,600 nm波长条件下,试剂空白吸光度应小于0.050。
1.4分析灵敏度
测试浓度为1.00 mmol/L的样本,吸光度差值应大于0.030。
1.5线性区间
试剂线性在[0.05,18.00] mmol/L区间内:
a)线性相关系数(r)应不小于0.995;
b)[0.05,18.00] mmol/L区间内,线性偏差应不超过±0.30 mmol/L或不超过
±10.0%。
1.6精密度
1.6.1重复性
重复测试(2.50±0.50)mmol/L和(5.00±1.00)mmol/L的血清样本,所得结果的重复性(变异系数,CV)应不大于3.0%。
1.6.2批间差
测试(2.50±0.50)mmol/L和(5.00±1.00)mmol/L的血清样本,所得结果的批间差(相对极差,R)应不大于10.0%。
1.7准确度
相对偏差应在±10.0%范围内。
低密度脂蛋白胆固醇测定试剂盒(直接法--保护性试剂法)产品技术要求乐普

低密度脂蛋白胆固醇测定试剂盒(直接法--保护性试剂法)适用范围:用于体外定量测定人血清中低密度脂蛋白胆固醇的含量。
1.1 包装规格试剂1:1×60 mL,试剂2:1×20 mL;试剂1:4×60 mL,试剂2:4×20 mL;试剂1:2×45 mL,试剂2:2×15 mL;试剂1:3×30 mL,试剂2:2×15 mL;试剂1:1×4.5 L,试剂2:1×1.5 L;试剂1:2×4.5 L,试剂2:1×3 L;校准品:1×1 mL(冻干)(选配)。
1.2组成成分试剂1主要组分:试剂2主要组分:校准品主要组分:2.1 外观试剂1:无色或浅黄色澄清液体;试剂2:无色或浅色澄清液体。
校准品:白色至浅黄色冻干粉,复溶后为无色至浅黄色透明液体。
外包装完好、无破损,标签完好、字迹清晰。
2.2装量液体试剂的装量应不少于标示值。
2.3 试剂空白吸光度用空白样本加入试剂测试时,试剂空白吸光度应<0.05。
2.4 分析灵敏度测定1.00mmol/L样本时,吸光度差值(△A)应>0.03。
2.5 准确度测试国家标准物质GBW09179b,结果与参考物质标示值偏差应不超过±10%。
2.6 线性在[0.30,10.00]mmol/L区间内,线性相关系数r应不小于0.995;在[0.30,3.00] mmol/L区间内,绝对偏差应不超过±0.30mmol/L;在(3.00,10.00] mmol/L区间内,相对偏差不超过±10%。
2.7精密度2.7.1重复性重复测试(2.50±0.50)mmol/L和(5.00±1.00)mmol/L的样本,所得结果的变异系数(CV)应不大于3%。
2.7.2 批间差测试(2.50±0.50)mmol/L的样本,所得结果的相对极差(R)应不大于10%。
LDL-C文档,低密度脂蛋白胆固醇测定试剂盒(LDL-C)检测标准操作规程

1、方法依据:深圳迈瑞生物医疗电子股份有限公司低密度脂蛋白胆固醇(LDL-C)测定试剂盒(直接法)检测方法 2、适用范围:适用于人血清或血浆低密度脂蛋白胆固醇(LDL-C)的测定。
3、试剂仪器:3.1 试剂:深圳迈瑞生物医疗电子股份有限公司原装试剂盒。
3.2 试剂储存:2℃~8℃保存有效期为一年。
试剂开瓶后应避光保存,在2℃~8℃可稳定28天。
试剂不可冰冻。
3.3 仪器:迈瑞BS-2000M 全自动生化分析仪. 4、操作程序4.1方法原理本试剂盒为均相方法,省去离心步骤直接检测LDL-C 。
在反应第一步,LDL 被选择性保护,而非LDL 脂蛋白被酶处理。
第二步中,LDL 被释放,由胆固醇酶法显色反应选择性地测定出LDL-C 。
(1) HDL,VLDL,和乳糜微粒胆甾烯酮+ H 2O 22H 2O 2 2H 2O + O 2 (2) LDL 胆甾烯酮 + H 2O 2H 2O 2 + TOOS + 4-氨基安替比林 醌亚胺染料4.2样本要求新鲜血清或血浆,采集后及时测定,应避免溶血和污染。
血清在2℃~8℃可保存5天。
CHE+CHOPOD过氧化氢酶 CHE+CHO4.3上机操作4.3.1试剂装载、校准、样品和质控血清分析操作详见“《迈瑞BS-2000M全自动生化分析仪标准操作、维护、保养规程》”。
4.3.2 校准:4.3.2.1 标准液的准备:校准品使用迈瑞医疗国际股份有限公司配套冻干品,按说明书要求稀释后分装,-20℃冷冻保存,用前提前15分钟从冰箱中取出,复溶到室温后上机检测。
4.3.2.2 校准程序:首次使用校准。
当有以下情况时需重新校准:1)换试剂批号或出现质控漂移时;2)当仪器做完保养后;3)仪器进行零件更换时。
每次试验前用准备好的校准品进行校准,校准通过后进行检测。
4.3.2.3 质控:在标本开始之前做质控,质控通过后方能进行标本的检测。
4.3.3 测试基本参数4.4参考范围0~4.11 mmol/L (注:各实验室应有自己的参考范围。
小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)产品技术要求jiuqiang
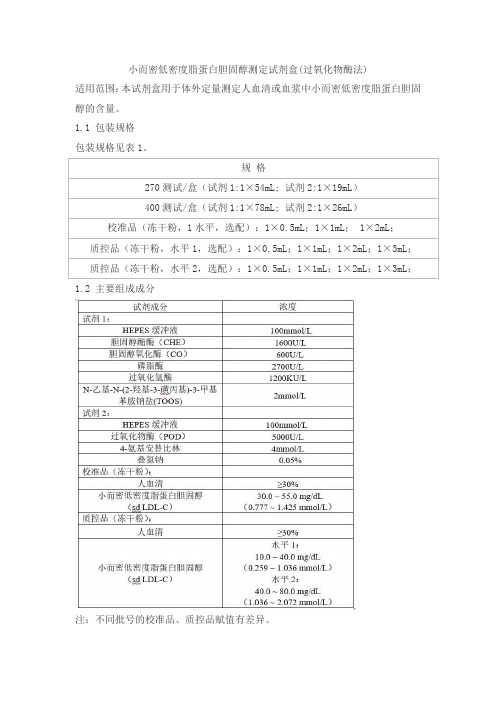
小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)适用范围:本试剂盒用于体外定量测定人血清或血浆中小而密低密度脂蛋白胆固醇的含量。
1.1 包装规格包装规格见表1。
1.2 主要组成成分注:不同批号的校准品、质控品赋值有差异。
2.1 外观试剂1为无色到淡褐色液体,目测不得有任何沉淀及絮状悬浮物;试剂2为淡黄色到黄色液体,目测不得有任何沉淀及絮状悬浮物;校准品为白色或淡黄色粉末状物质,复溶后为无色或淡黄色液体,目测不得有任何沉淀及絮状悬浮物;质控品为白色或淡黄色粉末状物质,复溶后为无色或淡黄色液体,目测不得有任何沉淀及絮状悬浮物。
试剂盒标签标识清晰,外包装完整无损。
2.2 净含量液体试剂的净含量应不少于标称量。
2.3 试剂空白吸光度A600nm下测定空白吸光度应≤ 0.05。
2.4 准确度与已上市产品进行比对试验:在 [4.0,100.0] mg/dL([0.104,2.59] mmol/L)区间内,相关系数r≥0.975,在 [4.0,30.0] mg/dL([0.104,0.777] mmol/L)区间内测定的绝对偏差应不超过±3 mg/dL (±0.0777 mmol/L),在(30,100.0] mg/dL ((0.777,2.59] mmol/L)区间内测定的相对偏差应不超过±10%。
2.5 分析灵敏度样本浓度为100.0 mg/dL(2.59 mmol/L)时,其吸光度变化在0.0500~0.2500之间。
2.6 线性区间在[4.0,100.0] mg/dL([0.104,2.59] mmol/L)区间内,线性相关系数r≥0.990, 在[4.0,30.0] mg/dL([0.104,0.777] mmol/L)区间内测定的绝对偏差应不超过±3 mg/dL(±0.0777 mmol/L),在(30,100.0] mg/dL((0.777,2.59] mmol/L)区间内测定的相对偏差应不超过±10%。
sdLDL-C小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)产品技术要求

医疗器械产品技术要求编号:小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)1.产品型号/规格及其划分说明R1:2×15ml 、R2:2×5mL ;校准品(选配):1×2ml ;质控品(选配):2×1ml (2个水平,每个水平1mL )。
2.性能指标2.1外观2.1.1试剂盒各组分应齐全、完整、液体无渗漏;中文包装标签应清晰、准确、牢固。
2.1.2 R1为无色液体,R2为无色或淡黄色液体。
2.2净含量液体试剂净含量应不少于标示值。
2.3试剂空白吸光度试剂空白吸光度A cm nm1600应<0.5。
2.4分析灵敏度测试(1.02±0.2)mmol/L 的样品,吸光度差值( A )应≥0.01。
2.5线性范围在[0.1~2.6]mmol/L 内线性相关系数r≥ 0.990。
在[0.1,0.5]mmol/L 范围内,绝对偏差≤0.5mmol/L ;在(0.5,2.6]mmol/L 范围内,相对偏差应不超过±15%。
2.6精密度2.6.1 重复性变异系数,CV 应≤10%。
2.6.2批间差相对极差,R ≤15%。
2.7准确度相对偏差应不超过±15%。
2.8 校准品、质控品2.8.1校准品、质控品外观白色或微黄色冻干品。
2.8.2校准品、质控品的准确度相对偏差在±15.0%范围内。
2.8.3校准品、质控品的均一性变异系数CV≤10.0%。
2.8.4校准品、质控品的批内瓶间差批内瓶间差CV≤15.0%。
3 检验方法检测条件:a)生化分析仪波长600nm;温度37℃±0.1℃。
b)恒温装置、准确加样器、生化分析仪。
测试方法按说明书规定,因不同机型使用试剂最终浓度相同。
在此推荐以本公司的BECKMAN或HITACHI全自动生化分析仪进行测试。
3.1 外观目测检查,应符合2.1的要求。
3.2 净含量用通用量具测量,应符合2.2的要求。
低密度脂蛋白胆固醇(LDL—C)测定试剂盒(直接法)产品技术要求mairui

2性能指标
2.1外观
试剂应为清澈透明的液体,无沉淀、悬浮物和絮状物。
2.2净含量
液体试剂的净含量应不少于标示值。
2.3试剂空白吸光度
试剂以水为空白在37 ℃ 1 ℃,600nm 波长条件下,吸光度应小于0.08 A。
2.4分析灵敏度
当样本浓度为 4 mmol/L 时,吸光度变化应不小于0.19 A。
2.5线性范围
试剂盒在(0.05~20)mmol/L 范围内:
a)线性相关系数r 应不小于0.9900;
b)当样本浓度不大于3 mmol/L 时,线性绝对偏差应不大于±0.3 mmol/L;当样本浓度大于3 mmol/L 时,线性相对偏差应不大于±10.0%。
2.6测量精密度
2.6.1重复性
变异系数:CV 应不大于 2.5%。
2.6.2批间差
相对偏差:R 应不大于 4.0%。
2.7准确度
测定校准品,测定结果与靶值的相对偏差应不大于±10.0%。
2.8分析特异性
血红蛋白浓度在300 mg/dL 内、抗坏血酸浓度在30 mg/dL 内、内源性酯浓度在300 mg/dL 内,对试剂检测结果的偏差影响应在±10%以内。
1。
低密度脂蛋白胆固醇(LDL-C)测定试剂盒(直接法-保护性试剂法)产品技术要求kemei

低密度脂蛋白胆固醇(LDL-C)测定试剂盒(直接法-保护性试剂法)适用范围:本试剂盒用于体外定量测定人血清中低密度脂蛋白胆固醇(LDL-C)的浓度。
1.1包装规格1.2主要组成成分2.1外观2.1.1试剂1应为无色或淡黄色透明溶液,无混浊,无未溶解物;2.1.2试剂2应为无色或淡黄色透明溶液,无混浊,无未溶解物;2.1.3校准品应为无色至淡黄色固体;2.1.4质控品应为无色至淡黄色固体。
2.2净含量液体试剂的净含量应不少于标示值。
2.3试剂空白LDL-C试剂盒在波长(600±20)nm处测定空白样品的吸光度值,应不大于0.0500。
2.4分析灵敏度LDL-C试剂盒测试1.00mmol/LLDL-C时,吸光度差值(ΔA)应大于0.0300。
2.5准确度测定国际参考物质SRM1951,测定结果的相对偏差不大于10%。
2.6精密度2.6.1重复性重复测试(2.50±0.50)mmol/L和(5.00±1.00)mmol/L的样品,所得结果的变异系数CV应不大于3%;2.6.2批间差测试(2.50±0.50)mmol/L的样本,所得结果的批间相对极差应不大于10%;2.7线性范围LDL-C试剂盒在[0.30,10.00] mmol/L范围内,线性相关系数(r)应不小于0.995;在[0.30,3.00] mmol/L区间内,线性绝对偏差应不超过±0.30mmol/L;在(3.00,10.00] mmol/L区间内,线性相对偏差应不超过±10%。
2.8质控品赋值有效性重复测定质控品,测定结果应在质控范围内。
2.9稳定性原包装的试剂盒在2℃~8℃密封避光贮存,有效期为12个月。
原包装校准品与质控品在2℃~8℃密封避光贮存,有效期为18个月。
在有效期满后2个月内,试剂性能应符合2.1、2.3、2.4、2.5、2.6.1、2.7、2.8的要求。
2.10校准品/质控品批内瓶间差批内瓶间差的变异系数(CV)应≤3%。
低密度脂蛋白胆固醇测定试剂盒(直接法-表面活性剂清除法)产品技术要求jiuqiang
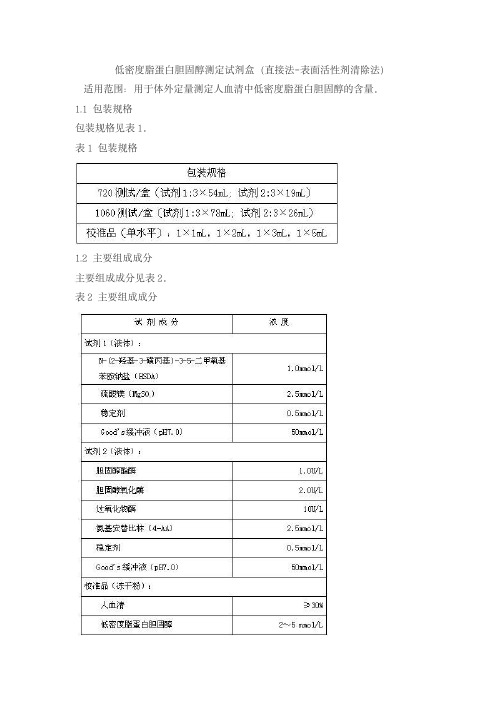
低密度脂蛋白胆固醇测定试剂盒(直接法-表面活性剂清除法)适用范围:用于体外定量测定人血清中低密度脂蛋白胆固醇的含量。
1.1包装规格包装规格见表1。
表1包装规格1.2主要组成成分主要组成成分见表2。
表2主要组成成分注:不同批号的校准品赋值有差异。
2.1外观试剂1为无色至淡黄色透明液体,目测不得有任何沉淀及絮状悬浮物;试剂2为无色至淡黄色透明液体,目测不得有任何沉淀及絮状悬浮物;校准品为淡黄色或黄色粉末状物质,复溶后为淡黄色或黄色液体,目测不得有任何沉淀及絮状悬浮物;试剂盒标签标识清晰,外包装完整无损。
2.2净含量应不少于标示量。
2.3试剂空白吸光度试剂空白:A604nm下测定空白吸光度应≤0.0500。
2.4准确度使用国际参考物质SRM1951,对试剂盒进行测试,其测量结果的相对偏差应不超过±10%。
2.5分析灵敏度测定1.0mmoL/L样本时,吸光度差值(ΔA)应>0.03。
2.6线性区间试剂盒线性在[0.3,12]mmoL/L区间内:线性相关系数(r)应不小于0.995;在[0.3,3.0]mmol/L区间内,测定的线性绝对偏差应不超过±0.3mmoL/L,在(3.0,12]mmoL/L区间内测定的线性相对偏差应不超过±10%。
2.7精密度2.7.1重复性重复测试(2.50±0.50)mmol/L和(5.00±1.00)mmol/L的样本,所得结果的变异系数(CV)应不大于3%。
2.7.2批间差测试(2.50±0.50)mmol/L的样本,所得结果的批间相对极差(R)应不大于10%。
2.8校准品批内瓶间差校准品的瓶间差应不大于10%。
2.9稳定性2.9.1试剂稳定性试剂盒在2℃~8℃密封避光保存,有效期为18个月。
取到效期后的样品检测外观、试剂空白吸光度、分析灵敏度、线性、重复性、准确度应符合2.1、2.3、2.4、2.5、2.6、2.7.1的要求。
小而密低密度脂蛋白胆固醇(sdLDL-C )测定试剂盒 (过氧化物酶法)产品技术要求参考

医疗器械产品技术要求编号:小而密低密度脂蛋白胆固醇(sdLDL-C)测定试剂盒(过氧化物酶法)1.产品型号/规格及其划分说明1.1包装规格试剂1(R1):2×60mL、试剂2(R2):2×20mL;试剂1(R1):1×48mL、试剂2(R2):1×16mL;试剂1(R1):2×48mL、试剂2(R2):2×16mL;试剂1(R1):1×60mL、试剂2(R2):1×20mL;试剂1(R1):2×30mL、试剂2(R2):2×10mL;试剂1(R1):1×30mL、试剂2(R2):1×10mL;试剂1(R1):1×24mL、试剂2(R2):1×8mL;试剂1(R1):1×18mL、试剂2(R2):1×6mL;试剂1(R1):1×15mL、试剂2(R2):1×5mL;试剂1(R1):1×12mL、试剂2(R2):1×4mL;256测试/盒(试剂1(R1):1×39mL、试剂2(R2):1×13mL)。
校准品(选配):1×1mL。
质控品(选配):2×1mL。
1.2主要组成成分产品主要组成成分见表1。
表1主要组成成分1.3适用范围本产品用于体外定量测定人血清或血浆中小而密低密度脂蛋白胆固醇(sdLDL-C)的含量。
2性能要求2.1外观试剂盒各组分应齐全、完整,液体无渗漏。
包装标签文字符号应清晰。
液体双试剂:R1:无色至褐色澄清液体;R2:无色至淡黄色澄清液体。
校准品:冻干品,复溶后为无色至淡黄色澄清液体。
质控品:冻干品,复溶后为无色至淡黄色澄清液体。
2.2装量液体试剂的净含量不得低于标示体积。
2.3空白吸光度在37℃、(600nm±10%范围内的)波长、1cm光径条件下,用纯化水(或生理盐水)作为样品加入试剂测试时,空白吸光度应≤0.05。
低密度脂蛋白胆固醇测定试剂盒(直接法-表面活性剂清除法)标准化操作规程LDLC-SOP

低密度脂蛋白胆固醇测定试剂盒(直接法-表面活性剂清除法)标准化操作规程1 目的规范实验室操作,保证检验工作顺利有效进行特制定此规程。
2 授权操作人经培训且考核通过的临床检验人员。
3 适用范围本试剂用于体外定量检测血清中低密度脂蛋白胆固醇的浓度。
4 检验方法本试剂采用直接测试法测定低密度脂蛋白胆固醇的浓度。
5 检验原理样本中的低密度脂蛋白胆固醇在试剂中表面活性剂的作用下被胆固醇脂酶选择性地催化水解为胆固醇和游离脂肪酸,生成的胆固醇经胆固醇氧化酶氧化生成胆甾-4-烯-3-酮和过氧化氢,过氧化氢在过氧化物酶的催化下与苯胺类色原物质和4-氨基安替比林作用产生水和醌亚胺色素,醌亚胺色素的生成量与样本中低密度脂蛋白胆固醇的含量成正比,通过测定特定波长处反应最终生成的色素量,可以计算出样本中低密度脂蛋白胆固醇的浓度。
低密度脂蛋白胆固醇脂+ H2O −−−−→−酶酯胆固胆固醇+游离脂肪酸胆固醇 + O2−−−−−−→−胆固醇氧化酶胆甾-4-烯-3-酮+ H2O2H 2O2+ 4-氨基安替比林 + 苯胺类色原物质−−−−−→−过氧化物酶醌亚胺色素 + 水6 标本要求6.1 样本为血清,不得使用溶血、脂血或被污染的样本。
6.2 样本在2℃~8℃可稳定7天,-20℃可稳定1个月。
避免样本反复冻融。
7 试剂及配套品7.1试剂来源长春迪瑞医疗科技股份有限公司低密度脂蛋白胆固醇试剂盒(直接测试法)7.27.3试剂的稳定性与贮存:7.3.1试剂在2℃~8℃条件下,干燥、避光、密封贮存,有效期为12个月。
7.3.2试剂开封后在2℃~8℃条件下可稳定30天。
7.3.3 请勿于0℃以下保存试剂。
8 实验仪器及性能指标8.1 实验仪器迪瑞CS系列全自动生化分析仪8.2试剂性能指标8.2.1 试剂空白吸光度:A<0.05。
8.2.2 分析灵敏度:测试1.00mmol/L的样本时,吸光度变化△A>0.03。
8.2.3 线性范围:试剂线性在[0.20,11.60] 区间内;线性回归系数r≥0.9950;[0.20,2.00] mmol/L范围内,线性绝对偏差应不超过±0.30mmol/L;(2.00,11.60] mmol/L范围内,线性相对偏差不超过±10%。
低密度脂蛋白胆固醇测定试剂盒(直接法-表面活性剂清除法)产品技术要求beiken

低密度脂蛋白胆固醇测定试剂盒(直接法-表面活性剂清除法)适用范围:用于定量测定人血清中低密度脂蛋白胆固醇(LDL-C)的浓度。
1. 产品规格及其划分说明1.1包装规格试剂的包装规格见表1的规定表1包装规格1.2主要组成成分试剂盒由液体试剂试剂A 和试剂B 组成,试剂成分见表2。
表2 试剂盒组成2.1外观试剂为澄清透明溶液,无沉淀及絮状悬浮物,标签文字符号应清晰,外包装完整无破损,液体无渗漏。
2.2装量试剂的装量应不少于标示值。
2.3试剂空白吸光度在600nm的波长测试时,用蒸馏水作为样品加入试剂测试时,试剂空白吸光度应<0.05。
2.4 分析灵敏度测试1.00mmol/L样本时,吸光度差值应>0.03。
2.5 线性范围:试剂(盒)线性在[0.3,10.00] mmol/L区间a) 线性相关系数(r)应不小于0.995;b) 在[0.3,3.0] mmol/L区间内,绝对偏差不超过±0.30mmol/L;在(3.0,10.00] mmol/L区间内,相对偏差不超过±10%。
2.6精密度2.6.1重复性重复测试(2.50±0.50)mmol/L和(5.00±1.00)mmol/L的样本,所得结果的变异系数(CV)应不大于3%。
2.6.2批间差测试(2.50±0.50)mmol/L的样本,所得结果的批间相对极差(R)应不大于10%。
2.7准确度测试专用的标准物质(编号:GBW09178、 GBW09179、GBW09180a),所得准确度偏差不大于±10%。
2.8 稳定性:试剂盒贮存在2℃~8℃条件下,有效期为18个月。
有效期满后,分别测试2.3、2.4、2.5、2.6.1、2.7,结果符合各项要求。
低密度脂蛋白胆固醇测定试剂盒(直接法-表面活性剂清除法)产品技术要求海丰
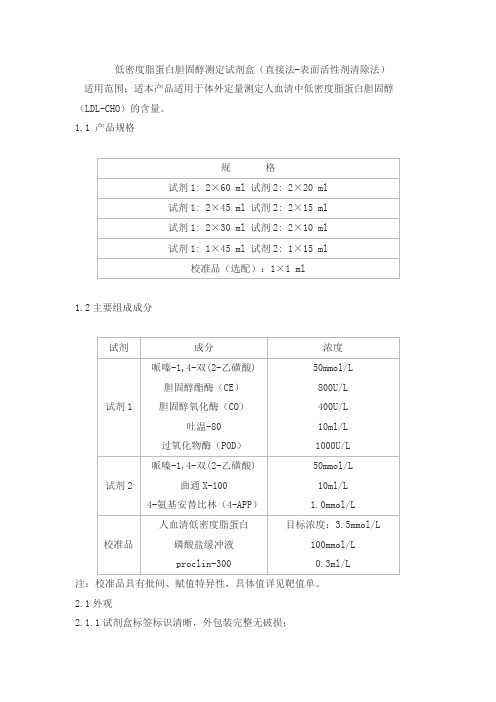
低密度脂蛋白胆固醇测定试剂盒(直接法-表面活性剂清除法)适用范围:适本产品适用于体外定量测定人血清中低密度脂蛋白胆固醇(LDL-CHO)的含量。
1.1 产品规格1.2主要组成成分注:校准品具有批间、赋值特异性,具体值详见靶值单。
2.1外观2.1.1试剂盒标签标识清晰,外包装完整无破损;2.1.2试剂1为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;2.1.3试剂2为无色或淡黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;2.1.4校准品:无色或浅黄色干粉,复溶后不得有任何沉淀及絮状悬浮物。
2.2净含量净含量不低于标示值。
2.3空白吸光度在主波长600nm、副波长700nm、37℃条件下,试剂空白吸光度应不大于0.05。
2.4线性范围[0.3,11.0]mmol/L范围内,相关系数r≥0.995;[0.30,3.00]mmol/L范围内,绝对偏差不超过±0.3mmol/L;(3.00,11.00]mmol/L范围内,相对偏差不超过±10%。
2.5分析灵敏度在产品说明书规定参数设定条件下,浓度为1.0mmol/L时,吸光度变化△A应不小于0.03。
2.6 精密度2.6.1批内重复性CV≤3.0%。
2.6.2批间差相对极差R≤10.0%。
2.7 准确度与已上市产品比对:相关系数(r)应不低于0.990;[0.30,3.00]mmol/L 范围内,绝对偏差不超过±0.3mmol/L;(3.00,11.00]mmol/L范围内,相对偏差不超过±10%。
2.8 校准品2.8.1均一性CV≤5%。
2.8.2瓶间差CV≤5%。
2.9稳定性未开封试剂2℃~8℃储存,可稳定12个月。
取到效期后2个月内产品进行检测,检测结果应满足2.3、2.4、2.5、2.6.1、2.7的要求。
2.10 溯源性依据GB/T 21415—2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源至(GBW09178)。
低密度脂蛋白胆固醇测定试剂盒产品技术审评规范版

低密度脂蛋白胆固醇测定试剂盒产品技术审评规范版The document was prepared on January 2, 2021附件4低密度脂蛋白胆固醇测定试剂(盒)产品技术审评规范(2017版)本规范旨在指导注册申请人对低密度脂蛋白胆固醇测定试剂(盒)注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本审评规范是对低密度脂蛋白胆固醇测定试剂(盒)的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据产品特性确定其中的具体内容是否适用。
本规范是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本规范。
本规范是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本规范相关内容也将进行适时调整。
一、适用范围低密度脂蛋白胆固醇测定试剂(盒)用于体外定量测定人血清和/或血浆中的低密度脂蛋白胆固醇的含量。
从方法学考虑,本规范主要指基于分光光度法原理,利用全自动、半自动生化分析仪或分光光度计,在医学实验室进行低密度脂蛋白胆固醇定量检验所使用的临床化学体外诊断试剂。
本规范不适用于干式低密度脂蛋白胆固醇测定试剂(盒),但适用处可参照执行。
依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号,以下简称《办法》)、《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管[2013]242号)低密度脂蛋白胆固醇测定试剂盒管理类别为Ⅱ类,分类代号为6840。
二、注册申报资料要求(一)综述资料综述资料主要包括产品预期用途、临床意义、产品描述、有关生物安全性方面说明、研究结果的总结评价以及同类产品上市情况介绍等内容,应符合《体外诊断试剂注册管理办法》和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局〔2014〕第44号公告)相关要求。
低密度脂蛋白胆固醇(LDL—C)测定试剂盒(直接法—表面活性剂清除法)产品技术要求derui
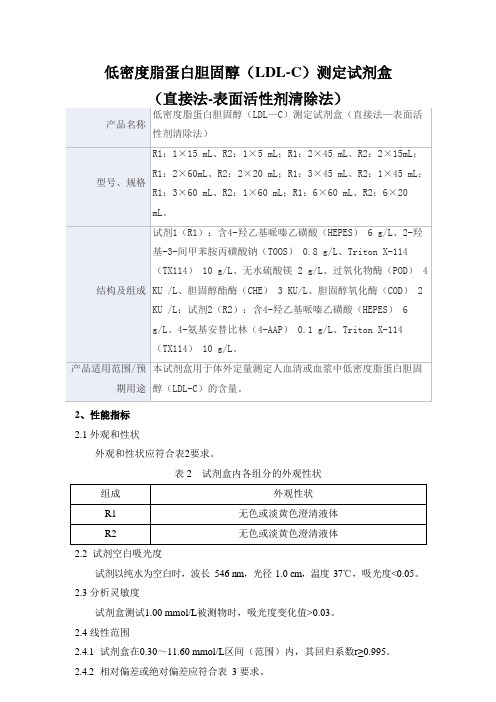
低密度脂蛋白胆固醇(LDL-C)测定试剂盒
2、性能指标
2.1外观和性状
外观和性状应符合表2要求。
表2 试剂盒内各组分的外观性状
2.2试剂空白吸光度
试剂以纯水为空白时,波长546 nm,光径1.0 cm,温度37℃,吸光度<0.05。
2.3分析灵敏度
试剂盒测试1.00 mmol/L被测物时,吸光度变化值>0.03。
2.4线性范围
2.4.1试剂盒在0.30~11.60 mmol/L区间(范围)内,其回归系数r≥0.995。
2.4.2相对偏差或绝对偏差应符合表3 要求。
表3 相对偏差或绝对偏差
2.5精密度
2.5.1试剂盒重复性CV 值应≤3%。
2.5.2试剂盒批间相对极差(R)应≤10%。
2.6准确度
相对偏差(Bias%)应在参考物质靶值±10%以内。
2.7液体装量
试剂盒不同规格的净含量应不少于其标示量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
低密度脂蛋白胆固醇测定试剂(盒)技术审评规范(2014版)一、前言本审评规范旨在指导注册申请人对低密度脂蛋白胆固醇测定试剂(盒)注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本审评规范是对低密度脂蛋白胆固醇测定试剂(盒)的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本审评规范是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料,相关人员应在遵循相关法规的前提下使用本审评规范。
本审评规范是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本审评规范相关内容也将适时进行调整。
二、适用范围低密度脂蛋白胆固醇测定试剂(盒)用于体外定量测定人血清和/或血浆中的低密度脂蛋白胆固醇的含量。
从方法学考虑,本文主要指采用分光光度法原理,利用全自动、半自动生化分析仪或分光光度计,在医学实验室进行低密度脂蛋白胆固醇定量检验所使用的临床化学体外诊断试剂。
本规范不适用于干式低密度脂蛋白胆固醇测定试剂(盒)。
依据《体外诊断试剂注册管理办法(试行)》(以下简称《办法》)低密度脂蛋白胆固醇测定试剂盒管理类别为Ⅱ类,分类代号为6840。
三、基本要求(一)综述资料综述资料主要包括产品预期用途、临床意义、产品描述、有关生物安全性的说明、研究结果的总结评价以及同类产品上市情况介绍等内容,应符合《办法》和《体外诊断试剂注册申报资料基本要求》(国食药监械〔2007〕609号)的相关要求。
下面着重介绍与低密度脂蛋白胆固醇测定试剂(盒)预期用途有关的临床背景情况。
低密度脂蛋白(LDL)是富含胆固醇(CHO)的脂蛋白,是动脉粥样硬化的危险性因素之一,LDL经过化学修饰后,其中的apoB-100变性,通过清道夫受体(scavenger receptor)被吞噬细胞摄取,形成泡沫细胞并停留在血管壁内,导致大量CHO沉积,促使动脉壁形成动脉粥样硬化斑块(atheromatous plaque),故LDL为致埃及粥样硬化的因子。
临床上以LDL-C的含量来反映LDL水平。
LDL-C水平增高:⒈判断发生冠心病的危险性:LDL是动脉粥样硬化的危险因子,LDL-C水平增高与冠心病发病呈正相关,因此,LDL-C可用于判断发生冠心病的危险性。
⒉其他:遗传性高脂蛋白血症、甲状腺功能减退症、肾病综合征、阻塞性黄疸、肥胖症以及应用雄激素、β-受体阴滞剂、糖皮质激素等LDL-C也增高。
LDL-C水平减低:LDL-C减低常见于无β-脂蛋白血症、甲状腺功能亢进症、吸收不良、肝硬化,以及低脂包含和运动等。
LDL-C检测的适应症:临床上主要用于高胆固醇血症、冠心病和动脉粥样硬化的辅助诊断。
注:若注册申报产品声称临床意义超出此内容范围,应提供相关文献或临床研究依据。
(二)产品说明书说明书承载了产品预期用途、试验方法、检测结果解释以及注意事项等重要信息,是指导实验室工作人员正确操作、临床医生针对检验结果给出合理医学解释的重要依据。
因此,产品说明书是体外诊断试剂注册申报最重要的文件之一。
产品说明书的格式应符合《体外诊断试剂说明书编写审评规范》的要求,结合《体外诊断试剂说明书编写指导原则》的要求,下面对低密度脂蛋白胆固醇测定试剂(盒)说明书的重点内容进行详细说明,以指导注册申报人员更合理地完成说明书编制。
1.【产品名称】(1)试剂(盒)名称由三部分组成:被测物名称、用途、方法或原理。
例如:低密度脂蛋白胆固醇测定试剂(盒)(直接法-选择抑制法)。
(2)英文名称(如有)应当正确、完整、直译,不宜只写缩写。
⒉【包装规格】(1)不得多于标准中所列的包装规格;(2)注明装量或可测试的样本数,如××测试/盒、××mL。
⒊【预期用途】应至少包括以下几部分内容:(1)说明试剂盒用于体外定量测定人血清和/或血浆中低密度脂蛋白胆固醇的含量。
(2)与预期用途相关的临床适应症背景情况,如临床适应症的发生率、易感人群等,相关的临床或实验室诊断方法等。
⒋【检验原理】本规范适用于对人血清和/或血浆中的低密度脂蛋白胆固醇进行定量检测的试剂(盒),以下介绍几种典型反应原理:(1)聚乙烯硫酸沉淀法:样本中的聚乙烯硫酸盐-聚乙二醇甲醚(PVS)选择性的沉淀LDL,离心后上层液中含高密度脂蛋白(HDL)、极低密度脂蛋白(VLDL)和乳糜微粒(CM),用胆固醇酶法测定试剂分别测定上层液和血清总胆固醇含量,二者之差即为LDL-C含量。
(2)直接法-表面活性剂清除法:反应分两步进行:第一步:R1中聚阴离子与LDL形成复合物,在表面活性剂1作用下,不与胆固醇酶试剂反应。
而其它脂蛋白(CM,VLDL-C,HDL-C)则被酶试剂水解产生过氧化氢,在缺乏偶联剂时被消耗而不显色。
第二步:R2中表面活性剂2使LDL释放胆固醇,在胆固醇酶试剂与偶联剂作用下参与Trinder反应而显色,吸光度与标本中低密度脂蛋白胆固醇浓度成正比。
(3)直接法-保护性试剂法:在反应第一步,LDL在两性表面活性剂(保护剂)作用下被选择性保护,而非LDL脂蛋白(CM,VLDL-C,HDL-C)被胆固醇酶法试剂处理。
第二步中,LDL 中胆固醇被释放,在酶试剂与偶联剂作用下参与Trinder反应而显色,吸光度与标本中低密度脂蛋白胆固醇浓度成正比。
⒌【主要组成成份】(1)说明试剂盒包含组分的名称、数量、比例或浓度等信息,如果对于正确的操作很重要,应提供其生物学来源、活性及其他特性;明确说明不同批号试剂盒中各组分是否可以互换。
(2)试剂盒内如包含校准品和/或质控品,应说明其主要组成成分及其生物学来源,校准品应注明其定值及溯源性,溯源性至少应写明溯源到的最高级别,包括:标准物质的发布单位及编号,质控品应有合适的靶值范围。
⒍【储存条件及有效期】(1)对试剂盒的效期稳定性、复溶稳定性、开瓶稳定性等信息做详细介绍。
包括环境温湿度、避光条件等。
(2)不同组分保存条件及有效期不同时,应分别说明,产品总有效期以其中效期最短的为准。
注:保存条件不应有模糊表述,如“室温”。
稳定期限应以月或日为单位。
⒎【适用仪器】(1)说明可适用的仪器,并提供与仪器有关的必要信息以便用户能够作出最好的选择。
(2)应写明具体适用仪器的型号,不能泛指某一系列仪器。
⒏【样本要求】重点明确以下内容:(1)样本采集前对患者的要求:如采集时间、采集顺序等,是否受临床症状、用药情况等因素的影响。
(2)样本采集:说明采集方法及样本类型,如有血浆样本,应注明对抗凝剂的要求。
(3)样本处理及保存:样本处理方法、保存条件及期限、运输条件等。
冷藏/冷冻样本检测前是否须恢复室温,冻融次数。
对储存样本的添加剂要求等。
(4)应明确当测定值超出线性上限时的稀释方法,并给出稀释最大倍数说明。
⒐【检验方法】详细说明试验操作的各个步骤,包括:(1)试验具体操作步骤。
(2)试剂配制方法、注意事项。
(3)试验条件:温度、时间、仪器波长等以及试验过程中的注意事项。
(4)校准:校准品的使用方法、注意事项、校准曲线的绘制。
应注明推荐的仪器校准周期。
(5)质量控制:质控品的使用方法、对质控结果的必要解释以及推荐的质控周期等,如质控不合格应提供相关的解决方案。
⒑【参考值(参考范围)】(1)应注明常用样本类型的正常参考值(范围),如:<3.12mmol/L(<120mg/dL)。
并简要说明参考值确定的方法。
(2)简单介绍设定该参考值(范围)所选健康人群的区域特征,建议注明以下字样“由于地理、人种、性别及年龄等差异,建议各实验室建立自己的参考值(范围)”。
⒒【检验结果的解释】说明可能对试验结果产生影响的因素;说明在何种情况下需要进行确认试验。
⒓【检验方法局限性】(1)说明检测结果仅供临床参考,不能单独作为确诊或排除病例的依据。
(2)说明该检验方法由于哪些原因会使测量结果产生偏离,或测量结果还不能完全满足临床需要。
如:干扰(胆红素、血红蛋白、甘油三酯等)等。
⒔【产品主要性能指标】产品性能指标应符合企业标准要求。
说明该产品主要性能指标,应至少包括:外观、装量、试剂空白吸光度、试剂空白吸光度变化率、分析灵敏度、线性范围、重复性、批间差等。
⒕【注意事项】应至少包括以下内容:(1)本试剂盒的检测结果仅供临床参考,对患者的临床诊治应结合其症状/体征、病史、其他实验室检查及治疗反应等情况综合考虑。
(2)使用不同生产商的试剂对同一份样本进行检测可能会存在差异。
(3)对所有样本和反应废弃物都应视为传染源对待,提示操作者采取必要的防护措施。
⒖【参考文献】注明引用参考文献,其书写应清楚、易查询且格式规范统一。
⒗【生产企业】包括企业名称、地址(注册地址和生产地址不同的应分别列出)、邮政编码、电话和传真号码、网址等。
⒘【其他】如医疗器械生产企业许可证编号、医疗器械注册证书编号、产品标准编号、说明书批准日期及修订日期等。
(三)拟定产品标准及编制说明拟定产品标准应符合《体外诊断试剂注册管理办法》和《体外诊断试剂注册申报资料基本要求》的相关规定。
如已有相应的国家/行业标准发布,则企业标准的要求不得低于其相关要求。
下面就标准中涉及的产品适用的相关标准、主要性能指标、标识标签说明书以及检验规则等相关内容做一简要叙述。
⒈产品适用的相关标准⑴GB/T 191-2008 包装储运图示标志⑵GB/T 21415—2008 体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性⑶GB/T 26124-2011 临床化学体外诊断试剂(盒)⑷YY/T 0316-2008 医疗器械风险管理对医疗器械的应用⑸YY/T 0466.1-2009医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求⒉主要性能指标:(1)外观a)试剂盒各组分应齐全、完整,液体无渗漏;b)包装标签文字符号应清晰。
(2)装量液体试剂的净含量应不少于标示量。
(3)试剂空白吸光度用指定空白样品测试试剂(盒),在说明书规定的测试条件下,记录反应结束(T)后的吸光度(A ),测试结果即为试剂空白吸光度测定值,应不大于0.05。
(4)分析灵敏度用试剂(盒)测试低密度脂蛋白胆固醇已知浓度在(2.00~4.00)mmol/L 的样本,记录在试剂(盒)规定参数下的吸光度差值。
换算为1.00mmol/L 的吸光度差值,吸光度差值(ΔA )应>0.03。
(5)线性用接近线性区间下限的低浓度样本稀释接近线性区间上限的高浓度样本,混合成6个稀释浓度(xi )。
