第三节金属晶体ycc3.27
人教版高二化学选修3课件:3.3 金属晶体(共28张PPT)

充分发挥学生搭建分子结构、晶体结构模型等活动的作用, 降低教学内容的抽象性,促进学生对相关内容的理解和认识。
选用学生熟悉的生活现象、实验事实,以及科学研究和
工业生产中的相关案例作为素材,激发学生的学习兴趣,帮 助学生建立结构与性质之间的联系,发展“宏观辨识与微观探 析”的化学学科核心素养。
第三节 金属晶体
海南侨中
第三章 【教学提示】 ——新课标44页
2.学习活动建议
(1)实验及探究活动:模拟利用X射线衍射研
究物质微观结构的方法;
(2)调查与交流讨论:交流讨论模型在探索物
质结构中的作用;收集20世纪科学家在物质结
构探索方面的有关资料:走访科研机构,了解
物质结构研究的现代技术和先进成果。
第三节 金属晶体
海南侨中
第三章 【教学提示】 ——新课标43页
1.教学策略 有效利用化学史的素材,帮助学生认识科学
理论会随着技术手段的进步和实验证据的丰富而 发展,通过设计角色扮演等活动引导学生理解科 学理论发展过程中的争论,从而增进对科学本质 的理解。
选取与现实生活与科学前沿密切相关的案例, 促使学生认识研究物质结构的价值。通过查阅文 献、听专家讲座、观看化学影视资料等多种途径 开展教学,开阔学生的视野,激发学生探索物质 结构奥秘的热情。
第三节 金属晶体
海南侨中
3-3 金属晶体
第三节 金属晶体
海南侨中
3-3 【内容要求】
2.1 微粒间的相互作用——新课标39页 知道金属键的特点与金属某些性质的关系。
2.4 晶体和聚集状态——新课标40页 借助金属晶体模型认识晶体的结构特点。
知道介于典型晶体之间的过渡晶体及混合型晶 体是普遍存在的。
人教化学选修3第三章第3节 金属晶体(共25张PPT)

=
2
②配位数:8
③空间利用率:
(二)三维空间密置层的堆积方式
第二层 对第一层来讲最紧密的堆积方式 是将球对准1,3,5 位。( 或对准 2,4,6 位,其情形是一样的 )
12
6
3
54
12
6
3
54
关键是第三层,对第一、二层来说,第三层 可以有两种最紧密的堆积方式。
配位数 空间利用率
12 74%
(2) 第二层小球的球心
正对着 第一层小球形成的空穴
1、简单立方堆积 Po
晶 胞
①平均占有的原子数目:
1 8
×8
=
1
② 配位数:6
③空间利用率:
a = 2r 金属原子体积=4/3πr3
%
2、体心立方堆积
碱金属(K、Na 等)Fe
体 心 立 方 晶 胞
①晶胞平均占有的原子数目:
1 8
×8
+
1
金属晶体
金属晶体的原子堆积模型
二、金属晶体的原子堆积模型
紧密堆积原理:
因为金属键没有方向性和饱和性,且晶体中 的原子可看成是直径相等的球体。金属晶体可 看成金属原子在三维空间中堆积而成。因此都 趋向于使金属原子吸引更多的其他原子分布于 周围,并以紧密堆积方式降低体系的能量,使 晶体变得比较稳定。
配位数:
②空间利用率 2a=4r
小结:
堆积模型 采纳这种堆 积的典型代 表
简单堆积 Po (钋)
空间 利用
率
52%
配位数 6
晶胞
体心立方 K、Na、Fe 68% 8 堆积
六方最密 Mg、Zn、Ti 74% 12 堆积
面心立方 Cu, Ag, 原子数目。
第三节金属晶体学案(第三课时)
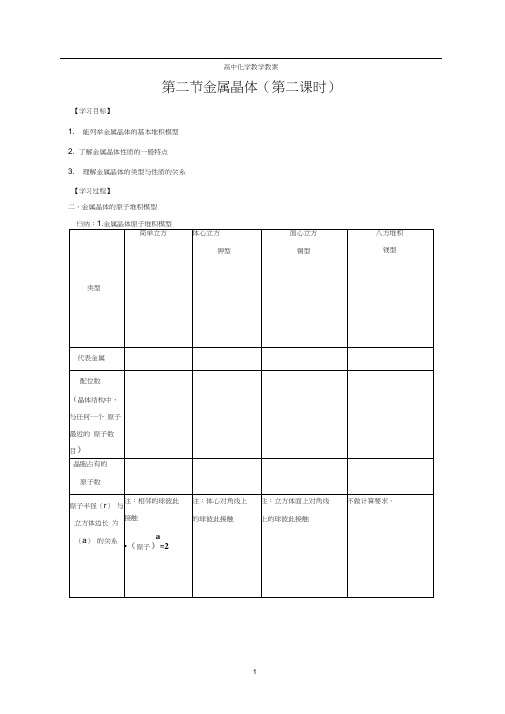
高中化学教学教案第二节金属晶体(第二课时)【学习目标】1. 能列举金属晶体的基本堆积模型2. 了解金属晶体性质的一般特点3. 理解金属晶体的类型与性质的关系【学习过程】二、金属晶体的原子堆积模型维系的;石墨的二维结构内,每一个碳原子的配位数为3,有一个末参与杂化的 2p 电子,晶体类型离子晶体分子晶体原子晶体 金属晶体 定义阴阳离子间通过形成的晶体分子间通过 形成的晶体相邻原子间通.过结合而成的立体网状的晶体由和 间相互作用形成的晶体构成粒子、粒子间作用力代表物NaCI, NaOH, MgSO q干冰,12, P 4, H 2OCQ金刚石,SiC 晶体硅,SiC 2镁、铁、金、钠物理性质硬度较_,熔点、 沸点较_,多数易 溶于水等极性溶 齐熔化或溶于水 时能导电。
硬度 ____ ,熔点、沸点_;相似相溶;熔 化时不导电,其水溶 液可导电。
硬度_,熔点、沸 点 ;难溶解;有的能导电,如晶体硅,但金刚石不导电。
硬度差异较大,熔 点、沸点差异较大, 难溶于水(钠、钙 等与水反应);晶体 导电,熔化时也导 电决定熔点、沸 点高主要因素1 ・石墨不同于金刚石,它的碳原子不像金刚石的碳原子那样呈 sp 3杂化•而是呈成平面六元并环结构,因此石墨晶体是层状结构的,每一层内部碳原子间是靠 系,层内的碳原子的核间距为142pm 层间距离为335pm ,说明层间没有化学键相连,是靠百分率)杂化,形 相维空间利用率 (晶胞中原 子的体积占 晶胞空间的它的原子轨道垂直于碳原子平面。
石墨晶体中,既有共价键,又有金属键,还有范德华力, 不能简单地归属于其中任何一种晶体,是一种混合晶体。
【典题解悟】例.关于金属晶体的六方最密堆积的结构型.式的叙述正确的是(解析.金属晶悴的六片最密堆积结构型式的晶胞是六棱柱的7——平行六面悴,有S 个顶点和1个内部原子,晶胞中绝对■占有2个原子》答案.B【当堂检测】2 .金属晶体的中金属原子的堆积基本模式有5.下列金属晶体米取的堆积方式是铜型的是6 .金属晶体的基本堆积方式中空间利用律最高的是7 .从严格意义上讲石墨属于&下列有关金属晶体的判断正确的是9 .下列有关晶体的叙述正确的是D.金属晶体的硬度 >原子晶体的硬度 >分子晶体的硬度10. 下列说法正确的是A .晶体是具有一定几何外观的,所以汞不属于金属晶体........A. 晶胞是六棱柱B. 晶胞是六面体C 每个晶胞中含4个原子D.每个晶胞中含17个原子1.金属钾晶体为体心立方结构,则在单位晶胞中钾原子的个数是B . 3C. 2 D . 1 B . 2C. 3D . 43 •仔细观察右图这■种堆积方式是 A .钾型B.简单立方C.镁型 D .铜型4 .下列排列方式是镁型堆积方式 ■的是A . ABCABCABCB . ABABABC . ABBAABBAD . ABCCBAABCCBAA . AgB . FeC . ZnD . PoA .简单立方B.钾型C.镁型 D .铜型A .分子晶体B. 原子晶体C. 混合晶体D. 金属晶体A .简单立方、配位数 6、空间利用律68%B .钾型、配位数 6、空间利用律68%C .镁型、配位数 8、空间利用律74%D .铜型、配位数12、空间利用律74%A .金属晶体含有金属阳离子和自由电子B .原子晶体一定是单质C .分子晶体一定是化合物 Qi .XB .金属一般具有较高的硬度,而钠可以用小刀切,但钠属于金属晶体 C. 塑料具有一定延展性,所以属于金属晶体D. 金属晶体一般具有较高的硬度,所以金刚石属于金属晶体 11.科学家发现的钇钡铜氧化合物在 90K 具有超导性,若该化合物晶体的晶胞结构如图所示,则该化合物的化学式可能是A . YBa 2CU 3O 4 C . YBa 2Cu 3O 512.金属原子在二维平面里有两种方式为非密置层和密置层,其配位数分别为分别是;金属晶体的最密堆积是13.. (1)请描述金属晶体中自由电子的存在状态.答:(2)请说明金属晶体中自由电子所起的作用.答:,溶液导电能力随温度升高而15.有一种金属结构单元是一个面心立方体”(注:八个顶点和六个面分别有一个金属原子) 。
第三节 金属晶体教案(第三课时).pdf

阅读讨论
与其它类型晶体的比较
石墨晶体有啥特点,和其它晶体 代表发言。
提问 有什么不 同?
二、混合晶体
石墨不同于金刚石,这的碳原子不 倾听思考 像金刚石的碳原子那样呈 sp3 杂
化.而是呈 sp2 杂化,形成平面六元
并环结 构,因此石墨晶体是层状结
构的,层内的碳原子的核间距为
142pm 层间距离为 335pm ,说明 教师 层间没有化学键相连,是靠范德
上堂课学习了金属原子二维平面
倾听、回顾、思考、交流
引入 的排列及非密置层在三维空间排 列的两种情况,请两位同学分别
代表发言
温故知新
描述一下二维及简单立方和钾型
堆积的特点
非 密置层堆积有简单立方和钾 情景 型两种,思考密置层的原子按钾 设计 型堆积 方式堆积,又会得到几种
基本堆积方式? 巡视 对学生交流进行适当的点拨。
自己动手把密置层的小球粘 培 养 分 析 问
合在一起,再一层一层地堆积起 题 和 解 决 问
来,使上层球填入下层球的空隙 题的能力,激
中。仔细比较两种类型的不同。 发 学 生 空 间
交流讨论。
想象能力
互动 和学生交流,鼓励学生大胆想象 踊跃发言
课件
代表发言 观看,思考,。
总结归纳的 能力培养。
培养 观察分
总结 华力维系的;石墨的二维 结构内,
每一个碳原子的配位数为 3,有一
个末参与杂化的 2p 电子,它的原
子轨道垂直于碳原子平面。石墨
晶体中,既有共价键,又有金属
键,还有范德华力,不能简单地
归属于其中任何一种晶体,是一
种混合晶体。
本节课通过探究密置层的堆积,
倾听、记录。
人教版高中化学选修三3.3 金属晶体 实用配套课件优秀课件PPT

知识拓展-石墨
石 墨 晶 体 结 构
用微笑告诉别人,今天的我,比昨天更强。瀑布跨过险峻陡壁时,才显得格外雄伟壮观。勤奋可以弥补聪明的不足,但聪明无法弥补懒惰的缺陷。孤独是 每个强者必须经历的坎。有时候,坚持了你最不想干的事情之后,会得到你最想要的东西。生命太过短暂,今天放弃了明天不一定能得到。只有经历人生 的种种磨难,才能悟出人生的价值。没有比人更高的山,没有比脚更长的路学会坚强,做一只沙漠中永不哭泣的骆驼!一个人没有钱并不一定就穷,但没 有梦想那就穷定了。困难像弹簧,你强它就弱,你弱它就强。炫丽的彩虹,永远都在雨过天晴后。没有人能令你失望,除了你自己人生舞台的大幕随时都 可能拉开,关键是你愿意表演,还是选择躲避。能把在面前行走的机会抓住的人,十有八九都会成功。再长的路,一步步也能走完,再短的路,不迈开双 脚也无法到达。有志者自有千计万计,无志者只感千难万难。我成功因为我志在成功!再冷的石头,坐上三年也会暖。平凡的脚步也可以走完伟大的行程。 有福之人是那些抱有美好的企盼从而灵魂得到真正满足的人。如果我们都去做自己能力做得到的事,我们真会叫自己大吃一惊。只有不断找寻机会的人才 会及时把握机会。人之所以平凡,在于无法超越自己。无论才能知识多么卓著,如果缺乏热情,则无异纸上画饼充饥,无补于事。你可以选择这样的“三 心二意”:信心恒心决心;创意乐意。驾驭命运的舵是奋斗。不抱有一丝幻想,不放弃一点机会,不停止一日努力。如果一个人不知道他要驶向哪个码头, 那么任何风都不会是顺风。行动是理想最高贵的表达。你既然认准一条道路,何必去打听要走多久。勇气是控制恐惧心理,而不是心里毫无恐惧。不举步, 越不过栅栏;不迈腿,登不上高山。不知道明天干什么的人是不幸的!智者的梦再美,也不如愚人实干的脚印不要让安逸盗取我们的生命力。别人只能给 你指路,而不能帮你走路,自己的人生路,还需要自己走。勤奋可以弥补聪明的不足,但聪明无法弥补懒惰的缺陷。后悔是一种耗费精神的情绪,后悔是 比损失更大的损失,比错误更大的错误,所以,不要后悔!复杂的事情要简单做,简单的事情要认真做,认真的事情要重复做,重复的事情要创造性地做。 只有那些能耐心把简单事做得完美的人,才能获得做好困难事的本领。生活就像在飙车,越快越刺激,相反,越慢越枯燥无味。人生的含义是什么,是奋 斗。奋斗的动力是什么,是成功。决不能放弃,世界上没有失败,只有放弃。未跌过未识做人,不会哭未算幸运。人生就像赛跑,不在乎你是否第一个到 达终点,而在乎你有没有跑完全程。累了,就要休息,休息好了之后,把所的都忘掉,重新开始!人生苦短,行走在人生路上,总会有许多得失和起落。 人生离不开选择,少不了抉择,但选是累人的,择是费人的。坦然接受生活给你的馈赠吧,不管是好的还是坏的。现在很痛苦,等过阵子回头看看,会发 现其实那都不算事。要先把手放开,才抓得住精彩旳未来。可以爱,可以恨,不可以漫不经心。我比别人知道得多,不过是我知道自己的无知。你若不想 做,会找一个或无数个借口;你若想做,会想一个或无数个办法。见时间的离开,我在某年某月醒过来,飞过一片时间海,我们也常在爱情里受伤害。1、 只有在开水里,茶叶才能展开生命浓郁的香气。人生就像奔腾的江水,没有岛屿与暗礁,就难以激起美丽的浪花。别人能做到的事,我一定也能做到。不 要浪费你的生命,在你一定会后悔的地方上。逆境中,力挽狂澜使强者更强,随波逐流使弱者更弱。凉风把枫叶吹红,冷言让强者成熟。努力不不一定成 功,不努力一定不成功。永远不抱怨,一切靠自己。人生最大的改变就是去做自己害怕的事情。每一个成功者都有一个开始。勇于开始,才能找到成功的 路。社会上要想分出层次,只有一个办法,那就是竞争,你必须努力,否则结局就是被压在社会的底层。后悔是一种耗费精神的情绪后悔是比损失更大的 损失,比错误更大的错误所以不要后悔。每个人都有潜在的能量,只是很容易:被习惯所掩盖,被时间所迷离,被惰性所消磨。与其临渊羡鱼,不如退而结网。 生命之灯因热情而点燃,生命之舟因拼搏而前行。世界会向那些有目标和远见的人让路。不积跬步,无以至千里;不积小流,无以成江海。骐骥一跃,不 能十步;驽马十驾,功在不舍。锲而舍之,朽木不折;锲而不舍,金石可镂。若不给自己设限,则人生中就没有限制你发挥的藩篱。赚钱之道很多,但是 找不到赚钱的种子,便成不了事业家。最有效的资本是我们的信誉,它小时不停为我们工作。销售世界上第一号的产品——不是汽车,而是自己。在你成
2024-2025学年高中化学第三章第三节金属晶体教案新人教版选修3

布置作业:
根据本节课学习的金属晶体内容,布置适量的课后作业,巩固学习效果。提醒学生注意作业要求和时间安排,确保作业质量。
拓展与延伸
1.拓展阅读材料:
-《金属晶体与合金》
-《金属晶体在高新技术领域的应用》
-《金属晶体结构与性质的关系研究》
5.分析金属晶体在制造过程中的铸造技术,并说明其优点。
答案示例:金属晶体在铸造过程中采用精密铸造技术,可以减少晶界和气孔,提高材料的力学性能和精度。优点包括:提高材料强度、改善表面光洁度、减少加工成本等。
板书设计
1.重点知识点:
①金属晶体结构特点
②金属晶体性质及其影响因素
③金属晶体在实际应用中的例子
-设计课堂小测验,测试学生对金属晶体相关概念、性质、应用等方面的记忆和理解能力。
-及时发现问题,针对学生的共性和个性问题进行讲解和辅导,确保学生能够及时消化和巩固所学知识。
-鼓励学生在课堂上积极表达自己的观点和疑问,培养学生的批判性思维和问题解决能力。
2.作业评价:
-对学生的课后作业进行认真批改,评估学生对课堂所学知识的巩固程度和运用能力。
(三)新课呈现(预计用时:25分钟)
知识讲解:
清晰、准确地讲解金属晶体的结构特点、性质及其影响,结合实例帮助学生理解。突出重点,强调难点,通过对比、归纳等方法帮助学生加深记忆。
互动探究:
设计小组讨论环节,让学生围绕金属晶体的性质和应用展开讨论,培养学生的合作精神和沟通能力。鼓励学生提出自己的观点和疑问,引导学生深入思考,拓展思维。
2024-2025学年高中化学第三章第三节金属晶体教案新人教版选修3
人教版选修3 第3章第3节 金属晶体(第2课时) 课件(43张)

[要点梳理] 1.金属晶体的基本堆积模型 (1)二维空间模型 ①非密置层 配位数为 4 ,如图所示:
②密置层 配位数为 6
,如图所示:
(2)三维空间模型 ①非密置层在三维空间堆积 a.简单立方堆积 相邻非密置层原子的原子核在 同一条直线上 的堆积,只有 金属 钋(Po) 采用这种堆积方式,其空间利用率太低。
b.体心立方堆积——钾型 将上层金属原子填入 下层的金属原子形成的凹穴 中,并使 非密置层的原子稍稍分离。其空间的利用率比简单立方堆积 高 , 属于钾型的主要有碱金属等。
②密置层在三维空间堆积 a.六方最密堆积——镁型 如图所示,按 ABABABAB ……的方式堆积。
b.面心立方最密堆积——铜型 如图所示,按 ABCABCABC
……的方式堆积。
2.石墨 在石墨晶体中,同层的碳原子以 sp2
杂化形成共价键,
每一个碳原子以 三 个共价键与另外三个原子相连。六个碳 原子在同一个平面上形成了 正六边形 的环,伸展成 片层 结
构,因此对于同一层来说,它是 原子 晶体。在同一平面的碳
原子还各剩下一个 p 轨道,它们相互重叠。电子比较自由,相当
(2)根据下列叙述,判断一定为金属晶体的是________。 A.由分子间作用力形成,熔点很低 B.由共价键结合形成网状晶体,熔点很高 C.固体有良好的导电性、导热性和延展性
[解析] (1)简单立方堆积的空间利用率太低,只有金属 Po 采取这种方式。体心立方堆积是上层金属原子填入下层的金属原 子形成的凹穴中,这种堆积方式的空间利用率比简单立方堆积的 高,多数金属是这种堆积方式。六方最密堆积按 ABAB……方式 堆积,面心立方最密堆积按 ABCABC……方式堆积,六方最密 堆积常见金属为 Mg、Zn、Ti,面心立方最密堆积常见金属为 Cu、 Ag、Au。
《第三节 金属晶体》PPT课件(广东省县级优课)

B
周期,即 AB AB 堆积方
A
式,形成六方紧密堆积。
…
按密置层的堆积方式的第一种:六方密堆积
3 六方最密堆积 镁型
六方最密堆积(Mg型)
配位数 每个晶胞含原子数
空间利用率
12
2 74%
按密置层的堆积方式的第二种:面心立方堆积
4 面心立方最密堆积 Cu型
面心立方最密堆积(Cu型)
铜型 [面心立方] (ⅠB Pb Pd Pt )
①原子坐标参数,表示晶胞内部各原子的相对位置,下图 为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B 为(,0,);C为(,,0)。则D原子的坐标参数为 ______。
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞 参数a=565.76 pm,其密度为__________g·cm-3(列出 计算式即可)。
C.晶胞中原子的配位数分别为:①6,②8,③8,④12 D.空间利用率的大小关系为:①<②<③<④
【感受高考】
2016年普通高等学校招生全国统一考试理科综合能力测试
37.[化学——选修3:物质结构与性质](15分)
锗(Ge)是典型的半导体元素,在电子、材料等领域应用 广泛。回答下列问题:
(6)晶胞有两个基本要素:
A.是密置层的一种堆积方式 B.晶胞是六棱柱 C.每个晶胞内含2个原子 D.每个晶胞内含6个原子
3、同堆积方式的金属晶体的晶胞如图所示,有关说 法正确的是 ( B )
A.①为简单立方堆积,②为六方最密堆积,③为体心立方堆 积,④为面心立方最密堆积
B.每个晶胞含有的原子数分别为:①1个,②2个,③2个,④ 4个
第二层对第一层来讲最紧密的堆积方式是将球对准 1 ,3,5 位 (或对准 2,4,6 位,其情形是一样的 )
人教版高中化学选修三 3.3 金属晶体(课件1)_最新修正版

最新修正版
9
3、镁型和铜型
密置层的原子按上述钾型堆积方式堆积,会得到两 种基本堆积方式——镁型和铜型。镁型如图3—25左所 示,按ABABABAB……的方式堆积;铜型如图3—25右所 示,按ABCADCABC……的方式堆积。分别用代表性金属 命名为镁型和铜型①,这两种堆积方式都是金属晶体的 最密堆积,配位数均为12,空间利用率均为74%,但所 得晶胞的形式不同。
最新修正版
16
再见
最新修正版
17
最新修正版
12
最新修正版
13
练习一
1.不仅与金属的晶体结构有关,而且与金属原子本身 的性质有关的是金属的
A.导电性 B.导热性 C.密度 D.熔点
2.某晶体不导电,在熔融状态下能被电解,则该晶
体是
A.分子晶体
B.原子晶体
C.离子晶体 D.金属晶体
3.下列叙述中,一定是金属元素的是
A.最外层只有一个电子
最新修正版
15
练习二
有一黄铜合金Cu和Zn的质量分数依 次为75%,25%, 晶胞的密度为8.9g·cm-3, 晶 体属于立方面心结构, 晶胞中含4个原子。 Cu和Zn的相对原子质量分别为63.5和65.4, 求:(1)Cu和Zn所占的原子百分数; (2)每个 晶胞含合金的质量是多少克; (3)晶胞的体 积多大。最新修正版7简单立方堆积:
这种堆积方式形成的晶胞是一个立方体,每个晶 胞含1个原子,被称为简单立方堆积。这种堆积方 式的空间利用率太低,只有金属钋(Po)采取这种 堆积方式。
最新修正版
8
2、钾型
非密置层的另一种堆积方式是将上层金属原子
填人下层的金属原子形成的凹穴中,每层均照此 堆积.
人教版选修3 第3章第3节 金属晶体 课件(59张)

(2)金原子半径为 A cm,则晶胞中面对角线是 4A cm,所以
晶胞的边长是
2
2A
cm,所以2
2A3·ρ 197
×NA
=
4
,
解
得
ρ=
4 129A73NA。
(3)晶胞的体积是(2 2A)3,而金原子占有的体积是 4×43πA3, 所以金原子空间占有率为42×432πAA33=42×243π3≈74%(0.74)。
解析:选 C 在金属晶体中,原子间以金属键相互结合,金 属键的本质是金属原子脱落下来的价电子形成遍布整块晶体的 “电子气”,被所有原子所共用,从而将所有金属原子维系在一 起而形成金属晶体。实际上也就是靠脱落下来的价电子与其中的 金属离子间的相互作用而使它们结合在一起。
2.金属的下列性质中和金属晶体的结构无关的是( )
4.金属原子在三维空间里有四种堆积方式:
简单立方堆 体心立方堆 六方最密堆 面心立方最密堆
积
积
积
积
知识分点突破
细梳理、练对点、层层过关
分点突破 1 金属键与金属晶体
1.金属键 (1)概念:“电子气理论”把金属键描述为金属原子脱落下 来的 1 __价__电__子__形成遍布整块晶体的“ 2 __电__子__气__”,被所有原 子所共用,从而把所有的 3 __金__属__原__子__维系在一起。
(3)在六方最密堆积中,如下图,
设原子半径为 r,则底面边长为 2r,底面高 h= 3r,所以底 面积 S=2r× 3r=2 3r2。晶胞的高 H=2×236r,所以晶胞体 积 V 晶胞=S×H=2 3r2×436r=8 2r3,2 个原子的体积 V 球=2×43 πr3。
空间利用率为VV晶球胞×100%=28×432πr3r3×100%≈74%。
高中化学第3章第3节金属晶体课件新人教版选修3

3.金属钠晶体为体心立方晶胞(
),晶胞的边长为 a。假定金
属钠原子为等径的刚性球,且晶胞中处于体对角线上的三个球相切。则钠
原子的半径 r 为( )
A.a2
B.
3a 4
C.
3a 2
D.2a
B [如果沿着某一面的对角线对晶胞作横切面,可得如图所示的结 构,其中 AB 为晶胞的边长,BC 为晶胞的面对角线,AC 为晶胞的体对角 线。根据立方体的特点可知:BC= 2a,结合 AB2+BC2=AC2 得:r= 43a。]
4.(1)图甲为二维平面晶体示意图,所表示的化学式为 AX3 的是 ________。
甲
(2)图乙为一个金属铜的晶胞,请完成以下各题。 乙
①该晶胞称为________(填序号)。
A.六方晶胞
B.体心立方晶胞
C.面心立方晶胞
②此晶胞立方体的边长为 a cm,Cu 的相对原子质量为 64,金属铜的
密度为 ρ g·cm-3,则阿伏加德罗常数为________(用 a、ρ 表示)。
③金属铜的空间利用率为________(写出计算式和结果)。
[解析] (1)由图甲中直接相邻的原子数可以求得 a、b 中两类原子数
之比分别为 1∶2、1∶3,求出化学式分别为 AX2、AX3,故答案为 b。(2)①
面心立方晶胞;②64·N4A=ρ·a3,NA=ρ2·5a63。
复习课件
高中化学第3章第3节金属晶体课件新人教版选修3
2021/4/17
高中化学第3章第3节金属晶体课件新人教版选修3
1
第三章 晶体结构与性质
第三节 金属晶体
目标与素养:1.了解金属键的含义,能用“电子气理论”解释金属的 一些物理性质。(宏观辨识与微观探析)2.了解金属晶体的 4 种堆积模型。(证 据推理与模型认知)3.了解混合晶体石墨的结构与性质。(宏观辨识与微观 探析)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
熔点很高的金属:钨(3410℃)
铁的熔点:1535 ℃
资料
金属之最
熔点最低的金属是-------- 汞 [-38.87℃] 熔点最高的金属是-------- 钨 [3410℃] 密度最小的金属是-------- 锂 [0.53g/cm3] 密度最大的金属是-------- 锇 [22.57g/cm3]
六方堆积
面心立方 堆积
例4.在面心立方最密堆积中,求: (1).配位数; 12 (2).晶胞实际占有的原子数 4 (3)面心立方晶胞的空间利用率
1
6
7
9 4 12
2
3
8
5
10
11
解:晶胞边长为a,原子半径为r. 由勾股定理: a 2 + a 2 = (4r)2 a = 2.83 r 每个面心立方晶胞含原子数目: 8 1/8 + 6 ½ = 4 = (4 4/3 r 3) / a 3 = (4 4/3 r 3) / (2.83 r ) 3 100 % = 74 %
化学变化 物理变化
晶体类型
增强
减弱
⑵、金属晶体结构与金属导热性的关系
【讨论2】金属为什么易导热?
自由电子在运动时经常与金属离子碰撞, 引起两者能量的交换。当金属某部分受热时, 那个区域里的自由电子能量增加,运动速度加 快,通过碰撞,把能量传给金属离子。
金属容易导热,是由于自由电子运动时与 金属离子碰撞把能量从温度高的部分传到温度 低的部分,从而使整块金属达到相同的温度。
5.下列有关金属元素特性的叙述正确的是 A. 金属原子只有还原性,金属离子只有氧化性 B. 金属元素在化合物中一定显正化合价
B
C. 金属元素在不同化合物中化合价均不相同
D. 金属元素的单质在常温下均为晶体 6. 金属的下列性质与金属键无关的是( C ) A. 金属不透明并具有金属光泽 B. 金属易导电、传热 C. 金属具有较强的还原性 D. 金属具有延展性
有阳离子,不一定有阴离子(金属晶体)
三、金属晶体的结构与金属性为什么易导电?
在金属晶体中,存在着许多自由电子,这些自由 电子的运动是没有一定方向的,但在外加电场的条件 下自由电子就会发生定向运动,因而形成电流,所以 金属容易导电。
电解质在熔化状态或溶于水能导电, 这与金属导电的本质是否相同? 电解质 金属晶体 水溶液或 晶体状态 导电时的状态 熔融状态下 自由移动的离子 自由电子 导电粒子 导电时发生的 变化 导电能力随温 度的变化
A. Li Na K
C. Li Be Mg
B. Na Mg Al
D. Li Na Mg
B
知识回顾:三种晶体类型与性质的比较
晶体类型 概念 原子晶体 相邻原子之间以共价 键相结合而成具有空 间网状结构的晶体 分子晶体 金属晶体 分子间以范德 通过金属键形成的 华力相结合而 晶体 成的晶体
作用力
构成微粒 物 理 性 质 实例 熔沸点 硬度 导电性
共价键 原子 很高 很大 无(硅为半导体)
金刚石、二氧化硅、 晶体硅、碳化硅
范德华力
金属键
金属阳离子 和自由电子
分子 很低
很小
差别较大
差别较大 导体
Au、Fe、Cu、钢 铁等
无
Ar、S等
二.金属晶体的原子堆积模型
二、金属晶体的原子堆积模型
①.理论基础:
由于金属键没有方向性,每个金属原 子电子分布基本是球对称的,所以可以 把金属晶体看成是由直径相等的圆球的 三维空间堆积而成。
四.金属晶体熔点变化规律
⑴金属晶体熔点变化较大
与金属晶体紧密堆积方式、金属阳离子与自由电子之间 的金属键的强弱有密切关系.
⑵一般情况下,金属晶体熔点由金属键强弱决定:
金属阳离子半径越小,所带电荷越多,自由电子越多,
金属键越强,熔点就相应越高,硬度也越大。 如:K ﹤ Na ﹤ Mg ﹤Al Li﹥ Na ﹥ K ﹥ Rb ﹥ Cs 熔点最低的金属:汞(常温时成液态)
金属的延展性
+ + + + + + + + + + + + + + + + + + + + + 自由电子 + + + + + + + + + + + + + + + + + + + + + +
位错
+
金属离子
金属原子
⑷、金属晶体结构具有金属光泽和颜色
• 由于自由电子可吸收所有频率的光,然后 很快释放出各种频率的光,因此绝大多数 金属具有银白色或钢灰色光泽。而某些金 属(如铜、金、铯、铅略带蓝色等)由于 较易吸收某些频率的光而呈现较为特殊的 颜色。 • 当金属成粉末状时,金属晶体的晶面取向 杂乱、晶格排列不规则,吸收可见光后辐 射不出去,所以成黑色。
7.能正确描述金属通性的是 ( AC ) A. 易导电、导热 B. 具有高的熔点 C. 有延展性 D. 具有强还原性
8. 下列生活中的问题,不能用金属键知识解释 的是 ( D ) A. 用铁制品做炊具 B. 用金属铝制成导线 C. 用铂金做首饰 D. 铁易生锈
9. 金属键的强弱与金属价电子数的多少有关, 价电子数越多金属键越强;与金属阳离子的半 径大小也有关,金属阳离子的半径越大,金属 键越弱。据此判断下列金属熔点逐渐升高的是
晶胞中原子所占的体积 V%= 晶胞的体积 ×100%
④配位数:在密堆积中,一个原子或离 子周围距离最近且相等的原子或离子的 数目。
二维平面堆积方式
非密置层
行列对齐,四球一空 非最紧密排列 配位数:4
密置层
行列相错,三球一空 最紧密排列 配位数:6
三维空间堆积方式
非密置层的2种三维堆积方式
第三层的另一种排列方式,是将球对 准第一层的2、4、6位,不同于 AB 两 层的位置,这是C 层。
1 6 5
2 3 4 6
1
2 3
5
4
第四层再排 A,于是 形成ABC ABC 三层一 个周期
A
C B A
1 6 5
2 3 4
C B
密 ② 面 心 立 方 最 密 堆 积
A
配位数 12 。 ( 同层 6, 上下层各 3 )
金属原子脱落下来的价电子形成遍布整晶体 的“电子气”,被所有原子所共用,从而把所有 的金属原子维系在一起。
(6)键的强弱:阳离子半径;所带电荷
㈡、金属晶体:
概念:金属阳离子和自由电子通过金属键作 用形成的晶体 组成粒子:金属阳离子和自由电子 作用力:金属离子和自由电子之间的较强作 用—— 金属键(电子气理论) 总结:在任意晶体中,有阴离子,一定有阳离子
⑶、金属晶体结构与金属延展性的关系
【讨论3】金属为什么具有较好的延展性?
原子晶体受外力作用时,原子间的位移必 然导致共价键的断裂,因而难以锻压成型, 无延展性。而金属晶体中由于金属离子与自 由电子间的相互作用没有方向性,各原子层 之间发生相对滑动以后,弥漫在金属原子间 的电子气可以起到类似轴承中滚珠之间润滑 剂的作用,仍可保持这种相互作用,因而即 使在外力作用下,发生形变也不易断裂。
微粒间作用力使微粒尽可 能的相互接近,使它们占 有最小的空间。
②堆积原理:
原子在空间的排列大都遵循紧密堆积原理。 因为金属键无方向性,堆积时趋向于使金 属原子吸引更多其他原子,并以紧密堆积 方式降低体系的能量,使晶体变得比较稳 定。
③空间利用率:空间被晶格质点占据的 百分数。用来表示紧密堆积的程度。
练习
1.金属晶体的形成是因为晶体中存在( C ) A.金属离子间的相互作用 B.金属原子间的相互作用 C.金属离子与自由电子间的相互作用 D.金属原子与自由电子间的相互作用 2.金属能导电的原因是( B) A.金属晶体中金属阳离子与自由电子间的 相互作用较弱 B.金属晶体中的自由电子在外加电场作用 下可发生定向移动 C.金属晶体中的金属阳离子在外加电场作 用下可发生定向移动 D.金属晶体在外加电场作用下可失去电子
8个顶点各1个原子,每个原子被8个 晶胞共享
每个晶胞含有几个原子:1 + 8 × 1/8 = 2
设原子半径为r 、晶胞边长为a , 根据勾股定理得: 2a 2 + a 2 = (4r) 2
3a 2 16 r 2 r 3 a 4
空间利用率 = 晶胞含有原子的体积 / 晶胞体积 100%
第三节 金属晶体
Ti
金属样品
Ti
一、金属共同的物理性质 容易导电、导热、有延展性、有金属光泽等 思考:金属为什么具有这些共同性质呢? 二、金属的结构
电子气理论:由于金属原子的最外层电子数较 少,容易失去电子成为金属离子,金属原子释放 出的价电子不专门属于某个特定的金属离子,而 为许多金属离子所共有,并在整个金属中自由运
3.下列叙述正确的是( B) A.任何晶体中,若含有阳离子也一定含有阴离子 B.原子晶体中只含有共价键 C.离子化合物中只含有离子键,不含有共价键 D.分子晶体中只存在分子间作用力,不含有其 他化学键 4.下列有关金属键的叙述错误的是 ( B ) A.金属键没有方向性 B.金属键是金属阳离子和自由电子之间存在的强 烈的静电吸引作用 C.金属键中的电子属于整块金属 D.金属的性质和金属固体的形成都与金属键有关
动,这些电子又称为自由电子.自由电子几乎均
匀分布在整个晶体中,像遍布于整块金属的 “电子气”,从而把所有金属原子维系在一起。
㈠、金属键
(1)定义: 金属离子和自由电子之间的强烈的相互作用。
(2)成键微粒: 金属阳离子和自由电子 (3)键的存在: 金属单质和合金中 (4)特征: 无方向性和饱和性 (5)键的本质: 电子气理论
