安洛替尼ALTER0303研究
安罗替尼三线治疗小细胞肺癌的临床研究

26
无效(
n) 总有效率(% )88 Nhomakorabea.0
4
a
χ2=5.
:
125,
P <0.
05,与对照组比较.
a
91.
3
2.
2 两组患者疼痛情况、住 院 时 间、住 院 费 用 比 较
研究组 患 者 VAS 明 显 小 于 对 照 组,住 院 时 间 明 显 短
于对照组,住 院 费 用 明 显 少 于 对 照 组,差 异 均 有 统 计
SCLC)临床疗效和安全性.方法 对 2018 年 12 月至
2020 年 3 月该院收治的 48 例体能状态评分为 0~3 分 的 SCLC 患 者 给 予 安 罗 替 尼 三 线 治 疗,随 访 观 察 其 接 受
治疗的疗效和不良反应.48 例患者中失访 2 例,最终 46 例患者纳入分析.结果 安洛替尼三线治疗的客观反
37.
0% )、
口腔溃疡(
32.
6% )等.5 例患者在治疗过程中出现了
3 级以上不良 反 应,
3例患者经暂缓用药及对症治疗
后不良反应症状得到缓 解,
2 例 患 者 导 致 停 药.46 例
患者不良反应发生情况见表 2.
不良反应
表 2 不良反应发生情况[
n(% ),
n=46]
高血压
乏力
厌食
手足综合征
两种麻醉方法 对 手 汗 症 康 复 的 影 响 [
J].浙 江 临 床 医 学,
2018,
20(
8):
1356
G
1357.
经验交流
安罗替尼三线治疗小细胞肺癌的临床研究
杨 培,李 强,王 艳,王 磊,蒋祥德
安罗替尼治疗晚期非小细胞肺癌的临床研究进展

・1414・Modern Practical Medicine, October 2019, Vol. 31, No. 10・讲座与综述・安罗替尼治疗晚期非小细胞肺癌的临床研究 进展李靖,虞亦鸣doi:10.3969^.issn,1671-0800.2019.10.068【中图分类号】R734.2肺癌是目前全球范围内肿瘤导致死 亡的主要原因之一,其中非小细胞肺癌 (NSCLC)占肺癌总数的80%~ 85%,死 亡率显著高于其他恶性肿瘤叫目前以 钳类为基础的联合化疗对于大部分进展 期NSCLC 不能带来显著的获益叫因 此,迫切需要寻求更有效的治疗药物和 方案。
安罗替尼是一种新型、口服、多靶 点的酪氨酸激酶抑制剂,具有显著的抗 肿瘤血管生成和抑制肿瘤生长的作用,在进展期NSCLC 的三线治疗中延长了 患者的生存期,也改善了患者的生活质量。
本文综述安罗替尼的相关临床试 验、耐药机制及亟待解决的问题。
1安罗替尼的抗肿瘤血管生成作用肿瘤血管生成对维持肿瘤微环境, 促进肿瘤生长和转移起到了重要作用。
肿瘤细胞能分泌多种促血管生成因子, 包括血管内皮生长因子(VEGF)、血小板 衍生生长因子(PDGF)和成纤维细胞生 长因子(FGF).这些促血管生成因子与 内皮细胞表面相应受体结合后能激活下 游信号通路,促进血管内皮细胞迁移,形 成有别于正常血管的新生血管,为肿瘤 细胞提供氧气和营养物质,促进肿瘤细 胞的生长和转移叫因此,阻碍肿瘤新生 血管的形成是攻克肿瘤的一个突破口。
在以往的一项研究中证实,无论在体内 輕塹空罗替尼均能抑制由VEGF/ 基金项目:医学科学研究基金 (YWJKJJHKYJJ-F2162G);宁波市自然科学基金(2018A610271)作者单位:315211宁波,宁波大学医学院(李靖);宁波大学医学院附属医院(虞亦鸣)通信作者:虞亦鸣.Email : 74516040【文献标志码】C 【文章编号】PDGF-BB/FGF-2所介导的血管生成,且 抑制作用优于舒尼替尼、索拉菲尼等其他 抗血管生成药物,是能同时阻断多个血管 生成途径的小分子酪氨酸激酶抑制剂叫 此外,另一项基础研究表明安罗替尼对血 管内皮生长因子受体2(VEGFR2)表现出 了高度选择性。
非小细胞肺癌中安罗替尼治疗相关高血压与其疗效的相关性研究

医学食疗与健康 2023年5月上第21卷第13期·论著·作者简介:吴倩,肿瘤内科,深圳市罗湖区人民医院。
非小细胞肺癌中安罗替尼治疗相关高血压与其疗效的相关性研究吴倩,高文斌深圳市罗湖区人民医院肿瘤内科,广东 深圳 518000【摘要】目的:本研究通过观察统计使用安罗替尼治疗的非小细胞肺癌患者疗效及副反应发生情况,寻找可能的疗效预测因子。
方法:收集2019-6-1至2022-3-1期间于罗湖区人民医院使用安罗替尼治疗的晚期非小细胞肺癌患者。
评估治疗相关高血压及预后的关系。
主要研究终点为中位无进展生存期,次要研究终点为中位总生存期及疾病有效率。
结果:共纳入32例使用安罗替尼治疗的晚期非小细胞肺癌患者,中位无进展生存期4.2个月。
中位总生存期6.5个月。
疾病有效率18.8%。
根据治疗相关高血压出现与否将患者分为A、B 两组(A 组:未出现安罗替尼治疗相关高血压,n =14;B 组:出现安罗替尼治疗相关高血压,n =18人)。
接受安罗替尼治疗后出现治疗相关高血压的患者中位无进展生存期较未出现治疗相关高血压者延长,结果有统计学意义(3.6个月VS 4.5个月,P =0.016,HR :0.38,95%CI :0.17 ~ 0.87)。
结论:本研究结果显示,安罗替尼治疗相关高血压副反应可能为其潜在疗效预测因子。
但以上结论需要进一步大样本量前瞻性临床试验进一步探索证实。
【关键词】非小细胞癌;安罗替尼;高血压;研究【中图分类号】R734.2 【文献标识码】A 【文章编号】2096-5249(2023)13-004-04肺癌是起源于肺部支气管粘膜或腺体的恶性肿瘤,是我国乃至全球发病率及死亡率最高的癌种。
据世界卫生组织国际癌症研究机构发布的2020年全球最新癌症流行病学统计数据显示,2020年中国肺癌新发病例82万,死亡病例71万[1]。
肺癌恶性程度高,预后差,近年来,随着对肺癌病理类型、分子生物学、驱动基因等各方面的深入研究,肺癌的治疗模式已经从不加选择地一味化疗变成根据其病理类型、临床分期、驱动基因、免疫表达等各方面特点制定精准化综合治疗的模式[2]。
盐酸安罗替尼胶囊Anlotinib-详细说明书与重点

盐酸安罗替尼胶囊Anlotinib商品名:福可维英文名:Anlotinib Hydrochloride Capsules汉语拼音:Yan Suan An Luo Ti Ni Jiao Nang【成份】本品活性成份为盐酸安罗替尼。
化学名称:1-[[[4-(4-氟-2-甲基-1H-吲哚-5-基)氧基-6-甲氧基喹啉-7-基]氧基]甲基]环丙胺二盐酸盐;化学结构式:分子式:C23H22FN3O3•2HC1 分子量:480.36【性状】本品内容物为白色或类白色粉末或颗粒。
【适应症】1.本品单药适用于既往至少接受过2种系统化疗后出现进展或复发的局部晚期或转移性非小细胞肺癌患者的治疗。
对于存在表皮生长因子受体(EGFR)基因突变或间变性淋巴瘤激酶(ALK) 阳性的患者,在开始本品治疗前应接受相应的标准靶向药物治疗后进展、且至少接受过2种系统化疗后出现进展或复发。
2.本品单药适用于腺泡状软组织肉瘤、透明细胞肉瘤以及既往至少接受过含蒽环类化疗方案治疗后进展或复发的其他晚期软组织肉瘤患者的治疗。
3.本品单药适用于既往至少接受过2种化疗方案治疗后进展或复发的小细胞肺癌患者的治疗。
该适应症是基于-项包括119例既往至少接受过2种化疗方案治疗后进展或复发的小细胞肺癌患者的1I期临床试验的结果给予的有条件批准。
该适应症的完全批准将取决于正在进行的确证性试验证实本品在该人群的临床获益。
(见[临床试验] )【规格】按安罗替尼(C23H22FN3O3)计:(1) 12mg; (2) 10mg; (3) 8mg。
【用法用量】本品应在有抗肿瘤药物使用经验医生的指导下使用(1)推荐剂量及服用方法:盐酸安罗替尼的推荐剂量为每次12mg,每日1次,早餐前口服。
连续服药2周,停药1周,即3周(21天)为一个疗程。
直至疾病进展或出现不可耐受的不良反应。
用药期间如出现漏服,确认距下次用药时间短于12小时,则不再补服。
(2)剂量调整:本品使用过程中应密切监测不良反应,并根据不良反应情况进行调整以使患者能够耐受治疗。
应用安罗替尼治疗小细胞肺癌伴脑转移患者一例
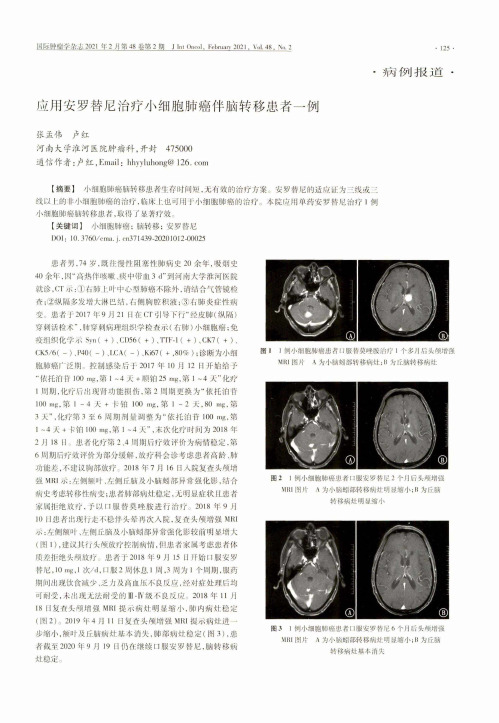
国际肿瘤学杂志2021 年2 月第48 卷第2 期J I n t Oncol, February 2021,Vol. 48,Na2•病例报道•• 125 •应用安罗替尼治疗小细胞肺癌伴脑转移患者一例张孟伟卢红河南大学淮河医院肿瘤科,开封475000通信作者:卢红,Email:hhyyluhong@126. com【摘要】小细胞肺癌脑转移患者生存时间短,无有效的治疗方案。
安罗替尼的适应证为三线或三线以上的非小细胞肺癌的治疗,临床上也可用于小细胞肺癌的治疗。
本院应用单药安罗替尼治疗1例小细胞肺癌脑转移患者,取得了显著疗效。
【关键词】小细胞肺癌;脑转移;安罗替尼D0I:10.3760/371439-20201012-00025患者男,74岁,既往慢性阻塞性肺病史20余年,吸烟史40余年,因“高热伴咳嗽、痰中带血3 d”到河南大学淮河医院就诊,CT示:①右肺上叶中心型肺癌不除外,请结合气管镜检查;②纵隔多发增大淋巴结,右侧胸腔积液;③右肺炎症性病变。
患者于2017年9月21日在CT引导下行“经皮肺(纵隔)穿刺活检术”,肺穿刺病理组织学检查示(右肺)小细胞癌;免疫组织化学示 Syn( + )、CD56( + )、TTF-1( + )、CK7( + )、CK5/6( -〉、P40( - )、LCA( - )、Ki67( + ,80% );诊断为小细 胞肺癌广泛期控制感染后于2017年10月12日开始给予 “依托泊苷1〇〇 mg,第1 ~4天+顺铂25 mg,第卜4天”化疗 1周期,化疗后出现肾功能损伤,第2周期更换为“依托泊苷 100 mg,第 1~4 天 + 卡铂 100 mg,第 1~2 天,80 mg,第 3天”,化疗第3至6周期剂量调整为“依托泊苷100 mg,第 I ~4天+卡钼100 mg,第1 ~4天”,末次化疗时间为2018年 2月18日患者化疗第2、4周期后疗效评价为病情稳定,第 6周期后疗效评价为部分缓解,放疗科会诊考虑患者高龄、肺 功能差,不建议胸部放疗。
安洛替尼ALTER0303-研究
安罗替尼组 (n=294) ≥ 3级,例数 (%) 123 (41.84)
1 (0.34) 2 (0.68)
3 (1.02) 1 (0.34) 3 (1.02) 1 (0.34)
2 (0.68)
39 (13.27) 7 (2.38)
11 (3.74)
7 (2.38)
1 (0.34) 1 (0.34)
第五页,共27页。
安罗替尼更优
安慰剂更优
ALTER0303试验-主要终点(OS)
生存率比较
*** p=0.0001
*
p=0.0149
出组后治疗 治疗类型
指标
无 有 化疗 靶向药物治疗 放疗 免疫治疗 中药抗肿瘤治疗 手术
p=0.5572
OS影响多因素分析
组别(试验组 vs 对照组) 性别(男 vs 女)
第十五页,共27页。
安罗替尼—EGFR 亚组分析(野生型)
安罗替尼治疗EGFR野生型患者PFS(5.37 个月 vs 1.57个 月)、OS(8.87个月 vs 6.47个月)均显著获益
Presented By Baohui Han at 2017 WCLC Meeting, Abstract NO. P3.03-006 .
组间比较
p<0.0001
p<0.0001 p<0.0001
第二周期末疗效评价(FAS)
最佳疗效
安罗替尼组 安慰剂组
组间比较
PR
16
1
SD
220
48
PD
33
72
p<0.0001
NE
25
22
合计
294
143
ORR(%, CR+PR)
安罗替尼说明书解读PPT课件

-
13
高血压-处理原则
分级
定义
策略
收缩压120~139mmHg
严密监测血压;限盐,戒烟酒;继续服用安罗替尼,
1级
或舒张压80~89mmHg
无需剂量调整
收缩压140~159mmHg
严密监测血压;继续服用安罗替尼,一般无需剂量
2级
或舒张压90~99mmHg
调整;应采用降压药治疗,且不得随意停药
收缩压≥160mmHg
128(43.54) 11(3.74)
103(35.03) 3(1.02)
63(21.43) 1(0.34)
119(40.48)
0
87(29.59) 13(4.42)
76(25.85) 137(46.60)
5(1.70) 1(0.34)
126(42.86) 85(28.91)
9(3.06)
7(2.38)
-
4
产品现状-特点3:低毒
靶区聚焦,对抗血管生成相关激酶选择性强—低毒
Anlotinib
-
5
产品现状-特点4:唯一
国内唯一获批单药对晚期非小细胞肺癌(NSCLC)有效的抗血管生成靶向 药
相比安慰剂 安罗替尼延长OS达3.33个月,p<0.05
ALTER0303 研究达到主要终点
相比安慰剂 安罗替尼延长PFS达3.97个月,p<0.05
-
安慰剂(n=143)
所有级别
≥3级
n(%)
n(%)
23(16.08)
0
38(26.57)
0
13(9.09)
0
21(14.69)
0
19(13.29)
0
20(13.99)
安罗替尼联合吉非替尼治疗EGFR突变NSCLC导致严重皮下出血1例

●病例报道●安罗替尼联合吉非替尼治疗EGFR 突变NSCLC导致严重皮下出血1例林宝琪1 ,彭秀凡1,陈鹏飞1,赵昌林2(广州中医药大学祈福医院 1肿瘤二区,2肿瘤一区,广东 广州,510000)摘要:安罗替尼为我国自主研发的新型小分子多靶点酪氨酸激酶抑制剂,可强效抑制多个靶点,因其显著延长总生存期(OS )及无进展生存期(PFS )而受到瞩目,不良反应主要包括高血压和蛋白尿,偶有致死性咯血报道。
本文报道了安罗替尼联合吉非替尼治疗EGFR 突变晚期非小细胞肺癌(NSCLC )导致严重皮下出血1例,为临床预防安罗替尼的不良反应提供参考。
关键词:安罗替尼;吉非替尼;不良反应;皮下出血中图分类号:R734.2,730.6 文献标识码:A 文章编号:2095-1264(2019)03-0527-02doi:10.3969/j.issn.2095-1264.2019.03.37Combination of Anlotinib and Gefitinib in the Treatment of EGFR MutationNSCLC Causing Severe Subcutaneous Hemorrhage: A Case ReportLIN Baoqi 1, PENG Xiufan 1, CHEN Pengfe 1, ZHAO Changlin 2(1Tumor Area 2, 2Tumor Area 1, Qifu Hospital, Guangzhou University of Traditional Chinese Medicine, Guangzhou, Guangdong, 510000)Abstract: Anlotinib is a novel small-molecule multi-target tyrosine kinase inhibitor which is independently developed in China. It can effectively inhibit multiple targets. And it is attracting attention for its significant prolongation of OS and PFS. Its adverse reactions mainly include high blood pressure and proteinuria, and there are occasional reports of lethal hemoptysis. In this article, we reported a case of severe subcutaneous hemorrhage caused by anlotinib plus gefitinib treatment for advanced NSCLC patient with EGFR mutations, so as to provide a reference for clinical prevention of adverse effects of anlotinib.Key words: Anlotinib; Gefitinib; Adverse reaction; Severe subcutaneous hemorrhage作者简介:林宝琪,女,硕士,主治医师,研究方向:中西医结合肿瘤方向,E-mail:874060114@。
[2017ASCO]Alter0303开启安罗替尼晚期非小细胞肺癌三线治疗新篇章
![[2017ASCO]Alter0303开启安罗替尼晚期非小细胞肺癌三线治疗新篇章](https://img.taocdn.com/s3/m/ee1ee8c47d1cfad6195f312b3169a4517623e578.png)
[2017ASCO]Alter0303开启安罗替尼晚期非小细胞肺癌三线治疗新篇章ASCO2017美国·芝加哥随着传统化疗的发展,以及靶向治疗和免疫治疗的研发和应用于临床,晚期非小细胞肺癌(NSCLC)的一线、二线治疗取得了重要进展,患者的生存也随之获得了改善。
然而,对于一线、二线治疗失败的晚期NSCLC患者而言,多数患者一般状况仍较好,能耐受抗肿瘤治疗。
如果这些患者能有机会接受有效的三线治疗,则有望进一步延长总生存。
令人遗憾的是,在现今,晚期NSCLC的三线治疗手段较为有限,且疗效不足和无统一标准,因此在临床上存在着巨大的未被满足的需求。
为填补这一空白,小分子多靶点TKI的开发成为了重要的探索方向。
尽管在既往,索拉非尼、舒尼替尼和帕唑帕尼等小分子多靶点TKI在晚期NSCLC三线治疗中均告失败,但这一方向的探索并未停止。
正大天晴药业历经多年研究之后,终于成功开发出新型小分子多靶点TKI—安罗替尼,为晚期NSCLC三线治疗带来了突破。
韩宝惠教授安罗替尼III期研究(ALTER 0303)成功达到主要终点安罗替尼是一种口服的新型小分子多靶点TKI,可强效抑制VEGFR、PDGFR、FGFR和c-Kit 等多个靶点,具有抗肿瘤血管生成和抑制肿瘤生长的作用。
安罗替尼用于晚期NSCLC三线治疗的I期、II 期研究相继获得成功之后,上海交通大学附属胸科医院韩宝惠教授和天津市肿瘤医院李凯教授共同作为主要研究者,开展了III期研究(ALTER 0303)。
这是一项全国多中心、随机、双盲、安慰剂对照III 期研究,旨在评价安罗替尼作为晚期NSCLC三线治疗的疗效和安全性。
该研究的主要终点为OS。
点击查看高清Poster在2017年6月2日~6日召开的ASCO年会上,ALTER 0303的研究结果隆重公布,并引发了广泛关注。
ALTER 0303研究纳入了437例既往至少接受过两次全身化疗的晚期NSCLC患者,患者随机接受安罗替尼(n=294)或安慰剂(n=143)治疗,直至疾病进展或不可耐受的毒性。
安罗替尼填补晚期肺癌三线治疗空白

安罗替尼填补晚期肺癌三线治疗空白编译:肿瘤资讯编辑部来源:肿瘤资讯肺癌治疗日新月异,但国内外的肺癌三线治疗尚无标准规范。
随着2017年ASCO会议上ALTER0303试验的公布,这一空白将被填补,安罗替尼将成为我国NSCLC三线治疗的新标准。
《肿瘤资讯》特邀国内肺癌领域的名家,共同探讨肺癌的三线治疗及安罗替尼未来的研究方向,详见下文。
指南尚无NSCLC三线治疗标准,这一迫切的临床需求亟待满足黄诚教授:晚期非小细胞肺癌的治疗需要分成有驱动基因阳性和没有驱动基因阳性两大类,治疗策略有所不同:1. 对于驱动基因阳性的晚期非小细胞肺癌患者,首选靶向治疗,二线选择化疗或者根据耐药机制治疗,三线尚处于探索性治疗阶段;2. 对于驱动基因阴性的晚期非小细胞肺癌患者,国内标准治疗仍然是化学治疗为主,一线化疗失败后,二线仍然以化疗作为标准治疗。
但二线化疗的总有效率非常低,在10%左右,三线及三线以后的治疗尚无标准。
3. 可以看出一线、二线治疗已有标准化方案,很多新药的研发进入探索性三线治疗阶段。
如果三线探索性治疗相关研究能在取得一定疗效,那么即有可能进入二线、甚至一线的探索。
这是肿瘤治疗药物作为一线、二线到三线治疗基本策略。
熊建萍教授:近20余年来,肺癌治疗发生翻天覆地的变化,可谓引领整个恶性肿瘤治疗领域的进展。
不断更新的肺癌临床研究证据促使NCCN指南不断的更新,目前NCCN指南已更新至第9版,但是仍然聚焦于一线及二线治疗。
目前指南中一线二线的治疗药物基本被TKIs、化疗药物、免疫治疗分割。
其中靶向治疗部分指南更新最多,各项研究目的在于探索如何进一步提高客观缓解率。
免疫治疗部分更新也非常迅速,一线、二线使用免疫抑制剂可以为患者带来生存获益,但如何定义PD-L1高表达的cut off值尚存争议。
相对而言,后线治疗的进展令人遗憾,第九版NCCN指南并未就此进行更新。
一线、二线药物治疗标准化使得更多患者有机会进入三线及以后的治疗,因而,后线治疗方案的更新显得愈发迫切。
盐酸安罗替尼在常见恶性肿瘤中的研究进展

综述 讲座 盐酸安罗替尼在常见恶性肿瘤中的研究进展张娜㊀佟旭㊀王大鹏㊀李义强㊀周煜ʌ摘要ɔ㊀安罗替尼是我国研发的具有自主知识产权的一种新型小分子多靶点酪氨酸激酶抑制剂ꎬ可强效抑制多个靶点ꎬ具有抗肿瘤血管生成和抑制肿瘤生长的作用ꎮⅡ/Ⅲ期临床试验显示安罗替尼在非小细胞肺癌㊁软组织肉瘤㊁甲状腺髓样癌㊁食管鳞癌㊁肾癌㊁结直肠癌等多种实体瘤患者也有明显治疗效果ꎬ且安罗替尼具有可控毒性㊁长循环和广谱抗肿瘤的潜力ꎬ安全性及耐受性良好ꎮ本文就安罗替尼在体内和体外研究进展进行综述ꎮʌ关键词ɔ㊀安罗替尼ꎻ㊀酪氨酸激酶抑制剂ꎻ㊀抗血管生成ꎻ㊀恶性肿瘤[中图分类号]R730.5㊀[文献标识码]A㊀DOI:10.3969/j.issn.1002-1256.2019.23.036Researchprogressofanlotinibhydrochlorideincommonmalignanttumors㊀ZHANGNa.㊀JiamusiuniversityꎬJiamusiꎬHeilongjiangꎬ154000ꎬChina.ʌAbstractɔ㊀Anlotinibisanewtypeofsmallmolecularmulti-targettyrosinekinaseinhibitorwithindependentintellectualpropertyrightsdevelopedinChina.Itcaninhibitmultipletargetsstronglyꎬandhastheeffectofanti-tumorangiogenesisandinhibitingtumorgrowth.PhaseⅡ/Ⅲclinicaltrialsshowthatanlotinibnotonlyhadeffectinnon-smallcelllungcancerꎬbutalsohaveobvioustherapeuticeffectinsofttissuesarcomasꎬmyeloidthyroidcarcinomaꎬesophagealsquamouscellcarcinomaꎬrenalcellcarcinomaꎬcolorectalcancerandothersolidtumorpatients.Inadditionꎬanlotinibhascontrolledtoxicityꎬlongcirculationandbroad-spectrumantitumorpotentialꎬwithwellsafetyandtolerance.Thisarticlereviewstheresearchprogressofanlotinibinvivoandinvitro.ʌKeywordsɔ㊀Anlotinibꎻ㊀Tyrosinekinaseinhibitorꎻ㊀Antiangiogenesisꎻ㊀Malignanttumor㊀㊀盐酸安罗替尼(AnlotinibHydrochlorideꎬAL3818)是我国自主研发和具有自主知识产权的1类创新药物ꎬ2007年取得化合物专利ꎬ2011年临床获得审批ꎬ2013年完成Ⅰ期临床试验ꎬ2014年美国(IND)获批ꎬ2015 2017年临床上市ꎮ安罗替尼是一种新型小分子多靶点酪氨酸激酶抑制剂(tyrosinekinaseinhibitorꎬTKI)ꎬ可强效抑制血管内皮生长因子受体(vascularendothelialgrowthfactorꎬVEGFR)ꎬ血小板衍生生长因子受体(platelet-derivedgrowthfactorreceptorꎬPDGFR)ꎬ成纤维细胞生长因子受体(fibroblastgrowthfactorreceptor2ꎬFGFR)和干细胞因子受体(c-Kit)等多个靶点ꎬ具有抗肿瘤血管生成和抑制肿瘤生长的作用[1 ̄2]ꎮ美国食品药品管理局(FoodandDrugAdministrationꎬFDA)在2015年批准其治疗卵巢癌孤儿药资格认定ꎬ在多个癌症适应症的临床研宄中表现出有效的趋势ꎮALTER0302和ALTER0303临床研究显示安罗替尼作为三线治疗方案在难治性㊁复发进展的非小细胞肺癌(non-smallcelllungcancerꎬNSCLC)治疗中能够同时带来总生存时间(OverallSurvivalꎬOS)和无进展生存期(ProgressionFreeSurvivalꎬPFS)的双重获益ꎬ是目前我国唯一单药对晚期NSCLC有效的血管靶向药[3 ̄4]ꎮ目前多种癌症相关临床试验正在进行中ꎬ临床Ⅱ㊁Ⅲ期研究显示ꎬ安罗替尼对㊀㊀作者单位:154000黑龙江佳木斯ꎬ佳木斯大学(张娜)ꎬ161000黑龙江齐齐哈尔ꎬ齐齐哈尔医学院附属第三医院放疗科(佟旭㊁王大鹏)ꎬ154000黑龙江佳木斯ꎬ佳木斯大学附属第一医院肿瘤科(李义强㊁周煜)㊀㊀通信作者:佟旭ꎬEmail:11517519@qq.comNSCLC㊁甲状腺髓样癌㊁食管鳞癌㊁软组织肉瘤㊁肾癌㊁结直肠癌等多种实体瘤患者也有明显治疗效果[5 ̄7]ꎮ本文就安罗替尼在临床和体外实验中的研究结果及进展进行综述ꎮ一㊁作用机制㊁安全性及药物动力学1.作用机制:肿瘤细胞分泌血管生成细胞因子ꎬ可诱导内皮细胞进行迁移及管腔的形成ꎬ进而产生新生血管ꎮ与肿瘤血管生成关系最为紧密的是VEGFR-2所介导的信号通路ꎬ因而目前的抗血管生成靶向药物多以VEGFR-2作为主要靶点[8 ̄9]ꎮ其中VEGF在多数癌症中均有表达ꎬ尤其是VEGFAꎮVEGFA与内皮细胞表达的VEGFR2具有很高的亲和力ꎬ两者的结合能激活酪氨酸激酶受体ꎬVEGFR2的磷酸化触发一个下游通路网络ꎬ促进内皮细胞的增殖㊁存活和迁移ꎮ与VEGF相似ꎬ成纤维细胞生长因子2(FGF-2)和血小板衍生生长因子BB(PDGF-BB)在肿瘤血管生成中起促血管生成因子的作用ꎮFGF-2触发FGF受体1(FGFR1)的自磷酸化ꎬ并激活下游信号级联ꎬ诱导血管生成ꎮPDGF-BB结合受体PDGF受体β(PDGFRβ)调节肿瘤血管生成ꎬ增长和转移ꎮLin[10]等发现安罗替尼可以强烈抑制血管新生相关VEGFR㊁PDGFR和FGFR所介导的下游信号通路ꎬ从而干预内皮细胞的增殖㊁迁移及形成管腔的能力ꎬ抑制微小血管的形成ꎬ并且能通过c-Kit激酶干预肿瘤细胞自身的多个生物学过程ꎮShen[11]等临床研究也表明ꎬ安罗替尼能使内皮细胞中VEGF/PDGF-BB/FGF-2诱导细胞迁移和毛细血管形成的能力降低ꎬ且安罗替尼在体内和体外均显著抑制VEGF/PDGF-BB/FGF-2诱导的血管生成ꎮ靶向药物作用的靶点在肿瘤细胞上出现高表达和特异性表达ꎬ但在正常组织不表达或低表达ꎬ所以相对于细胞毒性药物而言ꎬ其出现不良反应机率较少ꎬ抗肿瘤作用相对较高ꎬ对正常组织无损伤或损伤较轻ꎬ疗效显著ꎬ明显改善了患者生存质量[12]ꎮ2.安全性及药物动力学:Sun[13]等通过临床研究评估了安罗替尼在难治性晚期实体肿瘤患者中的应用ꎬ主要目的是通过确定剂量限制性毒性(DLT)㊁最大耐受量(MTD)㊁推荐的Ⅱ期剂量和计划来建立安罗替尼的安全性ꎮ次要目的包括单剂量和多剂量口服安罗替尼的药代动力学的描述和初步抗肿瘤效果的评估ꎮ本研究纳入未接受标准治疗的有病理和/或细胞学证实的晚期癌症患者ꎮ试验患者入选标准为:18~65岁㊁ECOGPS0-1㊁预估生存时间超过3个月ꎻ既往其他化疗药物患者至少停30天㊁手术患者休息至少4周ꎻ血液检测正常ꎬ无主要器官功能障碍ꎮ患者口服安罗替尼(5~16mgꎬ每日一次)ꎮ分为两组连续口服4周(4/0)或口服2周停药1周(2/1)ꎮ依据推荐剂量和时间表被进一步纳入扩大队列研究的患者共21例ꎮ所有患者均进行药代动力学采样ꎬ初步评估肿瘤反应ꎮ结果显示:在4/0中10mg时DLT为3级高血压ꎬ2/1中16mg时DLT为3级高血压和3级疲劳ꎮ药代动力学表明ꎬ安罗替尼有较长的药物半衰期ꎬ且在多次服药过程中累积增加ꎮ每天12mg可作为2/1方案扩大研究的最大耐受剂量ꎮ对21例(结肠腺癌㊁非小细胞肺癌㊁肾透明细胞癌㊁甲状腺髓样癌㊁软组织肉瘤)患者中20例进行了抗肿瘤活性评估:PR患者3例ꎬSD患者14例ꎬPD患者3例ꎬ肿瘤负荷缩小患者12例ꎮ本实验中最常见的不良反应为手足皮肤反应ꎬ高血压ꎬ疲劳ꎬ脂肪酶升高等ꎬ但其所有不良反应都是可控的ꎮ结果表明安罗替尼有可控毒性㊁长循环和广谱抗肿瘤的潜力ꎬ通过对症治疗或调低药物治疗计量等方式得到有效控制ꎬ对多种实体瘤治疗有效ꎬ值得进一步研究ꎮ二㊁体外实验研究进展1.肺癌:宋永安[14]等通过CCK8法㊁流式细胞术㊁划痕实验和Transwell实验ꎬ研讨了安罗替尼对肺癌A549细胞增殖㊁迁移和侵袭的影响ꎮ结果显示:经安罗替尼处理后ꎬA549细胞的增殖能力降低(P<0.05)ꎬ细胞凋亡比例增高(P<0.05)ꎬ细胞迁移率降低(P<0.05)ꎬ穿过Transwell小室膜的A549细胞数减少(P<0.05)ꎬ其侵袭能力受抑制ꎮ通过此项实验可表明安罗替尼作用于A549细胞后ꎬ能明显抑制其细胞增殖㊁迁移和侵袭的能力ꎬ并促进细胞凋亡ꎮ2.甲状腺癌:Ruan[15]等分别选取了3株PTC细胞系(BCPAP㊁k1和IHH4)和ATC细胞系(8505C㊁CAL-62和BHT-101)作为研究对象ꎬ研究了安罗替尼对甲状腺癌细胞的体外和体内作用ꎮ通过MTT测定㊁细胞周期与凋亡分析㊁Western㊁RNA干扰㊁体内致瘤试验和免疫组化等方法测定安罗替尼对甲状腺癌的抗肿瘤作用及机制ꎮ试验结果显示: (1)安罗替尼能有效抑制PTC和ATC细胞的活性ꎬ且PTC细胞对安罗替尼的敏感性略高于ATC细胞ꎮ(2)对BCPAP和8505C细胞具有抗增殖作用ꎬ且呈剂量依赖性ꎮ(3)能诱导甲状腺细胞G2/M期阻滞ꎮ但安罗替尼对甲状腺细胞的抗增殖作用不是通过阻断BRAF/MEK/ERK途径而发挥的ꎮ(4)对甲状腺癌细胞凋亡相关蛋白TP53㊁Caspase3和PARP的表达水平进行检测ꎬ结果显示安罗替尼对TP53的表达及凋亡标记物Caspase3和PARP的裂解呈剂量依赖性ꎮ因此ꎬ安罗替尼可能通过激活TP53途径诱导甲状腺癌细胞凋亡ꎮ(5)可能干扰F-肌动蛋白的形成ꎬ以抑制细胞迁移ꎮ(6)可以提高甲状腺癌异种移植鼠体内TP53和Caspase3的表达水平ꎬ抑制甲状腺肿瘤的生长ꎮ试验数据表明ꎬ安罗替尼可通过抑制细胞生长㊁诱导凋亡和抑制细胞迁移而对甲状腺癌发挥抗肿瘤作用ꎬ且安罗替尼对多种甲状腺癌均有抑制作用ꎬ在体内也可抑制肿瘤细胞的生长ꎮ3.肝癌:杨斌[16]等将系列浓度的安罗替尼以及作为对照组的索拉菲尼和舒尼替尼作用于人肝内胆管细胞癌细胞系HCCC-9810ꎬ通过MTT法检测药物对细胞的杀伤作用并计算抑制率和半数抑制浓度(IC50)ꎬTranswell实验检测药物对HCCC-9810细胞转移和侵袭的影响ꎮ结果表明:(1)安罗替尼能明显抑制HCCC-9810细胞的存活ꎬ而索拉菲尼和舒尼替尼活性较弱ꎮ(2)IC50(1μmol/L)的安罗替尼和相同浓度的索拉菲尼㊁舒尼替尼相比ꎬ安罗替尼能显著抑制HCCC-9810细胞的转移与侵袭作用ꎬ而索拉菲尼和舒尼替尼则无明显抑制作用ꎮ这一研究为肝脏胆管细胞癌治疗带来新的曙光ꎬ也说明安罗替尼在临床应用中有更广阔的前景ꎮ三㊁临床试验研究进展及应用效果1.肺癌:非小细胞肺癌:ALTER0302[3]临床试验采用随机㊁双盲的方法从中国13家医院招募了符合入选标准的117例患者进行分析ꎬ患者随机1ʒ1接受安罗替尼或安慰剂治疗ꎬ直至病情进展㊁不可接受的毒性反应㊁患者同意退出治疗或死亡ꎮ安罗替尼采用2/1方案进行服药ꎮ结果显示:60.7%的患者未接受免疫检查点抑制剂治疗ꎬ表皮生长因子受体状态不明ꎮ安罗替尼组与安慰剂组相比ꎬ其PFS为4.8个月vs1.2个月(P<0.0001)ꎬORR(P<0.05)ꎮ两组OS分别为9.3个月和6.3个月ꎮ安罗替尼组不良事件比安慰剂组更频繁ꎬ其3~4级治疗相关不良事件(TRAES)发生率为21.67%ꎮ说明与安慰剂组相比ꎬ安罗替尼作为三线治疗方案对难治性晚期非小细胞肺癌患者的PFS有明显的改善作用ꎬ且毒副反应可耐受ꎮLTER0303[4]临床试验采用相同方法ꎬ对安罗替尼治疗复发进展的NSCLC的疗效及安全性进行分析ꎮ入组患者为ⅢB/Ⅳ期NSCLC患者ꎬ既往至少接受过两种化疗方案治疗ꎬ且EGFR/ALK阳性患者必须接受过相应靶向治疗后耐药或不能耐受ꎮ共437例患者被随机分为安罗替尼组(294例)和安慰剂组(143例)ꎬ安罗替尼按2/1方案治疗ꎮ主要终点为OSꎬ次要终点为PFS㊁ORR㊁DCRꎮ结果显示:安罗替尼组与安慰剂组比较ꎬOS延长3.3个月(9.6vs6.3个月ꎬP<0.05)ꎻPFS延长4.0个月(5.4vs1.4个月ꎬP<0.0001)ꎻORR(9.2%vs0.7%ꎬP<0.0001)ꎬDCR(81.0%vs37.1%ꎬP<0.0001)ꎬ有统计学意义ꎮ试验结果表明ꎬ与安慰剂组相比ꎬ安罗替尼组治疗效果更好ꎮ基于以上两项研究说明ꎬ我国自主研发安罗替尼的成功ꎬ为患者和临床医生提供了一个有力的治疗选择方案ꎮ小细胞肺癌:ChengY[17]通过一项随机㊁双盲㊁安慰剂对照㊁多中心Ⅱ期临床试验ꎬ研究了安罗替尼对照安慰剂三线及三线以上治疗SCLC的临床效果ꎮ主要入组18~75岁㊁经病理学证实的㊁既往接受至少两种化疗方案失败的局限期或广泛期SCLC患者ꎮ共纳入我国11家中心的120例入组患者(2017年3月 2018年5月)ꎬ按2ʒ1随机分为安罗替尼组(n=82)和安慰剂组(n=38)ꎬ1例患者因诊断有误未纳入分析ꎬ按照分期和复发类型进行分层ꎮ主要终点为PFSꎬ次要终点为OS㊁ORR㊁DCR㊁生活质量㊁安全性和耐受性ꎮ到2018年6月30日为止ꎬ统计数据发现ꎬ安罗替尼组与安慰剂组相比ꎬ其PFS显著延长(4.1个月vs0.7个月ꎬHR=0.19ꎻ95%CI:0.12~0.32ꎻP<0.01)ꎬ有统计学意义ꎮORR(4.9%vs2.6%ꎬP>0.05)ꎬ无统计学意义ꎮ安罗替尼组DCR显著提高(71.6%vs13.2%ꎬP<0.0001)ꎬ有统计学意义ꎮ安全性方面ꎬ安罗替尼组TRAES的发生率高于安慰剂组(87.7%vs74.4%ꎬP<0.05)ꎮ最常见的不良事件包括乏力㊁高血压㊁厌食㊁手足综合征等ꎮ3-4级TRAEs的发生率安罗替尼组和安慰剂组分别是29例(35.8%)和6例(15.4%)ꎮ结果表明安罗替尼有与其他肿瘤相似的的不良事件ꎬ其耐受性较好ꎬ临床易于管理ꎮ根据此项研究结果ꎬ安罗替尼可作为SCLC患者三线及以上治疗的新选择ꎬ将来可进一步探索安罗替尼在SCLC一线㊁维持治疗及联合治疗中的应用ꎮ2.甲状腺癌:Sun[18]等进行了安罗替尼治疗局部晚期或转移性髓样甲状腺癌(MTC)患者的Ⅱ期研究试验ꎬ给予无法切除的局部晚期或转移MTC患者每日口服安罗替尼12mgꎬ2周/1周休息ꎬ直至病情进展㊁死亡或不可接受的毒性反应ꎬ根据观察毒性反应调整剂量ꎮ主要终点为PFSꎮ结果显示:入组共58例患者ꎬ分析时没有达到主要终点PFSꎬ56.9%的患者出现了部分反应ꎬ48周时PFS为85.5%ꎬ其中45例患者血清降钙素较基线明显下降50%ꎮ说明安罗替尼在局部晚期或转移性MTC中表现出持久的抗肿瘤活性和可控的不良反应ꎬ可以为晚期或转移性MTC患者提供一种新的有效的治疗方案ꎮ3.肉瘤:龙作尧[19]等对17例晚期进展性肉瘤患者进行了临床疗效观察的回顾性研究ꎮ对患者进行评估后ꎬ采用2/1方案口服安罗替尼ꎬ有手术指征者先行手术治疗ꎬ术后服药ꎬ直至肿瘤进展或无法耐受毒副作用ꎮ根据肿瘤体积和内部影像学变化评价用药效果ꎬCTCAE4.03评价不良反应ꎮ结果显示:无CRꎬPR患者2例(11.76%)ꎬSD患者11例(64.70%)ꎬPD患者4例(23.54%)ꎬORR为11.76%ꎬDCR为76.46%ꎮ常见不良反应:食欲减退(35.29%)ꎬ乏力(23.54%)ꎬ高血压(11.76%)ꎮ刘佳勇[20]等收集了2015年6月 2017年3月在北京肿瘤医院骨与软组织肿瘤科参加安罗替尼治疗晚期软组织肉瘤Ⅱb临床试验的患者ꎬ按2ʒ1随机分为安罗替尼组和安慰剂组ꎬ主要研究终点为PFSꎬ次要研究终点为DCR㊁OS和安全性ꎮ其中安罗替尼组28例ꎬ安慰剂组11例ꎮ结果示:安罗替尼组中PR患者4例ꎬ安慰剂组无PR患者ꎬ两组SD患者分别为13例和3例ꎬ其DCR接近统计学差异(P=0.082)ꎬ其中安罗替尼组中腺泡状软组织肉瘤的DCR为78.6%(11/14)ꎻ两组的mPFS分为12.4个月和4.0个月(P<0.05)ꎬ有统计学意义ꎻ两组的OS分别为19.4个月和17.6个月(P=0.961)ꎬ无显著性差异ꎮ安全性方面ꎬ安罗替尼组治疗相关不良事件(TRAES)的发生率高于安慰剂组(87.7%和74.4%ꎬP<0.05)ꎮ最常见的不良事件包括乏力㊁高血压㊁厌食㊁手足综合征等ꎮ3~4级TRAEs的发生率安罗替尼组和安慰剂组分别是29例(35.8%)和6例(15.4%)ꎮ结果表明安罗替尼有与其他肿瘤相似的的不良事件ꎬ其耐受性较好ꎬ临床易于管理ꎮ根据此项研究结果ꎬ安罗替尼可作为SCLC患者三线及以上治疗的新选择ꎬ将来可进一步探索安罗替尼在SCLC一线㊁维持治疗及联合治疗中的应用ꎮ4.肾癌:Zhou[21]等采用单臂㊁多中心的研究方法ꎬ进行了二线治疗肾癌的Ⅱ期临床研究ꎬ初步评价了安罗替尼胶囊对经TKI靶向药物治疗无效或不耐受的晚期肾细胞癌患者的有效性和安全性ꎬ研究摘要被纳入2016年ASCOꎮ研究纳入了43例既往接受过索拉菲尼或舒尼替尼治疗后病情进展或不能耐受的患者(透明细胞为主)ꎬ按2/1方案给药ꎮ结果显示:mPFS为11.8个月ꎮ同时亚组分析发现:入组前接受过索拉菲尼或舒尼替尼治疗后病情进展的患者的mPFS为8.5个月ꎮ入组前无法耐受索拉菲尼或舒尼替尼患者的mPFS未达到ꎮ试验证明:安罗替尼二线治疗效果优于索拉菲尼㊁阿西替尼且未接受过舒尼替尼或索拉菲尼治疗的肾癌患者获益更大ꎮ研究结果显示ꎬ安罗替尼的药物不良事件主要级别为1/2级ꎮ其中3/4级不良事件主要有:淋巴细胞减少(7.1%)㊁高血压(4.8%)和甲状腺功能减退(4.8%)ꎮ随后Zhou[22]等又进行了一线治疗肾癌的Ⅱ期临床研究ꎬ试验通过与阳性药物舒尼替尼胶囊进行对照ꎬ来评价安罗替尼胶囊治疗晚期肾细胞癌患者的有效性和安全性ꎮ患者入选标准与安罗替尼二线治疗肾癌的Ⅱ期临床研究相同ꎮ研究入组患者共133例ꎬ按照随机试验2ʒ1比例分配ꎮ其中90例(男66例ꎬ女24例)患者口服安罗替尼ꎬ12mgꎬqdꎬ连服2周停药1周ꎮ另43例(男34例ꎬ女9例)患者口服舒尼替尼ꎬ50mgꎬqdꎬ连用4周停药2周ꎮ结果显示:安罗替尼组和舒尼替尼组PFS相似(11.3个月vs11个月ꎬP=0.30)ꎬORR(24.4%vs23.3%)和6周DCR97.8%vs93.0%ꎬP=0.33)差异均无统计学意义ꎮ5.腹腔增生性小圆细胞瘤:Chen[23]等报告了1例安罗替尼在腹腔增生性小圆细胞肿瘤(IADSRCT)中的应用ꎮ1例38岁男性患者在2017年10月26日因前腹壁结节1月余就诊ꎬ体格检查示:结节质地坚硬ꎬ边界不清ꎬ活动度低ꎬ实验室评价结果正常ꎮ腹部CT示:右侧腹壁皮下软组织结节1.3cmˑ1.5cmꎬ腹腔囊性密度为9.9cmˑ8.7cmꎮ2017年11月进行腹腔镜肿瘤切除ꎬ病理结果诊断为IADSRCTꎮ免疫组化结果示:AE1/AE3㊁desmin㊁NSE㊁Ck7㊁CD34㊁CD99阳性ꎬCD56㊁GATA3㊁Syn部分阳性ꎮp63㊁CK5/6㊁P40㊁S100㊁CD31㊁Ki-67染色阴性ꎬ增殖指数为40%ꎮ术后2017年12月-2018年4月接受6周期化疗(异环磷酰胺3.6mgˑ5dꎬ阿霉素脂质体60mgˑ1d)作为辅助治疗ꎮ2018年5月ꎬCT扫描显示右腹股沟淋巴结和网膜淋巴结转移ꎮ肿大淋巴结大小分别为29.3mmˑ19.8mm和9.5mmˑ8.6mmꎮ2018年6月1日口服安罗替尼ꎬ12mgꎬqdꎬ2周/1周休息ꎮ两次治疗后ꎬ右腹股沟淋巴结和网膜淋巴结分别缩小为17.8mmˑ14.9mm和8.9mmˑ7.9mmꎬ疗效评定为SDꎬ四次治疗后淋巴结大小进一步缩小ꎬCT扫描显示SDꎮ目前为止ꎬ患者接受额外1周期的治疗ꎮ副作用为高甘油三酯和疲劳ꎬ但其毒性可控ꎬ耐受性强ꎮ由此可见安罗替尼应用于IADSRCT是有效的ꎬ但还有待进一步研究ꎮ㊀㊀总结㊀安罗替尼作为一种新型的多靶点小分子酪氨酸激酶抑制剂ꎬ可高度选择性抑制VEGFR2㊁PDGFR㊁FGFR和c-Kit等靶点ꎬ阻断其下游信号传导从而发挥高效的抗肿瘤血管生成与肿瘤生长作用ꎬ在多种实体肿瘤中有明显的作用效果ꎬ且已展现其安全性及有效性ꎬ尤其是作为晚期NSCLC的三线治疗已形成专家共识ꎮ在小细胞肺癌㊁软组织肉瘤及甲状腺癌等临床试验中也取得了较好的治疗效果ꎬ并获得了临床医师的认可ꎮ安罗替尼最常见的不良反应为高血压㊁手足皮肤反应㊁疲劳㊁脂肪酶升高等ꎬ但所有不良反应都是可控的ꎬ并且具有可控毒性㊁长循环和广谱抗肿瘤的潜力ꎬ可通过对症治疗或调低药物治疗计量等方式得到有效控制ꎮ目前安罗替尼联合化疗药物治疗肺癌也取得了明显的治疗效果[24 ̄25]ꎮ但尚无安罗替尼联合其他靶向药物㊁放疗㊁免疫治疗或其他抗肿瘤治疗的研究报道ꎬ其联合后对实体肿瘤治疗效果是否明显增加仍有待进一步研究ꎮ我们期待安罗替尼能在更多种类的实体瘤中进行其相关的基础研究及临床研究ꎬ发现其更多的作用疗效ꎬ为肿瘤患者的治疗带来新的曙光ꎮ参㊀考㊀文㊀献[1]㊀XieCꎬWanXꎬQuanHꎬetal.Preclinicalcharacterizationofanlotinibꎬahighlypotentandselectivevascularendothelialgrowthfactorreceptor-2inhibitor[J].CancerSciꎬ2018ꎬ109(4):1207 ̄1219.[2]㊀TaurinSꎬYangCHꎬReyesMꎬetal.Endometrialcancersharboringmutatedfibroblastgrowthfactorreceptor2proteinaresuccessfullytreatedwithanewsmalltyrosinekinaseinhibitorinanorthotopicmousemodel[J].IntJGynecolCancer.2018ꎬ28(1):152 ̄160. [3]㊀HanBꎬLiKꎬZhaoYꎬetal.Anlotinibasathird-linetherapyinpatientswithrefractoryadvancednon-small-celllungcancer:amulticentreꎬrandomisedphaseⅡtrial(ALTER0302)[J].BrJCancerꎬ2018ꎬ118(5):654 ̄661.[4]㊀HanBꎬLiKꎬWangQꎬetal.Third-linetreatment:arandomizedꎬdouble-blindꎬplacebo-controlledphaseⅢALTER-0303study-efficacyandsafetyofanlotinibtreatmentinpatientswithrefractoryadvancedNSCLC[J].JClinOncolꎬ2017ꎬ35:9053. [5]㊀EttingerDSꎬWoodDEꎬAisnerDLꎬetal.Non-smallcelllungcancerꎬversion5.2017ꎬNCCNclinicalpracticeguidelinesinoncology[J].JNatlComprCancNetwꎬ2017ꎬ15(4):504 ̄535. [6]㊀HanBHꎬLiKꎬWangQMꎬetal.EffectofAnlotinibasaThird-LineorFurtherTreatmentonOverallSurvivalofPatientsWithAdvancedNon-SmallCellLungCancer:TheALTER0303Phase3RandomizedClinicalTrial[J].JAMAOncolꎬ2018ꎬ4(11):1569 ̄1575.[7]㊀王睿晴ꎬ张艳华.抗肿瘤分子靶向药物安罗替尼的临床研究进展[J].中国新药杂志ꎬ2018ꎬ27(23):2770 ̄2774. [8]㊀KochSꎬTuguesSꎬLiXꎬetal.Signaltransductionbyvascularendothelialgrowthfactorreceptors[J].BiochemJꎬ2011ꎬ437(2):169 ̄183.[9]㊀ScottAJꎬMessersmithWAꎬJimenoA.Apatinib:apromisingoralantiangiogenicagentinthetreatmentofmultiplesolidtumors[J].DrugsToday(Barc)ꎬ2015ꎬ51(4):223 ̄229.[10]㊀LinBꎬSongXꎬYangDꎬetal.AnlotinibinhibitsangiogenesisviasuppressingtheactivationofVEGFR2ꎬPDGFRβandFGFR1[J].Geneꎬ2018ꎬ654:77 ̄86.[11]㊀ShenGSꎬZhengFCꎬRenDFꎬetal.Anlotinib:anovelmulti-targetingtyrosinekinaseinhibitorinclinicaldevelopment[J].JHematolOncolꎬ2018ꎬ11(1):120.[12]㊀叶佳丹ꎬ余克富ꎬ朱斌ꎬ等.肿瘤靶向药物的分类与研究进展[J].药学进展ꎬ2018ꎬ42(5):351 ̄358.[13]㊀SunYKꎬNiuWꎬDuFꎬetal.Safetyꎬpharmacokineticsꎬandantitumorpropertiesofanlotinibꎬanoralmulti-targettyrosinekinaseinhibitorꎬinpatientswithadvancedrefractorysolidtumors[J].JHematolOncolꎬ2016ꎬ9(1):105.[14]㊀宋永安ꎬ张雪燕ꎬ徐志伟ꎬ等.安罗替尼对肺癌A549细胞增殖㊁迁移侵袭的影响[J].成都医学院院报ꎬ2018ꎬ14(3):281 ̄284ꎬ293.[15]㊀RuanXꎬShiXꎬDongQꎬetal.Antitumoreffectsofanlotinibinthyroidcancer[J].EndocrRelatCancerꎬ2019ꎬ26(1):153 ̄164. [16]㊀YangBꎬXieHꎬWangCPꎬetal.StudyonInhibitionofArotinibonHumanIntrahepaticCholangiocarcinomaCellLineHCCC-9810[J].DigDisSciꎬ2017ꎬ19(12):1389 ̄1391.[17]㊀ChengYꎬWangQꎬLiKꎬetal.Anlotinibasthird-lineorfurther-linetreatmentinrelapsedSCLC:amulticentreꎬrandomizedꎬdouble-blindphase2trial[J/OL].WCLCꎬ2018ꎬOA13.03[2019-02-22].https://www.clinicaloptions.com/oncology/conference-coverage/wclc-2018/capsule-summary-slidesets/oa13_03. [18]㊀SunYꎬDuFꎬGaoMꎬetal.AnlotinibfortheTreatmentofPatientswithLocallyAdvancedorMetastaticMedullaryThyroidCancer[J].Thyroidꎬ2018ꎬ11(28):1455 ̄1461.[19]㊀LongGZYꎬLuYJꎬLiMHꎬetal.AretrospectivestudyofadvancedprogressivesarcomatreatedbyAnlotinib[J].ChinJBoneJointꎬ2019ꎬ8(1):3 ̄9.[20]㊀JiayongLiuꎬZhengfuFanꎬShuLiꎬetal.Anlotinibhydrochloridecapsulesforadvancedsofttissuesarcoma:single-centerdataanalysisofastageⅡmulticenterclinicaltrial[J].ChinJClinOncolꎬ2018ꎬ45(20):1066 ̄1070.[21]㊀ZhouAPꎬBaiYꎬSongYꎬetal.Anlotinibinmetastaticrenalcellcarcinoma(mRCC)withapreviousanti-VEGFRTKI:PreliminaryresultsfromamulticenterꎬphaseⅡtrial[J].JClinOncolꎬ2016ꎬ34:16082 ̄16082.[22]㊀ZhouAPꎬMaJꎬBaiYꎬetal.Anlotinibversussunitinibasfirstlinetreatmentformetastaticrenalcellcarcinoma(mRCC):preliminaryresultsfromarandomizedphaseⅡclinicaltria[J].JClinOncolꎬ2016ꎬ34(15Suppl):4565.[23]㊀ChenHMꎬFengG.Useofanlotinibinintra-abdominaldesmoplasticsmallroundcelltumors:acasereportandliteraturereview[J].OncoTargetsTherꎬ2019ꎬ12:57 ̄61.[24]㊀余双ꎬ杨树仁ꎬ王海兰ꎬ等.安罗替尼联合多西他赛二线治疗晚期肺腺癌的有效性及安全性分析[J].当代医学ꎬ2019ꎬ25(25):131 ̄132.[25]㊀MengLXꎬZengQQꎬMengQꎬetal.Comparisonofanlotinibversusbevacizumabcombinedwithpaclitaxelandcarboplatinintreatmentofadvancedlungadenocarcinoma[J].ChinaMedicineꎬ2019ꎬ14(8):1164 ̄1168.(收稿日期:2019 ̄05 ̄29)(本文编辑:卜明)。
安洛替尼ALTER研究培训课件

2(1.40%) 20(13.99%)
4(2.80%)
安罗替尼组(n=294)
151(51.36%) 143(48.64%) 66(22.45%) 84(28.57%)
25(8.50%) 3(1.02%) 32(10.88%) 7(2.38%)
治疗后肿瘤最佳疗效评价(FAS)
治疗后肿瘤最佳疗效评价(FAS)
最佳疗效 PR
SD缩小 SD变大
PD NE 合计 ORR(%, CR+PR) DCR(%, CR+PR+SD)
安罗替尼组 27 130 81 33 23 294
9.18(6.14, 13.08) 80.95(75.99, 85.28)
安慰剂组 1 12 40 74 16
本文档所提供的信息仅供参考之用,不能作为科学依据,请勿模仿;如有不当之处,请联系网站或本人删除。
汇报内容
1 ALTER 0303试验结果 2 亚组分析与疗效预测因素 3 总结
本文档所提供的信息仅供参考之用,不能作为科学依据,请勿模仿;如有不当之处,请联系网站或本人删除。
ALTER 0303试验结果
5.44 (3.14, 8.69)
0.7 (0.02,3.83)
p<0.0001
DCR(%,
CR+PR+SD)
80.27 (75.26, 84.67)
34.27 (26.54, 42.66)
p<0.0001
治疗后病灶出现空洞的情况
例数 95% CI
安罗替尼组 (n=294)
53 (18.03 %)
安罗替尼治疗软组织肉瘤数据解读

化合物专利
临床批 件
完成I 期
II期STS 临床
IIB期 STS临床
2007
2011
2013
20132015
20152017
盐酸 安罗替尼
NSCLC适 应症获批
STS、 SCLC适 应症获
批
2018
2019
STS:软组织肉瘤;NSCLC:非小细胞肺癌;SCLC:小细胞肺癌
1
福可维®三大作用机制
重塑肿瘤微环境,联合增效
8
研究结果—次要研究终点:ORR
病种
恶性纤维组织细胞瘤 脂肪肉瘤 平滑肌肉瘤 滑膜肉瘤 纤维肉瘤
腺泡状软组织肉瘤 透明细胞肉瘤 其他 合计
部分缓解人数
1 1 2 8 2 6 1 0 21
亚组总人数
19 13 26 47 18 13 7 23 166
客观缓解率(%)
5.3 7.7 7.7 17 11 46 14 0.0 13
7
研究结果—次要研究终点:PFS和OS
中位无进展生存期 mPFS (月)
mPFS 全分析集: 5.6月 95%CI (4.4-7.7 月) 数据截止 2016.7.6
中位总生存期 mOS (月)
mOS 全分析集: 12月 95%CI (11-16月) 数据截止 2016.7.6
经安罗替尼治疗的软组织肉瘤受试者的中位无进展生存期为5.6个月,中位总生存期为12个月
➢ 本研究不包括:横纹肌肉瘤(RMS),软骨肉瘤(CS),骨肉瘤(OS),尤因氏肉瘤(Ewing's sarcoma),隆起 皮肤纤维肉瘤(DFSP)和胃肠间质肉瘤(GIST)
Ref: Y. Chi, et al., Phase II study of anlotinib for treatment of advanced soft tissues sarcomas, Journal of Clinical Oncology, 34 (2016) 11005-11005.
安罗替尼对比多西他赛用于一线治疗失败后晚期非小细胞肺癌的疗效及安全性研究

㊀㊀ʌ摘要ɔ㊀目的㊀评价安罗替尼对比多西他赛用于一线治疗失败的晚期非小细胞肺癌(NSCLC)的疗效及安全性,探讨安罗替尼用于二线治疗晚期NSCLC的可行性㊂方法㊀收集2018年1月至2020年3月云南省肿瘤医院干部医疗科收治的60例晚期NSCLC患者,根据临床治疗方案不同均分为3组:安罗替尼组㊁多西他赛组及联合组,安罗替尼组口服安罗替尼治疗,多西他赛组静脉滴注多西他赛治疗,联合组采用口服安罗替尼和静脉滴注多西他赛联合治疗,观察3组患者的临床疗效㊁无进展生存期(PFS)及不良反应等,用Cox比例风险回归模型分析患者PFS的影响因素㊂结果㊀60例患者均达到治疗终点,未出现完全缓解病例,3组的稳定(SD)㊁进展(PD)及疾病控制率(DCR)差异均有统计学意义(P<0 05),安罗替尼组㊁联合组的SD㊁DCR均大于多西他赛组,PD小于多西他赛组,但3组的客观缓解率(ORR)差异无统计学意义(P>0.05)㊂安罗替尼组及联合组的中位PFS均优于多西他赛组(5.0㊁4.2个月vs.2.0个月),差异有统计学意义(P<0.05);安罗替尼组与联合组的中位PFS差异无统计学意义(P>0.05)㊂有吸烟史是影响患者PFS的危险因素㊂安罗替尼组和联合组最主要的不良反应均为乏力,分别有18例(90%)和16例(80%),多西他赛组最主要的不良反应是消化道反应(恶心呕吐)14例(70%)㊂结论㊀安罗替尼比多西他赛用于一线治疗失败的晚期NSCLC显示出治疗优势和可控制的毒性㊂ʌ关键词ɔ㊀安罗替尼;㊀多西他赛;㊀非小细胞肺癌;㊀疗效;㊀安全性doi:10.3969/j.issn.1674-4136.2021.02.015文章编号:1674-4136(2021)02-0177-05Efficacyandsafetyofanlotinibversusdocetaxelinadvancednon⁃smallcelllungcancerafterfirst⁃linetreatmentfailure㊀LIULiya,ZHUYing,TUChangling,JIANGBo.(DepartmentofCadreMedicalDivision,theThirdAffiliatedHospitalofKunmingMedicalUniversity/YunnanCancerHospital,Kunming650118,China)Correspondingauthor:JIANGBo,Email:jiangruonin1973@163.comʌAbstractɔ㊀Objective㊀Toevaluatetheefficacyandsafetyofanlotinibversusdocetaxelforadvancednon⁃smallcelllungcancer(NSCLC)thatfailedfirst⁃linetreatment,andtoexplorethefeasibilityofanlotinibforsecond⁃linetreatmentofadvancednon⁃smallcelllungcancer.Methods㊀Thisstudycollected60casesofpatientswithadvancedNSCLCdiagnosedandtreatedinthecadremedicaldepartmentofYunnanProvincialCancerHospitalfromJanuary2018toMarch2020,accordingtodifferentclinicaltreatmentplans,theyweredividedinto3groups:theanlotinibgroup,thedocetaxelgroup,thecombinedgroup;theanlotinibgroupreceivedoralanlotinibtreatment,andthedocetaxelgroupreceivedintravenousinfusionofdocetaxeltreatment;thecombinationgroupwastreatedwithoralanlotinibandintravenousinfusionofdocetaxeltreatment.Theclinicalefficacy,progression⁃freesurvival(PFS)andadversereactionsofthethreegroupswereobserved,andtheCoxproportionalhazardregressionmodelwasusedtoanalyzetheinfluencingfactorsofPFSinpatients.Results㊀All60patientsreachedtheendpointoftreatment,noneofthepatientsinthethreegroupshadcompleteremission.Thedifferencesinstability(SD),progression(PD),anddiseasecontrolrates(DCR)ofthethreegroupswerestatisticallysignificant(P<0.05).TheSDandDCRoftheanlotinibgroupandthecombinedgroupwerehigherthanthoseofthedocetaxelgroup,andthePDwaslessthandocetaxelgroup,buttheobjectiveresponserate(ORR)differenceofthe3groupswasnotstatisticallysignificant(P>0.05).themedianPFSoftheanlotinibgroupandthecombinationgroupwasbetterthanthatofthedocetaxelgroup(5.0,4.2monthsvs.2.0months),thedifferencewasstatisticalsignificance(P<0.05);themedianPFSdifferencebetweentheanlotinibgroupandthecombinationgroupwasnotstatisticallysignificant(P>0.05).SmokinghistoryisariskfactorofaffectingpatientswithPFS.Themostimportantadversereactionsintheanlotinibgroupandthecombinedgroupwerefatigue,with18cases(90%)and16cases(80%)respectively.Themainadversereactioninthedocetaxelgroupwasthedigestivetractreaction(nauseaandvomiting)14cases(70%).Conclusions㊀AnlotinibshowstherapeuticadvantagesandcontrollabletoxicitycomparedwithdocetaxelforadvancedNSCLCthatfailedfirst⁃linetreatment.ʌKeywordsɔ㊀Anlotinib;㊀Docetaxel;㊀Non⁃smallcelllungcancer;㊀Efficacy;㊀Safety㊀㊀肺癌目前是全球发病率㊁死亡率最高的癌症[1],而且大部分(56%)患者确诊时已经发生转移[2]㊂目前对于驱动基因阴性的晚期非小细胞肺癌(non⁃smallcelllungcancer,NSCLC)患者的二线化疗方案有培美曲赛㊁多西他赛㊁纳武单抗㊁帕博利珠单抗及阿特珠单抗㊂研究显示晚期NSCLC患者二线化疗使用培美曲赛与多西他赛的疗效相似,中位无进展生存期(progression⁃freesurival,PFS)为3 4个月,总生存期(overallsurvival,OS)不超过10个月[3⁃5]㊂随着免疫抑制剂的应用,对晚期NSCLC患者进行二线及以上化疗有了新的选择,但总体来说免疫抑制剂目前仍存在优势人群有限及价格昂贵等问题,因此仍需要积极探索有效的治疗药物以提高晚期NSCLC患者二线化疗的效果㊂抗血管生成药是治疗晚期NSCLC的有效药物,其中安罗替尼是我国自主研发的小分子多靶点抗血管生成受体酪氨酸激酶抑制剂(tyrosinekinaseinhibitor,TKI)㊂ALTER0303研究表明,与安慰剂相比,安罗替尼能显著提高NSCLC患者的中位PFS(5.4个月vs.1.4个月)及中位OS(9.6个月vs.6.3个月),证实安罗替尼在晚期NSCLC的三线化疗中能同时带来OS和PFS的双重获益[6],但目前关于安罗替尼应用于晚期NSCLC二线化疗的研究较少㊂本研究通过比较安罗替尼单药或联合多西他赛与多西他赛单用治疗一线化疗失败后的晚期NSCLC的效果,以期探讨安罗替尼单药或联合其他化疗药物用于二线治疗晚期NSCLC的可行性㊂1 资料与方法1.1㊀一般资料㊀收集2018年1月至2020年3月云南省肿瘤医院干部医疗科收治的晚期NSCLC患者60例㊂纳入标准:①年龄18 75岁;②ECOG体力评分0 2分;③预计生存期ȡ12周;④经组织学或细胞学确诊为NSCLC;⑤临床分期为ⅢA㊁ⅢB㊁ⅢC及Ⅳ期(本研究中ⅢA期指无手术或同步放化疗指征的患者),至少具有一个可测量病灶;⑥一线治疗失败的患者(包括按RECIST疗效评价标准评定为病情进展及不能耐受一线治疗不良反应者);⑦其他主要器官功能正常;⑧受试者自愿参加本研究,并签署知情同意书㊂排除标准:①病理类型为小细胞肺癌,包括小细胞癌与非小细胞癌混合的肺癌;②中央型有空腔的肺鳞癌或伴有咯血(>50ml/d)的患者;③肿瘤侵犯血管或经判断后续治疗期间有可能发生大咯血的患者;④存在任何出血体质或迹象的患者;⑤有脑转移症状的患者;⑥对研究药物成分过敏者;⑦目前存在无法口服研究药物的事件(如吞咽困难㊁慢性腹泻㊁肠梗阻等)㊂将入组的患者根据临床治疗方案不同均分为3个治疗组:安罗替尼组㊁多西他赛组及联合组,3组一般资料差异无统计学意义(P>0.05),见表1㊂1.2㊀治疗方案㊀①安罗替尼组:口服安罗替尼(正大天晴药业集团股份有限公司)12mg,1次/d,连续服药2周停1周为1个疗程㊂②多西他赛组:静脉滴注多西他赛(齐鲁制药厂)75 100mg/m2,第1天,每3周1次;治疗前1天开始口服糖皮质激素类药物地塞米松,4mg/次,2次/d,连续治疗3d㊂③联合组:口服安罗替尼12mg,1次/d,连续服药2周停1周;静脉滴注多西他赛60 75mg/m2,第1天,每3周1次;治疗前一天开始口服地赛米松,表1㊀3组患者一般资料比较㊀[n=20,例(%)]指标安罗替尼组多西他赛组联合组χ2值P值年龄1.6000.449㊀<60岁8(40)10(50)12(60)㊀ȡ60岁12(60)10(50)8(40)性别2.7270.256㊀男16(80)12(60)16(80)㊀女4(20)8(40)4(20)ECOG评分4.0190.134㊀010(50)12(60)16(80)㊀110(50)8(40)4(20)吸烟史4.0190.134㊀无4(20)8(40)10(50)㊀有(已戒)16(80)12(60)10(50)病理类型6.8650.089㊀鳞癌8(40)8(40)14(70)㊀腺癌10(50)12(60)6(30)㊀大细胞癌2(10)00临床分期3.8010.150㊀Ⅳ期8(40)14(70)12(60)㊀ⅢB期4(20)6(30)8(40)㊀ⅢA期6(30)00㊀ⅢC期2(10)00EGFR状态4.2000.122㊀阴性6(30)10(50)4(20)㊀状态不明∗14(70)10(50)16(80)注:EGFR为表皮生长因子受体;∗指患者未行EGFR基因检测4mg/次,2次/d,连续治疗3d㊂每2个疗程对各组进行1次疗效评价,患者肿瘤进展或出现不可耐受的不良反应即终止治疗,化疗总疗程不超过6个周期㊂1.3㊀疗效评价㊀采用实体瘤疗效评价新标准(RECIST)1.1版进行疗效评价㊂完全缓解(CR):所有靶病灶消失,任何病理性淋巴结(无论是否为靶病灶)的短径必须缩小至<10mm㊂部分缓解(PR):以基线的直径总和为参照,所有靶病灶的直径总和至少缩小30%㊂稳定(SD):既未出现足够的缩小符合PR,也未出现足够的增大而符合PD㊂进展(PD):以研究中直径总和的最小值(如果基线时总和值最小,则包括基线值)为参照,靶病灶直径的总和增加至少20%㊂除此以外,总和绝对值也必须证实增加至少5mm(若出现一个或多个新病灶也视为疾病进展)㊂客观缓解率(objectiveresponserate,ORR)=(CR+PR)/总数ˑ100%,疾病控制率(diseasecontrolrate,DCR)=(CR+PR+SD)/总数ˑ100%㊂1.4㊀统计学方法㊀应用SPSS22.0统计软件对数据进行分析㊂计数资料以例(%)表示,组间比较用χ2检验,用Kaplan⁃Meier法绘制生存曲线,Log⁃rank进行差异显著性检验;用Cox比例风险回归模型分析患者PFS的影响因素,P<0.05为差异有统计学意义,χ2检验两两比较时校正检验水准α=0.017㊂2 结果2.1㊀3组患者临床疗效比较㊀3组患者ORR差异无统计学意义(P>0.05),安罗替尼组㊁联合组的SD㊁DCR均大于多西他赛组,PD小于多西他赛组,差异有统计学意义(P<0.05),见表2㊂表2㊀3组患者临床疗效比较㊀㊀[n=20,例(%)]临床疗效安罗替尼组多西他赛组联合组χ2值P值CR0(0)0(0)0(0)0.0001.000PR2(10)4(20)6(30)2.4350.346SD18(90)a4(20)14(70)a21.667<0.001PD0(0)a12(60)0(0)a27.543<0.001ORR2(10)4(20)6(30)2.4350.346DCR20(100)a8(40)20(100)a27.543<0.001注:与多西他赛组比较,aP<0.052.2㊀3组患者生存情况比较㊀安罗替尼组㊁联合组的中位PFS分别为5.0个月[95%CI(3.91 6 08)]㊁4.2个月[95%CI(2.86 5.54)],均大于多西他赛组的2.0个月[95%CI(1.81 2.19)],差异有统计学意义(χ2=13.553,P<0.05);安罗替尼组与联合组的中位PFS差异无统计学意义(χ2=0 096,P>0.05),见图1㊂图1㊀安罗替尼组㊁多西他赛组及联合组的生存曲线2.3㊀患者PFS的影响因素分析㊀利用Cox风险回归模型分析患者的PFS与性别㊁ECOG评分㊁吸烟史㊁病理类型㊁临床分期及EGFR突变状态等因素的关系,结果显示有吸烟史是影响患者PFS的危险因素,见表3㊂2.4㊀3组患者的不良反应比较㊀本研究中患者出现的主要不良反应有恶心呕吐㊁骨髓抑制㊁咯血及乏力㊂安罗替尼组和联合组最主要的不良反应均为乏力,分别为18例(90%)和16例(80%),多西他赛组最主要的不良反应是消化道反应(恶心呕吐)14例(70%),见表4㊂表3㊀影响患者PFS的Cox风险回归分析结果因素中位PFS(月)安罗替尼组多西他赛组联合组P值性别0.388㊀男5.02.04.2㊀女5.03.32.0ECOG评分0.528㊀0分5.42.04.2㊀1分4.02.03.1吸烟史0.005㊀无5.02.16.8㊀有(已戒)5.01.84.2病理类型0.150㊀鳞癌5.43.34.2㊀腺癌4.02.05.0㊀大细胞癌1.5--临床分期0.378㊀Ⅳ期5.02.04.2㊀ⅢB期5.04.04.2㊀ⅢA期5.4--㊀ⅢC期2.5--EGFR状态0.154㊀阴性4.02.12.0㊀状态不明5.42.04.2-:指该组中未出现相应类型的患者表4㊀3组患者的不良反应比较㊀[n=20,例(%)]不良反应安罗替尼组多西他赛组联合组恶心呕吐㊀Ⅰ度0(0)12(60)2(10)㊀Ⅱ度0(0)2(10)0(0)骨髓抑制㊀Ⅰ度0(0)2(10)0(0)㊀Ⅳ度0(0)4(20)2(10)乏力18(90)0(0)16(80)咯血2(10)0(0)0(0)3 讨论目前对晚期驱动基因阴性NSCLC的二线治疗方案主要为化疗及免疫治疗,虽然免疫治疗能使患者的OS延长,但也存在优势人群有限㊁价格昂贵等问题㊂肿瘤的发生发展过程均需要血管的参与,抗血管生成药物不仅可以抑制肿瘤组织介导的新生血管形成,还可以使原有的肿瘤血管退化,从而使得存活的肿瘤血管正常化[7];正常化的血管不仅可以使局部组织缺氧的情况得到改善,还可以使组织渗透压降低,增加肿瘤组织内的化疗药物浓度,从而提高治疗效果[8⁃9]㊂我国药品监督管理局已经批准将安罗替尼单药用于晚期NSCLC患者三线及以上的治疗,且药物可及性强㊂本研究结果显示,安罗替尼组㊁联合组的PFS及DCR均大于多西他赛组,提示安罗替尼用于晚期NSCLC患者二线治疗比多西他赛有优势㊂本研究中除1例服用安罗替尼联合多西他赛的患者获得了较长的缓解期(PFS=14个月)外,统计学分析显示联合组与安罗替尼组的PFS无明显差异,考虑可能与纳入研究的病例数少有关㊂从临床疗效来看,安罗替尼组㊁多西他赛组及联合组的ORR分别是10%㊁20%及30%,差异无统计学意义,可能与病例数少有关㊂多西他赛组的消化道反应及骨髓抑制发生比例高于安罗替尼组及联合组,安罗替尼单用不良反应轻,且与多西他赛联用没有增加不良反应的发生㊂ATLER0303研究发现盐酸安罗替尼组的主要3级以上不良反应为手㊁足㊁皮肤反应,高血压,三酰甘油升高及蛋白尿[6],本研究并未观察到这些不良反应㊂关于厄洛替尼联合贝伐珠单抗的Ⅱ期[10]及Ⅲ期[11]临床研究结果显示:厄洛替尼联合贝伐珠单抗比厄洛替尼单药可显著延长EGFR突变阳性晚期NSCLC患者的中位PFS,提示抗血管生成药物与酪氨酸激酶抑制剂联用可改善EGFR突变阳性晚期NSCLC患者的PFS,这是因为活化的EGFR通路会增加肿瘤诱导的血管内皮生长因子(VEGF)过表达,抑制EGFR通路会降低肿瘤诱导的VEGF表达,所以同时抑制EGFR和VEGF有协同抗肿瘤的作用㊂但目前对抗血管生成药物与酪氨酸激酶抑制剂联用的研究主要是贝伐珠单抗与酪氨酸激酶抑制剂的研究,对安罗替尼联合酪氨酸激酶抑制剂的研究较少,需要进一步开展前瞻性㊁大样本的临床研究探索安罗替尼联合酪氨酸激酶抑制剂是否能使EGFR突变阳性的晚期NSCLC患者生存获益㊂目前用于治疗NSCLC的二线抗血管生成药物主要是尼达尼布,LUME⁃Lung1研究显示:与多西他赛相比,尼达尼布联合多西他赛可以使患者获得PFS和OS的双重获益(中位PFS:3.4个月vs.2.7个月,P=0.002;中位OS:12.6个月vs.10.3个月,P=0.036)[12]㊂LUME⁃Lung2研究结果显示:与培美曲赛单药相比,尼达尼布联合培美曲赛可以使患者的中位PFS明显改善(4.4个月vs.3.6个月,P=0.044),但中位OS差异无统计学意义(12.0个月vs.12.7个月,P=0.894)[13]㊂基于上述研究,多西他赛联合尼达尼布目前在国外已经被批准用于进展期或转移性肺腺癌的二线治疗,但由于缺乏中国人群的研究数据,该治疗方案在国内尚未获批㊂阿帕替尼目前在我国被批准用于晚期胃癌或食管⁃胃结合部腺癌三线及以上的治疗,但目前在晚期NSCLC中的研究也较多,一项研究用阿帕替尼单药二线及以上治疗晚期NSCLC患者,结果显示患者的中位PFS为3.06个月,中位OS是7.69个月[14]㊂同样一项将阿帕替尼用于一线治疗进展后晚期非鳞非小细胞肺癌的研究显示,与单用多西他赛及单用阿帕替尼相比,阿帕替尼联合多西他赛可以改善患者的中位PFS(3.3个月㊁3.1个月vs.6.2个月,P<0 001)[15]㊂以上研究提示阿帕替尼单用无法改善患者的PFS,联合化疗药物有改善疗效的趋势,但这些研究均是小样本或回顾性研究,尚无大样本的临床试验证明阿帕替尼对晚期NSCLC的疗效优于化疗药物㊂本研究显示安罗替尼比多西他赛对一线治疗失败的晚期NSCLC患者显示出治疗优势和可控制的毒性,提示安罗替尼或许可作为晚期NSCLC患者二线治疗的有效药物,但仍需大样本的临床研究进一步证明其疗效及安全性㊂本研究也有一定的局限性:病例数少,目前中国抗癌协会临床肿瘤学协作专业委员会(CSCO)指南推荐安罗替尼的适应证为三线及以上的晚期NSCLC患者,经伦理审批本研究用于无法耐受化疗的患者二线使用,导致患者样本量受限;而且在肺癌患者中病理类型为腺癌者较多,腺癌常规行基因检测后,若有基因突变,则服用EGFR⁃TKI靶向药物治疗,这部分患者出现耐药后可选择培美曲赛联合铂类药物治疗,所以在晚期NSCLC患者中二线使用安罗替尼联合多西他赛患者数较少;其次本研究病例来源主要为云南地区的肺癌患者,有一定的区域局限性㊂综上所述,安罗替尼作为我国自主研发的口服小分子靶向药物,口服用药方便,无需长时间及频繁入院治疗,且不良反应轻,能提高患者的生活质量及依从性,是晚期NSCLC患者后线治疗的可选药物,也是不愿意接受化疗患者的有效治疗方式㊂抗血管生成药物与化疗药物或酪氨酸激酶抑制剂联用可以改善患者的PFS,随着更多临床试验的开展,安罗替尼联合化疗药物或安罗替尼联合酪氨酸激酶抑制剂将成为一种新的治疗模式㊂参考文献:[1]㊀BrayF,FerlayJ,SoerjomataramI,etal.Globalcancerstatistics2018:GLOBOCANestimatesofincidenceandmortalityworldwidefor36cancersin185countries[J].CA:ACancerJClin,2018,68(6):394⁃424.[2]㊀EttingerDS,AkerleyW,BorghaeiH.Non⁃smallcelllungcancer[J].JNatlComprCancNetw,2012,10(10):1236⁃1271.[3]㊀杜芳,刘冰,王德林,等.培美曲塞或多西他赛联合奈达铂二线治疗晚期非小细胞肺癌的临床观察[J].中国医院用药评价与分析,2019,19(5):524⁃526,529.[4]㊀黄建国,陆建伟.奈达铂联合多西他赛二线治疗晚期非小细胞肺癌的临床观察[J].中国肿瘤外科杂志,2009,1(6):350⁃352.[5]㊀秦虹,张晓丽,阮志华.培美曲塞与多西紫杉醇二线治疗晚期非小细胞肺癌的Meta分析[J].重庆医学,2014,43(28):3735⁃3738.[6]㊀HanBH,LiK,WangQM,etal.Effectofanlotinibasathird⁃lineorfurthertreatmentonoverallsurvivalofpatientswithadvancednon⁃smallcelllungcancer:theALTER0303phase3randomizedclinicaltrial[J].JAMAOncol,2018,4(11):1569⁃1575.[7]㊀FalcónBL,HashizumeH,KoumoutsakosP,etal.Contrastingactionsofselectiveinhibitorsofangiopoietin⁃1andangiopoietin⁃2onthenormalizationoftumorbloodvessels[J].AmJPathol,2009,175(5):2159⁃2170.[8]㊀张静,张文超,钱子君,等.血管正常化提高肿瘤治疗疗效[J].中国癌症杂志,2016,26(2):188⁃192.[9]㊀ZhouCC,WuYL,ChenGY,etal.BEYOND:arandomized,double⁃blind,placebo⁃controlled,multicenter,phaseIIIstudyoffirst⁃linecarboplatin/paclitaxelplusbevacizumaborplaceboinChinesepatientswithadvancedorrecurrentnonsquamousnon–small⁃celllungcancer[J].JClinOncol,2015,33(19):2197⁃2204.[10]㊀SetoT,KatoT,NishioM,etal.Erlotinibaloneorwithbevacizumabasfirst⁃linetherapyinpatientswithadvancednon⁃squamousnon⁃small⁃celllungcancerharbouringEGFRmutations(JO25567):anopen⁃label,randomised,multicentre,phase2study[J].LancetOncol,2014,15(11):1236⁃1244.[11]㊀SaitoH,FukuharaT,FuruyaN,etal.ErlotinibplusbevacizumabversuserlotinibaloneinpatientswithEGFR⁃positiveadvancednon⁃squamousnon⁃small⁃celllungcancer(NEJ026):interimanalysisofanopen⁃label,randomised,multicentre,phase3trial[J].LancetOncol,2019,20(5):625⁃635.[12]㊀ReckM,KaiserR,MellemgaardA,etal.Docetaxelplusnintedanibversusdocetaxelplusplaceboinpatientswithpreviouslytreatednon⁃small⁃celllungcancer(LUME⁃Lung1):aphase3,double⁃blind,randomisedcontrolledtrial[J].LancetOncol,2014,15(2):143⁃155.[13]㊀HannaNH,KaiserR,SullivanRN,etal.Nintedanibpluspemetrexedversusplacebopluspemetrexedinpatientswithrelapsedorrefractory,advancednon⁃smallcelllungcancer(LUME⁃Lung2):arandomized,double⁃blind,phaseIIItrial[J].LungCancer,2016,102:65⁃73.[14]㊀WuFY,ZhangSJ,XiongAW,etal.AphaseIIclinicaltrialofapatinibinpretreatedadvancednon⁃squamousnon⁃small⁃celllungcancer[J].ClinLungCancer,2018,19(6):e831⁃e842.[15]㊀王学敏,张维红,杜伟娇,等.阿帕替尼用于一线治疗进展后晚期非鳞非小细胞肺癌的疗效和生存分析[J].中国肺癌杂志,2017,20(11):761⁃768.[收稿日期:2020⁃07⁃08][本文编辑:凌云]。
2019年中国生物制药专题研究:重磅创新药,安罗替尼进入收获期,布地奈德上市,强化呼吸科竞争优势

2019年中国生物制药专题研究:重磅创新药,安罗替尼进入收获期,布地奈德上市,强化呼吸科竞争优势正文目录1中国医药行业集中度提升过程,公司充分受益 (4)2公司治理结构完善,保持良好的发展势头 (4)2.1公司股权结构 (5)2.2公司主要子公司 (6)2.3公司主要业务领域 (6)2.4公司主要财务数据 (7)2.5公司保持较高的研发投入,研发费用高速增长 (9)3重磅创新药,安罗替尼进入收获期 (9)3.1安罗替尼是近年来获批的重磅创新药 (9)3.2安罗替尼针对非小细胞肺癌有较好疗效 (10)3.3安罗替尼上市后快速放量 (11)3.4安罗替尼潜在空间巨大 (12)4布地奈德上市,强化呼吸科竞争优势 (13)4.1呼吸科制剂,布地奈德增长潜力大 (13)4.2布地奈德在中国保持良好增长势头 (13)4.3在呼吸科深度布局,公司的布地奈德将加速替代原研产品 (14)5仿制药龙头地位突出 (14)5.1大量品种通过一致性评价,竞争优势正在强化 (14)5.2公司市场占有率较低的品种呈现良好的潜力 (15)5.3公司销售超过5亿元的品种,市场占有率较高 (16)5.4市场占有率3成以内的品种集采影响有限 (18)6公司的产品管线不断丰富 (19)6.1去年以来新产品加速上市 (19)6.2明年重磅药PD-1申请上市 (20)6.3公司近三年陆续有大量品种上市 (20)7盈利预测与评级 (22)7.1收入拆分与假设条件 (22)7.2利润表预测 (24)7.3同行对比与估值 (25)8风险提示 (26)图表目录图表1:公司上市以来里程碑事件 (5)图表2:公司主要股东实际持股比例 (5)图表3:公司核心子公司 (6)图表4:公司2018年收入构成 (6)图表5:公司2019年上半年收入构成 (7)图表6:公司2002年以来营业收入变化情况 (7)图表7:公司2002年以来扣除非净利润变化情况 (7)图表8:公司2002年以来毛利率一直在80%左右 (8)图表9:公司2006年以来净利率一直在20%左右 (8)图表10:公司2009年以来研发费用情况 (9)图表11:2018年药监局批准的创新药 (9)图表12:安罗替尼临床试验ALTER0303数据 (10)图表13:安罗替尼临床试验ALTER0302数据 (11)图表14:安罗替尼上市后销售快速增长 (11)图表15:肺癌发病人数多 (12)图表16:非小细胞肺癌占肺癌比例高 (12)图表17:安罗替尼肺癌适应症空间估计 (12)图表18:样本医院呼吸科主要品种及市场占有率 (13)图表19:布地奈德样本医药历年销售情况 (13)图表20:布地奈德2018年中国市场竞争格局 (14)图表21:2018 年以来通过一致性评价产品 (15)图表22:艾司奥美拉唑钠各企业历年销售占比 (16)图表23:注射用替加环素各企业历年销售占比 (16)图表24:恩替卡韦各企业历年销售占比 (17)图表25:异甘草酸镁历年销售额 (17)图表26:骨化三醇各企业历年销售占比 (18)图表27:厄贝沙坦氢氯噻嗪片各企业历年销售占比 (18)图表28:比阿培南各企业历年销售占比 (19)图表29:2018 年以来上市的重磅产品 (19)图表30:即将上市的重磅产品 (21)图表31:将上市新品种2018年样本医院销售金额(百万元) (22)图表32:销售收入分拆预测(百万元) (24)图表33:简易利润表预测(百万元) (25)图表34:可比公司估值 (25)。
安洛替尼ALTER0303 研究课件

DCR(%,
CR+PR+SD)
80.27 (75.26, 84.67)
34.27 (26.54, 42.66)
p<0.0001
治疗后病灶出现空洞的情况
例数 95% CI
安罗替尼组 (n=294)
53 (18.03 %)
13.80~22.91
安慰剂组 (n=143)
两组率差 组间比较
1(0.7 %) 0.02~3.83
——开启晚期非小细胞肺癌三线治疗大门
盐酸安罗替尼胶囊治疗晚期NSCLC III期临床研究总结
(ALTER0303 研究)
PPT学习交流
1
汇报内容
1 ALTER 0303试验结果 2 亚组分析与疗效预测因素 3 总结
PPT学习交流
2
ALTER 0303试验结果
1
PPT学习交流
3
ALTER 0303试验结果在ASCO 2017 公布
安慰剂组(n=143)
50(34.97%) 93(65.03%) 59(41.26%) 49(34.27%) 21(14.69%)
2(1.40%) 20(13.99%)
4(2.80%)
安罗替尼组(n=294)
151(51.36%) 143(48.64%) 66(22.45%) 84(28.57%)
25(8.50%) 3(1.02%) 32(10.88%) 7(2.38%)
7 (2.38) 0 (0)
3 (1.02)
PPT学习交流
对照组 (n=143) ≥ 3级,例数 (%)
29 (20.28)
0 (0) 1 (0.70)
0 (0) 0 (0) 0 (0) 0 (0)
安罗替尼三线以上治疗晚期非小细胞肺癌26例分析

CHINESE COMMUNITY DOCTORS中国社区医师2021年第37卷第10期肺癌是最常见的恶性肿瘤之一,在世界范围内发病率和死亡率均居首位,其中非小细胞肺癌(NSCLC)约占83%。
大部分患者确诊时已为中晚期,失去手术机会,对这部分患者,目前临床治疗方案有化疗、放疗、分子靶向治疗及免疫治疗等。
安罗替尼作为我国自主研发的小分子多靶点酪氨酸激酶抑制剂,具有抑制血管生成和肿瘤细胞生长的作用,已被批准用于既往曾接受至少两种化疗方案治疗的晚期NSCLC 患者,但入选临床试验的患者多经严格筛选,目前真实世界的相关数据较少。
本研究回顾性分析安罗替尼三线或三线以上治疗NSCLC 的近期疗效及安全性,现报告如下。
资料与方法2018年6月-2020年3月收治NSCLC 患者26例,化疗进展后使用盐酸安罗替尼进行三线或三线以上治疗,其中三线治疗6例,四线治疗12例,五线治疗8例。
男15例,女11例;中位年龄60岁;鳞癌13例,腺癌12例,大细胞癌1例;TNM 分期:Ⅲ期3例,Ⅳ期23例;ECOG 评分:0~1分24例,2分2例。
纳入标准:①经病理学诊断为NSCLC,TNM 分期为晚期NSCLC(ⅢB/Ⅳ期),至少有1个可测量病灶。
②至少接受过两种系统性化疗方案治疗。
③年龄>18岁。
治疗方法:所有患者均口服盐酸安罗替尼胶囊,初始计量为12mg/d,连续服药14d,停药7d,21d 为1个周期。
起始服药剂量为12mg/次,若出现3~4级不良反应,用药剂量则调整为10mg/d 或8mg/d。
评价指标:每6周评价疗效1次,以CT 测量目标病灶的最大直径判断疗效,疗效按RECIST 1.1标准分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)以及疾病进展(PD)。
总有效率(ORR)=(CR +PR)/总例数×100%。
疾病控制率(DCR)=(CR+PR+SD)/总例数×100%。
记录无进展生存时间(PFS),定义为开始服用盐酸安罗替尼胶囊至明确疾病进展的时间。
安罗替尼治疗KRAS突变型晚期肺腺癌1例

安罗替尼治疗KRAS突变型晚期肺腺癌1例苏雨栋;孟昭婷;徐晓燕;王心悦;左冉;侯云霞;李凯;陈鹏【期刊名称】《中国肺癌杂志》【年(卷),期】2018(21)5【摘要】近年来,晚期非小细胞肺癌(non-small cell lung cancer, NSCLC)患者逐渐增多,治疗方法也明显增多,然而,目前对于靶向治疗表皮生长因子受体(epidermal growth factor receptor, EGFR)/间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)耐药或化疗失败的三线及以上患者,国内外并没有标准的治疗方案,临床治疗效果也不尽如人意,安罗替尼是一种新型小分子多靶点酪氨酸激酶抑制剂,可强效抑制血管内皮细胞生长因子受体(vascular endothelial growth factor receptor, VEGFR)、血小板衍生生长因子受体(platelet-derived growth factor receptor, PDGFR)、纤维母细胞生长因子受体(fibroblast growth factor receptor, FGFR)和c-Kit等多个靶点,ALTER0303是一项关于安罗替尼作为晚期NSCLC三线治疗方案的临床研究,结果显示安罗替尼能显著延长晚期NSCLC患者的总生存期(overall survival,OS)和无进展生存期(progression-free survival, PFS),本文报道安罗替尼治疗KRAS突变型晚期肺腺癌1例.%In recent years, the number of advanced non-small cell lung cancer (NSCLC) patients has gradually increased, and the treatment methods have also been significantly increased. However, there are no standard treatment plans at home and abroad for third-line and above patients who are refractory to targeted therapy epidermal growth factor receptor (EGFR)/anaplastic lymphoma kinase (ALK) or chemotherapy. The clinical treatment effect isalso not satisfactory. Anlotinib is a novel TKI targeting the vascular endothelial growth factor receptor (VEGFR), fibroblast growth factor receptor (FGFR), platelet-derived growth factor receptor (PDGFR) and c-Kit. ALTER0303 trail, phase III study has demonstrated that Anlotinib significantly prolonged overall survival (OS) and progression-free survival (PFS) in advanced NSCLC patients as 3rdline treat-ment.Here we report a case of advanced lung adenocarcinoma harboring KRAS mutation treated with Anlotinib.【总页数】3页(P428-430)【作者】苏雨栋;孟昭婷;徐晓燕;王心悦;左冉;侯云霞;李凯;陈鹏【作者单位】300060 天津,天津医科大学肿瘤医院肺部肿瘤内科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,天津市恶性肿瘤临床医学研究中心;300060 天津,天津医科大学肿瘤医院肺部肿瘤内科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,天津市恶性肿瘤临床医学研究中心;300060 天津,天津医科大学肿瘤医院肺部肿瘤内科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,天津市恶性肿瘤临床医学研究中心;300060 天津,天津医科大学肿瘤医院肺部肿瘤内科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,天津市恶性肿瘤临床医学研究中心;300060 天津,天津医科大学肿瘤医院肺部肿瘤内科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,天津市恶性肿瘤临床医学研究中心;300060 天津,天津医科大学肿瘤医院肺部肿瘤内科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,天津市恶性肿瘤临床医学研究中心;300060 天津,天津医科大学肿瘤医院肺部肿瘤内科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,天津市恶性肿瘤临床医学研究中心;300060 天津,天津医科大学肿瘤医院肺部肿瘤内科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,天津市恶性肿瘤临床医学研究中心【正文语种】中文【相关文献】1.安罗替尼治疗阿帕替尼用药进展后的晚期肺腺癌1例 [J], 陈国华; 杨鑫; 李宁; 孟琦2.安罗替尼联合紫杉醇+卡铂治疗晚期肺腺癌的效果 [J], 舒桂君; 朱永东; 解华3.安罗替尼治疗晚期肺腺癌致男性乳腺发育症1例 [J], 陈馨蕊;张亚瑞;柳凤亭;王华庆4.安罗替尼治疗二线靶向治疗耐药的晚期肺腺癌的临床观察 [J], 苟福胜;余丹绯;乔青;周翔5.安罗替尼联合培美曲塞维持治疗驱动基因及PD-L1阴性的晚期肺腺癌患者的效果 [J], 赵志远;李芳;刘莹因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
路漫漫其修远兮, 吾将上下而求索
ALTER0303试验 剂量调整情况
药物号 组别 调整剂量
调整原因
1 安慰剂 10mg 全身性3级皮疹伴瘙痒
5 安罗替尼 10mg 厌食3级与体重下降,患者要求降低剂量
8 安罗替尼 10mg 血压升高伴有头晕,要求降低剂量
14 安罗替尼 10mg 高血压(3级)
17 安罗替尼 10mg 不能耐受的手足皮肤反应与声音嘶哑
结论:在安罗替尼起始治疗时较低的激活的循环内皮细胞水平和较长的PFS 相关,同时基线的较高的aCECs和较多的转移灶相关。
175 安罗替尼 10mg 因口腔粘膜炎不能耐受
221 安罗替尼 10mg 肝功能损伤
药物号 组别 调整剂量
调整原因
298 安罗替尼 10mg 心律失常
330 安罗替尼 10mg 高血压III级
387 安罗替尼 10mg 高甘油三酯血症3级
392 安罗替尼 10mg 腹泻3级
396
安罗替尼
10mg 蛋白尿 出现在第3周期, 2015/10/15开始10mg,12月 8mg 15日服8mg。患者15/09/21进展,申请再用药时。
424 安罗替尼 10mg 手足皮肤反应3级
426 安罗替尼 10mg 窦性心动过速
10mg
473 安罗替尼
肝功能损伤,患者16/8/31进展,申请减少剂量继续用药
8mg
541 安罗替尼 10mg 高甘油三酯血症3级
318 安罗替尼 10mg 口腔黏膜炎3级
10mg 手足皮肤反应不能耐受 238 安罗替尼
p=0.0001
*
p=0.0149
出组后治疗 治疗类型
指标
无 有 化疗 靶向药物治疗 放疗 免疫治疗 中药抗肿瘤治疗 手术
p=0.5572
OS影响多因素分析
系数
组别(试验组 vs 对照组) -0.35
性别(男 vs 女)
0.33
年龄(>60岁 vs≤60岁)
-0.05
ECOG评分(1 vs 0)
0.52
DCR(%,
CR+PR+SD)
80.27 (75.26, 84.67)
34.27 (26.54, 42.66)
p<0.0001
治疗后病灶出现空洞的情况
例数 95% CI
安罗替尼组 (n=294)
53 (18.03 %)
13.80~22.91
安慰剂组 (n=143)
1(0.7 %)
0.02~3.83
两组率差 组间比较
50(34.97%) 93(65.03%) 59(41.26%) 49(34.27%) 21(14.69%)
2(1.40%) 20(13.99%)
4(2.80%)
安罗替尼组(n=294)
151(51.36%) 143(48.64%) 66(22.45%) 84(28.57%)
25(8.50%) 3(1.02%) 32(10.88%) 7(2.38%)
7 (2.38) 0 (0)
3 (1.02)
对照组 (n=143) ≥ 3级,例数 (%)
29 (20.28)
0 (0) 1 (0.70)
0 (0) 0 (0) 0 (0) 0 (0)
1 (0.70)
0 (0) 2 (1.40)
0 (0)
1 (0.70)
0 (0) 0 (0)
0 (0) 0 (0) 2 (1.40)
安罗替尼更优
安慰剂更优
ALTER0303试验-主要终点(OS)
路漫漫其修远兮, 吾将上下而求索
相比安慰剂 安罗替尼延长OS达3.33个月,p<0.05
ALTER0303 研究达到主要终点
安罗替尼更优
安慰剂更优
ALTER0303试验-主要终点(OS)
路漫漫其修远兮, 吾将上下而求索
生存率比较
***
组织类型(腺癌 vs 其他)
0.00
驱动基因(阳性 vs 阴性) -0.20
转移病灶数(>3个 vs ≤3个) 0.71
吸烟情况(正在+曾经vs从未) 0.17
2统计量 7.97 3.95 0.14 9.26 0.00 2.07 34.78 1.16
P 0.0047 0.0470 0.7113 0.0023 0.9741 0.1501 <.0001 0.2805
结论:为安罗替尼疗效的预测提供了真实的基线临床资料数据
WCLC安罗替尼-poster3-激活的循环内皮细胞和转移负荷及PFS相关
路漫漫其修远兮, 吾将上下而求索
WCLC安罗替尼-poster3-激活的循环内皮细胞和转移负荷及PFS相关
Table 1. 不同的激活的循环内皮细胞 (min/baseline)的PFS率的对比
安罗替尼组 (n=294) ≥ 3级,例数 (%) 123 (41.84)
1 (0.34) 2 (0.68)
3 (1.02) 1 (0.34) 3 (1.02) 1 (0.34)
2 (0.68)
39 (13.27) 7 (2.38)
11 (3.74)
7 (2.38)
1 (0.34) 1 (0.34)
安罗替尼—EGFR 亚组分析(野生型)
路漫漫其修远兮, 吾将上下而求索
安罗替尼治疗EGFR野生型患者PFS(5.37 个月 vs 1.57个月)、OS(8.87个月 vs 6.47个月)均显著获益
Presented By Baohui Han at 2017 WCLC Meeting, Abstract NO. P3.03-006 .
最佳疗效 PR
SD缩小 SD变大
PD NE 合计 ORR(%, CR+PR) DCR(%, CR+PR+SD)
安罗替尼组 27 130 81 33 23 294
9.18(6.14, 13.08) 80.95(75.99, 85.28)
安慰剂组 1 12 40 74 16
143 0.7(0.02,3.83) 37.06(29.14, 45.53)
路漫漫其修远兮, 吾将上下而求索
安罗替尼—EGFR 亚组分析(敏感突变型)
路漫漫其修远兮, 吾将上下而求索
安罗替尼治疗EGFR敏感突变型患者PFS(5.57 个月 vs 0.83个月)、OS(10.70个月 vs 6.27个月)均显著获
益
Presented By Baohui Han at 2017 WCLC Meeting, Abstract NO. P3.03-006 .
确切概率 P
P=0.0015
P<0.0001 P=0.2255 P=0.0664 P=0.6640 P=0.3489 P=0.7550
次要终点 DCR和ORR
路漫漫其修远兮, 吾将上下而求索
Percentage (%) Percentage (%)
治疗后肿瘤最佳疗效评价(FAS)
治疗后肿瘤最佳疗效评价(FAS)
20 安罗替尼 10mg 气喘症状加重
10mg 腹泻 66 安罗替尼
8mg 腹泻
103 安罗替尼 10mg 手足皮肤反应3级
105 安罗替尼 10mg 厌食症3级
110 安罗替尼 10mg 发生手足皮肤反应3级
145 安罗替尼 10mg 手足皮肤反应不良反应明显
158 安罗替尼 10mg 3级手足皮肤反应
Progression Rate %
N
Log 3 months 6 months 9 months Rank χ2
P-valueaCECs min/aseline≥114
36.5
52.4
84.1 5.149 0.023
aCECs min/baseline<1
35
20.4
26.7
47.3
路漫漫其修远兮, 吾将上下而求索
OS
进展时粒细胞和淋巴细胞的比例 (HR=1.116, 95%CI 1.0811.151, p<0.0001)
基线目标病灶的最长直径总和(HR=1.006, 95%CI 1.003-1.008, p<0.0001)
进展时ECOG PS2 (HR=2.245, 95%CI 1.704- 3.508, p<0.0001)
安洛替尼ALTER0303研 究
路漫漫其修远兮, 吾将上下而求索
2020年4月13日星期一
汇报内容
1 ALTER 0303试验结果 2 亚组分析与疗效预测因素 3 总结
路漫漫其修远兮, 吾将上下而求索
ALTER 0303试验结果
1
路漫漫其修远兮, 吾将上下而求索
ALTER 0303试验结果在ASCO 2017 公布
HFS (HR=0.489, 95%CI 0.373-0.643, p<0.0001) 升高的 LDL 水平 (HR=0.630, 95%CI 0.437-0.909, p=0.014)
年龄 (HR=0.987, 95%CI 0.975-0.999, p=0.039)
路漫漫其修远兮, 吾将上下而求索
组间比较
p<0.0001
p<0.0001 p<0.0001
第二周期末疗效评价(FAS)
最佳疗效
安罗替尼组 安慰剂组
组间比较
PR
16
1
SD
220
48
PD
33
72
p<0.0001
NE
25
22
合计
294
143
ORR(%, CR+PR)
5.44 (3.14, 8.69)
0.7 (0.02,3.83)
p<0.0001
升高的TSH水平 (HR=0.725, 95%CI 95%CI 0.524-1.005, p=0.053) 高胆固醇血症 (HR=0.601, 95%CI 0.440-0.821, p<0.0001) 皮疹 (HR=0.581, 95%CI 0.369-0.916, p=0.19) 女性 (HR=0.713, 95%CI 0.533-0.953, p=0.022)
