医用有机化学 :翻转PPT-第三章++环烃(含第二章+共轭效应)
合集下载
有机化学--环烷烃 ppt课件
和键以最小的号数表示(用较小的数字表示较小的取代基) c:取代基为较长的碳链,则将环当作取代基,作为烷烃的衍
生物命名. d:顺反异构体的命名是假定环中碳原子在一个平面上,以
此为参考,两个取代基在同侧的为顺式(cis-),反之 为反式(trans-).
环丙烷
环丁烷
环戊烷
cycloproppaptn课e件 cyclobutane cyclopentane 7
CH3 CH3
CH2CH2CH2CH2CH3
A:Isopropylcyclopentane B:1-Cyclobutylpentane
C4 3
2 1
1-甲基-2-异丙基环戊烷
D
5
E
CH3
F
4
CH3
1
3
2
CH CH3
CH3
CH3
4-甲基环己烯 5-乙基-1,3-环己二烯
顺-1,3-二甲基环丁烷
ppt课件
19
3、氧化反应
a)小环不被高锰酸钾,臭氧所氧化
×H+
+ KMnO4
×H+
+ O3
应用:鉴别小环与不饱和烃类化合物
H3C H3C
CH3 CH=C
CH3
KMnO4 H+
H3C
ppt课件H3C
COOH
ppt课件
3
第一节 异构与命名
环烷烃:碳原子以单键连接且性质与开链烃相似的烷烃.
单环烷烃通式:CnH2n 1 脂环烃的分类
根据分子中是否含有重键:
环烷烃,环烯烃,环炔烃。
根据环的大小:
小环3~4C,普通环5~7C, 中环8~11C,大环>12C。
生物命名. d:顺反异构体的命名是假定环中碳原子在一个平面上,以
此为参考,两个取代基在同侧的为顺式(cis-),反之 为反式(trans-).
环丙烷
环丁烷
环戊烷
cycloproppaptn课e件 cyclobutane cyclopentane 7
CH3 CH3
CH2CH2CH2CH2CH3
A:Isopropylcyclopentane B:1-Cyclobutylpentane
C4 3
2 1
1-甲基-2-异丙基环戊烷
D
5
E
CH3
F
4
CH3
1
3
2
CH CH3
CH3
CH3
4-甲基环己烯 5-乙基-1,3-环己二烯
顺-1,3-二甲基环丁烷
ppt课件
19
3、氧化反应
a)小环不被高锰酸钾,臭氧所氧化
×H+
+ KMnO4
×H+
+ O3
应用:鉴别小环与不饱和烃类化合物
H3C H3C
CH3 CH=C
CH3
KMnO4 H+
H3C
ppt课件H3C
COOH
ppt课件
3
第一节 异构与命名
环烷烃:碳原子以单键连接且性质与开链烃相似的烷烃.
单环烷烃通式:CnH2n 1 脂环烃的分类
根据分子中是否含有重键:
环烷烃,环烯烃,环炔烃。
根据环的大小:
小环3~4C,普通环5~7C, 中环8~11C,大环>12C。
有机3-环烷烃PPT优秀课件

1
能量相等
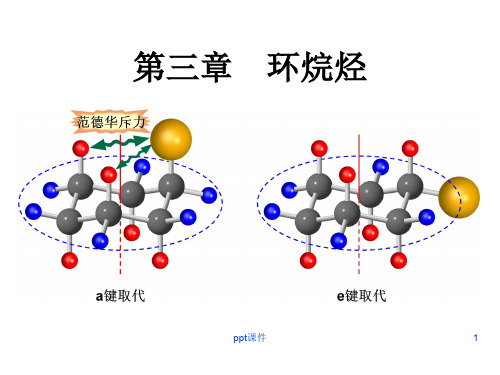
e, a-
3
C H 3
23
cis-1, 4-二甲基环己烷
H 3 C 4 1 C H 3
H
H
1, 4-cis
H 3 C
4
a, e-
C H 3H 3 C
4 1
C H 3
1
能量相等
e, a-
10
环己烷椅式构象
H H
HH
H
H
H
H H
HH
H
➢ 相间的两根键相互平行(画 Z 字形)
➢ 六个碳原子交替分布在两个平面上 ➢ 每个碳均有一根C-H键在垂直方向,上平面的向上
画,下平面的向下画
➢ 其它C-H键分别向左(左边的三个)或向右(右边
的三个),且上下交替
2021/6/3
11
两种类型C-H键
C2, C3, C5, C6 共平面 H
H
椅式构象
船式构象
两者互为构象异构体
2021/6/3
5
椅式构象
H
H
3
H
H
2
1
HH4
56
H H
H
H
H
H
C4-C3 C6-C1
H H3
4
H 5 1H
6
H H2 H H
交叉式
2.50Å
H
H
H~H之间距离均大
HH
于H的Van der
HH
H H
Waal’s半径之和
H
H
H
H
2.49Å (2.40Å )
2021/6/3
2.49Å
6
环己烷的椅式构象
2021/6/3
能量相等
e, a-
3
C H 3
23
cis-1, 4-二甲基环己烷
H 3 C 4 1 C H 3
H
H
1, 4-cis
H 3 C
4
a, e-
C H 3H 3 C
4 1
C H 3
1
能量相等
e, a-
10
环己烷椅式构象
H H
HH
H
H
H
H H
HH
H
➢ 相间的两根键相互平行(画 Z 字形)
➢ 六个碳原子交替分布在两个平面上 ➢ 每个碳均有一根C-H键在垂直方向,上平面的向上
画,下平面的向下画
➢ 其它C-H键分别向左(左边的三个)或向右(右边
的三个),且上下交替
2021/6/3
11
两种类型C-H键
C2, C3, C5, C6 共平面 H
H
椅式构象
船式构象
两者互为构象异构体
2021/6/3
5
椅式构象
H
H
3
H
H
2
1
HH4
56
H H
H
H
H
H
C4-C3 C6-C1
H H3
4
H 5 1H
6
H H2 H H
交叉式
2.50Å
H
H
H~H之间距离均大
HH
于H的Van der
HH
H H
Waal’s半径之和
H
H
H
H
2.49Å (2.40Å )
2021/6/3
2.49Å
6
环己烷的椅式构象
2021/6/3
第03章脂环烃PPT课件

-
10
7
1
6
2
5 43
7
1 6
2
5 43
二环[2. 2. 1]庚烷
2, 7, 7-三甲基二环[2. 2. 1]庚烷
bicyclo[2. 2. 1]heptane
9
2
1
3
8 6
4
7
5
2, 7, 7-trimethylbicyclo [2. 2. 1]heptane
7
4
5
3
1
6
2 用","隔开
8-甲基二环[4. 3. 0]壬烷
H2 / Pt 催化加氢
HI
Cl 自由基取代反应
不反应 不反应
!!!
小环环烷烃
活泼,易开环
-
17
小环化合物的特殊性质 —— 易开环加成)
➢ 小环化合物的催化加氢
H2 / Pt, 50oC or Ni, 80oC
CH3CH2CH3
(打开一根 C-C 键)
2
2
H2 / Pt, 50oC
CH3
3 1 CH2CH3 or Ni, 80oC
6586kjmol环烷烃的燃烧热数据环烷烃的燃烧热数据环的大小与稳定性环的大小与稳定性稳定性小环普通环中环环的大小与化学性质环的大小与化学性质五元以上五元以上环烷烃环烷烃链状烷烃链状烷烃性质相似性质相似小环环烷烃小环环烷烃活泼易开环活泼易开环小环化合物的特殊性质小环化合物的特殊性质易开环加成易开环加成小环化合物化合物的催化加氢打开一根cc主要产物主要产物支链多较稳定小环化合物与卤素的反应小环化合物与卤素的反应离子型加成反应自由基取代反应注意区分
椅式
半椅式 (half chair form)
医用有机化学课件:环烃 (脂环烃)

有机化学
二、環烷烴的結構(p38)
❖環丙烷 C-C-C 鍵角 105.5º
❖ 三個碳原子在一個平面 ❖ 部分重疊,“彎曲鍵”,與正常的σ鍵相比,存在
張力(達到最大重疊 的傾向),因此內能較高, 環不穩定。 ❖ 化學性質活潑:電子雲分佈在兩個原子連線外側,
易受親電試劑的進攻,如鹵素、鹵化氫。有机化学
❖ 編號:小環與螺原子相鄰的碳→小環→螺原子→大環。
官能團或取代基位次最小。
螺[3.5]壬烷
❖寫名稱:螺 [× . × ]某烷(烯),取代基寫在前面
↓↓
小環碳個數 大環碳個數
(不包括螺原子) (不包括螺原子)
有机化学
1,5-二甲基螺[2.4]庚烷 1-甲基螺[3.5]-5-壬烯 有机化学
(2) 橋環烴的命名
脂 脂環烴
環烯烴
環
不飽和脂環烴
烴 多環 螺環烴
環炔烴
脂環烴 橋環烴
脂環烴還可分為小環(3~4個碳)、常見環(5~6
個碳)、中環(7~12個碳)和大環(>12個有碳机)化。学
(二)脂環烴的命名
1.單環脂環烴的命名
❖ 簡單環烷烴:稱“環某烷”
環戊烷 1,2,4-三甲基環己烷 1-甲基-4-異丙基環己烷 ❖ 若支鏈複雜,則把環當取代基。
❖ 兩環共用的碳原子稱為橋頭碳原子,其餘的 稱為橋(鏈)碳原子,稱為二環烴。
❖ 編號:一個橋頭碳→最長橋→另一個橋頭碳 →次長橋→最短橋。
二環[4.2.0]辛烷
❖寫出名稱:二環[↓×. ×↓. ↓× ]某烷,取代基寫在前面。
最長橋碳數
次長橋 最短橋碳數 碳數
(不包括橋頭碳)
有机化学
2,9-二甲基二環[4.4.0]癸烷 2,7,7-三甲基二環[2.2.1]庚烷
二、環烷烴的結構(p38)
❖環丙烷 C-C-C 鍵角 105.5º
❖ 三個碳原子在一個平面 ❖ 部分重疊,“彎曲鍵”,與正常的σ鍵相比,存在
張力(達到最大重疊 的傾向),因此內能較高, 環不穩定。 ❖ 化學性質活潑:電子雲分佈在兩個原子連線外側,
易受親電試劑的進攻,如鹵素、鹵化氫。有机化学
❖ 編號:小環與螺原子相鄰的碳→小環→螺原子→大環。
官能團或取代基位次最小。
螺[3.5]壬烷
❖寫名稱:螺 [× . × ]某烷(烯),取代基寫在前面
↓↓
小環碳個數 大環碳個數
(不包括螺原子) (不包括螺原子)
有机化学
1,5-二甲基螺[2.4]庚烷 1-甲基螺[3.5]-5-壬烯 有机化学
(2) 橋環烴的命名
脂 脂環烴
環烯烴
環
不飽和脂環烴
烴 多環 螺環烴
環炔烴
脂環烴 橋環烴
脂環烴還可分為小環(3~4個碳)、常見環(5~6
個碳)、中環(7~12個碳)和大環(>12個有碳机)化。学
(二)脂環烴的命名
1.單環脂環烴的命名
❖ 簡單環烷烴:稱“環某烷”
環戊烷 1,2,4-三甲基環己烷 1-甲基-4-異丙基環己烷 ❖ 若支鏈複雜,則把環當取代基。
❖ 兩環共用的碳原子稱為橋頭碳原子,其餘的 稱為橋(鏈)碳原子,稱為二環烴。
❖ 編號:一個橋頭碳→最長橋→另一個橋頭碳 →次長橋→最短橋。
二環[4.2.0]辛烷
❖寫出名稱:二環[↓×. ×↓. ↓× ]某烷,取代基寫在前面。
最長橋碳數
次長橋 最短橋碳數 碳數
(不包括橋頭碳)
有机化学
2,9-二甲基二環[4.4.0]癸烷 2,7,7-三甲基二環[2.2.1]庚烷
环烃(芳香烃等)

(六)苯环亲电取代的定位规律
1、定位规律
第二个取代基进入苯环的位置和难易程度主要 决定于原有取代基的性质,而与进入的取代基 关系较少。这就是亲电取代反应的定位效应。
苯环上原有的取代基叫做定位基。
致活 邻、对位定位基 致钝
定位基
间位定位基 (致钝)
(1)邻、对位定位基(第Ⅰ类)
特征:与苯环相连的原子一般为饱和原子,含孤 对电子或带负电荷 (-CH3除外)。
无水AlCl3作用下,芳香烃环上的氢原子被烷基 和酰基所取代生成烷基苯和芳香酮的反应,称 为Friedel —Crafts反应,简称傅-克反应。
可分为傅-克烷基化反应和傅-克酰基化反应
苯环上有强吸电子基(如-NO2 、 -SO3H 、- COR)时,不发生傅-克反应。
a、烷基化反应
卤代烷在 AlCl3的作用下生成C+, C+在进攻苯 环之前会发生重排成稳定的C+(三个C以上)
3.三烷基苯,有三种位置异构体,可用数字表示位置, 相同的三元取代基还可用“连”、“偏”、“均” 表示。
❖ 若苯环上连有不同的烷基,其中一个为甲基,可用 甲苯为母体 CH3
CH2CH3
1-甲基-2-乙基-4-异丙基苯 CH(CH3)2 (2-乙基-4-异丙基甲苯) 若苯环上含不饱和键、官能团或较复杂的烷基, 苯作取代基
❖ 苯的邻位二元取代物应该有两种
解释:
摆动双键学说:分子中的单、双 键不是固定的,它们可以相互转 变—离域的朦胧。
苯分子结构的现代解释
平面六边形
苯分子模型
苯分子环状结构衍生物的命名和异构
1.一烷基苯,烷基作取代基。
CH(CH3)2
甲苯
乙苯
异丙苯
医学有机化学--第三章环烃

O2,钴催化剂 95℃,105Pa
HOOCCH2CH2CH2CH2COOH
3-2 芳香烃
• 芳香烃:苯是最典型的芳香烃。 • 含有苯环结构的化合物。 • 少数非苯芳烃,不含苯环,但含有结构、性质与苯环相似的 芳环。
•芳香性:具有苯的结构特点 ,不饱和度高但结构稳定,容易 进行取代反应,不易进行加成反应和氧化反应。
·
· · CH2
Cl2
CH2Cl + Cl
·
+ HCl
·
(2). 硝化
+ HNO3
浓H2SO4
50~60℃
NO 2
NO 2 NO 2
浓H2SO4
+ HNO3 发烟
100 ℃
NO 2
CH3 + HNO3
浓H2SO4 30℃
CH3 NO 2
62%
CH3 + NO 2
33%
反应活性:甲苯>苯>硝基苯
硝化反应历程:
一、芳香烃的分类 1. 单环芳烃
CH3
H C
2. 多环芳烃 • 多苯代脂烃
• 联苯 联苯 • 稠环芳烃
萘
三苯甲烷
蒽
菲
二、苯的结构
1、苯的环状结构——凯库勒式
分子式: C6H6
H C C H
H C H C
C H C H
研究表明, 凯库勒的结构式基本上是正确的。
但它不能解释苯的全部性能.
(1)、 无法解释苯特有的稳定性。
Br2 加热
CH2 CH2 CH2 CH2 Br Br
CH3 CH2 CH2 室温 Br
HBr
CH3 CH C H2C
CH3 HBr CH3
第三章--环烷烃PPT课件

31
Cyclohexane
船 式 构 象 球 棒 模 型
32
Cyclohexane
船 式 斯 陶 特 模 型
33
转环作用中的能量变化
半椅式
船式
扭船式
椅式
34
环己烷的椅式构象最稳定
✓ 角张力为0
✓ 采取邻位交叉式构象,扭转张力最小
✓
1,3-二a键相互作用小。因为H原子 范德华半径小,所以范德华张力为0
环数:使环状化合物 变成开链化合物所需 打破的碳碳键的数目
单环: 如
C
H
C
2
H
2
C
H
2
(
环
丙
烷
)
、
(环 己 烷 )
二环:如
(十 氢萘) 又叫二 环[4.4.0]癸烷
多环:二环以上。 如 金刚烷
螺环:共有1个碳 如 按环的连接方式 稠环:共有2个碳 如十氢萘
桥环:共有2个以上碳原子 如
3
二. 单环烷烃的命名
1,1-二甲基-4-乙基环己烷
4-Ethyl-1,1-dimethylcyclohexane 7
例3
CH3
CH3 CH CH3
CH 3 CH 2 C CH 2 CH 3 CH 3
1-甲基-2-异丙基环己烷 1-甲基-2-(1-甲基乙基)环己烷
3-甲基-3-环丁基环戊烷 (长链作母体) 8
环烷烃顺反异构
h
C H 2 H 2 CC H C l+ H C l
甲基环己烷+氯r
+Br2
Br
3. 环烯烃的氧化
O 3 Z n /H 2 O C H 3 C O C H 2 C H 2 C H (C H 3 )C H O
Cyclohexane
船 式 构 象 球 棒 模 型
32
Cyclohexane
船 式 斯 陶 特 模 型
33
转环作用中的能量变化
半椅式
船式
扭船式
椅式
34
环己烷的椅式构象最稳定
✓ 角张力为0
✓ 采取邻位交叉式构象,扭转张力最小
✓
1,3-二a键相互作用小。因为H原子 范德华半径小,所以范德华张力为0
环数:使环状化合物 变成开链化合物所需 打破的碳碳键的数目
单环: 如
C
H
C
2
H
2
C
H
2
(
环
丙
烷
)
、
(环 己 烷 )
二环:如
(十 氢萘) 又叫二 环[4.4.0]癸烷
多环:二环以上。 如 金刚烷
螺环:共有1个碳 如 按环的连接方式 稠环:共有2个碳 如十氢萘
桥环:共有2个以上碳原子 如
3
二. 单环烷烃的命名
1,1-二甲基-4-乙基环己烷
4-Ethyl-1,1-dimethylcyclohexane 7
例3
CH3
CH3 CH CH3
CH 3 CH 2 C CH 2 CH 3 CH 3
1-甲基-2-异丙基环己烷 1-甲基-2-(1-甲基乙基)环己烷
3-甲基-3-环丁基环戊烷 (长链作母体) 8
环烷烃顺反异构
h
C H 2 H 2 CC H C l+ H C l
甲基环己烷+氯r
+Br2
Br
3. 环烯烃的氧化
O 3 Z n /H 2 O C H 3 C O C H 2 C H 2 C H (C H 3 )C H O
3第三章 环烃

烃,构成螺环的公用碳原子特称为螺原子。 例:
CH3
螺[2 .4 ]庚烷 2-甲基螺[4.5]-6-葵烯
编号顺序:较小的环—螺原子—较大的环
螺[4.5]-1,6-癸二烯
2、桥环烃
具有两个或两个以上的碳环,碳环间共用两
个或两个以上碳原子的环烃称为桥环烃。命名时 编号顺序:
1个桥头碳原子——较长的桥路——另1个桥头碳
原子——较短的桥路。例:
7
12 8
二环[3.2.0]庚烷 辛烷
5
1,8-二甲基-2-乙基二环[3.2.1]
二、脂环烃的性质
2、化学性质
(一)与链烃类似的性质(略) (二)特殊的性质:小环不稳定,容易开环发生
加成反应,五元环和六元环则较稳定。
(1)加氢反应
+ H2
Ni 80oC
CH3CH2CH3
+ H2
使苯环上的电子云密度增
加,尤其是它的邻位和对 位。
HCH
2)间位定位基的定位效应
以硝基苯为例,硝基的-I 诱导效应和共轭效 应均使苯环的电子云密度降低,尤其以邻位和对 位的碳原子为甚。
O + O N
+
+
+
0
0
0
0
0
0
CH3 -0.017
NO2 +0.05
+0.001
-0.00
-0.011
+0.052
2)硝化
+
HNO3
H2SO4 20-30oC
NO2
SO3H
3)磺化反应
60oC +ቤተ መጻሕፍቲ ባይዱH2SO4
165oC
SO3H
CH3
螺[2 .4 ]庚烷 2-甲基螺[4.5]-6-葵烯
编号顺序:较小的环—螺原子—较大的环
螺[4.5]-1,6-癸二烯
2、桥环烃
具有两个或两个以上的碳环,碳环间共用两
个或两个以上碳原子的环烃称为桥环烃。命名时 编号顺序:
1个桥头碳原子——较长的桥路——另1个桥头碳
原子——较短的桥路。例:
7
12 8
二环[3.2.0]庚烷 辛烷
5
1,8-二甲基-2-乙基二环[3.2.1]
二、脂环烃的性质
2、化学性质
(一)与链烃类似的性质(略) (二)特殊的性质:小环不稳定,容易开环发生
加成反应,五元环和六元环则较稳定。
(1)加氢反应
+ H2
Ni 80oC
CH3CH2CH3
+ H2
使苯环上的电子云密度增
加,尤其是它的邻位和对 位。
HCH
2)间位定位基的定位效应
以硝基苯为例,硝基的-I 诱导效应和共轭效 应均使苯环的电子云密度降低,尤其以邻位和对 位的碳原子为甚。
O + O N
+
+
+
0
0
0
0
0
0
CH3 -0.017
NO2 +0.05
+0.001
-0.00
-0.011
+0.052
2)硝化
+
HNO3
H2SO4 20-30oC
NO2
SO3H
3)磺化反应
60oC +ቤተ መጻሕፍቲ ባይዱH2SO4
165oC
SO3H
《chapter3环烷烃》PPT课件

22
Br Br2
Br
精选课件ppt
23
(3) 与卤化氢反应
主要产物为:溴加到含氢少的碳上
精选课件ppt
24
(4) 氧化反应(小环对氧化剂相当稳定)
O
O
O2
+
O
? 原因:
(考虑羰基碳的杂化)
精选课件ppt
25
3.4 环的张力
3.4.1 拜尔张力学说
1880年以前,只知道有五元环,六元环。 1883年,W.H.Perkin合成了三元环,四元环。 1885年,A.Baeyer提出了张力学说。
精选课件ppt
11
H3C H
CH3 H
顺-1,2-二甲基环丙烷
实
cis-1,2-dimethylcyclopropane
例
三
H
CH3
H3C
H
反-1,2-二甲基环丙烷 trans-1,2-dimethylcyclopropane
精选课件ppt
带有二 个或二 个以上 取代基 时,构 型用顺 反表示 。
从现在的角度看,三员环的张力能是由以下几种因素造成的:
1 由于二个氢原子之间的距离小于范德华半径之和,所以产生
非键连作用,造成内能升高;Enb 2 轨道没有按轴向重迭,导致键长伸长或缩短,电子云重叠
减少,造成内能升高;El 3 E是由于偏转角引起的张力(即角张力)能。 4 E是由全重叠构象引起的。
张力能 = Enb(非键连作用) + El(键长) + E(键角) + E(扭转角)
45 3
6 7
2 19 8
二环[ 4.3.2]十一烷
8 CH3 Cl 6 5
医用化学精品课件-环烃PPT课件

2020年10月2日
9
二、环烷烃的结构
(二)环己烷的构象
CH3
95%
2020年10月2日
CH3
5%
10
二、环烷烃的结构
(二)环己烷的构象
CHC 3H3
稳定构象
(CH3)3C
CH3 CH3
构象难转变 CH3
2020年10月2日
11
二、环烷烃的结构
(三)十氢化萘的构象和构型
H ee
ee H H
H
e
甲苯 乙苯 苯乙烯 苯乙炔
CH3 CH3
CH3
CH3
邻二甲苯
CH3
间二甲苯
CH3
对二甲苯
ortho, o meta, m para, p
2020年10月2日
25
二、苯同系物的异构现象和命名
CH3 CH3
CH3
连三甲苯
CH3 CH3
CH3
偏三甲苯
CH3
CH3
CH3
均三甲苯
C6H5- 苯基 C6H5CH2- 苄基
22
一、苯的结构(Structure of Benzene)
凯库勒式 实验证实
H C HC CH
或 HC CH
C
H
X X
=
X X
如何解释?
2020年10月2日
23
一、苯的结构
第一课件网网站
2020年10月2日
24
二、苯同系物的异构现象和命名
C H3
C H2 C H3 C H=C H2 C C H
按照它们的结构中所含苯环数目和连 接方式,苯型芳香烃又可分为单环芳香烃 和多环芳香烃两类。
2020年10月2日
医用有机化学 :翻转PPT-第三章++环烃(含第二章+共轭效应)

螺原子
❖ 编号:
螺相邻碳
小环
大环
❖命名为“ 螺[x.y]a烃 ”
x.y: 先小后大
(2)桥环命名
桥头碳原子
12 7 83
64 5
桥头碳原子
桥头碳 长桥
次长桥
短桥
“ 二环[x.y.z]a烃” x.y: 先大后小
2.选人
脂环烃的命名
CH3 CH3
答案: 1,6-二甲基-1-环己烯
3.选人
脂环烃的化学性质(通性)
A、环丙烷、环丁烷和环戊烷都可以和卤素在光照条件 下发生卤代反应。 B、环丙烷、环丁烷和环戊烷都可以和卤素发生加成反 应。 C、环丙烷和丙烷可以用溴水来鉴别。
Hale Waihona Puke D、环丙烷和丙烯可以用酸性高锰酸钾来鉴别。
6.抢答
芳香烃的命名
CH3CH2CHCH2CH3
SO3H NO2
答案:3-苯基戊烷 答案:邻硝基苯磺酸
定位基
邻、对位定位基
致活 致钝(除卤素外)
间位定位基
(致钝)
(1)邻、对位定位基(第Ⅰ类)
• 特征: 与苯环相连的原子为饱和原子或带负电荷
❖强致活:
❖弱致活: ❖弱致钝:
-CH3(-R)
❖活化效应越强,其定位效应也越强。
(2)间位定位基(第Ⅱ类)
• 特征:与苯环相连的原子含重键或带正电荷
❖强致钝:
由共轭效应和诱导效应共同总电子效应决定的冲突时共轭效应诱导效应除卤素外位定位基使苯环电子云密度降低不利于亲电反应致钝定位
第三章 环烃
1.测试
下列化合物命名错误的是
A、
5-甲基螺[3.5]壬烷
B、
3-甲基环己烯
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
D、环丙烷和丙烯可以用酸性高锰酸钾来鉴别。
6.抢答
芳香烃的命名
CH3CH2CHCH2CH3
SO3H NO2
答案:3-苯基戊烷 答案:邻硝基苯磺酸
7.选人
❖完成反应方程式
CH3
① 光照
+ Cl2
② FeCl3 30℃
☆
CH2Cl
CH3
CH3
Cl
+
Cl
(1)卤代反应 (2)硝化反应
苯环的亲电取代反应
64 5
桥头碳原子
桥头碳 长桥
次长桥
短桥
“ 二环[x.y.z]a烃” x.y: 先大后小
2.选人
脂环烃的命名
CH3 CH3
答案: 1,6-二甲基-1-环己烯
3.选人
脂环烃的化学性质(通性)
① HBr
+ ② KMnO4/H+
Br
COOH C=O
+ HBr
4.抢答
☆
CH3 CH3
常温
H3C C CH CH3
π电子数 2
2
6
6
10
11.测试 ☆
❖下列化合物不具有芳香性的是 A、 环辛四烯二负离子 B、 环丙烯正离子 C、 环戊二烯负离子 D、 环庚三烯
12.测试
❖成下羧列酸苯的的是同系物,不能被酸性KMnO4溶液氧化
A、
CH3 CH3
B、CH3
CH(CH3)2
C、 CH3
C(CH3)3
C(CH3)3
第三章 环烃
1.测试
下列化合物命名错误的是
A、
5-甲基螺[3.5]壬烷
B、
3-甲基环己烯
C、 D、 H3C
二环[4.4]癸烷
CH3
1-甲基-4-异丙基环己烷
CH3
(1)螺环
❖命名为“ 螺[x.y]a烃 ”
x.y: 先小后大
(2)桥环命名
桥头碳原子
12 7 83
下列物质中有芳香性的是
+
A、
B、
C、
-
D、 -
芳香性的判断
(一)休克尔规则(芳香性判据):
①共平面的环状闭合共轭体系 ②π电子数为 4n+2 (n=0,1,2,3…正整数)
• π电子数的计算 ①负离子:总碳原子数+电荷数 ②正离子:总碳原子数-电荷数
(二)非苯芳烃
环丙烯 环丁二烯 环戊二烯 环庚三烯 环辛四烯 正离子 二正离子 负离子 正离子 二负离子
D、
13.测试
❖下列说法错误的是( ) A、环丙烷在光照下卤代反应属于自由基取代反应。
B、甲苯在光照下的卤代反应属于亲电取代反应。
C、甲苯的硝化反应属于亲电取代反应。 D、苯在无水AlCl3条件下和CH3Cl生成甲苯的反应属 于亲电取代反应。
(3)磺化反应
(4)傅克反应
Friedel —Crafts
重排反应:对医学及思维 意义不大,属于了解不作 具体要求,有兴趣可个别 咨询。
8.选人
(1) 发生亲电取代反应取代基进入已有取代基邻、对位的 是
(2) 发生亲电取代反应取代基进入已有取代基间位的 是
A、
OH
B、
Br
C、
NO2
D、
NH2
E、
CH3
F、
SO3H
9.测试
☆
下列化合物发生硝化反应活性最大的是
A、 C、
OCH2CH3 Br
B、
CH3
D、
NO2
苯环亲电取代的定位规律
1、定位规律
定位基
邻、对位定位基
致活 致钝(除卤素外)
间位定位基
(致钝)
(1)邻、对位定位基(第Ⅰ类)
• 特征: 与苯环相连的原子为饱和原子或带负电荷
❖强致活:
❖弱致活: ❖弱致钝:
•
(除卤素外)
• 间 位 定位基 使苯环电子云密度降低,不利于亲电反应(致钝)
• • 定位:由共轭效应交替极化决定: +C/ 邻对位
-C/间位
+I CH3- +C
活性:致活
-I -OH
+C
致活+C>-I
-I -Cl
+C
-I -NO2 -C
致钝 -I >+C
致钝
位置:邻/对位
+C
+C
间位
+C
-C
10.测试
-CH3(-R)
❖活化效应越强,其定位效应也越强。
(2)间位定位基(第Ⅱ类)
• 特征:与苯环相连的原子含重键或带正电荷
❖强致钝:
2、定位规律的解释
• 活性:由共轭效应和诱导效应共同(总电子效应)决定的, 冲突时,共轭效应>诱导效应(除卤素外)
• 邻对位定位基使苯环电子云密度增高,有利于亲电反应(致活)
Br
小环(环丙、 丁烷)特性:加成
------环戊烷以上不反应
反应机制:亲电加成
马氏规则:断裂在含氢最多和最少的两碳之间
注意:小环没有氧化特性(与烷烃一样)
5.测试
关于脂环烃,下列说法错误的是( )
A、环丙烷、环丁烷和环戊烷都可以和卤素在光照条件 下发生卤代反应。 B、环丙烷、环丁烷和环戊烷都可以和卤素发生加成反 应。 C、环丙烷和丙烷可以用溴水来鉴别。
6.抢答
芳香烃的命名
CH3CH2CHCH2CH3
SO3H NO2
答案:3-苯基戊烷 答案:邻硝基苯磺酸
7.选人
❖完成反应方程式
CH3
① 光照
+ Cl2
② FeCl3 30℃
☆
CH2Cl
CH3
CH3
Cl
+
Cl
(1)卤代反应 (2)硝化反应
苯环的亲电取代反应
64 5
桥头碳原子
桥头碳 长桥
次长桥
短桥
“ 二环[x.y.z]a烃” x.y: 先大后小
2.选人
脂环烃的命名
CH3 CH3
答案: 1,6-二甲基-1-环己烯
3.选人
脂环烃的化学性质(通性)
① HBr
+ ② KMnO4/H+
Br
COOH C=O
+ HBr
4.抢答
☆
CH3 CH3
常温
H3C C CH CH3
π电子数 2
2
6
6
10
11.测试 ☆
❖下列化合物不具有芳香性的是 A、 环辛四烯二负离子 B、 环丙烯正离子 C、 环戊二烯负离子 D、 环庚三烯
12.测试
❖成下羧列酸苯的的是同系物,不能被酸性KMnO4溶液氧化
A、
CH3 CH3
B、CH3
CH(CH3)2
C、 CH3
C(CH3)3
C(CH3)3
第三章 环烃
1.测试
下列化合物命名错误的是
A、
5-甲基螺[3.5]壬烷
B、
3-甲基环己烯
C、 D、 H3C
二环[4.4]癸烷
CH3
1-甲基-4-异丙基环己烷
CH3
(1)螺环
❖命名为“ 螺[x.y]a烃 ”
x.y: 先小后大
(2)桥环命名
桥头碳原子
12 7 83
下列物质中有芳香性的是
+
A、
B、
C、
-
D、 -
芳香性的判断
(一)休克尔规则(芳香性判据):
①共平面的环状闭合共轭体系 ②π电子数为 4n+2 (n=0,1,2,3…正整数)
• π电子数的计算 ①负离子:总碳原子数+电荷数 ②正离子:总碳原子数-电荷数
(二)非苯芳烃
环丙烯 环丁二烯 环戊二烯 环庚三烯 环辛四烯 正离子 二正离子 负离子 正离子 二负离子
D、
13.测试
❖下列说法错误的是( ) A、环丙烷在光照下卤代反应属于自由基取代反应。
B、甲苯在光照下的卤代反应属于亲电取代反应。
C、甲苯的硝化反应属于亲电取代反应。 D、苯在无水AlCl3条件下和CH3Cl生成甲苯的反应属 于亲电取代反应。
(3)磺化反应
(4)傅克反应
Friedel —Crafts
重排反应:对医学及思维 意义不大,属于了解不作 具体要求,有兴趣可个别 咨询。
8.选人
(1) 发生亲电取代反应取代基进入已有取代基邻、对位的 是
(2) 发生亲电取代反应取代基进入已有取代基间位的 是
A、
OH
B、
Br
C、
NO2
D、
NH2
E、
CH3
F、
SO3H
9.测试
☆
下列化合物发生硝化反应活性最大的是
A、 C、
OCH2CH3 Br
B、
CH3
D、
NO2
苯环亲电取代的定位规律
1、定位规律
定位基
邻、对位定位基
致活 致钝(除卤素外)
间位定位基
(致钝)
(1)邻、对位定位基(第Ⅰ类)
• 特征: 与苯环相连的原子为饱和原子或带负电荷
❖强致活:
❖弱致活: ❖弱致钝:
•
(除卤素外)
• 间 位 定位基 使苯环电子云密度降低,不利于亲电反应(致钝)
• • 定位:由共轭效应交替极化决定: +C/ 邻对位
-C/间位
+I CH3- +C
活性:致活
-I -OH
+C
致活+C>-I
-I -Cl
+C
-I -NO2 -C
致钝 -I >+C
致钝
位置:邻/对位
+C
+C
间位
+C
-C
10.测试
-CH3(-R)
❖活化效应越强,其定位效应也越强。
(2)间位定位基(第Ⅱ类)
• 特征:与苯环相连的原子含重键或带正电荷
❖强致钝:
2、定位规律的解释
• 活性:由共轭效应和诱导效应共同(总电子效应)决定的, 冲突时,共轭效应>诱导效应(除卤素外)
• 邻对位定位基使苯环电子云密度增高,有利于亲电反应(致活)
Br
小环(环丙、 丁烷)特性:加成
------环戊烷以上不反应
反应机制:亲电加成
马氏规则:断裂在含氢最多和最少的两碳之间
注意:小环没有氧化特性(与烷烃一样)
5.测试
关于脂环烃,下列说法错误的是( )
A、环丙烷、环丁烷和环戊烷都可以和卤素在光照条件 下发生卤代反应。 B、环丙烷、环丁烷和环戊烷都可以和卤素发生加成反 应。 C、环丙烷和丙烷可以用溴水来鉴别。
