分子原子离子及元素的关系
第讲分子原子离子及元素素材

第讲分子、原子、离子及元素素材一、分子1. 什么是分子?分子是由两个或两个以上的原子通过化学键结合在一起的化学粒子,是元素和化合物的基本单位。
2. 分子的组成一个分子由相同或不同的原子通过化学键结合在一起,它们按照一定的比例构成不同的分子。
3. 分子的种类根据原子的组成和不同的化学键,分子可分为原子分子、离子分子和共价分子。
•原子分子:由一种相同的原子组成,如氧分子(O2)、氢分子(H2)等;•离子分子:由正负离子按照比例结合在一起形成的分子,如氯化钠(NaCl)等;•共价分子:由原子之间共享电子形成的分子,如水分子(H2O)等。
4. 分子的性质分子的性质由分子结构和成分决定,它们不同的性质包括形状、极性、化学性质等。
•形状:分子的形状决定着分子的相互作用和反应方式,如水分子的呈V形;•极性:分子极性影响它们相互之间的吸引力和反应性质;•化学性质:分子的形成和反应均与化学键有关。
二、原子1. 什么是原子?原子是能够保持化学反应中化学物质属性的最小基本单位,是物质存在的基本单位。
2. 原子的组成原子由原子核和电子构成。
原子核由质子和中子组成,电子围绕在原子核外。
3. 原子的种类根据原子核内部的质子数,原子可分为不同的元素,如氧原子、氢原子等。
4. 原子的性质原子的性质由它们的成分和结构决定,包括原子的大小、质量、电子数等。
•原子大小:原子大小与其电子云的大小有关;•原子质量:原子的质量主要由其原子核的质量决定;•原子电子:原子电子影响原子的化学性质。
三、离子1. 什么是离子?离子是具有电荷的分子或原子,其电荷数目可以是正的或负的。
2. 离子的组成离子由原子或分子通过化学反应,在化学键中失去或获得电子而成。
正离子失去了一个或多个电子,成为具有正电荷的离子;负离子获得一个或多个电子,成为具有负电荷的离子。
3. 离子的种类离子根据其电荷性质分为阳离子和阴离子。
4. 离子的性质•离子的稳定性:离子的稳定性取决于其电荷大小、离子半径和结构等因素;•离子的性质:离子在化学反应中往往显示出特殊的反应性质。
分子原子离子及元素的关系

元素原子的结构特征与元素化学性质的关系离子与原子的比较分子、原子和离子的比较元素与原子的比较分子、原子及元素练习题一、选择题1、下列物质中含有氧分子的是A.水B.液氧C.氧化汞D.二氧化碳2、下列关于水的组成叙述,正确的是A.水是由氧气和氢气组成B.水是由氢分子和氧原子构成C.水是由氢元素和氧元素组成D.水是由两个氢原子和一个氧原子构成3、新装修的房屋常有一股异味,利用分子的性质解释该现象,最合理的是A•分子在不断运动 B •分子的质量很小 C.分子间有间隙D•分子的体积很小4、“墙脚数枝梅,凌寒独自开,遥知不是雪,为有暗香来。
”诗人在远处就能闻到梅花香味的原因是()A.分子很小B.分子是可分的C.分子间有一定的间隙D.分子是在不断运动的5原子的质量主要集中在()A. 质子B冲子 C.电子 D.原子核6、居里夫人在1898年从儿吨含铀的废料中提炼岀镭。
镭原子的核电荷数为88,相对原子质量为226,下列说法关于镭原子的说法中错误的是200mg 、铁4mg 、锌5mg,这里所标示的钙、铁、锌是指C.分子D.离子(C.最外层电子数 D .质子数9、2005年10月12日,我国载有两名航天员的“神舟 入太空。
歙餉’飞船在长征2号F 捆绑式大推力火箭的运载下,进,下列的燃料是偏二甲脐(化学式为C2H8N2 ()A. 由2个碳元素、4个氢分子以及1个氮分子组成B.C.由2个碳原子、8个氢原子、2个氮原子构成10、关于氧气和铁的构成,下列说法中正确的是A. 由氧元素和铁元素构成 C. 由氧原子和铁原子构成 11、下列说法中错误的是B. 由氧分子和铁原子构成 D. 由氧分子和铁分子构成A.水是由氢元素和氧元素组成的 C. 由同种元素组成的纯净物叫做单质 12、下列各组物质中,都是由分子构成的是 A.水、二氧化碳B.氧气、铝B. 原子是构成物质的一种基本微粒 D.含有氧元素的化合物就是氧化物C. 铜、食盐13定量的单质某气体其体积随压强和温度的变化的原因是' A.气体分子个数发生变化 B.气体分子本身大小发生变化 C.气体分子间的间隔发生变化D.构成分子的原子个数发生变化14、向盛水的烧杯中放入一小粒品红,一段时间后,烧杯中形成红色溶液,此实验说明中;②分①分子处于不断运动之子大,原子小;③分子可以再分,原子不能再分;④分子间有一定的间隔;()7、 某营养品说明书上标明:每片含钙 0A.原子B.元素 8、 下列能决定元素元素化学性质的是 A.电子数 B.中子数关于偏二甲腓组成的叙述正确的是B.由碳、氢、氧三种元素组成 D.组成元素碳、氢氧的质量比为1: 4:1A.①②B.②③C.①③15、 下列关于分子、原子、离子的说法中,错误的是 A.在化学反应中分子能再分,原子不能再分 C.分子、原子都能保持所构成的物质的性质 16、 下列叙述中,正确的是A.氧分子的保持氧气化学性质的最小粒子 C.液态空气是由空气分子构成的物质 17、 保持水化学性质的最小粒子是D.①④(B. 分子、原子、离子都能构成物质D. 水这种物质是由氢、氧两种原子直接构成的() B.氮分子是保持氮气物理性质的一种粒子 D.氮气和氧气混合后,它们的化学性质都会改变A .氢原子和氧原子 B.氢分子和氧原子18、用分子的观点分析下列变化,属于化学变化的是 C.水分子D.水原子A. 一种物质的分子运动到另一种物质的分子中间去了 C.分子改变了,由一种分子变成了另一种分子B.分子运动的速度变慢了19、下列现象不能用分子运动论解释的是D.分子间的间隔变大了A.把两块表面干净平滑的铝片压紧就不容易将它们拉开 C.医院里充满了药味20、下列说法正确的是B.氧化汞受热分解生成汞和氧气D.在室内,同样表面积的热水比冷水蒸发的快A .混合物一定是由多种分子构成的 C. 由多种分子构成的物质一定是混合物二、填空题B .纯净物一定是由一种分子构成的D-由多种元素组成的物质一定是混合物4个氮原子硅元素6个水分子 __________ 5个镁离子_____________________________2、加油站里汽油己放入贮存罐贮存好了,但在离油罐一定距离内仍要“严禁烟火”,其原因是3、液态氧和氧气的状态不同,化学性质_____________________ ,原因是_____________________________4、选择“元素”、“原子”或“分子”三个化学名词填空:⑴分子是由____________ 构成的;⑵同种______________ 组成的纯净物是单质;⑶不同种______________________ 构成的物质是混合物;⑷不同种________________ 组成的纯净物是_______________ o5、氧化镁、二氧化硫、氧化汞中都含有_____________________ ,它们都属于__________________ o6、在硝酸镀[NH4NO3]、二氧化碳、二氧化镭、氧气、蒸馅水、空气、铁中:⑴含有氧分子的物质是_________________ :⑵含有氧元素的物质是_____________________________ ;⑶属于单质的物质是_______________________:⑷属于化合物的物质是 _________________________ :⑸属于氧化物的物质是。
元素原子分子离子的概念

元素原子分子离子的概念元素元素指的是一种物质,它由同一种原子组成。
元素是构成物质的基本单位。
目前已经发现了118种元素,其中92种是自然存在的元素,其余的是人工合成的。
每个元素都有一个唯一的原子序数(也称为阶级),该序数与元素的性质有关。
元素可以按照它们的原子序数排列在周期表中。
原子原子是元素的基本单位。
原子是由中心核和围绕核运动的电子组成的。
原子的核由质子(带正电荷)和中子(无电荷)组成。
原子的质子数确定了它的原子序数。
原子序数相同的原子具有相同的化学性质。
原子的电子数可以不同,这是因为电子的数量影响着一个原子的化学性质。
分子分子是由两个或多个原子共用电子形成的,它是化学反应的基本单位。
分子可以是由相同元素的原子组成的(如氧气,由两个氧原子组成),或由不同元素的原子组成的(如水,由两个氢原子和一个氧原子组成)。
分子的种类很多,它们的性质取决于它们所包含的原子的种类和数量。
离子离子是电荷带电的原子或分子。
它们获得或失去电子,从而使它们带有一个或多个正或负电荷。
离子可以是阳离子或阴离子。
阳离子是带有一个或多个正电荷的离子,它们通常是由金属原子丢失一个或多个电子而形成的。
阴离子是带有一个或多个负电荷的离子,它们通常是由非金属原子获得一个或多个电子而形成的。
总结元素、原子、分子和离子是构成物质的基本单位。
元素是由同一种原子构成的物质。
原子是由中心的核和围绕核旋转的电子组成的。
分子是由两个或多个原子共用电子形成的。
离子是带有正或负电荷的原子或分子。
这些概念对于理解化学及生命科学等领域非常重要。
知识点包——物质的微观构成

一、知识点名称——物质的微观构成二、知识点详解分子、原子、离子、元素与物质之间的关系,如图所示:它们的区别是:1.物质和元素都是宏观概念,它们只讲种类,不讲个数;而分子、原子和离子等是微观粒子,既可以讲种类,也可以讲个数。
2.元素是具有相同核电荷数(即核内质子数)的一类原子的总称;它与物质之间是组成关系,也就是,它是用来描述物质的宏观组成的,习惯上用“组成”来描述。
三、强化训练【典型例题】下列说法错误的是()A.铁是由铁原子构成的B.水是由水分子构成的C.氯化钠是由氯化钠离子构成的D.氧气是由氧分子构成的【答案】C【解析】A、铁属于金属单质,是由铁原子构成的,正确;B、水是由水分子构成的,表述正确;C、氯化钠是由钠离子和氯离子构成的,表述错误;D、氧气是由氧分子构成的,表述正确。
故选:C。
【解题方法点拨】要想解答好这类题目,首先,要理解和熟记分子、原子、离子、元素与物质之间的关系,以及与之相关的知识.然后,根据所给的问题情景或图表信息等,结合所学的相关知识和技能,以及自己的生产或生活经验所得,细致地分析题意(或图表信息)等各种信息资源,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可。
【变式训练】1、下列物质中,只含有分子的是()A.氯化钠B.医用酒精C.镁铝合金D.硫酸铜溶液【解答】A、氯化钠是由钠离子和氯离子构成的,不含分子,故选项错误;B、医用酒精是酒精的水溶液,属于混合物,含有酒精分子和水分子,故选项正确;C、镁铝合金属于混合物,含有镁原子核铝原子,故选项错误;D、硫酸铜溶液是硫酸铜的水溶液,含有铜离子、硫酸根离子、水分子,故选项错误;故选:B。
2.如图是水的微观层次结构,图中右侧“O”表示()A.水分子B.氢原子C.氧原子D.氢分子【解答】由图可知:水的微观层次结构图中右侧“○”表示氢原子。
故选:B。
【通关测试】1、物质都是由不同的微观粒子构成的.在下列的微观粒子中,能直接构成物质的微观粒子是()A.原子B.质子C.中子D.电子【解答】A、原子不显电性,可直接构成物质,如金属单质可由金属原子直接构成,故A 正确;B、质子是构成原子的一种微粒,原子可以直接构成物质而质子不能直接构成物质,故B 错误;C、中子是构成原子的一种微粒,原子可以直接构成物质而中子不能直接构成物质,故C 错误;D、电子是构成原子的一种微粒,原子可以直接构成物质而电子不能直接构成物质,故D 错误。
第4讲 分子、原子、离子及元素

3.相对原子质量 以 一种碳原子质量的 1/12 为标准,其他原子质 量跟它相比较所得的比值,叫做这种原子的相对原子 质量。 相对原子质量的单位是 1 , 相对原子质量越大, 原子的实际质量越 大 ;两种原子的相对原子质量之 比 等于 这两种原子的质量比。
温馨提示: 1.原子中不一定有中子,如氢原子核内无中子。 2.在原子中,核电荷数=质子数=核外电子数。 3.相对原子质量≈ 质子数+中子数。
考点一
分子和原子的特性
例 1 (2016· 湘潭 ) 下列事实的微观解释错误的是 ( )
选 项 A 事实 温度降低,汽油的密度增大 微观解释 分子的体积变小
B
C
春天公园里散发出阵阵花香
10 mL酒精与10 mL水混合后 体积小于20 mL 一滴水中含有约1.67× 1021个 水分子
3.分类 元素种类 金属元素 非金属元素 稀有气体元 素 结论 最外层电子 数 <4 个 ≥4 个 8 个(氦 2 个) 得失电子 原子易 失 电子 原子易 得 电子 不易得、失电子
最外层电子数 决定了元素的化学 性质
4.元素符号 (1)由两个字母表示的元素符号:第一个字母 大 写 ,第二个字母 小写 。 (2)意义: ①宏观上表示 一种元素 ,微观上表示 该元素的 一个原子 ; 如:O 表示 氧元素 、 1 个氧原子 ;
-考Βιβλιοθήκη 四 1.概念元素质子数 (即 核电荷数 )相同的一类原子的总称。
2.分布 (1)空气中含量居于前 2 位的元素分别为 氮 、 氧 。 (2)地壳中含量居前 5 位的元素分别为 氧 、 硅 、 铝 、 铁 、 钙 。 (3)人体中含量居前 4 位的元素分别是 氧 、 碳 、 氢 、 氮 。
(4)海水中除了水由 氢 、 氧 两种元素组成外, 含量较高的元素是 钠 和 氯 ,即海水中含量最高的 盐是 氯化钠 。
分子、原子、离子及元素的关系
项分 目子 不 本 在化学 同 质 反应中 点 区 可以分
别 成原子 构 大多数 成 物质由
原 子 在化学 反应中 不能再 分 原子也 能直接
精心整理
物 分子构 构成物
质 成 质,但分
情
子是由
况
原子构
成的
相 1、 质量和体积都
同
很小
点 2、 都在不停地运
动
3、 粒子间由间隔
精心整理
稳定
结构
稀 =8 难得 极
有 (氦 失电 难
气为 子 发
体 2) (常 生
元
称为 化
素
稳定 学
结反
构) 应
精心整理
离子与原子的
比较
粒子 原
离
种类 子
子
阳离 阴离
子子
粒 核内 核内 核内
区 子 质子 质子 质子
结 数= 数> 数<
精心整理
构 核外 核外 核外 电子 电子 电子
别 数数 数 粒 不显 带正 带负 子 电性 电 电 电 性 用元 用阳 用阴 符 素符 离子 离子 号 号表 符号 符号
阴离子
失电子
失电子 构分 成裂
系
分
子
元素与原子的比较 精心整理
元
原
素
子
概 具有相同 化学变化
念 核电荷数 中的最小
(即核内 粒子
质子数)
的一类原
子的总称
区 只讲种 既将种
分 类,不讲 类,又讲
精心整理
个数 个数 使 用于描 用于描述 用 述物质 物质的微 范 的宏观 观构成 围 组成 举 水由氢元 每个水分 例 素和氧元 子由两个
分子、原子、离子、元素的关系初中化学

化学式表示一个分子; H2O、 CO2
化学式前加数目表示几
个分子。
3H2O、4CO2
元素符号右上方标上离 H+、 O2-
子所带电荷及数目;数 目在前,“+”或“-”在
2H+、5O2-
原子或 (一)关于分子的说法 离子
(1)物质是由分子构原成子的或离子构成
(2)保持物质性质的基本粒子是分子
(3)双氧水(H2O2)是由双氢氧分水子分和子氧构分成子
小于4
大于4 等于4
等于8 氦为2
易失
易得
电子
稳定结构
电子
(八)原子结构与元素周期表的关系
周期数 主族元素的族序数
电子层数 最外层电子数
(九)元素、原子、分子、离子的表示方法
元素 原子
分子
离子
表示方法
元素符号
实例
H、O、Mg
元素符号表示一个原子; H、O、Mg
元素符号前加数目表示
几个原子。
2H、3O、4Mg
ห้องสมุดไป่ตู้
讲种类,又讲个数,有 只讲种类,不讲个数。
量的意义。
如:一种元素,四种元
如:一个碳原子,一种 碳原子;三个氧原子
素,而不能说一个元素。
2、讨论微观时用构成 2、讨论宏观时用组成
原子内核电荷数即质子数决定元素的种类
(六)原子结构与元素分类的关系
一般
小于4
大于4 等于4
等于8 氦为2
一般
(七)原子结构与元素性质的关系
粒子种类 原 子
离子
阳离子 阴离子
区 粒子结构 质子数=电子数 质子数>电子数 质子数<电子数
别 粒子电性 不呈电性 带正电荷 带负电荷
元素原子分子的关系

元素原子分子的关系元素、原子和分子是化学中的重要概念,它们之间有着密切的关联。
下面将从元素、原子和分子的定义、特点以及它们之间的转化过程等方面进行详细阐述。
一、元素是组成物质的基本单位,它是由具有相同原子序数(即原子核中质子的数目)的原子组成的。
元素是构成化学物质的基础,目前已知的元素共有118种,分布在元素周期表中。
二、原子是元素的最小单位,它由中心的原子核和围绕核运动的电子组成。
原子核由质子和中子组成,质子带正电荷,中子不带电荷。
电子带负电荷,围绕在原子核周围的不同能级上运动。
三、分子是由两个或多个原子通过化学键结合而成的,是物质的基本组成单位。
分子可以是同一种元素的原子组成的,也可以是不同元素的原子组成的。
例如,氧气分子由两个氧原子结合而成,化学式为O2;水分子由两个氢原子和一个氧原子结合而成,化学式为H2O。
四、元素、原子和分子之间存在着密切的关系和相互转化。
首先,元素是由原子组成的,不同元素的原子具有不同的质量和性质。
其次,原子可以通过化学反应发生化学键的形成或断裂,从而形成分子。
化学键可以是共价键、离子键或金属键等。
最后,分子可以通过化学反应分解成原子,或者多个分子可以发生化学反应形成新的分子。
在化学反应中,元素、原子和分子之间的转化是不可逆的,符合质量守恒定律。
例如,当氢气和氧气发生反应生成水时,两个氢原子和一个氧原子结合成一个水分子,其质量保持不变。
反应前后的原子序数和元素种类都没有发生改变,只是原子重新组合形成了新的分子。
元素、原子和分子是化学研究的基础,它们的性质和相互转化关系对于理解物质的组成和性质具有重要意义。
通过研究元素的原子结构和化学键的形成,可以揭示物质的性质和反应机制。
同时,通过控制元素之间的原子和分子的组合,可以合成新的物质或改变原有物质的性质,广泛应用于化学工业、材料科学、生物医药等领域。
元素、原子和分子是化学研究中的重要概念,它们之间存在着紧密的关系和相互转化。
原子分子离子元素的区别

原子分子离子元素区别达2010原子:指化学反应中最小微粒;元素:指拥有相同核电荷数一类原子总称;分子:是保持物体化学性质最小微粒;离子:是指原子由于自身或外界作用而失去或得到一个或几个电子使其达到最外层电子数为8个或2个稳定结构。
这一过程称为电离。
电离过程所需或放出能量称为电离能具体理解如下:一、原子“原子是化学变化中最小微粒”,这一概念有三层含义:1. 原子也是一种微观上粒子。
2. 在化学变化中原子不能再分,不同原子组合成分子。
3. 原子由更小微粒:中子、质子、电子组成。
二、元素“同一类原子总称称为元素”,这一概念理解应注意以下几点:1. 元素是一个宏观概念,及分子、原子不同,它只论种类,不论个数,没有数量意义。
2. 核电荷数或质子数是划分元素种类唯一标准,也即核电荷数或质子数相同原子或离子或同位素都是同一类元素,如氢原子H、氢离子H+、重氢原子H都是氢元素。
3. 同种类元素可以有不同存在状态,单质中元素称为游离态,一般游离态化学性质和物理性质及化合态不同。
三、分子“分子是保持物质化学性质一种最小微粒”,这一概念包含三层含义:1. 分子是一种微观粒子,组成物质微观粒子有多种(如原子、离子、质子等),分子只是其中一种。
2. 分子不是最小微粒,只是在“保持物质化学性质”这一点上讲它是一种最小微粒,相同分子性质相同,不同分子性质不同。
3. 分子是由更小微粒:原子构成。
“其实分子、原子、元素之间还是有很密切联系,从下面这个图可以大致看出来:一、原子、分子、元素之间联系说明:(1)原子构成分子;(2)分子构成物质,如碳原子和氧原子构成二氧化碳分子,二氧化碳分子构成二氧化碳;(3)原子可直接构成物质,如铁原子构成铁,氦气由氦原子构成;(4)(5)同类原子总称为元素,而元素又组成物质。
二、运用分子、原子、元素概念进行描述时应注意问题1. 直接由分子构成物质(以二氧化碳为例)可以说:(1)二氧化碳由碳和氧两种元素组成(元素不讲个数)(2)二氧化碳由二氧化碳分子构成(宏观物质不讲个数)(3)二氧化碳分子由碳原子和氧原子构成(前后一致都不讲个数)(4)一个二氧化碳分子由一个碳原子和两个氧原子构成(都讲个数)2. 直接由原子构成物质(如铁)可以说:(1)铁由铁元素组成(元素为宏观概念,只讲种类,不讲个数)(2)铁由铁原子构成(铁物质是宏观概念,不讲个数)。
分子、原子、离子及元素的关系

联系
元素和原子是总体和个体的关系,原子是元素的个体,是构成并体现元素性质的最小微粒;元素是一类原子的总称,一种元素可以包含几种原子
Na、S
用阳离子符号表示,如
Na 、Mg
用阴离子符号表示,如
Cl 、OH
联系
得到电子得到电子
阳离子 原子 阴离子
失去电子失去电子
分子、原子和离子的比较
微粒
项目
分 子
原 子
离 子
概 念
保持物质化学性质的最小粒子
是化学变化中的最小粒子
带电的原子或原子团
表示方法
用化学式表示,如:
H 、He
用元素符号表示,如:
事 项
1、分子是保持物质化学性质的最小粒子
2、原子是化学变化中的最小粒子
3、分子是由原子构成的
4、对于原子直接构成的物质,原子是保持其化学性质的最小粒子
元素原子的结构特征与元素化学性质的关系
元素类别
最外层电子数
得失电子趋势
性质
结论
金属元素
<4
易失去最外层电子使次外层达到稳定结构
较易发生化学反应
元素的性质,特别是它的化学性质,与元素原子的最外层电子数关系密切
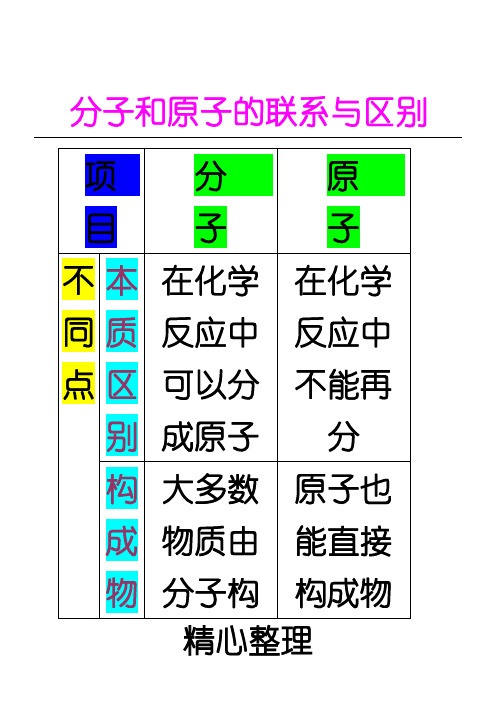
分子和原子的联系与区别
项 目
分 子
原 子
不同点
本质区别
在化学反应中可以分成原子
在化学反应中不能再分
构成物
质情况
大多数物质由分子构成
原子也能直接构成物质,但分子是由原子构成的
相 同 点
1、质量和体积都很小
2、都在不停地运动
3、粒子间由间隔
4、都是构成物质的粒子
5、同种粒子性质相同,不同种粒子性质不同
第2讲 分子、原子、离子及元素

结构模型的示意图,其中 a、 b、c 是 构成该原子的三种不同粒子。下列说 法正确的是 ( )
A.决定该原子种类的粒子是 b B.原子中 b 与 c 的数目一定相同 C.原子中 a 与 c 的数目一定相同 D.原子的质量集中在 a 和 c 上
3.每一格信息 (以碳元素为例 )
考点一
分子、原子 )
例 1 (2016· 济宁 )对下列事实的解释,不合理的是 (
A.通过气味辨别氮气和氨气 ——分子是运动的,不同分子的性 质不同 B.氧气经压缩储存在钢瓶中 ——压强增大,分子之间的间隔变 小 C.干冰升华为二氧化碳气体 ——状态变化,分子大小随之变化 D.蔗糖在热水中溶解更快——温度越高,分子运动速率越大
解析:本题考查了用分子的基本性质解释相关事 实。干冰为二氧化碳固体,干冰升华为二氧化碳气体, 状态变化,分子的间隔变大,但分子本身的大小不变, C 解释不合理,故选 C。
通常情况下,氮气为无色无味的气体,而氨气为无色 有刺激性气味的气体,不同分子性质不同,由于分子 是不断运动的,我们可以通过气味辨别氮气和氨气, 故 A 解释合理;气体分子间隔较大,经过压缩后分子 之间的间隔变小, 氧气经压缩可以储存在钢瓶中, 故B 解释合理;温度越高,分子运动越快,蔗糖在热水中 向水分子中扩散的速率更快,故 D 解释合理。 答案: C
数 ③元素可以组成单质或
②原子是微观粒子,既讲
种类,又讲个数 ③原子可以构成分子,也 可以直接构成物质
化合物
①元素是建立在原子的基础之上的,是具有相同质
子数(即核电荷数)的一类原子的总称
联系 ②原子核内的质子数决定元素的种类,即同种元素 的原子的核电荷数一定相同 ③元素的化学性质与原子最外层电子数有密切关系
原子、分子、离子、元素、物质之间的相互关系

+ 20 2
氖原子 微粒名称_______ 微粒符号_____ Ne
= 核外电子数 质子数___
周期数=原子的电子层数 铝离子 微粒名称_______ 微粒符号_____ Al3+ 核电荷数=质子数=核外电子数 相对原子质量=质子数+中子数
Hale Waihona Puke > 核外电子数 质子数___
单质
化合物
原子(或离子)结构示意图 氧离子 微粒名称_______ 微粒符号_____ O2< 核外电子数 质子数___
一种带2个单位正电荷的某离子核 外有18个电子,它的相对原子质 量为40,则下列说法正确的是 B A.该元素位于周期表第三周期 四 B.该粒子中子数为20 C.该粒子核电荷数为1820 D.该粒子质子数为18 20
分子、原子、离子、元素和化学式

分子、原子、离子、元素和化学式元素:具有相同核电荷数(即核内质子数)的一类原子总称元素。
原子的核电荷数(即核内质子数)决定原子或离子的元素种类。
①大部分单个的元素符号表示:一种元素、该元素的一个原子、一种单质但H N O Cl等符号不能表示单质,它们的单质是:H2 N2 O2 Cl2②地壳中元素按质量分数由多至少前四位是:O氧 Si硅 Al铝 Fe铁。
铝是地壳中含量最多的金属元素。
③化学的“语法”: “某分子”由“某原子构成”“某物质”由“某元素组成”或“某某分子构成”(金属单质、稀有气体讲由某原子直接构成)例:水由氢元素和氧元素组成,水由水分子构成。
1个水分子由2个氢原子和1个氧原子构成元素、物质都是宏观概念,只表示种类,不表示个数。
不能说“水是由二个氢元素和一个氧元素组成”④具有相同核电荷数的粒子不一定是同种元素,下列粒子有相同的核电荷数:⑴H2和He ⑵CO、N2和Si ⑶O2、S和S2- ⑷OH-和F-元素、分子和原子的区别与联系元素组成物质宏观概念,只讲种类,不讲个数同类原子总称构成构成构成微观概念,既讲种类,又讲个数原子分子粒子:如原子、离子、分子、电子、质子等,它们都是微观概念,既表示种类又可表示个数。
分子、原子、离子都是构成物质的粒子。
金属单质和稀有气体由原子直接构成;非金属单质、非金属与非金属形成的共价化合物由分子构成,化合物中既有金属元素又有非金属元素的离子化合物是由离子构成。
分子:分子是保持物质化学性质的最小粒子。
分子由原子构成,例:1个水分子由2个氢原子和1个氧原子构成原子:原子是化学变化中的最小粒子。
(注意:原子不是构成物质的最小粒子。
)原子的的构成:原子由核外带负电的电子和带正电的原子核构成,原子核由带正电的质子和不带电的中子构成。
在不显电性的粒子里:核电荷数=质子数=核外电子数注意:原子不是构成物质的最小粒子。
原子只是化学变化中的最小粒子;普通氢原子核中只有质子无中子,氢原子的原子核就是一个质子。
元素原子分子离子之间的关系

元素原子分子离子之间的关系
嘿,同学们!你们知道吗?在这个神奇的化学世界里,元素、原子、分子、离子,它们就像是一群神秘的小伙伴,有着千丝万缕的联系。
先来说说元素吧,这就好比是一个大家庭的姓氏。
比如说“氢”这个元素,就像是姓氢的一大家子。
而原子呢,那就是这个大家庭里的一个个成员。
比如说氢原子,它就是氢这个大家庭里的一份子。
那原子到底是啥呀?哎呀,你就想象一下,原子就像是一个个小小的球,特别特别小,小到咱们用眼睛根本看不到。
分子呢?分子就像是几个小伙伴手拉手抱在一起。
比如说氧气,它就是由两个氧原子手拉手组成的一个氧分子。
这像不像咱们在做游戏的时候,几个人一组紧紧拉在一起?
再说说离子。
离子就有点特别啦,它就像是原子这个小伙伴,一不小心丢了或者多了几个电子,然后就变成离子啦!
有一次上化学课,老师问我们:“同学们,你们能说说原子和分子的区别吗?”大家都七嘴八舌地讨论起来。
“我觉得分子比原子大!”小明抢着说。
“不对不对,应该是分子是由原子组成的!”小红着急地反驳。
老师笑着说:“同学们说得都有道理。
原子是化学变化中的最小粒子,而分子是保持物质化学性质的最小粒子。
”
哎呀,这么一说,是不是觉得元素、原子、分子、离子之间的关系有点清楚啦?
其实呀,它们就像是一个复杂的拼图,每个部分都不可或缺,共同构成了我们奇妙的化学世界。
如果没有元素,哪来的原子?没有原子,又怎么会有分子和离子呢?
所以说,化学世界真的太神奇啦!我们一定要好好探索,才能发现更多的奥秘!。
物质中分子、原子、质子、中子、电子、离子、夸克的概念和关系

物质中分子、原子、质子、中子、电子、离子、夸克的概念和关系物质由分子构成。
分子:化学变化中可分解的最小粒子,是一个稳定的结构。
原子:化学变化中最小粒子(物理中,原子是由原子核与核外电子组成)原子核:物理中,由质子和中子组成,原子核外有电子围绕电子:又称核外电子,顾名思义,是绕原子核高速运转的粒子,它的排布是分层的(一圈圈的),它的最外层电子个数决定着该原子的化学性质.离子:如果一个原子它得到电子,那么它叫阴离子(电子数比质子数多)如果一个原子它失去一个电子,那么它叫阳离子(电子数比质子数多) 质子:原子核的重要组成部分,原子核的质量大部分是由它组成的.中子:构成原子核的部分夸克:现今发现组成物质的最小粒子,组成质子和中子由小到大排列:(构成关系)夸克构成中子和质子构成原子核, 原子核与核外电子构成原子构成分子构成物质!粒子:包括分子,原子,质子,中子,电子全部。
原子:就是一个元素,比如氧气由两个氧原子够成,氢气由两个氢原子够成,二氧化碳由两个氧原子一个碳原子够成。
质子和中子一起构成原子核,通常质子的数量和电子的数量相同,质子带一个单位的正电菏,电子带一个单位的负电菏。
质子和中子质量一样,都等于一个H原子的质量。
为1。
通常中子和质子数量相同。
中子和质子的质量之和就是原子的质量,电子的质量太小,可以不记。
分子:分子就是由元素组成的,也可以说是由原子组成的,比如二氧化碳,氧气,氢气都是分子。
不过有些分子也是由一个原子构成,比如银,金等等。
也就是说,分子由原子构成,原子组成分子。
原子由原子核(原子核由质子和中子构成)和电子组成。
原子构成了分子原子由原子核和核外电子组成如果核外电子丢失或者得到电子,这个原子就变成了离子在原子核中有质子和中子,一个质子带一个单位的正电,与核外电子中和后呈中性因为离子的核外电子带电量不能和原子核带电量中和,所以离子是带电的量子是一个比较宽泛的概念~应该是指量子力学中研究的各种粒子,包括质子,中子,电子……粒子也是比较宽泛的概~泛指各种微粒。
元素分子原子的关系

元素分子原子的关系
嘿,咱今天就来讲讲元素、分子和原子的关系哈。
你看哈,元素就像是一个大家族,每个元素都有自己独特的性格和特点呢。
比如说氧元素,那可是生命离不开的呀。
而分子呢,就像是家族里的一个个小团体。
它们是由原子组合在一起形成的。
原子就像是一个个小精灵,它们手牵手组成了分子。
就说水分子吧,它就是由两个氢原子和一个氧原子组成的,这三个小精灵在一起,就成了我们每天都离不开的水啦。
再比如说氧气分子,那是由两个氧原子紧紧抱在一起形成的,给我们提供了呼吸的保障呢。
这些原子呀,就像是小朋友找伙伴一样,它们找到合适的小伙伴就组成了不同的分子。
而这些分子呢,又共同构成了我们丰富多彩的世界。
有时候我就想呀,这世界还真是奇妙,小小的原子组合起来就能有这么大的作用。
就像我们每个人看似普通,但团结在一起就能创造出很多了不起的事情。
就拿我们的身体来说吧,身体里有无数的分子和原子在忙碌地工作着,让我们能健康地活着,能跑能跳能笑能闹。
元素、分子和原子的关系,就像是一场奇妙的大冒险,它们相互合作,共同演绎着这个世界的精彩。
哎呀呀,说了这么多,其实就是想让你明白,它们可都是很重要的呀,少了谁都不行呢。
就像我们的生活一样,每一个部分都是不可或缺的。
好啦,今天关于元素分子原子关系的故事就讲到这里啦,希望你也能像我一样觉得它们有趣又神奇哟!嘿嘿。
元素原子分子离子之间的关系

元素原子分子离子之间的关系在我们探索物质世界的奥秘时,元素、原子、分子和离子是四个非常重要的概念。
它们相互关联,共同构成了丰富多彩的物质世界。
让我们用通俗易懂的方式来理解它们之间的关系。
首先,我们来聊聊元素。
元素是具有相同质子数(即核电荷数)的一类原子的总称。
这就好比是一个大家族的名称,比如“氢元素”“氧元素”“碳元素”等等。
每种元素都有独特的名称和符号,就像每个人都有自己的名字一样。
目前我们发现的元素有一百多种,它们被按照一定的规律排列在元素周期表中。
而原子呢,就是构成元素的基本粒子。
可以把原子想象成一个个小小的“球”,这些“球”有着复杂的内部结构。
原子的中心有一个很小很小但却很重的原子核,原子核由质子和中子组成。
质子带正电荷,中子不带电。
围绕着原子核高速运转的是电子,电子带负电荷。
原子的质子数决定了它属于哪种元素。
比如说,氢原子就只有一个质子,氧原子有 8 个质子。
分子则是由原子通过一定的方式结合而成的。
当两个或多个原子通过共用电子对或者其他方式结合在一起,形成一个保持物质化学性质的微粒,这就是分子。
例如,氧气(O₂)就是由两个氧原子组成的分子,水分子(H₂O)是由两个氢原子和一个氧原子组成的。
分子可以是同种原子构成,像氧气;也可以是不同种原子构成,像水。
离子又是怎么回事呢?当原子或分子得到或失去电子时,就会形成离子。
如果原子得到电子,就会带上负电荷,成为阴离子;要是失去电子,就带上正电荷,成为阳离子。
比如,钠原子(Na)失去一个电子,就变成了钠离子(Na⁺);氯原子(Cl)得到一个电子,就变成了氯离子(Cl⁻)。
那么,元素、原子、分子和离子之间到底有怎样紧密的联系呢?元素是宏观的概念,它是从众多原子中抽象出来的类别。
原子是构成元素的具体微粒,是微观的概念。
元素是同一类原子的总称,不同元素的原子具有不同的质子数。
原子可以通过一定的方式结合形成分子。
分子是保持物质化学性质的最小粒子。
许多物质都是由分子构成的,比如常见的气体、液体和大部分的固体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1、分子是保持物质化学性质的最小粒子
2、原子是化学变化中的最小粒子
3、分子是由原子构成的
4、对于原子直接构成的物质,原子是保持其化学性质的最小粒子
元素原子的结构特征与元素化学性质的关系
元素类别
最外层电子数
得失电子趋势
性质
结论
稳定结构
较易发生化学反应
元素的性质,特别是它的化学性质,与元素原子的最外层电子数关系密切
联
系
得电子 得电子
阳离子 原子 阴离子
失电子 失电子
构 分
成 裂
分子
元素与原子的比较
元 素
原 子
概念
具有相同核电荷数(即核内质子数)的一类原子的总称
化学变化中的最小粒子
区分
只讲种类,不讲个数
既将种类,又讲个数
使用范围
用于描述物质的宏观组成
用于描述物质的微观构成
举例
水由氢元素和氧元素组成,或说水中含有氢元素和氧元素
每个水分子由两个氢原子和一个氧原子构成
联系
元素和原子是总体和个体的关系,原子是元素的个体,是构成并体现元素性质的最小微粒;元素是一类原子的总称,一种元素可以包含几种原子
Na、S
用阳离子符号表示,如
Na 、Mg
用阴离子符号表示,如
Cl 、OH
联系
得到电子得到电子
阳离子 原子 阴离子
失去电子失去电子
分子、原子和离子的比较
微粒
项目
分 子
原 子
离 子
概 念
保持物质化学性质的最小粒子
是化学变化中的最小粒子
带电的原子或原子团
表示方法
用化学式表示,如:
H 、He
用元素符号表示,如:
分子和原子的联系与区别
项 目
分 子
原 子
不同点
本质区别
在化学反应中可以分成原子
在化学反应中不能再分
构成物
质情况
大多数物质由分子构成
原子也能直接构成物质,但分子是由原子构成的
相 同 点
1、质量和体积都很小
2、都在不停地运动
3、粒子间由间隔
4、都是构成物质的粒子
5、同种粒子性质相同,不同种粒子性质不同
注 意
非金属元素
≥4(氢为1)
易得到电子使最外层达到8个电子的稳定结构
稀有气体元素
=8(氦为2)
难得失电子(常称为稳定结构)
极难发生化学 反应
离子与原子的比较
粒子种类
原 子
离 子
阳离子
阴离子
区
别
粒子结 构
核内质子数=核外电子数
核内质子数>核外电子数
核内质子数<核外电子数
粒子电 性
不显电性
带正电
带负电
符号
用元素符号表示,如
H、Fe
用离子符号表示,如:
Na 、CO
微 粒
的
运 动
物理变化是分子运动的结果,如:水的蒸发
化学变化是原子运动的结果,如:水的电解
离子运动的结果可能是物理变化,也可能是化学变化,如:NaCl的溶解是物理变化,NaCl与AgNO 反应是化学变化
化学计量数与符号的关系
化学式、元素符号、离子符号前加上化学计量数,如:2H、2H 、3Na ,只表示分子、原子、离子的“个数”,不表示物质和元素
