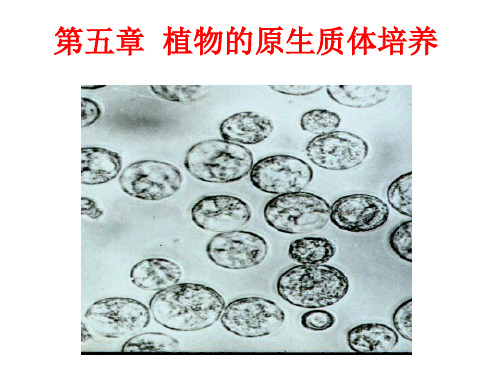
第五章原生质体培养
《原生质体育种》课件

化学诱变
使用化学诱变剂处理原生 质体,诱发基因突变,筛 选具有优良性状的新品种 。
细胞融合
将不同物种或同一物种不 同品系的原生质体进行融 合,以获得具有杂种优势 的新品种。
原生质体育种的应用
培育抗逆性强的新品种
改良作物的品质
通过原生质体育种技术,可以筛选出具有 较强抗逆性的新品种,如抗旱、抗寒、抗 盐碱等。
详细描述
物理法包括电融合、激光融合等,这些方法利用物理能量来诱导原生质体的融 合。化学法则是利用化学物质如聚乙二醇等诱导原生质体的融合。这些方法的 选择取决于实验条件和目的。
原生质体融合的应用
总结词
原生质体融合在植物育种、基因工程和生物技术等领 域有广泛的应用。
详细描述
在植物育种方面,原生质体融合可以用于创造新的植物 品种,通过将不同亲本的原生质体融合,可以产生具有 优良性状的杂种细胞,进而培育出新的植物品种。在基 因工程领域,原生质体融合可以用于基因转移和基因编 辑,通过将外源基因导入原生质体,可以实现基因的转 移和表达。此外,原生质体融合还可以用于研究细胞融 合的机制和细胞生物学特性,为生物技术的发展提供重 要的理论支持和实践经验。
现植物的遗传改良。
细胞融合
02
将不同植物的原生质体进行融合,创造新的植物品种或改良现
有品种。
细胞培养生产有用次生代谢产物
03
利用原生质体培养生产具有药用、工业或其他用途的次生代谢
产物。
02
原生质体融合
原生质体融合的定义
总结词
原生质体融合是将两种或多种植物细胞原生质体通过物理或化学方法融合,形成一个杂种细胞的技术 。
原生质体育种
目录
• 原生质体培养 • 原生质体融合 • 原生质体育种技术 • 原生质体育种的优势与挑战 • 原生质体育种案例分析
原生质体培养

原生质体培养原生质体培养原生质体(protoplast)是去除细胞壁的裸露植物细胞。
Klercker 在1892年第一次尝试用利刃对细胞进行机械切割而获得原生质体,产量和效率都很低。
1960年,Cocking采用真菌培养物中的纤维素酶来降解番茄根细胞壁,获得原生质体。
T akebe等(1971)首次获得烟草叶肉原生质体培养的再生植株。
在20世纪80年代中叶,先后从水稻和油菜原生质体培养出再生植株。
原生质体培养的研究成功,不仅是生命活动理论研究的一个良好体系,还可改良作为的某些性状,潜力巨大。
原生质体培养再生植株技术是细胞融合(cell fusion)、体细胞杂交(somatic cell hybridization)的基础。
体细胞杂交能使有性过程不能杂交的亲本之间进行遗传物质重组,在农作物育种上有广阔的应用前景。
近一二十年来,原生质体培养取得了可喜的成果。
据统计,1993年有分属于49个科、146个属的320多种植物,经原生质体培养得到了再生植株。
其趋势主要是农作物和经济植物,但从一年生扩展到多年生,从草本到木本、从高度植物到低等植物,如食用菌、藻类等。
原生质体培养目前已成为体细胞遗传学、遗传工程和改良作物品种等方面的新途径。
一、设备与用具:植物原生质体培养是在植物组织培养的基础上建立的一门技术。
因此,除了需要组织培养的设备与用具之外,还需要一些专门的仪器和用具:(一)倒置显微镜、荧光显微镜及照相设备,检查原生质体或细胞培养密度,采用血球计数板,在普通显微镜或倒置显微镜下观察。
观察培养皿、培养瓶或三角瓶中的培养物需用倒置显微镜。
检查原生质体活性及去壁情况时,用荧光染料染色后在荧光显微镜下观察。
显微镜一般都应备有显微照相设备,记录原生质体和细胞的生长状态。
(二)细菌过滤器,酶液不能高温高压灭菌,因为高温高压会使酶钝化破坏。
如果溶液中含有易被高温、高压破坏的物质时,必须用细菌过滤器过滤灭菌。
一般用0.45um的滤膜可以滤去细菌和病毒。
原生质体培养名词解释

原生质体培养名词解释原生质体培养是一种常用的植物组织培养技术,用于繁殖植物和研究植物基因转化等问题。
本文将介绍原生质体培养的定义、原理和应用等方面的名词解释。
下面是本店铺为大家精心编写的4篇《原生质体培养名词解释》,供大家借鉴与参考,希望对大家有所帮助。
《原生质体培养名词解释》篇11. 原生质体(Protoplast)原生质体是指从植物细胞中除去细胞壁后剩余的细胞质部分,包括细胞膜、质体、线粒体、质体小体、微管和微丝等细胞器。
原生质体是一个高度液态的细胞质体系,其形态和功能类似于一个微小的细胞。
原生质体可以通过融合实现远缘杂交,从而扩大植物遗传资源的利用范围。
2. 原生质体培养(Protoplast Culture)原生质体培养是指将离体的植物原生质体在适当的培养基上进行培养,以获得再生的植物组织或细胞。
原生质体培养的主要目的是通过原生质体的融合,克服远缘杂交障碍,实现植物遗传资源的利用和改良。
3. 原生质体融合(Protoplast Fusion)原生质体融合是指两个或多个原生质体合并成一个细胞的过程。
原生质体融合可以通过电激、化学处理或生物方法等手段诱导。
融合后的细胞称为杂种细胞,可以用于植物遗传资源的利用和改良。
4. 再生(Regeneration)再生是指通过培养技术,使离体的植物组织或细胞重新分化、再生为新的植株或组织。
再生是原生质体培养的重要应用之一,也是植物组织培养技术的基础。
5. 遗传转化(Genetic Transformation)遗传转化是指将外源基因或基因组导入植物细胞内,并使其表达的过程。
遗传转化是植物基因工程的重要组成部分,也是原生质体培养的应用之一。
通过原生质体培养技术,可以将目的基因导入植物细胞内,并实现植物的遗传转化。
6. 植物组织培养(Plant Tissue Culture)植物组织培养是指将离体的植物组织或细胞在适当的培养基上进行培养,以获得再生的植物组织或细胞。
第五章 原生质体培养与细胞杂交

半纤维素酶 Rhozyme Hp-150 (Rohm and Haas Co. inde. 美国宾西法尼亚州)。
培养基中含多少原生质体.用 CPW13M 悬浮原生质 体,血球计数板计数,计算稀释倍数,离心,去除 CPW13M,用所算体积的培养基悬起原生质体,用于 培养.
一、原生质体的培养基
1、在多数情况下原生质体所用的基本培养基为NT, KM,DPD、MS、B5 2、无机盐 3、大量元素浓度; (一般要低于愈伤组织培养基)
根据渗透剂的浓度和成分可分为以下几种培养基:
CPW13M: CPW 盐+13%甘露醇(mannitol) CPW9M: CPW 盐+9%甘露醇 CPW21S: CPW 盐+21%sucrose CPW0M: CPW 盐溶液。
多数情况下,甘露醇是常用的渗透剂,可能是由于它的钝 性及扩散入原生质体的速度很慢的缘故,这样一来能保证 一个稳定的渗透压。
4. 细胞质膜稳定剂
细胞质膜稳定剂,能防止质膜破坏,提高原生质体的稳定 性与活性,促进细胞壁形成及细胞分裂等。常用质膜稳定
剂有:葡萄糖硫酸钾、MES、CaCl•2H2O、KH2PO4
等。 MES:2-( N-morpholino) ethanesulfonic acid, 2-( N-吗啉) 乙烷磺酸
一般常用温度是23-32℃。酶处理时一般在暗处培养。叶片 分离原生质体可在静置条件下进行,悬浮细胞由于壁厚,培 养(分离)过程中间断低速震荡有利于酶渗透。
第五章 植物原生质体的分离与培养

八. 原生质体融合
(二)杂种细胞的选择与细胞杂种的鉴定 1. 杂种细胞的选择方法 (1)培养基促进异核体生长的选择方法 (2)叶绿素缺失互补选择法 (3)机械分离,肉眼分辩法 (4)双突变系选择法 (5)荧光标记选择法
八. 原生质体融合
2. 体细胞杂种的鉴定
这种鉴定不但在于确认细胞杂种的杂种
八. 原生质体融合
八. 原生质体融合
八. 原生质体融合
原生质体的融合过程
八. 原生质体融合
原生质体的融合过程
八. 原生质体融合
八. 原生质体融合
(一)原生质体融合的方法 1. 无机盐诱导融合 用来做融合剂的无机盐是硝酸钠,1972年
Carlsony就是用它来融合烟草的原生质体,并 首次获得种间的体细胞杂种。其原理是硝酸钠 的作用是中和了质膜的负电荷,使原生质体不 再相互排斥,而紧密结合在一起,但硝酸钠对 原生质体有害作用,且诱导频率也很低,所以 目前很少有人采用。
二. 植物原生质体的基本特点与作用
5.植物原生质体为研究细胞壁的生物合成
提供了方便。 6.植物原生质体为研究细胞膜与信息的传 递,能量的转换,物质的运输等基本现 象之间的密切联系提供了可能。 7.植物原生质体不但是良好的受体,同时 又是分离细胞内各种细胞器,如细胞核、 叶绿体、线粒体等的好材料。 见图1:
融合技术要点:
P1 P2
混合静止1min
P1 P2
加入PEG
选 择
培 养
高Ca2+高pH
加入培养基
融 合
洗 涤
电场下形成原生质体凝聚体
八. 原生质体融合
3. 电融合技术
就是使用电融合仪,其优点在于避免了
第五章:原生质体培养

细胞融合的过程
膜融合
胞质融合
核融合
植物体细胞杂交 过程示意图
(1) (2) (1) (5) (3)
(4)
2、不对称细胞杂交
除了用双亲完整的原生质进行诱导融合外,也 有用一个亲本的原生质体与另一亲本原生质 体的衍生系统 如: 原生质体与胞质体 原生质体与核质体
甘蓝白化苗下胚轴胞质体和甘蓝型油菜原生 质体诱导融合得到胞质杂种。
1、机械法分离原生质体时期
1892年由Klercker用于从质壁分离的 Stratiotes aloides 细胞分离原生质体;随 后 为 Chambers 和 Hofler(1931) 将 洋 葱 表皮组织的薄片浸在1.0mol/L 蔗糖溶液中, 当原生质体收缩脱离壁时用快的刀片切开 表皮细胞,获得了少量表皮细胞的原生质 体。
3、原生质体再生植株的遗传特性
原生质体再生植株往往在形态和性状方面出现 变异,如出现白化苗、“玻璃苗”、叶发生变异、 性别、育性及发育期等发生变异。除形态和性状发 生变异外,染色体的倍性和数目也常常发生变化。 造成变异的原因是多方面的,一种是分离原生质体 的材料本身所存在的,这在使用长期无性繁殖的植 物材料时更易发生。另一方面更重要的原因可能在 于原生质体操作本身引起的。
小结
原生质体分离
原生质体纯化
原生质体培养 胞壁再生 细胞分裂形成细胞团 再生植株
第二节 原生质体融合和细胞杂交
细胞融合(细胞杂交) 两种异源(种、属间)原生质体, 在诱导剂诱发下相互接触,从而发生膜 融合,胞质融合和核融合并形成杂种细 胞,进一步发育成杂种植物体,称为细 胞融合或细胞杂交。
一、细胞融合的类型
3、渗透压的稳定剂:
酶液、洗液和培养液中渗透压应和原生质体内的相 同或接近,渗透压略大些有利于原生质体的稳定,过大 会使原生质体收缩并阻碍原生质体的启动分裂。 广泛使用的渗透压调节剂使甘露醇和山梨醇、蔗 糖、葡萄糖和麦芽糖,其浓度约在0.4~0.6mol/L。 加入CaCl2、KH2PO4、葡聚糖硫酸钾都可以提高原 生质膜的稳定性,增加完整的原生质体数目和活力。葡 聚糖硫酸钾是通过降低酶液中核糖核酸酶活性,而有利 于原生质膜的稳定。
植物的原生质体培养
3). 纯化
将酶解悬浮液通过300-400目网, 将酶解悬浮液通过300-400目网,以除去大 300 目网 的未消化的碎片 然后将含有原生质体的酶液收集在离心管 低速离心,使原生质体沉于管底, 中,低速离心,使原生质体沉于管底,倾 去上清液 在离心管中加入适量洗涤液,再离心; 在离心管中加入适量洗涤液,再离心;重 复此步骤3 使酶解液充分除去; 复此步骤3次,使酶解液充分除去; 最后用原生质体培养液离心一次
植物原生质体培养的应用
1、利用原生质体融合获得融合细胞 、利用原生质体融合获得融合细胞 原生质体融合 2、利用原生质体进行外源基因的转化 、利用原生质体进行外源基因的转化 3、利用原生质体再生植株 、利用原生质体再生植株 4、利用固定化原生质体培养生产次级代谢产物 、利用固定化原生质体培养生产次级代谢产物 较多的分泌产物 5、利用原生质体进行生物转化 、利用原生质体进行生物转化 通过原生质体中存在的酶或酶系的催化作 将酶作用的底物转化为所需的产物, 用,将酶作用的底物转化为所需的产物,提高 转化效率
6、影响原生质体活力的因素: 影响原生质体活力的因素:
分离材料的生理状态; 分离材料的生理状态; 酶解条件:酶质量、浓度、酶解温度、 酶解条件:酶质量、浓度、酶解温度、 酶解时间、酶溶液的渗透压; 酶解时间、酶溶液的渗透压; 分离条件:离心次数、离心速度、纯 分离条件:离心次数、离心速度、 化方法、分离持续时间; 化方法、分离持续时间; 环境条件:操作环境的温度、 环境条件:操作环境的温度、分离用 具的影响。 具的影响。
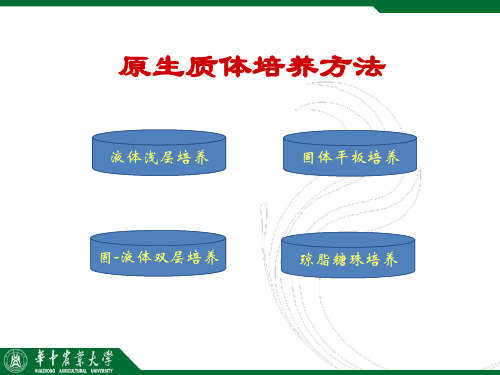
二)原生质体培养方法
液体浅层培养 固体培养 液体- 液体-固体双层培养 琼脂糖珠培养
三)影响原生质体培养的主要因素
基因型:如番茄与秘鲁番茄有性杂交后对性 基因型 状分离的遗传分析,证明其愈伤组织的再生 能力是2个显性基因所决定; 原生质体的来源:供体材料体类型、供体细 原生质体的来源 胞的分化程度、供体细胞的生长同步性; 起始培养密度与培养基:基本起始密度、培 起始培养密度与培养基 养基激素水平、密度与培养基营养成分完全 性。
植物的原生质体培养PPT课件

酶液中加入葡聚糖硫酸钾、CaCl2等盐类
保护细胞膜、提高原生质体稳定性和活力
.
19
3)原生质体分离过程:一步法 (以烟草叶片为例)
▪ 第一步:预处理即对烟草植株限制供水
▪ 第二步:取幼叶常规表面消毒后在无菌条件下剥 去外表皮切成4cm的小块
▪ 第三步:制作混合酶液(纤维素酶2%和果胶酶 0.5 % )并加入的0.7 mol甘露醇0.1 m mol
5、稳定性较差: 失去了细胞壁的保护作用,稳定性较差,易
于受到渗透压等条件变化的影.响。
6
原生质体用途
信息传递、能量转换 细胞壁合成机理 膜的结构与功能 核质关系 杂交或自交不亲和的机理 细胞间的相互作用 植物激素的作用机理
融合产生体细胞杂种 分离各种细胞器 引入各种细胞器 导入外源基因 诱发突变体
.
12
2)酶解法
1960年英国诺丁汉大学的科金第一次用酶解法从番 茄幼苗根尖中大量制备出原生质体;
常用酶:纤维素酶类、果胶酶类、半纤维素酶、蜗 牛酶等;
优点:条件温和、原生质体完整性好、活力 高、得率高,而且几乎所有的植物或它们的器 官组织或细胞均可用酶解法获得原生质体。
缺点:酶制剂中均含有核酸酶、蛋白酶、过 氧化物酶以及酚类物质,影响所获原生质体的 活力。
.
8
二、 原生质体的制备
不同的植物细胞,由于细胞壁的组成、结 构和性质有所不同,原生质体的制备方法也不 一样。
1、用于分离原生质体的材料准备:选取生长旺盛 的细胞,幼嫩的组织。
无菌试管苗叶片
上胚轴和子叶
培养细胞(愈伤组织)
.
9
2、原生质体的分离 1)、机械法:利刃机械切割 2)、酶解法:果胶酶和纤维素酶处理
原生质体培养

四,原生质体纯化
原生质体的纯化 方法
过滤离心法
漂浮法
沉降法和漂浮发 结合
五,原生质体鉴定与活力测定
原生质体的鉴定
正的原生质体
检验所获得的原生质体是否是真
(1)低渗胀破法:把原生质体放入低渗透溶液中,在显微镜下观察原生质 : 体从低渗溶液中吸水胀破的过程。如果是真正的原生质体,因为没有细 胞壁,这样在胀破后留下的残迹应该是无形的。如果原生质体还带有部 分细胞壁,则原生质体从无壁部分吸水向外膨胀直至胀破,破碎后留下 的残迹仍保持半圆形的细胞壁。 (2)荧光染色法:将原生质体放入离心管中,加入0.7mol/L甘露醇配置的 : 0.05%~0.1%荧光增白剂溶液,染色5~10min,离心、洗涤除去多余 的染料,在荧光显微镜观察。绿色光显示纤维素的存在,发出红色光的 是没有纤维素的真正的原生质体
原生质体的活力测定FDA)法:FDA本来没有荧光,当其进入细胞
后被脂酶分解为具有荧光的极性物,不能透过质膜,而是留在细胞内 发出荧光。因此能发出荧光的是具有活性的原生质体。②酚藏花红染 料法:具有活力的原生质体吸收染料显红色;无活力的不能吸收染料而 显示白色.③伊文思蓝染色法:有活力的细胞不能吸收染料为无色;而没 则能吸收染料显蓝色
其他法:①胞质环流法②渗透压变化③氧电极法
六,原生质体培养
液体浅层培养 液体培养法 液体悬滴培养
固体平板法
双层培养法
七,植株再生
经原生质体培养的植株再生一般经过细胞壁再生,细胞分裂成细胞团, 愈伤组织(或胚状体),植株再生这几个过程。 ①细胞壁再生:原生质体在合适条件下短时间内开始膨胀,叶绿体重排, 并开始合成新的细胞壁,进而由球形变成椭圆形。 ②细胞分裂:不同的植物细胞分裂时间不同。为了细胞能持续分裂,应注 意及时添加新鲜培养液。 ③愈伤组织:细胞不断分裂形成细胞团,并进一步形成愈伤组织。一些植 物由细胞系形成胚状体。 愈伤组织诱导:在合适的培养基,通过调节生长素和分裂素的 ④植株再生 比例,诱发芽和根的生成。 诱导胚状体:在原生质体培养时直接诱发胚状体的生长,从而 发育成完整植株。
第五章-药用植物原生质体培养

原生质体培养发展简史
1880 年 , Hanstein 首 次 起 用 原 生 质 体 (protoplast)一词。
1960年,Cocking首次应用酶法制备番茄根原 生质体获得成功。
1971年,Takebe et al.首次得到烟草叶肉原生 质体培养的再生植株。
1985年,Fujimura et al.第一例禾谷类作物- 水稻原生质体培养再生植株。
缺点:由于原生质体沉积于试管底部,造成 相互挤压,常引起原生质体的破碎。
2.1.2 漂浮法
原理:应用渗透剂含量较高的洗涤液(如蔗 糖浓度21%)使原生质体漂浮在液体的表面 。
步骤: ✓ 400目网筛过滤。离心。 ✓ 吸取上层液,洗涤液重悬,离心沉淀。重复
2-3次。 ✓ 收集溶液表面原生质体,用培养液洗1次。
酶分离法使用的酶
种类:纤维素酶类、果胶酶类、半纤维素酶 类、 崩溃酶、 蜗牛酶
果胶酶:是从根霉、黑曲霉中提取的,使细胞 间的果胶质降解,把细胞从组织内分离出来。
纤维素酶:是从绿色木霉中提取的,降解细 胞壁中纤维素的酶。
酶
来源
生产厂家
果胶酶类
Macerozyme R-10
Pectinase Pectolyase Y-23
2.5 微悬滴法培养
方法:吸取原生质体的悬浮液,滴于6cm直径 的培养皿的盖上,液滴大小 20-50µl左右,悬滴 培养。原生质体在液滴的中央生长。
为了防止培养基迅速蒸发,可以在培养基的 底皿里加液体培养基保湿。
3. 培养条件
KM-8p培养基,25℃-27℃,最初两周暗培 养(壁的形成和细胞再生);分化时补充光照 培养(光照16h/d,注意KM-8p在强光下对植物 有毒)最初几天经常摇动,以助透气。
原生质体培养的过程

原生质体培养的过程
原生质体的分离
机械分离法:先将细胞放在高渗糖溶液中预处理,待细胞发生轻微质壁分离,原生质体收缩成球形后,再用机械法磨碎组织,从伤口处可释放出完整的原生质体,该方法的缺点:获得完整的原生质体的数量比较少,能够用此法产生原生质体的植物种类受到限制。
优点:该方法可避免酶制剂对原生质体的破坏作用。
酶解分离法:指将材料放入能降解细胞壁的混合等渗酶液中保温一定时间,在酶液的作用下,细胞壁被降解,从而获得大量有活力的原生质体的方法。
优点:获得量大,适用广泛。
缺点:商品酶制剂均含有核酸酶、蛋白酶、过氧化物酶以及酚类物质,会影响所获原生质体的活力
原生质体的纯化
1过滤法,用滤网过滤酶解混合物,滤去未被酶解的细胞和组织块2离心法,低速离心,使完整的原生质体沉积于离心管底部
3漂浮法,采用比重大的高渗溶液,是原生质体漂浮
原生质体的培养方法
1固体培养法原生质体纯化、离心、稀释后,再与1.4%琼脂或琼脂糖(37?C左右)等体积混合成0.7% ,培养于培养皿中2浅层液体培养法培养皿中注入3-4ml培养液,成一薄层——接种一定密度(2x105/ml)原生质体——每日轻摇2-3次,加强通气——原生质体细胞壁产生——分裂形成细胞团——转至固体培养基,分化成苗
3双层培养法培养皿底部铺一层0.7%琼脂糖的固体培养基,在其上进行原生质体浅层培养。
第五章原生质体培养

细胞分裂和生长
一般原生质体培养2~7d后开始第一次分裂,
但开始第一次分裂的时间随植物的种类、分离
原生质体的材料、原生质体的质量、培养基的 成分和培养条件而异。 一般用幼苗的下胚轴、子叶、幼根、悬浮
培养细胞、未成熟种子子叶等为材料分离的原
生质体,比用叶分离的原生质体容易诱导分裂,
第一次分裂出现的时间较快。
琼脂糖珠培养
将含有原生质体的液态琼脂糖培养基用吸
管以大约50ul一滴的量滴于直径6cm的培养皿,
待其固化后向其中添加3ml液体培养基并于摇床
上低速旋转培养。培养过程中,通过调整液体
培养基的渗透压来调节培养物的渗透压以利于
其进一步的生长和发育。这种方法由于改善了
培养物的通气和营养环境,从而促进了原生质
a
b
c
d
e
f
a: first division, 10 days after protoplast isolation b,c: 2 and 3 wo microcolonies.
d,e: 4 and 6 wo microcalli
f: 8 wo microcalli just before being transferred onto B5h medium
体的分裂和细胞团的形成。
3、原生质体发育和植株再生
细胞壁再生 细胞分裂与生长 愈伤组织形成 植株再生
细胞壁的再生
原生质体培养数小时后开始再生新的细胞壁, 一至数天内便可形成完整的细胞壁。 电镜观察发现,原生质体培养数小时后新壁开 始形成,先是质膜合成形成细胞壁主要成分的微 纤维,然后转移到质膜表面进行聚合作用产生多 片层的结构,以后在质膜与片层之间或在膜上产 生小纤维丝,逐渐形成不定向的纤维团,最后形 成完整的细胞壁。
原生质体培养方法
的微纤维,然后转移到质膜表面进行聚合作用产生多片层的结构,之后在 质膜与片层结构之间或在膜上产生小纤维丝,逐渐形成不定向的纤维团, 最后形成完整的细胞壁
–只有能形成完好细胞壁的再生细胞才能进入细胞分裂阶段
2. 细胞分裂和生长
原生质体培养数天后,胞质增加,细胞器增殖,RNA、 蛋白质及多聚糖合成增加,不久即可发生核的有丝分裂及 胞质分裂 原生质体一般培养2~7 d开始第1次分裂,但第1次分裂 的时间随植物种类、分离原生质体的材料、原生质体质量、 培养基成分和培养条件而异 用幼苗下胚轴和子叶、幼根、悬浮培养的细胞、未成熟种 子的子叶等分离原生质体,一般比用叶肉分离原生质体容 易诱导分裂,第一次分裂出现的时间较快
固体平板培养:Solid culture
固体培养也就是琼脂糖包埋培养。低融点琼脂糖可在 30 C左右融化与原生质体混合而不影响原生质体的生 命活动。混合后的含有原生质体的培养基铺于培养皿 底部,封口后进行培养
优点:可以跟踪观察单个原生质体的发育情况,易于 统计原生质体分裂频率
缺点:操作要求严格,尤其是混合时的温度掌握必须 合适,温度偏高则影响原生质体的活力,温度偏低则 琼脂糖凝固太快原生质体不易混合均匀
4.植株再生
原生质体培养再生的愈伤组织可直接转移到分化培养基,一步成苗 (器官发生)。愈伤组织也可通过体细胞胚发生,先形成胚状体,再 诱导生芽、生根。不同植物种属,其再生方式不同
仙客来原生质体的Байду номын сангаас生
香蕉原生质体再生—Assani等2006
看护培养
Sugarbeet (糖 甜菜)callus and protoplast regeneration
原生质体培养实验

B、原生质体培养:将纯化的原生质体以0.5mlMS1培养基轻轻悬浮,
与等体积的MS2培养基混合均匀,加入30mm×10mm培养皿,用Parafilm
膜封口后放入27℃恒温培养箱中倒置(防止水分蒸发)进行暗培养;其中将 MS基本培养基中的大量元素减半,得到1/2MS,加入了2.4-二氯苯氧乙酸 2.5mg/L、6-糠基嘌呤0.5mg/L,另外含有蔗糖30g/L和甘露醇80g/L;MS2为 1/2MS,加入6-苄基嘌呤0.5mg/L、2,4-二氯苯氧乙酸1.0mg/L、奈乙酸 0.5mg/L,另外含有蔗糖30g/L和甘露醇80g/L,培养10天后,获得微小愈伤 组织,直接将微小愈伤组织转入芽分化培养基,该培养基为MS,加入了噻 重氮苯基脲0.5mg/L和活性炭3g/L;培养20后,获得具4片叶的小苗,再将小 苗转入诱根培养基,该培养基与MS1相同,但不含任何激素,而且加入了 活性炭3g/L;诱根 10天左右萌发4-5条不定根,即可进行移栽。
四、实验步骤
1、培养基及试剂的配制
➢ 原生质体培养基:MS+2,4-D 0.5+NAA1+BA0.5+蔗糖250mg/L+葡萄 糖10000mg/L+(琼脂1.2%)
➢ CPW溶液:KH2P04 27.2 mg/L,KN03 101 mg/L,CaCl2.2H20 1480 mg/L,MgS04.7H20 240 mg/L, KI 0.16 m g/L,CuS04.5H20 0.025 mg/L,pH 5. 6)。
➢ 质壁分离液CPW-13M的配制:含有13%甘露醇的CPW溶液 ➢ 细胞壁酶解液:2%(W/V)纤维素酶(cellulase Onzuka R-10) 、 1%(W/V)
半纤维素酶( hemicellulase H-2125, 0. 026 unit/m g)、0.5% (W/V)果胶酶 ( pectinase, 0.1 5 unit/m g)、0.5%离析酶(MacerozymeR-10)的CP W -9 M(含有9%甘露醇,5 mmol/L MES的CPW溶液,pH 5.2)液。 ➢ 洗涤液:含或不含250 μmol/L CaCl2,含5 mmol/L MES的9%甘露醇溶 液,pH 6.0。
第五章植物细胞培养及原生质体培养

(3) 悬浮培养特点:
培养过程中细胞总数不断增加,一定时间后产量达 最高点,生长趋于停止。然后进行移植继代培养,其过 程表现出严格可重复周期性变化,细胞增长规律与微生 物相同,有延迟期、对数生长期、减慢期及静止期等阶 段。植物细胞接种时要达到一定细胞浓度,通常为0. 25 x l0‘细胞/ml 一0. 5 x 10‘细胞/m1。
(1) 优良的悬浮细胞培养体系必需满足:
A. 悬浮培养物分散性好,细胞团较小,一般由几十 个以下的细胞组成。 B. 均一性好,细胞形状和细胞团大小大致相同。 C. 生长迅速,悬浮细胞的量一般2—3天甚至更短时 间便可增加一。
(2) 培养过程:
将愈伤组织、无菌苗、吸涨胚胎或外植体芽尖、根 尖及叶肉组织,经匀浆器破碎、纱布或不锈钢网过滤, 单细胞滤液作为按种材料,接种于液体培养基中振荡培 养。
(3)细胞悬浮培养的诱导:将离心管中近l/3的悬浮细胞 培养物倒入三角瓶中,并根据所需要的起始密度补加新鲜 培养基,悬浮细胞在120转/分,25℃黑暗下培养。并定 期计数细胞密度,计录并绘制细胞生长曲线. 4.细胞团和愈伤组织的再形成及植核再生 大约在悬浮培养2周后,将细胞分裂形成的小愈伤组织 团块(直径约1.5—2.5mm)及时转移到分化培养基上(Ms 基本成分,附加0.3%酵母提取物,0.3%水解酪蛋白, 10mg/L KT.0.4mg/L NAA及7.0%蔗糖)。连续光 照,空温25℃。3周后即可分化出试管苗。如果不及时转 移,愈伤组织团块很快失去分化能力,转入分化培养基后 即停止生长,变褐,死亡。
B. 连续培养(Continuous culture):
是用一定容积的非密闭系统进行 细胞培养的 方法,在培养过程中不断注入新鲜培养基,而使 营养物连续得到补充,细胞生长和增殖连续进行, 同时有等体积的培养物排除系统。 最大特点是细胞生长速率标准一致,新形成 的细胞补偿了被排出的细胞,系统内细胞密度、 生长速度、化学成分、细胞代谢活性都维持恒定。 可通过改变培养基及培养条件建立恒定系统。 恒化控制:通过营养液或某一成分 恒浊控制:比浊计测定浑浊度而进行流量控 制。
原生质体培养

净化的方法: A、清除较大碎屑:酶解后的混合物穿过一个镍丝网(50-
70um)
B、清除较小的物质:
1.沉降法 2.漂浮法 3.界面法
1.沉降法
镍丝网滤出液 置于离心管(离心2-3分钟,原生质 体沉于离心管底部,残液碎屑悬浮于上清液) 弃去 上清液 再把沉淀物重新悬浮于清洗培养基中(反 复3次)
酶液pH值:4.7-5.8,
酶溶液的pH值对原生质体的产量和生活力影响很大。 用菜豆叶片作培养材料时,发现原始pH值为5.0时, 原 生质体产生得很快,但损坏较严重,并且培养后大量破裂。 当pH值提高到6.0时,最初原生质体却产生少,但与pH 值为5.0时处理同样时间后相比,原生质体数量显著增加。 –高 活性低 –低 原生质体损坏多 –纤维素酶,p H5.4,果胶酶5.8,两种混合5.4~5.6
Pectolyase Y-23 黑曲霉 Seishin Pharm. Co. Ltd., Tokyo, Japan
半纤维素酶
Rhozyme HP-150 黑曲酶 Rohm and Hass Co., Philadelphia, PA 19105, USA
Hemicellulase 63178,USA
原生质体的培养
供体植物的选择
原生质体的培养基
培养条件
培养方法
细胞壁的形成
细胞分裂与愈伤组织形成
植株的再生
影响原生质体培养的因素
一、原生质体的培养基
1.在多数情况下原生质体所用的基本培养基为NT,KM, DPD、MS、B5
2.无机盐 大量元素浓度;(一般要低于愈伤组织培养基) NO3-和NH4+的比例;(降低NH4+ 、NO3- 增加有机氮) Ca2+浓度(增加,适当的浓度,能提高分裂细胞的百分数) 3.有机成分 维生素、氨基酸、糖(常用葡萄糖,过滤灭菌)及糖醇等,
第5章 原生质体及细胞悬浮培养

第二节 细胞培养生产有用物质
ቤተ መጻሕፍቲ ባይዱ
许多生活物质,包括药物、染料、香料、色 素等来源于植物,属于植物次生代谢产物; 传统方法:植物种植,适当时间获取植物相 关部位,提取(溶剂法、蒸馏法); 植物细胞培养成功,激发人们利用该体系, 作为有用物质的来源; 40年代后期,Bonner报道了银胶菊植物组织 培养物能产生橡胶; 30多种化合物在组织培养物中的积累等于或 超过其原植物的产量;
细胞生长动态
2. 连续培养
连续培养(continuous culture)是利用特制的培 养容器进行大规模细胞培养的一种培养方式; 不断排掉用过的培养基,注人新鲜培养基, 容积保持恒定下,营养物质不断得到补充。 连续培养有封闭型和开放型之分 ① 封闭型 细胞经机械方法收集起来之后,又被放回到 培养系统中;细胞总量不断增加;
细胞生长与次生物质合成
用于次生产物生产的植物组织培养物类型, 通常有五种,组织培养,器官培养,再生器 官培养、细胞培养和混合类型 很多研究说明,生长迅速而未分化的细胞培 养物一般不积累或很少积累为其原植物所含 有的次生产物,它们的合成通常要求在形态 上和生化上有某种程度的分化,生长较缓慢 的组织中 细胞生长与次生物质合成矛盾必须得到完善 的解决;
悬浮细胞的优势
悬浮培养与固体培养比较有三个优点: 一是增加培养细胞与培养液的接触面,改善 营养供应; 二是在振荡条件下可避免细胞代谢产生的有 害物质在局部积累而对细胞自身产生毒害; 三是振荡培养可以适当改善气体的交换。
Callus Formation ….…
一、细胞的分离
原生质体培养要求和融合

1、 将酶解后的原生质体悬液混匀,通过孔径 44-169 µm的筛网过滤(孔径大小因植物种类 而异),除去大的组织碎片和残渣。
2、将滤液与高渗溶液混合,在900-4500r/min 下离心,小心吸取上层的原生质体。重复洗23次。
也可以通过细胞器的转移,使物种获 得相应的性状。
5、 用于理论研究
如细胞壁的生物合成、原生质膜的结 构与功能、激素的作用机理、病毒的侵染 机理等。
原生质体研究已在细胞生物学、生 物技术、生理学、遗传学、病理学、病毒 学、育种学等领域得到广泛应用。
6、用于种质资源保存
A scheme of plant protoplast
6、原生质体的游离(分离)与纯化 1)原生质体的游离
经酶液处理后,细胞壁被降解,释 放出球状原生质体。为使原生质体从组 织上解离下来,酶解的最后2小时需轻 度振荡,速度为45转/分(rpm)。
酶解液
酶解后的产物包括:
完整原生质体
破碎的原生质体、未去壁的细胞(团)、细胞器及碎片 酶及其它不利于原生质体培养的试剂。
原生质体培养要求和融合
名词术语:
➢ 原生质体(protoplast):指除去细胞壁的细胞或是 一个被质膜所包围的裸露细胞。
➢ 亚原生质体(subprotoplast):在原生质体分离过程 中,有时会引起细胞中内含物的丢失而形成一些 较小的原生质体,称为亚原生质体。 它可以具有细胞核,也可以没有细胞核,或是 只有1条或少数几条染色体,具体情况有:
优点:方法简单。 缺点:原生质体沉积在试管底部,造成相互间挤压,引起原生质体破裂。
➢ C、界面法:
➢ 原理:采用两种比重不同的溶液,其中一种 比原生质体大,一种更小,使原生质体处于 两相的界面中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
伊凡蓝法:伊凡蓝不能穿过质膜,只有质膜受到严重损
坏使,细胞才能被染色,因而可以通过细胞被染色与否确 定活性。
5、影响原生质体活力的因素 分离材料的生理状态 酶解条件:酶质量、浓度、酶解温度、酶解时间、酶
溶液的渗透压
分离条件:离心次数、离心速度、纯化方法、分离持 续时间 环境条件:操作环境的温度、分离用具的影响
Recovery of plantlets through somatic embryogenesis
g
h
i
g: Transfer of microcalli onto B5H medium and induction of somatic embryos. h: Transfer of globular embryos onto Boi2y medium for maturation of somatic embryos. i: Transfer of cotyledonary stage embryos onto MS medium for conversion of embryo into plantlets.
Purified protoplasts
4、原生质体活力检测
目测法:在显微镜下观察,根据细胞形态、流动性确定
原生质体活力。
FDA法:FDA(二乙酸荧光素)是一种非极性物质,能
自由地穿越细胞质膜,在活细胞内,FDA被酯酶裂解即发 荧光(荧光素),由于荧光素不能自由通过质膜,因而可 以在荧光显微镜下通过具荧光的细胞的观察确定细胞活性 。
来源
绿色木霉 绿色木霉 Irpex lutens
生产厂家
Yakult Honsha Co. Ltd., Tokyo, Japan Calbiochem., San Diego, CA 92037, USA Kayowa Hakko Kogyo Co., Tokyo, Japan
果胶酶类
Macerozyme R-10 根霉 Pectinase 黑曲霉
体的分裂和细胞团的形成。
3、原生质体发育和植株再生
细胞壁再生 细胞分裂与生长 愈伤组织形成 植株再生
细胞壁的再生
原生质体培养数小时后开始再生新的细胞壁, 一至数天内便可形成完整的细胞壁。 电镜观察发现,原生质体培养数小时后新壁开 始形成,先是质膜合成形成细胞壁主要成分的微 纤维,然后转移到质膜表面进行聚合作用产生多 片层的结构,以后在质膜与片层之间或在膜上产 生小纤维丝,逐渐形成不定向的纤维团,最后形 成完整的细胞壁。
液体-固体双层培养
在培养皿的底部铺一层琼脂糖固体培养基,
再将原生质体悬浮液滴于固体培养基表面。
优点:
固体培养基中的营养物质可缓慢释放到液体
培养基中,如果在下层固体培养基中加一定量
的活性炭,则还可以吸附培养物产生的一些有
害物质,促进原生质体的分裂和细胞团的形成。
缺点:不易观察细胞的发育过程。
固体平板培养
建立细胞悬浮系
叶肉原生质体分离纯化
Leaves were cut in thin stripes and digested in an enzyme solution with mannitol
Purification of protoplasts from leaf debris on sucrose gradient.
琼脂糖珠培养
将含有原生质体的液态琼脂糖培养基用吸
管以大约50ul一滴的量滴于直径6cm的培养皿,
待其固化后向其中添加3ml液体培养基并于摇床
上低速旋转培养。培养过程中,通过调整液体
培养基的渗透压来调节培养物的渗透压以利于
其进一步的生长和发育。这种方法由于改善了
培养物的通气和营养环境,从而促进了原生质
a
b
c
d
e
f
a: first division, 10 days after protoplast isolation b,c: 2 and 3 wo microcolonies.
d,e: 4 and 6 wo microcalli
f: 8 wo microcalli just before being transferred onto B5h medium
二、原生质体培养 1、原生质体培养基
无机盐:大量元素浓度;NO3-和NH4+的比例;Ca2+浓度
有机成分:维生素、氨基酸、糖及糖醇等,酵母提取物、水解酪蛋白。 激素:常用的激素:NAA、IAA、BA与2,4-D 渗透压:常用的渗透压调节剂:甘露醇、山梨醇、蔗糖和葡萄糖等。
原生质体的渗透压原则:培养基渗透压与细胞渗透压等渗
Sigma Chemical Co.,St. Louis, MO 63178,USA
酶溶剂及其渗透压 酶溶剂:原生质体培养基或特殊配制。
渗透压调节剂:葡萄糖、甘露醇、山梨醇等
酶处理: 酶浓度 酶解时间 酶解温度
3、原生质体的收集和纯化 飘浮法:常用的飘浮剂:蔗糖、Percoll、Ficoll。 沉淀法:常用甘露醇作为渗透压调节剂,先将 酶液洗出干净,再用Percoll飘浮一次。
Yakylt Honsha Co. Ltd.,Tokyo, Japan Sigma Chemical Co., St. Louit, MO 63178,USA
Pectolyase Y-23
半纤维素酶
黑曲霉
Seishin Pharm. Co. Ltd., Tokyo, Japan
Rhozyme HP-150 黑曲酶Rohm and Hass Co., Philadelphia, PA 19105, USA Hemicellulase 黑曲霉
但越来越多的试验证明,两步成苗法更适 合大多数植物原生质体再生植株。即:首先 将愈伤组织培养于含低浓度生长素培养基上, 让其增殖和调整状态,再将其转移到分化培 养基上分化成苗。
a Friable embryogenic calli, b suspension cell aggregates, c freshly isolated protoplasts from suspension culture, d protoplasts stained with FDA, e division of cell derived from protoplasts, f cell colonies derived from protoplast, g proto-calli developed from protoplasts embedded in agarose, h green shoot formation, i fertile green plant Protoplast culture and fertile green plant regeneration of rye.
愈伤组织形成
通常原生质体培养2周后,形成多细胞的细胞团,Βιβλιοθήκη 周后形成肉眼可见的小细胞团,约6周
后形成直径1mm的小愈伤组织。 原生质体培养7~10d后需及时添加新鲜培养 基,否则形成的细胞团不继续生长。待小愈伤 组织长至约1mm时应及时转移到固体培养基上使 其进一步生长。
植株再生
原生质体形成的愈伤组织直接转移到分化 培养基上可一步成苗。
即琼脂糖包埋培养。低融点的琼脂糖可在约 30℃融化与原生质体混合而不影响原生质体的生 命活动。混合后含有原生质体的培养基铺于培养 皿底部,封口后进行培养。
优点:
可以跟踪观察单个原生质体的发育情况,易于 统计原生质体分裂频率。 缺点:
操作要求严格,尤其是混合时的温度掌握必需 合适,温度偏高则影响原生质体的活力,温度偏 低则琼脂糖凝固太快原生质体不易混合均匀。
2、原生质体培养方法
液体浅层培养
将含有原生质体的培养液在培养皿底部铺一 薄层,封口后进行培养。 优点: 操作简单,对原生质体的损伤小,且易于添 加新鲜培养基转移培养物。 缺点: 原生质体分布不均匀,常常发生原生质体之 间的粘连现象而影响其进一步的生长和发育。 此外,难以跟踪观察某一个细胞的发育情况。
第五章 原生质体培养
一、原生质体的制备 基础材料准备 预处理与酶解 原生质体收集与纯化
原生质体活力测定
1、用于分离原生质体材料的准备
无菌试管苗叶片
培养细胞
2、预处理与酶解 材料预处理:子叶、下胚轴;叶片;愈伤组织或 胚性悬浮细胞
叶肉原生质体
原生质体分离常用的商品酶
酶
纤维素酶类 onozuka R–10 Cellulysin Driselase
细胞分裂和生长
一般原生质体培养2~7d后开始第一次分裂,
但开始第一次分裂的时间随植物的种类、分离
原生质体的材料、原生质体的质量、培养基的 成分和培养条件而异。 一般用幼苗的下胚轴、子叶、幼根、悬浮
培养细胞、未成熟种子子叶等为材料分离的原
生质体,比用叶分离的原生质体容易诱导分裂,
第一次分裂出现的时间较快。
