第13章羧酸衍生物
第13章 羧酸衍生物
注意反应溶剂
13.3.4 羧酸衍生物与金属试剂的反应
常用于制备含有两个相同取代基的叔醇
如果要停留在酮,反应温度控制至关重要
13.3.5 酰胺的特殊反应
很好的亲核试剂
2 3 2 2
5 o 3 2
2 3 2 2 2
5 2
2 o
2 3 2 2 2
5
Hofmann降解:
(或NaOX) 反应机理:
制备少一个碳的伯胺
碱性条件下的酯交换
(2) 酸性介质中的反应,先是羰基质子化
O RC OR' O RC NH2 + H2O H
+
O RC OH
酸性条件下的酯交换
(3) 反应活性
O RCH2C X O RCH2C O OCR' O RCH2C OR' O RCH2C NH2
羰基碳的正电性减小,-H的活性减小
L的离去能力减小(离去基团的稳定性减小)
羰基的活性减小(取决于综合电子效应)
O
13.3.3 还原反应
RC O R O RC
X
LiAlH4 O
H
RCH2OH
LiAlH4 R LiAlH4 H3O+
H
O
RCH2OH
OR'
RCH2OH + R'OH
O RC O RC O RC NR'2 LiAlH4 H2O RCH2 NR'2 NHR' LiAlH4 H2O RCH2 NHR' NH2 LiAlH4 H2O RCH2 NH2
3
2
2
3 2
3
7
4
9
香蕉香
菠萝香
13-羧酸衍生物
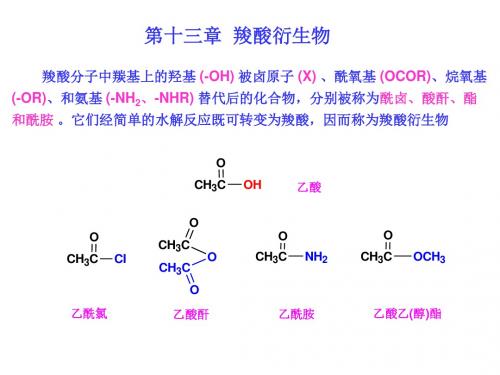
衍生物命名注意事项:
• 1 酰卤:首先正确叫出原羧酸的名称,改 成酰氯即可。 • 2 酸酐:准确叫出两个羧酸的名称,然后 再改成酸酐,相同羧酸的酸酐可以省略一 个。 • 3 酯:首先准确叫出羧酸的名称,然后准 确叫出醇的名称,最后定名为某酸某酯。 • 4 酰胺:先叫出N上的取代基,然后再叫出 羧酸名称,最后定名为酰胺。
酸性:
HCl > RCOOH > ROH > NH3
4~ 5 16~19 34
pKa: ~2.2
离去能力:Cl-> -OCOR> -OR’ > -NH2
∴活性:酰氯 > 酸酐> 酯 > 酰胺
(2) 酸碱理论:离去基团的难易 碱性越弱,越容易离去。离去基团L 的碱性由强到弱的次序:
Cl
> RCOO > RO > NH2
O C O
O C CH3
庚二酸单酰氯 6-氯甲酰基-己酸
O C O O C CH3
甲乙酸酐
O C O CH(CH3)2
COOEt
乙酸苯甲酸酐 混合酸酐命名:分别叫出 两个羧酸然后加” 酐” 。 O C OH 邻羟基苯甲酰苯胺 N-苯基邻羟基苯甲酰胺 NH
Cl 间氯苯甲酸异丙酯 3-氯苯甲酸异丙酯 COOCH3 对苯二甲酸甲乙酯
L
d
-
① p- 共轭使羰基碳上正电密度降低
R-C
使C-L具有部分双键性质 不利于酰基化反应发生
O p- -Cl <
期元素
-O-C-R
酰基是 吸电子基
<
-O-R' < -NH2
烃基是 斥电子基 电负性:
共轭的强度: 第三周
O>N
即酰氯的羰基碳最正。
∴活性:酰氯>酸酐>酯>酰胺
第十三章 羧 酸 衍 生 物

剧烈反应
O
=
(C H 3)3C C O O H 位阻大
SOCl2
(C H 3)3C C O C l
C6H5OH 吡 啶
(C H 3)3C C O C 6H5
O C
O
反应活性较差
应可用于从低沸点酯制备高沸点酯。如:
C H2 =C HC O O C 3 H + C H3(C H2)2C H2O H
b.p: 80.5℃ 低沸点酯
综上所述,羧酸衍生物的反应活性顺序为:
O X > R C O R C
R C
=
=
O O > R C
=
O > R C OR’
=
O NH2
醛/酮的活性介于酸酐和酯之间,其中醛的活性大于酮
=
⑴ 水解
特点: a.产物均有羧酸生成。 b.活性:酰卤
O R C Cl
剧烈反应
〉酸酐 〉酯 〉酰胺
+
H 2O
RCOOH+ HCl 2RCOOH RCOOH+ R'OH RCOOH+ NH4+
MgX
O + O O
H2O
COCH2CH2COOH H3CO
H3CO
⑶ 酯与格氏试剂的反应
+ R C= O R” R’MgX
醚
R C O R” R’
R’MgX 醚
OR ”
R C R’
R R’ C OH
R R’ C R’
H3O
=
O
O MgX
Mg
X
O
+
O MgX
结构 R’ 对称的 叔醇
比较反应活性:
< R C R’ R C= O R”
第十三章-+羧酸衍生物

Ac2O
H2N CH3
KMnO4 / H+ AcHN CH3
AcHN
COOH
H+ / H2O
H2N
COOH
降低反应活性,制备酚、芳胺的单卤代化合物
OH
Ac2O
OAc
Br2 / Fe
OAc
H+ / H2O
OH
Br
Br
23
五、格氏反应
O Ph C Cl CH3MgBr Et2O OMgBr Ph C Cl CH3 -MgBrCl O Ph C CH3 CH3MgBr OMgBr Ph C CH3 CH3 H3O+ OH Ph C CH3 CH3
R CO2C2H5 O NaOC2H5 C2H5OH
R CO2C2H5 O
R R' R'X CO2C2H5 O 1) NaOH 2) H3O O R R' 双烷基化
乙酰乙酸乙酯制备甲基酮衍生物
甲酸己酯:苹果香味 甲酸苄酯:香蕉香气 乙酸苯乙酯:玫瑰清甜蜜香 苯乙酸苄酯:茉莉香气
11
二、化学性质:亲核取代反应
1.水解反应(hydrolysis)
O R C O R C O R C O R C NH2(R') OR' O X H 2O HX O C R' O O R H2 O HOR' H+ or OH H2 O H+ or OH HNH2 (HNHR') C OH + HO C R'
苯甲酰溴
4
2、酸酐的命名
以酐为母体,前面加酸的名称
CH3CH2CO-O-OCCH3
O O H C O C H
[工学]第十三章--羧酸及其衍生物PPT课件
![[工学]第十三章--羧酸及其衍生物PPT课件](https://img.taocdn.com/s3/m/b7c4094d53d380eb6294dd88d0d233d4b04e3f5c.png)
强、宽谱带
NMR:
-COOH 上质子的化学位移9.5~13ppm
-
11
§13.3 羧酸的化学性质
-COOH的结构: C(近似)sp2杂化
O
O
P-π共轭,羟基、
R
C O
R H
C
O.. H
羰基不是独立的
H离解后负电荷为- 三原子共同承担
12
O
O-
RC
RC
O-
O
共 振酸 结根 构的 式
亲核试剂进攻生成羧酸衍生物
反丁烯二酸 (富马酸)
-
6
§13.2 羧酸的物理性质和波谱性质
• C1~3:无色透明液体 C4~10: 油状液体 C10以上:蜡状固体。 • 饱和一元羧酸的沸点随分子量的增加而升高。
分子量相近时,沸点:羧酸>醇。
原因:羧酸氢键较稳定,并形成双分子缔合。
O HO
H3CC OH
CCH3 O
例:甲酸 (101℃) > 乙醇 (78℃)
解: -Cl 连在开链烃上主要为诱导效应,距离越近作用越大。
酸性:CH3CHClCOOH > CH2ClCH2COOH
-
18
例:比较酸性
COOH
COOHCOOH COOH
OC3H HO
H2N
解:供电子强弱顺序:-NH2 > -OH > -OCH3 都使酸性减弱
COOH COOH COOH COOH
-
30
二.由烃氧化制备
CH 3
KMnO4
H+
COOH
烯烃、有α-H的烷基苯氧化
三.由R-MgX制备
R-MgX + O=C=O
羧酸衍生物

第十三章羧酸衍生物第一节羧酸衍生物的结构和命名一、羧酸衍生物的结构羧酸衍生物在结构上的共同特点是都含有酰基(),酰基与其所连的基团都能形成P-π共轭体系。
二、羧酸衍生物的命名酰卤和酰胺根据酰基称为某酰某。
酸酐的命名是在相应羧酸的名称之后加一"酐"字。
例如:酯的命名是根据形成它的酸和醇称为某酸某酯。
例如:三、羧酸衍生物的光谱性质1.IR:醛、酮、羧酸、酰卤、酸酐、酯和酰胺都含有羰基,因此,在IR都有C=O的强吸收峰。
醛、酮的νC=O 1705~1740cm-1 ,羧酸衍生物的C=O伸缩振动扩大到了1550~1928 cm-1. 这是因为:酸酐:在1800-1860cm-1(强)和1750-1800cm-1(强)区域有两个C=O伸拉振动吸收峰,这两个峰往往相隔60cm-1左右。
对于线形酸酐,高频峰较强于低频峰,而环状酸酐则反之。
另外:C-O的伸拉振动吸收在1045~1310/cm(强)。
酯:酯的C=O伸缩振动稍高于酮,在1735~1750cm-1处,与芳基相连的则降至1715~1730 cm-1 ,酯在1015~1300 cm-1 区域内有两个强的C-O伸缩谱带。
可以与酮相区别。
一级酰胺,-NH2的N-H吸收为两个峰。
二级酰胺N-H为一个尖峰。
2.核磁共振(NMR):酯:RCOOCH δ=3.7~4.1ppm。
酰胺:RCONH δ=5~8ppm。
往往不能给出一个尖锐的峰。
四.羧酸衍生物的亲核取代反应分为加成-消除两步:加成一步取决于电子因素和空间因素。
消除一步取决于L的碱性和稳定性。
L碱性越弱,越容易离去;L 越稳定,越容易离去。
就酰氯、酸酐、酯、酰酐、酰胺而言,L的碱性为:Cl-< R-COO-< R'O-< NH2-;L的稳定性为:Cl->R-COO-> R'O-> NH2-,所以羧酸衍生物的活性为:羧酸的衍生物在碱性或酸性条件下比在中性溶液中更容易水解,这是可以理解的:碱性溶液提供给氢氧根离子,它充当一种强的亲核试剂;酸性溶液提供给氢离子,它接到羰基氧上从而使分子易受弱亲核试剂,即水的进攻。
第十三章羧酸衍生物ppt文档

O H3C C
O
乙酸甲酯
CH 3
CH3 O H2C= CC
O CH3
甲基丙烯酸甲酯
O H3C C
OCH 2CH 3
乙酸乙酯
O H3C C
O CH=C2 H
乙酸乙烯酯
内酯用希腊字母标明羟基的位置,酯前加 “内”字
γ-丁内酯
δ-戊内酯
二元羧酸与一元醇生成的酯,分为酸性酯和中性酯。
CONH2 Br2
NaOH H2O
COOH
NH2 COOH
减碳反应,制伯胺
反应历程:
O
OH
RC-NH + Br2
H
O
O
OH
RC-N Br
RC -N
Br
H
R N=C=O H2O
OH
RNH2 + CO32-
13.5 碳酸衍生物
HC O OH CC l Cl RC OOR
13.4.1 酰基上的亲核取代反应 三解(水解、氨解、醇解)
酰化剂:能够提供酰基的化合物称为酰化剂 常用酰卤、酸酐。
酰化反应:由酰化剂与含活泼氢的化合物 (如醇、酚、氨、胺、含α-H的酯、醛、酮等) 进行的反应称为酰化反应,也叫酰基转移反应。
酰化反应的应用
有机合成中保护易氧化的酚羟基和芳胺基
降低某些化合物的反应活性 (如制备酚、芳胺的单卤代化合物) 药物中引入酰基可改善疗效。
酰卤的三解
H2O
O
R C + R'OH
X
NH3
RCOOH + HX
O
RC
+ HX
O R'
O
第十三章 羧酸衍生物

O
O + R C OH
O CF3 C O
混酐
37
O
O OH
C R + CF3 C
三氟乙酸形成的混酐是一个良好的酰化试剂,在合成 上用处很大。 例:酚不易和酸形成酯,而在三氟乙酐存在下这个反应 很容易进行。
CH3 CH3 COOH CH3
H 3C
O CF3 C
+ HO
H 3C
CH3
2
O 25℃
CH3 CH3
(CH3CO)2O CH2CH2C
O
CH2CH2C O
CH3CH2OH CH2CH2COOC2H5
SOCl2
CH2CH2COOC2H5 CH2CH2COCl
Br
CH2CH2COOH
Br2
CH2CH2COOC2H5 CH3CH2OH CH2CHCOOC2H5 CH2CHCOCl Br
30
CH2CH2COOC2H5
酰氯:1800 cm-1
酸酐:1825 ~ 1815,1755 ~ 1745 cm-1 两个吸收峰
这两个峰往往相隔 60 cm-1 酯: 1740 cm-1
酰胺: 1690 ~ 1630 cm-1 腈: 腈的C≡N伸缩振动吸收在2240~2260cm-1
11
酰胺的N-H伸缩振动吸收:
O R
O R NHR'
Cl:表现为吸电子诱导效应,与羰基共轭效应很弱。 例:
CH3 Cl
178.9 pm
178.4 pm
4
N:表现为与羰基的共轭效应。
O
例:
H
NH2
CH3 NH2
137.6 pm
147.4 pm
α氢的活泼性:
有机化学第13章 羧酸衍生物

35
另一方面,乙酰胺的水溶液能与氧化汞作用生成稳定的汞盐。
酰胺与金属钠在乙醚溶液中作用,也能生成钠盐,但它遇水即 分解。这些说明酰胺具有弱酸性。
O C NH C O
邻苯二甲酰亚胺
36
2.酰胺脱水
酰胺与强脱水剂共热或高温加热,则分子内脱水生成腈,这
是合成腈最常用的方法之一。常用的脱水剂有五氧化二磷和亚硫
10
IR:
11
酰卤的C=O伸缩振动在1815~1785cm-1区域有强吸收,其C—X
的面内弯曲振动在645 cm-1附近。
12
酸 酐的 C=O伸 缩 振动 吸 收 与其它 羰 基 化合物 明 显不 同 , 在 1850~1800cm-1和1780~1740 cm-1区域内有两个C=O伸缩振动的强 吸收峰。线型酸酐的高频峰强于低频峰,而环状酸酐则相反。酸酐
26
酰基化试剂中离去基团离去的难易,取决于离去基团(L)的碱 性。碱性愈弱,愈易离去。离去基团L的碱性由弱到强的次序是:
C1—<RCOO—<RO—<NH2—。因此氯原于是最容易离去的基团,
而氨基则是最难离去的基团。即酰氯是最活泼的酰基化试剂,而酰 胺是最弱者。 离去基团碱性的强弱,可从其共轭酸的酸性强弱得知(强酸的 共轭碱是弱碱):
酯的醇解亦称酯交换反应。例如:
21
腈的醇溶液和浓硫酸或盐酸共热,则发生醇解反应得到酯。 例如:
22
3.氨解
酰氯、酸酐和酯与氨或胺作用,都可以生成酰胺。例如:
23
N-未取代的酰胺与胺反应生成N-取代酰胺。例如:
以上这些反应对羧酸衍生物是发生了水解、醇解或氨解;但对 水、醇或氨则是发生了酰基化反应。酰氯、酸酐和酯都是酰基化试 剂,酰胺的酰化能力极弱,一般不用作酰基化试剂。
第十三章 羧酸衍生物

第十三章 羧酸衍生物1. 说明下列名词:酯、油脂、皂化值、干性油、碘值、非离子型洗涤剂。
答案:酯:是指酸和醇之间脱水后的生成物,它包括无机酸酯和有机酸酯,如硫酸酯,磷酸酯和羧酸酯。
油酯:是指高级脂肪酸与甘油之间形成的酸类化合物,通常称为甘油三酯。
皂化值:是完全水解1克油脂所需的氢氧化钾毫克数。
油脂在碱催化下水解反应称为皂化。
干性:是指空气中会逐渐就有韧性的固态薄膜的油脂。
油的这种结膜牲叫做干性。
干性油通常是由不饱和脂肪酸组成的甘油三酯。
碘值:是指100克不饱和脂肪酸甘油酸通过C=C 键的加成反应所能吸叫的碘的质量(克)。
碘值的大小反映了油脂的不饱和程度的高低,它是油脂分析的一项重要指标。
非离子型洗涤剂:是指一类中性的具有OCH 2CH 2OHn结构单元的即告醚表面活性剂。
最常用的非离子型洗涤剂为C 8H 17OCH 2CH 2OHn2. 试用方程式表示下列化合物的合成路线: (1) 由氯丙烷合成丁酰胺; (2) 由丁酰胺合成丙胺;(3) 由邻氯苯酚、光气、甲胺合成农药“害扑威”答案: (1)CH 3CH 2CH 2Cl CH 3CH 2CH 2CONH 2CH3CH 2CH 2Cl乙醚CH 3CH 2CH 2MgClCH 3CH 2CH 2COOHNH 3CH 3CH 2CH 2COONH 4CH 3CH 2CH 2CONH 2+H 2O(2)CH 3CH 2CH 2CONH 2CH 3CH 2CH 2NH 2CH 3CH 2CH 2CONH 2NaOHCH 3CH 2CH 2CONHNaBr 2CH 3CH 2CH 2CONHBrNaOH-HBrCH 3CH 2CH 2CONCH 3CH 2CH 2NC OH 3O +CH 3CH 2CH 2NH 2(3)COCl 2+CH 3NH 2ClCNHCH 3OClOCONHCH 3Cl OH3.用简单的反应来区别下列各组化合物:答案:CH 3CHCH 2COOH +H 2OCH 3CHCH 2COOCl+H 3O无明显热效应CH 3CH 2CH 2COCl +H 2OCH 3CH 2CH 2COOH +HCl(1)(2)CH 3CH 2CH 2COOC 2H 5+NH 2OH .HClCH 3CH 2CH 2COONHOH+C 2H 5OHCH 3CH 2CH 2COONHOH +FeCl 3C 3CH 2CONHFe3+HCl 3CH 3CH 2CONH 2+NH 2OH .HCl无反应(3)CH 3COOC 2H 5+NaHCO 3无反应CH 3OCH2COOH +NaHCO 3CH 3OCH 2COONa +CO 2(4)CH 3COONH 4+NaOH CH 3COONa +NH 3CH 3CONH 2+NaOH CH 3CONHNa +H 2O(5)(CH 3CO)2O +H 2O 2CH 3COOH放热反应CH3COOC 2H 5+H 2O无反应答案:CH 2+HBr 过氧化物CH 2BrNaCNCH 2CN答案:CH 3COCH 3Mg TiCl 3COH OH3C OH OHCH HCH 3CC(CH 3)3O2,(CH 3)3CCOOH +CHBr 3答案:Mg乙醚(CH 3)2CHBr(CH 3)2CHMgBr 环氧乙烷(CH 3)2CH 2CH 2OMgBrPBr 3(CH 3)2CHCH 2CH 2Br HCCNa +CH 3CH 2CH 2CH 2BrHC CCH 2CH 2CH 2CH 3NaNH 2NaC CCH 2CH 2CH 2CH 3(CH 3)2CHCH 2CH 2Br(CH 3)3HCH 2CH 2CCCH 2CH 2CH 2CH 3H ,Pd-BaSO CCHCH 2CH 2CH 2CH 3H(CH 3)3CHCH 2CH 2答案:CH 2CH(CH 2)8COOHBrCH 2(CH 2)9COOHCH 3COCH 2COOEt2BuLiLiCH 2COCHLiCOOEtBrCH (CH )COOH (1)H 3O +EtOOCCH 2COCH 2CH 2(CH 2)9COOH4EtOOCCH 2CH(CH 2)11COOHOHCH(CH 2)11COOHEtOOCCHH 2,NiEtOOC(CH 2)11COOHEtOOC(CH 2)11COOEt答案:COOHCOOH C 2H 5OOHH COOC 2H 5OHCOOC 2H 5OH 25OCOOC 2H 525OCOOC 2H 525OCOOC 2H 5C 2H 5(1)-H 3OOCOOHC 2H5OC 2H 5答案:CH 2(COOC 2H 5)22C 2H 5ONaNaCH 2(COOC 2H 5)22BrC 2H 5BrCH 2CH(COOC 2H 5)2CH 2CH(COOC 2H 5)2C 2H 5ONa2CHC(COOC 2H 5)2CH 2C(COOC 2H 5)2BrC 2H 5BrCOOC 2H 5CC COOC 2H 5OOH 5C 2OH 5C 2O(1)-H 3O COOHCOOH答案:CH3CH3KMnO4COOHCOOHLiAlH4CH2OHCH2OH PBr3CH2BrCH2BrCH2CNCH2CNHClC2H5OHCH2COOC2H5CH2COOC2H5C H ONaOCOOC2H5O(1)OHH3O+(2)答案:OHHOClSO3HOHHOHO3S SO3HHNO324OHHOHO3S SO3HNO23+OHHONO2答案:+CH 3+OOO3CH 3COOH多聚磷酸CH 3OONaBH 4CH 3HOOHCH 3答案:3O答案:++OOOAlCl 3OCOOH多聚磷酸OMgBrOMgBr15.某化合物A 的熔点为85°C,MS 分子离子峰在480m/e,A 不含卤素、氮和硫。
有机化学课件第十三章 羧酸衍生物

四、与格氏试剂的反应
RCOX + R'MgX RCOR' 1) R'MgX 2)H2O OH R C R' R'
13.3 羧酸酯 13.3.1 羧酸酯的物理性质 1、 沸点比相应的醇低; 2、 在水中的溶解度较小; 3、有芳香气味。 13.3.2 羧酸酯的化学性质 一、酯的水解、醇解和氨解
RCO2R' + H2O 水解 酯化 RCOOH + R'OH
RCH2CO2Et EtOH EtONa RCH2 O C CH CO2Et R
练习
H C
CO2Et
H C _
O CO2Et + H C+
CHO O CH2CO2Et H C OEt
O Ph C HC CO2Et
O Ph C + +
_ HC
CO2Et
CH3 O Ph C OEt
CH3 CH3CH2 CO2Et
CO2Et CO2Et
Na EtOH
CH2OH CH2OH
2、酮醇缩合反应(非质子性溶剂)
O R C OR' Na, 二甲苯 R R CH OH C O
历程
O R C O R C OR' OR' O-Na+ Na. R C
Na.
. .
OR' R R OR'
O-Na+ C C OR' OR'
R
C
O-Na+ R R C C
CH3COCH2CO2Et 1)OH-,H2O 1)EtONa RCOX CH3COCHCO2Et COCH3
2)H3O+
第13章___羧酸衍生物
O H3C C OC2H5
+ C2H5MgCl
13.4.6 酰氨氮原子上的反应 (1) 酰胺的酸碱性
胺是碱性的 酰胺是中性的 酰亚胺略带酸性
O
O
..
R C NH2
O
NH + KOH
NK
O
邻苯二甲酰亚胺
O
邻苯二甲酰亚胺钾
酰胺一般被认为是中性的。但有时酰胺可表现出弱碱性和弱酸性:
CH3CONH2 + HCl 乙醚
13.4.5 与Grignard试剂的反应
四种羧酸衍生物均可与Grignard试剂作用,生成相应的叔醇。然而, 在合成中用途比较大的是酯和酰卤(尤其是酯)与Grignard试剂的作用。
(1) Grignard试剂与酯的反应
=
=
R C =O + R’MgX 醚
X
OMgX RCX
O MgX2 R C R’
õõõ ù õ é õõ ù ° ±õ ù
Nu(õ ×õõõ)õ H2O (HO-) õ R'OH õ NH3
成 , 后反 消应 除是 ,分 最步 终完 生成 成的 取: 代先 产亲 物核 。加
羧酸衍生物的反应活性:
第一步——取决于羰基碳原子的亲电性。 羰基碳原子连有吸电子基团,使反应活性↑;反之,反应活性↓
R’
R
R’MgX
醚 R’
C
R’ H3O+
R R’ C R’
OMgX
OH
比较反应活性:
R
C =O
>R
O C R’
X
结构对称的叔醇
结论:反应可以停留在生成酮的阶段。
例1:
O
C6H5-C-OC2H5
有机课件 第十三章 羧酸衍生物

R
C
OR '
4、酰胺:是羧酸分子中的羟基被氨基(—NH2) 或烃氨基(—NHR,—NR2)取代后的生成物。
二、命名:
O
R C 的名称是将RCOOH中的“酸”字改 为“酰”字。 1、酰卤和胺:酰基名称+卤素名称或胺。如: 乙酰氯、丁酰溴、丙烯酰胺、N—乙基乙酰胺等。 2、酸酐:羧酸名称后加“酐”字。如:乙酸酐、 乙丙酸酐等。 3、羧酸名称后加烃基名称,最后加“酯”。如: 乙酸乙酯、苯甲酸苄酯等。
1、 建立产物分子可需的骨架
2、 官能团的转化
由原料通过某些化学反应得产物分子可需的骨架 时,若官能团不是产物所需,则需转化。
如:由CH2=CH2→CH3CH2CH2CH2OH
三、有机合成设计:
<一>、建立产物分子可需的骨架;
1、 产物属什么类型的化合物?
2、 这种化合物有什么方法制备?
3、 是否需要增长或减短碳链? 4、 分析产物分子的骨架 1>、 "切断"产物的分子骨架;"碎片"进行常 见的增碳、减碳等反应得产物骨架。
(NH3)
R' — NH
C
(NH2 — COOR)
方法2: COCl2+R'NH2 R'N=C=O+ROH
(异氰酸酯)
R'N=C=O+2HCl
O
R' — NH
C
OR
2>、重要的氨基甲酸酯有:西维因,灭菌灵等, 见P66 。
§13.9有机合成路线 一、有机合成的基本要求 产率高、副反应少、反应速度快、原料易得、步 骤少、安全。 二、有机合成的任务
CO2↑+N2↑+3H2O
有机化学 第十三章 羧酸衍生物

羧酸衍生物
O
OO
O
O
R CXR CO C RR CO RR ' CN 2H ( RCN)
O
上述化合物中均含有 R C 因此它们的化学性质相似:
① 均可以核亲核试剂发生亲核加成消去反应; ② 均可由羧酸制备; ③ 水解均可以得到羧酸。 一、羧酸衍生物结构的比较:
1、酰胺:
O
CN O
H C NH 2 CH 3 NH 2
1.376
1.474 Oδ -
H C NH 2
C
δ+
NH 2
① 羰基碳正电荷降低,亲核加成困难;
② N原子电荷降低,碱性减弱,显弱酸性。
2、酯:
O
H C O CH 3 CH 3 OH
CO
1.334
1.430
OC O
由于O的电负性大于N,因此,酯中羰基碳 的正电荷应大于酰胺中羰基碳的正电荷。
酯 +酯
β -酮 酸 酯
酯 + 甲酸酯
α -甲 酰 酯
酯 + 苯甲酸酯
α -苯 甲 酰 酯
酯 + O C( OE t) 2 酯 + 草酸酯
取代丙二酸酯 β -环 二 酮 酯
酯+ 酮
β -二 酮
二元酸酯
β -环 酮 酯
七、达参缩合:
O
α-卤代酸酯+ C O
α ,β -环氧酯 O E tO -
O + C Cl2HC Ot E
取代基—I效应:
O
X2>R C O >RO> N2 H
羰基的正电荷:
O
OO
O
O
第十三章 羧酸衍生物

酮与格氏试剂的反应比酯与格氏试剂的反应快,因此,仅位阻较大的 酯才能停留在酮的阶段。内酯也能发生相同的反应,产物为二醇。
O
O
1, C2H5MgBr 2, H3O
OH HOCH2CH2CH2CH2C C2H5 C2H5
(3)还原反应 )
催化氢化
RCOOR' + H2
氢化铝锂
CuO-CrO3 20-30MPa
(COOC2H5)2 170℃
C6H5CHCOOC2H5 COCOOC2H5
C6H5CHCOOC2H5 COOC2H5
C6H5CH2COOC2H5 +
HCOOC2H5
C2H5ONa
C6H5CHCOOC2H5 CHO
利用甲酸酯和草酸酯是在酯的α-位引入醛基和酯基的重要方法。
酮的α-氢比酯的α-氢更活泼,因此当酮与酯进行缩合时就可以得到β-羰基酮。
*
O * + OH R C OCH3
2、酸性条件下的机理
O R C L + H OH R C L
H2 O 慢
R
OH C L OH2
-H
R
OH C L OH
H
R
OH C LH OH
OH R C OH
-H
O R C OH + HL
3o醇的羧酸酯水解:SN1机制 醇的羧酸酯水解: 机制
O RCOC(CH3)3
O NH O
邻苯二甲酰亚胺
二、物理性质与光谱性质
酰卤、酸酐有刺激性气味,强腐蚀作用。酯有香味。 IR光谱:C=O的特征吸收峰 酰卤:1800~1750 cm-1 酸酐:1850~1800 cm-1 ,1790~1740 cm-1两个 酯: 1750~1745 cm-1,没有OH的吸收峰 酰胺:1690~1630 cm-1,3550~3050 cm-1有N-H吸收
第13章-羧酸衍生物

C2H5ONa C2H5OH OH H
H2O
CH3CH=CHCH2 CH2CO2H
30
CH2(CO2C2H5)2 + BrCH2CH2CH2Cl CO2C2H5 CO2C2H5
O CO2CH3 O CO2CH3 CH2CO2CH3
H2O OH H
D
C2H5ONa
H2O
OH
H
D
CO2H
+ ClCH2CO2CH3
O O CH3C O CCH3 + H2O O CCl
H2O / THF
室温
酯:需要酸或碱催化,有时需加热
HCl or NaOH
CH3CO2C2H5 + H2O
CH3CO2H + C2H5OH
5
酯水解的反应机理
酸催化:可逆 O RC OR' OH RC OR' H OH
R'OH H
OH RC OR'
O O CH3C O CCH2CH3 乙(酸)丙(酸)酐
O
O
O
丁二酸酐
O CH3C Br (Cl, I) 乙酰溴(氯、碘)
CH3CN 乙腈
CN 苯甲腈
NCCH2CN 丙二腈
2
第二节 羧酸衍生物的物理性质
沸点:(同分子量) 酰胺 > 酸、腈 > 酯、酰卤、酸酐
溶解性:一般在水中溶解性较差。
羧酸、酸酐、酰卤有强刺激性气味,酯味芳香
稀 NaOH KMnO4/H
+
稀NaOH CH3COCH2CH2CH CH2
H /H2O
+
OH CH3COCH2CH2CHCH3
33
2.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
例:
O 2 ( C H 3 C ) 2 O+H O
常 用 酰 基 化 试 剂
O
O HH 2 S O 4
9 3 %
C H 3 C O
O O C C H 3+2 C H 3 C O O H
酚 酯
O
O
H + , 9 4 %
C H 2 = C H - C - O C H 3 + C H 3 C H 2 C H 2 C H 2 O H
第13章羧酸衍生物cyclohexanecarboxylate
多元醇的酯,一般把”酸”名放在后面,称为” 某醇某酸酯”
O
CH2 O
C
CH3
CH2 O
C
CH3
乙二醇二乙酸酯
O
C H 2O N O 2
CHONO2
甘油三硝酸酯
C H 2O N O 2
第13章羧酸衍生物
酰胺的命名:RCONH2
• 酰胺 ×酸 →×酰胺 N-烃基×酰胺 • -ic acid → -amide
沸点: 酰卤、酸酐、酯的沸点低于羧酸; 伯酰胺的沸点高于羧酸。
第13章羧酸衍生物
IR光谱
例1:丙酸酐的红外光谱。 例2:乙酸乙酯的红外光谱。
NMR谱:
例:乙酸乙酯的第核13章磁羧酸共衍振生物谱。
(三) 羧酸衍生物的化学性质
(1)酰基上的亲核取代
(5) 与有机金属试剂的反应
(甲) 水解
(6) 酰氨氮原子上的反应
-carboxylic acid → -carboxamide
O CH 3C NH 2
O C
NH 2
O HCN(C3)H 2
乙酰胺 环戊烷羧酰胺 N,N-二甲基甲酰胺
Acetamide Cyclopentanecarboxamide N,N-Dimethylformamide
第13章羧酸衍生物
(二) 羧酸衍生物的物理性质
(甲) 水解
O R-C-Cl
O (R-C)2O
O R-C-OR'
+ H2O
HCl
RCOOH +
羧酸
RCOOH R'OH
O
R-C-NH2
NH3
O
O
O
O
水解速度 剧 R-烈 : C放 -> C热 (l热 R水 -第21C3O中 章)羧> 酸进 衍R加 H生+行 o-物热 rCO-催 -H > O化 RR催 高 , '-化 温 C-剂 下 2N, 长 H时难 间! 回
第十三章 羧酸衍生物 Carboxylic Acid Derivatives
教学目标与要求: ➢掌握羧酸衍生物的命名 ➢掌握酰基化反应及规律 ➢掌握重要的羧酸衍生物及其性质 ➢简单了解碳酸衍生物的化学性质
第13章羧酸衍生物
第十三章 羧酸衍生物
(一) 羧酸衍生物的命名 (二) 羧酸衍生物的物理性质 (三) 羧酸衍生物的化学性质 (四) 碳酸衍生物
第13章羧酸衍生物
(一) 羧酸衍生物的命名
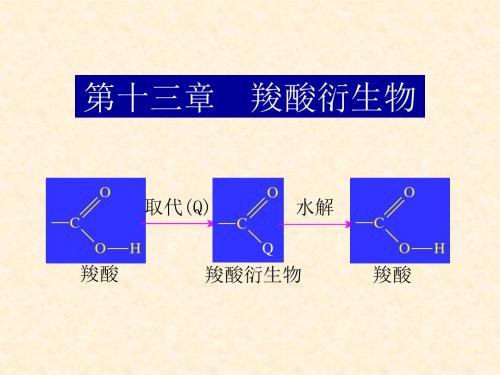
羧酸衍生物系指酰卤、酸酐、酯、酰胺,它们经 简单水解后都得到羧酸。
O R-C-X
酰卤
O R-C
O R-C
O 酸酐
O
O
R-C-OR' R-C-N2H
酯
酰胺
(R或R'可以是Ar或H)
取代酸(如氨基酸、羟基酸、卤代酸等)通常不属 于羧酸衍生物。
本章还将讨论碳酸第衍13生章羧物酸衍。生物
物态及水溶解性: 酰氯、酸酐:分子间无氢键作用,挥发性强,有刺鼻气味 的液体。沸点随着相对分子质量↑而↑。遇水水解。 酯:酯不溶于水。低级酯是有酯香味的液体。高级脂肪酸 的高级脂肪醇酯为固体,俗称“蜡”。
酰胺:分子间氢键作用强,一般为固体,但DMF或DEF为液 体,是常用的非质子性溶剂。低级酰胺可溶于水,随着 分子量↑,水溶解度↓。
酯的命名:RCO2R’
O
O
• 酯 ×酸×(烃基名)酯 R C OH • -ic acid → alkyl -ate
R C OR
羧酸的氢被烃基取代
O CH3C OCH2CH3
O C OCH3
O C OC(C3H)3
乙酸乙酯 Ethyl acetate
苯甲酸甲酯 环己烷羧酸叔丁酯 Methyl benzoate tert-Buthyl
酰卤的命名: RCOX
• 酰卤 相应的羧酸名称去掉“酸”字 + “酰卤”
• -ic acid → -yl + halide or -carboxylic acid → carbonyl + halideO CH3来自ClO CBr
O C
Cl
乙酰氯 苯甲酰溴
环己烷甲酰氯
Acetyl chloride Benzoyl bromide Cyclohexanecarbonyl 第13章羧酸衍生物chloride
CH2CH2COOH OH
邻 羟 基 苯 丙 酸
O
O
C H 3 C - N H
B rC 2 H 5 O H - H 2 O , K O H
9 5 %
C H 3 C O - K ++H 2 N
B r
对 溴 乙 酰 苯 胺
第13章羧酸衍生乙 物酸 钾
对 溴 苯 胺
(乙) 醇解
O
R-C-Cl
O
活 (R-C)2O
性 降
O
+ HOR'
低 R-C-OR''
O
R-C-NH2
HCl
RCOOR' +
酯
RCOOH R''OH
NH3
O
O
O
O
醇解速度 R-: C-> C(lR-2OC)>R-C-> ORR'-C-2 NH难!
常用酰基化剂 可逆,酯交 难换 ,醇需过量 直接醇解 从低级酯制高级酯 第1( 3章羧如 酸衍涤 生物 纶的生产)
(乙) 醇解
(甲) 酰胺的酸碱性
(丙) 氨解 (2)酰基上的亲核取代反应机 理 (3)酰基化试剂的相对活性
(乙) 酰胺脱水 (丙) Hofmann降解反应
(4)还原反应
(甲) 用氢化铝锂还原
(乙)用金属钠-醇还原
(丙) Rosenmund还原
第13章羧酸衍生物
(三) 羧酸衍生物的化学性质
(1) 酰基上的亲核取代
例:
O
(C6H5)2CHC2HCCl
H2O。,N2aCO3
0 C,95%
3,3-二苯基丙酰氯
O
(C6H5)2CHC2HCOH
3,3-二苯基丙酸
O
H3C C O HC O
H2O, 94%
顺-2-甲基丁烯二酸酐
H3C C COOH H C COOH
顺-2-甲基丁烯二酸
H2O,NaOH
O O ,90%
邻 羟 基 苯 丙 酸 内 酯
酸酐的命名: RCO2COR’
• 酸酐 ×酸 →×(酸)酐 x酸×酸酐 • acid→anhydride
O
OO
OO
CH3C O C CH3 HC O C CH3
O
乙酸酐 Acetic anhydride
甲(酸)乙(酸)酐
Acetic formic anhydride
第13章羧酸衍生物
O
丁二酸酐 Butanedioic anhydride
