杂环--吡啶.
吡啶

吡啶吡啶是目前用途开发最多的杂环化合物之—,系列吡啶产品广泛应用于医药、农药、染料、香料、饲料添加剂、食品添加剂、橡胶助剂及合成材料等领域,用途广泛,深加工前景广阔。
作为基础原料的吡啶,过去主要是从煤焦油中提取,现在主要采取以乙醛、甲醛与氨气相化学合成法。
2000年以前我国没有没有合成法吡啶生产,吡啶生产仍采用传统分离煤焦油法,生产能力不足200t/a,严重制约了下游产品的开发与生产。
2O00年比利时Reilly公司与南通醋酸化工厂合作建立了1.1万/t/a的吡啶系列产品生产装置,填补了国内合成法吡啶生产空白,改变了我国吡啶系列产品—直依赖进口的局面,近年来我国吡啶下游产品开发活跃,开发、研究与生产方兴未艾。
目前我国部分厂家已初步开始生产吡啶系列化产品,而且其中大部分产品进入国际市场,如山海关万通助剂厂的乙烯基吡啶系列;天津京福精细化工厂的氯化吡啶系列;上海松江天南化工厂氨基吡啶系列;河北亚诺化工有限公司的羟基吡啶、溴代吡啶、氯代吡啶、氨基吡啶系列;营口中海精细化工厂N-乙基吡啶酮毓;武进江春化工厂烷基吡啶系列;浙江华义医药化工有限公司的药物用中间体吡啶系列;武进腾帆精细化工厂氰基和硝基吡啶系列、河南台前县香精香料厂的3-甲基吡啶系列等等。
国内具体能够生产的吡啶系列产品有3-甲基吡啶、2-甲基吡啶、4-甲基吡啶、2-氯-4-氨基吡啶、2-氯-3-氰基吡啶、2-氯-4-氰基吡啶、2-乙烯基吡啶、2-氯吡啶、2,6-二氯吡啶、3,5-二氯吡、2,3,5,6-四氯吡啶、3-氯吡啶、2-溴吡啶、3-溴吡啶、2-羟基吡啶、2-巯基吡啶、2-氨基吡啶、3-氨基吡啶、4-氨基吡啶、3-羟基吡啶、吡啶硫铜盐、2-氨基-5-氯吡啶、2-氯-3-氨基吡啶、2-氯-4-氨基吡啶、2-氨基-6-甲基吡啶、2,6-二氨基吡啶、2-氨基-6-甲醛吡啶、2,3,5-三甲基吡啶、2,4,6-三甲基吡啶、2-氰基-3-甲基吡啶、2-羟甲基-4-硝基-3-甲基吡啶、2-羟甲基-3,5-二甲基-4-硝基吡啶、2-羟甲基-3,5-二甲基-4-甲氧基吡啶、4-硝基-2,3-二甲基吡啶-N-氧化物、五氯咄啶、3,6-.二氯吡啶甲酸、吡啶盐酸盐、2-氯甲基-3,5-二甲基-4-甲氧基吡啶盐酸盐、N-乙基吡啶酮等。
吡啶

吡啶汉语拼音:bǐdìng英文名称:pyridine中文名称2:氮(杂)苯CAS No.:110-86-1分子式:C5H5N分子量:79.10吡啶是含有一个氮杂原子的六元杂环化合物。
可以看做苯分子中的一个(CH)被N取代的化合物,故又称氮苯。
吡啶及其同系物存在于骨焦油、煤焦油、煤气、页岩油、石油中。
[编辑本段]物理性质外观与性状:无色或微黄色液体,有恶臭。
熔点(℃):-41.6沸点(℃):115.3相对密度(水=1):0.9827折射率:1.5067(25℃)相对蒸气密度(空气=1):2.73饱和蒸气压(kPa): 1.33/13.2℃闪点(℃):17引燃温度(℃):482爆炸上限%(V/V):12.4爆炸下限%(V/V): 1.7溶解性:溶于水、醇、醚等多数有机溶剂。
与水形成共沸混合物,沸点92~93℃。
(工业上利用这个性质来纯化吡啶。
)[编辑本段]化学性质吡啶及其衍生物比苯稳定,其反应性与硝基苯类似。
典型的芳香族亲电取代反应发生在3、5位上,但反应性比苯低,一般不易发生硝化、卤化、磺化等反应。
吡啶是一个弱的三级胺,在乙醇溶液内能与多种酸(如苦味酸或高氯酸等)形成不溶于水的盐。
工业上使用的吡啶,约含1%的2-甲基吡啶,因此可以利用成盐性质的差别,把它和它的同系物分离。
吡啶还能与多种金属离子形成结晶形的络合物。
吡啶比苯容易还原,如在金属钠和乙醇的作用下还原成六氢吡啶(或称哌啶)。
吡啶与过氧化氢反应,易被氧化成N-氧化吡啶。
[编辑本段]用途除作溶剂外,吡啶在工业上还可用作变性剂、助染剂,以及合成一系列产品(包括药品、消毒剂、染料、食品调味料、粘合剂、炸药等)的起始物。
吡啶还可以用做催化剂,但用量不可过多,否则影响产品质量。
[编辑本段]来源(合成方法)吡啶可从天然煤焦油中获得,也可由乙醛和氨制得。
吡啶及其衍生物也可通过多种方法合成,其中应用最广的是汉奇吡啶合成法,这是用两分子的β-羰基化合物,如乙酰乙酸乙酯与一分子乙醛缩合,产物再与一分子的乙酰乙酸乙酯和氨缩合形成二氢吡啶化合物,然后用氧化剂(如亚硝酸)脱氢,再水解失羧即得吡啶衍生物。
吡啶化学性质

ACS;PVC Coated Bottles;Aluminum Bottles;CHROMASOLV Plus;Chromatography Reagents&;HPLC &;HPLC Plus Grade Solvents (CHROMASOLV);HPLC/UHPLC Solvents(CHROMASOLV);UHPLC Solvents (CHROMASOLV);ACS Grade Solvents;Carbon Steel Cans with NPT Threads;Semi-Bulk Solvents;分析标准品;精细化学品Mol110-86-1.mol文件:吡啶性质熔点-42 °C沸点96-98 °C(lit.)密度0.983 g/mL at 20 °C蒸气密度 2.72 (vs air)蒸气压23.8 mm Hg ( 25 °C)折射率n20/D 1.509(lit.)FEMA 2966闪点68 °F储存条件Store at RT.水溶解性Miscible凝固点-42℃Merck 14,7970BRN 103233稳定性Stable. Flammable. Incompatible with strong oxidizing agents, strong acids.CAS 数据库110-86-1(CAS DataBase Reference)NIST化学物质信息Pyridine(110-86-1)EPA化学物质信息Pyridine(110-86-1)吡啶用途与合成方法概述吡啶(分子式C6H5N)含有一个氮杂原子的六元杂环化合物,即苯分子中的一个-CH=被氮取代而生成的化合物,与苯类似,具有相同的电子结构,仍有芳香性,故又称氮苯和氮杂苯,在常温下是一种无色有特殊气味的液体,熔点-41.6℃,沸点115.2℃,与水形成共沸混合物,沸点92~93℃。
吡啶环上原子杂化类型为

吡啶环上原子杂化类型为吡啶是一种含氮杂环化合物,具有嗅爆性气味,是许多重要药物和农药的基础结构单元。
吡啶环上原子的杂化类型可以通过量子化学的理论来解释和描述。
以下是相关参考内容,详细介绍了吡啶环上原子的杂化类型。
吡啶的化学式为C5H5N,它是一种六元杂环,由五个碳原子和一个氮原子组成。
吡啶环上的碳原子和氮原子通过形成共价键与周围原子连接。
吡啶环的拓扑结构使得其中的碳原子杂化类型存在一定的变化。
在吡啶环上,氮原子的杂化类型是sp2杂化。
氮原子有三个单电子对,它们分别与三个sp2杂化的轨道形成σ键。
由于氮原子有一个孤对电子,这个孤对电子被认为是一个p轨道,它处于垂直于吡啶平面的位置。
吡啶环上碳原子的杂化类型则分为两种。
一种是sp2杂化,碳原子通过sp2杂化形成σ键和氮原子形成共价键。
在吡啶环的正上方,有一个在平面内的孤对电子。
这个孤对电子使得碳原子处于sp2杂化状态。
另一种是sp3杂化,碳原子通过sp3杂化形成σ键和邻近的碳原子之间形成共价键。
这种杂化类型存在于吡啶环上离氮原子较近的位置。
吡啶环上的sp3杂化碳原子通常被称为α-碳。
由于α-碳处于吡啶平面内,它的杂化类型与sp2杂化的碳原子有所不同。
吡啶环上碳原子的杂化类型可以通过以下几种实验数据来推断和验证:1. 碳原子的化学位移:NMR技术可以测定吡啶环上碳原子的化学位移。
通过对不同位置的化学位移进行分析,可以推断出杂化类型的变化。
2. 结构分析:通过X射线晶体衍射等结构分析方法,可以确定吡啶分子的三维结构,进而推断出碳原子的杂化类型。
3. 能级计算和分子模拟:通过量子化学计算方法,如密度泛函理论(DFT)等,可以模拟吡啶分子的电子结构和能级分布,从而推断碳原子的杂化类型。
总之,吡啶环上原子的杂化类型是由氮原子的sp2杂化和碳原子的sp2杂化、sp3杂化共同决定的。
这种杂化类型的特殊性使得吡啶具有一系列重要的化学和生物活性。
通过对吡啶杂化类型的研究,可以更好地理解吡啶的结构和性质,进一步应用于药物研发和其他领域的应用。
吡啶取代氢谱判断

吡啶取代氢谱判断
吡啶是一种六元杂环芳香化合物,它的核磁共振氢谱(1H NMR 谱)可以提供有关分子结构的信息。
在吡啶的1H NMR谱中,取代氢谱的判断主要涉及到氢的化学环境和化学位移。
以下是判断吡啶取代氢谱的一般步骤:
1.化学位移((Chemical Shift):吡啶环中的氢原子的化学位移可以通过1H NMR谱中的峰位置确定。
不同位置的氢原子由于化学环境的不同而表现出不同的化学位移。
在吡啶中,通常有两个区域的峰,即吡啶环上的峰和与氮原子相邻的峰。
2.吡啶环上的峰:吡啶环上的氢通常在6.5至8.5 ppm之间,具体位置受取代基的影响。
吡啶环上的氢通常显示为一个复杂的峰,其形状和峰的分裂模式取决于取代基的数目和相对位置。
3.相邻氮原子的峰:与氮原子相邻的氢通常在8.0至9.5 ppm之间,位置较为特征性。
这个峰往往是一个相对较宽的单峰。
4.分裂模式:吡啶环上的氢通常会受到相邻氢的影响,呈现出特定的分裂模式。
通过观察峰的分裂模式,可以推断氢的数目和相对位置。
5.取代基的效应:取代基的种类和数目会影响氢的化学位移和峰的形状。
例如,取代基的电子效应和取代基之间的相互作用都可能影响氢谱的表现。
需要注意的是,吡啶的1H NMR谱在不同的实验条件下可能会有所变化。
综合考虑各种因素,通过观察峰的位置、形状、分裂模式等信息,可以对吡啶分子结构和取代基进行初步的判断。
在实际应用
中,高分辨率的1H NMR谱和其他谱图((如13C NMR谱)结合使用,有助于更准确地确定吡啶分子的结构。
吡啶 结构

吡啶结构引言:吡啶结构的重要性和应用领域介绍吡啶是一种含氮杂环化合物,由于其稳定性和广泛的化学反应性质,在化学、医学、材料科学等领域中有广泛的应用。
吡啶结构的探究和研究对于人类文明的进步和科学研究的发展有着十分重要的意义。
接下来将从吡啶结构的含义、结构特点、应用领域等几个方面来详细分析。
第一部分:吡啶结构的含义和结构特点吡啶结构是指由一个含氮的芳香环和一个烷基结构组成的化合物。
其分子式为C5H5N,分子量为79.1g/mol。
吡啶结构的特点是其具有一个含有五个碳原子的芳香环和一个相邻的硝基原子组成的烷基结构,因此其结构不仅具有柔韧性和稳定性,还具有强烈的活性基团和反应性能力。
第二部分:吡啶结构的应用领域1. 医学领域吡啶类化合物广泛应用于药物合成中,具有强效抗菌、消炎、抗癌、治疗心血管疾病等功效。
如磺胺类药物、喹诺酮类药物、非类固醇类抗炎药等均含有吡啶结构。
2. 材料科学领域吡啶类化合物作为高分子制备中的功能性单体,其聚合物具有良好的电子传输、半导体特性和荧光性能,在太阳能电池、有机发光二极管等领域有着广泛的应用。
3. 化学领域吡啶结构的化学反应活性可以进行多种官能团的取代,合成出多种求电子性、亲核性、碱性和酸性的有机化合物。
因此,吡啶及其衍生物是制备高效催化剂、高性能涂料、高能指示剂等化学品的重要中间体。
第三部分:吡啶结构中的研究进展1. 吡啶结构的合成方法研究目前,吡啶类化合物的制备方法较多,如使用过渡金属催化剂的环合成、亲核取代反应、氧化反应、还原反应等,部分反应已经得到了大量的研究和发展,如Suzuki偶联反应、Sonogashira偶联反应等。
2. 吡啶结构的功能研究吡啶类化合物的应用领域相对较广,但研究并不充分,很多研究还有待深入进行。
例如针对药物用途的吡啶酮类化合物,在治疗癌症中的具体作用机制、药效等方面还需要更多的研究;利用吡啶结构作为多种官能团的催化剂,其反应机制、催化性能也需要进一步研究。
吡啶的亲电取代反应
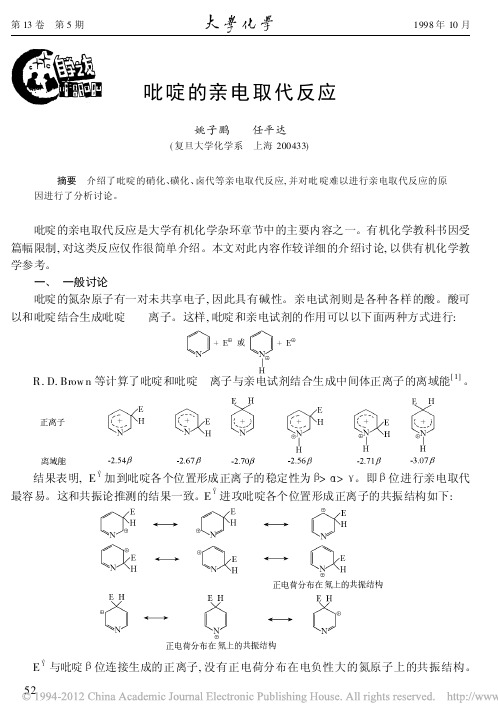
+ A lCl3( 熔融) C l2
1B
2
10%
40%
氯气通入吡啶和三氯化铝的混合物, 却得不到氯代产物。
+ Cl2
AlCl3
这一比较令人奇怪的反应, 其可能的机理如下:
+ A lCl3
和氯代反应不同, 溴代反应已找到了较合适的条件, 并得到较高产率的 3- 溴吡啶[ 6] 。 55
+ Br2
66% 发烟 H2SO4 130 e
+ 浓 HN O 3/ 浓 H2SO 4
300 e 1天
6%
+ NaN O3/ 发烟 H2SO4
300 e 1天
4. 5%
ห้องสมุดไป่ตู้
+ KN O 3/ 发烟 H2SO 4
300 e 1天
15%
+ KN O 3, H NO 3, H 2S O4, Fe
300 e 1天
22%
当吡啶环上有推电子取代基时, 硝化反应产率较好。若取代基是甲基, 则至少要有两个甲
第 13 卷 第 5 期
1998 年 10 月
吡啶的亲电取代反应
姚子鹏 任平达
( 复旦大学化学系 上海 200433)
摘要 介绍了吡啶的硝化、磺化、卤代等亲电取代反应, 并对吡 啶难以进行亲电取代反应的原 因进行了分析讨论。
吡啶的亲电取代反应是大学有机化学杂环章节中的主要内容之一。有机化学教科书因受 篇幅限制, 对这类反应仅作很简单介绍。本文对此内容作较详细的介绍讨论, 以供有机化学教 学参考。
物[ Cp2T i( P- ClC6H4O) 2] 和四丁基氟化铵( T BA F) 的存在下, 将聚甲氢硅氧烷制成了氢硅烷 基衍生物。产 物用 氢氧化钠或 T BAF 处理后得到游离的乳醇。发明者 认为, Cp2T iH 起 催化剂 作用, 内酯先 插入 T i) H 键形 成 一种环中氧与钛配位的烷基氧化物, 然后与 硅烷分 子参与 R- 键复分 解, 生 成钛的 氢化物 和硅烷 基化的 乳醇。
比较吡略与吡啶两种杂环。从酸碱性、环对氧化剂的稳定性、取代反应及受酸聚合性等角度加以讨论。

比较吡略与吡啶两种杂环。
从酸碱性、环对氧化剂的稳定性、取代反应及受酸聚合性等角度加以讨论。
吡啶和吡嗪是两种常见的杂环化合物,它们在酸碱性、环对氧化剂的稳定性、取代反应和受酸聚合性等方面存在差异:
1.酸碱性:吡啶是一种较强的碱性化合物,其氮原子可以接
受质子形成吡啶离子。
相比之下,吡嗪的氮原子上有两个
孤对电子,使其碱性较弱。
2.环对氧化剂的稳定性:吡啶对氧化剂比较稳定,不容易被
氧化。
而吡嗪中的氮原子上有两个孤对电子,使其较容易
被氧化剂氧化。
3.取代反应:吡啶相对于吡嗪,由于氮原子上的孤对电子密
度较低,因此吡啶具有较高的活性,易于进行取代反应。
相反,吡嗪由于孤对电子密度较高,具有较低的反应活性。
4.受酸聚合性:吡啶具有较低的受酸聚合性,不容易通过酸
触媒形成聚合物。
吡嗪由于孤对电子的共轭效应和较高的
自由电子密度,具有较高的受酸聚合性,容易形成聚合物。
综上所述,吡啶和吡嗪在酸碱性、环对氧化剂的稳定性、取代反应和受酸聚合性等方面有各自的特点。
吡啶具有较强碱性,对氧化剂稳定,易于进行取代反应,有较低的受酸聚合性。
相比之下,吡嗪具有较弱碱性,对氧化剂较不稳定,反应活性较低,但具有较高的受酸聚合性。
六元杂环.

H2SO4 heat
H H2C C CHO
NH2 +
H H2C C CHO
Michael addition
H
N
H+
OHC
H N
H+ , - H2O
OH
H N OHC H N
H N
+
NO2
N
NH2
+
以 α,β-不饱和醛或酮代替甘油、酸也可用磷酸或其他酸
NH2 +
H2C
HO C CCH3
FeCl3, ZnCl 2 PhNO2, heat
环上的亲核取代
环上有好的离去基团 ( 如 NO2 , Cl ) 可被取代
Cl
NH3
NH2
N
100 - 200 ℃ N
NaOMe N Cl MeOH, heat
N OMe
N Br
NaOH H2O, heat
Cl PhNH2
N
heat
N OH NHPh N
强碱亲核试剂---- 消除-加成机理
PhLi N
N
+
N
浓 H2SO4
N
22 ℃
SO3H N
N NO2
Br Br2, 浓 H2SO4
N
Ag2SO4, heat
N
+
N
Br
亲核取代反应
NaNH2, Xylene 100 ℃
N
n-BuLi Toluene N
N
NH2
N
Bu-n
喹啉和异喹啉 氧化和还原均比苯容易
氧化:苯环优先 还原:吡啶环优先
KM nO4
嘧啶环上有活化基团 ( 如 OH、NH2 等 ) 时,可硝化、磺化
吡啶化学式

吡啶化学式吡啶是一种有机化合物,其化学式为C5H5N。
它是一种含有一个五元环的芳香胺,是一种常见的含氮杂环化合物。
吡啶经常用作有机合成中的重要中间体,也常用于制备药物、染料、塑料等化学品。
吡啶的结构吡啶的分子结构是由一个五元环和一个氮原子组成的。
吡啶的分子式为C5H5N,它的化学式中有一个氮原子,氮原子上有一个孤对电子,因此吡啶是一种碱性化合物。
吡啶的分子中还存在着共轭双键,因此它具有很强的芳香性。
吡啶的制备吡啶的制备方法有很多种,其中最常用的方法是通过吡啶和氢气在催化剂的作用下反应得到。
吡啶的制备还可以通过吡啶酮和氢气在催化剂的作用下还原得到。
此外,吡啶还可以通过吡啶醛和氨水在催化剂的作用下反应得到。
吡啶的性质吡啶是一种无色液体,具有刺激性气味。
吡啶的沸点为115℃,密度为0.981g/cm3。
吡啶是一种具有良好溶解性的有机化合物,可以溶解于许多有机溶剂中,如乙醇、乙醚、苯等。
吡啶是一种碱性物质,可以与酸反应生成盐。
吡啶的应用吡啶是一种重要的有机中间体,广泛应用于有机合成中。
吡啶的衍生物可以作为药物、染料、塑料等化学品的原料。
吡啶还可以用于制备染料、塑料、合成纤维等化学品。
此外,吡啶还可以用作溶剂、催化剂等。
吡啶的安全性吡啶是一种有毒的化学品,应该避免直接接触。
吡啶在加热或接触火源时易燃,应该储存在阴凉、干燥、通风良好的地方。
在使用吡啶时应该佩戴防护手套、防护眼镜等个人防护用品。
结论吡啶是一种重要的有机化合物,具有广泛的应用价值。
吡啶的制备方法有多种,其中最常用的方法是通过吡啶和氢气在催化剂的作用下反应得到。
吡啶是一种有毒的化学品,应该遵守安全操作规程。
吡啶

芳香杂环化合物环状有机化合物,成环的原子除碳原子外,还含有其它原子的化合物称为杂环化合物。
除碳以外的其它原子叫杂原子。
常见的杂原子有氮、氧、硫。
本章将要讨论的杂环化合物一般比较稳定,不容易开环,具备不同程度的芳香性,常被称为芳香杂环化合物。
第一节芳香杂环化合物的分类与命名杂环化合物按含杂原子数目可分为含一个、两个或多个杂原子的杂环,按环的形式又可分为单环和稠环两类,单环又可按环的大小分为五元杂环和六元杂环。
杂环化合物的命名比较复杂,我国目前主要采用音译法,即按照英文名称的音译,选用同音汉字,再加上“口”字旁表示杂环名称。
当杂环有取代基时,以杂环为母体,对环上的原子编号。
编号的原则是:从杂原子开始,依次为1,2,3,……,或从杂原子旁的碳原子开始,依次用α,β,γ,……编号,取代基的名称及在环上的位次写在杂环母体名称前。
当环上有两个或两个相同的杂原子时,尽可能使杂原子编号最小,如环上不止一个杂原子时,则按O,S,N顺序依次编号,如果其中的一个杂原子上连有氢,应从连有氢的杂原子开始编号。
稠杂环的编号,一般和稠环芳烃相同,但有少数稠杂环另有一套编号顺序,如异喹啉、吖啶、嘌呤。
第二节芳香六元杂环一、吡啶的结构吡啶可看作是苯分子中的CH被氮原子取代所得到的化合物,环上的六个原子都在一个平面上,结构与苯相似,也符合Hückel规则,具有芳香性,但吡啶环上电子云密度不像苯那样均匀分布。
二、吡啶的性质(一)水溶性吡啶氮原子上的一对未共用电子能与水形成氢键,吡啶能与水互溶。
(二)碱性吡啶是一个弱碱,碱性较苯胺强,比氨和脂肪胺弱,容易和无机酸生成盐。
(三)亲电取代与亲核取代反应吡啶环上亲电取代反应要比苯难得多,与硝基苯相似,亲电取代反应主要进入β位。
吡啶环比苯易进行亲核取代反应,主要生成α-位取代产物。
当α-位上有易离去基团(如Cl,Br)时,较弱的亲核试剂(如NH3,H2O等)就能发生亲核取代反应。
(四)吡啶类化合物侧链氧化反应吡啶环对氧化剂较苯环更为稳定。
杂环化合物-吡啶的性质、反应及其合成

概要
吡啶药物 吡啶的性质 吡啶的合成
吡啶的相关药物
★ 2014年全球销售额TOP25的药物中,具吡啶结构的药物有两个,分 别为诺华公司的甲磺酸伊马替尼和阿斯利康公司的埃索美拉唑。
★ 08年上市新药
吡啶的相关药物
吡非尼酮-细胞因子抑制剂 日本盐野义
百达生 德国勃林格殷格翰
■ 吡啶N原子sp2杂化轨道上有一对未成键的孤对电 子,故具有一定 的亲核性和碱性,可与酸、烷化剂、酰化剂以及金 属离子等相互作用。
吡啶的性质
■ 由于N原子电负性较大,环上的电子云向N上偏移,其结果是吡啶环相比于苯环缺电子, 难以发生亲电取代反应。
■ 若反应发生在2,4位,其共振式形成N+,但该物种极不稳定;由于吡啶HOMO轨道能 量低于苯环,反应发生在3位时很慢,而当2,4位有供电子基时可促进该反应。吡啶的来自关药物★ 12年上市新药
瑞戈非尼 德国拜尔
Erivedge 美国罗氏
吡仑帕奈3/4水合物 日本卫材
阿西替尼 美国辉瑞
吡啶的相关药物
★ 14年上市新药
Zontivity 美国默沙东
Sivextro Cubist和Bayer
奈妥匹坦 Helsinn公司与卫材公司
吡啶的相关药物
★ 15年上市新药
吡啶的合成
➢ 缩合法 该法是吡啶合成中应用最多的一类,由它可以演化出多种变形。
吡啶的合成
➢ 缩合法
吡啶的合成
➢ 缩合法
吡啶的合成
➢ 缩合法
吡啶的合成
➢ 6π电子环化法
吡啶的合成
➢ Diels-Alder环化法
吡啶的合成
➢ 扩环法
吡啶的合成
➢ 芳构化法 (1)氧化法 Pd/C:芳构化能力强,需高温,常用于哌啶的芳化。机理与Pd/C加氢还原类似,只不过是其 逆反应。
杂环类药物的分析——吡啶类药物的分析

掌握异烟肼、尼可刹⽶的鉴别、杂质检查和含量测定⽅法。
掌握盐酸氯丙嗪、奋乃静的鉴别、杂质检查和含量测定⽅法。
掌握地西泮、氯氮卓及其制剂的鉴别、杂质检查和含量测定⽅法。
本章讨论化学合成的杂环类药物,选择应⽤⽐较⼴泛的三类杂环药物中的⼏个典型考,试⼤收集整理药物予以重点介绍:即吡啶类中的尼可刹⽶、异烟肼、异烟腙和丙硫异烟胺等;吩噻嗪类中的氯丙嗪、异丙嗪、奋乃静和癸氟奋乃静等;苯骈⼆氮杂卓类中的地西泮、阿普唑仑和氯氮卓等。
第⼀节 吡啶类药物的分析 ⼀、结构与性质 (⼀)典型药物的结构 尼可刹⽶、异烟肼、异烟腙、丙硫异烟胺 (⼆)主要化学性质 1.弱碱性 本类药物母核吡啶环上的氮原⼦为碱性氮原⼦,吡啶环的pKb值为8.8(⽔中)。
尼可刹⽶分⼦结构中,除了吡啶环上氮原⼦外,吡啶环β位上被酰氨基取代,虽然酰氨基的化学性质不甚活泼,但遇碱⽔解后,释放出具有碱性的⼆⼄胺,故可以此进⾏鉴别。
2.吡啶环的特性 本类药物分⼦结构中均含有吡啶环,可发⽣开环反应(特性反应)。
尼可刹⽶、异烟肼和异烟腙的吡啶环α、α‘位未取代,⽽β或γ位被羧基衍⽣物所取代,丙硫异烟胺的吡啶环α位被丙基取代,⽽γ位被硫代甲酰氨基所取代。
3.还原性异烟肼吡啶环γ位上被酰肼取代,酰肼基具有较强的还原性,并可与某些含羰基的试剂发⽣缩合反应。
除此之外,各药物具有不同的取代基团,具有不同的化学性质。
⼆、鉴别试验 (⼀)吡啶环的开环反应 1.戊烯⼆醛反应(Konig反应) 当溴化氰与芳⾹第⼀胺作⽤于吡啶环,可形成戊烯⼆醛的有⾊喜夫⽒碱类(聚甲炔染料)。
这⼀反应不能由吡啶环单独发⽣,⽽是在溴化氰加到吡啶环,使环上氮原⼦由3价转变成5价时,吡啶环⽔解,形成戊烯⼆醛后再与芳⾹第⼀胺缩合⽽成。
本反应适⽤于吡啶环α、α‘位未取代,以及β或γ位为烷基或羧基的衍⽣物。
异烟肼和尼可刹⽶均具有此反应,⽽中国药典只⽤于尼可刹⽶的鉴别,所⽤芳⾹第⼀胺为苯胺。
⽅法取本品1滴,加⽔50ml,摇匀,分取2ml,加溴化氰试液2ml与2.5%苯胺溶液3ml,摇匀,溶液渐显黄⾊。
吡啶

1吡啶的结构吡啶是一个典型的芳香族杂环化合物.吡啶环是一个平面环,分子内存在π66的闭合共轭体系.由于N原子的电负性大于C,吡啶环上的电子云密度小于苯,发生亲电取代反应比苯难得多,一般要在强烈条件下才能进行.另外,吡啶分子中的氮原子有一对未共用电子对不参与π体系,所以吡啶具有一定的亲核能力,能进攻带有正电荷的分子,吡啶是一种重要的有机碱.2 物理性质在常温下是一种无色有特殊气味的液体,熔点-41.6℃,沸点115.2℃,与水形成共沸混合物,沸点92~93℃。
(工业上利用这个性质来纯化吡啶),密度0.9819g/cm3。
易溶于水,乙醇,醚等多数有机溶剂,本身也可作溶剂。
3.化学性质3.1吡啶的亲电取代反应吡啶和硝基苯在亲电取代反应的活性上具有类似性.在酸性条件下吡啶常以吡啶鎓离子的形式进行亲电取代反应,它比连有最强的第2类定位基-N+(CH3)3的苯环还要难以反应.若亲电试剂加得少,都和吡啶形成盐;若亲电试剂加得多,则吡啶都成了吡啶翁离子.为了增强亲电试剂的亲电能力,常加入Lewis酸催化剂,但Lewis酸也会和吡啶结合,使氮杂原子带正电从而使亲电取代反应难以进行.但是吡啶环上连有给电子基团时,其亲电取代反应就比较容易进行.3.2碱性吡啶分子中的氮原子有一对未共用电子没有参与π体系,这对电子可与质子结合,所以吡啶显示一定的碱性,其碱性大于吡咯和苯胺,但比脂肪族胺弱得多.吡啶与无机酸作用生成盐. 3.3亲核性吡啶与卤代烷结合生成相当于季铵盐的产物———吡啶翁盐.各种卤代烷的反应活性次序RI> RBr> RCl.若吡啶的3位或4位有给电子基团时,由于基团的给电子作用,N原子上的电子云密度增大,亲核能力增强;反之,吡啶的3位、4位上连有一些吸电子基团时,其亲核能力会下降.各种不同取代基的吡啶其亲核性次序如下:若吡啶的2位有取代基时,受空间位阻的影响不利于吡啶发生亲核反应.。
杂环药物、吡啶类药物

杂环药物吡啶类药物异烟肼的鉴别试验:还原反应。
异烟肼的酰肼基有还原性,可还原硝酸银中的Ag+成单质银,肼基则被氧化⽣成氮⽓。
加氨制硝酸银试液1ml,即产⽣⽓泡与⿊⾊浑浊,并在试管壁上⽣成银镜。
缩合反应。
异烟肼的酰肼基可以和含羰基的试剂(如芳醛)发⽣缩合反应。
异烟肼与⾹草醛反应,⽣成异烟腙,测定熔点供鉴别。
沉淀反应。
异烟肼分⼦中的吡啶环具有碱性,可以和重⾦属盐类(如氯化汞、硫酸铜、碘化铋钾)⼄基苦味酸形成沉淀。
异烟肼和氯化汞可⽣成⽩⾊沉淀。
和硫酸铜-枸橼酸试液反应,先产⽣绿⾊沉淀,加热,沉淀变为红棕⾊。
尼克刹⽶的鉴别:戊烯⼆醛反应。
属吡啶环的开环反应。
尼克刹⽶分⼦中的吡啶环与溴化氰反应,开环形成戊烯⼆醛的衍⽣物,再与苯胺缩合,形成黄⾊的希夫⽒碱。
异烟肼也可发⽣戊烯⼆醛反应,但需先⽤⾼锰酸钾或溴⽔氧化为异烟酸,再与溴化氰作⽤。
与苯胺缩合形成黄⾊⾄棕黄⾊产物,与联苯胺紫外分光光度法形成淡红⾄红⾊产物。
⽔解反应。
尼克刹⽶分⼦中的酰胺基在碱性条件下可⽔解,加氢氧化钠试液,加热,即有⼆⼄胺臭味逸出,能使湿润的红⾊⽯蕊试纸变成蓝⾊。
沉淀反应。
尼克刹⽶分⼦中的吡啶环也可以和重⾦属离⼦反应。
尼克刹⽶和硫酸铜及硫氰酸铵作⽤,⽣成草绿⾊配位化合物的沉淀。
异烟肼中游离肼的检查:薄层⾊谱法。
肼的检测限为0.1µg,控制限量为0.02%。
异烟肼的含量测定:异烟肼分⼦中的酰肼基具有还原性,可采⽤氧化还原滴定法测定其含量。
溴酸钾法。
甲基橙作指⽰剂,溴酸钾滴定⽌粉红⾊消失。
每1ml的溴酸钾滴定液(0.1667mol/L)相当于3.429mg的C6H7N3O.异烟肼的⽚剂、注射剂均采⽤溴酸钾法测定含量。
还可使⽤溴量法、剩余碘量法测定含量,也可⽤⾮⽔溶液滴定法。
尼克刹⽶含量测定:⾮⽔溶液滴定法。
溶剂:冰醋酸,指⽰剂:结晶紫,滴定液:⾼氯酸。
⾄溶液蓝绿⾊。
每1ml⾼氯酸滴定液(0.1mol/L)相当于17.82mg的C10H14N2O。
吡啶基配体在偶联反应_概述说明以及概述

吡啶基配体在偶联反应概述说明以及概述1. 引言1.1 概述吡啶基配体作为有机合成化学中重要的功能性单位,在偶联反应中发挥着关键的催化作用。
由于其独特的结构和活性,吡啶基配体已经在多种有机反应中得到广泛应用,并取得了显著的研究进展和实际应用价值。
本文将对吡啶基配体在偶联反应中的应用进行概述,介绍其定义、特点以及作用机制,并归纳总结了吡啶基配体在不同类型偶联反应中的典型应用案例。
1.2 文章结构本文主要分为五个部分。
首先是引言部分,概述了文章的目的和结构。
接下来第二部分将详细介绍吡啶基配体在偶联反应中的应用,包括其定义和特点、作用机制以及不同类型偶联反应中的具体应用案例。
第三部分将回顾吡啶基配体在有机合成中的发展历程,从初期探索与发现到发展与改进过程,并展望当前研究进展以及未来前景。
第四部分将深入讨论吡啶基配体的设计和合成方法,包括研究结构与性质关系的应用、合成方法及其优化策略研究以及新型吡啶基配体的设计与合成案例分析。
最后,第五部分为结论与展望,对本文主要研究结果进行总结,并展望未来在吡啶基配体领域中的潜在研究方向。
1.3 目的本文旨在系统地介绍和探讨吡啶基配体在偶联反应中的应用以及在有机合成中的发展历程。
通过对吡啶基配体相关研究的概述和分析,期望能够全面了解吡啶基配体的特点和作用机制,并揭示其在不同类型偶联反应中的应用案例。
此外,本文还将对吡啶基配体的设计和合成方法进行详细阐述,并展望未来可能出现的研究方向。
通过这些内容的综合讨论与分析,为进一步提高吡啶基配体的催化性能、扩展其应用范围以及推动有机合成反应和纳米材料等领域取得更多创新突破提供借鉴和参考。
2. 吡啶基配体在偶联反应中的应用2.1 吡啶基配体的定义和特点吡啶基配体是一类具有含有吡啶环结构的有机化合物,它们通常被设计用于催化各种偶联反应。
这些配体可以通过选择性地与金属催化剂形成稳定的络合物,从而促进反应进程,并提高反应的效率和选择性。
吡啶作为五元杂环结构,具有良好的稳定性和可调节的电子性质,使其成为理想的配体分子。
杂环化合物 (3)

环上已有给电子基的定位作用
G
E
E
E
E
N
G
N
G 强) ( N
E
G(弱) N
E
归纳一下,有什么规律? 归纳一下,有什么规律?
三. 吡啶环上的亲核取代反应
• 吡啶的亲电性
δ+
Nu
δ+ δ+
Nu
• 吡啶的亲核取代通式
H N
亲核加成
N
δ−
Nu
亚胺结构
−H
负氢消除
N
Nu Nu = NH2, Ph
Nu
通过氧化去氢 或其它途径
(4) Lewis 酸作用下的加成反应
O H C H N CH3 ZnCl2 N CH2CH2OH
机理: 机理:
− HCl
N CH3 ZnCl2 N ZnCl Cl C H2 H N ZnCl CH2
O H C H
Lewis 酸加强了α氢的酸性 酸加强了α
H2O
N ZnCl
CH2
CH2O
N
CH2CH2OH
十氢喹啉
吡啶环比苯环易被还原
2. 吡啶的氧化
KMnO4
• 氧化在侧链上
N
CH3 HNO3 ∆
N
COOH COOH N
N N CH3
尼古丁(烟碱) 尼古丁(烟碱)
烟酸
• 氧化在 N 上
H2O2 N HOAc N O
对比:叔胺的H2O2氧化 对比:叔胺的H
R3N H2O2 R3N O
胺氧化合物
N-氧化吡啶
二. 吡啶环上的亲电取代
取代位置和反应活性( 取代位置和反应活性(例:吡啶的硝化) 吡啶的硝化)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
6-氨基嘌呤
腺嘌呤
8-羟基喹啉
12 杂环化合物
12.2
五元杂环
杂环化合物的结构和芳香性
O S
N H 呋喃、噻吩、吡咯结构上共同点:五元杂环的环上5个原 子都是sp2杂化的,位于同一平面上,碳原子p轨道上有1个单 电子,杂原子p轨道上有2个电子,5个p轨道垂直于环所在的 平面,侧面交盖形成闭合的共轭体系。
杂环化合物的分类和命名
1. 杂环化合物的分类 单杂环
五元杂环 六元杂环
稠杂环
苯并杂环
杂环并杂环
2 . 杂环化合物的命名
。 音译法是按杂环化合物的外文名称音译,以口字旁 同音汉字表示。
12 杂环化合物
五元杂环
编号从杂原子开始, 按O S N的顺序, 使杂原子的序号最低.
N O
furan
N N H
imidazole
SP2杂化 2S2 2P3 3个SP2 未杂化的P轨道
N
N
N
缺电子芳杂环
符合休克尔4n+2规则,具有芳香性。
12 杂环化合物
下列化合物是否有芳香性?数出π电子。
NH2 N N OH
N N S
N N H
N
O
N CH 3 O CH 3
O
CH 3CH 2
N H
N N CH 3
N H
N CH 3 N H
12 杂环化合物
S
thiophene
N H
pyrrole
S
thiazole
呋喃
β α
噻吩
吡咯
噻唑
咪唑
O
CH3
O
CHO
CH3 O
CH2CH3
2-甲基呋喃
2-呋喃甲醛
2-甲基-5-乙基呋喃
12 杂环化合物
N CH3 O CH3 CH3 S
N CH3 N H
N
2,5-二甲基噁唑
N CH 3 N H CH 3
5-甲基噻唑
N H
β-吲哚乙酸 吲哚的松木片反应呈红色。β-吲哚乙酸简称 IAA,是最早发现的植物内源激素之一。
12 杂环化合物 嘌呤及衍生物
N ቤተ መጻሕፍቲ ባይዱ N H N
O(S)的杂化
SP2杂化 2S2
2P4
3个SP2
未杂化的P
12 杂环化合物
O
S
N的杂化
吡咯N的杂化
SP2杂化
2S2
2P3
3个SP2
未杂化的P轨道
N H
符 合 休 克 尔 4 n+2 规 则 , 都 具有芳香性。 富电子芳杂环
12 杂环化合物
六元杂环
六元杂环结构和芳香性,以吡啶为例: 吡啶N的杂化
NK+
+
+ H2O
N
+ +
HCl
N Cl H N ICH 3
+
N
CH 3I
12 杂环化合物 几种含N化合物碱性强弱
六氢吡啶 > 四氢吡咯 > 氨 > 吡啶 > 苯胺 > 吡咯
N H
>
N H
>
NH3
>
N
>
NH2
>
N H
5、显色反应
呋喃遇盐酸浸过的松木片显绿色,此现象可用于检 验呋喃及其低级衍生物。 吡咯蒸气遇浓盐酸浸过的松木片显红色,可用于 鉴别吡咯及其低级衍生物。
呋喃唑酮
12 杂环化合物 吡咯衍生物
吡咯的衍生物广泛存在 于自然界。如叶绿素、 血红素等。
CH 2 CH 3 CH 3 N N Mg N N
R C 2H 5 CH 3 O
CH3 CH3 HOOC
CH2 N N Fe N N
CH3 CH2 CH3 COOH
R'OOCCH 2CH 2
COOCH 3
叶绿素 R= CH 3 a R= CHO b CH 3 CH 3 R'= CH 3 CHCH 2CH 2CH 2 3C CHCH 2
12 杂环化合物
2、还原反应
呋喃、噻吩、吡咯很容易被还原为饱和的环系。
H2 Pd
O
H2 Pd
O N H
Na C2H5OH
THF
N H S
pKb= 3.7
S
+
S
呈现共轭烯烃的性质
,催化氢化得六氢吡啶。
H2 Pt
pKb= 2.88
N
N H
12 杂环化合物
3、氧化反应
呋喃、吡咯对氧化剂都很敏感,在空气中 就能被氧化。吡啶对氧化剂相当稳定。
12 杂环化合物
12.4 重要杂环化合物
呋喃衍生物
O CHO
浓 OH-
O 2N O
CHO
糠醛
5-硝基糠醛
CH2OH O O O 5-硝基糠醛是医药工业的原料,醛基与氨基化合物 缩合可制备呋喃西林、呋喃唑酮等杀菌和抗菌药物。 CHO
COO-
+
O2N O CH NNHCONH2
呋喃西林
O2N O CH N N O O
血红素
N N H H N N
卟吩
12 杂环化合物 吡啶及其衍生物 吡啶重要的衍生物 维生素PP
吡啶 是有臭味的液体, 能与水、乙醇互溶。吡 啶是非常有用的溶剂, 能溶解氯化铜、氯化锌、 氯化汞、硝酸银等许多 无机盐。
-COOH N
β(烟酸或尼克酸)
CHO HO CH3 N CH2OH
CONH2 N β-吡啶甲酰胺 (烟酰胺或尼克酰胺)
12
杂环化合物
( heterocyclic compound )
环状化合物中,成环 的原子除C外,还含 有 O、S 、 N 等其它原 子的化合物称为杂环 化合物。
12.1
杂环化合物的分类和命名
12.2
12.3 12.4
杂环化合物的结构与芳香性
杂环化合物的性质 重要杂环化合物
12 杂环化合物
12.1
12.3 杂环化合物的化学性质 1、亲电取代反应
N H O S
HNO3
吡咯、呋喃、噻吩 α位取代
I2 NaOH
I
I
吡啶 β位取代
I N I H O S NO 2
亲电取代反应活性
CH3COONO 2 -5 30 0 C ~ H2SO4
SO 3H
NO2 N
吡咯 > 呋喃 > 噻吩 > 苯 > 吡啶
N
H2SO4 370 0 C
CH 3CH 2 N N CH 3
5-甲基咪唑
2,5-二甲基咪唑
N-甲基-4-乙基咪唑
12 杂环化合物
六元杂环
-COOH N
吡啶
N
3-吡啶甲酸
(烟酸)
NH2 N N OH
胞嘧啶
稠杂环
CH 3 5
6 7 4 3
N1 H
2
1N 2
6
NH 2
5 4
N7 N9 H
8
5 6 7 8
4 3
N
3
OH
N
1
2
5-甲基吲哚
CH2NH2 CH2OH
维生素B6
HO CH3 N
CH2OH CH2OH
HO CH3 N
吡哆醇
吡多醛
吡哆胺
12 杂环化合物 嘧啶及其衍生物 核酸中的嘧啶碱
NH 2 N N OH OH N N OH
N N
CH 3 OH N N OH
胞嘧啶(C)
吲哚及其衍生物
尿嘧啶(U)
胸腺嘧啶(T)
CH2COOH
N H
CH 3 KMnO 4 N
KMnO 4/H+
OH-
-COOH N
O C N C O
N
N CH3
-COOH N -COOH
NH2 N
O
NH3
?
N
O CNH 2 N -COOH
12 杂环化合物
4、吡咯、吡啶的酸碱性
含氮化合物碱性的强弱取决于氮原子上未共用 电子对与H+结合的能力。
N H
+ KOH (s)
