吡啶化学性质
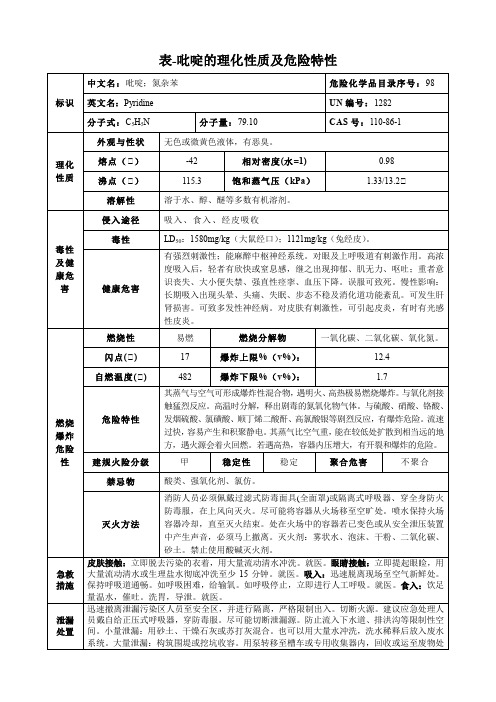
吡啶-理化性质及危险特性表
储存注意事项:储存于阴凉、通风的库房。远离火种、热源。库温不宜超过30℃。应与氧化剂、酸类、食用化学品分开存放,切忌混储。采用防爆型照明、通风设施。禁止使用易产生火花的机械设备和工具。储区应备有泄漏应急处理设备和合适的收容材料。运输注意事项:铁路运输时应严格按照铁道部《危险货物运输规则》中的危险货物配装表进行配装。运输时运输车辆应配备相应品种和数量的消防器材及泄漏应急处理设备。夏季最好早晚运输。运输时所用的槽(罐)车应有接地链,槽内可设孔隔板以减少震荡产生静电。严禁与氧化剂、酸类、食用化学品等混装混运。运输途中应防曝晒、雨淋,防高温。中途停留时应远离火种、热源、高温区。装运该物品的车辆排气管必须配备阻火装置,禁止使用易产生火花的机械设备和工具装卸。公路运输时要按规定路线行驶,勿在居民区和人口稠密区停留。铁路运输时要禁止溜放。严禁用木船、水泥船散装运输。
表
标识
中文名:吡啶;氮杂苯
危险化学品目录序号:98
英文名:Pyridine
UN编号:1282
分子式:C5H5N
分子量:79.10
CAS号:110-86-1
理化性质
外观与性状
无色或微黄色液体,有恶臭。
熔点(℃)
-42
相对密度(水=1)
0.98
沸点(℃)
115.3
饱和蒸气压(kPa)
1.33/13.2℃
燃烧爆炸危险性
燃烧性
ቤተ መጻሕፍቲ ባይዱ易燃
燃烧分解物
一氧化碳、二氧化碳、氧化氮。
闪点(℃)
17
爆炸上限%(v%):
12.4
自燃温度(℃)
482
爆炸下限%(v%):
1.7
危险特性
其蒸气与空气可形成爆炸性混合物,遇明火、高热极易燃烧爆炸。与氧化剂接触猛烈反应。高温时分解,释出剧毒的氮氧化物气体。与硫酸、硝酸、铬酸、发烟硫酸、氯磺酸、顺丁烯二酸酐、高氯酸银等剧烈反应,有爆炸危险。流速过快,容易产生和积聚静电。其蒸气比空气重,能在较低处扩散到相当远的地方,遇火源会着火回燃。若遇高热,容器内压增大,有开裂和爆炸的危险。
吡啶与嘧啶结构式__概述说明以及解释

吡啶与嘧啶结构式概述说明以及解释1. 引言1.1 概述吡啶和嘧啶是两种重要的杂环化合物,在有机化学和药物化学领域具有广泛的应用。
它们都属于氮杂环化合物,拥有特殊的分子结构和性质。
本文将对吡啶和嘧啶的结构式、性质及应用进行综述,并探讨它们的合成方法和反应机理。
1.2 文章结构本文共分为五个部分。
首先是引言部分,概述文章的目的和内容。
接下来是吡啶与嘧啶结构式的介绍,包括吡啶和嘧啶的具体结构式及其区别与联系。
第三部分将详细阐述吡啶与嘧啶的性质及其在不同领域中的应用。
然后,我们将着重探讨吡啶与嘧啶的合成方法和反应机理,包括各自的合成路线以及互相之间可能存在的转化反应机制。
最后,在结论中总结了吡啶与嘧啶的特点和重要性,并展望了未来研究领域可能面临的挑战。
1.3 目标本文旨在全面介绍吡啶和嘧啶的结构式、性质及应用,并对它们的合成方法和反应机理进行深入探讨。
通过该文,读者可以更好地理解吡啶和嘧啶这两种重要化合物,了解它们的特点和重要性,以及在不同领域中的应用前景。
同时,本文也为相关领域的研究人员提供了一些可能的发展方向和挑战。
2. 吡啶与嘧啶结构式2.1 吡啶的结构式吡啶是一种含有氮原子的芳香化合物,其分子式为C5H5N。
吡啶分子由一个六元环和一个氮原子组成,六元环上有五个碳原子和一个氮原子,碳原子上分别连接着一个氢原子。
吡啶的结构示意图如下所示:```H|H–C=N–C–H|H```2.2 嘧啶的结构式嘧啶也是一种含有氮原子的芳香化合物,其分子式为C4H4N2。
嘧啶分子由一个六元环和两个氮原子组成,六元环上有四个碳原子和两个氮原子。
其中一个氮原子连接着另一个含碳基团。
嘧啶的结构示意图如下所示:```H H\ /C = N –C|N|H```2.3 吡啶与嘧啶的区别与联系尽管吡啶和嘧啶都属于芳香异族化合物且具有相似的命名后缀“-in”,它们之间存在一些区别和联系。
区别:- 结构差异: 吡啶分子的六元环上只有一个氮原子,而嘧啶分子的六元环上有两个氮原子,并且其中一个氮原子连接着碳基团。
吡啶

吡啶汉语拼音:bǐdìng英文名称:pyridine中文名称2:氮(杂)苯CAS No.:110-86-1分子式:C5H5N分子量:79.10吡啶是含有一个氮杂原子的六元杂环化合物。
可以看做苯分子中的一个(CH)被N取代的化合物,故又称氮苯。
吡啶及其同系物存在于骨焦油、煤焦油、煤气、页岩油、石油中。
[编辑本段]物理性质外观与性状:无色或微黄色液体,有恶臭。
熔点(℃):-41.6沸点(℃):115.3相对密度(水=1):0.9827折射率:1.5067(25℃)相对蒸气密度(空气=1):2.73饱和蒸气压(kPa): 1.33/13.2℃闪点(℃):17引燃温度(℃):482爆炸上限%(V/V):12.4爆炸下限%(V/V): 1.7溶解性:溶于水、醇、醚等多数有机溶剂。
与水形成共沸混合物,沸点92~93℃。
(工业上利用这个性质来纯化吡啶。
)[编辑本段]化学性质吡啶及其衍生物比苯稳定,其反应性与硝基苯类似。
典型的芳香族亲电取代反应发生在3、5位上,但反应性比苯低,一般不易发生硝化、卤化、磺化等反应。
吡啶是一个弱的三级胺,在乙醇溶液内能与多种酸(如苦味酸或高氯酸等)形成不溶于水的盐。
工业上使用的吡啶,约含1%的2-甲基吡啶,因此可以利用成盐性质的差别,把它和它的同系物分离。
吡啶还能与多种金属离子形成结晶形的络合物。
吡啶比苯容易还原,如在金属钠和乙醇的作用下还原成六氢吡啶(或称哌啶)。
吡啶与过氧化氢反应,易被氧化成N-氧化吡啶。
[编辑本段]用途除作溶剂外,吡啶在工业上还可用作变性剂、助染剂,以及合成一系列产品(包括药品、消毒剂、染料、食品调味料、粘合剂、炸药等)的起始物。
吡啶还可以用做催化剂,但用量不可过多,否则影响产品质量。
[编辑本段]来源(合成方法)吡啶可从天然煤焦油中获得,也可由乙醛和氨制得。
吡啶及其衍生物也可通过多种方法合成,其中应用最广的是汉奇吡啶合成法,这是用两分子的β-羰基化合物,如乙酰乙酸乙酯与一分子乙醛缩合,产物再与一分子的乙酰乙酸乙酯和氨缩合形成二氢吡啶化合物,然后用氧化剂(如亚硝酸)脱氢,再水解失羧即得吡啶衍生物。
吡啶化学性质

ACS;PVC Coated Bottles;Aluminum Bottles;CHROMASOLV Plus;Chromatography Reagents&;HPLC &;HPLC Plus Grade Solvents (CHROMASOLV);HPLC/UHPLC Solvents(CHROMASOLV);UHPLC Solvents (CHROMASOLV);ACS Grade Solvents;Carbon Steel Cans with NPT Threads;Semi-Bulk Solvents;分析标准品;精细化学品Mol110-86-1.mol文件:吡啶性质熔点-42 °C沸点96-98 °C(lit.)密度0.983 g/mL at 20 °C蒸气密度 2.72 (vs air)蒸气压23.8 mm Hg ( 25 °C)折射率n20/D 1.509(lit.)FEMA 2966闪点68 °F储存条件Store at RT.水溶解性Miscible凝固点-42℃Merck 14,7970BRN 103233稳定性Stable. Flammable. Incompatible with strong oxidizing agents, strong acids.CAS 数据库110-86-1(CAS DataBase Reference)NIST化学物质信息Pyridine(110-86-1)EPA化学物质信息Pyridine(110-86-1)吡啶用途与合成方法概述吡啶(分子式C6H5N)含有一个氮杂原子的六元杂环化合物,即苯分子中的一个-CH=被氮取代而生成的化合物,与苯类似,具有相同的电子结构,仍有芳香性,故又称氮苯和氮杂苯,在常温下是一种无色有特殊气味的液体,熔点-41.6℃,沸点115.2℃,与水形成共沸混合物,沸点92~93℃。
吡啶(MSDS)

危险化学品安全技术性能数据(MSDS)标识中文名:吡啶英文名:Pyridine分子式:C2H6S2相对分子质量:CAS号:110-86-1危险性类别:易燃液体化学类别:组成与性状主要成分:含量99.5%外观与形状:主要用途:用于制造维生素、磺胺类药、杀虫剂及塑料等。
健康危害健康危害:吸入有毒,口服会中毒。
呼吸道刺激、皮肤刺激、严重眼刺激。
急救措施皮肤接触:立即脱去污染的衣着,用大量流动清水冲洗。
如有不适感,就医。
眼睛接触:立即提起眼睑,用大量流动清水或生理盐水彻底冲洗10~15分钟。
如有不适感,就医。
吸入:迅速脱离现场至空气新鲜处。
保持呼吸道通畅。
如呼吸困难,给输氧。
呼吸、心跳停止,立即进行心肺复苏术。
就医。
食入:饮足量温水,催吐、洗胃、导泻。
就医。
急性和迟发效应,主要症状:有强烈刺激性;能麻醉中枢神经系统。
对眼及上呼吸道有刺激作用。
高浓度吸入后,轻者有欣快或窒息感,继之出现抑郁、肌无力、呕吐;重者意识丧失、大小便失禁、强直性痉挛、血压下降。
误服可致死。
慢性影响:长期吸入出现头晕、头痛、失眠、步态不稳及消化道功能紊乱。
可发生肝肾损害。
可致多发性神经病。
对皮肤有刺激性,可引起皮炎,有时有光感性皮炎。
爆炸特性与消防燃烧性:易燃,其蒸气与空气混合,能形成爆炸性混合物。
闪点(℃):20爆炸下限(V%):1.8爆炸上限(V%):12.4引燃温度(℃):482最大爆炸压力(Mpa):无意义最小点火能(Mj):无意义危险特性:其蒸气与空气可形成爆炸性混合物,遇明火、高热极易燃烧爆炸。
与氧化剂接触猛烈反应。
高温时分解,释出剧毒的氮氧化物气体。
与硫酸、硝酸、铬酸、发烟硫酸、氯磺酸、顺丁烯二酸酐、高氯酸银等剧烈反应,有爆炸危险。
流速过快,容易产生和积聚静电。
蒸气比空气重,沿地面扩散并易积存于低洼处,遇火源会着火回燃。
若遇高热,容器内压增大,有开裂和爆炸的危险。
灭火方法:用雾状水、泡沫、干粉、二氧化碳、砂土灭火。
灭火注意事项及措施:消防人员须佩戴防毒面具、穿全身消防服,在上风向灭火。
吡啶怎么读

吡啶怎么读
吡啶:bǐdìnɡ
有机化合物,化学式C5H5N。
无色液体,有臭味。
用做溶剂和化学试剂。
物理性质:
分子量为79.10。
吡啶在常温下是一种无色有特殊气味的液体,熔点-41.6℃,沸点115.2℃,密度0.9819g/cm。
易溶于水和乙醇,本身也可作溶剂。
结构:
从结构上看,吡啶是一种杂环化合物,是一个氮原子取代了苯上的一个碳原子而形成的化合物。
氮堟子的5个电子中,3个用来与其它碳原子形成∏键,因此吡啶有芳香性。
另外2个是定域的孤电子对,所以吡啶呈碱性,也是一种良好的配体(作配体时记作py)。
其共轭酸吡啶合氢离子的pKa值为5.30。
制取:
吡啶可以从天然煤焦油中获得,也可由乙醛和氨制得。
除作溶剂外,吡啶在工业上还可以用作变性剂、助染剂,以及合成一系堗产品的起始物,包括药品、消毒剂、栓料、食品调味料、粘合剂、炸药等等。
药理毒理:
吡啶有毒,吸入、摄取或皮肤接触叠导致男性生育能力降低,也可致癌。
吡啶理化性质与质量指标

吡啶理化性质与质量指标吡啶是一种具有芳香味且具有碱性的有机物,化学式为C5H5N。
它可从煤焦油中提取得到,也可由γ-氨基丁酸经氢化、环化得到。
吡啶具有一系列的理化性质和质量指标,下面将对其进行详细介绍。
一、理化性质:1. 外观和性状:吡啶为无色液体,具有特殊气味。
它的密度为0.982 g/cm³,沸点为115-116℃,熔点为-41℃。
吡啶可溶于水、乙醇、醚等有机溶剂,在大多数有机溶剂中能够与不同物质发生反应。
2.水溶性:吡啶在水中有一定的溶解度,但溶解度较小。
其溶解度随温度的升高而增大,随着吡啶分子量的增大而减小。
在20℃时,吡啶的溶解度为56.7g/L。
3.导电性:吡啶是一种较软的碱,在水中能与H+离子结合形成离子性化合物,使水溶液导电。
吡啶的电离常数(pKa)为5.28,在弱酸性条件下,吡啶能够与酸发生中和反应。
4.氧化性:吡啶在氧气或氧化剂的存在下易氧化成吡啶N-氧化物。
吡啶N-氧化物是吡啶的一个有趣衍生物,其结构与吡啶相似,但有一个氧原子连接到吡啶环上。
吡啶N-氧化物可用作催化剂、氧化剂和还原剂。
5.腐蚀性:吡啶具有一定的腐蚀性,可以与金属发生反应并产生腐蚀作用。
在酸性介质中,吡啶可与铁、铜等金属发生反应生成金属吡啶盐,从而引起金属的腐蚀。
二、质量指标:1.含量:吡啶的含量是指吡啶在化合物或混合物中的质量分数。
含量是判断吡啶纯度的重要指标,一般使用色谱法或滴定法进行测定。
2.水分:水分是指吡啶中溶剂或水的含量。
水分的含量对吡啶的稳定性和使用效果有较大的影响,一般使用干燥管法或卡尔费伯法进行测定。
3.溶解度:吡啶的溶解度是指吡啶在特定溶剂中的溶解度。
溶解度会受到温度、压力和溶剂种类的影响,可通过实验方法进行测定。
4.酸度:吡啶的酸度是指吡啶分子中氮原子与酸发生反应形成离子的能力。
酸度通常通过pKa值进行表示,pKa值越小表示酸性越强。
5.密度:吡啶的密度是指单位体积吡啶的质量。
吡啶MSDS
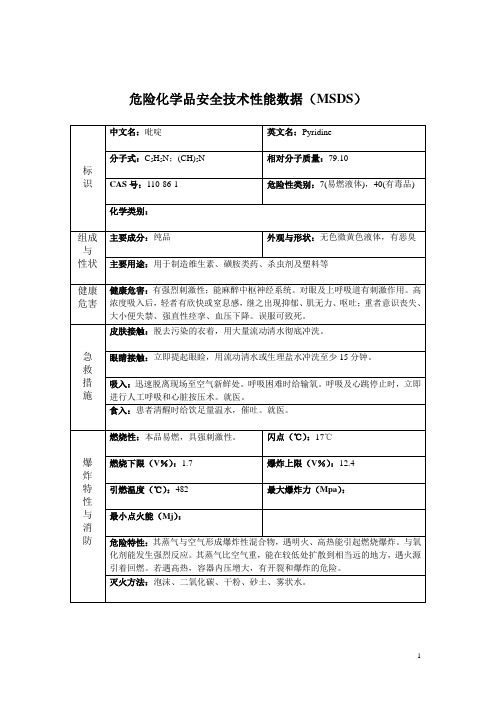
临界温度(℃):无资料
临界压力(Mpa):无资料
溶解性:溶于水、醇、醚等多数有溶剂
燃烧热(kj/mol):无资料
折射率:
稳定性和反应活性
稳定性:稳定
聚合危害:
避免接触的条件:
禁忌物:酸类、强氧化剂、氯仿。
燃烧(分解)产物:一氧化碳、二氧化碳、氧化氮。
毒
理
学
资
料
急性毒性
储运注意事项
储存于阴凉、通风的库房。远离火种、热源。库温不宜超过30℃。应与氧化剂、酸类、食用化学品分开存放,切忌混储。采用防爆型照明、通风设施。禁止使用易产生火花的机械设备和工具。储区应备有泄漏应急处理设备和合适的收容材料。
防护措施
车间卫生标准:中国(TJ36-79),车间空气中有害物质的最高容许浓度,4mg/m3
包装方法:小开口钢桶;安瓿瓶外普通木箱;螺纹口玻璃瓶、铁盖压口玻璃瓶、塑料瓶或金属桶(罐)外普通木箱。
法规信息
化学危险物品安全管理条例(1987年2月17日国务院发布),化学危险物品安全管理条例实施细则(化劳发[1992] 677号),工作场所安全使用化学品规定([1996]劳部发423号)等法规,针对化学危险品的安全使用、生产、储存、运输、装卸等方面均作了相应规定;常用危险化学品的分类及标志(GB 13690-92)将该物质划为第3.2类中闪点易燃液体。
LD50:1580 mg/kg(大鼠经口);1121 mg/kg(兔经皮)
LC50:无资料
亚急性和慢性毒性:
致癌性:
环境资料
该物质对环境可能有危害,应特别注意对水体的污染。
废
弃
用控制焚烧法处置。焚烧炉排出的氮氧化物通过洗涤器除去。 Nhomakorabea运输信息
吡啶的鉴别方法

吡啶的鉴别方法摘要:一、引言二、吡啶的性质与鉴别方法1.吡啶的化学性质2.吡啶的生物活性3.吡啶的鉴别方法三、常见吡啶衍生物的鉴别1.吡啶甲酸2.吡啶甲醇3.吡啶甲醛四、吡啶的检测技术1.气相色谱法2.液相色谱法3.质谱法五、结论与展望正文:一、引言吡啶,一种具有广泛生物活性的有机化合物,存在于许多生物体内,起着重要的生理作用。
在医药、农药、染料等领域有着广泛的应用。
由于吡啶类化合物具有相似的化学结构,因此,对其进行鉴别具有重要意义。
本文将对吡啶的性质及鉴别方法进行综述,以期为相关领域的研究提供参考。
二、吡啶的性质与鉴别方法1.吡啶的化学性质吡啶是一种含有氮原子的芳香烃,其化学结构独特,具有较高的化学稳定性。
吡啶分子中含有π电子,可以与金属形成金属配合物,表现出金属有机化合物的性质。
2.吡啶的生物活性吡啶及其衍生物具有广泛的生物活性,如抗炎、抗菌、抗病毒、抗癌等。
这些生物活性使其在医药领域具有广泛的应用前景。
3.吡啶的鉴别方法吡啶的鉴别方法主要包括光谱法、色谱法、质谱法等。
其中,光谱法主要包括红外光谱、紫外可见光谱和核磁共振氢谱等;色谱法主要包括气相色谱法和液相色谱法;质谱法包括质谱法和电喷雾质谱法等。
三、常见吡啶衍生物的鉴别1.吡啶甲酸吡啶甲酸是一种常见的吡啶衍生物,具有抗菌、抗病毒等生物活性。
其鉴别方法主要包括红外光谱、核磁共振氢谱等。
2.吡啶甲醇吡啶甲醇是一种具有醇和吡啶两种性质的化合物,其生物活性包括抗炎、抗菌等。
鉴别方法主要包括红外光谱、紫外可见光谱等。
3.吡啶甲醛吡啶甲醛是一种具有醛和吡啶两种性质的化合物,具有较高的反应性。
其鉴别方法主要包括红外光谱、紫外可见光谱、核磁共振氢谱等。
四、吡啶的检测技术1.气相色谱法气相色谱法是一种常用的吡啶检测方法,具有较高的灵敏度和分辨率。
通过样品挥发成气相,进入色谱柱进行分离和检测。
2.液相色谱法液相色谱法是另一种常用的吡啶检测方法。
样品经过提取、净化后,进入液相色谱柱进行分离和检测。
吡啶介绍

吡啶产品简介一、用途:主要用作医药工业的原料,用作溶剂和酒精变性剂,也用于生产橡胶、油漆、树脂和缓蚀剂等2-氯吡啶2,6-二氯吡啶2-氨基吡啶N,N'-二环己基碳二亚胺吡啶三唑酮硫双灭多威百草枯还原灰M 可溶性还原蓝IBC 盐酸洛美沙星恶丙嗪维生素D2 甲睾酮醋酸氢化可的松氟他胺危险。
二、理化性质中文别称:一氮三烯六环、氮杂苯、氮环、杂氮苯:英文名Pyridine英文别名Pyridine anhydrous; Azabenzene; Pyridin; Pyr分子式C5H5N分子量79.10CAS号110-86-1凝固点:一42℃沸点:115.3℃液体密度(26℃):978kg/m闪点:-20℃自燃点:482.2℃折射率(20℃): 1. 5092爆炸极限:1.8%~12.4%(体积)外观无色微黄色液体,有恶臭含量99.99%熔点115.3℃~116℃在常温常压下吡啶为具有使人恶心的恶臭的无色或微黄色易燃有毒液体。
能溶于水、醇、醚及其它有机溶剂。
其水溶液呈微威性。
遇火种、高温、氧化剂有发生火灾的危险。
与硫酸、硝酸、铬酸、发烟硫酸、氯磺酸、顺丁烯二酸酐、高氯酸银等反应剧烈,有爆炸的危险。
其蒸气与空气能形成爆炸性混合物。
三、生产方法吡啶可以从炼焦气和焦油内提炼。
汉奇吡啶合成法:这是用两分子的β-羰基化合物,如乙酰乙酸乙酯与一分子乙醛缩合,产物再与一分子的乙酰乙酸乙酯和氨缩合形成二氢吡啶化合物,然后用氧化剂(如亚硝酸)脱氢,再水解失羧即得吡啶衍生物。
主要原料:37%甲醛,乙醛,液氨、丙酮等。
但合成技术上很难突破,被美国等跨国公司垄断全球半个多世纪,我国曾组织专家历经五个五年计划攻关未果。
目前,吡啶国内市场需求很大,目前主要依赖于进口,其吡啶项目生产工艺极其复杂,约有100多道工序。
唐教授:在目前的工业化生产中,催化合成的工艺主要是以甲醛、乙醛和氨气为原料通过缩合反应实现的。
可通过改变原料中醛的种类或反应物的比例来调整产物的种类和产物的量。
吡啶安全技术说明书

吡啶安全技术说明书第一部分化学品及企业标识化学品中文名:吡啶化学品英文名:pyridine危险化学品目录序号:98第二部分成分/组成信息纯品√混合物×有害物成分浓度CAS No.吡啶110-86-1第三部分危险性概述危险性类别:易燃液体,类别2侵入途径:吸入、食入、经皮吸收健康危害:有强烈刺激性;能麻醉中枢神经系统。
对眼及上呼吸道有刺激作用。
高浓度吸入后,轻者有欣快或窒息感,继之出现抑郁、肌无力、呕吐;重者意识丧失、大小便失禁、强直性痉挛、血压下降。
误服可致死。
慢性影响:长期吸入出现头晕、头痛、失眠、步态不稳及消化道功能紊乱。
可发生肝肾损害。
可致多发性神经病。
对皮肤有刺激性,可引起皮炎,有时有光感性皮炎。
环境危害:燃爆危险:本品易燃,具强刺激性。
第四部分急救措施皮肤接触:立即脱去污染的衣着,用大量流动清水冲洗。
就医。
眼睛接触:立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。
就医。
吸入:迅速脱离现场至空气新鲜处。
保持呼吸道通畅。
如呼吸困难,给输氧。
如呼吸停止,立即进行人工呼吸。
就医。
食入:饮足量温水,催吐。
洗胃,导泄。
就医。
第五部分消防措施危险特性:其蒸气与空气可形成爆炸性混合物,遇明火、高热极易燃烧爆炸。
与氧化剂接触猛烈反应。
高温时分解,释出剧毒的氮氧化物气体。
与硫酸、硝酸、铬酸、发烟硫酸、氯磺酸、顺丁烯二酸酐、高氯酸银等剧烈反应,有爆炸危险。
流速过快,容易产生和积聚静电。
其蒸气比空气重,能在较低处扩散到相当远的地方,遇火源会着火回燃。
若遇高热,容器内压增大,有开裂和爆炸的危险。
有害燃烧产物:一氧化碳、二氧化碳、氧化氮。
灭火方法:消防人员必须佩戴过滤式防毒面具(全面罩)或隔离式呼吸器、穿全身防火防毒服,在上风向灭火。
尽可能将容器从火场移至空旷处。
喷水保持火场容器冷却,直至灭火结束。
处在火场中的容器若已变色或从安全泄压装置中产生声音,必须马上撤离。
灭火剂:雾状水、泡沫、干粉、二氧化碳、砂土。
吡啶的官能团

吡啶的官能团吡啶的官能团吡啶是一种重要的芳香性化合物,由于其特殊的结构和化学性质,被广泛应用于药物、农药、染料等领域。
吡啶分子中具有多个官能团,这些官能团影响着吡啶的物理性质和化学反应。
下面,我们来了解一下吡啶中常见的官能团及其作用。
1. 羧基吡啶含有一个带负电荷的羰基,即羧基(-COOH)。
羧基在吡啶分子中具有较强的极性和亲水性,使得吡啶易于形成氢键和离子键。
羧基的存在还增强了吡啶分子的活性,使其在化学反应中更易于发挥作用。
2. 氨基吡啶分子中还可以存在氨基(-NH2)官能团。
氨基在吡啶中具有弱碱性和亲电性,容易与酸或亲电试剂反应。
氨基还可以参与电子位移反应,改变吡啶的碳原子的电荷分布。
3. 叔胺基叔胺基(-N(CH3)2)是一种弱碱性的有机官能团,在吡啶中起到调节不饱和体系的作用。
叔胺基可以改变吡啶分子的电子结构,增加其核子性,促进吡啶分子的活化和反应性。
4. 氯基在吡啶中,氯原子(-Cl)可以取代吡啶的氢原子,替代反应往往会发生在2位。
氯原子对吡啶的毒性较强,因此可以用于制备杀虫剂、除草剂等农药。
5. 溴基吡啶分子中的溴原子(-Br)具有较强的亲电性,可以参与亲电取代反应。
溴代吡啶是一种很常见的吡啶衍生物,广泛应用于药物合成、染料合成等领域。
6. 烯基吡啶分子中还可以存在烯基官能团,例如某些含有3-vinyl基的吡啶。
烯基团在吡啶中具有不饱和性和活性,可以参与共轭加成反应,促进分子内的电荷转移和共轭体系的建立。
总结吡啶分子中的官能团丰富多样,其含有的羧基、氨基等官能团可以发挥亲电性、极性等性质,参与亲核反应或发生取代反应等,从而扩展了吡啶的应用领域。
同时,吡啶中的氯基、溴基等官能团也被广泛应用于化学合成和药物研发。
这些官能团的结合和组合,为吡啶分子的研究和应用提供了更广阔的发展空间。
吡啶及其衍生物.ppt

催化剂去再生塔再生后循环使用。 冷凝液经萃取、精馏(4个精馏塔)。
25
精馏塔制得产物: 2-甲基吡啶、 2-甲基-5-乙基吡啶。 另外一些副产物如4-甲基吡啶和二甲基吡
啶等。
2-甲基吡啶与2-甲基-5-乙基吡啶比例与反 应时间、压力、催化剂的浓度等有关。
17
乙醛 氨
常压、350-500℃,Al2O3为催化剂
气体
预热
催化反应
冷凝
工 艺
精制
分馏
过
程
2-甲基吡啶 4-甲基吡啶
含量:99.2% 收率40-60%
脱水
18
乙醛与氨气相反应与乙醛、甲醛和氨气相 反应所用的催化剂基本相同,
可以设计一套装置进行两种反应的生产, 意大利Montecation公司就有一套装置生产
26
⑤丙酮与丙烯腈反应
丙烯腈与过量的丙酮以伯胺及弱酸催化、在 180℃及2.2 MPa(表压)条件下进行液相反 应,主要得到单氰乙基产物。
后 经者氰在基的H2还流原下、经环过化含及钯脱催氢化,剂得的到气2相-甲反基应吡器, 啶。
O CH3CCH3 + CH2=CHCN
O CH3CCH2CH2CH2CN
N
CH3
27
三 3-甲基吡啶 3-Methylpyridine
(1)性质,无色油状液体,有不愉快的气 味,能与水,乙醇、乙醚混溶。
别名:β-甲基吡啶、3-皮考林。
分子式:C6H7N,
分子量:93.13,
CH3
结构式:
N
28
基本物性数据如下:
29
有毒,液体和蒸气刺激皮肤和粘膜,能使神经中枢 麻醉,可引起流泪、咳嗽、不适、眩晕、头痛、疲 劳、呼吸频繁、四肢震颤、麻醉和昏睡等症状。
吡啶和吡咯结构

吡啶和吡咯结构
吡啶和吡咯是有机化学中常用的两种环状有机化合物,它们在有机合成中具有重要作用。
性质和结构上它们有很大的区别,需要弄清楚它们之间的区别。
首先让我们来看看它们的结构。
吡咯环是一种具有5个碳原子的环,碳原子由3个双键或3个单键和2个双键构成。
而吡啶是一种由3个碳原子和3个氢原子构成的环,碳原子之间有4个单键。
它们的稳定性也有很大的区别,吡啶的稳定性要强于吡咯。
其次,要弄清楚它们之间的化学性质。
吡咯和吡啶各自衍生物的活性也不一样,吡咯衍生物具有很强的氧化、降解和对含酚类有机物活性,吡啶衍生物更多地用于生物合成反应,也有一定的氧还原作用。
此外,吡咯更容易形成取代衍生物,而吡啶容易形成颜色衍生物,比较适合用作颜料。
最后,让我们来看看它们在生物学中的作用。
其中吡咯在生物学中有一定的作用,常用于合成抗菌药物和抗生素,它可以有效地抑制致病菌的生长,但也有可能产生耐药性。
而吡啶则在生物体内催化荷尔蒙合成反应,因此吡啶可以用来制备雌激素、孕激素和甲状旁腺激素等激素。
吡啶的化学制备发

吡啶的化学制备发吡啶的化学制备方法及应用吡啶是一种重要的有机化合物,具有多种应用价值。
它可以用作溶剂、中间体和催化剂等,在有机合成领域有着广泛的应用。
吡啶的化学制备方法有多种,下面将介绍一些常用的方法及其应用。
一、环合反应法环合反应法是吡啶的常见合成方法之一。
一种典型的环合反应是利用胺和醛的缩合反应生成吡啶。
在这种反应中,胺和醛首先发生亲核加成,然后通过缩合反应生成环。
最后,通过脱水反应得到吡啶。
这种方法简单、高效,适用于合成各种取代基的吡啶。
二、氧化反应法氧化反应法是另一种常用的吡啶合成方法。
一种常见的氧化反应是通过氧化吡啶的前体,如吡啶-N-氧化物,得到吡啶。
这种方法通常需要辅助氧化剂的参与,如过氧化氢或过氧化苯甲酰。
氧化反应法制备的吡啶通常具有较高的纯度和较好的产率。
三、重氮化合物反应法重氮化合物反应法是一种独特的吡啶合成方法。
在这种方法中,重氮化合物通过与酮反应生成吡啶。
这种方法的优点是反应条件温和,反应中间体稳定,适用于合成取代基较多的吡啶。
吡啶的应用吡啶作为一种重要的有机化合物,在化工、医药、农药等领域有着广泛的应用。
以下是吡啶的一些常见应用:一、作为有机合成中间体吡啶可以作为有机合成的中间体,用于合成各种有机化合物,如杀虫剂、染料、药物等。
吡啶的化学性质稳定,反应活性高,适用于各种有机合成反应。
二、作为催化剂吡啶及其衍生物可以作为各种有机反应的催化剂,如酯化反应、氧化反应、重氮化合物反应等。
吡啶的催化活性高,反应效率高,是化学合成中的重要催化剂之一。
三、作为溶剂吡啶是一种优良的溶剂,可溶解各种有机化合物,如醇、醚、酮等。
吡啶的溶解性好,挥发性低,对环境的影响小,广泛应用于化工生产中。
综上所述,吡啶的化学制备方法多种多样,各有特点,应根据实际需要选择合适的合成方法。
吡啶作为一种重要的有机化合物,应用价值广泛,在化工、医药、农药等领域有着重要的地位。
通过合理的应用,吡啶可以发挥其在各个领域的优势,促进各种化学反应的进行,为各种产业的发展提供有力支持。
吡啶化学性质

ACS;PVC Coated Bottles;Aluminum Bottles;CHROMASOLV Plus;Chromatography Reagents&;HPLC &;HPLC Plus Grade Solvents (CHROMASOLV);HPLC/UHPLC Solvents(CHROMASOLV);UHPLC Solvents (CHROMASOLV);ACS Grade Solvents;Carbon Steel Cans with NPT Threads;Semi-Bulk Solvents;分析标准品;精细化学品Mol110-86-1.mol文件:吡啶性质熔点-42 °C沸点96-98 °C(lit.)密度0.983 g/mL at 20 °C蒸气密度 2.72 (vs air)蒸气压23.8 mm Hg ( 25 °C)折射率n20/D 1.509(lit.)FEMA 2966闪点68 °F储存条件Store at RT.水溶解性Miscible凝固点-42℃Merck 14,7970BRN 103233稳定性Stable. Flammable. Incompatible with strong oxidizing agents, strong acids.CAS 数据库110-86-1(CAS DataBase Reference)NIST化学物质信息Pyridine(110-86-1)EPA化学物质信息Pyridine(110-86-1)吡啶用途与合成方法概述吡啶(分子式C6H5N)含有一个氮杂原子的六元杂环化合物,即苯分子中的一个-CH=被氮取代而生成的化合物,与苯类似,具有相同的电子结构,仍有芳香性,故又称氮苯和氮杂苯,在常温下是一种无色有特殊气味的液体,熔点-41.6℃,沸点115.2℃,与水形成共沸混合物,沸点92~93℃。
吡啶

1吡啶的结构吡啶是一个典型的芳香族杂环化合物.吡啶环是一个平面环,分子内存在π66的闭合共轭体系.由于N原子的电负性大于C,吡啶环上的电子云密度小于苯,发生亲电取代反应比苯难得多,一般要在强烈条件下才能进行.另外,吡啶分子中的氮原子有一对未共用电子对不参与π体系,所以吡啶具有一定的亲核能力,能进攻带有正电荷的分子,吡啶是一种重要的有机碱.2 物理性质在常温下是一种无色有特殊气味的液体,熔点-41.6℃,沸点115.2℃,与水形成共沸混合物,沸点92~93℃。
(工业上利用这个性质来纯化吡啶),密度0.9819g/cm3。
易溶于水,乙醇,醚等多数有机溶剂,本身也可作溶剂。
3.化学性质3.1吡啶的亲电取代反应吡啶和硝基苯在亲电取代反应的活性上具有类似性.在酸性条件下吡啶常以吡啶鎓离子的形式进行亲电取代反应,它比连有最强的第2类定位基-N+(CH3)3的苯环还要难以反应.若亲电试剂加得少,都和吡啶形成盐;若亲电试剂加得多,则吡啶都成了吡啶翁离子.为了增强亲电试剂的亲电能力,常加入Lewis酸催化剂,但Lewis酸也会和吡啶结合,使氮杂原子带正电从而使亲电取代反应难以进行.但是吡啶环上连有给电子基团时,其亲电取代反应就比较容易进行.3.2碱性吡啶分子中的氮原子有一对未共用电子没有参与π体系,这对电子可与质子结合,所以吡啶显示一定的碱性,其碱性大于吡咯和苯胺,但比脂肪族胺弱得多.吡啶与无机酸作用生成盐. 3.3亲核性吡啶与卤代烷结合生成相当于季铵盐的产物———吡啶翁盐.各种卤代烷的反应活性次序RI> RBr> RCl.若吡啶的3位或4位有给电子基团时,由于基团的给电子作用,N原子上的电子云密度增大,亲核能力增强;反之,吡啶的3位、4位上连有一些吸电子基团时,其亲核能力会下降.各种不同取代基的吡啶其亲核性次序如下:若吡啶的2位有取代基时,受空间位阻的影响不利于吡啶发生亲核反应.。
吡啶-化学品安全数据表

吡啶-化学品安全数据表
1. 概述
- 吡啶是一种有机化合物,分子式为C₅H₅N,是无色油状液体。
- 吡啶主要用作溶剂、催化剂和中间体,在化工、制药和农药等行业广泛应用。
2. 物理性质
- 外观:无色液体
- 相对密度:1.03g/cm³
- 沸点:115-117℃
- 熔点:-41℃
- 溶解度:可溶于水、醇和醚类溶剂
- 稳定性:稳定,避光存放
3. 危险特性
- 吡啶属于易燃液体,遇明火或高温会燃烧。
- 吸入吡啶蒸气可引起头晕、嗜睡、呕吐等中毒症状。
- 接触吡啶可引起皮肤刺激和红斑。
4. 防护措施
- 储存时应远离火源,避免高温区域。
- 在操作时应戴防护眼镜、手套和防护服。
- 遇到泄漏应立即停止泄漏源并采取适当的清理措施。
5. 应急处理
- 发生泄漏时,应迅速撤离人员并隔离泄漏区域。
- 采取适当的通风措施,防止蒸气扩散到工作区。
- 使用干燥的吸附剂吸收泄漏物,放入适当的中处理。
6. 急救措施
- 如吸入过多吡啶蒸气,应将中毒人员移到空气新鲜处,并立即就医。
- 如皮肤接触,立即用大量清水冲洗,并就医检查。
7. 废弃物处理
- 废弃物需按照当地环保法规进行处理,不能直接排入水体或环境中。
请注意:以上数据仅供参考,请在使用吡啶前详细了解相关安全措施和现实情况,遵守相关法律法规。
吡啶类药物的分析

_ 吡啶类药物的分析一.基本结构、典型药物与主要化学性质基本结构如下:典型药物有:主要化学性质1.弱碱性;本类药物母核吡啶环上的氮原子为碱性氮原子,吡啶环在水中的PK b 值为8.8,可用非水溶液滴定法测定该类药物的含量。
2.形成沉淀:本类药物具有吡啶结构,可与重金属盐类(如氯化汞、硫酸酮、碘化铋钾)及苦味酸等试剂形成沉淀,可用于鉴别3.吡啶环的开环反应:可发生戊烯二醛反应,二硝基氯苯反应,用于该类药物的鉴别4.紫外吸收特征:本类药物母核吡啶在紫外区有吸收。
5.各药物具有不同取代基具有不同化学性质a)异烟肼的酰肼基具有较强的还原性,并可与含羰基的试剂发生缩合反应b)尼可刹火与氢氧化钠加热即有二乙胺逸出,能使湿润的荭色石蕊试纸变蓝。
二.鉴别试验(一)吡啶环的开环反应(1)戊烯二醛反应(konig反应)本反应适用于 , `未被取代的吡啶衍生物首先溴化氰作用于吡啶环,使环上氮原子由3价转变为5价,吡啶环经水解形成戊烯二醛,再与芳伯胺缩合而成。
以尼可刹米为例,反应式如下:(2)沉淀形成反应本类药物具有吡啶环的结构,可与重金属盐类(如氯化汞、硫酸酮、碘化铋钾)及苦味酸等试剂形成沉淀。
如异烟肼、尼可刹米可与氯化汞形成白色沉淀(三)此外吸收光谱特征药物溶剂 max(nm) E1%1cm异烟肼HCl(0.01mol/l) 265 约420水266 378尼可刹米H2SO4(0.05mol/l) 263 273NaOH(0.01mol/l) 255 840266 860(四)酰肼基团的反应1.还原反应:异烟肼加水溶解后,加氨制硝酸银试液即有黑色浑浊出现,并生成氮气和金属银。
2.缩合反就:异烟肼中未被取代的酰肼基可与芳醛缩合形成腙,具有一定的熔点。
常用的芳醛为香草醛,其它还有:水杨醛、对二甲氨基苯甲醛等。
(五)分解产物的反应尼可刹米与氢氧化钠试液加热,即有二乙胺臭味逸出,能使湿润的红色石蕊试纸变蓝。
含量测定(一)氧化还原滴定法利用异烟肼酰肼基具有还原性可采用溴酸钾法、碘量法、溴量法等测定其含量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
ACS;PVC Coated Bottles;Aluminum Bottles;CHROMASOLV Plus;Chromatography Reagents
&;HPLC &;HPLC Plus Grade Solvents (CHROMASOLV);HPLC/UHPLC Solvents
(CHROMASOLV);UHPLC Solvents (CHROMASOLV);ACS Grade Solvents;Carbon Steel Cans with NPT Threads;Semi-Bulk Solvents;分析标准品;精细化学品
Mol
110-86-1.mol
文
件:
吡啶性质
熔点-42 °C
沸点96-98 °C(lit.)
密度0.983 g/mL at 20 °C
蒸气密度 2.72 (vs air)
蒸气压23.8 mm Hg ( 25 °C)
折射率n20/D 1.509(lit.)
FEMA 2966
闪点68 °F
储存条件Store at RT.
水溶解性Miscible
凝固点-42℃
Merck 14,7970
BRN 103233
稳定性Stable. Flammable. Incompatible with strong oxidizing agents, strong acids.
CAS 数据库110-86-1(CAS DataBase Reference)
NIST化学物质信息Pyridine(110-86-1)
EPA化学物质信息Pyridine(110-86-1)
吡啶用途与合成方法
概述吡啶(分子式C6H5N)含有一个氮杂原子的六元杂环化合物,即苯分子中的一个-CH=被氮取代而生成的化合物,与苯类似,具有相同的电子结构,仍有芳香性,故又称氮苯和氮杂苯,在常温
下是一种无色有特殊气味的液体,熔点-41.6℃,沸点115.2℃,与水形成共沸混合物,沸点92~
93℃。
(工业上利用这个性质来纯化吡啶),密度0.9819g/cm3。
易溶于水,乙醇,醚等多数有机
溶剂,本身也可作溶剂。
吡啶最初由骨焦油内分离出来,随后发现煤焦油、煤气、页岩油、石
油内也含有吡啶及其同系物,如2-甲基吡啶和2,6-二甲基吡啶。
吡啶及其衍生物比苯稳定,其反应性与硝基苯类似。
由于环中氮原子的吸电子作用,使2,4,6
位上的电子密度低于3,5两位,典型的芳香族亲电取代反应发生在3,5位上,但反应性比苯低,。
