第十四章过渡元素ⅣB-ⅦBⅧ-资料
第十四章过渡元素ⅣB-ⅦBⅧ-资料

( n=0 )
( n=2 )
(不稳定)
Fe2+ Fe3+无此配合物
.
无机化学
Thank you
1–3. 过渡元素的氧化态.
由于d电子的部分或全部参加成键,所以过渡 元素的氧化态一般从+Ⅱ~与族数
相同的最高氧化态.见p1049 表21–8. 同一周期.从左→右 氧化态↑ ⅦB 最高,然后
↓. 同一族.自上而下,高氧化态比较稳定,而主族
低氧化态比较稳定;
无机化学
六、资产配置
• 资产配置的定义、类别 • 战略资产配置:主要针对各资产大类 • 战术资产配置:主要针对各资产子类、行业
与酸反应 Cr( 无氧化膜 ), 可溶于稀 HN Mo、W可溶于HNO3+HF 与非金属反应. 易形成合金
无机化学
3-2.重要化合物
1.CrO3 2.Cr2O3 3.重铬酸盐 4.铬酸盐(CrO24- ) 5.钼酸盐.
无机化学
4-2.
Hale Waihona Puke .1.Mn(Ⅱ)2.MnO2 3.KMnO4
1.Mn(Ⅱ)
Mn(Ⅱ)具有还原性
2Mn2++5S2O
2Mn(OH)2+O2=2MnO(OH)2↓
白色
棕褐色
2.MnO2
MnO2黑色粉末具有氧化性 MnO2+4HCl D= MnCl2+Cl2+2H2O 2MnO2+4KOH+O2=2K2MnO4+2H2O pH>14预定
3MnO +4H+=2MnO+MnO2+H2O
无机化学
1-1. 过渡元素的价电子层结构.
(n-1)d1~10ns1~2 (Pd:4d105s0) d电子数较多.d电子可部分或全部成键. d轨道未充满可接受孤电子
过渡金属元素类型与应用

• 过渡元素是指长周期表中d区和ds区元素,在周期 表中包括IIIB族~IIB族。通常按同元素的性质相 近把过渡元素分成三个系列。
族
周期
IIIB IVB VB VIB VIIB
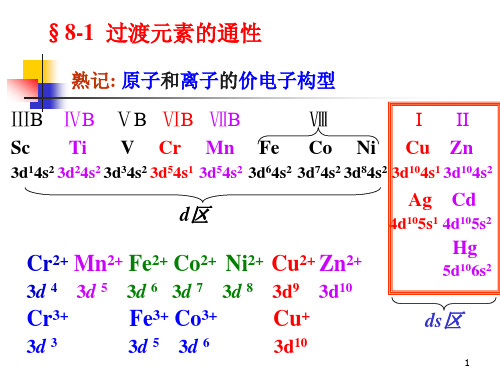
第一过渡系 Sc Ti V Cr Mn
VIIIቤተ መጻሕፍቲ ባይዱ Fe Co Ni
IB IIB Cu Zn
第二过渡系 Y Zr Nb Mo Tc Ru Rh Pd Ag Cd
-0.44 -0.277
稀HCl 稀HCl H2SO4 等
等 (缓慢)
-0.257
稀H2SO4 HCl等
Cu
0.34
浓 H2SO4
Zn -0.7626 稀HCl H2SO4等
值同I其。I一I可B活第族周溶泼一是期于性过过迅元非减渡渡速素氧元弱氧系从素化化金左中,性属过到最渡与稀金除活右属水酸元C泼素作总u类置的型用外趋和换金应释,势用出E属放E,氢(出MS(氢气Mc2+、气。/2M+Y/M、)均L)增为a 能大负
(2)水合离子的颜色 • 过渡金属的水合离子、含氧酸根离子和配离子常
是有颜色的,与此相反,主族金属的相应离子是 无色的。 • 过渡元素的离子通常在d轨道上有未成对电子,这 些电子的基态和激发态的能量比较接近,一般只 要是可见光中的某些波长的光就可使电子激发, 这些离子大都具有颜色。
过渡金属元素类型和应用
过渡元素熔点、沸点的递变规律是自IIIB至VIB依次升 高,VIB族金属的熔点、沸点最高,VIIB族以后逐渐 降低,IIB族已是低熔点金属,汞的熔点(234.13K) 最低。VIB族的铬硬度过最渡金大属元(素类9型)和应。用
IVB~VIIB族元素的单质具有高熔、沸点、高硬度的原 因,主要是它们的原子半径较小,有效核电荷较大, 价电子层有较多的未成对d电子(铬有5个),这些d电 子也参与成键,因而增过渡强金属了元素金类型属和应的用 强度和晶格能。
过渡金属元素分解

其中:ΦA / V
Cr2O72 -/ Cr3+ MnO4- / Mn2+ FeO42- / Fe2+ NiO42- / Ni2+
1.33 1.49 1.84 1.75
(三)氧化态的稳定性
2.同一族
高稳氧 氧定化 化性性 态↗↘
Ⅵ
CrO42-/Cr3+ MoO4-/M3+ WO42-/W3+
Ⅶ
MnO4-/Mn2+ TcO4-/Tc+3 ReO4-/Re3+
低稳 氧定 化性 态
↗
与ⅢA ~ ⅤA 族规律相反!
反映过渡金属元素 5d, 6d 电子参与成键倾向↑
原因:
(1)(n-1)d 电子电离能
n ↗, (n-1)d 电子电离倾向↘ (d 电子云发散)
(2)形成 d-p 键能力:
3d < 4d < 5d
稳定性: 氧化性:
CrO42- < MoO42- < WO42-
二、氧化态
(一)同一元素,多种氧化态
原因:(n-1)d 与 ns 轨道能量相近,部分(n-1)d 电子参与成键。
例:Mn 2 ~ +7 均出现,主要+2,+3,+4,+6,+7. Fe 2 ~ +6 均出现,主要+2,+3,+6.
(二)最高氧化态
ⅢB ~ ⅦB 族:最高氧化态 == 族数
例: Sc Cr Mn
24Cr
3d54s1
不是 3d44s2
41Nb 铌
4d45s1
不是 4d35s2
42Mo
4d55s1
不是 4d45s2
元素周期表(默写版)
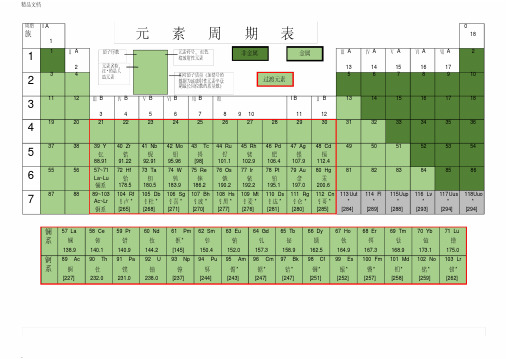
周期 I A
族
1
11
23
3 11
4 19
ⅡA 2 4
12
20
元
原子序数
元素名称, 注 *的是人 造元素
ⅢB
3 21
ⅣB
4 22
ⅤB
5 23
素周期表
元素符号, 红色 指放射性元素
非金属
金属
相对原子质量(加括号的 数据为该放射性元素半衰 期最长同位数的质量数)
ⅥB
ⅦB
Ⅷ
过渡元素 IB
6
7
8 9 10
140.1
59 Pr 镨
140.9
60 Nd 钕
144.2
61 Pm 钷*
[145]0
64 Gd 钆
157.3
65 Tb 铋
158.9
66 Dy 镝
162.5
67 Ho 钬
164.9
68 Er 铒
167.3
69 Tm 铥
168.9
70 Yb 镱
173.1
La~Lu
铪
钽
钨
铼
锇
铱
铂
金
汞
镧系 178.5 180.5 183.9 186.2 190.2 192.2 195.1 197.0 200.6
88 89~103 104 Rf 105 Db 106 Sg 107 Bh 108 Hs 109 Mt 110 Ds 111 Rg 112 Cn 113 Uut 114 Fl 115Uup 116 Lv 117 Uus 118Uuo
11
24
25
26
27
28
29
ⅡB
12 30
ⅢA 13 5
元素周期表(带读音、英文名称高清版)
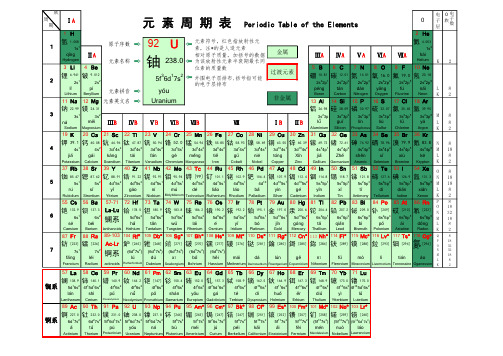
Gallium Germanium Arsenic Selenium Bromine Krypton K 2
37 Rb 38 Sr 39 Y 40 Zr 41 Nb 42 Mo 43 Tc 44 Ru 45 Rh 46 Pd 47 Ag 48 Cd 49 In 50 Sn 51 Sb 52 Te 53 I 54 Xe O 8
Helium K 2 5 B 6 C 7 N 8 O 9 F 10 Ne
硼 碳 氮 氧 氟 氖 10.81
12.01
14.01
16.0
19.0
20.18
2s22p1 2s22p2 2s22p3 2s22p4 2s22p5 2s22p6
péng
tàn
dàn
yǎng
fú
nǎi L 8
Boron Carbon Nitrogen Oxygen Fluorine Neon K 2
2
57 La 58 Ce 59 Pr 60 Nd 61 Pm 62 Sm 63 Eu 64 Gd 65 Tb 66 Dy 67 Ho 68 Er 69 Tm 70 Yb 71 Lu
镧系
镧 铈 镨 钕 钷 钐 铕 钆 铽 镝 钬 铒 铥 镱 镥 138.9
140.1
140.9
144.2
[147]
150.4
137.3 La-Lu
178.5
180.9
183.8
186.2
190.2
192.2
195.1
197.0
200.6
204.4
207.2
209.0
[209]
[210]
O [222] N
6s1
6s2 镧系
5d26s2
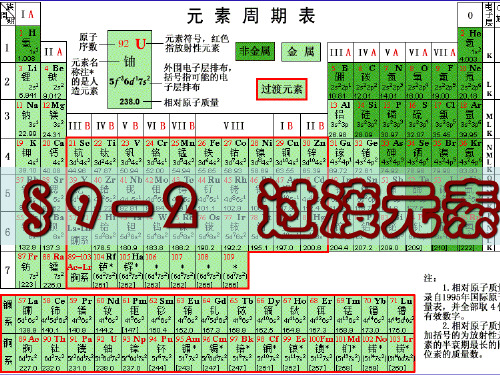
过渡元素

简介
综合介绍
信息介绍
性质特征
信息介绍
周期表中从IIIB族到VIII族的元素。共有三个系列的元素(钪到镍、钇到钯和镧到铂),电子逐个填入他 们的3d、4d和5d轨道。有时人们把过渡元素的范围扩大到包括镧系元素和锕系元素。因此有时也把铜族元素包括 在过渡元素范围之内。锌族元素(IIB)形成稳定配位化合物的能力上与过渡元素很相似,因此也有人建议把锌 族元素归入过渡元素范围。各系列过渡元素的与阿兹半径自左而右缓慢递减,各族元素的半径自上而下略有增加, 但不像主族元素增加的那样显著。
制作模式
过渡金属大多有其独特的生产方法:电解法、金属热还原法、氢还原法和碘化物热分解法。 存在: 大多数过渡金属都是以氧化物或硫化物的形式存在于地壳中,只有金、银等几种单质可以稳定存在。
催化剂
过渡金属催化剂或是生命起源的关键
要解释生命如何在地球上出现这个悬而未决的大问题,就像是回答先有鸡还是先有蛋的悖论:诸如氨基酸和 核苷酸这样的基本生化物质,是如何在生物催化剂(蛋白质或核酶)出现之前而完成其构造的?在最新一期《生 物学通报》上,科学家发表论文指出,或是第三种类型的催化剂启动了深海热泉中的新陈代谢以及生命。
原子结构
原子构型
原子半径
原子构型
过渡元素原子电子构型的特点是它们的d轨道上的电子未充满(Pd例外),最外层仅有1~2个电子,它们的 价电子构型为(n-1)d1-9ns1-2(Pd为4d5s)。
过渡元素原子的价电子层结构和氧化态 注:划横线的表示比较常见、稳定的氧化态;带括号的表示不稳定的氧化态。 多电子原子的原子轨道能量变化是比较复杂的,由于在4s和3d、5s和4d、6s和5d轨道之间出现了能级交错 现象,能级之间的能量差值较小,所以在许多反应中,过渡元素的d电子可以部分或全部参加成键。
过渡元素的结构特点与基本性质

过渡元素的结构特点与基本性质元素周期表中第四、五、六七周期元素中,第ⅢB~ⅤⅢ族,共25种元素,统称为过渡元素。
过渡元素的单质都是金属,所以也称为过渡金属元素。
见表16.1.5s0,是一种例外的电子排布)。
镧系、锕系的元素的电子排布,增加的电子填入(n-2)f亚层,例如:57La 4f 05d1 6s 2,在结构上,它们最外层二个电子层都是未充满的,因此在元素周期表的划分上不属于过渡金属元素,而属于内过渡元素。
也称之为镧系、锕系元素。
镧系57La ~ 71Lu (15种元素) 4f 0~145d0-1 6s2锕系89Ac~103Lr铹(15种元素)5f 0~146d0~1 7s216.1.1 价电子构型过渡金属价电子构型的通式为:(n-1)d1~9 ns1~2。
原子核外电子排布遵循能量最低原理、保里不相容原理和洪特规则。
L. Pauling 原子轨道近似能级图如下:1s; 2s 2p ; 3s 3p; 4s 3d 4p; 5s 4d 5p; 6s 4f 5d 6p ; 7s 5f 6d也有一些电子排布例外的情况,例如:Z = 24,41 ~ 46:Nb 铌4d45s1不是4d35s241W 钨 5d46s2不是4d55s142Ru 钌4d75s1不是4d65s244Rh 铑4d85s1不是4d75s245Pd 钯4d105s0 不是4d85s24616.1.2 氧化态的规律过渡金属元素常表现为多种氧化态,其根本原因在于内层电子的排布,过渡金属外层电子排布为:(n-1)d1~9 ns1~2 ,(n-1)d轨道与ns轨道能量相近,部分(n-1)d电子参与成键。
例:Mn:+2 ~ +7均出现,主要+2,+3,+4,+6,+7.Fe:+2 ~ +6均出现,主要+2,+3,+6.过渡金属元素的最高氧化态与所在的族相等,最高氧化态= 所处的族数例:Sc +3 Ⅲ3d14s2Cr +6 Ⅵ3d54s1Mn +7 Ⅶ3d54s1但Ⅷ族:多数最高氧化态小于其族数,是因为随着有效核电荷的增加(Z *↑),不是所有(n-1)d 电子都参与成键。
过渡元素
2、分类
为了讨论的方便,可以根据过渡元素的综合化学性质进行分类:
★周期表
位置
前过渡元素:IVB-VIIB,不包括Mn,位于d区前部, 其特征是其高价离子在水溶液中常发生聚合作用。 后过渡元素: Mn到Cu,第一过渡系的后部,其特点 是以水溶液化学和配位化学为其特征。
(1) Cr2O3(铬绿) 微溶于水, 具有-Al2O3的结构
[制备]
4Cr 3O2 2Cr2O3 ( NH 4 )2 Cr2O7 Cr2O3 N 2 4 H 2O
[两性]
Cr2O3 6 H 2Cr 3 3H 2O
亚铬盐(紫色)
3H 2O Cr2O3 2OH 2Cr (OH ) 4 亚铬酸盐(绿色)
★贵金属元素:Ⅷ的第五、六周期元素有:Ru、Rh、Pd,Os、 Ir、Pt,再加上Ag、Au,特征:丰富的配位化学。 ★不同 周期
★电子进
第四周期:第一过渡系,又称轻过渡元素;
第五、第六周期:第二、三过渡系,又称重过渡元素。
第一、第二和第三过渡系总称为“主过渡元素”;
f区元素称为“内过渡元素”。
入轨道
3)过渡元素的多变氧化态
过渡元素一般都有多变的氧化态。 如:Fe有+2、+3、+6 三种氧化态(FeO、Fe2O3、Na2FeO4等) Cr有+2、+3、+6 三种氧化态(CrO、Cr2O3、CrO3等) Mn有+2、+3、+4、+6、+7 多种氧化态(MnO、Mn2O3、 MnO2、K2MnO4、KMnO4等)
第一过渡系
过渡元素
Cr2O72-+ 4 H2O2+ 2 H+
2 CrO5 + 5 H2O
蓝色
在酸介质中CrO5分解:
4 CrO(O2)2 + 6 H2SO4 = 2Cr2(SO)3+ 7 O2 ↑+ 2 H2O
CrO5 (过氧化铬)结构 实际是 过氧离子O22- 以π电子对Cr(Ⅵ)形成配位键。
12
总结:铬的重要化合物
过渡元素的原子或离子具有部分空的(n-1)d, ns、 空的np轨道可接受配体的孤对电子。
过渡元素的离子一般具有较高的电荷、较小的 半径,极化力强, 对配体有较强的吸引力。 过渡元素及化合物有催化特性
催化剂 Fe/Mo Pt/Rh V2O5 反应 合成氨 氨氧化为NO SO2氧化为SO3
Pd Raney
油状 绿色
冷
MnO2 + O2 + O3
Mn2O7 + 有机物(例乙醇) → 爆炸、燃烧
20
2. 强氧化剂,常用于“氧化—还原滴定”定量分析中, 其还原产物与酸碱介质有关:
介质 被还原产物
酸性 Mn2+
OH-
中性或弱碱性 MnO2
MnO42MnO2↓ + SO42Mn2+
Sc 0 无
[Fe(H2O)6]3++H2O [Fe(OH)(H2O)5]2++H3O+ [Fe(OH)(H2O)5]2++H2O [Fe(OH)2(H2O)4]++H3O+ 因水解, 溶液呈黄色或红棕色, pH增大, 缩聚成红棕色胶 状沉淀, pH=4~5, 形成水合三氧化二铁沉淀
2
元素周期表

周期的特点
• 周期序数 = 电子层数
• 记住每一周期包含的元素种类和每 一周期起止元素的原子序数,可以 很方便的判断元素在周期表中的位 置
周期分类及各周期元素种数
周 期 一二三四五六 七
元素种数 周期分类
288 短周期
18 18 32 长周期
32,32 + 稀有气体的原子序数:2,10,18,3
6,54,86. + 记住1~20号元素的名称和符号
方法指引
根据原子序数推算主族元素在周期表中的位置
将该原子序数同与之最相近的惰性元素的序数相 减:
1、若比相应惰性元素大1-2,则应处在下一周期 的ⅠA- ⅡA
2、若比相应惰性元素小1-5,则应处在同一周期 的ⅦA -ⅢA,依次倒推
元素周期表
1869年门捷列夫在继承和分析了前人工作的基 础上,对大量实验事实进行了订正、分析和概括, 成功地对元素进行了科学分类。将化学性质相似的 元素放在一个纵行制出了第一张元素周期表,揭示 了化学元素的内在联系,使其构成一个完整的体系 成为化学发展史上重要的里程碑之一。
他还预言了一些未知元素的性质都得到了证实。 但是由于时代的局限,门捷列夫揭示的元素内在联 系的规律还是初步的,他未能认识到形成元素性质 周期性变化的根本原因。
元素周期表
IA
0
H
A:主族
He
1
1氢 IIA IIIA IVA VA VIA VIIA 2氦
Li Be B
C
N
O
F Ne
2
3锂 4铍 5硼 6碳 7氮 8氧 9氟 10氖
Na Mg Al Si
元素周期表知识点总结

考纲要求:①了解元素、核素和同位素的含义。
②了解原子的构成。
了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
③了解原子核外电子排布规律。
④掌握元素周期律的实质。
了解元素周期表(长式)的结构(周期、族)及其应用。
⑤以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。
⑥以ⅠA 和ⅦA 族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
⑦了解金属、非金属元素在周期表中的位置及其性质递变规律。
⑧了解化学键的定义。
了解离子键、共价键的形成。
知识点总结:中子N(核素)原子核质子Z → 元素符号原子结构 : 决定原子呈电中性 电子数(Z 个):化学性质及最高正价和族序数核外电子 运动特征:体积小,运动速率高(近光速)排布规律 → 电子层数 周期序数及原子半径 表示方法 → 原子(离子)的电子式、原子结构示意图1.原子结构[核电荷数、核内质子数及核外电子数的关系]核电荷数=核内质子数=原子核外电子数注意: (1) 阴离子:核外电子数=质子数+所带的电荷数阳离子:核外电子数=质子数-所带的电荷数(2)“核电荷数”与“电荷数”是不同的,Cl -的核电荷数为17,电荷数为1.[质量数] 用符号A 表示.将某元素原子核内的所有质子和中子的相对质量取近似整数决定X)(A Z值相加所得的整数值,叫做该原子的质量数.说明(1)质量数(A)、质子数(Z)、中子数(N)的关系:A=Z + N.(2)符号A Z X的意义:表示元素符号为X,质量数为A,核电荷数(质子数)为Z的一个原子.例如,2311Na中,Na原子的质量数为23、质子数为11、中子数为12.[原子核外电子运动的特征](1)当电子在原子核外很小的空间内作高速运动时,没有确定的轨道,不能同时准确地测定电子在某一时刻所处的位置和运动的速度,也不能描绘出它的运动轨迹.在描述核外电子的运动时,只能指出它在原子核外空间某处出现机会的多少.(2)描述电子在原子核外空间某处出现几率多少的图像,叫做电子云.电子云图中的小黑点不表示电子数,只表示电子在核外空间出现的几率.电子云密度的大小,表明了电子在核外空间单位体积内出现几率的多少.(3)在通常状况下,氢原子的电子云呈球形对称。
过渡金属元素ppt课件

其中:ΦA / V
Cr2O72 -/ Cr3+
1.33
MnO4- / Mn2+
1.49
FeO42- / Fe2+ NiO42- / Ni2+
1.84 1.75
5
(三)氧化态的稳定性
2.同一族
高稳氧 氧定化 化性性 态↗↘
Ⅵ
CrO42-/Cr3+ MoO4-/M3+ WO42-/W3+
Ⅶ
MnO4-/Mn2+ TcO4-/Tc+3 ReO4-/Re3+
ⅢB ⅦB Ⅷ
+3 +7 +6 最高氧化态氧化性↗ 最高氧化态稳定性↘
低氧化态稳定性↗
例 第一过渡系列:
氧化性 稳定性
Sc3+ < TiO2+ < VO2+ < Cr2O72 - < MnO4- < FeO42Sc3+ > TiO2+ > VO2+ > Cr2O72- > MnO4- > FeO42-
例:r / pm 57 La 187.7, 71 Lu 173.5
Δr
187.7 173.5 = 71 57
≈ 1 pm
9
三、原子半径:
“镧系收缩”
——从 57 Ln – 71 Lu,随着原子序数递增,增加的电子进入 (n-2) f(即 4f)轨道(4f 0 ~145d 0~16s 2);对于最外层 6s 电子而言,4f 电子位于次外层, Z*增加很小,因此
过渡金属元素
(ⅢB~ⅤⅢ族,d 区)
(n-1)d1~9 ns1~2 (例外 Pd 4d10 5s0 )
元素周期表 超高清
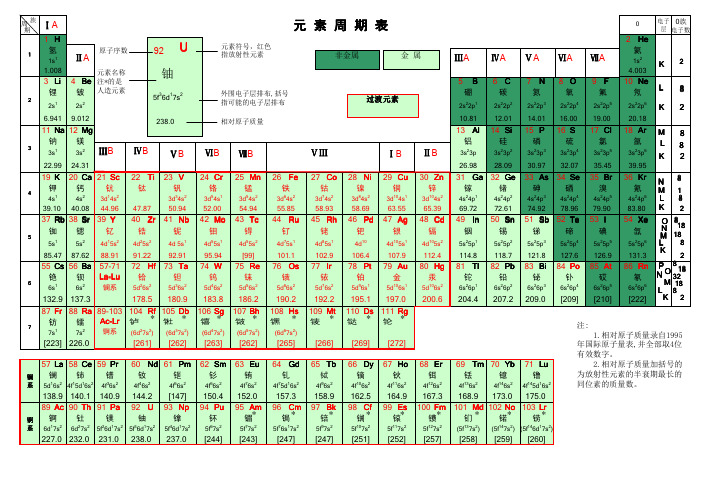
57 La 58 Ce 59 Pr
镧系
镧铈
镨
5d16s2 4f15d16s2 4f36s2
60 Nd 61 Pm
钕
钷
4f46s2
4f56s2
138.9 140.1 140.9 144.2 [147]
89 Ac 90 Th 91 Pa 92 U 93 Np
锕系
锕
6d17s2
钍
镤
铀
6d27s2 5f26d17s2 5f36d17s2
7 N 8O
氮
氧
2s22p3
2s22p4
14.01
15 P 磷
3s23p3
16.00
16 S 硫
3s23p4
30.97 32.07
33 As 砷
4s24p3
74.92
51 Sb 锑
34 Se 硒
4s24p4
78.96
52 Te 碲
5s25p3
5s25p4
121.8
83 Bi 铋
6s26p3
127.6
4d10
4d105s1
106.4
78 Pt 铂
5d96s1
107.9
79 Au 金
5d106s1
195.1 197.0
110 Ds 111 Rg 钅达 * 钅仑 *
[269] [272]
30 Zn 锌
3d104s2
65.39
48 Cd 镉
4d105s2
112.4
80 Hg 汞
5d106s2
200.6
钾钙
钪
钛
4
4s1
4s2
3d14s2
钒
3d34s2
《过渡元素化学》课件

化学工业:用 航空航天工业: 于制造催化剂、 用于制造耐高 染料、农药等 温、耐腐蚀的
合金材料
核工业:用于 制造核燃料和 核反应堆的部
件
环保工业:用 于处理废水、 废气等污染物
过渡元素在生物体内 的作用:如铁、铜、 锌等在血液、骨骼、 神经等系统中的作用
过渡元素在药物中 的应用:如铁、铜、 锌等在药物中的作 用
汇报人:
原子结构:过渡元素原子核外电子排布具有周期性规律 电子排布:过渡元素原子核外电子排布具有周期性规律 电子排布特点:过渡元素原子核外电子排布具有周期性规律 电子排布规律:过渡元素原子核外电子排布具有周期性规律
金属性:过渡元素中,金属性最强的是铼,最弱的是铋 非金属性:过渡元素中,非金属性最强的是铋,最弱的是铼 电离能:过渡元素中,电离能最高的是铼,最低的是铋 过渡元素的物理性质与其金属性和非金属性有关,电离能是衡量元素化学性质的重要指标
磁性:过渡 元素具有磁 性,其中铁、 钴、镍等元 素具有较强 的磁性
热导率:过 渡元素的热 导率较高, 其中铜、银 等元素具有 较高的热导 率
电导率:过 渡元素的电 导率较高, 其中铜、银 等元素具有 较高的电导 率
熔点:过 渡元素的 熔点较高, 其中钨、 钼等元素 具有较高 的熔点
硬度:过 渡元素的 硬度较高, 其中钨、 钼等元素 具有较高 的硬度
应用:氧化物和氢氧化物在工业、化学实验和日常生活中有广泛的应用,如催化剂、颜料、药物等
盐类:过渡元素与 酸或碱反应生成的 化合物,如氯化铁、 硫酸铜等
络合物:过渡元素 与有机配体形成的 化合物,如铁氰化 钾、铜氨络合物等
性质:盐类和络合物 具有不同的物理和化 学性质,如颜色、溶 解度、稳定性等
(完整版)元素周期表(word全面版).docx

周期族I A元素周期表0181 2 311 HⅡ A氢1.00823 Li4 Be锂铍6.9419.01211 Na12 Mg钠镁原子序数元素名称,注*的是人造元素Ⅲ BⅣ B8 O元素符号,红色非金属指放射性元素氧相对原子质量(加括号的16.00数据为该放射性元素半衰期最长同位数的质量数)Ⅴ BⅥ BⅦ BⅧ金属Ⅲ AⅣ AⅤ A131415过渡元素5 B6 C7 N硼碳氮10.8112.0114.01I BⅡ B13 Al14 Si15 P铝硅磷Ⅵ AⅦ A 2 He氦1617 4.0038 O9 F10 Ne氧氟氖16.0019.0020.1816 S17 Cl18 Ar硫氯氩4 5 6 722.9924.3134567891019 K20Ca21 Se22 Ti23 V24 Cr25 Mn26 Fe27Co钾钙钪钛钒铬锰铁钴39.1040.0844.9647.8750.9452.0054.9455.8558.9337 Rb38Sr39 Y40 Zr41 Nb42 Mo43 Tc44 Ru45Rh铷锶钇锆铌钼锝钌铑85.4787.6288.9191.2292.9195.96[98]101.1102.955 Cs56Ba57~7172 Hf73 Ta74 W75 Re76 Os77Ir铯钡La~Lu铪钽钨铼锇铱132.9137.3镧系178.5180.5183.9186.2190.2192.287 Fr88Ra89~103104 Rf105 Db106 Sg107 Bh108 Hs109 Mt钫镭Ac~Lr钅卢 *钅杜 *钅喜 *钅波 *钅黑 *钅麦 *[223][226]锕系[265][268][271][270][277][276]111226.9828.0930.9728 Ni29 Cu30 Zn31 Ga32 Ge33 As镍铜锌镓锗砷58.6963.5565.3869.7272.6374.9246 Pd47 Ag48 Cd49 In50 Sn51 Sb钯银镉铟锡锑106.4107.9112.4114.8118.7121.878 Pt79 Au80 Hg81 Ti82 Pb83 Bi铂金汞铊铅铋195.1197.0200.6204.4207.2209.0110 Ds111 Rg112 Cn113Uut114 Fl115Uup钅达 *钅仑 *钅哥 ****[281][280][285][284][289][288]32.0635.4539.9534 Se35 Br36 Kr硒溴氪78.9679.9083.8052 Te53 I54 Xe碲碘氙127.6126.9131.384 Po85 At86 Rn钋砹氡[209][210][222]116 Lv117Uus118Uuo***[293][294][294]镧系锕系57La58Ce59Pr60 Nd61Pm62Sm63Eu64Gd65Tb66Dy67Ho68 Er69 Tm70 Yb71 Lu镧铈镨钕钷 *钐铕钆铋镝钬铒铥镱镥138.9140.1140.9144.2[145]150.4152.0157.3158.9162.5164.9167.3168.9173.1175.0 89Ac90Th91Pa92 U93Np94Pu95Am96Cm97Bk98Cf99Es100 Fm101 Md102 No103 Lr锕钍镤铀镎钚镅 *锯 *锫 *锎 *锿 *镄 *钔 *锘 *铹 *[227]232.0231.0238.0[237][244][243][247][247][251][252][257][258][259][262]一、部分酸、碱和盐的溶解性表(室温)元素周期表有关知识NaOH烧碱、火碱、苛性钠KOH苛性钾阳离子阴离子H+NH4+K+Na+Ba2+Ca2+2+MɡAl 3+2+MnZn2+Fe2+Fe3+Cu2++Aɡ物的俗名化学式NaClNa2CO3--Cl-2-2-OH NO SO CO343溶、挥溶、挥溶溶、挥溶、挥溶溶溶溶溶溶溶溶溶溶溶溶溶溶溶溶溶不不微溶溶微不不溶溶溶微不溶溶溶-不溶溶溶不不溶溶溶不不溶溶溶不不溶溶溶-不溶溶溶--溶不微不俗名化学式食盐MgCl2·6H2O纯碱、苏打NaHCO3说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“ - ”表示那种物质不存在或遇水就分解了。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.氧化物.
• Fe2O3.红棕色粉末,不溶于水,可做催化剂、 颜料、除锈剂.
• Fe3O4{FeⅢ[(FeⅡFeⅢ)O4}为铁磁性材料敏 、 电阻材料.
2020/5/30
A2.氢氧化物
还原 性 增 强
• Fe(OH)2 Co(OH)2 Ni(OH)2 • 白色 粉红 绿色
• Fe(OH)3 Co(OH)3 Ni(OH)3 • 红棕色 棕色 黑色
熔融碱应选用镍坩埚. • ⑤与CO反应生成羰基化合物. • 羰基Fe化(C合O物)5.、C(CO)8、Ni(CO)4加热这些
2020/5/30
5-2.重要化合物.(+2、+3氧化态)
• +3具有氧化性:Fe3+<Co3+<Ni3+ • +2具有还原性:Fe2+>Co2+>Ni2 • 1.氧化物. • 2.氢氧化物 • 3. 重要的盐 • 4.重要配合物
• 大多数有磁性.(与其含有未成对d电子有 关)
• 根据未成对电子数 n可判断配位情况确 定高自旋或低自旋.
2020/5/30
例题:
• 某中心离子在八面体弱磁场n=4.9BM,n=4,而在 八面体强场n=0BM,n=0.
• 由此推导出中心离子的d电子数为6,即可能是 Co3+或Fe2+
• ∵弱场
•
• 2MnO2+4KOH+O2=2K2MnO4+2H2O
•
pH>14预定
• 3MnO24 -+4H+=2MnO+MnO2+H2O
2020/5/30
3.KMnO4
• KMnO4深紫色晶体.强氧化剂,其还原产物与 介质有关.
• 2KMnO4(s)+H2SO4(浓)=Mn2O7+K2SO4+H2O
2020/5/30
• ②与酸反应Cr(无氧化膜),可溶于稀HNO3、H2SO4, Mo、W可溶于HNO3+HF
• ③与非金属反应. • ④易形成合金
2020/5/30
3-2.重要化合物
• 1.CrO3 • 2.Cr2O3 • 3.重铬酸盐 • 4.铬酸盐(Cr24O- ) • 5.钼酸盐.
2020/5/30
CrO3 Cr2O3
2020/5/30
1–3. 过渡元素的氧化态.
• 由于d电子的部分或全部参加成键,所以过渡 元素的氧化态一般从+Ⅱ~与族数
• 相同的最高氧化态.见p1049 表21–8. • 同一周期.从左→右 氧化态↑ ⅦB 最高,然
后↓. • 同一族.自上而下,高氧化态比较稳定,而主族
低氧化态比较稳定; •
2020/5/30
1–4.单质的性质
• 1.物性: • ①由于过渡元素的r较小,所以密度、硬度
较大,熔沸点较高. • ②由于含有较多d电子,能级交错,所以具
有金属光泽,导电导热性大多有磁性. • ③由于金属晶体是通过金属键结合的,
所以过渡金属具有良好的延展,机械加工 性;其中W的熔沸点最大(22-57g.cm3)
2020/5/30
§14-5. 铁、钴、镍(3d6~84s2)
• 5-1. 单质:银白色金属. • 5-2.重要化合物.(+2、+3氧化态)
2020/5/30
5-1. 单质:银白色金属.
• ①有磁性(其合金磁化后可做永久磁铁) • ②中等活泼,能溶于稀酸. • ③加热下可与许多非金属反应, • ④铁可与热的浓碱反应.而Co、Ni不反应.
2020/5/30
§14-4 .锰3d54s2
• 4-1.单质 • 4-2. 重要化合物.
2020/5/30
4-1.单质
• 白色金属,质硬而脆,一般使用锰合金,锰 钢,耐磨,抗冲击,不锈钢耐腐蚀.
2020/5/30
4-2. 重要化合物.
• 1.Mn(Ⅱ) • 2.MnO2 • 3.KMnO4
2020/5/30
2020/5/30
1-1. 过渡元素的价电子层结构.
• (n-1)d1~10ns1~2 (Pd:4d105s0) • d电子数较多.d电子可部分或全部成键. • d轨道未充满可接受孤电子
2020/5/30
1-2过渡元素的原子半径和电离势.
• 过渡元素原子半径比较小,电离势不如主族有规律:
•
同一周期,从左→右 r↓ ⅦB , Ⅷ最小 , 然后↑未
2020/5/30
1-5. 过渡元素氧化物的酸碱性
• 同一周期从左→右 酸性↑ 碱性↓. 如
:Sc2O3 TiO2 CrO3 Mn2O7
•
碱性 两性 酸性 强酸性
• 同一族自上而下酸性减弱;(氧化态相同);
• 同一种元素氧化态↑酸性↑.
• 如: MnO2 Mn2O3 MnO3 Mn2O7
•
碱性 弱碱 两性 酸性
• 1. 单质: • 银白色金属.较硬(>钢).常温下不溶于稀酸,可溶于
HNO3、王水、热的浓 • H属2反SO形4,成在合O2金存. 在下熔融强 碱,加热时与大多数非金 • 2.重要化合物. • V2O5 橙黄色~深红色晶体,有毒,微溶于水,为强氧
化剂.
• V2O5+6H++2Cl– 2VO2++ Cl2+3H2O • V2O5作催化剂(SO2氧化)及有机合成.
2.化性.
大多数 M n 较小甚至为反值. M
M具有较强还原性;
还原性:第一过渡系列 > 第二 < 第三(同族↓)而
主族同一族自上而下还原性↑,表现在; ①与酸反应. 第一过渡系列与稀酸; ②与活泼非金属反应.
其中Sc,La的还原性较强,在空气中迅速被氧化, 在水中反应放出H2,也能溶于酸 。
高
自旋
•
强场
• • 2020∴/5/30与事实相符.
低自旋
§14-2. 钛、钒
• 2-1.钛. 3d24s2 • 2-2.钒. . 3d34s2
2020/5/30
2-1.钛. 3d24s2
• 1.单质:银白色金属.ρ=4.506g .cm-3(铁的一半) • 较高机械温度,表面致密氧化膜,有良好的抗腐蚀性,制
• 1.CrO3暗红色晶体,酸酐,强氧化剂
•
洗
液
K2Cr2O7(s)+2H2SO4(浓)=2KHSO4+2CrO3+H2O • (NH3)2Cr2O7 Cr2O3+N2+4H2O
• 2.Cr2O3绿色粉末 .Cr2O3不溶于酸和碱,作催化剂
2020/5/30
3. 重铬酸盐.
• 如K2Cr2O7、(NH3)2Cr2O7 。大多易溶于 水,在酸性介质中为强氧化剂:
• Cr2O+6Fe2++14H+=2Cr3++6Fe3++7H2O
2020/5/30
4.铬酸24盐- (CrO )
• K+Na+NH+盐易溶,Hg+、Ba2+、Pb2+盐难溶.
• •
2CrO
黄2 4-2H
Cr2O72 -
+H2O 橙红
2020/5/30
5.钼酸盐.
• (NH4)2MoO4 • ( NH4)3PO4·12MoO3 ·6H2O↓ 黄色
(不稳定)
• Fe2+ Fe3+无此配合物
.
2020/5/30
•
棕色 鉴定Fe2+ N-O
3
• Cu2++2Fe3+=Cu2++2Fe2+ 制作线路板
• Fe202C0/5/l330可使蛋白质凝集–––止血剂.
4.重要配合物
• ①氨配合物:
• [Co(NH3)6]3+、[Ni(NH3)4]2+ 、 [Ni(NH3)6]2+ 、 [Co(NH3)6]2+
• ( n=0 ) ( n=2 )
造飞机、坦克有关设备. • 2. 重要化合物. • TiO2,白色粉末,不溶于水、酸,可溶于HF,热的浓H2SO4 • TiO2+6HF=H2[TiF6]+2H2O • TiO2+H2SO4(浓)=TiOSO4+H2O • TiO2作颜料,催化剂,化妆品.
2020/5/30
2-2.钒. 3d34s2
充满,d的屏蔽效应↓、z↑、r↓.到了ⅡB全充满d屏蔽↑
、z↓ 、 r↑
•
同一族 .五、六周期的r相似–––镧系收缩,离
子半径变化相似 较小,
2020/5/30
• 过渡元素的电离势的变化规律与原子半径 变化有关:
•
同一周期从左→右 I↑ ⅦB , Ⅷ最大,
然后又逐渐减小.
• 见p1047 表21––7.
第十四章过渡元素 ⅣB-ⅦB Ⅷ
§14-1 过渡元素的通性 §14-2 钛、钒 §14-3 铬、钼、钨 §14-4 锰 §14-5. 铁、钴、镍
§14-1.过渡元素的通性
• 1-1. 过渡元素的价电子层结构. • 1-2. 过渡元素的原子半径和电离势. • 1-3. 过渡元素的氧化态. • 1-4. 单质的性质 • 1-5. 过渡元素氧化物的酸碱性. • 1-6. 过渡元素水合离子的颜色. • 1-7. 过渡元素的配位性质 • 1-8. 过渡金属及其化合物的磁性.
1.Mn(Ⅱ)
• Mn(Ⅱ)具有还原性 A g
• 2Mn2++5S2O8 2-8H 2O 2M4 - n1 O S 04 2 O -1H 6
• 2Mn(OH)2+O2=2MnO(OH)2↓
