第六章 氧化反应
药物合成反应第六章氧化反应

嘌呤及其衍生物的氧化
要点一
总结词
嘌呤及其衍生物是一类重要的生物碱,其氧化反应在药物 合成中具有重要意义。
要点二
详细描述
嘌呤可以通过氧化反应生成8-羟基嘌呤和8-醛基嘌呤等化 合物,这些化合物在药物合成中具有广泛的应用。常用的 氧化剂包括硝酸、高锰酸钾、过氧化氢等。
详细描述
腈的氧化通常会将其转化为相应的羧酸或酸 酐,这一过程在药物合成中常用于制备具有 生物活性的化合物。在氧化过程中,需要注 意控制反应条件,以避免过度氧化导致产物 的分解或副反应的发生。
06
CATALOGUE
杂环化合物的氧化
呋喃和噻吩的氧化
总结词
呋喃和噻吩是重要的杂环化合物,其氧化反应在药物 合成中具有广泛应用。
氧化等。
醇的氧化产物通常是醛 、酮、酸等,这些化合 物在药物合成中具有重
要应用。
醇的氧化反应通常需要 在较低的温度和压力下 进行,因此相对安全。
醛酮的氧化
醛酮的氧化可以通过多种方式进行, 如空气氧化、过氧化物氧化、金属盐 催化等。
醛酮的氧化反应通常需要在较低的温 度和压力下进行,因此相对安全。
醛酮的氧化产物通常是羧酸、酯、腈 等,这些化合物在药物合成中具有重 要应用。
氧化反应在药物合成中的应用
01
02
03
引入官能团
通过氧化反应,可以在药 物分子中引入羟基、羧基 、羰基等官能团,从而改 变药物的性质。
碳-碳键的形成
某些氧化反应可以用于合 成含有碳-碳键的药物分子 ,如烯烃、醇、醛等。
杂环化合物的合成
利用氧化反应可以合成各 种杂环化合物,如吡啶、 嘧啶等。
氧化反应的机理与选择性
第六章氧化反应

第六章氧化反应从广义上来讲,凡是有机物分子中碳原子失去电子,碳原子总的氧化态增高的反应均称为氧化反应;从狭义上讲,凡使反应物分子中的氧原子数增加,氢原子数减少的反应称为氧化反应。
利用氧化反应除了可以得到各类有机化合物如醇、醛、酮、酸、酯、环氧化物和过氧化物等,还可以制备有机腈和二烯烃等。
有机物的氧化反应都是强放热反应,因此,氧化反应中及时移除反应热是一个很关键的问题。
烃类和其它有机物的氧化反应几乎都是不可逆反应,反应都能进行到底。
有机合成中氧化方法主要有三种,即催化氧化和催化脱氢、化学氧化、电解氧化。
此外,生物氧化在有机合成中的应用也日益受到人们的重视。
生物氧化是一种较缓和的氧化过程。
人类在很早以前就利用微生物进行氧化反应来进行酿酒、制醋。
生物氧化具有高度的选择性,收率高,反应条件温和,三废少等特点。
因此,生物氧化是一种很有发展前景的氧化合成方法。
第一节催化氧化和催化脱氢一、催化氧化在没有催化剂的情况下,有机物在室温下与空气接触,就能发生缓慢的氧化反应,这种现象称为自动氧化。
在实际生产中常常需要使用催化剂,以提高反应的速度和选择性。
在催化剂存在下进行的氧化反就应称为催化氧化。
催化氧化法生产能力大,对环境污染小,且作为氧化剂的空气和氧来源广泛,无腐蚀性。
因此,工业上大吨位产品多采用空气催化氧化法。
氧化反应根据反应温度和反应物聚集状态不同,又可分为液相催化氧化和气相催化氧化反应。
液相催化氧化多在100︒C左右进行反应;气相催化氧化则常在200~400︒C下进行反应。
(一)液相空气氧化液相空气氧化是液态有机物在催化剂存在下,通入空气进行的催化氧化反应。
液相空气氧化反应的实质是在气液两相间进行的,大多采用鼓泡型反应器。
1.反应历程液相空气氧化属于自由基反应历程,其反应历程包括链的引发,链的传递和链的终止三个步骤,其中决定性步骤是链的引发。
下面以烃的氧化为例:(1)链引发 烃类R-H 在光照、热及可变价金属盐或自由基引发剂的作用下发生C-H 键的均裂而生成自由基R ⋅。
药物合成反应-第六章-氧化反应

另外,二氧化硒毒性非常大,使用极大受限。
位 氧 化
2
选择性的氧化可将烯丙位氧化为醛、酮或醇而不破坏双键。
烯
应用特点: 二氧化硒氧化
CH CH CH2
丙 位
二氧化硒可将烯丙位氧化为醛或酮,但如果想得到醇羟基,需在醋酸溶液中以醋酸酯的形 式分离产物,再水解得羟基。
氧 化
SeO2/C2H5OH heat
高锰酸钾、四氧化鋨及碘&湿羧酸银是常用的氧化条件。反应一般经历环状过渡态。
高锰酸钾需要低浓度及碱性 pH>12低温反应,否则易进
KMnO4
OH
NaOH
OH
一步氧化。
KMnO4 H2O
CHO CHO
CH3 OsO4/Py CH3 Et2O
CH3
OH 两 个 OH在 位 阻 小 的 地 方 生 成
OH
CH3
醇 氧 化
DMSO-Ac2O,能氧化大 位阻的醇;
1
Oppenauer氧化:
三烷氧基铝(如异丙醇铝)和丙酮,氧化仲醇为酮。(伯醇不适合此氧化)
特别适合氧化烯丙位醇为α,β-不饱和酮,普通仲醇也可,但β,γ-双键常移位到α,β。
O
O
O
CH3CCH3
60%
Al(O-ipr)3
HO
HO
H3CO
CH N
N 奎宁
O
CH3
CH (OCCH3)2
CHO
CrO3 / Ac2O / H2SO4
H2SO4 H2O
(65-66%)
NO2
NO2
NO2
苄 位 氧 化
1
非选择性强氧化
使用强氧化剂KMnO4、Na2Cr2O7、Cr2O3或稀硝酸等,将苄甲基氧化为羧基。
第六章 氧化反应

饱和脂肪烃的氧化反应仅对那些具有叔C-H键的饱和烃才有 合成价值。铬酸或高锰酸盐常常可将叔C-H键选择性氧化成叔醇, 若为手性叔碳的C-H键,氧化时可保持构型。
n-Bu CH 3 Et
CH 3
PhCH 2NEt3MnO 4 3℃ , 数天
H
Na 2 Cr2 O 7 HClO 4 / HOAc / H 2 O
CH 3 CH 3 CH 3
n-BuONO / CH 3ONa (91%)
CH 3 NOH O
CH 2O/ HCl / HOAc (~100%)
CH 3
CH 3 O O
O
6.1.4 烯丙位烃基的氧化
烯丙位的甲基、亚甲基或次甲基在一些氧化剂作用下可被氧化成相应的醇 (酯)、醛或酮,而双键不被氧化或破坏,但可能发生双键的迁移。 铬酐-吡啶配合物和二氯甲烷组成的溶液称为Collins试剂,它和PCC[铬酐吡啶配合物的盐酸盐]在室温下可使醇迅速氧化成相应的羰基化合物,而对醇 中的双键、苄位亚甲基和硫醚不起作用。若使用过量的Collins试剂(室温) 或PCC(在二氯甲烷或苯中回流),可将烯丙位碳氢键氧化成羰基。
n-Bu CH 3 Et
CH 3 OH
(72%)
OH
桥环化合物的桥头C-H键一般为叔C-H,张力较大的桥头碳 氢键因离子和自由基均难形成,不易发生氧化反应,但一些环 系较大的桥环化合物的氧化反应也可选择性地发生在桥头碳原 子上。例如:
(40%~50% )
HO
CrO3 / Ac2O / AcOH 35 C , 1h , r.t. , 6h(71%)
OH
CrO 3 / H 2SO 4 / 丙酮 (75%)
O
Jones 氧化
OLeabharlann OHH(73%)
第六章 氧化反应

(2) 空气氧化
Br O2 / Co(OAc)2 / HBr / HAc 2h CH3 COOH Br (91%)
(3) 用硝酸铈铵作氧化剂,苄位 用硝酸铈铵作氧化剂, 亚甲基氧化成酮
ArCH2CH3 CAN / HNO3 900C, 70min O Ar C CH3 (77%)
O CAN / HNO3 300C, 90min (76%)
CH3 CH3 CH2 C CH CH3 SeO2 CH3 CH3 CH C OH CH CH3 CH2 OH CH3 CH2 C CH CH3
34
:
1
(3)当上述两规则有矛盾时, (3)当上述两规则有矛盾时,一般遵 当上述两规则有矛盾时 循(1)
CH3 H3C C CH CH2CH3 SeO2 H 3C CH2OH C CH CH2CH3
二
羰基 α 位活性烃基的氧化
1 形成 α -羟酮
O C O Pb(OAc)4 / BF3 O(C2H5)2 / C6H6 250C AcO AcO CH3 O O C CH2OAc
(86%)
加BF3有利于羰基的甲基乙酰化
RN O2 / tBuOH / tBuOK / P(OC2H5)3 H COCH3 CONH2 -200C HO COCH3 CONH2 RN
机理: 机理:
Ce4+ ArCH3 +
ArCH2 + Ce4+ + H2O
+ Ce3+ + H+ ArCH2
3+ ArCH2OH + Ce + H+
ArCH3OH + 2Ce
4+
+ 2Ce3+ + 2H+ ArCHO
药物合成反应 第六章 氧化反应

1. Chromium Regent • (1)Jones :CrO3/acetone/H2SO4
对酸敏感化合物不能用此法; 如果起始原料是醛,可氧化成酸;
• (2)Sarret and Collins Regent
• 制备存在危险性; • 产品从吡啶中分离困难;
Example
(3)PCC、PDC
(氧环在位阻小的一侧形成)
PH值有影响:
2.不与羰基共轭的烯键的环氧化
O
CH3 H
CH3 H
+ CH3CO3H
CH3 H
C
C
CH3 H
+ CH3CO2H
烯烃在试剂的作用下,生成环氧化合物的反应称为环氧化反应。
O OH
+
OH R
+
H O
反 应 机 理
R
C O
+
[
R
C O
C O
O
-
O
] -
OH R C O O
• 2. 氧化生成酮、羧酸 • 应用特点
KMnO4、Na2Cr2O7、Cr2O3和稀HNO3作 氧化剂
空气氧化
用硝酸铈铵作氧化剂, 苄位亚甲基氧化成酮
SeO2试剂
(82%)
二 羰基a位活性烃基的氧化
1.形成a-羟酮
(1)反应通式
• (2)影响因素
加BF3可催化酮的烯醇化,KC有利,从而有 利于乙酰化。
• ②铬酰氯为氧化剂
(Chromychlorde)CrO2Cl2
机理:(自由型)
Etard复合体
机理:(离子型)
(Etard复合体)
• (3)影响因素 • ①反应温度
第六章 氧化反应

OH
H2CrO4
O
Jones氧化法(CrO3-H2SO4-丙酮)
OH CrO3/H2SO4/CH3COCH3 O
(75%)
§2 Jones氧化法
O CrO3/H2SO4/CH3COCH3 O HO O O (73%) O
§2 PCC
Cl N H
/ CrO 3
= PCC
§2 PDC
2
N H
2
Cr2O7
PhCOOOH O + (94:6) O
§4 .1.5 有机过氧酸为环氧化剂
OH PhCOOOH O OH
§4 .1.5 有机过氧酸为环氧化剂
OOCCH 3 PhCOOOH
OOCCH 3 O
§4. 2 .1 顺式羟基化
• 常用试剂是高锰酸钾 • 四氧化锇 • 碘-湿乙酸银。
§4. 2.1 顺式羟基化
TPAP(Pr4NRuO4)
• 直接将RuCl4· nH2O加到过量的溴酸钠(NaBrO3)的l mol/L 浓度的碳酸钠水溶液中,氧化成[RuO4]-,接 着加入(Pr4N)OH,即产生深绿色的TPAP晶体, 过滤后干燥备用。TPAP用量(摩尔分数)为5%(相 对于被氧化的醇),常用的共氧化剂为双氧水和N甲基吗啉氧化物(NMO),由于TPAP是在非水介质 中氧化醇,故共氧化剂用后者。常用的溶剂是 CH2Cl2 或CH3CN,在用CH2Cl2 作溶剂时加10% 的CH3CN ,可提高催化剂的利用率。
= PDC
§2 醇氧化成酮
PhCH(OH)Ph
PCC
PhCOPh
(100%)
§2 醇氧化成醛
HO DMAP/HCl/CrO3 HO HO CHO
§2 醇氧化成酮:用锰化合物氧化
第六章 氧化反应
O
CH2 CCH3
Organic Reactions for Drug Synthesis
由于反应按自由基机理进行,有时伴有双键的重 排,生成相对更稳定的结构。
CH3 CrO3-Py/CH2Cl2 O
O CrO3-Py/CH2Cl2 F F
CH3
Organic Reactions for Drug Synthesis
ArCH(OCrCl2OH)2
H2O
ArCHO + 2H2CrO3
(Etard复合体)
Organic Reactions for Drug Synthesis
③ 铬酐-醋酐(CrO3-Ac2O)
O O Cr O + CH3 CH3
CH3 + O O H2O Cr O OCCH3 OCCH3 O CHO CH
3 有机过酸酯 (引入酰氧基后水解生成醇)
反应机理是自由基取代反应。
OH CH3CO3C(CH3)3
得烯丙醇
CuBr
CH3CH2CH CH2
O 常用
CH3CO3C(CH3)3
CuBr
CH3CHCH OH
CH2
C6H5COOC(CH3)3 CH3COOC(CH3)3 O
Organic Reactions for Drug Synthesis
三 、烯丙位的氧化反应
CH CH CH2 CH CH CH OH [O] O CH CH C
1.SeO2——醇
2. CrO3—吡啶络合物——酮
3. 有机过酸酯——酯水解成醇
反应中烯键不影响。
Organic Reactions for Drug Synthesis
1.SeO2/H2O/HOAc
第六章氧化反应

第四节 醛、酮的氧化
• 一、醛的氧化 • 1.反应通式
• 2.应用特点 • (1)醛氧化制备羧酸
新制Ag2O、CuO氧化
(2)Dakin反应
当醛基的邻、对位有-OH等供电子基时,则 经过酸氧化,甲酸酯中间体生成羟基
当-CHO邻、对位有供电子基时,芳环电子云密度较 丰富,有利于“b式”重排;若无取代基或供电子 基在间位以及存在吸电子基时,则按“a式”重排, 形成酸。
• O3/H2O2; O3/Zn/H+; O3/DMS; O3/Ph3P
• NaIO4/KMnO4; NaIO4/OsO4替代方法
第六节 芳烃的氧化反应 一 芳环的氧化开裂 1. KMnO4氧化
即:芳环上有供电子基的优先被氧化
2. RuO4氧化
3 CuCl+Py氧化
二、氧化成醌 1.铬酸氧化剂
• M-CPBA
• OsO4 • Bromohydrin
• Prevost • Woodward
5. Asymmetric Dihydroxylation Reaction
Sharpless Catalytic Asymmetric Dihydroxylation (AD) Reaction
三、烯烃的氧化性断裂及还原性断裂
• 二、酮的氧化
• Baeyer-Villiger oxidation
反应机理
迁移能力:3>2>环己基>苄基>苯基>1>H 越富电子烷基越先迁移
第五节 含烯键化合物的氧化
一、烯键的环氧化 1.a、b-不饱和羰基化合物的环氧化
环氧化机理:
此键可旋转,最终生成比较稳定的E型环氧 化合物
如:
两个较大基团在环的两侧
药物合成反应_第六章_氧化反应

苄 位 氧 化
1
非选择性强氧化
使用强氧化剂KMnO4、Na2Cr2O7、Cr2O3或稀硝酸等,将苄甲基氧化为羧基。
CH3
KMnO4
COOH
不管侧链多长均被氧化成-COOH
COOH
CH2CH2CH3
苄 位 氧 化
CH3 CH2CH3
CH3
40%HNO3
COOH
氧化碳链长的一段
CrO3 /HOAc(75%) H3CO 40℃、2hr H3CO O
伯 ︑ 仲 醇 氧 化
HO
O
1
DMSO氧化:
DMSO与强亲电试剂,如DCC、酸酐(Ac2O,三氟醋酸酐)、酰氯(SOCl2,草酰氯) 等配合,可选择性氧化羟基为醛/酮;条件温和收率高。
DMSO-DCC,不易氧化 大位阻的醇;
伯 ︑ 仲 醇 氧 化
DMSO-Ac2O,能氧化大 位阻的醇;
1
Oppenauer氧化:
④:环内双键,在②前提下优先氧化环上的烯丙位;
烯 丙 位 氧 化
OH CH2CH3
(Z)
CH2CH3
(Z)
SeO2
HOAc SeO2 ⑤:末端双键,常常重排引入端位羟基; CH3CH2CH2CH2CH CH2
CH3CH2CH2CH2CH CH2
SeO2
CH3CH2CH2CH2 CH CH2OH
3
CH3CH2CH2CH2 CH CH2OH
OOCR C O C H C O H CF3CO3H H2O/H2SO4 C RCOO C OH OH OH C 水解 C OH OH C
烯 键 氧 化 二 醇
1,2-
其实过氧酸也是烯键环氧化试剂之一,只是自身的酸性及酸根亲核试剂不利于环氧的稳定。 所以过氧醋酸和过氧甲酸等常用于直接从烯键制备反式1,2-二醇。
第六章 氧化反应

• 环氧化反应中取代基较多的双键比取代基少 的更易反应。富电子的双键比缺电子的双键 易反应。
O t-BuOOH, PhH Mo(CO)6, reflux
CHO
t-BuOOH Ti(Ⅳ), SiO2 O
CHO
• 对于含烯丙醇结构的烯烃,在金属催化剂 存在下,叔丁基过氧化氢可区域选择性或 立体选择性的环氧化反应。
• α,β-不饱和腈在过氧化氢碱性介质中,首先在氰 基上加成,随之在双键上的环氧化反应得到环氧 酰胺,叔丁基过氧化氢碱性条件环氧化α,β-不饱 和腈可以得到环氧腈
NH C N H2O2, NaOH OOH O O NH2
Ph C N Ph t-BuOOH NaOH Ph Ph O C N
• 过氧羧酸是最常用的环氧化试剂。是用相应 的羧酸与过氧化氢反应制取。过氧羧酸大多 不稳定,现用现配。 • 过氧羧酸与烯烃反应是合成环氧化物最简便 的方法。尤其对孤立双键、单独用过氧化氢 或过氧醇(不存在金属催化剂)不易被环氧 化,而用过氧羧酸很容易反应,其环氧化烯 烃的反应机理是过氧羧酸对碳-碳双键的氢 电性进攻
• 6-3-4 高碘酸 • 高碘酸或高碘酸盐水溶液是1,2-二醇氧化裂解 试剂。溶剂为甲醇、乙醇、乙酸、二氧六环等。 能定量的反应,根据高碘酸的消耗,推知多元 醇中相邻羟基的数目,根据产物推知原化合物 的结构。
H H R C C CH2CH2 COOH OHOH KIO4/H2SO4 EtOH/H2O RCHO + CHO-CH2CH2COOH
O
Ph (1) O3 (2) Zn, AcOH
O
Ph CHO
O
(1) O3, Et2O, 0 de AcO H (2) LiAlH4, 0 de OAc
第六章-1氧化反应

O H2C O O H2C O
O O
H2O (N aH SO) 3
_
CHO
O H / H2O
Et CH
O3 水解
CHO
O
O 90%
C4H9CH=CHCH 3
① O3 ② LiAlH4
C4H9CH2OH + CH3CH2OH
碘和羧酸银氧化法
将烯烃氧化成1,2-二醇 用Prevost试剂可以克服 用其它试剂所遇到的困 难。由碘的四氯化碳溶 液与等物质量的醋酸银 或苯甲酸银组成的试剂 叫Prevost试剂。在 Prevost条件下(即无水 条件下),用该氧化剂 氧化烯烃可以直接得到 反式二醇的二酰基衍生 物;在woodward条件下 (即有水存在时),得 到顺式邻二醇的单脂。
O R R
R C CHCOR O
R C CH=C
Oxone
Oxone
KMnO4
R
H H
_
MnO4
R R H
O O
H MnO2[Mn(Ⅴ)]
_ OH ,H2O
H OH OMnO3
2-
R R
H 2O
R R H
OH OH
R
H
Mn(Ⅶ)
_ MnO4
H [Mn(Ⅴ)]
HOOC
H R R O OH H2O R R O Mn(Ⅳ) H
沉淀在硅藻土上的碳酸银是一种能将伯醇和仲醇以很高的产率氧化成 醛和酮的极好试剂,反应在温和的近中性条件下进行,一般其他官能 团不起反应。
OH H3C H3C H3C
Ag2CO 3 CH3COCH3
H3C
OH
HO
O
H3C OH H3C
氧化反应

特点 1 稳定,市场上可以购买; 2 酸性不如PCC; 3 氧化性比PCC强 4 根据溶剂的不同,可以选择性将伯醇氧化为醛或羧酸; 5 氧化仲醇时反应速度慢,通常需要加入酸为催化剂(砒啶三氟 乙酸盐或3A MS
不同铬氧化剂的特点和应用
2.锰化合物的氧化
(1) KMnO4 高锰酸钾活性很高,氧化伯醇可得到酸,氧化含α-H的仲醇常 导致降解,但氧化不含α-H的仲醇可得到相应的酮(反应时加入酸 或镁盐中和生成的碱,也可高收率地获得酮)。
4.其他氧化剂
(1)Ag2CO3为氧化剂
AgNO3+Na2CO3
藻土
Ag2CO3均匀分布在载体上
特点: 碳酸银(硝酸银/碳酸钠)氧化条件温和,可氧化伯醇和仲醇 。 优先氧化烯丙位羟基,然后是仲醇,位阻大的醇不被氧化。 1,4-、1,5-和1,6-二元伯醇氧化时得内酯。
可待因的氧化
其反应机理据认为是自由基过程。
根据被氧化的原子: C-氧化 S-氧化
N-氧化
第一节 烃类的氧化
CH2
苄位C-H键的氧化
羰基α-位活性C-H键的氧化
烯丙位活性C-H键的氧化
一、苄位C-H键的氧化
1.氧化生成醛
常用的氧化剂有铬酐-醋酐、二氯铬酰、 硝酸铈铵
(1) 铬酐-醋酐(CrO3-Ac2O) 氧化苄位甲基形成醛基
(2)二氯铬酰( Etard’s试剂) 制备:将CrO3溶解在水中,在00C下加入一定量的 浓HCl,并在100C左右滴加硫酸,分层、分离、蒸 馏。收集沸点1170C馏分即为Etard’s试剂。
在氧化仲醇为酮的同时可完成双键在5,4位之间的转位 ,在甾醇氧化中应用十分广泛。
H C HO CH H3CO N N
CH2 O Ph2CO C H3CO N N
第六章 氧化反应

Oxidation Reaction
氧化反应
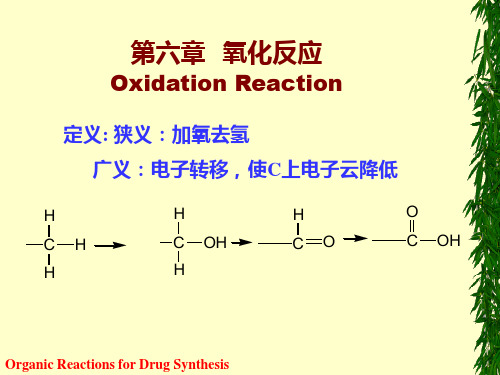
定义:
广义--C上电子云密度降低
狭义--加氧去氢 氧化反应是一类使底物(原料)增加氧或失去氢 ,从而使底物中有关碳原子周围的电子云密度降 低的反应,即碳原子失去电子或氧化态升高。
H 氧化态 C H -3 H H C H -1
2
H OH C +1 O
17
二、自由基反应机理
1. 自由基加成 O2氧化酮羰基α位氢成α-羟基的反应为自由基加成机理。 2. 自由基取代 过氧酸酯氧化烯丙位烃基成α-烯酯的反应为自由基取代反应。
3. 自由基消除 用弗里米盐在稀碱水溶液中将酚氧化成醌的反应为自由基消 除机理。
18
第二节 烃类的氧化反应
CH2
苄位C-H键的氧化 羰基α位活性C-H键的氧化 烯丙位活性C-H键的氧化
8
四、其它氧化剂
(三)四醋酸铅 四醋酸铅一种选择性很强的氧化剂,化学性质不稳定,遇水立即 分解 。所以,用四醋酸铅作氧化剂的反应,多数在无水有机溶剂 如冰醋酸、氯仿、二氯甲烷、硝基苯、已腈等中进行。四醋酸铅除 用于苄位烃基的氧化外,还可用于邻二醇的氧化、一元醇的选择性 氧化等。 (四)二甲基亚砜(DMSO)及其类似物 二甲基亚砜 (DMSO)是实验室常用的一种极性非质子溶剂,它又 是一种很有用的选择性氧化剂,是无色无臭微苦,吸湿性的液体, 能氧化伯、仲醇及磺酸酯成相应的羰基化合物。 (五)高铁氰化钾(赤血盐) 高铁氰化钾和三氯化铁、多伦试剂都是较弱的氧化剂。又称六氰 合铁酸钾,赤血盐钾。高铁氰化钾的氧化,多用于酚的氧化偶合、 吲哚衍生物的合成、季铵盐和酰肼化合物的氧化等。
OH
RH2C
[2,3 δ迁移]
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
O2N
HO H N H O
O2N Al[OCH(CH3)2]3, HOCH(CH3)2
HO H N H O
O p-Nitro- -acetamido--hydroxyphenylpropanone
H OH (± )-thero-1-p-nitrophenyl-2acetamidopropane-1,3-diol
加氧或脱氢 的反应 称为氧化
Oxidation State(氧化态)
氧化与药物代谢
药物生物合成
第一节 烃类的氧化反应
一、 烷烃的氧化
Oxidation of alkanes and alkyl groups
Barton reaction
二、 苄位烃基的氧化
1. 氧化生成醇、酮、羧酸
2)Jones reagent (选择性氧化方法): —— CrO3-diluted H2SO4-acetone
Jones reagent HO O
—— Unsaturated secondary alcohols can be oxidized to ketones while carbon-carbon double bonds remain unchanged.
O CCH3 RC O3H
methyl
O COCH3 ? + O OCCH3
√
?
三、 –羟酮的氧化反应
第四节 含烯键化合物的氧化
一. 烯键环氧化
1. ,–不饱和羰基化合物的环氧化
,–不饱和羰基化合物中,碳碳双键与羰基共轭,一 般在碱性条件下用过氧化氢或叔丁基过氧化氢使 之环氧化.
机理
O2N
Br2, C6H5Cl O
O2N Br O
(CH2)6N4, C6H5Cl
O2N Br .(CH2)6N4 O
氯 霉 素 合 成
C2H5OH,HCl, H2O
O2N NH2.HCl O p-Nitro- -aminophenylacetone
Ac2O, AcONa
O2N N H O
O
HCHO, C2H5OH pH = 2~7.5
H
Cl2CHCOOCH3, CH3OH
H HN OH H OH
立体选择性还原(threo)
Meerwein-Ponndorf Reduction
二、 醇被氧化成羧酸
CH3CH2CH2CH2O H H2CrO4
C H3C H2C H2C HO
further oxidation
CH3CH2CH2CO O H
CH3CH2CH2CH2OH CH3(CH2)4C CCH2OH
PCC CH2Cl2,25℃ Sarrett 试剂 CH2Cl2,25℃
CH3CH2CH2CHO CH3(CH2)4C CCHO
PCC(pyridinium chlorochromate) and PDC(pyridinium dichromate)
O
AcO OMe O
NMe2
O OH
O O O O
(6)
Dess-Martin高价碘化合物
DMP对羟基的选择性氧化
OAc O OMe O O OH OAc O O NMe2
OAc O OMe O O O OAc O O NMe2
HO
DMP
HO
Oppenauer 氧化
仲醇氧化成酮的有效方法. 负氢受体(氧化剂): 丙酮, 环己酮.
第五节 芳烃的氧化反应
一 芳烃的氧化开环 二 氧化成醌 三 芳环的酚羟基化 四 稠芳环与氧的Diels-Alder反应
二. 氧化成醌
OH OH
OH
Na2Cr2O7 H2SO4 30oC
O
AgO 醚 -H2O
O
HNO3
NH2 NH2
O
Na2Cr2O7 H2SO4 20-30oC
NH2
OH
NH2 Cl
O
O
Na2Cr2O7 H2SO4
NH2
Cl
OH
O
OH
O
(KO3S)2NO
O
Na2Cr2O7 H2SO4
O
O
四 稠芳环与氧的Diels-Alder反应
R1 R2
R3 R4
Air
R1 O O R2
R3 R4
第六节 脱氢反应
一 以醌为脱氢剂
二 催化脱氢
催化氢化的逆过程.
第七节 胺的氧化反应
HIO4
-HIO3
H3C CH3 C O + O C H3C H
CH3 CH3 H3C C CH C CH2 OHOH OHOH
H3C H3C
C O+
O O + + CH2O HC OH H3C COH
第三节 醛酮的氧化反应
一、 醛的氧化
Dakin reaction
当芳香醛的醛基的邻对位有给电子取代 基时
环氧化具有立体选择性,氧环常在位阻小的一 边形成.
2. 不与羰基共轭的烯键的环氧化
Reagents: 过硼酸钠 sodium perborate(SPB,17),过碳 酸钠 sodium percabonate(SPC,18) and 间氯过氧苯 甲酸 m-chloroperoxybenoic acid(MCPBA).
当芳香醛没有取代基,或给电子取代基在 间位,或有吸电子取代基时.
二、 酮的氧化
O CH3CH2CCH 2CH 3 RCO3H O CH3CH2COCH2CH3
Baeyer-Villiger oxidation
:
O: C R' O + C H3C O OH OC R' HO OCCH3 O -H
三、 二元醇的氧化
1. 1,2-二醇的氧化
(1) 用Pb(OAc)4氧化
The cleavage of 27 occurs 300 times faster than that of 28
用HIO4氧化
CH3 CH3 C CHCH3 OHOH
HIO4 -H2O
CH3 CH3 C CHCH3 O O I O O OH
[O]
RCOOH
1) 最常用的氧化剂是铬酸(H2CrO4) —— 三氧化铬溶于水或重铬酸钠溶于酸性水溶液
OH C H3C H2C HC H 3 OH C rO3 H2S O4 Na2C r2O7 H2S O4 OH CHCH2CH3 H2C rO4 O C H3C H2C C H 3 O
O CCH2CH3
Synthesis of Propranolol(普奈 洛尔)
1,2-Diol formation
—— OsO4 氧化烯烃生成邻二醇 —— syn-addition
Oxidation with KMnO4 and OsO4
Oxidation with KMnO4 and OsO4
—— KMnO4在温和条件下,生成邻二醇 —— syn-addition
20 alcohol(醇)氧化成 ketone(酮)
Primary alcohols:
CH3CH2CH2CH2O H H2CrO4
C H3C H2C H2C HO
further oxidation
CH3CH2CH2CO O H
但是在PCC( CrO3ClH-Py)或Sarrett L H 试 剂 (CrO3 – Py)作用下可以停留在醛的阶段
+
:
R
OC R' O OCCH3 O
:
R
R
H+
:
RO
O: C R'
O + C H3C O H
Baeyer-Villiger oxidation
relative migration tendencies: H > tert-alkyl > sec-alkyl > = phenyl
> primary alkyl
2. 氧化生成醛
(1) 硝酸铈铵(CAN)作为氧化剂
(NH4)2Ce(NO3)6
(2) CrO3-Ac2O, CrO2Cl2氧化剂
三、 羰基位活性烃基的氧化
四、 烯丙位烃基的氧化
第二节 醇类的氧化反应
RCH2OH RR'CHOH RR'R''OH
[O] [O] [O]
RCHO RR'C=O 不反应
CH3CH2CH2CH2OH
由伯醇、仲醇制备醛、酮的常用方法
N3 NMe2 (COCl)2, DMSO, Et3N, CH2Cl2, O
N3 NMe2 (4) O O O O O
O N O O O O
AcO OMe O OH
O N
AcO OMe O
O
O O O O O O
AcO OMe O
NMe2 NCS/PDC/PCC/(COCl)2 O O O
锰氧化剂应用
用二甲亚砜和亲电试剂氧化
DMSO-DCC
DMSO-(COCl)2
Swern oxidation: DMSO-(COCl)2-Et3N
1. DMSO, (COCl)2, -600 2. Et3N OH CH3CH2CHCH3 1. DMSO, (COCl)2, -600 2. Et3N O CH3CH2CCH3 CH3CH2CH2CHO
氧化反应
Oxidation
无机化学中的氧化还原表现为元素的原子 价态的变化 在有机化学中,碳始终是四价,其氧化还 原的特点是部分的电子得失 因此广义的说多数有机反应都是氧化还原 反应,不过习惯上将加氧或脱氢的反应称 为氧化,脱氧或加氢的反应称为还原
